Method Article
הכנת תאי לבלב acinar לצורך סידן ההדמיה, פגיעה בתא המדידות, וזיהום adenoviral
In This Article
Summary
אנו מתארים שיטת הכנה לשחזור של תאי לבלב acinar עכבר מעכבר לצורך בחינת אותות סיד סלולריים acinar ופציעה סלולרית עם גירויים רלוונטיים מבחינה פיזיולוגית ופתולוגית. שיטה לזיהום adenoviral של תאים אלה היא גם סיפק.
Abstract
תא acinar הלבלב הוא תא parenchymal העיקרי של הלבלב אקסוקרינית וממלא תפקיד עיקרי בהפרשת אנזימי לבלב לתוך צינור הלבלב. זהו גם האתר לייזום של דלקת בלבלב. כאן אנו מתארים כיצד תאי acinar מבודדים מכל רקמת לבלב ואותות סידן תוך נמדדים. בנוסף, אנו מתארים את הטכניקות של transfecting תאים אלה עם מבני adenoviral, ולאחר מכן מדידת הדליפה של חומצת החלב דהידרוגנז, סמן של פגיעה בתא, בתנאים אשר יגרום לפגיעה בתא acinar במבחנה. טכניקות אלה מספקים כלי רב עוצמה כדי לאפיין acinar תא הפיסיולוגיה והפתולוגיה.
Introduction
שינויים דינמיים בסיד cytosolic נחוצים לאירועים סלולריים acinar הן פיסיולוגיים ופתולוגיים. תופעות אלה מסתעפות של סידן נחשבות לנבוע מדפוסי מרחב ובזמן שונים של סידן איתות 1. לדוגמה, אנזים והפרשת נוזלים מתא acinar צמוד לקוצי סידן מאזור מוגבל של מוט הפסגה שבו ההפרשה מתרחשת 2. לעומת זאת, גל סידן גלובלי ואחרי אותות סידן שאינה oscillatory האינטנסיביים קשור לאירועים פתולוגיים מוקדמים שמובילים לדלקת לבלב חריפה 3,4. אלה כוללים הפעלת התוך acinar פרוטאז, הפרשת אנזים מופחתת, ופגיעה בתא acinar. המעבדה שלנו משתמשת מבודד לבלב acini ללמוד האירועים האלה תחילת פתולוגיים שיובילו למחלה גם in vivo ו במבחנה 5-7. השיטות, כמפורט כאן לתאר בידוד של תאי acinar העיקריים לצורך מדידת CYרמות הסידן tosolic ופגיעה בתא. שיטה לזיהום adenoviral של תאים אלה היא גם סיפק.
Protocol
1. הכנת תאי לבלב acinar לסידן הדמיה
- הכן את חיץ הדגירה HEPES המכיל 20 HEPES המ"מ, 95 מ"מ NaCl, 4.7 מ"מ KCl, 0.6 מ"מ MgCl 2, 1.3 מ"מ CaCl 2, גלוקוז 10 מ"מ, גלוטמין 2 מ"מ, ו1 × חומצות אמינו לא החיוניות בינוני מינימום של הנשר. התאם את הפתרון הסופי ל-pH 7.4 עם NaOH.
- הכן את חיץ דגירה BSA על ידי הוספת BSA (1% w / v סופי) עד 25 מ"ל של חיץ הדגירה HEPES (כמתואר לעיל).
- הכן את חיץ עיכול collagenase על ידי הוספת 1.1 מ"ג / מ"ל (200 יחידות / מ"ל) מסוג 4 collagenase ו1 מ"ג / מיליליטר מעכבי טריפסין סויה עד 6 מ"ל של חיץ הדגירה BSA (שתואר לעיל).
- coverslips מ"מ 22x22 חומצה לשטוף ידי טבילה בשני חלקי HNO 3 וחלק HCl אחד במשך שעה 2. ואז למזוג מים ובאמצעות חנות DI ב70% אתנול.
- להרדים את העכבר אחד בחנק CO 2. אוריינט בעלי החיים במצב שכיבה, ולהכין את שטח הבטן על ידי CLEaning עם 70% אתנול. בצע laparotomy לחשוף את חלל הבטן. לנתח את הלבלב ולשטוף באופן מיידי בסירה קטנה המכילה 6 שוקלים מ"ל של חיץ עיכול collagenase.
- שם לנתח את כל חתיכות גדולות של כלי דם או שומן נראים לעין, ולאחר מכן להסיר 5 מ"ל של חיץ עיכול collagenase ולהוסיף אותו בחזרה לצינור חרוטי 15 מ"ל.
- שימוש במספריים לנתיחה משובח טחון הלבלב בסירה הקטנה במשקל המכילה 1 מ"ל של חיץ עיכול collagenase. בשר טחון עד לפתרון שהתקבל מופיע מפוזר באופן שווה.
- העבר את המוצר הטחון בבקבוק פלסטיק Erlenmeyer מ"ל 125, ולהוסיף 5 מ"ל הנותר של חיץ עיכול collagenase למכל. ודא הרקמה היא שקועה באופן מלא במאגר.
- מניחים את הבקבוק באמבט מים 37 מעלות צלזיוס ולנער ב 90 סל"ד למשך 30 דקות. במהלך תקופה קצרה זו של השבתה, להכין אגוניסטים הפעלת סידן (למשל caerulein, carbachol) ולשטוף את מכסה חומצת שטף מ"מ 22x22התלושים עם מים די. יבש, ולאחר מכן למקם על גבי משטח שטוח בשורה של סרט מעבדה.
- לאחר 30 דקות לעכל הושלם, להעביר את ההשעיה חזרה לצינור חרוטי 15 מ"ל ולאפשר לתאים להתיישב. פיפטה בזהירות את חיץ עיכול collagenase ולהחליף עם 6 מ"ל של חיץ הדגירה BSA. בתוקף ללחוץ את הצינור ביד למשך 10 שניות על מנת לפזר את התאים לקבוצות קטנות יותר. מייד עם רועד, להסיר כל פסולת גדולה, צוף מהתקשורת בלתי המוסדרת.
- אפשר התאים שנותרו כדי להתיישב, ולהחליף את התקשורת עם חיץ הדגירה BSA טרי.
- חזור על שלב 1.11 פעמיים, עד שההשעיה מורכבת רק קבוצות קטנות שהן רק דק גלויות לעין בלתי מזוינת. התאים צריכים להיות דומים לאלו שמתוארים באיור 1 א (בשורה העליונה).
- הסר את חיץ הדגירה BSA ולהחליף עם חיץ הדגירה HEPES.
- להכין 750 מיקרומטר, מניות 100X של Fluo-04:00 ב10% DMSO.
- לטעון את התאים בצינור חרוטי 15 מ"ל המכיל את ההשעיה התא וחיץ הדגירה HEPES ללא BSA. כדי לעשות זאת, להוסיף נפח מתאים (1:100 דילול) של פתרון המניות להשעית התא. לאחר מכן צלחת μl 500 של השעיה זו על כל coverslip מ"מ 22x22.
- שמור coverslips בחושך בטמפרטורת חדר. קח Ca 2 + המדידות הראשון 30 דקות לאחר טעינה. הצבע יוסר באופן אוטומטי מהמדיום על התחלת זלוף, שאמור להתרחש 30 דקות לאחר טעינת צבע.
2. מדידת הסידן בתאי לבלב acinar
- יש לשטוף את כל זלוף הגדרה עם מים די ולמלא עם כמות מתאימה של חיץ או אגוניסט. ראש כל מזרק עם חיץ או אגוניסט כדי להבטיח זרימה תקינה. הצמד מזרקים לטבעת עומד כ 1-2 מטרים מעל הבמה מיקרוסקופ.
- השתמש בפינצטה העדינה לתפוס בזהירות מההשעיה שלו קצה אחד coverslip המכילה תא. הטה את המכסהלהחליק 45 °, ולאפשר למאגר העודף לברוח. מקם את coverslip על גבי אטם הגומי עם התאים על גבי coverslip, ולהרכיב את החדר (איורים 2 א ו -2).
- אבטח את תא זלוף לבמה ולהכניס את הצינור המכיל חיץ לכניסה הראשונה של החדר (איור 2 ג). הפעל את המזרק המכיל חיץ על ולאפשר לחיץ perfuse על כל פני השטח של coverslip. ברגע שהמאגר שהגיע בקצה השני של החדר, להוסיף קו ואקום ליניקת הוואקום. הכנס את כל צינורות אחרים (המכיל אגוניסט, מעכבים, וכו ') למקומו המתאים שלהם לאורך החדר.
- דמיינו את התאים או באמצעות, או אובייקטיבי 200X 400X 1.4 מספרי צמצם וארגון לייזר כדי לרגש את צבע Fluo-04:00 באורך גל של 488 ננומטר (איור 1 א, למטה). כוח ההגדרות של לייזר צריכים להיות מותאמות באופן שהצינור המכפיל (PMT) אינו רווי באור הנפלט. בנוסף, מתח על פני PMT צריך להיות מותאם לגילוי אור מרבי.
- אותות פליטה ארוכים לעבור של 515 ננומטר> נאספים במהירויות מסגרת של 2-5 שניות / מסגרת להמחשה של דפוסי oscillatory איטיים ו0.2-0.3 שניות פריימים / המאפשר הדמיה מהירה יותר, גלי סיד הגלובליים (איורים 3 ו -4).
- לאחר ההדמיה הושלמה, סגור את המזרקים ולהסיר את כל צינורות. לפרק את התא וחזור על שלבי 2.2-2.4.
- איסוף נתונים כערכים מספריים של עוצמת הקרינה לאורך זמן והעברה לתמונת J (חבילת תוכנה המסופקת כתוכנה החופשית על ידי המכון הלאומי לבריאות וניתן למצוא בhttp://rsb.info.nih.gov/ij/).
- צפה בתמונות סלולריות בזמן אמת ולזהות אזורים של עניין (ROIs, כלומר הפסגה, basolateral, גרעיני, וכו ')
- רוכש את עוצמות הקרינה לROIs אלה וRepresent כעוצמת הקרינה בעוצמה / תחילת המחקר הקרינה (כלומר F/F0).
- ליצור העתקים על ידי התוויית F f / 0 לעומת זמן. בנוסף להעתקים, תמונות נציג מסופקות בדרך כלל ומוצגות באמצעות pseudocolor.
3. הכנת תאי לבלב acinar למבחני פגיעה בתא
- תקשורת חמה DMEM-F-12 (ללא פנול האדום) ל 37 ° C.
- הוסף BSA (0.1% w / v סופי), וHCl (50 מיקרומטר סופי) לתקשורת את ה-F-12 DMEM.
- Aliquot 50 מ"ל של DMEM לתוך צינור חרוטי.
- הכן את חיץ collagenase על ידי הוספת 0.5 מ"ג / מ"ל (12 U / מ"ל) של collagenase הסוג IV עד 10 מ"ל של תקשורת בתוספת DMEM-F-12.
- להרדים את העכבר אחד בחנק CO 2. אוריינט בעלי החיים במצב שכיבה, ולהכין את שטח הבטן על ידי ניקוי עם 70% אתנול. בצע laparotomy לחשוף את חלל הבטן. לנתח את הלבלב ולשטוף באופן מיידי בסירה קטנה במשקל גontaining 6 מ"ל של חיץ collagenase.
- לרכך את הרקמה באמצעות מספריים לנתיחה קנס עבור 3-5 דקות או עד לפתרון שהתקבל מופיע מפוזר באופן שווה.
- העבר את הרקמה הטחון בבקבוק 125 מ"ל Erlenmeyer עם 5 מ"ל של חיץ collagenase נוסף, ולאחר מכן למקום 37 ° C אמבט מים עם הרועד בסל"ד 90 למשך 5 דקות.
- מרשימת שייקר, לאפשר לתאים להתיישב לזמן קצר, וחילופים עם 5 מ"ל של חיץ collagenase טרי. ואז דגירה של 35 דקות נוספות ב 37 ° C אמבט מים עם הרעד ב90 סל"ד.
- במרץ resuspend לעכל באמצעות פיפטה העברה עד ההשעיה מופיעה הומוגנית ללא גושי תא ברורים. ואז בעדינות פיפטה ההשעיה התא דרך רשת ניילון מראש רטובה לתוך בקבוק חרוטי.
- במרץ פיפטה 3 מ"ל נוסף של תקשורת ה-F-12 DMEM טרי (עם collagenase) מבעד לרשת, על מנת לכפות דרך כל תאים הנותרים.
- הוסף 6-10 מ"ל נוסף של DMEM מדיה F-12 וllow התאים ליישוב במשך 2-3 דקות. חזור על פעולה זו פעמיים, ולהסיר את supernatant לאחר לשטוף הסופי.
- הוסף מדיה טרי DMEM-F-12, resuspend התאים, ואת צלחת μl 500 של השעיה תא לתוך באר כל צלחת תרבית רקמת 48 היטב. התאים צריכים להיות דומים לאלו שמתוארים באיור 1.
- לאפשר את הצלחת לשבת באמבט מים 37 מעלות צלזיוס ב 90 סל"ד במשך 5 דקות לפני הוספת אגוניסטים.
- לגרות את התאים עם משתנה אגוניסטים במשך 2-4 שעות.
- הטה את הצלחת בזווית כדי לאפשר לתאים להתיישב ופיפטה בזהירות aliquot של תקשורת (בדרך כלל 100 μl) והקפאת הבזק בחנקן נוזלי.
- פלאש להקפיא את ההשעיה התא הנותרת. הקפאת פלאש היא לא חיונית למדידות LDH. כפי שניתן שמרו לדגימות אלטרנטיביות על קרח, אם הם יהיו assayed באותו היום או לאחסן -20 ° C עבור אחסון לטווח ארוך.
4. מדידה דלף קטט דהידרוגנאז
- דהידרוגנז דליפת חומצת החלב מדוד (LDH), תוך שימוש בעיקר בחומרים הכימיים וההנחיות שסופקו בערכת 96 Promega CytoTox ללא רדיואקטיבי Cytotoxicity assay (ראה טבלה של חומרים כימיים וחומרים ספציפיים).
- מחדש את מצע LDH (המסופק בערכה) עם 12 מ"ל של חיץ assay (גם סיפק).
- הפשירי השעיה תא קפוא ודגימות תקשורת באמבט מים בטמפרטורת חדר.
- צלחת μl 50 של כל דגימת תקשורת בצלחת 96 היטב.
- להשעית התא, להוסיף נפח ההכרחי של מאגר תמוגה 10X, כך שהריכוז הסופי הוא 1X. בקצרה מערבולת ולדגור על 37 מעלות צלזיוס למשך 60 דקות.
- צנטריפוגה דגימות lysed ב 250 XG במשך 4 דקות לפסולת תא גלולה.
- לlysates התא, צלחת μl 50 של דילול 1:10 לבאר כל צלחת 96 באר.
- הוסף 50 μl של מצע משוחזר היטב כל אחד, דגירה את הצלחת בחושך בטמפרטורת חדר למשך 30 דקות.
- לעצור את התגובה על ידיהוספת 50 μl של להפסיק פתרון (מסופק בערכה) זה טוב.
- מדוד הספיגה ב 490 ננומטר.
- השתמש בנוסחות הבאות לחישוב זליגת% LDH. הצפיפות האופטית מתחת מתוקנות על ידי הפחתה מתוך קריאת OD ריקה מהיטב המכיל רק PBS, מצע, ולהפסיק פתרון.
LDH בתקשורת = (מדיה OD492) X (גורם לדילול תקשורת) X (כרך של תקשורת) * מאז הוא בדרך כלל מיותר לדלל דגימות בתקשורת, גורם לדילול יהיה לרוב equal1.
סה"כ LDH = (X X (lysate OD 490) (גורם לדילול lysate) (כרך א בהשעית תא)) + (X X (מדיה OD 490) (גורם לדילול) (כרך של תקשורת aliquoted לדגימה))
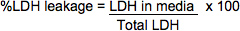
5. הדבקה של תאי לבלב עם acinar Adenovirus
- להכיןתאי לבלב acinar כאמור בסעיף 3.
- בעקבות צעד 3.12, להוסיף 10 יחידות 7 זיהומיות (IFUs) של אדנווירוס להשעית תא דגירה למשך 30 דקות ב 37 ° C.
- באופן שווה צלחת 2 מ"ל של השעיה תא בצלחת 6 באר.
- עבור רוב בונה ביטוי, תאים צריכים להיות מספקת נגועים בתוך 18 שעות, ועבור חלק ממבני לוציפראז, רק בתוך 6 שעות.
תוצאות
דוגמה של מדידות סיד סלולריים acinar בתגובה לגירויים פיסיולוגיים מסופקת באיור 3. תאי acinar היו עמוסים הסיד לצבוע Fluo-4 וperfused עם אצטילכולין האנלוגי carbachol (CCH; 1 מיקרומטר)) 8. תאים הגיבו בצורה של גל סיד אשר יוזם באזור הקודקוד ומתפשט לאזור basolateral 3,9. העתקי נציג המוצגים באיור 3 מדגימים את דפוס שיא הרמה הטיפוסי נצפה בדרך כלל עם carbachol 1 מיקרומטר. לעומת זאת, שימוש במינונים תת מקסימאלי של כולציסטוקינין האנלוגי caerulein (10 בלילה) מניב תגובות oscillatory סיד (איור 4) 10.
דליפה של LDH מתאי acinar בתגובה לאגוניסטים דלקת לבלב וישכנע מוצגת באיור 5. כאן אנו מדגימים עליית ריכוז תלויה בדליפת LDH בנוכחות caerulein, carbachol, או לאהוא מרה חומצה גופרתי חומצת taurolithocholic-3 (TLCS). הריכוזים הדרושים על מנת לגרום לזליגה מקסימלי של LDH עולים בקנה אחד עם אלה הנדרשים כדי לגרום להפעלת פרוטאז התוך acinar ואיתות סיד פתולוגיים, דבר המצביע אירועים אלה עלולים להוביל לפציעה.
תאי acinar נדבקו באדנווירוס כתב לוציפראז, כי הוא מונע על ידי האמרגן לגורם מורד Cn מפעיל, גרעין של תאי T מופעל (NFAT; איור 6 א). אנו מספקים נתונים מייצגים אימות זיהום השיטה שלנו, הוכחת עליית ריכוז ותלויה זמן בפעילות NFAT-לוציפראז בנוכחות TLCS (האיורים 6B ו6C).

איור 1. נציג תמונות של תאי לבלב acinar folגעיית הכנות שונות. () תאי acinar מוכנים לCa 2 + מדידות, כפי שדמיינו בהגדלה 630X. בשורה עליונה מציגה מיקרוסקופ שדה בהיר, בשורה תחתונה מציגה תאי acinar עמוסים Ca 2 + הצבע Fluo-4 ו דמיין באמצעות מיקרוסקופ פלואורסצנטי. (ב) תאי acinar מוכנים למבחני cytotoxicity, כפי שדמיינו בהגדלה 400X.

איור 2. . קאמרי perifusion () התא מורכב משלוש שכבות:. מתכת פשוטה; אטם גומי; וכיסוי פלסטיק (ב ') אטם הגומי ממוקם על גבי המתכת וcoverslip מ"מ 22x22 המכילה תאים מושם כלפי מעלה על גבי אטם הגומי. כיסוי הפלסטיק מוברג לבסיס המתכת וcoverslip מ"מ 18x18 ממוקמת על גבי. (ג) הוא התא אזמאובטח על הבמה מיקרוסקופ. אבובים, מאגר המכיל או אגוניסט, מוזן לתוך פתחי הכניסה הממוקמות על קצו של החדר (חץ). צינורות נפרדים מובילים לואקום (ראש חץ).
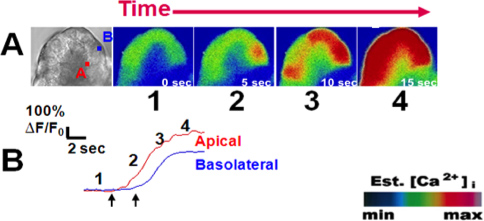
איור 3. אות סיד שיא רמה טיפוסית על גירוי עם carbachol (1 מיקרומטר). () משמאל לימין; תצוגת שדה מוארת של acinus כותרת ב() Pical ו (ב) אזורי asolateral עניין מתא acinar. תאים הועמסו עם מחוון סיד Fluo-4 (5 מיקרומטר). על הגירוי עם carbachol הפיזיולוגי (1 מיקרומטר; אח אנלוגי), התמונות הבאות מראות את תחילתו של אות הסיד באזור הפסגה ואחרי התפשטות לאזור הבסיס (ב) כל תמונה ספונת (1-4), מתאימה למסגרת. יחד עם נציג התחקות של שינוי בקרינה לאורך זמן עבור כל אזור של עניין. תמונות הןמיוצג בpseudocolor עם סולם צבעים (מימין למטה). חיצים שמאלה וימינה להראות זמן של עליית סיד הראשונה באזורי apical והבסיסיים, בהתאמה. נתון זה פורסם במקור בכתב העת לכימיה ביולוגית. (Orabi AI, AU שאה, Muili ק ', י' לואו, מחמוד SM, אחמד ע ', ריד א, אתנול SZ חוסיין משפר הפעלת פרוטאז-Induced carbachol ומאיץ גלי סידן בacini לבלב חולדה המבודד. כתב העת לכימיה ביולוגית , 2 86, 14,090-14,097 (2011)).

איור 4. תנודת סידן אופיינית על גירוי caerulein (10 בלילה). (א) שינויים בכל סיד cytosolic תא נמדדו פעם אחת לשנייה על ידי מיקרוסקופיה confocal זמן לשגות באמצעות הסיד לצבוע Fluo-4 / AM. תמונות מוצגות בpseudocolor עם הצבע שלקייל (ימין למעלה). (ב) עלילת נציג של הקרינה לאורך הזמן נרשמה מתא בודד שטופל בcaerulein (10 בלילה) ב-pH 7.4. נתון זה פורסם במקור בכתב העת לכימיה ביולוגית. (ריד בבוקר, חוסיין "ז, א זורק, אלכסנדר מ ', א שאה, גורליק FS, pH תאי נמוך נתנזון MH גורם נזק בתא acinar הלבלב על ידי סידן שיפור איתות כתב העת לכימיה ביולוגית, 286, 1919-1926 ( 2011)).

איור 5. מדידת פגיעה בתא מהתאים שטופלו באגוניסטים acinar דלקת לבלב וישכנע שונים. בתאי acinar מבודדים, דהידרוגנז דליפת חומצת החלב (LDH) שימש כדומחוון ochemical של פציעה. טופלו תאי acinar מבודדים עם ריכוזים שונים של () caerulein (1-100 ננומטר) (ב) carbachol (1 מיקרומטר -1 מ"מ) ו (ג) TLCS (50-500 מיקרומטר), ו% דליפת LDH נמדד לאחר 2 משאבי אנוש. (N = 3). #, *, P <0.05 לעומת השליטה וTLCS לבד, בהתאמה.

איור 6. מדידת פעילות לוציפראז בתאי לבלב acinar הנגועים Adeno-NFAT-לוציפראז. () סכימה לזיהום של תאי לבלב acinar עכבר עיקריים עם הצטברות NFAT-לוציפראז. (ב ') מנהל מTLCS (5-500 מיקרומטר) פעילות NFAT-לוציפראז המושרה. (C) כמובן זמן להפגין adenoviral של הארה עם TLCS (500 מיקרומטר) שניתנה על 6hr התקופה. (N = 3). *, #, P <0.05, ביחס לשליטה או TLCS לבד, בהתאמה.
Discussion
שיטת בידוד התא והמבחנים שלאחר מכן מתוארות כאן מייצגים כלים רבי עוצמה שבה ללמוד את התכונות הפיזיולוגיות וpathophysiological של הלבלב אקסוקרינית. השיטה לבידוד תאי לבלב acinar מפוזר תוארה לראשונה על ידי אמסטרדם וג'יימיסון 11 בשינה 1972. השיטות שהוצגו כאן הותאמו משיטות הבידוד האחרונות יותר שתוארו על ידי ואן אקר ועמיתיו 12. למרות שטכניקות אלה הן שחזור מאוד ולמד בקלות, יש כמה תכונות קריטיות לכל שיטה שצריכה להתבצע באופן מדויק. הבנת פרטים טכניים אלה תאפשר ליישום בעיות ירי קל יותר ומשופר.
בהכנת התאים למדידות סידן, גילה שהלבלב ממכרסמים צעירים מניב תוצאות עקביות יותר. את acini יותר יחולק בצורה שווה, ואולי משום שהם מכילים פחות רקמת fibro-שומנית. עבור Ca 2 + מדידות, אנו מכינים acini קטן הדמיה תא בודד אופטימלית. זה דורש ריכוז collagenase גבוה (1.1 מ"ג / מ"ל או 200 U / מ"ל) בהשוואה לזה המשמש למדידות LDH. למדידות LDH, אנו מכינים acini גדול יותר מכיוון ששיטה זו פגיעתו פחותה, בתחילת מחקר. ההכנה, אם כן, מקבלת ריכוז collagenase נמוך יותר (0.5 מ"ג / מ"ל או 91 U / ml).
לCa 2 + מדידות, זה קריטי, כי תאים להיות מצופה על coverslips חומצת שטף. המטרה של החומצה לשטוף היא לספק משטח נקי, כמו גם אינטראקציות אלקטרוסטטיות שתאפשר דבקות המרבית של acini. תא טאק (BD Bioscience) יכול לשמש כתחליף או בנוסף לשיטה זו. בנוסף לכך, זה קריטי, כי Ca 2 + הצבע טעון בחיץ דגירה ללא BSA במטרה (1) כדי למנוע את הצבע מהכריכה לBSA ו( 2) כדי לאפשר acini לדבוק מקסימאלי לcoverslips חומצת שטף .
t "> חדר זלוף תאר היה. תאים מסחריים שנועדו מותאמים אישית ומערכות זרימה, לעומת זאת, זמינים דרך מכשירים וורנר. בנוסף לזלוף, הקמת ואקום מוסדר כראוי מהווה גורם קריטי במניעת תאי acinar מלהיות שואבים את coverslip.כאשר מודדים אותות סידן מתאי לבלב acinar, אנו מתארים את השימוש במיקרוסקופ confocal. Confocal הדמיה משתמשת בחריר מול צינור מכפיל כדי לחסל אור מעל או מתחת למישור המוקד. בניגוד לכך, הדמיה רחבה בתחום מזהה אור לאורך נתיב העירור של הדגימה, המאפשרת את המיקוד של אור (אור כלומר מעל ומתחת למישור הרצוי של מוקד) לזהם את תמונת הקרינה של הדגימה. היתרון של מיקרוסקופיה confocal מעל השדה רחב הוא שהיא מאפשרת הדמיה דק קטע של מדגם, כמו גם שחזור 3D של פרוסות אופטיות שנאספו לאורךציר ה-Z. בנוסף, מיקרוסקופיה confocal מספקת מערכות איסוף במהירות גבוהה אשר יכול ללכוד שינויים מהירים בקרינת סידן באמצעות דיסק מסתובב, סורק קו, סורק sweptfield, או אפילו אזורים המצומצמים מסורק נקודה.
שינויים במרחב ובזמן סיד דפוסי איתות כגון גלים ותנודות, בהתאמה, ניתן למדידה מהימנה באמצעות חישוב 0 F / F, אבל זה לא אינדיקציה אמיתית של [Ca 2 +]. מדידות כמותיות של [Ca 2 +] ניתן לחשב באמצעות עירור אורך גל יחיד וצבעי סיד פליטה כגון Fluo-4, למרות שטעויות יכולות להתרחש במדידות אלה בשל photobleaching ולצבוע אובדן 13,14. [Ca 2 +] ניתן למדוד בצורה מדויקת יותר על ידי שימוש בצבעי ratiometric, כגון Fura2 או Indo1 15, אבל זה לא מעשי במיקרוסקופי confocal ביותר בגלל הדרישה של לייזר UV לעירור. מצד השני, concomitaשימוש NT של Fluo-3-4 או Fluo וFura, אדום יכול לאפשר יחס הדמיה באמצעות קו 488 ננומטר העירור שקיים ברוב המיקרוסקופים confocal 16.
דליפת LDH היא כלי רגיש למדידת פציעת תא acinar 7,17. שיטה נוספת היא משלימה propidium ספיגת יודיד 18. זיהומי אדנווירוס להשיג שיעורי זיהום גבוהים בacini התרבותי 19. הריכוז של וירוס ייתכן שיהיה צורך טיטרציה. בנוסף, כדאי לספק תנאי בקרה דומים שבו מבנה adenoviral אחר רלוונטי גם נגוע. רוב מחקרי הזיהום שלנו האחרונים ב 12 שעות. עם זאת, לתקופות ארוכות יותר, ניתן להוסיף אנטיביוטיקה לתקשורת את DMEM-F12 בתחילת הדרך.
Disclosures
אין ניגוד האינטרסים הכריז.
Acknowledgements
עבודה זו נתמכה על ידי מכון לאומי לבריאות DK083327 גרנט, וDK093491 (לSZH).
Materials
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalogue Number | Comments |
| Mice | NCI | N/A | Male 20-30 grams; virtually any strain should yield comparable results. |
| HEPES | American Bioanalytical | AB00892 | |
| Sodium Chloride | J.T. Baker | 3624-05 | |
| Potassium Chloride | J.T. Baker | 3040-01 | |
| Magnesium Chloride | Sigma | M-8266 | |
| Calcium Chloride | Fischer | C79 | |
| Dextrose | J.T. Baker | 1916-01 | |
| L-Glutamine | Sigma | G-8540 | |
| 1X minimum Eagle's medium non-essential amino acid mixture | Gibco | 11140-050 | |
| Sodium Hydroxide | EM | SX0593 | |
| Bovine Serum Albumin | Sigma | A7906 | |
| Collagenase | Worthington | 4188 | |
| Soybean Trypsin Inhibitor | Sigma | T-9003 | |
| Carbon Dioxide | Matheson Gas | 124-38-9 | |
| 125 ml Erlenmeyer plastic flask | Crystalgen | 26-0005 | |
| Dissection kit | Fine Science Tools | 14161-10 | |
| 70% Ethanol | LabChem | LC222102 | |
| P1000, P100, P10 pipettes | Gilson | FA10005P | |
| Weighing boat | Heathrow Scientific | HS1420A | |
| Plastic transfer pipettes | USA Scientific | 1020-2500 | |
| 15 ml conical tubes | BD Falcon | 352095 | |
| 50 ml conical tubes | BD Falcon | 352070 | |
| 1.5 ml micro-centrifuge tube | Fisher | 05-408-129 | |
| 0.65 ml micro-centrifuge tube | VWR | 20170-293 | |
| 22 x 22 mm glass coverslips | Fisher | 032811-9 | |
| Nitric Acid | Fischer | A483-212 | |
| Hydrochloric Acid | Fischer | A142-212 | |
| Deionized water | N/A | N/A | |
| 18 x 18 mm coverslips | Fischer | 021510-9 | |
| Laboratory film | Parafilm | PM-996 | |
| Fluo-4AM | Invitrogen | F14201 | |
| Dimethylsulfoxide | Sigma | D2650 | |
| Luer lock | Becton Dickinson | 932777 | |
| 60 ml syringe | BD Bioscience | DG567805 | |
| 23 ¾ gauge needle | BD Bioscience | 9328270 | |
| PE50 tubing | Clay Adam | PE50-427411 | |
| Flat head screwdriver | N/A | N/A | |
| DMEM F-12, no Phenol Red | Gibco | 21041-025 | |
| 30.5 gauge needle | BD Bioscience | 305106 | |
| 5 CC syringe | BD Bioscience | 309603 | |
| 25 ml Erlenmeyer flask | Fischer | FB50025 | |
| Nylon mesh filter | Nitex | 03-150/38 | 150 μm pore size |
| 48 well tissue culture plate | Costar | 3548 | |
| 96 well tissue culture plate | Costar | 3795 | |
| 6 well tissue culture plate | Costar | 3506 | |
| Liquid nitrogen | Matheson Gas | 7727-37-9 | |
| Cytotoxicity assay kit | Promega | G1782 | |
| Adeno-GFP | N/A | N/A | Gift from J. Williams |
| Equipment | |||
| Ring stand with clamps | United Scientific | SET462 | |
| Perifusion chamber | N/A | N/A | Designed by S.Z.H and colleagues at Yale University |
| Vacuum line | Manostat | 72-100-000 | |
| Water bath with shaker | Precision Scientific | 51220076 | |
| Confocal microscope | Zeiss | LSM 710 | |
| BioTek Synergy H1 plate reader | BioTek | 11-120-534 | |
| Tissue culture hood | Nuaire | NU-425-600 | |
| Tissue culture Incubator | Thermo | 3110 |
References
- Toescu, E. C., Lawrie, A. M., Petersen, O. H., Gallacher, D. V. Spatial and temporal distribution of agonist-evoked cytoplasmic Ca2+ signals in exocrine acinar cells analysed by digital image microscopy. Embo J. 11, 1623-1629 (1992).
- Ito, K., Miyashita, Y., Kasai, H. Micromolar and submicromolar Ca2+ spikes regulating distinct cellular functions in pancreatic acinar cells. Embo J. 16, 242-251 (1997).
- Husain, S. Z., et al. The ryanodine receptor mediates early zymogen activation in pancreatitis. Proc. Natl. Acad. Sci. U.S.A. 102, 14386-14391 (2005).
- Raraty, M., et al. Calcium-dependent enzyme activation and vacuole formation in the apical granular region of pancreatic acinar cells. Proc. Natl. Acad. Sci. U.S.A. 97, 13126-13131 (2000).
- Orabi, A. I., et al. Dantrolene mitigates caerulein-induced pancreatitis in vivo in mice. Am. J. Physiol. Gastrointest. Liver Physiol. 299, G196-G204 (2009).
- Shah, A. U., et al. Protease Activation during in vivo Pancreatitis is Dependent upon Calcineurin Activation. Am. J. Physiol. Gastrointest. Liver Physiol. , (2009).
- Muili, K. A., et al. Pharmacologic and genetic inhibition of calcineurin protects against carbachol-induced pathologic zymogen activation and acinar cell injury. Am. J. Physiol. Gastrointest. Liver Physiol. , (2012).
- Orabi, A. I., et al. Ethanol enhances carbachol-induced protease activation and accelerates Ca2+ waves in isolated rat pancreatic acini. J. Biol. Chem. 286, 14090-14097 (2011).
- Nathanson, M. H., Padfield, P. J., O'Sullivan, A. J., Burgstahler, A. D., Jamieson, J. D. Mechanism of Ca2+ wave propagation in pancreatic acinar cells. J. Biol. Chem. 267, 18118-18121 (1992).
- Reed, A. M., et al. Low extracellular pH induces damage in the pancreatic acinar cell by enhancing calcium signaling. J. Biol. Chem. 286, 1919-1926 (2011).
- Amsterdam, A., Jamieson, J. D. Structural and functional characterization of isolated pancreatic exocrine cells. Proc. Natl. Acad. Sci. U.S.A. 69, 3028-3032 (1972).
- Van Acker, G. J., et al. Tumor progression locus-2 is a critical regulator of pancreatic and lung inflammation during acute pancreatitis. J. Biol. Chem. 282, 22140-22149 (2007).
- Ito, K., Miyashita, Y., Kasai, H. Kinetic control of multiple forms of Ca(2+) spikes by inositol trisphosphate in pancreatic acinar cells. J. Cell Biol. 146, 405-413 (1999).
- Leite, M. F., Burgstahler, A. D., Nathanson, M. H. Ca2+ waves require sequential activation of inositol trisphosphate receptors and ryanodine receptors in pancreatic acini. Gastroenterology. 122, 415-427 (2002).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46, 143-151 (2008).
- Schild, D., Jung, A., Schultens, H. A. Localization of calcium entry through calcium channels in olfactory receptor neurones using a laser scanning microscope and the calcium indicator dyes Fluo-3 and Fura-Red. Cell Calcium. 15, 341-348 (1994).
- Saluja, A. K., et al. Secretagogue-induced digestive enzyme activation and cell injury in rat pancreatic acini. Am. J. Physiol. 276, 835-842 (1999).
- Husain, S. Z., et al. Ryanodine receptors contribute to bile acid-induced pathological calcium signaling and pancreatitis in mice. Am. J. Physiol. Gastrointest. Liver Physiol. , (2012).
- Gurda, G. T., Guo, L., Lee, S. H., Molkentin, J. D., Williams, J. A. Cholecystokinin activates pancreatic calcineurin-NFAT signaling in vitro and in vivo. Mol. Biol. Cell. 19, 198-206 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved