Method Article
إعداد خلايا البنكرياس عنيبية لغرض التصوير الكالسيوم، القياسات إصابة الخلية، وعدوى الفيروسة الغدانية
In This Article
Summary
نحن تصف طريقة استنساخه من خلايا عنيبية إعداد البنكرياس الماوس من الماوس لغرض فحص إشارات الكالسيوم خلية عنيبية وإصابة الخلوية مع المحفزات ذات الصلة من الناحية الفسيولوجية ومرضي. وتقدم أيضا وسيلة للعدوى الفيروسة الغدانية من هذه الخلايا.
Abstract
الخلية عنيبي البنكرياس هي الخلية متني الرئيسي من إفرازات البنكرياس، ويلعب دورا أساسيا في إفراز أنزيمات البنكرياس في القناة البنكرياسية. بل هو أيضا موقع لبدء التهاب البنكرياس. نحن هنا تصف كيف يتم عزل بعض الخلايا الحويصلية من كامل الأنسجة البنكرياس وإشارات الكالسيوم داخل الخلايا ويتم قياس. وبالإضافة إلى ذلك، نحن تصف أساليب transfecting هذه الخلايا مع البنى الغدانية، وقياس وقت لاحق تسرب نازعة اكتات، علامة على إصابة الخلية، خلال الظروف التي تحفز على إصابة الخلية عنيبي في المختبر. هذه التقنيات توفر أداة قوية لتوصيف عنيبي خلية علم وظائف الأعضاء وعلم الأمراض.
Introduction
التغيرات الدينامية في الكالسيوم عصاري خلوي ضرورية لأحداث الخلية عنيبي على حد سواء الفسيولوجية والمرضية. ويعتقد أن هذه الآثار متباينة من الكالسيوم أن تنجم عن أنماط متميزة المكاني والزماني من الكالسيوم مما يشير 1. على سبيل المثال، ترتبط انزيم وإفراز السوائل من الخلايا عنيبي إلى ارتفاع الكالسيوم من منطقة محدودة من القطب القمي حيث يأخذ إفراز مكان 2. في المقابل، ويرتبط موجة الكالسيوم العالمي تليها إشارات الكالسيوم غير متذبذبة مكثفة مع الأحداث المرضية في وقت مبكر مما يؤدي إلى التهاب البنكرياس الحاد 3،4. وتشمل هذه التنشيط داخل عنيبي الأنزيم البروتيني، وانخفاض إفراز انزيم، وإصابة الخلية عنيبي. مختبرنا يستخدم معزولة البنكرياس عنيبات لدراسة هذه الأحداث المرضية في وقت مبكر الذي يؤدي إلى مرض على حد سواء في الجسم الحي في المختبر و 5-7. الأساليب بالتفصيل هنا وصف عزل الخلايا الأولية عنيبي لغرض قياس قبرصيمستويات الكالسيوم tosolic وإصابة الخلية. وتقدم أيضا وسيلة للعدوى الفيروسة الغدانية من هذه الخلايا.
Protocol
1. إعداد خلايا البنكرياس عنيبية للتصوير الكالسيوم
- إعداد HEPES العازلة الحضانة التي تحتوي على 20 ملي HEPES، 95 مم كلوريد الصوديوم، 4.7 ملي بوكل، 0.6 ملي MgCl 2، 1.3 مم CaCl 2، 10 ملي الجلوكوز، 2 مم الجلوتامين، و 1 × الأحماض الأمينية غير الأساسية المتوسطة الحد الأدنى النسر. ضبط الحل النهائي لدرجة الحموضة 7.4 مع هيدروكسيد الصوديوم.
- إعداد العازلة الحضانة BSA بإضافة BSA (1٪ ث / النهائي الخامس) إلى 25 مل من العازلة الحضانة HEPES (المذكورة أعلاه).
- إعداد العازلة الهضم كولاجيناز عن طريق إضافة 1.1 ملغ / مل (200 وحدة / مل) نوع-4 كولاجيناز و 1 ملغ / مل فول الصويا مثبط التربسين إلى 6 مل من العازلة الحضانة BSA (المذكورة أعلاه).
- حمض غسل ملم coverslips على 22x22 بغمر في جزأين HNO 3 وحمض الهيدروكلوريك جزء واحد لمدة 2 ساعة. ثم صب الماء باستخدام DI وتخزينها في الايثانول 70٪.
- الموت ببطء الماوس واحدا تلو CO 2 الاختناق. توجيه الحيوان في موقف ضعيف، وإعداد السطح البطني by كليآنينغ مع الايثانول 70٪. إجراء فتح البطن لفضح تجويف البطن. تشريح خارج البنكرياس وشطف على الفور في وزن قارب صغير يحتوي على 6 مل من العازلة الهضم كولاجيناز.
- تشريح بعيدا أي قطعة كبيرة من الدهون أو مرئية الأوعية الدموية، ثم إزالة 5 مل من العازلة الهضم كولاجيناز وإضافته مرة أخرى إلى مل أنبوب مخروطي 15.
- باستخدام مقص تشريح غرامة اللحم المفروم البنكرياس في قارب وزنها صغير يحتوي على 1 مل من العازلة الهضم كولاجيناز. اللحم المفروم حتى يظهر الحل الناتج فرقت بالتساوي.
- نقل المنتج المفروم إلى 125 مل دورق مخروطي سعة البلاستيك، وإضافة 5 مل المتبقية من العازلة الهضم كولاجيناز إلى الحاوية. تأكد من أن تغمر الأنسجة بالكامل في المخزن المؤقت.
- ضع قارورة في 37 ° C حمام الماء ويهز في 90 دورة في الدقيقة لمدة 30 دقيقة. خلال هذه الفترة القصيرة من الوقت الضائع، وإعداد منبهات تفعيل الكالسيوم (مثل caerulein، كرباكول) وشطف مم غطاء حمض غسلها 22x22زلات مع الماء DI. الجافة، ومن ثم وضع على رأس سطح مستو اصطف من قبل فيلم المختبر.
- بعد 30 دقيقة هضم كاملة، نقل تعليق عودة إلى مل أنبوب مخروطي 15 وتسمح للخلايا لتسوية. ماصة بعناية المخزن المؤقت الهضم كولاجيناز واستبدالها مع 6 مل من العازلة الحضانة BSA. هزة بقوة الأنبوب باليد لمدة 10 ثانية من أجل تفريق الخلايا في مجموعات أصغر. فور والهز، وإزالة أي كبير، والحطام العائم من وسائل الإعلام غير المستقرة.
- تسمح للخلايا المتبقية لتسوية، وتبادل وسائل الإعلام مع الطازجة العازلة الحضانة BSA.
- كرر الخطوة 1.11 مرتين، حتى يتكون تعليق مجموعات صغيرة فقط والتي هي فقط مرئية ناعما للعين المجردة. الخلايا يجب أن يشبه تلك مبين في الشكل 1A (الصف العلوي).
- إزالة العازلة الحضانة BSA واستبدالها مع HEPES العازلة الحضانة.
- إعداد 750 ميكرومتر، والأوراق المالية 100X من فلوو-4:00 في 10٪ DMSO.
- تحميل الخلايا في أنبوب مل 15 المخروطية التي تحتوي على تعليق خلية وHEPES خالية من BSA العازلة الحضانة. للقيام بذلك، إضافة حجم المناسب (1:100 تمييع) من محلول المخزون لتعليق الخلية. ثم لوحة 500 ميكرولتر من هذا التعليق على كل مم ساترة 22x22.
- الحفاظ على coverslips على في الظلام في درجة حرارة الغرفة. خذ أول كا 2 + قياسات 30 دقيقة بعد التحميل. تتم إزالة الصبغة تلقائيا من المتوسطة على البدء في التروية، والتي ينبغي أن تحدث 30 دقيقة بعد التحميل صبغ.
2. قياس الكالسيوم في خلايا البنكرياس عنيبية
- شطف كل نضح مجموعة المتابعة مع الماء DI وملء مع مبلغ مناسب من العازلة أو ناهض. رئيس كل حقنة مع العازلة أو ناهض لضمان التدفق السليم. المشبك المحاقن الى حلقة الوقوف حوالي 1-2 أقدام فوق خشبة المسرح المجهر.
- استخدام ملاقط غرامة لفهم بعناية من حافة واحدة ساترة تعليقها الخلية التي تحتوي. إمالة الغطاءتنزلق 45 درجة مئوية، والسماح المخزن المؤقت الزائدة لتشغيل قبالة. وضع ساترة على أعلى من المطاط طوقا مع الخلايا على رأس ساترة، وغرفة تجميع (أرقام 2A و 2B).
- تأمين غرفة نضح إلى مرحلة وإدراج الأنبوب الذي يحتوي المخزن المؤقت في مدخل أول من الغرفة (الشكل 2C). بدوره الحقنة تحتوي على عازلة على وتسمح المخزن المؤقت ليروي على سطح كامل من ساترة. مرة واحدة وصلت المخزن المؤقت الطرف الآخر من الغرفة، إدراج سطر فراغ في فراغ مدخل. إدراج أي الأنابيب الأخرى (التي تحتوي على ناهض، مثبطات، وغيرها) إلى موقفهم المناسبة على طول الغرفة.
- تصور الخلايا باستخدام إما، 1.4 العددية الهدف فتحة 200X أو 400X والأرجون ليزر لإثارة صبغ فلوو-04:00 في طول موجة من 488 نانومتر (الشكل 1A، أسفل). ينبغي تعديل إعدادات الطاقة من الليزر مثل أن أنبوب مضخم (PMT) غير مشبعة من الضوء المنبعث. وبالإضافة إلى ذلك، فإن الجهد عبر PMT يحتاج إلى أن يكون الأمثل لأقصى قدر من كشف ضوء.
- يتم جمع إشارات الانبعاثات طويلة تمريرة من> 515 نيوتن متر عند سرعات الإطار من 2-5 ثانية / الإطار لتصور أنماط متذبذبة بطيئة و0.2-0.3 ثانية / الإطار لتصور أسرع، وموجات الكالسيوم العالمي (الشكلان 3 و 4).
- بعد اكتمال التصوير، أغلق المحاقن وإزالة جميع الأنابيب. تفكيك الدائرة وكرر الخطوات من 2،2-2،4.
- جمع البيانات كقيم رقمية من كثافة مضان بمرور الوقت ونقل إلى صورة J (حزمة البرامج المقدمة ومجانية من قبل المعاهد الوطنية للصحة ويمكن العثور عليها في http://rsb.info.nih.gov/ij/ ).
- عرض الصور الخلوية في الوقت الحقيقي، وتحديد المناطق ذات الاهتمام (رويس، أي القمي، basolateral، النووية، الخ.)
- الحصول على كثافة مضان لهذه رويس وRepresent كما مضان كثافة / خط الأساس كثافة مضان (أي F/F0).
- توليد اقتفاء أثر التآمر من قبل F / F 0 مقابل الوقت. بالإضافة إلى اقتفاء أثر هي صور ممثل المقدمة عادة وعرضها باستخدام pseudocolor.
3. إعداد خلايا البنكرياس عنيبية لفحوصات إصابة الخلية
- الدافئة DMEM F-12 وسائل الاعلام (دون الحمراء الفينول) إلى 37 درجة مئوية.
- إضافة BSA (0.1٪ ث / ت النهائي)، وحمض الهيدروكلوريك (50 ميكرومتر النهائي) إلى DMEM F-12 وسائل الإعلام.
- قسامة 50 مل من DMEM في أنبوب مخروطي الشكل.
- إعداد العازلة كولاجيناز عن طريق إضافة 0.5 ملغ / مل (12 U / مل) من كولاجيناز النوع الرابع إلى 10 مل من DMEM تستكمل F-12 وسائل الإعلام.
- الموت ببطء الماوس واحدا تلو CO 2 الاختناق. توجيه الحيوان في موقف ضعيف، وإعداد السطح البطني عن طريق تنظيف مع الايثانول 70٪. إجراء فتح البطن لفضح تجويف البطن. تشريح خارج البنكرياس وشطف على الفور في صغيرة وزنها قارب جontaining 6 مل من العازلة كولاجيناز.
- اللحم المفروم والأنسجة باستخدام مقص تشريح غرامة لمدة 3-5 دقيقة أو حتى يظهر الحل الناتج فرقت بالتساوي.
- نقل الأنسجة المفروم إلى 125 مل دورق مخروطي مع 5 مل من العازلة كولاجيناز إضافية، ثم المكان الى 37 درجة مئوية حمام مائي مع اهتزاز في 90 دورة في الدقيقة لمدة 5 دقائق.
- إزالة من شاكر، تسمح للخلايا ليستقر لفترة وجيزة، وتبادل مع 5 مل من العازلة كولاجيناز الطازجة. ثم احتضان لمدة 35 دقيقة إضافية لفي 37 ° C حمام الماء مع اهتزاز في 90 دورة في الدقيقة.
- resuspend بقوة هضم باستخدام ماصة نقل حتى يظهر التعليق متجانسة مع عدم وجود كتل الخلية واضحة. ثم ماصة بلطف تعليق الخلية من خلال شبكة من النايلون ما قبل الرطب في قارورة المخروطية.
- ماصة بهمة إلى 3 مل إضافية من الطازجة DMEM F-12 وسائل الإعلام (مع كولاجيناز) من خلال شبكة، من أجل إجبار أي من خلال الخلايا المتبقية.
- أضف 6-10 مل أخرى من DMEM F-12 وسائل الإعلامllow الخلايا إلى تسوية لمدة 2-3 دقيقة. كرر هذه الخطوة مرتين، وإزالة طاف بعد غسل النهائي.
- إضافة الطازجة DMEM F-12 وسائل الإعلام، resuspend الخلايا، وطبق 500 ميكرولتر من تعليق خلية في كل بئر من 48 جيدا نسيج لوحة الثقافة. الخلايا يجب أن يشبه تلك مبين في الشكل 1B.
- تسمح لوحة للجلوس في 37 ° C حمام الماء عند 90 دورة في الدقيقة لمدة 5 دقائق قبل ان يضيف منبهات.
- تحفيز الخلايا مع منبهات مختلفة لمدة 2-4 ساعة.
- إمالة لوحة في زاوية للسماح للخلايا لتسوية وماصة بعناية قسامة من وسائل الإعلام (عادة 100 ميكرولتر) وتجميد فلاش في النيتروجين السائل.
- فلاش تجميد تعليق خلية المتبقية. تجميد فلاش ليست ضرورية لإجراء قياسات LDH. كما يمكن أن تظل على عينات بديلة على الجليد إذا كان سيتم يعاير نفس اليوم أو تخزينها في -20 درجة مئوية لمدة التخزين على المدى الطويل.
4. قياس اللاكتات تسرب إنزيم
- قياس اللاكتات نازعة (LDH) تسرب في المقام الأول باستخدام الكواشف والتعليمات المرفقة في PROMEGA CytoTox 96 غير المشعة السمسة عدة الفحص (انظر الجدول من الكواشف ومواد محددة).
- إعادة الركيزة LDH (التي يتم توفيرها في عدة) مع 12 مل من العازلة مقايسة (كما قدم).
- ذوبان الجليد تعليق خلية المجمدة وعينات سائل الإعلام في حمام مائي في درجة حرارة الغرفة.
- لوحة 50 ميكرولتر من كل عينة وسائل الإعلام في لوحة 96 جيدا.
- لتعليق الخلية، إضافة حجم اللازمة من تحلل العازلة 10X بحيث تركيز النهائي هو 1X. لفترة وجيزة دوامة واحتضان عند 37 درجة مئوية لمدة 60 دقيقة.
- أجهزة الطرد المركزي العينات هي lysed في 250 x ج لمدة 4 دقائق على الحطام الخلية بيليه.
- للست] الخلية، لوحة 50 ميكرولتر من التخفيف 01:10 في كل بئر من 96 لوحة جيدا.
- إضافة 50 ميكرولتر من الركيزة المعاد إلى كل بئر، واحتضان لوحة في الظلام في درجة حرارة الغرفة لمدة 30 دقيقة.
- وقف رد فعل من قبلإضافة 50 ميكرولتر من الحل محطة (المنصوص عليها في عدة) إلى كل بئر.
- قياس الامتصاصية في 490 نانومتر.
- استخدام الصيغ التالية لحساب٪ LDH تسرب. يتم تصحيح الكثافة البصرية أدناه بطرح بقراءة OD فارغة من التي تحتوي على برنامج تلفزيوني جيدا فقط، الركيزة، ووقف الحل.
LDH في وسائل الإعلام = (وسائل الإعلام OD492) × (عامل التخفيف وسائل الإعلام) × (المجلد من وسائل الإعلام) * نظرا لأنه عادة ما يكون غير ضروري لتخفيف عينات سائل الإعلام، فإن عامل التخفيف equal1 في معظم الأحيان.
مجموع LDH = ((المحللة OD 490) × (عامل التخفيف المحللة) × (المجلد في تعليق خلية)) + ((وسائل الإعلام OD 490) × (عامل التخفيف) × (المجلد من وسائل الإعلام aliquoted لأخذ العينات))
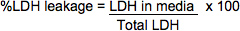
5. اصابة خلايا البنكرياس عنيبية مع اتش
- إعدادخلايا البنكرياس عنيبية كما هو موضح في القسم 3.
- بعد خطوة 3.12، إضافة 10 7 وحدات المعدية (تعليمات الاستخدام) من اتش لتعليق الخلية واحتضان لمدة 30 دقيقة عند 37 درجة مئوية.
- بالتساوي لوحة 2 مل من تعليق خلية في لوحة 6 جيدا.
- بالنسبة لمعظم بنيات التعبير، والخلايا ينبغي أن تكون مصابة بشكل كاف في غضون 18 ساعة، وبالنسبة للبعض بنيات وسيفيراز، فقط في غضون 6 ساعة.
النتائج
وتقدم مثالا للقياسات الكالسيوم خلية عنيبية في استجابة للمحفزات الفسيولوجية في الشكل 3. تم تحميل خلايا عنيبية مع الكالسيوم صبغ فلوو-4 ومع perfused أستيل التماثلية كرباكول (لجنة التنسيق؛ 1 ميكرومتر)) 8. استجابت الخلايا في شكل موجة الكالسيوم الذي يبدأ في منطقة قمية ويكاثر إلى المنطقة basolateral 3،9. اقتفاء أثر ممثل هو مبين في الشكل 3B تدليل على نمط ذروة هضبة نموذجي لاحظ عادة مع 1 ميكرومتر كرباكول. وعلى العكس، وذلك باستخدام جرعات شبه القصوى للكوليسيستوكينين التماثلية caerulein (22:00) ينتج استجابات الكالسيوم متذبذبة (الشكل 4) 10.
ويظهر تسرب LDH من خلايا عنيبية استجابة لمنبهات التهاب البنكرياس الذي يحفز في الشكل 5. نحن هنا لشرح الزيادات تعتمد على التركيز في LDH تسرب في وجود caerulein، كرباكول، أو روقال انه حامض الصفراء taurolithocholic حمض كبريتات 3 (مركز التعلم). التركيزات اللازمة للحث على تسرب القصوى من LDH تتسق مع تلك المطلوبة للحث داخل عنيبي التنشيط البروتيني وإشارات الكالسيوم مرضية، مما يشير إلى هذه الأحداث قد تؤدي إلى الإصابة.
أصيب الخلايا عنيبي مع اتش مراسل luciferase، التي يقودها المروج لسي إن المستجيب عامل المصب، النووية لتنشيط خلايا تي (NFAT؛ الشكل 6A). نحن توفير بيانات تمثيلية التحقق من صحة طريقة العدوى لدينا، مما يدل على تركيز والمعتمدة على الزمن زيادات في النشاط NFAT-وسيفيراز في وجود مدرسة مركز التعلم (أرقام 6B و 6C).

الشكل 1. صور الممثل من الخلايا عنيبي البنكرياس فلخوار الاستعدادات المختلفة. (A) خلايا عنيبية أعدت للكا 2 + قياسات، كما تصور في التكبير 630X. الصف العلوي يصور المجهر حقل مشرق، الصف السفلي يصور خلايا عنيبية محملة كا 2 + صبغ فلوو-4 وتصور باستخدام المجهر مضان. (B) خلايا عنيبية استعداد لفحوصات السمية الخلوية، كما تصور في التكبير 400X.

الشكل 2. . غرفة perifusion (A) تتكون دائرة من ثلاث طبقات: أ قاعدة معدنية؛ طوقا المطاط، وغطاء من البلاستيك (B) يتم وضع طوقا المطاط على الجزء العلوي من قاعدة معدنية ومم ساترة 22x22 تحتوي يتم وضع الخلايا صعودا على رأس طوقا المطاط. هو مشدود غطاء من البلاستيك إلى قاعدة معدنية ويوضع مم ساترة 18x18 على القمة. (C) الغرفة هو ثمأمنت إلى مرحلة المجهر. ويتم تغذية الأنابيب، التي تحتوي على عازلة أو ناهض، إلى مداخل تقع على حافة الغرفة (السهم). أنابيب منفصلة يؤدي إلى فراغ (رأس السهم).
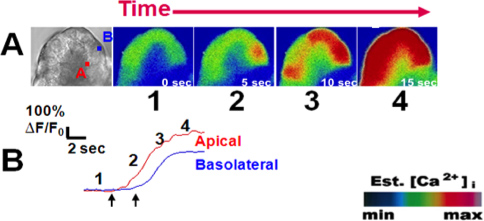
الشكل (3). نموذجي ذروة هضبة إشارة الكالسيوم على التحفيز مع كرباكول (1 ميكرومتر). (A) من اليسار إلى اليمين؛ عرض حقل مشرق من عنيبة صفت في (A) pical و (ب) الأقاليم asolateral من الاهتمام من خلية عنيبية. تم تحميل الخلايا مع المؤشر الكالسيوم فلوو-4 (5 ميكرومتر). على التحفيز مع كرباكول الفسيولوجية (1 ميكرومتر؛ منظمة العمل ضد الجوع التماثلية) والصور اللاحقة تظهر الشروع في إشارة الكالسيوم في المنطقة قمية تليها الانتشار في المنطقة القاعدية (B) كل صورة نصب منصة (1-4)، يتوافق مع الإطار. على طول ممثل اقتفاء أثر التغير في مضان بمرور الوقت لكل منطقة من الفائدة. الصور هيممثلة في pseudocolor مع نطاق اللون (أسفل اليمين). اليسار واليمين السهام تظهر مرة من أول ارتفاع الكالسيوم في المناطق القمية والقاعدية، على التوالي. تم نشر هذا الرقم في الأصل في مجلة الكيمياء البيولوجية. (عرابى منظمة العفو الدولية، الاتحاد الافريقي شاه، Muili K.، لوه Y.، محمود SM، أحمد A.، ريد A.، حسين SZ الايثانول يعزز التنشيط البروتيني كرباكول التي يسببها ويسرع موجات الكالسيوم في عزلة عنيبات البنكرياس الفئران. مجلة الكيمياء البيولوجية ، 2 86، 14090-14097 (2011)).

الشكل 4. A التذبذب الكالسيوم نموذجي على التحفيز caerulein (22:00). (A) تم قياس التغيرات في الخلية كله الكالسيوم عصاري خلوي مرة واحدة في الثانية الواحدة عن طريق الوقت الفاصل بين المجهري متحد البؤر باستخدام الكالسيوم صبغ فلوو-4 / AM. يتم تمثيل الصور في pseudocolor بلون قكال (أعلى اليمين). (B) سجلت مؤامرة ممثل مضان بمرور الوقت من خلية واحدة تعامل مع caerulein (10:00) في درجة الحموضة 7.4. تم نشر هذا الرقم في الأصل في مجلة الكيمياء البيولوجية. (ريد AM، حسين SZ، الرامي E.، الكسندر M.، شاه A.، غرليك FS، ناثانسون MH الرقم الهيدروجيني خارج الخلية منخفض ينتج عنه من ضرر في عنيبي خلية البنكرياس من خلال تعزيز الكالسيوم اشارة مجلة الكيمياء البيولوجية، 286، 1919-1926 ( 2011)).

الشكل 5. قياس إصابة الخلية من خلايا عنيبية تعامل مع مختلف منبهات التهاب البنكرياس الذي يحفز. في خلايا عنيبية معزولة، تم استخدام اللاكتات نازعة (LDH) تسرب باعتبارها ثنائيةمؤشر ochemical من الاصابة. تم علاج الخلايا عنيبي معزولة مع تركيزات مختلفة (A) caerulein (1-100 نانومتر) (B) كرباكول (1 ميكرومتر -1 ملم) و (C) وقد تم قياس مدرسة مركز التعلم (50-500 ميكرون)، و٪ LDH تسرب بعد 2 الموارد البشرية. (ن = 3). #، *، P <0.05 مقارنة بالكنترول ومدرسة مركز التعلم وحدها، على التوالي.

الشكل (6). قياس luciferase النشاط في خلايا البنكرياس عنيبية المصابين الغدة NFAT-وسيفيراز. (A) مخطط لإصابة خلايا فأر عنيبي البنكرياس الأولية مع NFAT-وسيفيراز. (B) إدارة مدرسة مركز التعلم (5-500 ميكرومتر) التي يسببها النشاط NFAT-وسيفيراز. (C) دورة تدريبية يتظاهرون تراكم الغدانية من التألق مع مدرسة مركز التعلم (500 ميكرومتر) تعطى على مدى 6HR الفترة. (ن = 3). *، #، P <0.05، نسبة إلى عنصر التحكم أو مدرسة مركز التعلم وحدها، على التوالي.
Discussion
طريقة العزلة الخلية والمقايسات اللاحقة صورت هنا تمثل أدوات قوة، والتي لدراسة ملامح الفسيولوجية والمرضية في جسم المريض من إفرازات البنكرياس. وقد وصفت طريقة لعزل الخلايا فرقت عنيبي البنكرياس أول من أمستردام وجاميسون في عام 1972 11. وقد تم تكييف الأساليب المقدمة هنا من أساليب العزلة أكثر حداثة التي وصفها فان آكر وزملاؤه 12. على الرغم من أن هذه التقنيات هي تكرار للغاية وتعلمت بسهولة، وهناك العديد من الميزات الهامة إلى كل الطريقة التي يجب أن تنفذ بدقة. وفهم هذه التفاصيل التقنية تسمح لتسهيل حل المشاكل وتحسين التطبيق.
في إعداد الخلايا لقياس الكالسيوم، وجدنا أن البنكرياس من القوارض الأصغر تعطي نتائج أكثر اتساقا. وعنيبات توزع بالتساوي أكثر، ربما لأنها تحتوي على الأنسجة الدهنية أقل الليفي. إلى كا 2 + القياسات، ونحن نستعد لعنيبات أصغر الأمثل التصوير خلية واحدة. وهذا يتطلب تركيز كولاجيناز أعلى (1.1 ملغ / مل أو 200 U / مل) من تلك المستخدمة لقياس LDH. لإجراء قياسات LDH، ونحن نستعد عنيبات أكبر لأن هذا الأسلوب يسبب أقل إصابة في الأساس. إعداد، لذلك، يتلقى تركيز كولاجيناز السفلى (0.5 ملغ / مل أو 91 U / مل).
لكا 2 + القياسات، فمن الأهمية بمكان أن يتم مطلي الخلايا coverslips على حمض غسلها. الغرض من حمض غسل هو توفير سطح نظيف وكذلك التفاعلات كهرباء من شأنها أن تسمح الحد الأقصى من الالتزام عنيبات. خلية تاك (BD العلوم البيولوجية) يمكن استخدامها بدلا من أو بالإضافة إلى هذا الأسلوب. وبالإضافة إلى ذلك، من المهم جدا أن كا 2 + صبغ تم تحميله في مخزن مؤقت حضانة خالية من BSA في النظام (1) لمنع الصبغة من ملزمة لBSA و (2) للسماح للعنيبات الالتزام الحد الأقصى لcoverslips على حمض غسلها .
ر "> غرفة نضح صفها ومصممة خصيصا. الغرف التجارية وأنظمة التدفق، ومع ذلك، تتوفر من خلال أدوات وارنر. بالإضافة إلى نضح، وإقامة فراغ ينظم بشكل صحيح يشكل عاملا حاسما في منع الخلايا من عنيبي يجري شفط قبالة ساترة.عند قياس إشارات الكالسيوم من خلايا البنكرياس عنيبية، ونحن تصف استخدام المجهر متحد البؤر. يستخدم متحد البؤر التصوير ذات الثقب أمام أنبوب مضخم من أجل القضاء على الضوء من فوق أو تحت المستوى البؤري. في المقابل، تصوير واسعة المجال بالكشف الخفيفة طوال مسار الإثارة للعينة، والذي يسمح للخروج من ضوء التركيز (أي ضوء فوق وتحت الطائرة المرجوة من التركيز) لتلويث صورة مضان من العينة. ميزة من خلال الفحص المجهري متحد البؤر واسعة المجال هو أنه يتيح لقسم رقيقة التصوير لعينة، وكذلك إعادة الإعمار 3D من شرائح الضوئية التي جمعت على طولوZ-المحور. وبالإضافة إلى ذلك، يوفر الفحص المجهري متحد البؤر نظم جمع عالية السرعة التي يمكن التقاط التغيرات السريعة في مضان الكالسيوم باستخدام قرص الغزل، فاحص خط، sweptfield الماسح الضوئي، أو المناطق حتى ضاقت من ماسح ضوئي نقطة.
التغيرات المكانية والزمانية في الكالسيوم أنماط الإشارات مثل موجات والتذبذبات، على التوالي، ويمكن قياسها بشكل موثوق باستخدام F / F 0 حساب، ولكن هذا ليس مؤشرا صحيحا من [كا 2 +]. القياسات الكمية من [كا 2 +] يمكن حسابها باستخدام الإثارة الطول الموجي واحد والأصباغ الكالسيوم الانبعاثات مثل فلوو-4، على الرغم من أن يمكن أن تحدث أخطاء في هذه القياسات بسبب photobleaching وصبغ خسارة 13،14. [كا 2 +] ويمكن قياس أكثر دقة باستخدام الأصباغ ratiometric، مثل Fura2 أو Indo1 15، ولكن هذا غير عملي في معظم المجاهر مبائر بسبب اشتراط وجود ليزر الأشعة فوق البنفسجية لإثارة. من ناحية أخرى، concomitaيمكن استخدام NT من فلوو-3-4 أو فلوو وFURA الأحمر تسمح باستخدام التصوير نسبة 488 نانومتر خط الإثارة التي موجود في معظم المجاهر مبائر 16.
LDH تسرب هو أداة حساسة لقياس إصابة الخلية عنيبي 7،17. طريقة مكملة آخر هو يوديد propidium امتصاص 18. التهابات اتش تحقيق معدلات الإصابة المرتفعة في تربيتها عنيبات 19. قد تحتاج تركيز الفيروس إلى أن معاير. وبالإضافة إلى ذلك، فإنه من المفيد لتوفير ظروف مماثلة في التحكم التي يتم إصابة أيضا بناء آخر الغدانية لا صلة لها بالموضوع. معظم الدراسات عدوى دينا آخر لأقل من 12 ساعة. ومع ذلك، لفترات أطول، ويمكن إضافة المضادات الحيوية إلى وسائل الإعلام DMEM-F12 في البداية.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل المعاهد الوطنية للصحة منح DK083327، وDK093491 (لSZH).
Materials
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalogue Number | Comments |
| Mice | NCI | N/A | Male 20-30 grams; virtually any strain should yield comparable results. |
| HEPES | American Bioanalytical | AB00892 | |
| Sodium Chloride | J.T. Baker | 3624-05 | |
| Potassium Chloride | J.T. Baker | 3040-01 | |
| Magnesium Chloride | Sigma | M-8266 | |
| Calcium Chloride | Fischer | C79 | |
| Dextrose | J.T. Baker | 1916-01 | |
| L-Glutamine | Sigma | G-8540 | |
| 1X minimum Eagle's medium non-essential amino acid mixture | Gibco | 11140-050 | |
| Sodium Hydroxide | EM | SX0593 | |
| Bovine Serum Albumin | Sigma | A7906 | |
| Collagenase | Worthington | 4188 | |
| Soybean Trypsin Inhibitor | Sigma | T-9003 | |
| Carbon Dioxide | Matheson Gas | 124-38-9 | |
| 125 ml Erlenmeyer plastic flask | Crystalgen | 26-0005 | |
| Dissection kit | Fine Science Tools | 14161-10 | |
| 70% Ethanol | LabChem | LC222102 | |
| P1000, P100, P10 pipettes | Gilson | FA10005P | |
| Weighing boat | Heathrow Scientific | HS1420A | |
| Plastic transfer pipettes | USA Scientific | 1020-2500 | |
| 15 ml conical tubes | BD Falcon | 352095 | |
| 50 ml conical tubes | BD Falcon | 352070 | |
| 1.5 ml micro-centrifuge tube | Fisher | 05-408-129 | |
| 0.65 ml micro-centrifuge tube | VWR | 20170-293 | |
| 22 x 22 mm glass coverslips | Fisher | 032811-9 | |
| Nitric Acid | Fischer | A483-212 | |
| Hydrochloric Acid | Fischer | A142-212 | |
| Deionized water | N/A | N/A | |
| 18 x 18 mm coverslips | Fischer | 021510-9 | |
| Laboratory film | Parafilm | PM-996 | |
| Fluo-4AM | Invitrogen | F14201 | |
| Dimethylsulfoxide | Sigma | D2650 | |
| Luer lock | Becton Dickinson | 932777 | |
| 60 ml syringe | BD Bioscience | DG567805 | |
| 23 ¾ gauge needle | BD Bioscience | 9328270 | |
| PE50 tubing | Clay Adam | PE50-427411 | |
| Flat head screwdriver | N/A | N/A | |
| DMEM F-12, no Phenol Red | Gibco | 21041-025 | |
| 30.5 gauge needle | BD Bioscience | 305106 | |
| 5 CC syringe | BD Bioscience | 309603 | |
| 25 ml Erlenmeyer flask | Fischer | FB50025 | |
| Nylon mesh filter | Nitex | 03-150/38 | 150 μm pore size |
| 48 well tissue culture plate | Costar | 3548 | |
| 96 well tissue culture plate | Costar | 3795 | |
| 6 well tissue culture plate | Costar | 3506 | |
| Liquid nitrogen | Matheson Gas | 7727-37-9 | |
| Cytotoxicity assay kit | Promega | G1782 | |
| Adeno-GFP | N/A | N/A | Gift from J. Williams |
| Equipment | |||
| Ring stand with clamps | United Scientific | SET462 | |
| Perifusion chamber | N/A | N/A | Designed by S.Z.H and colleagues at Yale University |
| Vacuum line | Manostat | 72-100-000 | |
| Water bath with shaker | Precision Scientific | 51220076 | |
| Confocal microscope | Zeiss | LSM 710 | |
| BioTek Synergy H1 plate reader | BioTek | 11-120-534 | |
| Tissue culture hood | Nuaire | NU-425-600 | |
| Tissue culture Incubator | Thermo | 3110 |
References
- Toescu, E. C., Lawrie, A. M., Petersen, O. H., Gallacher, D. V. Spatial and temporal distribution of agonist-evoked cytoplasmic Ca2+ signals in exocrine acinar cells analysed by digital image microscopy. Embo J. 11, 1623-1629 (1992).
- Ito, K., Miyashita, Y., Kasai, H. Micromolar and submicromolar Ca2+ spikes regulating distinct cellular functions in pancreatic acinar cells. Embo J. 16, 242-251 (1997).
- Husain, S. Z., et al. The ryanodine receptor mediates early zymogen activation in pancreatitis. Proc. Natl. Acad. Sci. U.S.A. 102, 14386-14391 (2005).
- Raraty, M., et al. Calcium-dependent enzyme activation and vacuole formation in the apical granular region of pancreatic acinar cells. Proc. Natl. Acad. Sci. U.S.A. 97, 13126-13131 (2000).
- Orabi, A. I., et al. Dantrolene mitigates caerulein-induced pancreatitis in vivo in mice. Am. J. Physiol. Gastrointest. Liver Physiol. 299, G196-G204 (2009).
- Shah, A. U., et al. Protease Activation during in vivo Pancreatitis is Dependent upon Calcineurin Activation. Am. J. Physiol. Gastrointest. Liver Physiol. , (2009).
- Muili, K. A., et al. Pharmacologic and genetic inhibition of calcineurin protects against carbachol-induced pathologic zymogen activation and acinar cell injury. Am. J. Physiol. Gastrointest. Liver Physiol. , (2012).
- Orabi, A. I., et al. Ethanol enhances carbachol-induced protease activation and accelerates Ca2+ waves in isolated rat pancreatic acini. J. Biol. Chem. 286, 14090-14097 (2011).
- Nathanson, M. H., Padfield, P. J., O'Sullivan, A. J., Burgstahler, A. D., Jamieson, J. D. Mechanism of Ca2+ wave propagation in pancreatic acinar cells. J. Biol. Chem. 267, 18118-18121 (1992).
- Reed, A. M., et al. Low extracellular pH induces damage in the pancreatic acinar cell by enhancing calcium signaling. J. Biol. Chem. 286, 1919-1926 (2011).
- Amsterdam, A., Jamieson, J. D. Structural and functional characterization of isolated pancreatic exocrine cells. Proc. Natl. Acad. Sci. U.S.A. 69, 3028-3032 (1972).
- Van Acker, G. J., et al. Tumor progression locus-2 is a critical regulator of pancreatic and lung inflammation during acute pancreatitis. J. Biol. Chem. 282, 22140-22149 (2007).
- Ito, K., Miyashita, Y., Kasai, H. Kinetic control of multiple forms of Ca(2+) spikes by inositol trisphosphate in pancreatic acinar cells. J. Cell Biol. 146, 405-413 (1999).
- Leite, M. F., Burgstahler, A. D., Nathanson, M. H. Ca2+ waves require sequential activation of inositol trisphosphate receptors and ryanodine receptors in pancreatic acini. Gastroenterology. 122, 415-427 (2002).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46, 143-151 (2008).
- Schild, D., Jung, A., Schultens, H. A. Localization of calcium entry through calcium channels in olfactory receptor neurones using a laser scanning microscope and the calcium indicator dyes Fluo-3 and Fura-Red. Cell Calcium. 15, 341-348 (1994).
- Saluja, A. K., et al. Secretagogue-induced digestive enzyme activation and cell injury in rat pancreatic acini. Am. J. Physiol. 276, 835-842 (1999).
- Husain, S. Z., et al. Ryanodine receptors contribute to bile acid-induced pathological calcium signaling and pancreatitis in mice. Am. J. Physiol. Gastrointest. Liver Physiol. , (2012).
- Gurda, G. T., Guo, L., Lee, S. H., Molkentin, J. D., Williams, J. A. Cholecystokinin activates pancreatic calcineurin-NFAT signaling in vitro and in vivo. Mol. Biol. Cell. 19, 198-206 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved