JoVE Science Education
Biomedical Engineering
Vous avez un accès complet à ce contenu via
Nanyang Technological UniversitySimulations numériques de la dynamique des fluides du flux sanguin lors d'un anévrisme cérébral
Vue d'ensemble
Source: Joseph C. Muskat, Vitaliy L. Rayz, et Craig J. Goergen, Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
L'objectif de cette vidéo est de décrire les progrès récents des simulations de dynamique des fluides computationnels (CFD) basées sur la vascularisation spécifique au patient ou à l'animal. En l'espèce, des segmentations de navires en question ont été créées et, à l'aide d'une combinaison d'outils open source et commerciaux, une solution numérique à haute résolution a été déterminée dans un modèle d'écoulement. De nombreuses études ont démontré que les conditions hémodynamiques dans la vascularisation affectent le développement et la progression de l'athérosclérose, des anévrismes, et d'autres maladies périphériques d'artère ; en même temps, les mesures directes de la pression intraluminale, du stress de cisaillement de mur (WSS), et du temps de résidence de particule (PRT) sont difficiles à acquérir in vivo.
Le CFD permet d'évaluer ces variables de manière non invasive. En outre, le CFD est utilisé pour simuler des techniques chirurgicales, ce qui permet aux médecins de mieux faire preuve de prévoyance en ce qui concerne les conditions de débit postopératoire. Deux méthodes d'imagerie par résonance magnétique (IRM), d'angiographie par résonance magnétique (MRA) avec un temps de vol (TOF-MRA) ou un MRA amélioré par contraste (CE-MRA) et un contraste de phase (PC-MRI), nous permettent d'obtenir des géométries de navires et des champs de vitesse 3D résolus dans le temps. Respectivement. TOF-MRA est basé sur la suppression du signal à partir de tissu statique par des impulsions RF répétées qui sont appliquées sur le volume image. Un signal est obtenu à partir de spins insaturés se déplaçant dans le volume avec le sang qui coule. CE-MRA est une meilleure technique pour l'imagerie des navires avec des flux de recirculation complexes, car il utilise un agent de contraste, comme le gadolinium, pour augmenter le signal.
Séparément, PC-MRI utilise des gradients bipolaires pour générer des décalages de phase qui sont proportionnels à la vitesse d'un fluide, fournissant ainsi des distributions de vitesse résolues dans le temps. Tandis que PC-MRI est capable de fournir des vitesses de flux sanguin, la précision de cette méthode est affectée par la résolution spatiotemporal limitée et la gamme dynamique de vitesse. CFD fournit une résolution supérieure et peut évaluer la gamme de vitesses des jets à grande vitesse à la recirculation lente des tourbillons observés dans les vaisseaux sanguins malades. Ainsi, même si la fiabilité du CFD dépend des hypothèses de modélisation, elle ouvre la possibilité d'une représentation complète et de haute qualité des champs d'écoulement spécifiques aux patients, qui peuvent guider le diagnostic et le traitement.
Principles
TOF-MRA, CE-MRA et PC-MRI sont souvent utilisés comme géométrie d'entrée et conditions de limite d'écoulement pour les simulations CFD. Comme nous l'avons vu plus haut, la géométrie du navire et les conditions limites d'entrée (profils de vitesse à travers une section transversale) sont mesurées pour chaque sujet. Pour les données incluses dans cette étude, la résolution TOF-MRA était de 0,26 x 0,26 x 0,50 mm, tandis que la résolution PC-IRM était de 1,00 x 1,00 x 1,20 mm. La séquence d'IRM de flux 4D a été employée pour acquérir la distribution tridimensionnelle de vitesse par le cycle cardiaque. Les données TOF sont segmentées pseudo-automatiquement avec une variété d'outils. La résolution de l'image, c'est-à-à-d., la taille d'un voxel, influence directement la qualité du modèle résultant de la géométrie. L'IRM 4D Flow détermine  la vitesse du sang
la vitesse du sang  à chaque voxel en utilisant le décalage de phase selon les équations suivantes :
à chaque voxel en utilisant le décalage de phase selon les équations suivantes :
 (1)
(1)
 (2)
(2)
Les décalages de phase et  les vitesses mesurés dépendent du champ de gradient, du rapport
les vitesses mesurés dépendent du champ de gradient, du rapport  gyromagnétique, de la position initiale de la rotation,
gyromagnétique, de la position initiale de la rotation, 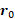 de la vitesse
de la vitesse  de rotation et de l'accélération
de rotation et de l'accélération 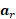 de spin. Les champs magnétiques et les constantes matérielles sont définis lors de l'irm. L'IRM 4D Flow code en trois directions orthogonales pour obtenir des champs de vitesse tridimensionnels. Ensuite, des modèles 3D pour chaque cas spécifique au patient ou à l'animal peuvent être générés. Les méthodes détaillées dans la section procédure nous amèneront à une simulation CFD en résolvant numériquement les équations Navier-Stokes, qui sont généralisées comme :
de spin. Les champs magnétiques et les constantes matérielles sont définis lors de l'irm. L'IRM 4D Flow code en trois directions orthogonales pour obtenir des champs de vitesse tridimensionnels. Ensuite, des modèles 3D pour chaque cas spécifique au patient ou à l'animal peuvent être générés. Les méthodes détaillées dans la section procédure nous amèneront à une simulation CFD en résolvant numériquement les équations Navier-Stokes, qui sont généralisées comme :
 (3)
(3)
où  est
est 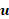 la densité, est la vitesse d'écoulement, p est la pression, et mu est la viscosité dynamique du flux.
la densité, est la vitesse d'écoulement, p est la pression, et mu est la viscosité dynamique du flux.
Procédure
Un précurseur du tutoriel est la création d'un modèle de vascularisation spécifique au patient. Dans cette démonstration, les outils Materialise Mimics, 3D Systems Geomagic Design X et Altair HyperMesh ont été utilisés pour générer un maillage de volume tétraèdre à partir de données MRA.
1. Générer des lignes maîtresses de navire pour le modèle
- Ouvrez le vmtk-lanceur python GUI. Dans le PypePad, tapez : vmtkcenterlines -ifile [fichier STL enregistré sur le bureau].stl -ofile [STL name]centerlines.vtp
- Sélectionnez Exécuter, Exécutez tous pour charger les données dans le programme. Une nouvelle fenêtre s'ouvrira qui affiche les instructions et le rendu du modèle d'entrée. Faites pivoter le modèle et placez le curseur sur chaque emplacement d'auto-lit. Appuyez sur la barre d'espace pour placer une graine.
- Après avoir placé des graines sur toutes les entrées, appuyez sur 'Q' pour continuer. Répétez le même placement de graines pour tous les points de vente. Après avoir placé les graines de sortie, appuyez à nouveau sur «Q» et laissez le programme s'exécuter. Cela enregistrera le fichier central sur le bureau.
2. Configuration des données dans le logiciel de visualisation
- Démarrer l'outil de visualisation open-source, ParaView (version 5.4.1 utilisé dans cette procédure).
- Sélectionnez Fichier, Ouvrez..., et localisez les fichiers précédemment créés : le maillage de volume spécifique au patient, le fichier central et le fichier EnSight.case(s). Après avoir cliqué sur Ok, toutes les données doivent être chargées dans l'interface.
- À partir de la table Propriétés en bas à gauche, sélectionnez Appliquer. Cette commande chargera et lira toutes les informations qu'un utilisateur a chargées ou modifiées dans ParaView. Mettez en évidence le maillage de volume en cliquant sur son nom dans le navigateur pipeline pour activer cette sélection.
- Encore une fois, dans la table Propriétés, faites défiler et modifiez la valeur Opacity à quelque part entre 0,2 - 0,5. Maintenant, les lignes maîtresses et les rendus géométriques doivent être visibles.
3. Remap 4D Flow IRM avec le maillage volumétrique-grille et supprimer le bruit
- Dans le menu du haut, sélectionnez Filtres, Alphabetical, ResampleWithDataset. Une nouvelle fenêtre s'ouvrira. Définir la source comme le maillage de volume et l'entrée comme fichier EnSight.case. Sélectionnez Ok une fois qu'ils sont réglés.
- Dans le tableau Propriétés, sélectionnez Appliquer pour appliquer le filtre.
- Comme auparavant, mettez en évidence le nouveau nom ResampleWithDatasetpour l'activer. Réduisez l'opacité de ce nouveau rendu comme mentionné précédemment. En outre, changez l'aleme central de Surface en Points dans le menu supérieur.
4. Déterminer les conditions de limite d'entrée et de débit de sortie
- Sur le côté droit de l'interface, à côté pour maximiser et minimiser les options de rendu, sélectionnez l'outil Create View (carré avec ligne verticale). Sélectionnez l'option SpreadSheet View.
- À partir de la case de dépôt de l'affichage, sélectionnez le fichier central (s). Un seul type de fichier peut être sélectionné à la fois. Parcourez les données en parcourant les données en sélectionnant différents points pour identifier un emplacement dans chaque entrée et sortie.
- Maintenant, utilisez la vue SpreadSheet sous les points pour calculer le vecteur normal entre deux points près des mêmes endroits trouvés dans (4.2).
- Après avoir trouvé le vecteur normal pour chaque emplacement d'aulet et de sortie, sélectionnez Filtres, Alphabetical, Slice. Assurez-vous d'activer le ResampleWithDatasetMD à l'avance.
- Le filtre Slice doit apparaître sous une nouvelle branche provenant de ResampleWithDataset. Dans la table Propriétés, définir l'origine du plan comme le même emplacement de point XYZ pour l'un des deux points utilisés pour calculer le vecteur normal. Utilisez le vecteur normal de (4.3) pour remplir les valeurs normales. Sélectionnez Appliquer.
- Mettez en surbrillance/activez le filtre SliceMD qui vient d'être créé, et sélectionnez Filtres, Alphabetical, Surface Flow, puis Appliquer. Activez le nouvel élément SurfaceFlowMD dans le navigateur pipelineet appliquez les filtres, alphabetiques,étapes du temps de groupe, appliquer.
- Dans SpreadSheet View, ouvrez les données GroupTimeStepsMD. Exportez ces données à Microsoft Excel par copier-coller ou utilisez Export Spreadsheet.
- Dans Excel, calculez les valeurs pondérées correspondant au rapport du débit à chaque prise par rapport au débit total des entrées. En raison du bruit inhérent et de l'erreur des données d'IRM 4D Flow, identifiez le plus petit navire (généralement ayant des données moins fiables) à laisser « ouvert » pour assurer la conservation de la masse.
- Dans le logiciel de simulation CFD, les formes d'ondes de flux transitoires sont importées à l'aide d'une commande de tables de lecture transitoire; par conséquent, enregistrez les données de flux d'entrée dans un format compatible, .txt décrit dans les tutoriels en ligne.
5. Mise en place de simulations CFD
- Logiciel de simulation CFD ouvert. Ici, nous utilisons ANSYS Fluent (version 18.1 décrite dans cette procédure comme par défaut). Choisissez Fichier, Lire, et Cas ..., et ouvrir le fichier maillage de volume .cas utilisé précédemment dans ParaView. Afficher le maillage (cette procédure utilise un fichier .cas généré avec Altair HyperMesh) en sélectionnant Display..., Display.
- Il est important d'augmenter la géométrie pour assurer la bonne taille physique du modèle. Sélectionnez Échelle ... et appliquer toute conversion d'unité est nécessaire pour le cas spécifique, puis Fermer.
- Sélectionnez Matériaux, Créer / Modifier pour entrer dans les propriétés matérielles pour le sang. Ce tutoriel utilise des valeurs physiologiquement pertinentes de 1060 kg/s et 0,0035 kg/ms pour la densité et la viscosité, respectivement.
- Définir les conditions transitoires de délimitation du débit en prescrivant des débits de masse ou des débits de vitesse en fonction du temps pour chaque entrée. Utilisez les formes d'onde obtenues à partir de la mesure 4D Flow MRI pour prescrire les conditions limites de l'entrée. Les points de vente sont donnés des valeurs pondérées trouvées dans (4.8).
- Under Solution, Methods, a établi les schémas numériques utilisés pour la discrètement spatiale et temporelle des équations Navier-Stokes. Pour cette procédure, utilisez Coupled, qui permet le couplage pleine pression-vitesse, Least Squares Cell Based (gradient), Second Order scheme for pressure, Third-Order MUSCL scheme for momentum equations, and Second Order Implicit scheme for discretization in time. Assurez-vous que le paramètre Temps en haut à gauche a été défini sur Transitoire.
- Sous solution, initialisation, sélectionnez Initialisation Standard. Avec toutes les valeurs initiales fixées à 0, sélectionnez Initialize. Maintenant, le programme est prêt à s'exécuter. Désignez un dossier de solution pour enregistrer des résultats chaque autosave Chaque (étapes de temps) sous les activités de calcul.
- Dans les dernières étapes, configurez la taille de l'étapetemporelle (s) sous le calcul del'exécution . Utilisez les données de l'état de limite Excel dans (4.7) pour déterminer cette valeur. La réduction de l'étape temporelle facilite la convergence et améliore la précision de la solution numérique, tout en augmentant le temps de solution. C'est une bonne pratique d'exécuter la simulation pendant au moins trois cycles cardiaques complets pour éliminer l'effet des transitoires initiaux.
- Enfin, définir Max Itérations pour chaque étape de temps entre 300 - 500. Le logiciel arrêtera automatiquement les itérations à chaque étape de temps une fois que la convergence est atteinte et procédera à l'étape de temps suivante. La convergence peut être améliorée en exécutant une simulation de débit régulier avec des valeurs de vitesse moyennes, puis en utilisant les résultats comme conditions initiales pour la simulation de flux pulsatile. Sélectionnez Calculer lorsqu'il est prêt à exécuter le solveur.
- Le logiciel exécutera chaque itération jusqu'à ce que la convergence soit réalisée ou que Max Itérations provoque la poursuite de l'itération. Les fichiers seront automatiquement enregistrés à partir de (5.5) et les données de la solution pourront être visualisées dans le logiciel ANSYS CFD-Post ou ParaView.
Résultats
Dans cette démonstration, un modèle spécifique d'un anévrisme cérébral a été généré et le CFD a été utilisé pour simuler le champ d'écoulement. En fournissant des caractéristiques de débit détaillées et en quantifiant les forces hémodynamiques qui ne sont pas obtenues à partir des données d'imagerie, le CFD peut être utilisé pour augmenter les données d'IRM 4D Flow à faible résolution. La figure 1 montre comment le CFD donne une description plus complète du flux dans les régions proches du mur et de la recirculation.
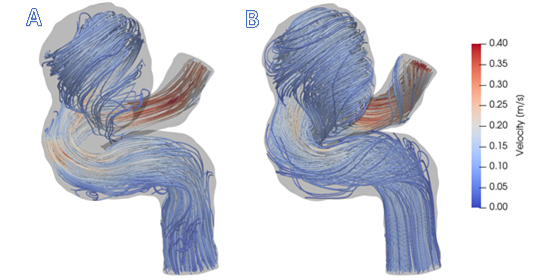
Figure 1: A) Visualisation des données IRM 4D Flow dans la géométrie du navire. B) Visualisation des résultats de simulation CFD. En général, cfd rationalise donner une meilleure compréhension des modèles de flux sanguin dans cet anévrisme cérébral.
La figure 1 montre que les résultats du CFD sont en accord avec l'IRM in vivo 4D Flow. La figure 1 (A) montre les schémas complexes et recirculants dans la région anévrismale, la dilatation en ballon de l'artère, qui ont été détectées avec l'IRM 4D Flow. Cependant, les régions de flux stagnant dans les sections supérieure et inférieure de la lésion ne sont pas remplies de rationalisations. C'est parce que le rapport signal/bruit dans ces régions est faible. Le débit simulé par le CFD, indiqué à la figure 1 (B), offre un champ de vitesse à plus haute résolution, particulièrement près des parois du navire. Ainsi, les modèles DECS sont capables de fournir des estimations plus précis des mesures cliniquement pertinentes et dérivées du flux, telles que la pression, le SSM et l'EPR, qui peuvent être utilisées pour prédire la progression de la maladie aneurysmale.
En outre, les simulations CFD peuvent être utilisées pour modéliser les conditions de débit postopératoire qui résulteraient d'options de traitement alternatives. Par exemple, la figure 2 (A) et (B) comparent le débit à travers le même navire avec des taux d'entrée différents. En prescrivant des conditions limites variées, telles que simuler l'occlusion de navire sans écoulement, le flux après une série de traitements chirurgicaux est montré.

Figure 2: A) Simulation pour la coupure chirurgicale de l'artère cérébrale antérieure droite (ACA). B) Simulation pour la coupure chirurgicale de l'ACA gauche. Pour plus de simplicité, ce chiffre maintient le taux d'entrée préopératoire à l'entrée non modifiée; en réalité, le débit augmenterait dans le navire ouvert pour compenser. C) Les taux normaux de circulation sanguine prescrivent les conditions d'entrée pour ce modèle. Les données des patients de l'IRM 4D Flow fournissent des conditions d'entrée pour une visualisation réaliste des modèles de débit.
La capacité de simuler les champs de flux postopératoires résultant de divers traitements chirurgicaux est un avantage important des modèles de CFD. En appliquant des géométries et des données d'entrée réalistes et spécifiques aux patients, différents scénarios de traitement peuvent être démontrés pour fournir aux médecins des informations sur l'effet d'une procédure planifiée sur les schémas de débit. Par exemple, la figure 2 (A) et (B) montrent les flux de recirculation qui se produiraient si l'une ou l'autre artère proximale était coupée. Des traitements tels que la coupure de navire ou le déploiement d'un déviateur d'écoulement peuvent être simulés, permettant aux médecins et aux patients de décider ce qui fonctionnera le mieux dans chaque cas spécifique.
Applications et Résumé
Le cadre décrit ici peut être utilisé pour effectuer des simulations CFD spécifiques aux patients. Un maillage haute résolution est utilisé pour interpoler les données d'IRM 4D Flow à basse résolution; cela isole les données de débit et minimise les erreurs associées au bruit extérieur à la paroi du navire. En utilisant des conditions limites basées sur le patient pour les flux d'entrées et de sorties, la simulation est capable de faire correspondre les conditions hémodynamiques imageavec l'IRM.
De nouvelles méthodes pour PC-MRI sont capables de montrer des gammes de vitesses plus grandes et dynamiques. Cependant, ceci est sévèrement limité par le temps de balayage patient. Souvent, les données des patients sont acquises à des résolutions inférieures pour réduire le temps passé dans le scanner. Malheureusement, cela peut entraîner soit des données alias ou une chute de signal, un problème exacerbé lorsque le gradient d'encodage de vitesse (VENC) est réglé trop haut. Cela peut manquer les données de flux lents et recirculant. Associer le flux et la géométrie spécifiques aux patients avec le CFD fournit une méthode efficace pour capturer la dynamique du flux sanguin à haute résolution.
Ce qui rend la modélisation basée sur le patient intrinsèquement utile est sa capacité à fournir des informations détaillées sans avoir besoin de généraliser entre les patients, les maladies ou les traitements qui possèdent généralement des caractéristiques très différentes. Les simulations permettent aux médecins et aux ingénieurs de modéliser d'autres scénarios de traitement avant d'effectuer une procédure réelle. La simulation de la dynamique du flux sanguin peut être utilisée pour modéliser les endoprothèses de détournement de débit, la greffe de pontage des artères et l'injection de contraste à base de cathéter, entre autres applications. Alors que les cliniciens et les patients souhaitent le meilleur résultat, CFD fournit une méthode pour regarder le flux postopératoire, qui fournit une meilleure prévoyance. En plus de représenter le flux après l'introduction d'un dispositif ou d'un traitement, CFD permet d'estimer les contraintes de cisaillement au mur. Ceci, jumelé avec la connaissance que le WSS bas corrèle souvent à la progression de la maladie artérielle, permet la prévision ou la modélisation de probabilité. L'utilisation d'outils informatiques pour identifier les précurseurs de la croissance de l'anévrisme, de la formation de caillots ou de l'hémorragie ouvre la possibilité d'identifier plus tôt les patients à risque. En résumé, la combinaison de données d'image spécifiques aux patients avec des simulations CFD est un outil puissant pour l'évaluation de la maladie et la prédiction chirurgicale.
Remerciements
Les auteurs tenons à remercier la Dre Susanne Schnell et Michael Markl de l'Université Northwestern de nous avoir fourni les données sur les patients en 4D utilisées dans nos chiffres.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Simulations numériques de la dynamique des fluides du flux sanguin lors d'un anévrisme cérébral
Biomedical Engineering
11.9K Vues

Imagerie d'échantillons biologiques par microscopie optique et confocale
Biomedical Engineering
36.2K Vues

Imagerie d'échantillons biologiques par MEB
Biomedical Engineering
24.0K Vues

Biodistribution des nanomédicaments : Application de la microscopie à balayage électronique
Biomedical Engineering
9.5K Vues

Imagerie par ultrasons à haute fréquence de l'aorte abdominale
Biomedical Engineering
14.8K Vues

Cartographie quantitative de la déformation d'un anévrisme de l'aorte abdominale
Biomedical Engineering
4.6K Vues

Tomographie photoacoustique pour l'imagerie du sang et des lipides dans l'aorte infrarénale
Biomedical Engineering
5.9K Vues

Imagerie par résonance magnétique cardiaque
Biomedical Engineering
15.0K Vues

Imagerie des anévrismes de l'aorte abdominale par fluorescence dans le proche infrarouge
Biomedical Engineering
8.4K Vues

Techniques de mesure non invasive de la pression artérielle
Biomedical Engineering
12.1K Vues

Acquisition et analyse d'un signal ECG (électrocardiographie)
Biomedical Engineering
106.7K Vues

Résistance à la traction des biomatériaux résorbables
Biomedical Engineering
7.5K Vues

Imagerie Micro-CT de la moelle épinière d'une souris
Biomedical Engineering
8.3K Vues

Visualisation de la dégénérescence de l'articulation du genou après une blessure non invasive du LCA chez le rat
Biomedical Engineering
8.3K Vues

Imagerie combinée SPECT et CT pour visualiser la fonctionnalité cardiaque
Biomedical Engineering
11.2K Vues
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.