Titrage du n-butyllithium
Vue d'ensemble
Source : Vy M. Dong et Le Diane, Department of Chemistry, University of California, Irvine, CA
Cette expérience démontrera une technique simple pour titrer et obtenir une concentration exacte de la réactifs organolithiens, n- butyllithium (n- BuLi). Réactifs organolithiens sont extrêmement sensibles au air et l’humidité et des soins appropriés doivent être prises pour maintenir la qualité du réactif de sorte qu’il peut être utilisé avec succès dans une réaction. Le n- BuLi expériences de titrage doivent être effectuées régulièrement pour obtenir des concentrations exactes à utiliser dans une réaction chimique. Par la suite, nous allons démontrer l’ajout du titré n- BuLi de benzaldéhyde.
Principles
Réactifs organolithiens sont des composés contenant une liaison C−Li et sont des bases très fortes. Parce que les organolithiums sont extrêmement air - et sensibles à l’humidité, bon il faut gérer ces réactifs. Ils sont sensibles aux acides, produits corrosifs et souvent pyrophoriques. n- BuLi, un alkyllithium, est généralement stocké à basse température (inférieure à 0 ° C) et stockée sous forme d’une solution dans les hydrocarbures tels que hexanes. N- BuLi peut être utilisé comme une base ou un nucléophile en fonction des conditions de réaction. En outre, il peut être utilisé dans les réactions d’échange lithium-halogène pour générer des réactifs au lithium d’aryle ou de vinyle, qui peuvent réagir avec un électrophile. En outre, n- BuLi est couramment utilisé comme l’initiateur de la polymérisation de diènes utilisés dans les élastomères.
Titrage est une technique analytique quantitative courante utilisée pour déterminer une concentration inconnue d’un analyte en ajoutant une concentration connue d’une solution titrante jusqu'à ce que la réaction atteint achèvement, ce qui est indiqué par un changement de couleur. Dans cette expérience, nous démontrera le titrage du n -BuLi et calculer sa concentration avec l’acide diphénylacétique comme la solution titrante, est une écurie solide et peut être facilement taré. Par réaction du n- BuLi avec de l’acide diphénylacétique, la solution tourne une couleur jaune foncé à la fin du titrage, et donc un indicateur n’est pas nécessaire (Figure 1). En mesurant le volume précis de n- BuLi utilisé pour consommer de l’acide diphénylacétique, nous pouvons calculer la molarité de la réaction. Cette expérience doit être répétée trois fois pour obtenir une mesure moyenne.

Figure 1. Réaction de n- BuLi avec de l’acide diphénylacétique.
Procédure
1. préparation de la solution titrante
- Un ballon à fond rond séché flamme équipé d’un bar de remuer sous N2, ajouter l’acide diphénylacétique (250 mg, 1.18 mmol) et THF anhydre (5 mL).
2. titrage du n- BuLi
- Calculer le montant approximatif du n- BuLi solution (en hexanes) nécessaire de consommer de l’acide diphénylacétique. À l’aide d’une seringue, ajoutez lentementune solution de n- BuLi goutte à goutte. Le mélange réactionnel sera temporairement jaunissent et retour à une solution incolore à chaque chute.
- Continuez à ajouter la solution de n- BuLi goutte à goutte jusqu'à ce que le mélange réactionnel continue à rester une couleur jaune foncé. Ce sera le point final de la réaction.
- Répéter le titrage 3 x pour obtenir un volume moyen du n- BuLi utilisé.
3. calcul de molarité
- Les taupes du n- BuLi utilisée dans le titrage sont équivalentes aux moles d’acide diphénylacétique utilisé dans la réaction. Depuis les taupes de diphénylacétique l’acide utilisé est connu, le calcul de la concentration de n- BuLi est donnée par l’équation suivante : mmol diphénylacétique acide/mL n- BuLi = molarité de la solution de n- BuLi.
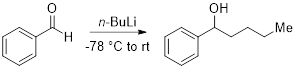
4. Ajout du n- BuLi de benzaldéhyde (Figure 2)
- Ajouter à un ballon à fond rond séché flamme équipé d’un bar de remuer sous N2, THF anhydre (30 mL) et le benzaldéhyde (3 mmol, 1 équiv.). Refroidir la solution à −78 ° C.
- Ajouter n- BuLi (1.1 équiv.) et laisser la réaction à chaude à la température ambiante.
- Ajouter saturés NH4Cl (AQ., 10 mL) pour étancher la réaction et en extraire la phase aqueuse à l’éther éthylique (2 x 25 mL).
- Laver les couches organiques combinés (2 x 15 mL) d’eau additionnée de saumure (1 x 20 mL).
- Sécher avec Na2donc4, filtrer et concentrer les couches organiques combinés sous réduit la pression de payer le produit.
La figure 2. Ajout du n - BuLi de benzaldéhyde.
Résultats
Les résultats représentatifs pour le titrage du n- BuLi pour les procédures de 1-3
| Étape de la procédure | Couleur du mélange réactionnel |
| 1.1 | Incolore |
| 2.1 | Jaune, puis incolore |
| 2.2 | Jaune foncé |
| 3.1 | 1.18 mmol diphénylacétique acide/1 mL n- BuLi = 1,18 M n- BuLi dans hexanes |
Tableau 1. Les résultats représentatifs pour procédures 1–3.
Applications et Résumé
Dans cette expérience, nous avons démontré comment déterminer la concentration d’une solution de n- BuLi en utilisant de l’acide diphénylacétique. Nous avons également réalisé une réaction en ajoutant n- BuLi de benzaldéhyde.
Les concentrations exactes du n- BuLi sont importantes pour son application réussie dans un certain nombre de réactions. n- BuLi est couramment utilisé dans les réactions d’échange lithium-halogène pour préparer des réactifs aryllithium ou vinyllithium, qui peuvent être ensuite utilisés dans la liaison C-C réactions de formation. En outre, il peut être utilisé comme une base ou un nucléophile, suivant les conditions réactionnelles.
Passer à...
Vidéos de cette collection:

Now Playing
Titrage du n-butyllithium
Organic Chemistry II
47.7K Vues

Nettoyage de la verrerie
Organic Chemistry II
123.5K Vues

Substitution nucléophile
Organic Chemistry II
99.5K Vues

Agents reducteurs
Organic Chemistry II
43.0K Vues

Réaction de Grignard
Organic Chemistry II
149.0K Vues

Appareil de Dean-Stark
Organic Chemistry II
100.2K Vues

Ozonolyse des alcènes
Organic Chemistry II
67.0K Vues

Organocatalyse
Organic Chemistry II
16.6K Vues

Réaction de couplage catalysé au palladium
Organic Chemistry II
34.3K Vues

Synthèse en phase solide
Organic Chemistry II
41.0K Vues

Hydrogénation
Organic Chemistry II
49.6K Vues

Polymérisation
Organic Chemistry II
93.8K Vues

Point de fusion
Organic Chemistry II
149.8K Vues

Spectroscopie infrarouge
Organic Chemistry II
214.6K Vues

Polarimètre
Organic Chemistry II
99.9K Vues