Method Article
Modèle préclinique d’exposition prénatale au delta-9-tétrahydrocannabinol pour évaluer son impact sur les résultats neurodéveloppementaux
Dans cet article
Résumé
À mesure que les restrictions législatives changent, entraînant une accessibilité accrue des produits cannabinoïdes, il est extrêmement important de développer des modèles pour étudier l’impact de ces expositions, en particulier pendant la grossesse. Un modèle préclinique d’exposition prénatale modérée aux cannabinoïdes par ingestion volontaire a été développé, permettant des investigations plus approfondies.
Résumé
L’exposition prénatale aux cannabinoïdes (PCE) est de plus en plus fréquente alors que de plus en plus d’États des États-Unis légalisent la marijuana récréative (cannabinoïdes). La consommation de produits cannabinoïdes pendant la grossesse a été associée à divers résultats anormaux, bien que des études historiques aient été menées à une époque où la puissance de ces produits était environ 300 % inférieure à celle des produits actuels. Compte tenu de l’utilisation croissante des cannabinoïdes, il est essentiel de comprendre les impacts potentiels que la PCE peut avoir sur le développement neurologique du fœtus et le développement ultérieur du nourrisson et de l’enfant. Des études antérieures ont démontré que le PCE affecte négativement l’apprentissage et la mémoire, les compétences comportementales, le sommeil et l’attention chez la progéniture. L’objectif de cette étude est de récapituler l’ECP par l’ingestion volontaire de delta-9-tétrahydrocannabinol (THC), le composant psychoactif des produits cannabinoïdes, pendant la grossesse dans un modèle préclinique. Cet article décrit la procédure à suivre pour obtenir une ECP modérée tout au long de la gestation. Dans ce modèle, le groupe témoin consomme des mini-biscuits au chocolat/beurre de cacahuète nature, tandis que le groupe PCE consomme du THC mélangé à du beurre de cacahuète associé à des mini-biscuits au chocolat. Cette approche permet d’approfondir l’étude de l’impact de l’ECP sur les résultats de développement.
Introduction
Alors que les taux d’utilisation prénatale de produits cannabinoïdes augmentent, probablement influencés par la légalisation croissante des produits cannabinoïdes aux États-Unis, des études sont nécessaires pour mieux comprendre leur impact sur le développement fœtal. Le delta-9-tétrahydrocannabinol (THC), le composant psychoactif des produits cannabinoïdes, traverse facilement le placenta et interagit avec le système endocannabinoïdeendogène 2,3. Le système endocannabinoïde endogène joue un rôle essentiel dans le développement neuronal et peut être une voie par laquelle des altérations du développement se produisent. L’utilisation de cannabinoïdes pendant la grossesse a été associée à une réduction du poids à la naissance4 et à un risque accru de naissance prématurée 5,6. D’autres anomalies du développement, telles que des déficits dans le comportement social et les fonctions exécutives tout au long de la vie, ont également été signalées 7,8,9.
Au fil du temps, l’évolution de la puissance des cannabinoïdes et des modes de consommation dans la population générale a mis en évidence la nécessité d’études détaillées sur les effets potentiels de l’exposition prénatale sur le développement fœtal. L’utilisation de produits cannabinoïdes pendant la grossesse augmente, car ces produits sont souvent perçus comme atténuant des symptômes tels que la dépression, le stress, la douleur, les troubles du sommeil et les nausées10,11. Dickson et coll.12 ont mené une étude portant sur les recommandations de 400 dispensaires de cannabis concernant la consommation au cours du premier trimestre au Colorado et ont constaté qu’environ la moitié des dispensaires (50,5 %) recommandaient des produits comestibles aux personnes enceintes. On pense souvent que les produits comestibles évitent les méfaits et les risques pour la santé associés au tabagisme13,14, ce qui amène de nombreuses personnes enceintes à consommer des produits comestibles.
Les produits comestibles délivrent des cannabinoïdes par le biais du système gastro-intestinal, où le THC est absorbé dans la circulation sanguine et transporté via la veine porte vers le foie pour un métabolisme de premier passage. Dans le foie, les enzymes hydroxylent le THC pour produire du 11-hydroxytétrahydrocannabinol (11-OH-THC), un métabolite psychoactif très puissant qui traverse facilement la barrière hémato-encéphalique15. Bien qu’il faille plus de temps pour que l’effet psychoactif initial des produits comestibles soit plus long (30 à 90 min), le « high » qui en résulte dure plus longtemps, avec un pic 2 à 4 h après l’ingestion16,17. La demi-vie pharmacocinétique du THC est de 1,3 à 7,3 h chez le rat18,19.
Compte tenu de l’utilisation croissante pendant la grossesse et du manque de données sur son impact sur le neurodéveloppement fœtal, un modèle préclinique d’ingestion volontaire de THC pendant la grossesse a été développé, s’alignant plus étroitement sur l’utilisation humaine typique rapportée (consommation orale pour soulager les nausées) afin de décrire plus en détail l’impact sur les résultats neurodéveloppementaux.
Protocole
Toutes les procédures décrites ici ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux (IACUC) du Centre des sciences de la santé de l’Université du Nouveau-Mexique (UNM HSC). Toutes les expériences ont été menées dans le respect des directives ARRIVE. Des rats Long-Evans (Blue Spruce, HsdBlu : LE) ont été obtenus à partir d’une source commerciale. Les mâles utilisés étaient des rats reproducteurs adultes avérés, âgés de 12 semaines à l’arrivée et de 15-16 semaines au début du protocole de reproduction. Les femelles pesaient de 125 à 150 g et étaient âgées d’environ 6 à 7 semaines à leur arrivée. Au moment de la reproduction, les femelles étaient âgées d’environ 9 à 10 semaines. Il est essentiel de s’assurer que toutes les mères potentielles n’ont pas d’antécédents de gestation. Prévoyez au moins une semaine pour vous acclimater à l’installation et à leur nouvel environnement de logement. La première partie de ce protocole aborde la consommation de cannabinoïdes avant la grossesse, tandis que la deuxième partie se concentre sur l’exposition aux cannabinoïdes pendant la grossesse. Les détails des animaux, des réactifs et de l’équipement utilisés sont fournis dans la table des matériaux. Le plan expérimental est présenté à la figure 1.
1. Exposition aux cannabinoïdes avant la grossesse
- Logement et entretien
- Hébergez les animaux individuellement dans des cages de micro-isolement statiques standard pour rats avec une litière à 22 °C selon un horaire inversé de 12 heures (lumières allumées de 21h00 à 09h00 tous les jours).
- Fournir un accès à des aliments irradiés (voir la table des matières) et à de l’eau du robinet à volonté tout au long de l’étude.
- Préparation des matériaux et des produits chimiques
- Procurez-vous tous les matériaux et produits chimiques requis (tels qu’ils sont fournis dans la table des matériaux).
- Conservez du THC de qualité recherche dans des flacons contenant 10 mg/mL ou 20 mg/mL de THC dissous dans de l’éthanol.
REMARQUE : Utilisez un équipement de protection individuelle (EPI) approprié, car le THC est un irritant cutané et un risque d’aspiration. Placez le THC dans une armoire en acier, car il est classé comme une substance contrôlée de l’annexe I par le ministère américain de la Santé et des Services sociaux et la Food and Drug Administration des États-Unis.
- Mesures de référence
- Obtenez le poids corporel de référence pour chaque rat femelle.
- Faites une pause dans l’expérience pendant 1 à 2 semaines si nécessaire.
- Préparation des biscuits infusés au THC
- Préparez les biscuits 30 minutes avant l’administration à 14h00 tous les jours pour maintenir des heures de repas constantes.
- Séparez les mini biscuits au chocolat et ajoutez environ une demi-cuillère à café de beurre de cacahuète à la crème.
- Mélangez la dose requise de THC (1,5 mg/kg pendant les 2 premiers jours, suivi de 3 mg/kg pendant 7 jours) avec le beurre de cacahuète avant d’assembler le biscuit.
- Évaluation de la consommation
- Fournissez un biscuit nature au beurre de cacahuète / mini au chocolat pendant 2 à 4 jours jusqu’à ce qu’une consommation constante soit atteinte. Retirez l’eau de la cage et administrez la friandise à chaque rat à l’aide d’une pince à 14h00 tous les jours.
- Observez jusqu’à ce que la friandise soit complètement consommée. Retirez les restes si nécessaire.
REMARQUE : Administrer le THC à une dose de 1,5 mg / kg pendant 2 jours, suivie de 3 mg / kg pendant 7 jours. Laissez les friandises dans la cage jusqu’à 2 h pour les rats qui ne consomment pas immédiatement. - Continuez uniquement avec des rats qui présentent une consommation constante de friandises. Retirez de l’expérience ceux dont l’ingestion est irrégulière.
- Évaluez la consommation avant la grossesse pendant 2 semaines.
- Affectation de groupe post-ECP
- Attribuez au hasard les rats avec une ingestion constante au groupe de biscuits nature (contrôle) ou infusé au THC (PCE).
- Prévoyez un minimum de 4 jours sans cookies avant la reproduction pour assurer l’élimination du THC de leur système.
2. Exposition aux cannabinoïdes pendant la grossesse (prénatale)
- Reproduction et confirmation de gestation
- Pesez les femelles pour obtenir un poids de départ avant de les placer dans une cage avec un éleveur mâle éprouvé (le mâle n’a jamais de THC).
- Assurez-vous que les rats femelles ne consomment pas de biscuit pendant ce temps.
- Confirmez la grossesse par la présence d’un bouchon vaginal, ce qui se produit généralement 24 heures après l’accouplement.
- Pesez le rat femelle et remettez-le dans la cage de la maison. C’est ce qu’on appelle le jour de gestation (JG) 1.
- Infusion de THC pendant la grossesse
- Fournir un biscuit nature ou infusé au THC (3 mg/kg) à 14h00 tous les jours à partir du JG 1 pour la durée de la grossesse.
- Continuez ce régime jusqu’à ce que la mère soit en train de nicher, après quoi l’exposition au THC est arrêtée.
- Suivi de la prise de poids maternelle
- Pesez les mères de rats deux fois par semaine pour évaluer la prise de poids maternelle.
REMARQUE : Les nouveaux poids sont également utilisés pour calculer la quantité de THC à inclure dans le biscuit, en ajustant la dose si nécessaire en fonction du poids de la mère.
- Pesez les mères de rats deux fois par semaine pour évaluer la prise de poids maternelle.
- Cessation de l’exposition au THC et documentation de naissance
- Arrêtez les procédures d’exposition au THC lorsque le barrage est en train de nicher au moment prévu de la livraison.
- Une fois que la progéniture est née, notez le nombre de petits vivants.
- Désigner le jour de l’accouchement comme jour postnatal (P) 0.
- Sevrage et hébergement de la progéniture
- Sevrer la progéniture au jour postnatal (P) 23.
- Le groupe héberge la progéniture sevrée avec des compagnons de portée en fonction du sexe.
- Euthanasie des barrages
- Une fois la portée sevrée, euthanasier les mères en suivant les protocoles approuvés par l’établissement.
3. Étapes post-procédurales
- Hébergement et surveillance de la progéniture
- Assurez-vous que toute la progéniture est maintenue dans des conditions de logement appropriées, en assurant une température, une lumière et une ventilation appropriées.
- Surveillez régulièrement les chiots pour détecter tout problème de santé ou de développement, tel qu’un poids corporel anormal ou des retards de développement.
- Évaluation de référence
- Si nécessaire, évaluez les mesures de base telles que le poids corporel, les réflexes ou d’autres paramètres de développement pertinents avant d’entreprendre des expériences sur la progéniture.
- Affectation expérimentale en groupe
- Attribuez les petits à des groupes expérimentaux au hasard afin de minimiser les biais dans les tests.
- Limitez le nombre de petits utilisés par expérience à 1 ou 2 petits de chaque portée afin de réduire les effets potentiels sur la portée.
Résultats
Pour établir la consommation volontaire de THC, de nombreuses friandises ont été testées pour déterminer celles qui étaient appétissantes pour les rats et qui seraient consommées rapidement et régulièrement.
Initialement, des cubes de gélatine sans sucre aromatisés à la fraise (format 1 mL), avec et sans THC, ont été testés. La quantité d’arôme de sirop de fraise a été augmentée et le THC a été testé à trois concentrations différentes (2 mg/kg/dose, 3 mg/kg/dose et 5 mg/kg/dose). Les rats ne consommaient pas systématiquement les cubes et arrêtaient rapidement de consommer aux concentrations de THC les plus élevées. On sait que les rats peuvent refuser les aliments au goût amer ou acide, ce qui a soulevé des inquiétudes quant au fait que ce modèle pourrait ne pas être viable pour une consommation volontaire.
Après consultation avec le vétérinaire de l’établissement, diverses autres friandises ont été testées, notamment des craquelins au beurre de cacahuète ou au fromage, des mini biscuits au chocolat au beurre de cacahuète, des craquelins au fromage au beurre de cacahuète et des craquelins en forme de poisson au fromage, tous obtenus d’Amazon. Les rats femelles consommaient systématiquement les mini biscuits au chocolat avec du beurre de cacahuète, souvent dans les 10 à 30 minutes suivant l’offre de la friandise. Du THC a ensuite été ajouté aux mini-biscuits au chocolat avec du beurre de cacahuète, et le pourcentage de mères qui ont consommé la friandise quotidienne était similaire entre les groupes témoins et exposés au THC (67 % contre 62 %, respectivement ; p = 0,14).
Les mères ont ensuite été exposées au THC comme décrit dans le protocole, avec une exposition aux cannabinoïdes avant la grossesse et prénatale. Les mères ont été randomisées dans le groupe témoin ou le groupe PCE (exposition au THC à 3 mg/kg/dose) avant la reproduction. La taille de la portée et le gain de poids maternel étaient similaires entre les groupes. Le taux de mortalité (pourcentage de décès de la naissance à P2) et le poids à la naissance approchaient de la signification entre les témoins et l’ECP (0 % contre 0,04 %, p = 0,06 et 6,25 g contre 5,96 g, p = 0,07, respectivement ). Le taux de mortalité a eu tendance à augmenter dans le groupe PCE, et le poids à la naissance de la progéniture a eu tendance à diminuer dans le groupe PCE (tableau 1 et figure 2), ce qui est cohérent avec la littérature humaine20.
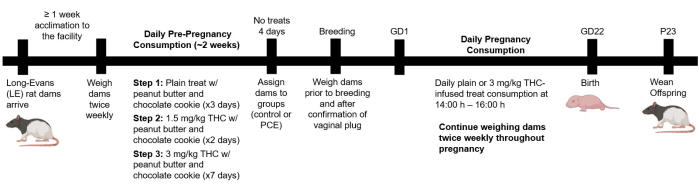
Figure 1 : Conception expérimentale. Les mères ont volontairement ingéré quotidiennement des biscuits infusés au THC avant la reproduction pour assurer un apport constant. Les barrages qui ne consommaient pas les biscuits ont été exclus de l’expérience. Les mères restantes ont été randomisées pour consommer un biscuit nature ou infusé de THC (3 mg/kg) pendant la grossesse. La naissance s’est déroulée normalement et les petits ont été sevrés le jour postnatal (P) 23. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Représentation graphique des caractéristiques de la mère et de la progéniture pour le modèle PCE. Cette figure fournit une représentation graphique des caractéristiques de la mère et de la progéniture dans le modèle PCE. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Trompe-l’œil (n = 6 barrages) | PCE (n = 4 barrages) | p Valeur* | |
| Prise de poids maternelle (g) | 107.00 ± 6.83 | 94.25 ± 10.03 | 0.48 |
| Taille de la portée (nombre de petits vivants/portée) | 10.83 ± 1.31 | 12.75 ± 0.74 | 0.22 |
| Taux de mortalité ( % de décès de la naissance à P2) | 0,00 ± 0,00 | 0,04 ± 0,02 | 0.06 |
| Poids de naissance de la progéniture (g) | 6,25 ± 0,11 | 5,96 ± 0,10 | 0.07 |
| Poids de la progéniture au jour postnatal 21 (g) | 41,31 ± 1,40 | 37,61 ± 2,22 | 0.17 |
| *La valeur p a été calculée à l’aide du test t d’un élève | |||
Tableau 1 : Caractéristiques de la mère et de la progéniture pour le modèle PCE. Le gain de poids maternel au 22e jour de gestation (JG) a été mesuré comme l’augmentation du poids corporel en grammes et n’était pas significativement différent entre les groupes (p = 0,48). Le tableau comprend également la taille moyenne des portées, le taux de mortalité (pourcentage de décès de la naissance à P2), le poids de la progéniture à la naissance par portée et le poids à P21. Toutes les données sont indiquées sous la forme de la valeur moyenne ± de l’erreur type de la moyenne (SEM) ; *Les valeurs p ont été calculées à l’aide d’un test t de Student.
Discussion
Le paradigme PCE décrit ici implique la consommation volontaire de THC par des mères de rats gravides. Il s’agit de la première étude à explorer l’administration de THC à des mères de rats gravides par ingestion volontaire dans un modèle préclinique. Les deux groupes de mères de rats ont consommé le même régime alimentaire pour rats, minimisant ainsi la variabilité potentielle de la nutrition et de l’apport calorique entre les groupes. Les modèles animaux offrent l’avantage de contrôler le moment et le dosage du PCE à des fins d’étude.
La consommation avant la grossesse est évaluée afin d’identifier les rats qui consomment du THC aux niveaux souhaités pour les phases ultérieures du protocole de consommation. Cette approche garantit que toutes les rates femelles ont une expérience préalable de l’ingestion de THC avant la grossesse, reflétant plus précisément le comportement humain5, où les individus utilisent souvent du THC avant la grossesse. Dans ce modèle, l’ECP se produit tout au long du développement gestationnel, ce qui correspond à peu près aux deux premiers trimestres de la gestation humaine. Les preuves suggèrent que la consommation de cannabinoïdes est plus fréquente au cours du premier trimestre, diminue au cours du deuxième et diminue encore au cours du troisième1.
Les récepteurs endocannabinoïdes ne sont pas exprimés chez le fœtus avant 5-6 semaines de gestation21. L’exposition avant cette période peut ne pas influencer directement le développement du cerveau fœtal, bien que des effets indirects par l’expression des récepteurs endocannabinoïdes dans le placenta soient toujourspossibles22. Par conséquent, les chercheurs qui se concentrent sur les résultats neurodéveloppementaux devront tenir compte du moment de l’exposition par rapport aux résultats spécifiques d’intérêt.
Une étape critique du protocole est la capacité de mesurer fréquemment les niveaux de THC pour s’assurer que la consommation atteint les niveaux sériques cibles. Des expériences en cours mesurent les taux sériques tout au long de la grossesse pour s’assurer qu’un niveau stable peut être maintenu malgré les changements métaboliques qui se produisent pendant la grossesse.
Nous avons envisagé d’autres techniques d’administration orale, telles que le gavage oral. Cependant, l’objectif de ce modèle est de rester aussi pertinent que possible sur le plan clinique. L’administration par gavage peut induire un stress important chez les rats, entraînant une augmentation de la pression artérielle, des taux élevés de corticostérone plasmatique et d’autres effets indésirables23,24. Ainsi, nous avons choisi l’ingestion volontaire pour minimiser les effets secondaires involontaires.
Les limites de cette étude incluent la nécessité d’assurer une consommation régulière et la nécessité de faire preuve de prudence lors de la préparation des friandises, car des inexactitudes dans le dosage du THC pendant la préparation pourraient affecter les résultats. Bien que le métabolisme puisse différer d’un rat à l’autre, il s’agit également d’une force compte tenu du désir de corrélation clinique.
Dans l’ensemble, un modèle préclinique d’ingestion volontaire pour produire une exposition modérée au THC est réalisable. L’élaboration de ce modèle permettra d’approfondir les études sur les résultats neurodéveloppementaux, ainsi que sur d’autres domaines d’intérêt. Les études futures contribueront à la littérature croissante concernant l’impact de l’ECP sur le développement fœtal.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Merci au programme d’approvisionnement en drogues du National Institute on Drug Abuse (NIDA) pour l’approvisionnement généreux en THC. Soutenu par la subvention du comité d’allocation de la recherche du département de pédiatrie de l’Université du Nouveau-Mexique et la division de néonatologie.
matériels
| Name | Company | Catalog Number | Comments |
| 5L0D PicoLab Laboratory Rodent Diet, irradiated | Purina LabDiet | 5L0D | |
| Cellulose/paper bedding BioFresh Comfort Bedding | BioFresh Vet | NA | https://biofreshvet.com/products/ |
| Digital Kitchen Scale | Etekcity | EK4150 | |
| Female rats, 125-150 g | Inotiv | 14005F | |
| Long-Evans rats (Blue Spruce, HsdBlu: LE) | Inotiv | 14016M | |
| N10 Rodent Plastic Cage Bottoms | Ancare | N10PLF | |
| N10 Rodent Wire Lids | Ancare | N10SS | |
| Narrow Pattern Forceps | Fine Science tools (FST) | 11002-14 | |
| OREO mini chocolate Sandwich cookies, Go Paks, 12-3.5 oz cups | Amazon | B0198TUO7W | |
| proven adult breeder males | Inotiv | 14016M | |
| Rat static polysulfone microisolator cages (R20): | |||
| Research Grade THC (only available with a DEA license, Schedule I drug) | NIDA | NA | https://nida.nih.gov/research/research-data-measures-resources/nida-drug-supply-program |
| SKIPPY Creamy Peanut Butter spread | Amazon | B0C75KZ28C | |
| THC Consumption Supplies: |
Références
- Volkow, N. D., Han, B., Compton, W. M., McCance-Katz, E. F. Self-reported medical and nonmedical cannabis use among pregnant women in the United States. JAMA. 322 (2), 167-169 (2019).
- de Salas-Quiroga, A., et al. Prenatal exposure to cannabinoids evokes long-lasting functional alterations by targeting CB1 receptors on developing cortical neurons. Proc Natl Acad Sci USA. 112 (44), 13693-13698 (2015).
- Baglot, S. L., et al. Maternal-fetal transmission of delta-9-tetrahydrocannabinol (THC) and its metabolites following inhalation and injection exposure during pregnancy in rats. J Neurosci Res. 100 (3), 713-730 (2022).
- Ryan, S. A., Ammerman, S. D., O'Connor, M. E. Committee on Substance Use and Prevention; Section on Breastfeeding. Marijuana use during pregnancy and breastfeeding: implications for neonatal and childhood outcomes. Pediatrics. 142 (3), e20181889 (2018).
- Corsi, D. J., et al. Association between self-reported prenatal cannabis use and maternal, perinatal, and neonatal outcomes. JAMA. 322 (2), 145-152 (2019).
- Duko, B., Dachew, B. A., Pereira, G., Alati, R. The effect of prenatal cannabis exposure on offspring preterm birth: a cumulative meta-analysis. Addiction. 118 (4), 607-619 (2023).
- Scheyer, A. F., Melis, M., Trezza, V., Manzoni, O. J. J. Trends in Neurosciences. Trends Neurosci. 42 (12), 871-884 (2019).
- Nashed, M. G., Hardy, D. B., Laviolette, S. R. Prenatal Cannabinoid Exposure: Emerging Evidence of Physiological and Neuropsychiatric Abnormalities. Front Psychiatry. 11, 624275 (2021).
- Lin, A., et al. Prenatal cannabinoid exposure: why expecting individuals should take a pregnancy pause from using cannabinoid products. Front Pediatr. 11, 1278227 (2023).
- Chang, J. C., et al. Beliefs and attitudes regarding prenatal marijuana use: perspectives of pregnant women who report use. Drug Alcohol Depend. 196, 14-20 (2019).
- Young-Wolff, K. C., et al. Trends in cannabis polysubstance use during early pregnancy among patients in a large health care system in Northern California. JAMA Netw Open. 5 (6), e2215418 (2022).
- Dickson, B., et al. Recommendations from cannabis dispensaries about first-trimester cannabis use. Obstet Gynecol. 131 (6), 1031-1038 (2018).
- Murphy, F., et al. Baby boomers and cannabis delivery systems. J Drug Issues. 45 (3), 293-313 (2015).
- Barrus, D. G., et al. Tasty THC: Promises and challenges of cannabis edibles. Methods Rep, RTI Press. , 1-22 (2016).
- Mura, P., Kintz, P., Dumestre, V., Raul, S., Hauet, T. THC can be detected in brain while absent in blood. J Anal Toxicol. 29 (8), 842-843 (2005).
- Grotenhermen, F. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacol Ther. 42 (4), 327-360 (2003).
- Thompson, R., DeJong, K., Lo, J. Marijuana Use in Pregnancy: A Review. Obstet Gynecol Surv. 74 (7), 415-428 (2019).
- Ravula, A., et al. Pharmacokinetic and pharmacodynamic characterization of tetrahydrocannabinol-induced cannabinoid dependence after chronic passive cannabis smoke exposure in rats. Cannabis Cannabinoid Res. 4 (4), 240-254 (2019).
- Zgair, A., et al. Dietary fats and pharmaceutical lipid excipients increase systemic exposure to orally administered cannabis and cannabis-based medicines. Am J Transl Res. 8 (8), 3448-3459 (2016).
- Mulligan, M. K., Hamre, K. M. Influence of prenatal cannabinoid exposure on early development and beyond. Adv Drug Alcohol Res. 3, 10981 (2023).
- Paul, S. E., et al. Associations between prenatal cannabis exposure and childhood outcomes: Results from the ABCD study. JAMA Psychiatry. 78 (1), 64-76 (2021).
- Fügedi, G., et al. Increased placental expression of cannabinoid receptor 1 in preeclampsia: An observational study. BMC Pregnancy Childbirth. 14, 395 (2014).
- Walker, M. K., et al. A less stressful alternative to oral gavage for pharmacological and toxicological studies in mice. Toxicol Appl Pharmacol. 260 (1), 65-69 (2012).
- Brown, A. P., Dinger, N., Levine, B. S. Stress produced by gavage administration in the rat. Contemp Top Lab Anim Sci. 39 (1), 17-21 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon