Method Article
Effet des conditions de synthèse par micro-ondes sur la structure des nanofeuilles d’hydroxyde de nickel
Dans cet article
Résumé
Les nanofeuilles d’hydroxyde de nickel sont synthétisées par une réaction hydrothermale assistée par micro-ondes. Ce protocole démontre que la température et le temps de réaction utilisés pour la synthèse par micro-ondes affectent le rendement de la réaction, la structure cristalline et l’environnement de coordination locale.
Résumé
Un protocole de synthèse hydrothermale rapide, assistée par micro-ondes, de nanofeuilles d’hydroxyde de nickel dans des conditions légèrement acides est présenté, et l’effet de la température et du temps de réaction sur la structure du matériau est examiné. Toutes les conditions de réaction étudiées aboutissent à des agrégats de nanofeuillets de α-Ni(OH)2 stratifiés. La température et le temps de réaction influencent fortement la structure du matériau et le rendement du produit. La synthèse de α-Ni(OH)2 à des températures plus élevées augmente le rendement de la réaction, réduit l’espacement entre les couches, augmente la taille du domaine cristallin, déplace les fréquences des modes vibratoires des anions intercalaires et abaisse le diamètre des pores. Des temps de réaction plus longs augmentent les rendements de réaction et permettent d’obtenir des tailles de domaine cristallin similaires. La surveillance de la pression de réaction in situ montre que des pressions plus élevées sont obtenues à des températures de réaction plus élevées. Cette voie de synthèse assistée par micro-ondes fournit un processus rapide, à haut débit et évolutif qui peut être appliqué à la synthèse et à la production d’une variété d’hydroxydes de métaux de transition utilisés pour de nombreuses applications de stockage d’énergie, de catalyse, de capteurs et autres.
Introduction
L’hydroxyde de nickel, Ni(OH)2, est utilisé pour de nombreuses applications, notamment les batteries nickel-zinc et nickel-hydrure métallique 1,2,3,4, les piles à combustible4, les électrolyseurs d’eau 4,5,6,7,8,9, les supercondensateurs4, les photocatalyseurs 4, les échangeurs d’anions10et de nombreuses autres applications analytiques, électrochimiques et de capteurs 4,5. Ni(OH)2 a deux structures cristallines prédominantes : β-Ni(OH)2 et α-Ni(OH)211. β-Ni(OH)2 adopte une structure cristalline Mg(OH)2 de type brucite, tandis que α-Ni(OH)2 est une forme turbostratiquement stratifiée de β-Ni(OH)2 intercalée avec des anions résiduels et des molécules d’eau issues de la synthèse chimique4. Dans α-Ni(OH)2, les molécules intercalées ne sont pas dans des positions cristallographiques fixes mais ont un degré de liberté d’orientation, et fonctionnent également comme une colle intercalaire stabilisant les couches Ni(OH)2 4,12. Les anions intercalaires de α-Ni(OH)2 affectent l’état d’oxydation moyen du Ni13 et influencent les performances électrochimiques du α-Ni(OH)2 (par rapport au β-Ni(OH)2) vers les applications de batterie 2,13,14,15, de condensateur16 et d’électrolyse de l’eau17,18.
Ni(OH)2 peut être synthétisé par précipitation chimique, précipitation électrochimique, synthèse sol-gel ou synthèse hydrothermale/solvothermique4. Les voies de précipitation chimique et de synthèse hydrothermale sont largement utilisées dans la production de Ni(OH)2, et différentes conditions synthétiques modifient la morphologie, la structure cristalline et les performances électrochimiques. La précipitation chimique de Ni(OH)2 consiste à ajouter une solution très basique à une solution aqueuse de sel de nickel (II). La phase et la cristallinité du précipité sont déterminées par la température, l’identité et les concentrations du sel de nickel (II) et de la solution basique utilisée4.
La synthèse hydrothermale de Ni(OH)2 consiste à chauffer une solution aqueuse de sel de nickel (II) précurseur dans un flacon de réaction sous pression, ce qui permet à la réaction de se dérouler à des températures plus élevées que celles normalement autorisées sous pression ambiante4. Les conditions de réaction hydrothermale favorisent généralement le β-Ni(OH)2, mais le α-Ni(OH)2 peut être synthétisé par (i) l’utilisation d’un agent d’intercalation, (ii) l’utilisation d’une solution non aqueuse (synthèse solvotherme), (iii) l’abaissement de la température de réaction, ou (iv) l’inclusion d’urée dans la réaction, ce qui donne du α-Ni(OH)2intercalé par l’ammoniac 4. La synthèse hydrothermale de Ni(OH)2 à partir de sels de nickel se fait par un processus en deux étapes qui implique une réaction d’hydrolyse (équation 1) suivie d’une réaction de condensation par olation (équation 2). 19
[Ni(H2O)N] 2+ + hH2O ↔ [Ni(OH)h(H2O) N-h](2-h)++ hH3O+ (1)
Ni-OH + Ni-OH2 Ni-OH-Ni + H2O (2)
La chimie des micro-ondes a été utilisée pour la synthèse en un seul pot d’une grande variété de matériaux nanostructurés et est basée sur la capacité d’une molécule ou d’un matériau spécifique à convertir l’énergie des micro-ondes en chaleur20. Dans les réactions hydrothermales conventionnelles, la réaction est initiée par l’absorption directe de chaleur à travers le réacteur. En revanche, dans les réactions hydrothermales assistées par micro-ondes, les mécanismes de chauffage sont la polarisation dipolaire du solvant oscillant dans un champ micro-ondes et la conduction ionique générant un frottement moléculaire localisé20. La chimie des micro-ondes peut augmenter la cinétique de réaction, la sélectivité et le rendement des réactions chimiques20, ce qui la rend d’un intérêt significatif pour une méthode évolutive et industriellement viable de synthèse de Ni(OH)2.
Pour les cathodes de piles alcalines, la phase α-Ni(OH)2 offre une capacité électrochimique améliorée par rapport à la phase13 β-Ni(OH)2, et les méthodes de synthèse pour synthétiser le α-Ni(OH)2 sont particulièrement intéressantes. Le α-Ni(OH)2 a été synthétisé par diverses méthodes assistées par micro-ondes, notamment le reflux assisté par micro-ondes 21,22, les techniques hydrothermales assistées par micro-ondes 23,24 et les précipitations catalysées par base assistées par micro-ondes25. L’inclusion d’urée dans la solution réactionnelle influence de manière significative le rendement de la réaction26, le mécanisme26,27, la morphologie et la structure cristalline27. La décomposition de l’urée assistée par micro-ondes s’est avérée être un composant essentiel pour l’obtention de α-Ni(OH)227. Il a été démontré que la teneur en eau d’une solution d’éthylène glycol et d’eau a un impact sur la morphologie de la synthèse assistée par micro-ondes de nanofeuillets de α-Ni(OH)2 24. Le rendement réactionnel du α-Ni(OH)2, lorsqu’il est synthétisé par une voie hydrothermale assistée par micro-ondes à l’aide d’une solution aqueuse de nitrate de nickel et d’urée, dépend du pH26 de la solution. Une étude antérieure de nanofleurs de α-Ni(OH)2 synthétisées par micro-ondes à l’aide d’une solution précurseur d’EtOH/H2O, de nitrate de nickel et d’urée a révélé que la température (de l’ordre de 80 à 120 °C) n’était pas un facteur critique, à condition que la réaction soit menée au-dessus de la température d’hydrolyse de l’urée (60 °C)27. Un article récent qui a étudié la synthèse par micro-ondes de Ni(OH)2 à l’aide d’une solution précurseur d’acétate de nickel tétrahydraté, d’urée et d’eau a révélé qu’à une température de 150 °C, le matériau contenait à la fois des phases α-Ni(OH)2 et β-Ni(OH)2, ce qui indique que la température peut être un paramètre critique dans la synthèse de Ni(OH)228.
La synthèse hydrothermale assistée par micro-ondes peut être utilisée pour produire du α-Ni(OH)2 et du α-Co(OH)2 de grande surface en utilisant une solution de précurseur composée de nitrates métalliques et d’urée dissoute dans une solution d’éthylène glycol/H2O 12,29,30,31. Des matériaux de cathode α-Ni(OH)2 substitués par des métaux pour les piles alcalines Ni-Zn ont été synthétisés à l’aide d’une synthèse à grande échelle conçue pour un réacteur à micro-ondes de grand format12. Le α-Ni(OH)2 synthétisé par micro-ondes a également été utilisé comme précurseur pour l’obtention de nanofeuilles de β-Ni(OH)2 12, de nanocadres de nickel-iridium pour les électrocatalyseurs de réaction d’évolution de l’oxygène (REL)29 et d’électrocatalyseurs d’oxygène bifonctionnels pour les piles à combustible et les électrolyseurs d’eau30. Cette voie de réaction micro-ondes a également été modifiée pour synthétiser Co(OH)2 en tant que précurseur de nanotrames de cobalt-iridium pour les électrocatalyseurs OER acides31 et les électrocatalyseurs bifonctionnels30. La synthèse assistée par micro-ondes a également été utilisée pour produire des nanofeuillets de α-Ni(OH)2 substitués par le Fe, et le rapport de substitution du Fe modifie la structure et l’aimantation32. Cependant, aucune procédure étape par étape pour la synthèse par micro-ondes du α-Ni(OH)2 et l’évaluation de la façon dont la variation du temps de réaction et de la température dans une solution eau-éthylène glycol affecte la structure cristalline, la surface, la porosité et l’environnement local des anions intercalaires dans le matériau n’a pas été rapportée auparavant.
Ce protocole établit des procédures pour la synthèse micro-ondes à haut débit de nanofeuillets de α-Ni(OH)2 à l’aide d’une technique rapide et évolutive. L’effet de la température et du temps de réaction a été varié et évalué à l’aide de la surveillance de la réaction in situ , de la microscopie électronique à balayage, de la spectroscopie à rayons X à dispersion d’énergie, de la porosimétrie à l’azote, de la diffraction des rayons X sur poudre (DRX) et de la spectroscopie infrarouge à transformée de Fourier pour comprendre les effets des variables synthétiques sur le rendement de la réaction, la morphologie, la structure cristalline, la taille des pores et l’environnement de coordination locale des nanofeuillets de α-Ni(OH)2 .
Protocole
NOTE : La figure 1 présente un aperçu schématique du procédé de synthèse par micro-ondes.
1. Synthèse par micro-ondes de nanofeuillets de α-Ni(OH)2
- Préparation de la solution de précurseur
- Préparer la solution de précurseur en mélangeant 15 mL d’eau ultrapure (≥18 MΩ-cm) et 105 mL d’éthylène glycol. Ajouter 5,0 g de Ni(NO3)2 · 6 H2O et 4,1 g d’urée dans la solution et couvrir.
- Placez la solution de précurseur dans un sonicateur de bain rempli de glace et d’eau (fréquence de 40 kHz) et sonisez à pleine puissance (sans impulsion) pendant 30 min.
- Réaction micro-ondes de la solution de précurseur
- Transférer 20 mL de la solution de précurseur dans un flacon de réaction micro-ondes muni d’une barre d’agitation en polytétrafluoroéthylène (PTFE) et sceller le récipient de réaction avec un couvercle verrouillable avec une doublure en PTFE.
- Programmez le réacteur à micro-ondes pour qu’il chauffe à la température de réaction en utilisant le réglage le plus rapidement possible (à 120 ou 180 °C) et maintenez-le à cette température pendant 13 à 30 minutes.
REMARQUE : Le chauffage aussi rapide que possible est un réglage de micro-ondes qui applique la puissance maximale du micro-ondes jusqu’à ce que la température souhaitée soit atteinte ; Appliquez ensuite une puissance variable pour maintenir la température de réaction. - Une fois la réaction terminée, purgez la chambre de réaction avec de l’air comprimé jusqu’à ce que la température de la solution atteigne 55 °C. Chaque étape de la réaction (chauffage, maintien et refroidissement) est réalisée sous agitation magnétique à 600 tr/min.
- Centrifugation et lavage du précipité de réaction micro-ondes.
- Transvaser la solution post-réaction dans des tubes à centrifuger de 50 ml. Centrifuger la solution post-réaction à 6 000 tr/min/6 198 rcf pendant 4 min à température ambiante, puis décanter le surnageant.
- Ajouter 25 mL d’eau ultrapure pour remettre les nanofeuilles en suspension. Centrifuger dans les mêmes conditions, puis décanter le surnageant.
- Répétez les étapes de lavage, de centrifugation et de décantation cinq fois au total en utilisant de l’eau, puis trois fois en utilisant de l’éthanol.
REMARQUE : L’alcool isopropylique peut également être utilisé à la place de l’éthanol.
- Mesure du pH avant et après la réaction micro-ondes
- Mesurez le pH de la solution de précurseur avant de commencer la réaction micro-ondes et mesurez le pH du surnageant immédiatement après la première centrifugation.
- Séchage de l’échantillon
- Couvrir les tubes de centrifugation avec un mouchoir en papier ou une serviette en papier pour agir comme un couvercle poreux afin de réduire la contamination potentielle et les sécher dans une étuve d’échantillonnage à 70 °C pendant 21 h sous atmosphère ambiante.
REMARQUE : Le temps et les conditions de séchage peuvent influer sur les intensités relatives et les valeurs de 2θ° des pics (DRX), comme décrit dans les résultats représentatifs.
- Couvrir les tubes de centrifugation avec un mouchoir en papier ou une serviette en papier pour agir comme un couvercle poreux afin de réduire la contamination potentielle et les sécher dans une étuve d’échantillonnage à 70 °C pendant 21 h sous atmosphère ambiante.
2. Caractérisation et analyse des matériaux
- Caractérisation de la morphologie et de la composition par microscopie électronique à balayage (MEB) et spectroscopie à rayons X à dispersion d’énergie (EDS)
- Préparer les échantillons pour l’analyse MEB et EDS en mettant en suspension une petite quantité de poudre de Ni(OH)2 dans 1 mL d’éthanol à l’aide d’un sonicateur au bain-marie.
- Coulé le mélange Ni(OH)2/éthanol sur un embout MEB et évaporer l’éthanol en plaçant le talon MEB dans un étuve à échantillon à 70 °C.
- Collectez des micrographies MEB et des spectres EDS. Collectez des images MEB à l’aide d’une tension d’accélération de 10 kV et d’un courant de 0,34 nA à des grossissements de 6,5 kX, 25 kX et 100 kX. Collectez des spectres EDS sur des régions sélectionnées à l’aide d’une tension d’accélération de 10 kV, d’un courant de 1,4 nA et d’un grossissement de 25 kX.
- Analyse de la surface et de la porosité à l’aide de la porosimétrie par physisorption de l’azote
- Préparez les échantillons pour l’analyse en ajoutant 25 mg de Ni(OH)2 dans le tube d’échantillonnage. Effectuer une procédure de dégazage et de séchage pré-analyse sous vide à 120 °C pendant 16 h avant l’analyse.
- Transférez le tube d’échantillon de l’orifice de dégazage à l’orifice d’analyse pour recueillir les isothermes d’azote (N2).
- Analyser les données isothermes N2 à l’aide de l’analyse Brunauer-Emmett-Teller (BET) pour déterminer la surface spécifique. Effectuer l’analyse BET selon les méthodologies de l’Union internationale de chimie pure et appliquée (UICPA)33. Le progiciel d’analyse spécifique utilisé pour effectuer l’analyse BET est inclus dans le tableau des matériaux.
- Analysez la branche de désorption de l’isotherme à l’aide de la méthode Barrett-Joyner-Halenda (BJH) pour obtenir le volume des pores, le diamètre des pores et la distribution de la taille des pores. Effectuer l’analyse BJH selon les méthodologies de l’IUPAC. 33 Le progiciel d’analyse utilisé pour effectuer l’analyse BJH est inclus dans le tableau des matériaux.
- Analyse structurale par diffraction des rayons X sur poudre (DRX)
- Remplissez le puits d’échantillon d’un support XRD de poudre sans bruit de fond avec Ni(OH)2, en veillant à ce que la surface de la poudre soit plane.
- Prélever des diffractogrammes de rayons X sur poudre à l’aide d’une source de rayonnement CuKα entre 5° et 80° 2θ en utilisant un incrément de 0,01.
- Analyser l’espacement d à l’aide de la loi de Bragg,
nλ = 2d sinθ,
où n est un entier, λ est la longueur d’onde des rayons X, d est l’espacement d et θ est l’angle entre les rayons incidents et l’échantillon. - Analyser la taille du domaine cristallite, D, à l’aide de l’équation de Scherrer,
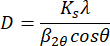
où Ks est la constante de Scherrer (une constante de Scherrer de 0,92 a été utilisée pour l’analyse), λ est la longueur d’onde des rayons X, β2θest la largeur intégrale du pic de diffraction et θ est l’angle de Bragg (en radians). Pour l’analyse, β2θa été pris comme la largeur totale à la moitié du maximum (fwhm) et multiplié par une constante de 0,939434.
- Caractérisation du matériau par spectroscopie infrarouge à transformée de Fourier à réflectance totale atténuée (ATR-FTIR)
- Équipez l’accessoire de réflectance totale atténuée (ATR) du spectromètre infrarouge à transformée de Fourier (IRTF).
- Pressez une petite quantité de poudre de Ni(OH)2 entre deux lames de verre pour créer une petite pastille.
- Placez la pastille de Ni(OH)2 sur le cristal ATR de silicium et obtenez un spectre FTIR compris entre 400 et 4 000 cm-1. Les spectres infrarouges représentent la moyenne de 16 balayages individuels avec une résolution de 4 cm-1 .
Résultats
Influence de la température et du temps de réaction sur la synthèse du α-Ni(OH)2
Avant la réaction, la solution de précurseur [Ni(NO3)2 · 6 H2O, urée, éthylène glycol et eau] est de couleur verte transparente avec un pH de 4,41 ± 0,10 (Figure 2A et Tableau 1). La température de la réaction micro-ondes (120 °C ou 180 °C) influence la pression de réaction in situ et la couleur de la solution (Figure 2B-G et Figure 3). Pour la réaction à 120 °C, le rayonnement micro-ondes chauffe la solution de précurseur à une température de 120 °C en moins de 1 min 30 s. Le réacteur à micro-ondes maintient la température à 120 °C pendant 13 à 30 minutes sous une puissance micro-ondes variable, puis la cuve a besoin de 3 minutes pour refroidir à 55 °C (figure 3A). Une fois la température appliquée, la réaction à 120 °C génère une pression modeste, atteignant une pression de réaction maximale de 9 à 11,5 psi. Le pH de la solution passe de 4,41 ± 0,10 à 6,75 ± 0,04 après 13 min à 120 °C, et monte à 7,03 ± 0,04 après 30 min à 120 °C. La centrifugation permet de séparer la poudre précipitée du surnageant vert (figure 2B-F). Le lavage et le séchage ultérieurs donnent une poudre verte (figure 2H) avec un rendement de 62 ± 12 mg pour le temps de réaction de 13 min et un rendement de 131 ± 24 mg pour le temps de réaction de 30 min à 120 °C (tableau 1).
L’augmentation de la température de réaction de 120 °C à 180 °C entraîne une accumulation importante de pression (Figure 3A vs. 3B), des modifications de la couleur du surnageant post-réaction (Figure 2B vs. 2D et 2E vs. 2G) et augmente le rendement de réaction par rapport aux réactions à 120 °C aux temps de réaction de 13 et 30 min (Tableau 1). En utilisant une température de réaction de 180 °C, la réaction atteint une pression de réaction maximale de 138 psi, coïncidant avec la fin de la réaction (Figure 3A). Pour déterminer les contributions relatives des différents composants à la pression, on compare la pression générée à l’aide de la solution de précurseur d’origine à la pression générée à l’aide d’une solution d’eau, d’éthylène glycol et d’urée et d’une solution d’eau et d’éthylène glycol (figure supplémentaire 1). D’après la comparaison de la pression générée par chaque solution à l’aide d’une température de réaction de 180 °C (figure supplémentaire 1), les solutions contenant de l’urée entraînent des pressions plus élevées. La solution d’eau et d’éthylène glycol contribue à une pression constante de 50 psi tout au long de la réaction ; la solution d’eau, d’éthylène glycol et d’urée a un profil de pression similaire à celui de la solution de nitrate de nickel, d’eau, d’éthylène glycol et d’urée (en rouge et en bleu dans la figure supplémentaire 1). La pression supplémentaire générée à 180 °C dans les solutions contenant de l’urée est attribuée à la décomposition de l’urée27 en CO2 et NH3 en phase gazeuse (comme nous l’avons vu dans la section suivante), le H2O en phase vapeur contribuant à la pression globale.
Contrairement au surnageant de couleur verte suivant la réaction micro-ondes à 120 °C (Figure 2E,F), le surnageant obtenu à la suite de la réaction à 180 °C est bleu (Figure 2G). Des photographies in situ de la réaction montrent la coloration bleue après refroidissement de la réaction (Figure 3C), et la solution subit un changement de couleur progressif entre la fin du chauffage au micro-ondes (encadré #2 de la Figure 3B) et la fin de l’étape de refroidissement (encadré #3 de la Figure 3B). Avant le chauffage de la solution à 180 °C induit par micro-ondes, le sel de nickel donne à la solution une couleur verte transparente (figure 3C, correspondant à la case #1 de la figure 3B). La solution est vert pâle trouble lorsque la réaction se termine (figure 3C, case #2 de la figure 3B), mais à mesure que la réaction est refroidie et que la pression diminue, la solution change de couleur du vert sombre au bleu (figure 3C, case #3 de la figure 3B). Le surnageant de la réaction à 180 °C a un pH de 8,91 ± 0,03, ce qui est beaucoup plus élevé que le surnageant à 120 °C (pH de 6,75 ± 0,04 pendant un temps de réaction de 13 minutes), et le pH plus élevé peut être lié à des niveaux plus élevés de décomposition de l’urée. La centrifugation, le lavage et le séchage de la réaction à 180 °C pendant 13 min donnent une poudre verte (aucune trace de couleur bleue n’a été observée avec la poudre) avec un rendement de 202 ± 4 mg, ce qui est beaucoup plus élevé que les rendements des réactions à 120 °C (tableau 1).
Effet du temps de réaction et de la température sur la morphologie, la composition et la porosité du α-Ni(OH)2
Les micrographies électroniques à balayage (MEB) révèlent que les matériaux Ni(OH)2 synthétisés sont composés d’agrégats (~1-5 μm de diamètre) de nanofeuilles ultraminces qui sont entrelacées de manière aléatoire (Figure 4). À partir d’images MEB, la température de réaction influence la croissance directionnelle relative des nanofeuilles individuelles au sein de l’agrégat global. Pour les réactions à 180 °C (Figure 4D-F), une nanofeuille individuelle dans l’agrégat semble avoir des dimensions latérales de feuilles plus longues par rapport à celles des réactions à 120 °C (Figure 4A-C et 4G-L). La comparaison d’images MEB de matériaux synthétisés pendant 13 min à 120 °C (Figure 4A) à 30 min à 120 °C (Figure 4G) montre que l’augmentation du temps de réaction de 13 à 30 min à 120 °C augmente la taille des agrégats de nanostructures nucléées de ~3 μm à ~5 μm. L’imagerie par microscopie électronique à transmission à haute résolution de matériaux similaires a montré que les nanofeuillets sont constitués de plusieurs cristallites, plutôt que d’une nanofeuille étant un monocristal32. L’analyse des matériaux produits à partir d’une variation de cette voie de synthèse a également montré que les nanofeuillets ont une épaisseur de 2 à 12 nm et sont composés d’empilements organisés de couches individuelles (001)12.
La spectroscopie à rayons X à dispersion d’énergie (EDS) montre une distribution uniforme du nickel, de l’oxygène, du carbone et de l’azote dans tous les matériaux synthétisés en nanofeuillets (Figure 5). Le carbone et l’azote incorporés dans la structure proviennent des composés résiduels des précurseurs de la réaction (par exemple, les nitrates, l’urée et l’éthylène glycol) et des dérivés 4,12,35, et la présence de ces composés dans la structure est étayée par l’analyse IRTF, comme décrit ci-dessous.
D’après l’analyse de la physisorption de l’azote, les nanofeuillets de Ni(OH)2 synthétisés par micro-ondes ont des surfaces BET allant de 61 à 85 m2·g-1, des volumes de pores moyens de 21 à 35 Å et des volumes de pores cumulés de 0,426 à 0,630 cm3·g-1 (tableau 1). En utilisant la nomenclature de l’UICPA pour le type isotherme et la largeur des pores33, les matériaux fabriqués à l’aide de ce protocole présentent tous des isothermes de type IV, et les diagrammes de distribution de la taille des pores montrent que la majorité du volume libre se situe dans les gammes mésopore (largeur des pores de 2 à 50 nm) et macropore (largeur des pores >50 nm) (figure supplémentaire 2). À partir de ces mesures, les surfaces des matériaux préparés à des températures et des temps de réaction différents se situent dans l’erreur expérimentale les unes des autres. Le matériau synthétisé à 180 °C pendant 13 min a un diamètre de pore et un volume de pores plus petits que le matériau synthétisé à 120 °C pendant 13 min, ce qui indique que la température de réaction affecte la porosité du matériau.
Impact du temps de réaction et de la température sur la structure du α-Ni(OH)2
Les diagrammes XRD des trois échantillons synthétisés par micro-ondes montrent des pics caractéristiques de α-Ni(OH)2. Plusieurs pics de diffraction sont observés dans la gamme 11-12°, 23-24°, 33°, 36° et 59° 2θ, correspondant respectivement aux plans (001), (002), (110), (111) et (300) de α-Ni(OH)2 (Figure 6A)12. Les positions des pics observées dans le diffractogramme en rayons X du matériau synthétisé à 120 °C pendant 13 min correspondent à celles d’une structure α-Ni(OH)2 hydratée (carte CIMD n° 00-038-0715). Pour la réaction à 120 °C, lorsque le temps de synthèse passe de 13 à 30 min, la position de la réflexion (001) se déplace vers une valeur inférieure de 2θ (Figure 6B), ce qui fait passer la hauteur de la galerie intercalaire de 7,85 à 7,94 Å. L’augmentation du temps de synthèse de 13 à 30 min à 120 °C n’a pas d’influence significative sur la taille du domaine cristallite dans les directions (001) ou (110) au-delà de l’erreur expérimentale (résultats résumés dans le tableau 2).
En plus des effets du temps de réaction, l’augmentation de la température de réaction micro-ondes de 120 °C à 180 °C induit également des modifications de la structure cristalline du α-Ni(OH)2 . À des températures élevées, le plan de diffraction (001) se déplace vers une valeur plus élevée de 2θ (Figure 6B), ce qui raccourcit la hauteur de la galerie intercalaire de 7,85 à 7,36 Å et entraîne un pic plus étroit (002), indiquant un degré d’ordre plus élevé dans la région intercalaire (Figure 6A). Le plan de diffraction (001) du α-Ni(OH)2 synthétisé à 180 °C se situe à une position comprise entre celle d’un α-Ni(OH)2 hydraté (carte CIMD n° 00-038-0715) et d’un α-Ni(OH)2 nitré (carte CIMD n° 00-022-0752), et la structure est donc compatible avec un α-Ni(OH)2 hydraté/nitré (Figure 6B). Comme des travaux antérieurs indiquent que la position maximale des réflexions (001) dans le α-Ni(OH)2 dépend des conditions de séchage36, les mêmes conditions de séchage (70 °C, 21 h, atmosphère ambiante) ont été appliquées aux échantillons afin d’éviter l’effet potentiel des conditions de séchage sur la position maximale (001). À des fins de comparaison, l’effet d’autres conditions de séchage a également été évalué. Des conditions de séchage de 16 h sous atmosphère ambiante ou sous vide ont donné lieu à des espacements d (001) dans l’erreur expérimentale de nos conditions de séchage standard de 70 °C pendant 21 h sous atmosphère ambiante (figure supplémentaire 3B). L’utilisation d’un temps de séchage plus long de 24 h sous atmosphère ambiante permet d’obtenir un espacement d (001) légèrement supérieur à l’erreur expérimentale ; cependant, les décalages dans l’espacement d de la réflexion (001) résultant de l’utilisation de différentes conditions de réaction (tableau 2) sont au-delà de l’erreur expérimentale de différentes conditions de séchage (figure supplémentaire 3B).
La morphologie de la nanofeuille se traduit par des tailles significativement différentes de domaines cristallins composés de (001) et (110) plans, qui sont des plans orthogonaux au sein de la structure cristalline α-Ni(OH)2 (Figure 6C). Les plans (001) résultent de l’ordre des couches de Ni(OH)2 , tandis que les plans (110) résultent de l’ordre des atomes dans le plan de la nanofeuille. Pour le matériau α-Ni(OH)2 synthétisé à 120 °C, les tailles de domaine cristallitique de 4,5 nm (001) et 12,9 nm (110) sont cohérentes avec les images MEB qui montrent des dimensions latérales plus grandes des feuillets par rapport à l’épaisseur des feuillets (Figure 4). Si l’on compare le α-Ni(OH)2 synthétisé à 120 °C et à 180 °C pendant 13 min, on constate que le matériau synthétisé à 180 °C présente des tailles de domaine plus grandes de 6,6 nm (001) et 15,2 nm (110) par rapport aux valeurs obtenues à 120 °C (tableau 2), ce qui est cohérent avec la microscopie MEB qui montre des nanofeuilles plus grandes et plus plates dans l’agrégat par rapport aux matériaux à 120 °C (Figure 4). Le matériau synthétisé à une température plus élevée a une taille de domaine plus grande, ce qui est cohérent avec le diamètre et le volume de pores plus petits de l’analyse de physisorption de l’azote (tableau 1).
Les spectres ATR-FTIR des nanofeuillets synthétisés par micro-ondes dans la région de 400 à 4 000 cm-1 (Figure 7A et Tableau 2) montrent un mode de réseau Ni-O35 entre 400 et 800 cm-1, des modes de ligands et de molécules structurales35 entre 800 et 2 000 cm-1, des bandes de cyanate31 entre 2 000 et 2 500 cm-1 et des modes de réseau α-OH35 entre 3 500 et 3 800 cm-1. Les figures supplémentaires comprennent les régions élargies des modes de réseau Ni-O (figure supplémentaire 4A), les modes cyanate (figure supplémentaire 4B) et les modes de réseau α-OH (figure supplémentaire 4C). Le tableau supplémentaire 1 présente les nombres d’onde expérimentaux pour les matériaux préparés dans différentes conditions de réaction et les affectations de pics provenant d’études antérieures. À l’intérieur des ligands et des molécules structurales marqués par région des spectres FTIR (Figure 6B), tous les échantillons montrent deux modes vibrationnels de nitrate distincts, un nitrate lié, ν3(NO3-), et un nitrate libre, ν3(NO3- libre), un point commun entre le α-Ni(OH)2 synthétisé à partir de solutions de nitrates de nickel12,35. Les trois échantillons montrent des modes d’étirement vibratoire provenant des cyanates dérivés de l’urée, νs(C-O-CN)/νs(OCN-)12,31 et des modes de flexion de l’eau libre, δs(H-O-H)35. Le mode ν(C-O) est attribué aux carbonates dans le matériau α-Ni(OH)2 31. L’augmentation du temps de réaction de 13 min à 30 min à 120 °C entraîne une diminution de l’intensité relative du mode ν(C-O), ce qui confirme que des temps de réaction plus longs influencent l’incorporation de carbonates dans le matériau, affectant la région intercalaire4.
L’augmentation de la température de réaction de 120 °C à 180 °C modifie les fréquences et les intensités relatives des modes vibrationnels du cyanate, du nitrate, de l’hydroxyle et de l’eau (Figure 7B). En comparant les matériaux à 120 °C et 180 °C pendant 13 min, à la température de réaction plus élevée de 180 °C, la fréquence du mode δ(α-OH) passe à un nombre d’onde plus élevé (région surlignée en vert de la figure 7B), indiquant un changement dans l’environnement d’énergie potentielle locale de -OH coordonné au centre Ni. La température de réaction modifie également les intensités relatives des modes cyanate, nitrate et eau libre. La comparaison des spectres d’échantillons chauffés à 180 °C et 120 °C montre que, par rapport au mode ν3(NO3-) (région surlignée en gris de la figure 7B), les intensités du mode ν(C-O-CN) (encart rouge de la figure 7B) et du mode δ(H-O-H, libre) (encart bleu de la figure 7B) sont plus faibles dans le matériau à 180 °C que dans le matériau à 120 °C. De plus, l’intensité relative des modes nitrate, ν3(NO3-) et ν3(NO3-, libre), par rapport au mode δ(H-O-H, libre) est plus élevée à des températures de réaction élevées. L’augmentation de l’intensité relative des modes nitrate par rapport au mode δ(H-O-H, libre) à des températures de réaction élevées appuie l’analyse XRD selon laquelle l’augmentation de la température de réaction de 120 à 180 °C entraîne l’expression du matériau sous la forme d’un α-Ni(OH)2 hydraté-nitré. La forme maximale du mode cyanate qui se produit entre 2 000 et 2 500 cm-1 change également avec une élévation de la température de réaction (figure supplémentaire 4B), où il semble y avoir deux bandes dans les échantillons. Dans la région du mode cyanate, l’échantillon chauffé à 180 °C a une intensité relative différente du pic de fréquence supérieure à celle des échantillons à 120 °C.
Les changements observés dans la fréquence et l’intensité relative indiquent un changement de température et de temps de réaction dans l’environnement d’énergie potentielle local de ces fractions, et une analyse supplémentaire est nécessaire pour établir davantage les corrélations fréquence-structure de ces modes vibratoires au sein de ces matériaux.
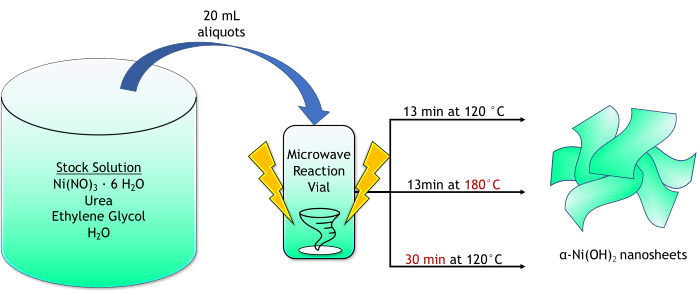
Figure 1 : Représentation schématique de la synthèse de nanofeuillets de α-Ni(OH)2. Le procédé a utilisé 20 mL d’aliquotes d’une solution mère (Ni(NO)3 · 6 H2O, urée, éthylène glycol et H2O) passées au micro-ondes sous des temps de réaction variables (13 ou 30 min) et des températures (120 ou 180 °C) produisant des nanofeuillets de α-Ni(OH)2. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Images de la solution réactionnelle micro-ondes composée de nitrate de nickel, d’urée, d’éthylène glycol et d’eau. (A) Avant le rayonnement micro-ondes ; après rayonnement micro-ondes pendant (B) 13 min à 120 °C, (C) 30 min à 120 °C et (D) 13 min à 180 °C. Photos des échantillons après la première centrifugation [qui sépare le Ni(OH)2 de tout nitrate de nickel, urée, éthylène glycol et eau qui n’ont pas réagi] : (E) 13 min à 120 °C, (F) 30 min à 120 °C et (G) 13 min à 180 °C. (H) Les poudres lavées et séchées de matériaux synthétisés à l’aide de 13 min à 120 °C, 30 min à 120 °C et 13 min à 180 °C. Cliquez ici pour voir une version agrandie de cette figure.
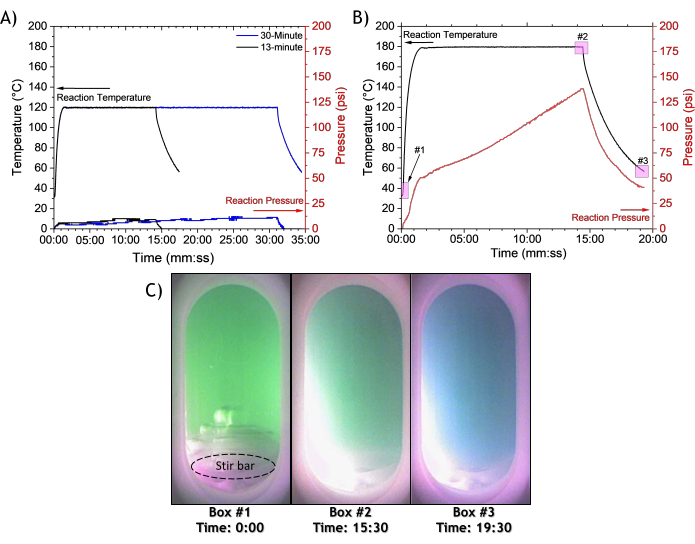
Figure 3 : Profils de temps, de température et de pression des réactions micro-ondes de solutions composées de nitrate de nickel, d’urée, d’éthylène glycol et d’eau. L’influence du temps de réaction sur la pression des micro-ondes synthétise Ni(OH)2 à (A) 120 °C pendant 13 et 30 min et (B) 180 °C pendant 13 min. (C) Photographies in situ de la réaction à 180 °C. Les encarts roses de 1 à 3 po (B) correspondent aux photographies in situ de la réaction en (C). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Micrographies électroniques à balayage de nanofeuillets de α-Ni(OH)2 synthétisés par micro-ondes à différents grossissements. (A-C) 13 min à 120 °C, (D-F) 13 min à 180 °C et (G-L) 30 min à 120 °C. Veuillez cliquer ici pour voir une version agrandie de cette figure.
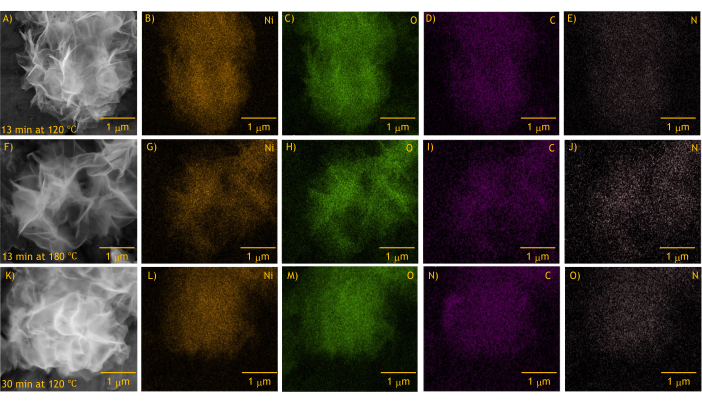
Figure 5 : Cartographie élémentaire spectroscopique à rayons X à dispersion d’énergie du nickel (Ni), de l’oxygène (O), du carbone (C) et de l’azote (N) dans les nanofeuillets de α-Ni(OH)2 synthétisés par micro-ondes. (A-E) 13 min à 120 °C, (F-J) 13 min à 180 °C et (K-O) 30 min à 120 °C. Veuillez cliquer ici pour voir une version agrandie de cette figure.
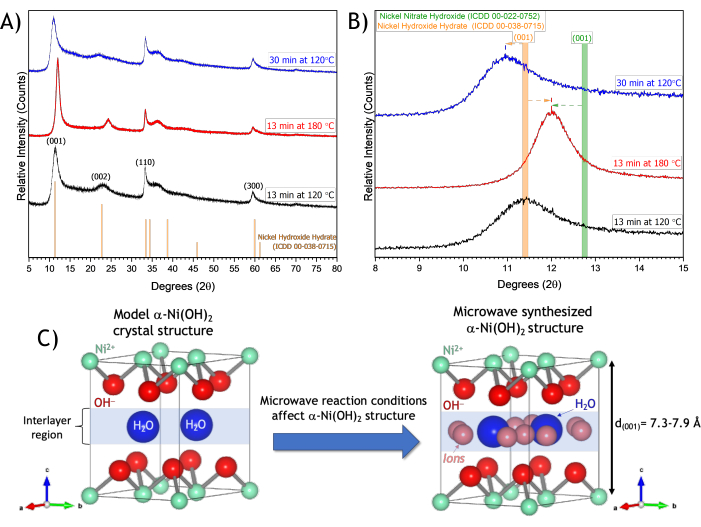
Figure 6 : Diagramme de diffraction des rayons X de nanofeuillets de α-Ni(OH)2 synthétisés par micro-ondes préparés dans différentes conditions de réaction (13 min à 120 °C, 13 min à 180 °C et 30 min à 120 °C). (A) Motif XRD en poudre entre 5° et 80° 2 régions. (B) Une région élargie du diffractogramme dans les régions 10-14° 2 montrant le plan (001) de α-Ni(OH)2. (C) Comparaison d’un modèle de structure cristalline α-Ni(OH)2 aux nanofeuillets de α-Ni(OH)2 synthétisés par micro-ondes et créés à l’aide d’un logiciel de structure cristalline37. Veuillez cliquer ici pour voir une version agrandie de cette figure.
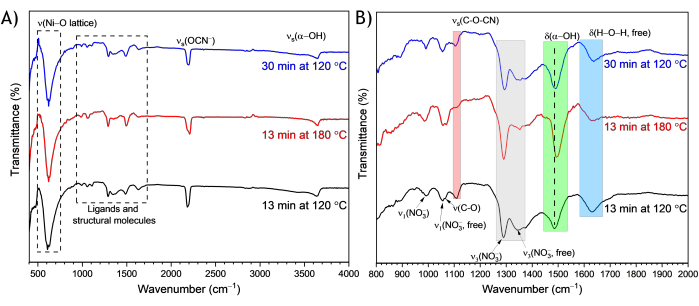
Figure 7 : Spectres de spectroscopie infrarouge à transformée de Fourier par réflectance totale atténuée (ATR-FTIR) de nanofeuillets de α-Ni(OH)2 synthétisés par micro-ondes. Les nanofeuillets ont été préparés dans différentes conditions de réaction (13 min à 120 °C, 13 min à 180 °C et 30 min à 120 °C) et analysés par ATR-FTIR dans la région (A) 400-4 000 cm-1 , et (B) vue élargie dans la région 800-2 000 cm-1 ; Les affectations de crête sont affichées et les détails des affectations de crête sont fournis dans le texte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Conditions de réaction | Composition élémentaire déterminée par EDS | Physisorption de l’azote | |||||||
| Température de réaction (°C) | Temps de réaction (minutes) | pH avant réaction | pH après réaction | Rendement (mg) | % atomique Ni | Atomique % O | BET Surface (m2 • g-1) | Diamètre des pores (Å) | Volume des pores (cm 3 • g-1) |
| 120 °C | 13 | 4,41 ± 0,10 | 6,75 ± 0,04 | 62 ± 12 | 21 ± 2 | 68 ± 4 | 79 ± 19 | 35 ± 6 | 0,630 ± 0,093 |
| 180 °C | 13 | 4,41 ± 0,10 | 8,91 ± 0,03 | 202 ± 4 | 21 ± 1 | 67 ± 4 | 85 ± 10 | 21 ± 2 | 0,497 ± 0,085 |
| 120 °C | 30 | 4,41 ± 0,10 | 7,03 ± 0,04 | 131 ± 24 | 16 ± 4 | 67 ± 4 | 61 ± 21 | 21 ± 14 | 0,426 ± 0,115 |
Tableau 1 : Caractéristiques physico-chimiques du Ni(OH)2 synthétisé par micro-ondes. Les caractéristiques ont été mesurées à différentes températures (120 °C et 180 °C) et temps de réaction (13 min et 30 min) ; le pH, le rendement, la composition élémentaire à partir de la spectroscopie à rayons X à dispersion d’énergie (EDS) et les données de porosimétrie à l’azote ; Des détails sont fournis dans le texte.
| Conditions de réaction micro-ondes | Diffraction des rayons X | Spectroscopie infrarouge | |||||
| (001) espacement d (Å) | Taille du domaine cristallite (nm) | Nombre d’onde (cm-1) | |||||
| <001> | <110> | ν(Ni-O) | δ(α-OH) | ν3(N°3-) | νs(OCN-) | ||
| 13 min à 120 °C | 7,85 ± 0,17 | 4,5 ± 1,1 | 12,9 ± 1,3 | 617 | 1487 | 1289 | 2183 |
| 13 min à 180 °C | 7,36 ± 0,03 | 6,6 ± 0,5 | 15,2 ± 0,6 | 620 | 1493 | 1291 | 2207 |
| 30 min à 120 °C | 7,94 ± 0,02 | 5,2 ± 0,6 | 12,0 ± 1,7 | 620 | 1498 | 1294 | 2197 |
Tableau 2 : Analyse structurale de nanofeuillets de α-Ni(OH)2 synthétisés par micro-ondes. Analyse structurale de nanofeuillets préparés dans différentes conditions de réaction (13 min à 120 °C, 13 min à 180 °C et 30 min à 120 °C) obtenus à partir de la XRD sur poudre et de la spectroscopie infrarouge à transformée de Fourier. Des détails sont fournis dans le texte.
Discussion
La synthèse par micro-ondes fournit une voie pour générer du Ni(OH)2 qui est nettement plus rapide (temps de réaction de 13 à 30 minutes) par rapport aux méthodes hydrothermales conventionnelles (temps de réaction typiques de 4,5 h)38. En utilisant cette voie de synthèse par micro-ondes légèrement acide pour produire des nanofeuilles de α-Ni(OH)2 ultraminces, on observe que le temps de réaction et la température influencent le pH de la réaction, les rendements, la morphologie, la porosité et la structure des matériaux résultants. À l’aide d’un manomètre de réaction in situ , une très faible accumulation de pression se produit pendant les deux réactions à 120 °C, mais l’augmentation de la température de réaction de 120 °C à 180 °C génère une pression de réaction substantielle. L’urée se décompose enNH3 et CO2 (équation 3) puis réagit davantage, générant du CO32- et OH- (équations 4 et 5), etNH4+ et OCN- (équation 6)27, avec la libération continue de OH - entraînant les réactions d’hydrolyse et de condensation qui entraînent la croissance de la structure Ni(OH)2 27.
H2NCONH2(s) + H2O(l) 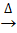 2 NH3(g) +CO2(g) (3)
2 NH3(g) +CO2(g) (3)
H2O(l) + CO2(g) → CO32(aq)+ 2 H+(aq) (4)
NH3(g) + H2O(l) → NH4+(aq) + OH-(aq) (5)
H2NCONH2(s) + H2O(l) → OCN- (aq) + NH4+(aq)+ H2O(l) (6)
L’augmentation de la pression générée lors de la réaction effectuée à 180 °C est attribuée au gaz généré par la décomposition de l’urée. La réaction à 180 °C génère également des niveaux de pH plus élevés résultant de l’alcalinisation médiée par l’urée (augmentation du pH) de la solution. L’augmentation du pH et l’augmentation du rendement du produit de la réaction à 180 °C résultent de l’augmentation du taux de décomposition de l’urée, ce qui peut entraîner l’hydrolyse du nitrate de nickel et la réaction de condensation à un rythme plus rapide. Cette analyse est cohérente avec les travaux antérieurs, qui ont rapporté la synthèse de α-Ni(OH)2 dans l’urée etH2O et ont constaté que le rendement de la réaction dépend de l’évolution du pH26.
La pression de réaction et le pH plus élevé obtenus à la température de réaction la plus élevée peuvent également influencer la direction de croissance latérale préférée des nanofeuillets, comme observé à partir d’images MEB (Figure 4), les nanofeuillets synthétisés à 120 °C s’organisant de manière plus aléatoire par rapport à l’organisation plus plane des nanofeuillets à 180 °C. À la fin de la réaction à 180 °C, la couleur de la solution passe du vert trouble au bleu à mesure que la pression est relâchée et peut être liée à une réaction de l’ammoniac avec le Ni qui n’a pas réagi dans la solution, ce qui rend la solution bleue. Le changement de couleur du vert au bleu peut être dû au fait que le NH3 réagit avec le Ni2+ restant et forme une solution bleue qui peut contenir un complexe de Ni coordonné par le NH3. Cependant, une analyse plus approfondie est nécessaire pour identifier la spéciation spécifique de la coloration bleue.
Une étude antérieure du groupe Suib a rapporté que, dans la plage de 80 à 120 °C (au-dessus de la température d’hydrolyse de l’urée de 60 °C), la température n’est pas un facteur critique dans la synthèse assistée par micro-ondes et médiée par l’urée de nanofleurs de α-Ni(OH)2 27. Dans cette étude, des températures plus élevées (120-180 °C) influencent la structure cristalline, la structure locale et la porosité du α-Ni(OH)2. Cette solution de synthèse par micro-ondes diffère de la leur par le choix du solvant ; cette réaction utilise un mélange d’éthylène glycol / H2O, alors que le groupe de Suib a utilisé de l’éthanol / H2O comme milieu de réaction27. Les surfaces BET des nanofeuillets de α-Ni(OH)2 synthétisés à l’aide de ce protocole (61-85 m2·g-1) sont plus grandes que celles synthétisées à partir de NiCl2 (9,2 m2·g-1)22, mais inférieures au reflux assisté par micro-ondes du nitrate de nickel dans l’éthanol (173 m2·g-1)21.
Lorsqu’elle est synthétisée dans l’urée et le H2O, la croissance des cristallites α-Ni(OH)2 est considérée comme anisotrope, augmentant dans la direction (001) [la croissance (110) restant constante] avec le temps de réaction et se stabilisant avec l’épuisement du Ni2+ dans la solution26. Dans cette étude, un changement plus important de la taille des cristallites dans les directions (001) et (110) est observé à des températures élevées par rapport aux changements de taille des cristallites induits par un temps de réaction plus long. Il a été démontré que la région intercalaire du α-Ni(OH)2 substitué par un métal modifie l’espacement d et l’ordre des intercalaires en fonction de l’électrostatique et de la population de molécules dans l’intercouche12. De même, ce travail montre des changements dans l’espacement d et l’ordre des intercouches, mais à des températures de réaction élevées et des temps de réaction plus longs, plutôt qu’en utilisant des dopants métalliques. Les analyses XRD, FTIR et MEB-EDS indiquent qu’en utilisant une température de réaction de 120 °C, la structure du matériau α-Ni(OH)2 est une forme hydratée de α-Ni(OH)2, avec une région intercalaire contenant principalement des nitrates libres, des molécules d’eau libres et d’autres molécules résiduelles des produits chimiques de départ. Une représentation de la structure cristalline de α-Ni(OH)2 avec l’eau et les ions intercalaires est présentée à la figure 6C, où l’eau et les ions intercalaires ne sont pas dans des positions cristallographiques fixes dans la cellule unitaire mais ont une certaine liberté de rotation et de translation dans le plan ab4.
Lorsque la température de réaction est augmentée à 180 °C, on observe un espacement d plus petit (001), une région intercalaire plus ordonnée (002) et une diminution de l’intensité relative du mode vibratoire δ (HOH, libre). Lors de la synthèse à 180 °C, l’accumulation de pression dans la réaction provient en partie de la décomposition de l’urée, mais aussi de la vaporisation de H2O, ce qui entraîne une diminution de l’H2O en phase solution disponible pour être incorporé dans la structure α-Ni(OH)2 . Les différences dans les positions des pics XRD et les intensités relatives des modes nitrate, ν3(NO3-) et ν3(NO3-, libre), par rapport au mode δ(H-O-H, libre) à 120 et 180 °C confirment que la conduite de la réaction à une température plus élevée augmente la concentration relative de nitrates dans la structure ; Cependant, une analyse plus approfondie est nécessaire pour déterminer comment les anions nitrate interagissent dans la structure. La décomposition de l’urée contribue à une augmentation de la pression réactionnelle, conduisant la réaction d’hydrolyse et de condensation du Ni(OH)2 vers des rendements réactionnels plus élevés par rapport aux réactions à 120 °C. L’intensité relative du mode νs(C-O-CN) de l’échantillon à 180 °C diminue par rapport à l’échantillon à 120 °C, ce qui indique qu’une moindre quantité de produit de décomposition de l’urée est présente dans la structure à des températures plus élevées.
Ce travail fournit un protocole pour la synthèse assistée par micro-ondes de Ni(OH)2 et montre que la température et le temps de réaction affectent la structure et le rendement du α-Ni(OH)2 . L’utilisation de différentes conditions de synthèse pour contrôler la structure ouvre la voie au développement de matériaux améliorés pour les batteries et d’autres applications. Les limites de cette réaction comprennent des volumes relativement importants de déchets aqueux contenant du nickel résultant des étapes de lavage/centrifugation du protocole. La réaction peut générer des pressions élevées et de l’ammoniac comme sous-produit et peut ne pas convenir aux réacteurs à ciel ouvert ou aux espaces de travail non ventilés. De plus, ce protocole a été évalué dans un réacteur à micro-ondes à l’échelle du laboratoire et peut être modifié pour adapter la voie de synthèse à l’échelle du kilogramme.
Figure supplémentaire 1 : Comparaison de la température de réaction et de la pression de réaction en fonction du temps. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Analyse de nanofeuillets d’αNi(OH)2 synthétisés par micro-ondes. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Effets des conditions de séchage sur les diagrammes de diffraction des rayons X du α-Ni(OH)2. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 4 : Spectres infrarouges à transformée de Fourier à réflectance totale atténuée (ATR-FTIR) de nanofeuillets de α-Ni(OH)2 synthétisés par micro-ondes. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Analyse IRTF de nanofeuillets de α-Ni(OH)2 synthétisés par micro-ondes. Veuillez cliquer ici pour télécharger ce fichier.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
S.W.K. et le C.P.R. remercient chaleureusement l’Office of Naval Research Ship Research Program (subvention n° N00014-21-1-2072). S.W.K. remercie le Naval Research Enterprise Internship Program pour son soutien. Le C.P.R et le C.M. reconnaissent le soutien du Centre pour l’assemblage intelligent des matériaux (PREM) de la National Science Foundation (PREM), prix n° 2122041, pour l’analyse des conditions de réaction.
matériels
| Name | Company | Catalog Number | Comments |
| ATR-FTIR | Bruker | Tensor II FT-IR spectrometer equipped with a Harrick Scientific SplitPea ATR micro-sampling accessory | |
| Bath sonicator | Fisher Scientific | 15-337-409 | -- |
| Ethanol | VWR analytical | AC61509-0040 | 200 proof |
| Ethylene Glycol | VWR analytical | BDH1125-4LP | 99% purity |
| Falcon Centrifuge tubes | VWR analytical | 21008-940 | 50 mL |
| KimWipes | VWR analytical | 21905-026 | -- |
| Lab Quest 2 | Vernier | LABQ2 | -- |
| Microwave Reactor | Anton Parr | 165741 | Monowave 450 |
| Ni(NO3)2 · 6 H2O | Ward's Science | 470301-856 | Research lab grade |
| pH Probe | Vernier | PH-BTA | Calibrated vs standard pH solutions (pH= 4, 7, 11) |
| Porosemeter | Micromeritics | -- | ASAP 2020. Analysis software: Micromeritics, version 4.03 |
| Powder x-ray diffactometer | Bruker | AXS Advanced Poweder x-ray diffractometer; d-spacing, and crystallite size analyses were performed using Highscore XRD software, and crystal structures were created using VESTA 3 software. | |
| Reaction vial | Anton Parr | 82723 | 30 mL G30 wideneck, 20 mL max fill capacity |
| Reaction vial locking lid | Anton Parr | 161724 | G30 Snap Cap |
| Reaction vial PTFE septum | Anton Parr | 161728 | Wideneck |
| Scanning electron microscope | FEI | -- | Helios Nanolab 400 |
| Urea | VWR analytical | BDH4602-500G | ACS grade |
Références
- Liu, B., et al. 120 Years of nickel-based cathodes for alkaline batteries. Journal of Alloys and Compounds. 834, 155185(2020).
- Young, K. H., et al. Fabrications of high-capacity α-Ni(OH)2. Batteries. 3, 6(2017).
- Huang, M., Li, M., Niu, C., Li, Q., Mai, L. Recent advances in rational electrode designs for high-performance alkaline rechargeable batteries. Advanced Functional Materials. 29 (11), 1807847(2019).
- Hall, D. S., Lockwood, D. J., Bock, C., MacDougall, B. R. Nickel hydroxides and related materials: a review of their structures, synthesis and properties. Proceedings of the Royal Society A. Mathematical, Physical and Engineering Sciences. 471 (2174), 20140792(2015).
- Miao, Y., et al. Electrocatalysis and electroanalysis of nickel, its oxides, hydroxides and oxyhydroxides toward small molecules. Biosensors and Bioelectronics. 53, 428-439 (2014).
- Suen, N. T., et al. Electrocatalysis for the oxygen evolution reaction: recent development and future perspectives. Chemical Society Reviews. 46 (2), 337-365 (2017).
- Diaz-Morales, O., Ledezma-Yanez, I., Koper, M. T., Calle-Vallejo, F. Guidelines for the rational design of Ni-based double hydroxide electrocatalysts for the oxygen evolution reaction. ACS Catalysis. 5 (9), 5380-5387 (2015).
- Rossini, P. dO., et al. Ni-based double hydroxides as electrocatalysts in chemical sensors: a review. Trends in Analytical Chemistry. 126, 115859(2020).
- Yu, Z., Bai, Y., Tsekouras, G., Cheng, Z. Recent advances in Ni-Fe (Oxy)hydroxide electrocatalysts for the oxygen evolution reaction in alkaline electrolyte targeting industrial applications. Nano Select. 3 (4), 766-791 (2021).
- Othman, M. R., Helwani, Z., Martunus, F. W. J. N. Synthetic hydrotalcites from different routes and their application as catalysts and gas adsorbents: a review. Applied Organometallic Chemistry. 23 (9), 335-346 (2009).
- Bode, V. H., Dehmelt, K., Witte, J. About the nickel hydroxide electrode. II. On the oxidation products of nickel(II) hydroxidesZeitschrift für Anorganische und Allgemeine Chemie. 366, 1-21 (1969).
- Kimmel, S. W., et al. Capacity and phase stability of metal-substituted α-Ni(OH)2 nanosheets in aqueous Ni-Zn batteries. Materials Advances. 2 (9), 3060-3074 (2021).
- Corrigan, D. A., Knight, S. L. Electrochemical and spectroscopic evidence on the participation of quadrivalent nickel in the nickel hydroxide redox reaction. Journal of the Electrochemical Society. 136 (3), 613-619 (1989).
- Shangguan, E., et al. A comparative study of structural and electrochemical properties of high-density aluminum substituted α-nickel hydroxide containing different interlayer anions. Journal of Power Sources. 282, 158-168 (2015).
- Li, Y. W., et al. Effect of interlayer anions on the electrochemical performance of Al-substituted α-type nickel hydroxide electrodes. International Journal of Hydrogen Energy. 35 (6), 2539-2545 (2010).
- Wang, C., Zhang, X., Xu, Z., Sun, X., Ma, Y. Ethylene glycol intercalated cobalt/nickel layered double hydroxide nanosheet assemblies with ultrahigh specific capacitance: structural design and green synthesis for advanced electrochemical storage. ACS Applied Materials & Interfaces. 7 (35), 19601-19610 (2015).
- Hunter, B. M., Hieringer, W., Winkler, J. R., Gray, H. B., Müller, A. M. Effect of interlayer anions on [NiFe]-LDH nanosheet water oxidation activity. Energy & Environmental Science. 9 (5), 1734-1743 (2016).
- Zhou, D., et al. Effects of redox-active interlayer anions on the oxygen evolution reactivity of NiFe-layered double hydroxide nanosheets. Nano Research. 11, 1358-1368 (2018).
- Cochran, E. A., Woods, K. N., Johnson, D. W., Page, C. J., Boettcher, S. W. Unique chemistries of metal-nitrate precursors to form metal-oxide thin films from solution: materials for electronic and energy applications. Journal of Materials Chemistry A. 7 (42), 24124-24149 (2019).
- Bilecka, I., Niederberger, M. Microwave chemistry for inorganic nanomaterials synthesis. Nanoscale. 2 (8), 1358-1374 (2010).
- Zhang, X., et al. Microwave-assisted synthesis of 3D flowerlike alpha-Ni(OH)2 nanostructures for supercapacitor application. Science China Technological Sciences. 58, 1871-1876 (2015).
- Li, J., Wei, M., Chu, W., Wang, N. High-stable α-phase NiCo double hydroxide microspheres via microwave synthesis for supercapacitor electrode materials. Chemical Engineering Journal. 316, 277-287 (2017).
- Tao, Y., et al. Microwave synthesis of nickel/cobalt double hydroxide ultrathin flowerclusters with three-dimensional structures for high-performance supercapacitors. Electrochimica Acta. 111, 71-79 (2013).
- Zhu, Y., et al. Ultrathin nickel hydroxide and oxide nanosheets: synthesis, characterizations and excellent supercapacitor performances. Scientific Reports. 4, 1-7 (2014).
- Benito, P., Labajos, F. M., Rives, V. Microwave-treated layered double hydroxides containing Ni and Al: the effect of added Zn. Journal of Solid State Chemistry. 179 (12), 3784-3797 (2006).
- Soler-Illia, G. J. dA., Jobbágy, M., Regazzoni, A. E., Blesa, M. A. Synthesis of nickel hydroxide by homogeneous alkalinization. precipitation mechanism. Chemistry of Materials. 11 (11), 3140-3146 (1999).
- Xu, L., et al. 3D flowerlike α-nickel hydroxide with enhanced electrochemical activity synthesized by microwave-assisted hydrothermal method. Chemistry of Materials. 20 (1), 308-316 (2008).
- Alshareef, S. F., Alhebshi, N. A., Almashhori, K., Alshaikheid, H. S., Al-Hazmi, F. A ten-minute synthesis of alpha-Ni(OH)2 nanoflakes assisted by microwave on flexible stainless-steel for energy storage devices. Nanomaterials. 12 (11), 1911(2022).
- Godínez-Salomón, F., et al. Self-supported hydrous iridium-nickel oxide two-dimensional nanoframes for high activity oxygen evolution electrocatalysts. ACS Catalysis. 8 (11), 10498-10520 (2018).
- Godínez-Salomón, F., Albiter, L., Mendoza-Cruz, R., Rhodes, C. P. Bimetallic two-dimensional nanoframes: high activity acidic bifunctional oxygen reduction and evolution electrocatalysts. ACS Applied Energy Materials. 3 (3), 2404-2421 (2020).
- Ying, Y., et al. Hydrous cobalt-iridium oxide two-dimensional nanoframes: insights into activity and stability of bimetallic acidic oxygen evolution electrocatalysts. Nanoscale Advances. 3 (7), 1976-1996 (2021).
- Kimmel, S. W., et al. Structure and magnetism of iron-substituted nickel hydroxide nanosheets. Magnetochemistry. 9 (1), 25-47 (2023).
- Thommes, M., et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure and Applied Chemistry. 87 (9-10), 1051-1069 (2015).
- Birkholz, M., Fewster, P. F., Genzel, C. Thin Film Analysis by X-ray Scattering. , Wiley-VCH. (2006).
- Hall, D. S., Lockwood, D. J., Poirier, S., Bock, C., MacDougall, B. R. Raman and infrared spectroscopy of alpha and beta phases of thin nickel hydroxide films electrochemically formed on nickel. Journal of Physical Chemistry A. 116 (25), 6771-6784 (2012).
- Choy, J. H., Kwon, Y. M., Han, K. S., Song, S. W., Chang, S. H. Intra- and inter-layer structures of layered hydroxy double salts, Ni1-xZn2x(OH)2(CH3CO2)2xnH2O. Materials Letters. 34 (3-6), 356-363 (1998).
- Momma, K., Izumi, F. VESTA for three-dimensional visualization of crystal, volumetric and morphology data. Journal of Applied Crystallography. 44 (6), 1272-1276 (2011).
- Godinez-Salomon, F., Mendoza-Cruz, R., Arellano-Jimenez, M. J., Jose-Yacaman, M., Rhodes, C. P. Metallic two-dimensional nanoframes: unsupported hierarchical nickel-platinum alloy nanoarchitectures with enhanced electrochemical oxygen reduction activity and stability. ACS Applied Materials & Interfaces. 9 (22), 18660-18674 (2017).
- Shakhashiri, B. Z., Dirreen, G. E., Juergens, F. Color, solubility, and complex ion equilibria of nickel (II) species in aqueous solution. Journal of Chemical Education. 57 (12), 900-901 (1980).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon