Method Article
Analyses qualitatives et comparatives des données d’activité corticale à partir d’une expérience de spectroscopie fonctionnelle dans le proche infrarouge appliquant la conception de blocs
Dans cet article
Résumé
Nous décrivons l’analyse de l’expérience fonctionnelle continue-onduleuse de spectroscopie proche infrarouge utilisant une conception de bloc avec une tâche sensorimotrice. Pour accroître la fiabilité de l’analyse des données, nous avons utilisé la cartographie statistique paramétrique qualitative générale basée sur un modèle linéaire et les modèles mixtes hiérarchiques comparatifs pour les canaux multiples.
Résumé
Les études de neuroimagerie jouent un rôle central dans l’évaluation des affections neurologiques pré-interventionnelles par rapport aux affections post-interventionnelles, comme la réadaptation et le traitement chirurgical. Parmi les nombreuses technologies de neuroimagerie utilisées pour mesurer l’activité cérébrale, la spectroscopie fonctionnelle dans le proche infrarouge (fNIRS) permet d’évaluer les activités corticales dynamiques en mesurant les niveaux locaux d’hémoglobine similaires à l’imagerie par résonance magnétique fonctionnelle (IRMf). En outre, en raison d’une restriction physique moindre dans fNIRS, plusieurs variantes de tâches sensorimotrices peuvent être évaluées. De nombreux laboratoires ont mis au point plusieurs méthodes d’analyse des données du FNIRS; cependant, malgré le fait que les principes généraux sont les mêmes, il n’existe pas de méthode universellement normalisée. Ici, nous présentons les méthodes analytiques qualitatives et comparatives des données obtenues à partir d’une expérience fNIRS multicanal à l’aide d’un plan de bloc. Pour l’analyse qualitative, nous avons utilisé un logiciel pour le NIRS comme approche univariée de masse basée sur le modèle linéaire généralisé. L’analyse NIRS-SPM montre des résultats qualitatifs pour chaque session en visualisant la zone activée pendant la tâche. En outre, le numériseur tridimensionnel non invasif peut être utilisé pour estimer les emplacements des canaux fNIRS par rapport au cerveau. Pour corroborer les résultats du NIRS-SPM, l’amplitude des changements dans les niveaux d’hémoglobine induits par la tâche sensorimotrice peut être statistiquement analysée en comparant les données obtenues à partir de deux sessions différentes (avant et après l’intervention) du même sujet d’étude à l’aide d’un modèle mixte hiérarchique multicanal. Nos méthodes peuvent être utilisées pour mesurer l’analyse pré- vs post-intervention dans une variété de troubles neurologiques tels que les troubles du mouvement, les maladies cérébrovasculaires et les troubles neuropsychiatriques.
Introduction
Neurorehabilitation joue un rôle important dans le rétablissement fonctionnel suivant la perturbation sensorimotrice. Pour clarifier les mécanismes de la récupération fonctionnelle associée à la neuroplasticité, diverses technologies de neuroimagerie ont été utilisées, telles que l’imagerie par résonance magnétique fonctionnelle (IRMf), la tomographie par émission de positons (TEP), l’électroencéphalographie (EEG) et la spectroscopie fonctionnelle dans le proche infrarouge (IRNirs). Différentes modalités d’imagerie présentent différents avantages et inconvénients. Bien que l’IRMf soit l’appareil le plus typique, il est affecté par les champs magnétiques, a un coût élevé, une restriction physique élevée et des tâches sensorimotrices limitées1,2,3,4. Le dispositif fNIRS se distingue comme une neuroimagerie optique non invasive et a une résolution spatiale relativement inférieure, mais il a une meilleure résolution temporelle que l’IRMf4. Le fNIRS convient lors de la vérification des effets du traitement, car il compare les effets pré- et post-intervention, a des tâches motrices dynamiques, est portable et fonctionne davantage dans les environnements naturels que l’IRMf1,2,4. Il a été rapporté que le NIRS est plus approprié dans les domaines des maladies cérébrovasculaires, des troubles épileptiques, des lésions cérébrales graves, de la maladie de Parkinson et des troubles cognitifs1,5. En ce qui concerne les tâches sensorimotrices, il est largement utilisé dans la démarche et l’équilibre debout6,7,8,la fonction des membres supérieurs (préhension de la main, tapotement des doigts)8,9,l’entraînement moteur complexe10,11,la robotique12,13,14,15,et l’interface cerveau-ordinateur16,17,18. Le fNIRS est basé sur les principes de neuroimagerie optique et de couplage neurovasculaire, qui mesurent l’activité métabolique corticale, l’augmentation du flux sanguin, et par conséquent l’activité corticale comme signaux secondaires19. On a signalé que les signaux fNIRS ont de fortes corrélations avec les signaux d’IRMf20dépendant du niveau d’oxygène dans le sang. Un fNIRS à ondes continues utilise la loi de Beer-Lambert modifiée pour déterminer les changements dans les niveaux de concentration corticale d’hémoglobine oxygénée(HbO2)et d’hémoglobine désoxygénée (HHb) en fonction des changements mesurés dans l’atténuation de la lumière proche infrarouge à large bande21,22. Comme il n’était pas possible de mesurer le facteur différentiel de longueur de chemin (DPF) à l’aide du système NIRS à ondes continues, nous avons supposé que le DPF était constant et que les changements de signal d’hémoglobine étaient notés en unités arbitraires de millimole-millimètre (mM x mm)2,18.
Les expériences fNIRS doivent sélectionner les méthodes les plus adéquates, y compris les paramètres de la sonde, les plans d’expérience et les méthodes d’analyse. En ce qui concerne le réglage de la sonde, la méthode internationale 10-20 utilisée dans la mesure EEG est la norme de réglage utilisée par de nombreux chercheurs en neuroimagerie. Au cours des dernières années, des paramètres de coordonnées basés sur le cerveau standard sur la base des coordonnées de l’Institut neurologique de Montréal (INM) ont été utilisés. L’expérience utilise une conception de bloc, généralement utilisée pour les tâches sensorimotrices, et une conception liée aux événements. Il s’agit d’une méthode de comparaison des changements dans la concentration d’hémoglobine au repos et pendant les tâches; Les niveaux de concentration de HbO2 augmentent et les niveaux de concentration de HHb diminuent avec des changements du flux sanguin cérébral lié à l’activité corticale tâche-dépendante. Bien qu’il existe différentes méthodes d’analyse, le logiciel libre NIRS-SPM permet une analyse similaire à la cartographie paramétrique statistique (SPM) de l’IRMf. Le traitement des données nirs utilise une approche univariée de masse basée sur le modèle linéaire général (GLM). Lors de l’analyse de l’activité cérébrale dépendante de la tâche, les mesures fNIRS peuvent être affectées par une activité neuronale évoquée ou non évoquée et des interférences physiologiques systémiques (fréquence cardiaque, pression artérielle, fréquence respiratoire et activité du système nerveux autonome) dans le compartiment cérébral et extracérébral23. Par conséquent, le traitement de pré-analyse, le filtrage, la conversion d’ondelettes et l’analyse en composantes principales sont utiles23. En ce qui concerne le filtrage et les artefacts du traitement des données à l’aide du NIRS-SPM, le filtrage passe-bas9 et la longueur minimale de description des ondelettes (Wavelet-MDL)24 detrending ont été utilisés pour surmonter le mouvement ou d’autres sources de bruit / artefact. Pour plus de détails sur cette méthode analytique, voir le rapport de Ye et coll.25. Bien qu’il existe des rapports utilisant uniquement SPM, il ne s’agit que d’un index qualitatif par analyse d’image, et en raison de la faible résolution spatiale de NIRS, une extrême prudence est requise pour l’analyse de groupe. De plus, lorsque le DPF est constant, des comparaisons numériques entre les canaux et les individus ne doivent pas être effectuées, mais la différence dans les changements dans chaque canal peut être vérifiée. Sur la base des conditions ci-dessus, afin de compléter les résultats de l’analyse de groupe NIRS-SPM, nous avons utilisé la méthode d’analyse originale pour l’analyse multicanal après avoir amélioré la précision de l’enregistrement spatial. Cette analyse multicanal a comparé l’amplitude de la variation des niveaux d’HbO2 et de HHb entre les périodes de repos et de travail à chaque canal avant et immédiatement après le traitement à l’aide de modèles mixtes hiérarchiques avec des interventions fixes (avant ou après), des périodes fixes (repos ou sur la tâche) et des effets individuels aléatoires.
De cette façon, il existe plusieurs méthodes de mesure et d’analyse du FNIRS; toutefois, aucune méthode normalisée n’a été établie. Dans cet article, nous présentons nos méthodes, la cartographie paramétrique statistique qualitative basée sur glm et le modèle mixte hiérarchique multi-niveaux comparatif, pour analyser les données obtenues à partir d’une expérience fNIRS multicanal de pré- vs post-intervention en utilisant une conception de bloc avec des tâches sensorimotrices.
Protocole
Cette étude a été approuvée par le comité d’examen institutionnel (CISR) de l’Université de Fukuoka, au Japon (CISR no 2017M017). Avant la participation, tous les patients ont donné leur consentement éclairé par écrit.
1. Préparation de l’expérience fNIRS
REMARQUE : Un système NIRS à ondes continues multicanal à ondes continues a été utilisé pour cette expérience. Les longueurs d’onde de la lumière proche infrarouge étaient de 780 nm, 805 nm et 830 nm, et le taux d’échantillonnage a été fixé à 7,8 Hz. Le temps et la résolution spatiale (distances entre l’émetteur de lumière et la sonde du détecteur) étaient de 0,13 s et 3,0 cm, respectivement.
- Réglez le dispositif fNIRS dans un endroit sombre et silencieux. Mener des expériences à température ambiante. Démarrez l’instrument fNIRS 30 min avant l’expérience.
NOTA: Les systèmes fNIRS sont utilisés dans des conditions de température et d’humidité contrôlées pour assurer un fonctionnement stable de l’équipement26. - Utilisez un bouchon entier pour l’enregistrement fNIRS et fixez le capuchon sur la tête du sujet de telle sorte que la position correspondant à la centrale (Cz) du système international 10-20 soit située au support n° 245 du capuchon. (Figure 1).
- Fixez l’autocollant de marquage aux points de localisation de référence : le nasion (Nz), le méat auditif externe droit (AR) et le méat auditif externe gauche (AL).
REMARQUE: Étant donné que les coordonnées tridimensionnelles (3D) sont lues autour des positions de l’autocollant de marquage Nz, AR, AL et du support Cz, il est nécessaire de joindre l’autocollant de marquage avant de prendre une photo. - Après l’étalonnage d’un appareil photo numérique haute résolution pour l’enregistrement spatial, prenez des photos de la tête du sujet avec l’emplacement de la sonde tout en montrant les points de référence (Cz, Nz, AR et LR) à partir de 15 perspectives.
REMARQUE: S’il vous plaît prendre une photo avant de placer la sonde. Si une photo est prise après avoir placé la sonde, le repère peut être caché par la sonde et le cordon de câblage. Comme recommandé par le fabricant, après avoir pris 12 photos en diagonale 30° vers l’avant à droite du sujet, prenez trois photos ou plus légèrement au-dessus afin que le Cz (support n ° 245) apparaisse sur la photo. En effet, il est facile de le rendre tridimensionnel lors de la capture d’un total de 15 prises de vue ou plus. - Séparez soigneusement les cheveux du sujet qui interfèrent avec l’optode à l’aide d’une tige en plastique éclairée par diode électroluminescente (LED) pour fixer la sonde. Disposez la sonde de manière à ce que les optodes soient fixées à une distance minimale de la surface du cuir chevelu et en contact avec le cuir chevelu.
REMARQUE: Vérifiez soigneusement s’il y a une pression ou un inconfort pour le patient en raison de la fixation des optodes, en raison de la force croissante des facteurs de confusion systémiques associés à l’activation du système nerveux autonome23. - Disposer le système à 48 canaux avec 32 optodes (16 sources lumineuses et 16 détecteurs; réseau 4 x 4 pour chaque hémisphère) à un capuchon de tête bilatéralement sur les zones frontales et pariétales en tant que régions d’intérêt(Figure 2).
- Démarrez et utilisez le logiciel de numériseur 3D pour déterminer l’enregistrement spatial.
- Après avoir scanné les données d’image d’une tête entière, déterminez la coordonnée spatiale de chaque patient en mesurant automatiquement et enregistrez-les dans le fichier Origine et autres (fichier *CSV).
Remarque : Si les points de coordonnées n’ont pas pu être détectés à partir des images à l’aide de la mesure automatique, entrez le réglage manuellement.
2. Exécutez l’expérience
- Sélectionnez un plan de bloc pour l’expérience, et la tâche peut être n’importe quel mouvement d’intérêt pour l’étude tel que l’ouverture / fermeture de la main, le tapotement des doigts, etc. Dans notre étude précédente, la tâche était les mouvements du coude assistés par robot15.
REMARQUE: Chaque cycle est composé de trois blocs (15 s de repos - 15 s de tâche - 15 s de repos), et chaque patient complète sept cycles dans chaque session. - Faites attendre le participant dans une position confortable jusqu’au signal de départ. Demandez au sujet de fermer les yeux pendant le reste et la tâche.
- Donnez des indices de départ et d’arrêt (c.-à-d. « Répétez la flexion et l’extension du coude », « Arrêtez-vous et détendez-vous »).
Remarque : Ne parlez pas pendant les mesures. Vérifiez soigneusement les artefacts sur l’écran du moniteur pendant les mesures. - Effectuez la tâche de conception de bloc dans la même posture. Une posture verticale avec position debout ou assise est souhaitable pour ne pas déformer le casque.
REMARQUE: Si le patient se sent mal à l’aise après avoir porté le porte-tête pendant une période prolongée, retirez ou desserrez la sonde pendant l’exercice assisté par robot. - Après avoir terminé la mesure NIRS, retirez le porte-tête et l’autocollant de marquage pour mettre fin à l’expérience.
REMARQUE: Vérifiez soigneusement les dommages cutanés au cuir chevelu en raison d’un port prolongé.
3. Analyse GLM qualitative à l’aide du logiciel NIRS-SPM
- Démarrez le NIRS-SPM sur le logiciel MATLAB. Convertir le fichier de données lié à la modification de la concentration d’HbO2 et de HHb acquise à partir du dispositif NIRS dans le format de fichier pour l’analyse NIRS-SPM.
- Choisissez l’option using NIRS system dans le menu contextuel. Sélectionnez le bouton de chargement et choisissez les options de conversion de changement de concentration HbO2 et HHb.
- Détecter l’enregistrement spatial de l’emplacement du canal NIRS. Cochez la case Autonome, puis cochez la case Avec le numériseur 3D.
- Dans À partir de coordonnées réelles à l’espace MNI, utilisez la boîte de dialogue pour choisir _origin. CSV faisant référence au fichier de point de référence de coordonnées et _others. CSV faisant référence au fichier de sondes/canaux de coordonnées.
- Sélectionnez le bouton Inscription. Choisissez les points pour passer à l’estimation spatiale, puis cliquez sur le bouton OK. Cliquez sur le bouton Coordonner l’INM du projet vers le cerveau rendu.
NOTA : La position spatiale des emplacements des canaux du NIRS est estimée à l’aide du modèle de cerveau de l’Institut neurologique de Montréal (INM). - Sélectionnez l’option Vue dorsale et cliquez sur le bouton Enregistrer.
- Dans la section Spécifier le1er niveau, sélectionnez le nom de fichier des données NIRS et le répertoire SPM. Cochez la case hémoglobine; HbO2 ou HHb. Mettez en surbrillance l’option Spécifier la conception' et sélectionnez l’option Sec. Mettez en surbrillance les options Nombre de conditions/essais et entrez le nombre 7.
- Mettez en surbrillance les options Vecteur d’apparition et Durée(s) et entrez un vecteur d’apparition multiplié par la durée des conditions expérimentales comme suit.
REMARQUE: Dans ce cas, le vecteur des heures d’apparition doit être spécifié comme [15:45:285] ou [15 60 105 150 195 240 285]. Le vecteur de durée doit être spécifié comme [15* ones(7,1)] ou [15 15 15 15 15 15 15]. - Pour la déconseillement, sélectionnez le bouton Wavelet-MDL. Utilisez la méthode de précoloration: filtre passe-bas et sélectionnez le bouton hrf, et corrigez la corrélation sérielle, puis sélectionnez le bouton aucun.
- Pour estimer les corrélations temporelles, vérifiez l’analyse individuelle.
Remarque : enregistrez la localisation spatiale des positions de canal fNIRS dans les systèmes de coordonnées MNI individuels sous la forme d’un fichier texte. De même, enregistrez la carte en fonction de la zone de Brodmann (BA) individuelle en tant que fichier texte. - Pour estimer les corrélations temporelles, vérifiez l’analyse de groupe. Le NIRS-SPM a aligné les positions moyennes d’optode du nombre de participants selon le système de coordonnées cérébrales normalisé de l’INM.
- Calculer la carte d’activation en fonction des changements dans le niveau d’hémoglobine pour le cerveau normalisé. Des niveaux de HbO2 et de HHb ont été considérés significatifs à un seuil non corrigé de p < 0,01.
Remarque : les informations gauche/droite ont été retournées dans les côtés droit-affectés pour l’analyse de groupe.
4. Analyse comparative multicanal basée sur un modèle mixte hiérarchique
- Démarrez le logiciel SAS. Convertir le document texte (. TXT) des changements de concentration deHbO2 et HHb dans le fichier de données NIRS traité avec un filtre passe-bas (la fréquence de coupure a été fixée à 0,1 Hz) dans le fichier de valeurs séparées par des virgules du tableur (. CSV).
- Créez les données SAS d’importation (.sas7bdat) à l’aide du programme.
- Sortie du fichier d’importation avec la commande suivante, libname out « Importer le fichier »
- En sortie du fichier pré-intervention et post-intervention pour chaque sujet, exécutez les commandes suivantes dans la SAP Analysis. (Figure 3) Lors de la création du fichier d’importation, donnez un nom qui puisse identifier les informations sur le sujet et avant ou après l’intervention (par exemple, id1 pre, id1 post...)
- Exécutez la commande de données pré- et post-intervention pour chaque canal (ch1-48; HbO2 et HHb) comme suit(figure 4).
- D’après les données obtenues à partir des résultats de sortie, entrez les différences avant et après l’intervention en ce qui concerne les valeurs de changement (différence à la tâche et au repos), au repos et à la tâche (valeurs estimées, limites supérieures et limites inférieures) de chaque canal dans le fichier de classeur de feuilles de calcul (.xlsx).
- De même, entrez les degrés de liberté du numérateur et du dénominateur, la valeur F et la valeur P de l’élément d’interaction du test de type 3 à effet fixe dans le fichier de classeur de feuille de calcul (.xlsx).
- Pour contrôler le taux de fausses découvertes (FDR) dans les tests multicanaux, utilisez les méthodes de Benjamin et Hochberg27 et contrôlez le FDR à une valeur de p < 0,01.
Résultats
Nous présentons ici la rééducation assistée par robot sur laquelle notre groupe travaille actuellement : les effets du biofeedback sur le déficit moteur des membres supérieurs chez les patients ayant subi un AVC aigu. Nous avons inclus 10 patients consentants de course (âge moyen : 66,8 ± 12,0 ans ; deux femmes et huit hommes) qui ont été admis à notre hôpital. À l’étape subaiguë de course, plus de 2 semaines après le début, nous avons évalué l’activité corticale moteur-connexe de ces patients utilisant un système de fNIRS avant et juste après la réadaptation robot-aidée de membre supérieur le même jour. En ce qui concerne les tâches de conception de bloc, ils ont effectué des mouvements de flexion/extension de coude affectés 15x dans les 15 s dans chaque cycle de tâche, et ils ont répété sept cycles de tâche. En outre, six volontaires en bonne santé (âge moyen : 58,7 ± 7,1 ans ; deux femmes et quatre hommes) ont été également inscrits comme commandes pour identifier l’endroit de l’activation corticale tâche-connexe normale pendant les mouvements droit de flexion/prolongation de coude.
La figure 5 montre les résultats de l’analyse de groupe de 10 patients ayant subi un AVC par lesvaleurs de cartographie t-statistiques à l’aide de modèles GLM avec le logiciel NIRS-SPM. Cette méthode a montré une augmentation de l’activité corticale du cortex moteur primaire dans l’hémisphère mesuré immédiatement après la rééducation assistée par robot par rapport à celle d’avant l’entraînement. La collecte de données pré-intervention, l’intervention (exercice assisté par robot) et la collecte de données post-intervention ont été effectuées lors de la seule séance expérimentale le même jour et au même endroit.
La figure 6 montre les résultats de l’analyse de groupe multicanal comparant la pré-intervention à la post-intervention (exercice assisté par robot). Une analyse statistique du modèle mixte hiérarchique à plusieurs niveaux avec le logiciel SAS a été effectuée. On a observé l’activité corticale accrue dans le cortex primaire de moteur après intervention, la même région de cerveau que dans le NIRS-SPM.
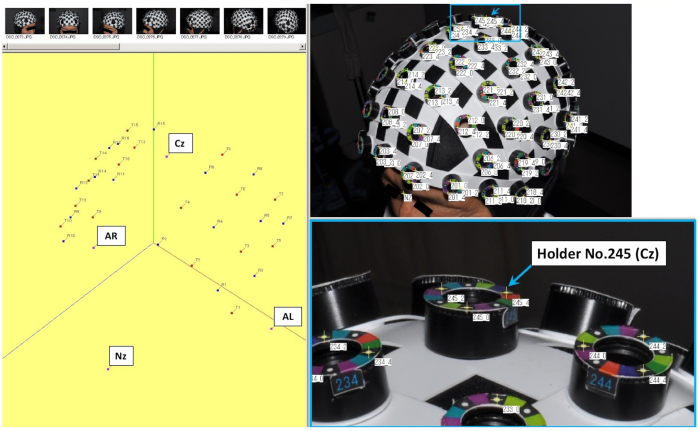
Figure 1: Réglage de l’enregistrement spatial tridimensionnel (3D) et chaque support du bonnet utilisé pour l’enregistrement fNIRS. Le porte-n° 245 indiqué par la flèche sur la figure montre la position centrale (Cz), qui est l’un des axes de coordonnées. Veuillez cliquer ici pour voir une version plus grande de cette figure.
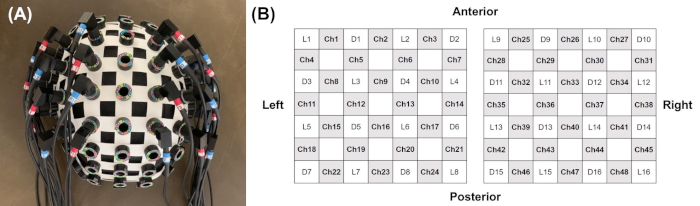
Figure 2: Disposition du système à 48 canaux avec 32 optodes lors de l’enregistrement fNIRS. (A) Emplacement des sondes sur le porte-tête, (B) disposition des 48 canaux et sondes (16 sources lumineuses et 16 détecteurs; réseau 4 x 4 pour chaque hémisphère) à un capuchon bilatéralement sur les zones corticales, en tant que régions d’intérêt. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3: Entrée de commande pour la création de fichiers utilisés dans le logiciel d’analyse SAS. La figure montre comment définir des termes et des valeurs numériques sur l’écran de saisie de commande qui convertit les informations de fichier texte obtenues à partir du fichier NIRS en un fichier CSV Excel, puis les convertit pour l’analyse SAS. L’ID, l’âge, le sexe, le côté ipsilesional, avant et après l’intervention, le temps total, et les périodes de tâche, ont été écrits numériquement. En outre, des informations sur HbO2,HHb, et le niveau total de concentration d’hémoglobine (mM x mm) ont été également entrées. Veuillez cliquer ici pour voir une version plus grande de cette figure.
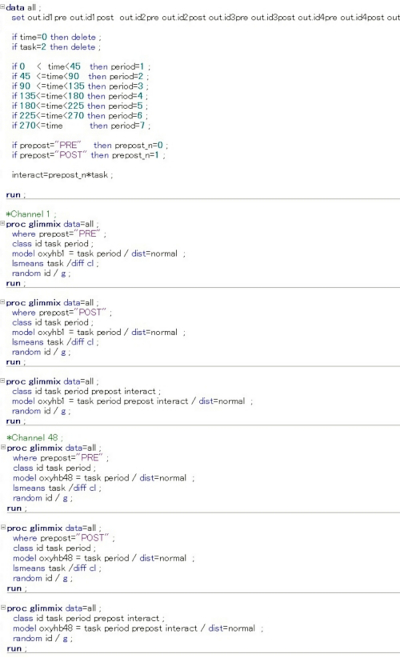
Figure 4: Entrée de commande utilisée pour chaque analyse de canal dans le logiciel d’analyse SAS. Dans ce modèle mixte hiérarchique à plusieurs niveaux, les valeurs numériques suivantes ont été définies et entrées sur l’écran de saisie de commande SAS. L’état au repos (tâche = 0) et à la tâche (tâche = 1) a été comparé, et l’état au moment de la récupération (tâche = 2) a été exclu. En outre, le statut avant l’intervention a été placé à n = 0 et le statut immédiatement après l’intervention a été placé à n = 1, et l’interaction a été étudiée pour des différences statistiquement significatives dans la quantité de changement dansHbO2 et HHb pour chaque canal. Dans la figure, les informations de l’écran de saisie jusqu’à ch2 ou ch47 sont omises. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 5: Les résultats de l’analyse de groupe par les valeurs de mappaget-statistiques à l’aide de modèles GLM avec le logiciel NRS-SPM. L’activité corticale moyenne de tous les patients est représentée sur la vue ci-dessus des modèles standardisés de cerveau. Le supérieur et le bas représentent l’activation corticale dans hbO2 et niveau de HHb, respectivement. L’image de droite indique l’activité corticale des sujets sains pendant les tâches. En comparant la rééducation assistée par robot auparavant, l’activité corticale a été augmentée immédiatement après l’entraînement assisté par robot le même jour. Comparé à d’autres régions corticales, chaque statut exécutant a été sensiblement augmenté (non corrigé, p < 0,01). Les lignes pointillées indiquent la sulcature centrale (CS) sur les images cérébrales normalisées. Ce chiffre a été modifié à partir de Saita et al.15. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 6: Résultat de l’analyse multicanal à l’aide de modèles mixtes hiérarchiques multiniveaux avec le logiciel SAS. L’activité corticale du changement représente la comparaison entre pré-intervention et post-intervention utilisant des traitements de réadaptation assistés par robot. Pour l’image de gauche, les nombres de canaux NIRS ont été superposés au cerveau normalisé selon le système de coordonnées MNI. Pour l’image de droite, le rouge et le bleu indiquent une augmentation et une diminution du niveau d’HbO2, respectivement (FDR corrigé, p < 0,01). Gray indique que les canaux n’ont pas changé de manière significative après la réhabilitation assistée par robot. Ce chiffre a été modifié à partir de Saita et al.15. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Dans nos méthodes analytiques de groupe pour le fNIRS, en plus d’effectuer une méthode d’analyse d’imagerie par des mappages qualitatifs de statistiques t,nous avons comparé pré- et post-intervention (exercice assisté par robot) en utilisant l’analyse multicanal comparative. Pour l’analyse qualitative, nous avons utilisé le logiciel NIRS-SPM comme une approche univariée de masse basée sur le modèle linéaire généralisé. L’analyse NIRS-SPM montre les résultats qualitatifs de chaque session en visualisant la zone activée pendant la tâche. De plus, les informations du numériseur 3D non invasif permettent d’estimer les emplacements des canaux fNIRS par rapport au cerveau. L’analyse de groupe utilisant l’analyse NIRS-SPM a pu capturer les zones d’activation cérébrale rugueuses de l’intervention pré- vs post- pendant les tâches sensorimotrices, mais n’a pas pu comparer la différence dans les changements dans les mêmes canaux. Pour corroborer les résultats du NIRS-SPM, l’amplitude des changements dans les niveaux d’hémoglobine induits par la tâche sensorimotrice peut être statistiquement analysée en comparant les données obtenues à partir de deux sessions différentes (c.-à-d. avant et après l’intervention) chez le même sujet d’étude à l’aide du modèle mixte hiérarchique multicanal. En utilisant ces deux méthodes, les résultats se complètent mutuellement et ont été montrés plus clairement.
Pour obtenir une activité cérébrale précise liée aux tâches par les données NIRS, la conception des tâches, le placement des sondes, le traitement de pré-analyse, les méthodes d’analyse et les paramètres environnementales sont très importants23,26. En ce qui concerne la conception du bloc utilisant des tâches sensorimotrices dans nos études représentatives, nous fixons le temps de tâche et de repos à 15 et 30 s, respectivement15. Il a été signalé que le pic après l’activité et la récupération par temps de repos dépendent de la conception de la tâche. Dans les recherches précédentes, il a été rapporté que la conception de la tâche est souvent de 10-30 s pour les tâches liées au mouvement de la main (tapotement des doigts, tâche de préhension) et de 30 s pour les tâches liées au contrôle de la posture et à la marche7,8,28. Pour les périodes de tâche, il faut environ 5-10 s pour atteindre le pic après le démarrage de l’activation de la tâche8,29, et les périodes de récupération sont favorables avec une variation aléatoire de 15 à 18 s pour éviter les effets d’anticipation et Mayer-Wave28,30. À cet égard, le protocole de tâche de notre recherche est considéré comme approprié et réalisable car il suit la conception de bloc avec mouvement du coude. Cependant, les périodes de tâche peuvent avoir besoin d’être plus longues en fonction de la difficulté de la tâche, comme pour les tâches de marche et les tâches cognitives complexes. En ce qui concerne la disposition de la sonde, le fNIRS a une résolution spatiale plus faible, de sorte que la réorganisation de l’intervention pré- par rapport à l’intervention post- est un problème majeur. Dans notre étude représentative, cette lacune a été compensée par notre conception ne nécessitant pas de déplacement de sonde pour confirmer l’effet immédiat du traitement robotique le même jour. Si un repositionnement est nécessaire, il est important de vérifier la distance entre l’autocollant de marquage et le support à l’aide d’une image pré-capturée pour s’assurer qu’elle n’est pas hors d’agencement par rapport à la pré-intervention. Cependant, dans notre conception, il était insuffisant pour confirmer l’effet de l’interférence physiologique systémique telle que le système nerveux autonome sur l’utilisation du porte-tête par mesure continue pendant une longue période. Il est donc nécessaire d’utiliser à l’avenir la surveillance fNIRS dans le cadre des paradigmes fonctionnels et la surveillance multimodale23. En ce qui concerne le domaine d’intérêt pour la mesure nirs, de nombreuses études NIRS sur le traitement cognitif se sont concentrées sur la mesure de l’activité du cortex préfrontal (PFC) étant donné que le PFC est un domaine clé dans la fonction exécutive et le contrôle cognitif du mouvement31,32. Pour les tâches sensorimotrices, il est important de mesurer la région pariétale afin d’évaluer l’activité sensorielle. La mesure de la région pariétale est cependant sensible aux obstacles tels que les cheveux et le cuir chevelu épais; il est donc nécessaire de configurer soigneusement la mesure. Une limitation de cette méthode expérimentale fNIRS est qu’en raison de la structure du porte-tête, nous avons utilisé la méthode de mesure générale avec une distance d’optode de 3 cm. Cependant, en utilisant des canaux de séparation courts pour calibrer les signaux superficiels ou les bruits, il est possible de mesurer l’activité cérébrale précise33.
En ce qui concerne les méthodes d’analyse de groupe NIRS, comme condition préalable, il est préférable d’analyser attentivement les données personnelles des résultats de mesure NIRS similaires à l’EEG. Une combinaison d’analyses à un seul niveau et au niveau du groupe peut être l’approche optimale23. Bien que le cerveau normalisé soit utilisé pour l’analyse de groupe des données nirs, les limites en ce qui concerne la résolution spatiale inférieure ont été discutées4. Dans cette étude, la méthode d’enregistrement spatial a été conçue et il a été possible de détecter des coordonnées plus précises, ce qui a potentiellement conduit à de meilleurs résultats. Deuxièmement, la présente étude présente des limites quant à la capacité du système NIRS décrit ici. Les valeurs numériques utilisées dans l’analyse sont des valeurs relatives utilisant nirs à ondes continues, et un dispositif tel que le domaine temporel (TD)-NIRS doit être utilisé pour l’évaluation en utilisant les valeursabsolues 34,35. Cependant, td-NIRS est coûteux et présente un inconvénient de ne pas convenir à une telle analyse multicanal. Parce que CW-NIRS est si largement utilisé, nous avons besoin d’une méthode d’évaluation relativement précise qui peut être réalisée pour compenser cette lacune. En tant que processus de pré-analyse, notre analyse des canaux devra également envisager des moyens d’utiliser une analyse en composantes principales supplémentaire pour éliminer ces facteurs de confusion.
À l’avenir, nous rapporterons les résultats du changement dans la pré- vs post-opération de la stimulation cérébrale profonde pour la maladie de Parkinson9, troubles cérébrovasculaires avec spasticité12, et la déficience cognitive36 en utilisant l’application de spectroscopie proche infrarouge. Nos méthodes peuvent être appliquées à une variété de troubles neurologiques tels que les troubles du mouvement, les maladies cérébrovasculaires et les troubles neuropsychiatriques.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts pertinent à la présente étude à divulguer.
Remerciements
Ce travail a été en partie soutenu par la Japan Society for the Promotion of Science (JSPS) Grant-in-Aid for Scientific Research (C) 18K08956 et un fonds de l’Institut central de recherche de l’Université de Fukuoka (n ° 201045).
matériels
| Name | Company | Catalog Number | Comments |
| 3D-digitizer software | TOPCON | - | NS-1000 software ver.1.50 |
| NIRS system | Shimadzu | - | FOIRE-3000 |
| Robot | CYBERDYNE | - | Single-joint type Hybrid Assitive Limb (HAL-SJ) |
Références
- Bonilauri, A., Sangiuliano Intra, F., Pugnetti, L., Baselli, G., Baglio, F. A systematic review of cerebral functional near-infrared spectroscopy in chronic neurological diseases-actual applications and future perspectives. Diagnostics (Basel). 10 (8), (2020).
- Mihara, M., Miyai, I. Review of functional near-infrared spectroscopy in neurorehabilitation. Neurophotonics. 3 (3), 031414(2016).
- Yang, M., Yang, Z., Yuan, T., Feng, W., Wang, P. A systemic review of functional near-infrared spectroscopy for stroke: Current application and future directions. Frontiers in Neurology. 10, 58(2019).
- Pinti, P., et al. The present and future use of functional near-infrared spectroscopy (fNIRS) for cognitive neuroscience. Annals of the New York Academy of Sciences. 1464 (1), 5-29 (2020).
- Obrig, H. NIRS in clinical neurology - a 'promising' tool. Neuroimage. 85, Pt 1 535-546 (2014).
- Fujimoto, H., et al. Cortical changes underlying balance recovery in patients with hemiplegic stroke. Neuroimage. 85, Pt 1 547-554 (2014).
- Herold, F., et al. Functional near-infrared spectroscopy in movement science: a systematic review on cortical activity in postural and walking tasks. Neurophotonics. 4 (4), 041403(2017).
- Leff, D. R., et al. Assessment of the cerebral cortex during motor task behaviours in adults: a systematic review of functional near infrared spectroscopy (fNIRS) studies. Neuroimage. 54 (4), 2922-2936 (2011).
- Morishita, T., et al. Changes in motor-related cortical activity following deep brain stimulation for parkinson's Disease detected by functional near infrared spectroscopy: A pilot study. Frontiers in Human Neuroscience. 10, 629(2016).
- Lee, S. H., Jin, S. H., An, J. The difference in cortical activation pattern for complex motor skills: A functional near- infrared spectroscopy study. Science Reports. 9 (1), 14066(2019).
- Hatakenaka, M., Miyai, I., Mihara, M., Sakoda, S., Kubota, K. Frontal regions involved in learning of motor skill--A functional NIRS study. Neuroimage. 34 (1), 109-116 (2007).
- Saita, K., et al. Combined therapy using botulinum toxin A and single-joint hybrid assistive limb for upper-limb disability due to spastic hemiplegia. Journal of the Neurological Sciences. 373, 182-187 (2017).
- Chang, P. H., et al. The cortical activation pattern by a rehabilitation robotic hand: a functional NIRS study. Frontiers in Human Neuroscience. 8, 49(2014).
- Bae, S. J., Jang, S. H., Seo, J. P., Chang, P. H. The optimal speed for cortical activation of passive wrist movements performed by a rehabilitation robot: A functional NIRS study. Frontiers in Human Neuroscience. 11, 194(2017).
- Saita, K., et al. Biofeedback effect of hybrid assistive limb in stroke rehabilitation: A proof of concept study using functional near infrared spectroscopy. PLoS One. 13 (1), 0191361(2018).
- Mihara, M., et al. Near-infrared spectroscopy-mediated neurofeedback enhances efficacy of motor imagery-based training in poststroke victims: a pilot study. Stroke. 44 (4), 1091-1098 (2013).
- Naseer, N., Hong, K. S. fNIRS-based brain-computer interfaces: a review. Frontiers in Human Neuroscience. 9, 3(2015).
- Mihara, M., et al. Neurofeedback using real-time near-infrared spectroscopy enhances motor imagery related cortical activation. PLoS One. 7 (3), 32234(2012).
- Tak, S., Jang, J., Lee, K., Ye, J. C. Quantification of CMRO(2) without hypercapnia using simultaneous near-infrared spectroscopy and fMRI measurements. Physics in Medicine and Biology. 55 (11), 3249-3269 (2010).
- Strangman, G., Culver, J. P., Thompson, J. H., Boas, D. A. A quantitative comparison of simultaneous BOLD fMRI and NIRS recordings during functional brain activation. Neuroimage. 17 (2), 719-731 (2002).
- Scholkmann, F., et al. A review on continuous wave functional near-infrared spectroscopy and imaging instrumentation and methodology. Neuroimage. 85, Pt 1 6-27 (2014).
- Delpy, D. T., et al. Estimation of optical pathlength through tissue from direct time of flight measurement. Physics in Medicine and Biology. 33 (12), 1433-1442 (1988).
- Tachtsidis, I., Scholkmann, F. False positives and false negatives in functional near-infrared spectroscopy: issues, challenges, and the way forward. Neurophotonics. 3 (3), 031405(2016).
- Jang, K. E., et al. Wavelet minimum description length detrending for near-infrared spectroscopy. Journal of Biomedical Optics. 14 (3), 034004(2009).
- Ye, J. C., Tak, S., Jang, K. E., Jung, J., Jang, J. NIRS-SPM: statistical parametric mapping for near-infrared spectroscopy. Neuroimage. 44 (2), 428-447 (2009).
- Orihuela-Espina, F., Leff, D. R., James, D. R., Darzi, A. W., Yang, G. Z. Quality control and assurance in functional near infrared spectroscopy (fNIRS) experimentation. Physics in Medicine and Biology. 55 (13), 3701-3724 (2010).
- Benjamini, Y., Hochberg, Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing. Journal of the Royal Statistical Society Series B. 57 (1), 289-300 (1995).
- Herold, F., Wiegel, P., Scholkmann, F., Muller, N. G. Applications of functional near-infrared spectroscopy (fNIRS) neuroimaging in exercise(-)cognition science: A systematic, methodology-focused review. Journal of Clinial Medicine. 7 (12), (2018).
- Boden, S., et al. The oxygenation response to functional stimulation: is there a physiological meaning to the lag between parameters. Neuroimage. 36 (1), 100-107 (2007).
- Pinti, P., Scholkmann, F., Hamilton, A., Burgess, P., Tachtsidis, I. Current status and issues regarding pre-processing of fNIRS neuroimaging data: An investigation of diverse signal filtering Methods within a general linear model Framework. Frontiers in Human Neuroscience. 12, 505(2018).
- Udina, C., et al. Functional near-infrared spectroscopy to study cerebral hemodynamics in older adults during cognitive and motor tasks: a review. Frontiers in Aging Neuroscience. 11, 367(2019).
- Verghese, J., Wang, C., Ayers, E., Izzetoglu, M., Holtzer, R. Brain activation in high-functioning older adults and falls: Prospective cohort study. Neurology. 88 (2), 191-197 (2017).
- Yucel, M. A., et al. Short separation regression improves statistical significance and better localizes the hemodynamic response obtained by near-infrared spectroscopy for tasks with differing autonomic responses. Neurophotonics. 2 (3), 035005(2015).
- Torricelli, A., et al. Time domain functional NIRS imaging for human brain mapping. Neuroimage. 85, Pt 1 28-50 (2014).
- Giacalone, G., et al. Time-domain near-infrared spectroscopy in acute ischemic stroke patients. Neurophotonics. 6 (1), 015003(2019).
- Saita, K., et al. Contralateral cerebral hypometabolism after cerebellar stroke: a functional near-infrared spectroscopy study. Journal of Stroke and Cerebrovascular Diseases. 26 (4), 69-71 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon