Method Article
Automatisation d’un protocole de synthèse tomographie par émission de positons (TEP) traceurs radioactifs pour la Production de la clinique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Tomographie par émission de positons (TEP) d’imagerie des sites qui sont impliqués dans plusieurs essais de recherche clinique précoce ont besoin de capacités de fabrication robuste et polyvalent de traceurs radioactifs. En utilisant des traceurs radioactifs [18F] Clofarabine à titre d’exemple, nous illustrons comment automatiser la synthèse d’un radiotraceur utilisant un radiosynthèse souple, axée sur la cassette et valider la synthèse pour l’usage clinique.
Résumé
Le développement de nouveaux marqueurs qui seront tomographie par émission de positons (TEP) permet aux chercheurs et cliniciens afin d’imager un plus large éventail de cibles biologiques et les processus. Toutefois, l’augmentation du nombre de traceurs différents crée des défis pour leur production à radiopharmacie. Bien qu’historiquement il est pratique de dédier un radiosynthèse personnalisé et cellule chaude pour la production répétée de chaque traceur individuel, il devient nécessaire de modifier ce flux de travail. Ces dernières radiosynthesizers commerciales basées sur les cassettes/kits jetables pour chaque traceur simplifier la production des traceurs multiples avec un ensemble d’équipements en éliminant le besoin pour des modifications spécifiques à traceurs personnalisées. En outre, certains de ces radiosynthesizers permettent à l’opérateur à développer et optimiser leurs propres protocoles de synthèse en plus d’acheter des kits disponibles sur le marché. Dans ce protocole, nous décrire la procédure générale de comment la synthèse manuelle d’un nouveau traceur PET peut être automatisée sur l’un de ces radiosynthesizers et validé pour la production des traceurs de cliniques de qualité. À titre d’exemple, nous utilisons la radiosynthèse ELIXYS, un outil flexible radiochimie axée sur la cassette qui peut prendre en charge aussi bien les efforts de développement de traceurs TEP, ainsi que fabrication de routine clinique sonde sur le même système, pour produire [18F] Clofarabine ([ 18 F] CFA), un traceur de PET pour mesurer l’activité enzymatique en vivo déoxycytidine kinase (dCK). Traduire une synthèse manuelle consiste à réduire le protocole synthétique dans les processus de base de radiochimie qui sont ensuite traduits en chimie intuitive « opérations unitaires » pris en charge par le logiciel de synthétiseur. Ces opérations peuvent rapidement être converties en un programme de synthèse automatisée par l’assemblage à l’aide de l’interface de glisser-déplacer. Après les tests de base, la procédure de synthèse et purification peut exiger optimisation pour atteindre le rendement désiré et la pureté. Une fois que la performance désirée est obtenue, une validation de la synthèse est réalisée afin de déterminer son aptitude à la production de la traceurs radioactifs pour l’usage clinique.
Introduction
Une gamme croissante de cibles biologiques peut être visualisée dynamiquement la vie soumet via le système d’imagerie moléculaire PET. PET fournit in vivo des analyses de processus biologiques, biochimiques et pharmacologiques spécifiques en utilisant des radiotraceurs spécifiques (molécules marquées par des radionucléides émetteurs de positrons) qui sont injectées dans l’objet avant l’imagerie1. L’utilisation accrue de PET pour étudier un large éventail de ces processus en science fondamentale et recherche clinique2,3,4et dans la découverte, le développement et l’utilisation clinique des médicaments dans les soins aux patients5, 6, conduit à une demande croissante de radiotraceurs diverse7,8. Pour éviter l’exposition aux radiations à la radiochimiste et d’assurer une production reproductible de ces traceurs de courte durées, ils sont généralement fabriqués en utilisant un radiosynthèse automatisé à l’intérieur d’une cellule « chaude ». Radiosynthesizers ces dernières utilisent une architecture de jetables-cassette/kit pour simplifier la tâche de se conformer à la clinique de qualité fabrication tout en offrant la souplesse nécessaire pour préparer plusieurs types de traceurs radioactifs simplement en échange de cassettes9 . Toutefois, dans les premiers stades cliniques, il n’y a habituellement aucune cassettes/kits disponibles sur le marché pour effectuer la radiosynthèse automatisé ; par conséquent, installations de fabrication de drogue PET luttent pour personnaliser les systèmes à mettre en œuvre des capacités de production cGMP-grade traceur dans un délai approprié et à un coût raisonnable. Ainsi, radiosynthesizers ont été développés qui combinent l’architecture cassette/kit avec des fonctionnalités pour faciliter le développement et l’optimisation des traceurs.
Le FLEX/CHEM ELIXYS (ELIXYS) est un exemple d’un flexible radiosynthèse axée sur la cassette avec une large réaction, solvant et réactif température compatibilité10. Il a trois cuves de réaction et utilise un mécanisme robotique pour configurer dynamiquement la voie fluide tel que requis par n’importe quel protocole de synthèse particulier11. Le logiciel de synthétiseur permet la création de programmes de synthèse (séquences) à traceurs différents par glisser-déplacer des Opérations unitaires tels que Piège Isotope Isotope éluer, Ajouter réactif, réagir, et s’évaporent12. Chaque opération de l’unité a une variété de paramètres programmables disponibles à l’opérateur, comme la durée, la températureou gaz inerte, conduite de pression (pression). En comprenant la nature de chaque opération de l’unité, une synthèse manuelle peut être facilement traduite en une séquence d’opérations unitaires et ensuite être modifiée au cours de l’optimisation du protocole13. En combinaison avec le module ELIXYS PURE/forme, le système intégré peut aussi effectuer une purification automatisée et la formulation du traceur PET. En utilisant cette radiosynthèse, nous avons déjà rapporté la synthèse automatisée de 24 différents 18F marqué traceurs et groupes prosthétiques11,14,15,16, comme ainsi que la radiofluorination enzymatique automatisée des biomolécules17, en changeant simplement les réactifs et pas la configuration du système. D’autres ont montré la synthèse automatisée de [18F] RO6958948 pour l’imagerie du tau neurofibrillaire embrouillent18, la synthèse automatique du groupe prosthétique [18F] F-Py-PTF avec un marquage ultérieur des peptides19 et la synthèse automatisée de [18F] AM580 pour l’imagerie de la phosphodiestérase 10 a (PDE10A)20. En outre, plusieurs groupes ont montré la production des traceurs approprié pour l’usage clinique, y compris 4-[18F] fluorobenzyle-donneurs ([18F] FBnTP) pour l’imagerie de la membrane mitochondriale potentiel21, [ 18 DCFPyL F] pour l’imagerie de membrane prostatique spécifique antigène (LMFP)22et [18F] THK-5351 pour l’imagerie du tau23.
Dans cet article, nous utilisons notre expérience avec [18F] CFA pour illustrer comment une procédure manuelle radiosynthetic peut être carrément et rapidement traduite en une synthèse automatisée convient pour la production systématique suivant les directives GMP cyclique. Le traceur [18F] CFA a été conçu pour l’imagerie de l’activité de dCK. La radiosynthèse Manuel [18F] CFA a été initialement décrite par Shu et al. 24 comme une procédure à l’aide de deux cuves de réaction, purification de cartouche de silice intermédiaire et une purification finale d’HPLC étape (voir Supplementary Material, Section 1 pour plus de détails). Ces dernières in vitro et des études précliniques ont montré la spécificité exceptionnelle de ce traceur à dCK, et première chez l’humain ont démontré la biodistribution favorable25. Il y a un intérêt immédiat dans les études cliniques de plus grande échelle pour confirmer la sensibilité [18F] PET CFA aux variations dans l’activité dCK et un intérêt à plus long terme dans les applications cliniques potentielles de ce traceur26. Il peut être un biomarqueur utile des thérapies qui déclenche l’activation des lymphocytes T, provoquer des dommages à l’ADN ou dépendent des PROMÉDICAMENTS analogue nucléosidique dCK-dépendante. En particulier, [18F] CFA peut permettre la stratification des patients pour une éventuelle réponse au traitement par Clofarabine. [18F] CFA peut également faciliter l’étude et le développement d’inhibiteurs de dCK qui font progresser vers des essais cliniques. Puisque ce traceur a traditionnellement été synthétisé manuellement, faire progresser toutes ces études requiert une synthèse fiable et automatique de [18F] CFA approprié pour l’usage clinique.
Bien que nous avons déjà indiqué une synthèse automatisée de [18F] CFA pour les études précliniques16, ce protocole s’appuie sur ces efforts et décrit les modifications supplémentaires nécessaires à la production clinique de ce traceur, y compris l’intégration de purification entièrement automatisé et la formulation, la validation du protocole et essais de contrôle de la qualité. Les procédures générales décrites ici ne se limitent pas à l’élaboration d’une synthèse automatisée et cliniquement approprié [18F] CFA mais peut être généralisée d’une manière simple d’élaborer des synthèses automatisés appropriés pour l’usage clinique des autres traceurs marqués avec fluor-18.
Protocole
1. général de procédure pour l’automatisation et la Validation d’un protocole de radiosynthèse pour fabrication clinique
-
Analyser l’éligibilité du régime manuel de synthèse pour la fabrication de la clinique
- Effectuer une analyse de risque de contamination du produit avec des résidus chimiques indésirables.
- Éviter la classe 1 des solvants comme le benzène et les remplacer par des solvants de rechange appropriés (classe 2 ou classe 3).
- Éviter les produits chimiques qui seraient difficiles à détecter dans la formulation finale sous forme d’impuretés résiduelles possibles.
- Choisissez les seuls produits chimiques qui sont disponibles dans le commerce au grade de haute pureté (le grade USP ou Ph.Eur. désiré) et sont fournis avec un certificat d’analyse.
- Affiner le schéma de synthèse si des produits chimiques indésirables ou des solvants sont détectés par l’analyse des risques et répéter la section 1.1 jusqu'à ce qu’aucun.
- Effectuer une analyse de risque de contamination du produit avec des résidus chimiques indésirables.
-
Automatiser le protocole de la synthèse
- Si un protocole automatisé pour le traceur utilisant le synthétiseur même a déjà été créé et téléchargé vers un référentiel en ligne, télécharger une copie du programme de synthèse.
- Si un programme de synthèse automatique n’existe pas encore, créez-le.
- À l’aide de papier et un crayon, diviser la synthèse manuelle en étapes de haut niveau (p. ex., séchage/activation [18F] fluorure, chauffage pour faciliter une réaction radiochimique, effectuer une étape de purification, etc..). Plus de décomposer les étapes principales dans le discrets, procédures de base qui sont nécessaires. À titre d’exemple, le schéma de synthèse [18F] CFA est illustré à la Figure 1, l’identification des étapes principales est montrée dans la Figure 2 aet la ventilation dans les processus est montrée dans la Figure 2 b.
- À l’aide de papier et un crayon, mapper chaque processus dans les opérations de l’unité individuelle fournies par le logiciel de synthétiseur. À titre d’exemple, une analyse de la cartographie des procédures de base à la synthèse de [18F] CFA aux opérations de l’unité appropriée dans le synthétiseur logiciel13 est illustré à la Figure 2.
- À l’aide de l’interface de programmation de radiosynthèse, créer un programme vide et ajouter chacune des opérations unité identifiée dans la séquence en cliquant sur le bouton Menu (en haut à gauche) et sélection de séquences, puis en cliquant sur le nouveau Séquence bouton. Pour chaque opération d’unité identifiée à l’étape 1.2.2.2, faites glisser le fonctionnement de l’unité des opérations disponibles pour l’affichage pellicule et le clic ou le type à remplir la valeur désirée de chaque paramètre de l’opération de l’unité. La figure 3 montre un exemple de l’interface lorsque toutes les opérations de synthétiser [18F] CFA ont été peuplés, et l’utilisateur a sélectionné la première opération d’unité réagissent pour modifier les valeurs de paramètre. Le programme de synthèse finale pour [18F] CFA est décrite en Supplementary Material, Tables S1 et S2.
- Vérifiez le programme de synthèse.
- Effectuer un essai à vide. Mettre en place et exécuter le programme tout comme aux étapes 2.1 à 2.3, à l’aide de tous les réactifs et solvants autres que les radionucléides (par exemple, le fluorure [18F]) pour vérifier le comportement attendu.
- Si nécessaire, ajustez les valeurs de paramètre de fonctionnement unité dans le programme (par exemple, la fois ou la pression motrice à transférer complètement un réactif, le temps/température pour évaporer le solvant au niveau souhaité, etc.) et refaites le test. Pour ajuster les valeurs des paramètres, tout d’abord, revenir au mode modifier en choisissant des séquences dans le menu principal (en haut à gauche) et sélectionnez le programme nouvellement créé. Ensuite, cliquez sur l’opération de l’unité souhaitée à l’affichage pellicule (en bas de l’écran), naviguez vers le paramètre souhaité et sélectionnez ou tapez la nouvelle valeur.
- Effectuer un essai de faible activité (< 370 MBq) pour évaluer le programme.
- Optimiser la synthèse automatisée en ajustant les valeurs de paramètre pour améliorer le rendement, le temps de synthèse, répétabilité et tout autre résultat mesurable désirée.
-
Développer des procédures de tests de contrôle de qualité (QC)
- En utilisant une référence non radioactive du produit final et échantillons d’impuretés chimiques potentielles, développer une analyse radio-HPLC et/ou radio-mince méthode de chromatographie (radio-TLC) couche avec une séparation suffisante des espèces pour la détermination de chimique, activité molaire, la pureté radiochimique, identité et la pureté radiochimique. Valider l’ou les méthodes analytique pour la répétabilité et la linéarité et de déterminer les limites de détection et de quantification.
- De même, développer et valider une méthode de chromatographie en phase gazeuse pour analyser les impuretés volatiles (par exemple, des quantités résiduelles de solvants utilisés au cours de la synthèse).
- Élaborer et valider des tests analytiques qui permettent la détection et la quantification des autres impuretés éventuelles (p. ex., cryptand 222 via le test de tache de couleur standard).
- Utiliser des procédures standards pour la détermination de la stérilité, le pH, radionucléidique identité, la pureté radionucléique, concentration de radioactivité, volume produit et niveaux d’endotoxines.
-
Effectue une validation de synthèse
- Établir la norme de fonctionnement (PNF) pour la synthèse et les procédures d’essai de QC et intégrer un matériel et système de suivi de matériel conforme à l’actuelle bonne fabrication exigences de pratique (cGMP).
- Valider les procédures de synthèse via trois production indépendante et consécutives s’exécute les mêmes niveaux de radioactivité destinés à la fabrication clinique suivant les modes opératoires normalisés. Le document la synthèse et les résultats des tests de QC.
- Tous les essais de validation consécutifs doivent passer les limites prédéfinies de QC. Si une validation exécuté échoue, répétez le processus de toute validation après avoir correctement traiter la cause de l’échec.
2. exemple : Automatisé de synthèse de la CFA [18F] pour l’usage clinique
- Préparer la radiosynthèse
- Allumez la radiosynthèse.
- Assurer l’approvisionnement en gaz inerte est allumé avec une pression suffisante et que les vannes nécessaires sont ouvertes afin que la radiosynthèse est connecté à l’alimentation en gaz.
- Installer de nouvelles cassettes jetables dans le réacteur #1 et #2 postes et insérer des récipients contenant des barres magnétiques remuer. Veiller à ce que chaque tube de plongeur de transfert cassette est pointé vers le bas.
- Préparer les flacons et les installer dans les cassettes selon le schéma de la Figure 4.
- Installer un vide [18O] H2O récupération flacon dans la position de la W1 de Cassette #1.
- Activer une cartouche méthylammonium quaternaire (AMQ) d’abord en passant de 12 mL d’une solution de3 KHCO 1 M à travers elle, suivie de 12 mL d’eau désionisée. Conditionner une cartouche de silice Sep-Pak en passant 5 mL d’acétate d’éthyle à travers elle.
- Connecter les cartouches et effectuer tous les raccordements de tube de cassette, comme illustré à la Figure 5 a. Vérifiez qu’aucun tube de cassette (y compris les tubes non utilisés) est suspendu dans l’intérieur, où il peut interférer avec les mouvements robotiques.
- Connectez la ligne d’origine de fluorure [18F] de cyclotron jusqu'à la ligne d’entrée de fluorure [18F] sur Cassette #1.
- Assurez-vous que la poubelle est vide. Place canalisations depuis le sous-système de purification/formulation à la poubelle (c.-à-d., conduite d’écoulement boucle 1 échantillon, conduite d’écoulement sous-système HPLC et la conduite d’écoulement Pompe seringue).
- Connecter les lignes d’entrée de l’HPLC. Phase mobile CLHP place d’entrée ligne « A » dans un contenant de l’acétate d’ammonium 25 mM et la ligne d’entrée de phase mobile CLHP « B » dans un conteneur d’EtOH.
- Equilibrer le sous-système de purification/formulation et colonne CLHP.
- Ouvrez la page de commande pour le module de purification/formulation dans le logiciel HPLC en sélectionnant dans le menu principal (en haut à gauche). Par défaut, l’onglet de Purification est déjà sélectionné. (Cette page est illustrée à la Figure 6).
- Régler le débit à 5,0 mL/min à la composition du solvant définie et choisir quelle position de colonne, la colonne de purification est installée dans. Allumer la pompe HPLC en mode isocratique pendant au moins 10 min.
- Rincer la ligne de produits et de toutes les conduites de collecte fraction avec la phase mobile, chacun pendant 1 min.
- Rincer chaque boucle d’échantillonnage HPLC et le transfert de l’HPLC boucle échantillon tube 10 ml de la phase mobile à l’aide d’une seringue.
- Connecter les lignes d’entrée de pompe seringue de purification/formulation sous-système. Utilisation concentrée de chlorure de sodium (90 mg/mL) pour la ligne d’élution et salin de 0,9 % pour la ligne de reconstituer .
- Amorcer le sous-système de formulation.
- Accédez à l’onglet de la Formulation de la page de contrôle de purification/formulation.
- Pour amorcer le chlorure de sodium concentré (90 mg/mL), sélectionnez l’onglet élution . presse Initialize pour initialiser le pousse-seringue. Diluer 5 mL.
- Pour amorcer le salin de 0,9 %, sélectionnez la reconstituer onglet verser 5 mL.
- Connecter les lignes de produit et le produit Final de l’avant du sous-système purification/formulation dans une T-connection. Connectez la sortie de la T-connection à un filtre stérile (0,22 µm) qui, à son tour, est relié à la fiole de produit stérile final. Insérer une aiguille de ventilation avec un filtre stérile dans l’espace vide de la fiole de produit final. Une photographie de la mise en place définitive du système est illustrée à la Figure 5 b.
- Ajouter la glace sèche et EtOH ou MeOH au piège froid.
- Exécutez le programme de synthèse
- Accédez à la liste des programmes en sélectionnant des séquences dans le bouton du menu principal (en haut à gauche). Sélectionnez le programme CFA [18F] et lancer le programme en appuyant sur le bouton exécuter .
- Soigneusement passer par chaque élément de la liste de contrôle avant exécution et cochez comme ils sont terminés. Partie de l’écran de liste de contrôle avant exécution est illustrée à la Figure 7.
- Appuyez sur Continuer pour confirmer que la configuration est terminée et provoquer la synthèse automatisée commencer.
- Si vous le souhaitez, suivre la synthèse en temps réel via une rétroaction visuelle (caméras de réacteur), lectures de capteurs (température, pression, vide, lecture de rayonnement, etc.) et compte à rebours. Une capture d’écran représentant est illustré à la Figure 8.
- Au cours de l’opération d’unité de Purification , sélectionnez produit quand le pic de produit a commencé à apparaître sur le chromatogramme de détecteur de rayonnement. Une capture d’écran représentant au cours de cette opération de l’unité (contenant un chromatogramme du détecteur UV et détecteur de rayonnement de sortie) est illustré à la Figure 9.
- Une fois le pic de chromatogramme de détecteur de rayonnement a renvoyé à la ligne de base, sélectionnez des déchets pour détourner de la voie d’acheminement du sous-système HPLC à la poubelle.
- Mettre en place et diriger le programme de la Formulation
- Dans la liste des programmes (séquence d’écran), ouvrez le [18F] Formulation CFA programme.
- Ajustez les paramètres de l’opération d’unité de formulation.
- Calculer le volume de la fraction de produits collectés (fractionde V) basé sur le débit de pompe HPLC et la durée de la collecte de la fraction.
- Calculer le volume supplémentaire de chlorure de sodium (90 mg/mL) nécessaire pour obtenir isotonicity et calculer le montant d’une solution saline supplémentaire nécessaire pour diluer la concentration EtOH inférieure à 10 %.
- Modifier le programme avec ces valeurs. Le volume de chlorure de sodium (90 mg/mL) est entré à l’étape d’élution et le volume de solution saline est entré à l’étape de reconstituer . (Les calculs sont décrits dans le Matériel complémentaire, Figure S2.)
- Enregistrez le programme.
- Exécutez le programme. Le système va diluer la fraction recueillie produit purifié avec du chlorure de sodium et une solution saline pour assurer l’isotonicity de la formulation et le livrer à travers un filtre stérilisant dans le flacon de produit stérile.
- À frais virés formulé [18F] CFA pour contrôle de la qualité et l’expédition
- Retirer le produit CFA formulé [18F] de la cellule chaude.
- En utilisant des techniques de travail stérile, retirer deux échantillons (300 µL) pour réaliser les essais de contrôle de la qualité.
- Utilisez le premier échantillon pour tester pour la stérilité de la formulation finale en inoculant des médias thioglycolate fluide et bouillon trypticase soja pendant 14 jours sans observer aucune croissance.
- Utiliser le second échantillon pour effectuer le contrôle de la qualité selon les procédures mises en place dans l’étape 1.3. Les procédures établies à l’UCLA Ahmanson biomédicale Cyclotron installation conformément à la pharmacopée américaine sont décrites ci-dessous.
- Évaluer l’aspect par inspection visuelle.
- Évaluer un papier indicateur de pH.
- Évaluer le contenu d’endotoxine bactérienne à l’aide d’une cinétique chromogénique bactérienne endotoxines Test (BET).
- Permettre une identification radiochimique avec radio-HPLC analytique en vérifiant l’élution Co de l’échantillon radioactif et un composé de référence non radioactif.
- Évaluer la pureté radiochimique avec radio-HPLC analytique en comparant l’aire sous la courbe (AUC) d’impuretés radioactives dans le chromatogramme de gamma-détecteur avec les AUC correspondant au produit souhaité.
- Évaluer la pureté chimique avec HPLC analytique en déterminant les AUC dans le chromatogramme DETECTEUR UV de toutes les impuretés de l’UV-active.
- Évaluer l’activité molaire et masse porteuse avec radio-HPLC analytique en déterminant l’AUC correspondant au produit souhaité dans le chromatogramme DETECTEUR UV.
- Évaluer la demi-vie de la sonde en mesurant son activité en deux points différents et d’ajuster une courbe de décroissance.
- Évaluer la teneur en solvants résiduelle de la formulation par chromatographie en phase gazeuse.
- Évaluer l’énergie de radionucléides en utilisant un spectromètre gamma.
- Évaluer le contenu de cryptand 222 en utilisant un test de spot sur TLC.
- Si tous les tests passent, relâchez la formulation de la sonde pour l’expédition vers le site d’imagerie clinique.
- Post-run et système de fermeture
- Rincer la colonne de purification HPLC et tous les tubes utilisés pour la collecte des produits avec 70 % (v/v) EtOH dans l’eau. Cela devrait être fait avec la page de contrôle PURE/forme, semblable à l’étape 2.1.12.
- Arrêtez la radiosynthèse via le bouton d’alimentation sur le logiciel. Une fenêtre contextuelle indique lorsque la puissance du système peut être désactivée.
- Coupez l’alimentation d’air comprimé et de gaz inerte en fermant les vannes d’arrêt approprié.
- Patientez pour la radioactivité résiduelle dans la cellule chaude à la pourriture (généralement la nuit).
- Nettoyer la radiosynthèse
- Retirer et éliminer toutes les cassettes, cartouches, flacons de réacteur et les flacons de réactifs utilisés au cours de la synthèse.
- Vider le contenu du piège froid.
- Nettoyer les chemins d’accès du sous-système de purification fluide.
- Ouvrez un programme de nettoyage existant ou créer un nouveau programme qui contient une seule opération d’unité de Purification en mode de nettoyage (avec la case à cocher nettoyer sélectionné). Voir Du matériel supplémentaire, Figure S9 pour obtenir un exemple.
- Sur la page de configuration de paramètre, sélectionnez la colonne qui a été utilisée pour la purification et la ligne d’entrée de phase mobile HPLC qui est reliée à une bouteille contenant 70 % EtOH dans l’eau. Programmer un débit de 2 mL/min, une durée de rinçage pour chaque boucle d’injection de 5 min et une durée de rinçage pour chaque sortie de produit et de la fraction de 30 s. Sélectionnez Lignes sèches et programmer une durée de 30 s.
- Placez toutes les sorties de ligne de fraction dans un conteneur à déchets grand.
- Exécutez le programme.
- Après l’achèvement, vider la poubelle.
- Nettoyer les chemins d’accès du sous-système de formulation fluide.
- Ouvrez un programme existant ou créez un nouveau programme qui contient une opération d’unité de Formulation en mode de nettoyage (avec la case à cocher nettoyer sélectionné sous l’onglet nettoyage ). Voir Du matériel supplémentaire, Figure S10 pour obtenir un exemple.
- Remplir un réservoir propre dilution (à l’avant du sous-système purification/formulation) avec 100 mL d’éthanol.
- Placer le sous-système de purification/formulation élution d’entrée ligne dans un réservoir de EtOH (contenant > 50 mL d’EtOH).
- Placez les lignes d’entrée/rincer et reconstituer dans un conteneur à déchets ainsi que la ligne de sortie du produit final.
- Exécutez le programme.
- Après l’achèvement, vider la poubelle.
Résultats
Une méthode pour automatiser la production de [18F] CFA a été mis au point et trois lots de validation ont été synthétisés. Synthèse, la purification et formulation de [18F] CFA a été atteint en 90 ± 5 min (n = 3) et le rendement radiochimique non corrigées à la désintégration était de 8,0 ± 1,4 % (n = 3). Les rendements de l’activité des trois étaient 3.24 GBq, 2,83 GBq et 3.12 GBq, à partir de 34,3 GBq, 41,8 GBq et 41,1 GBq, respectivement. Les formulations de CFA obtenus [18F] passé tous les tests de contrôle de la qualité (tableau 1). Le protocole automatisé est actuellement utilisé pour la production de qualité clinique [18F] CFA pour appuyer les essais cliniques.
| Données de contrôle de la qualité | Exécution 1 de validation | Validation, 2e manche | Exécution 3 de validation |
| [exigence de « Pass »] | |||
| Apparence | Pass | Pass | Pass |
| [clair, incolore, exempt de particules] | |||
| Concentration de radioactivité à EOS | 213 MBq/mL | 210 MBq/mL | 180 MBq/mL |
| [≤ 740 MBq/mL @ EOS] | |||
| pH | 6 | 5.8 | 6 |
| [5.0-8.0] | |||
| Half-Life | 115 min | 108 min | 112 min |
| [105-115 min] | |||
| Pureté radiochimique | 99 % | 99 % | 99 % |
| [> 95 %] | |||
| Radiochimie identité par temps de rétention relatif (RRT) | 1.01 | 1.01 | 1.01 |
| [1,00 < RRT < 1.10] | |||
| Activité molaire | 314 GBq/µmol | > 370 GBq/µmol | > 370 GBq/µmol |
| [≥ 3,7 GBq/µmol] | |||
| Masse totale de transporteur dans le produit final | 3,1 µg | < 1 µg | < 1 µg |
| [≤ 50 µg/dose] | |||
| Masse totale d’impuretés dans le produit final | ND | ND | ND |
| [≤ 1 µg / dose] | |||
| Volume d’injection admissible maximale basée sur transporteur total masse ≤ 50 µg/dose et impureté total masse ≤ 1 µg/dose | Lot entier | Lot entier | Lot entier |
| Teneur résiduelle en EtOH par GC | 8,90 % | 9,50 % | 9,60 % |
| [≤ 10 %] | |||
| Teneur résiduelle en EtOAc par GC | < 1 ppm | < 1 ppm | < 1 ppm |
| [≤ 5000 ppm] | |||
| Teneur résiduelle en MeCN par GC | < 1 ppm | < 1 ppm | < 1 ppm |
| [≤ ppm 410] | |||
| K222 résiduelle par spot test des couleurs | Pass | Pass | Pass |
| [< 50 µg/mL] | |||
| Test d’intégrité membranaire filtre | Pass | Pass | Pass |
| [bulle point 50psi ≥] | |||
| Endotoxines bactériennes | Pass | Pass | Pass |
| [≤ 175 EU/lot] | |||
| Pureté radionucléique par spectroscopie gamma | Pass | Pass | Pass |
| [> 99,5 %] | |||
| Stérilité | Pass | Pass | Pass |
| [exigences USP < 71 >] |
Tableau 1 : données d’essais de contrôle de la qualité (CQ) sommaires pour les trois lots de validation. EOB = fin du bombardement ; EOS = fin de synthèse ; ND = non détecté.

Figure 1 : schéma de radiosynthèse CFA [18F]. TEM = Monomethoxytrityl. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : traduction d’une synthèse manuelle dans une séquence automatique des opérations unitaires. (A), ce tableau donne un aperçu des étapes principales dans la synthèse manuelle [18F] CFA. (B), ce panneau montre les procédures de base nécessaires pour accomplir chacune des étapes de haut niveau. (C) opérations unitaires de radiosynthèse spécifique utilisées pour effectuer les procédures de base sont affichées sous forme de cartes. Chaque opération de l’unité possède son propre ensemble de valeurs de paramètre (indiqué comme l’a souligné) qui sont configurés par le biais du logiciel. La notation « R1 » et « R2 » indiquent les cuves de réaction #1 et #2, respectivement. Les réactifs correspondant aux numéros de réactif sont identifiés dans la Figure 4. La série d’opérations unitaires est enregistrée sous forme de séquence et exécutée par le logiciel pour effectuer la synthèse automatisée. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : capture d’écran de l’interface du logiciel radiosynthèse (ELIXYS) pour créer un programme de synthèse. Opérations unitaires sont placées dans l’ordre souhaité sur la pellicule à l’aide d’une interface de glisser-déplacer. Cette capture d’écran, une opération d’unité réagir est sélectionnée, et valeurs de ses paramètres modifiables sont indiquées dans la partie principale de l’écran. Dans cet exemple, la réaction de fluoration s’effectuera dans le réacteur #1 (scellé) à 120 ° C pendant 10 min en remuant actif. Le navire est refroidi à 35 ° C une fois écoulé le temps de réaction. Détails des valeurs de paramètre qui peuvent être programmés pour les autres opérations unitaires sont indiqués dans le Matériel supplémentaire, l’article 3. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : capture d’écran de l’écran de configuration réactif. Pour la séquence de synthèse [18F] CFA, tous les réactifs sont chargés dans la cassette jetable #1, qui s’affiche en surbrillance dans la zone de sélection de composant. Pour la synthèse CFA [18F] décrite ici, éluant est 1,0 mg de K2CO3 + 5,0 mg de K222 à 0,4 mL de H2O/0.5 mL de MeCN, précurseur est de 6 mg de précurseur de la CFA à 0,6 mL de MeCN et Phase Mobile CLHP est 85:15 v éthanol : / v 25 mM d’ammonium acétate. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Radiosynthèse Set-up pour la synthèse de [18F] CFA. (A) il s’agit d’un schéma montrant les chemins fluide de la cassette, les connexions aux cartouches et la connexion de transfert final produit brut provenant du module de radiosynthèse au module purification/formulation. (Les deux modules sont contrôlés avec une interface unique de l’ordinateur et des logiciels). (B) il s’agit d’une photographie de la radiosynthèse à l’intérieur d’une cellule chaude après la préparation pour la synthèse de CFA [18F]. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : capture d’écran de l’interface de contrôle de module de purification/formulation. Cet écran est accessible par l’opérateur de contrôler manuellement les sous-systèmes HPLC et formulation lors de l’installation de synthèse. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 7 : écran de la liste de contrôle avant exécution. L’opérateur a entré le numéro de série des cassettes installé dans le système et doit cocher chaque point pour s’assurer que le système a été correctement configuré et préparé pour la synthèse. En plus de ces sections, l’opérateur est également invité pour un nom et une description de la synthèse exécutent (Section 1), et beaucoup des numéros pour tous les réactifs utilisés (Section 2) et est invité à vérifier tous les flux vidéo de réacteur fonctionnent correctement (Section 6). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 8 : Capture d’écran du logiciel lors de l’exécution de la séquence de synthèse [18F] CFA radiosynthèse. Le logiciel affiche l’ordre des opérations de l’unité dans la zone de la pellicule. Opérations terminées sont grisées et surlignées en blanc, l’opération en cours est affichée en gris et les opérations à venir sont indiquées en gris foncé. La zone centrale de l’écran montre le statut de l’unité active, y compris quel sous-commande est en cours d’exécution, ainsi que le statut courant du système (réacteur flux vidéo et données du capteur). Ce particulier réagir opération unitaire est la réaction de la fluoration. Dans la zone de la température , la température actuelle du réacteur s’affiche à côté de la température de consigne (programmé). Dessous, la zone d’activité affiche les valeurs de capteur de rayonnement par les trois capteurs associées à l’étape de la réaction. Enfin, une vidéo d’alimentation sur la gauche montre une vue en direct de la cuvette de réacteur. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
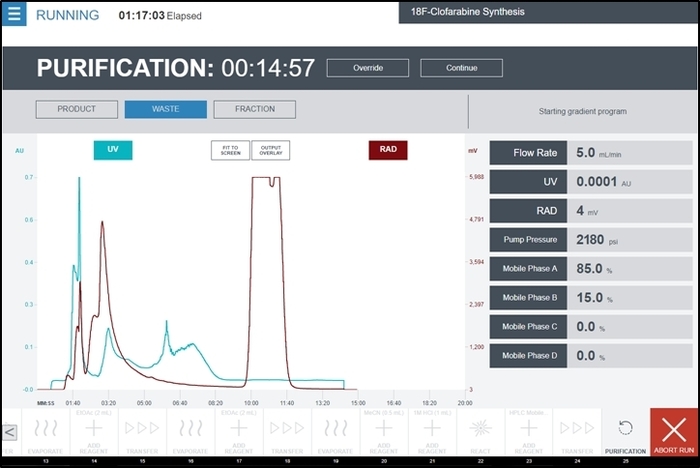
Figure 9 : Capture d’écran de l’interface utilisateur de radiosynthèse lors de l’exécution de l’opération d’unité de Purification au cours de la synthèse [18F] CFA. Détecteur UV the et détecteur de radiations sorties du module purification/formulation sont affichés sur le graphique central en temps réel. Commentaires additionnels des détecteurs et pompe HPLC sont indiqués sur le côté droit de l’écran. L’opérateur collecte le maximum de produit choisi temporairement un produit quand le sommet commence à apparaître, puis de passer à déchets après que le pic complet a été vu. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ce protocole définit les étapes de base qui devraient être prises lors de l’automatisation d’un protocole de synthèse manuelle pour réaliser la production de formulation de traceur de grade clinique. Le cycle de développement complet, y compris le développement du contrôle de la qualité, est illustré par les traceurs radioactifs [18F] CFA (pour l’imagerie de l’activité de dCK). Une attention particulière a été payée à la modification de la synthèse automatisée pour assurer les qualités de traceur pour l’usage clinique. La synthèse implique des procédures de base tels que l’activation de fluorure [18F], radiofluorination de la molécule précurseur, cartouche intermédiaire purification, enlèvement de groupe protecteur et semi-préparative purification HPLC et formulation pour l’injection. Ces procédures de base comprennent un répertoire standard qui est suffisant pour la synthèse de la grande majorité des traceurs 18marqués F PET.
Tout en concevant la synthèse, le choix des réactifs et leur assurance de la qualité est d’une importance particulière pour l’usage clinique. Assurer la programmation correcte et les connexions appropriées en effectuant une synthèse simulacre (solvants uniquement) est indispensable pour éliminer les erreurs inattendues lors de la synthèse est réalisée par la radioactivité. Les optimisations de synthèse subséquente (solvants, volumes, quantités, températures, temps de réaction et des conditions de purification) dépendent du traceur de PET spécifique dans le développement. Au cours de ces expériences, mettant l’accent devrait être brillé sur la pureté chimique et radiochimique du produit final qui peut être atteint, car ceux-ci doivent satisfaire des exigences strictes pour l’usage clinique. Une synthèse qui produit fiable un pur produit des rendements de l’activité plus faible mais suffisante est généralement préférée à un processus à haut rendement qui présente un risque d’échouer de façon sporadique. Une fois que la synthèse a été optimisée de façon adéquate, le processus final doit subir des tests de validation (une exigence réglementaire) pour s’assurer de la pertinence clinique. La méthode validée de synthèse peut ensuite servir pour produire le traceur de PET pour l’usage clinique. Lors synthétisant un traceur PET selon une méthode validée, les modes opératoires normalisés doivent être soigneusement observées. Pour assurer le respect, le logiciel est programmé pour avoir l’opérateur confirme l’achèvement des étapes clés via une liste de contrôle avant exécution après avoir cliqué sur exécuter pour démarrer la synthèse. Alors que le système va effectuer la synthèse de manière automatisée, l’étape de purification nécessite une intervention manuelle. L’opérateur doit, par conséquent, observez bien l’écran par chromatographie en phase au cours de l’étape de purification HPLC et saisir manuellement en temps réel lorsque de début et de fin de collecte de la fraction du produit.
Dans nos efforts d’automatisation et d’optimisation pour la synthèse CFA [18F], nous avons simplifié la méthode de purification HPLC semi-préparative du mélange produit à l’aide d’un système de solvant injectable composé de solution d’acétate d’ammonium et EtOH ; notre méthode précédente impliquait une étape supplémentaire d’échanger le solvant après purification16. Processus de l’élaboration subséquente, ainsi, besoins qu’à réduire la teneur en EtOH de la fraction recueillie aux niveaux autorisés, tout en assurant son isotonicity, qui peuvent être accomplis par dilution. L’étape de la formulation a été réalisée à l’aide d’un deuxième programme consistant en une seule opération d’unité de Formulation pour permettre des ajouts de volume variable de NaCl-solutions pour la fraction de produit purifié le via le module de formulation tenir compte de la variable volume obtenu après purification HPLC. Si le volume de fraction de produits collectés est réglé pour être constant au lieu de cela, l’opération d’unité Formulation pourrait figurer dans le programme principal de synthèse, évitant la nécessité d’un programme indépendant. Une autre approche pour éviter une intervention manuelle serait d’utiliser toutes les fonctionnalités du module formulation (p. ex., diluer le traceur purifié avec de l’eau, piéger sur une cartouche d’extraction en phase solide de C18, lavez-le, il éluer avec un volume fixe de EtOH et enfin, diluez-la avec un volume déterminé de solution saline).
La technique présentée ici pour l’automatisation et la validation d’un protocole de synthèse pour l’usage clinique est destinée à être tout à fait générale. Par le choix de radiosynthèse (ELIXYS), un large éventail de synthèses peut être automatisé et validé. Cela inclut les complexes pot 3 synthèses, ou synthèses impliquant des températures élevées de solvants volatils. Optimisation de la synthèse est possible en changeant les paramètres du logiciel. Le synthétiseur a des caractéristiques à surveiller l’impact des changements, tels que les cuves de réaction pour le prélèvement d’échantillons pour analyse radio-TLC ou radio-HPLC de positionnement. Cependant, sans les modifications du système, le système actuellement ne permet pas pour le traitement des volumes de réactifs très faible (environ 5-20 µL), distillation du produit intermédiaire ou la manipulation de [18F] AlF, 68Ga, ou autres radiometals. Si la synthèse manuelle à automatiser contient les mesures et qu’ils ne puissent être contournées, automatisation et validation par rapport à une autre plate-forme de radiosynthèse peuvent être appropriés.
Bien que ce travail a porté sur l’élaboration d’un protocole pour la production automatisée de [18F] CFA pour l’usage clinique, la synthèse de nombreux autres traceurs TEP pourrait être automatisée d’une manière convenable pour la production de la clinique, suivant la même logique et Méthodes. Suivant la méthode présentée ici, nous avons aussi adapté la synthèse automatisée de 9-(4-[18F] fluoro - 3-[hydroxyméthyl] butyl) guanine ([18F] FHBG) et validé pour l’usage clinique. Protocoles établis à l’utilisateur peuvent être téléchargés vers et téléchargés sur le réseau de sonde SOFIE, un portail web pour le partage de programmes de synthèse et associés documentation parmi radiopharmacie différents sites27. Cela peut éviter une duplication des efforts de la communauté et faciliter des études cliniques multicentriques de TEP.
Déclarations de divulgation
Les régents de l’Université de Californie ont une licence de technologie à SOFIE qui a été inventé par Jeffrey Collins et R. Michael van Dam et ont pris des actions dans SOFIE dans le cadre de l’opération de délivrance de licences. Par ailleurs, R. Michael van Dam est fondateur et consultant de SOFIE. Les conditions de cette entente ont été examinées et approuvées par l’Université de Californie, Los Angeles, conformément à sa politique de conflit d’intérêts. Eric Schopf et Christopher Drake sont employés et actionnaires de SOFIE.
Remerciements
Ce travail a été soutenu en partie par le National Cancer Institute (R44 CA216539) et la Fondation de UCLA provenant d’un don fait par Ralph et Marjorie Crump pour l’UCLA Crump Institut d’imagerie moléculaire.
matériels
| Name | Company | Catalog Number | Comments |
| ELIXYS FLEX/CHEM | Sofie (Culver City, CA, USA) | 1010001 | Radiosynthesizer |
| Radiosynthesizer cassette | Sofie (Culver City, CA, USA) | 1861030400 | Cassette for ELIXYS FLEX/CHEM |
| ELIXYS PURE/FORM | Sofie (Culver City, CA, USA) | 1510001 | Radiosynthesizer purification module |
| [O-18]H2O | IBA RadioPharma Solutions (Reston, VA, USA) | IBA.SP.065 | >90% isotopic purity |
| [F-18]fluoride in [O-18]H2O | UCLA | N/A | Produced in a cyclotron (RDS-112; Siemens; Knoxville, TN, USA) by the (p,n) reaction of [O-18]H2O. Bombardment at 11 MeV using a 1 mL tantalum target with havar foil. |
| Deionized water | UCLA | N/A | Purified to 18 MΩ and passed through 0.1 µm filter |
| Acetonitrile (MeCN) | Sigma-Aldrich (St. Louis, MO, USA) | 271004 | Anhydrous, 99.8% |
| Ethanol (EtOH) | Decon Laboratories, Inc. (King of Prussia, PA, USA) | 2701 | Anhydrous, 200 proof |
| Sodium hydroxide (NaOH) solution | Merck (Burlington, MA, USA) | 1.09137.1000 | 1M solution |
| Hydrochloric acid (HCl) solution | Fisher Chemical (Hampton, NH, USA) | SA48-500 | 1M solution |
| Ethyl acetate (EtAc) | Fisher Chemical (Hampton, NH, USA) | E195SK-4 | HPLC grade |
| Sodium chloride (NaCl) | Fisher Chemical (Hampton, NH, USA) | S-640-500 | USP grade |
| Ammonium acetate | Fisher Chemical (Hampton, NH, USA) | A639-500 | HPLC grade |
| Potassium carbonate (K2CO3) | Fisher Chemical (Hampton, NH, USA) | P-208-500 | Certified ACS |
| CFA precursor | CalChem Synthesis (San Diego, CA, USA) | N/A | Custom synthesis |
| Cryptand 222 (K222; Kryptofix 2.2.2) | ABX Advanced Biochemical Compounds (Radeberg, Germany) | 800.1000 | >99% |
| Sodium chloride (NaCl) solution (saline) | Hospira (Lake Forest, IL, USA) | 0409-4888-02 | 0.9%, for injection, USP grade |
| Silica cartridge | Waters (Milford, MA, USA) | WAT051900 | Sep-pak Classic |
| Quaternary methylammonium (QMA) cartridge | Waters (Milford, MA, USA) | WAT023525 | Sep-pak Light Plus |
| Sterile syringe filter (0.22 µm) | Millipore Sigma (Burlington, MA, USA) | SLGSV255F | Millex-GV |
| Glass V-vial (5 mL) | Wheaton (Millville, NJ) | W986259NG | Used for reaction vessels |
| Septa | Wheaton (Millville, NJ) | 224100-072 | Used for reagent vials |
| Crimp cap | Wheaton (Millville, NJ) | 224177-01 | Used for reagent vials |
| Amber serum vial (2 mL) | Voigt (Lawrence, KS, USA) | 62413P-2 | Used for reagent vials |
| Magnetic stir bar | Fisher Scientific (Hampton, NH, USA) | 14-513-65 | Used for reaction vessels |
Références
- Phelps, M. E. Positron emission tomography provides molecular imaging of biological processes. Proceedings of the National Academy of Sciences. 97 (16), 9226-9233 (2000).
- Kitson, S., Cuccurullo, V., Ciarmiello, A., Salvo, D., Mansi, L. Clinical Applications of Positron Emission Tomography (PET) Imaging in Medicine: Oncology, Brain Diseases and Cardiology. Current Radiopharmaceuticalse. 2 (4), 224-253 (2009).
- Sengupta, D., Pratx, G. Imaging metabolic heterogeneity in cancer. Molecular Cancer. 15, 4(2016).
- Rabinovich, B. A., Radu, C. G. Imaging Adoptive Cell Transfer Based Cancer Immunotherapy. Current Pharmaceutical Biotechnology. 11 (6), 672-684 (2010).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. British Journal of Clinical Pharmacology. 73 (2), 175-186 (2012).
- Hargreaves, R. The Role of Molecular Imaging in Drug Discovery and Development. Clinical Pharmacology & Therapeutics. 83 (2), 349-353 (2008).
- Radiosynthesis Database of PET Probes (RaDaP). , Available from: http://www.nirs.qst.go.jp/research/division/mic/db2/ (2017).
- 18F-Database of Imaging Radiolabelled Compounds (DIRAC). , Centre National de la Recherche Scientifique. Available from: http://www.iphc.cnrs.fr/dirac/ (2013).
- Keng, P. Y., Esterby, M., van Dam, R. M. Emerging Technologies for Decentralized Production of PET Tracers. Positron Emission Tomography - Current Clinical and Research Aspects. Hsieh, C. -H. , InTechOpen. London, UK. 153-182 (2012).
- Lazari, M., Irribarren, J., Zhang, S., van Dam, R. M. Understanding temperatures and pressures during short radiochemical reactions. Applied Radiation and Isotopes. , 82-91 (2016).
- Lazari, M., et al. ELIXYS - a fully automated, three-reactor high-pressure radiosynthesizer for development and routine production of diverse PET tracers. European Journal of Nuclear Medicine and Molecular Imaging (EJNMMI) Research. 3 (1), 52(2013).
- Claggett, S. B., Quinn, K., Lazari, M., Esterby, J., Esterby, M., van Dam, R. M. A new paradigm for programming and controlling automated radiosynthesizer. Journal of Nuclear Medicine. 53 (suppl. 1), 1471-1471 (2012).
- Claggett, S. B., Quinn, K. M., Lazari, M., Moore, M. D., van Dam, R. M. Simplified programming and control of automated radiosynthesizers through unit operations. European Journal of Nuclear Medicine and Molecular Imaging (EJNMMI) Research. 3, 53(2013).
- Lazari, M., et al. Fully Automated Production of Diverse 18F-Labeled PET Tracers on the ELIXYS Multireactor Radiosynthesizer Without Hardware Modification. Journal of Nuclear Medicine Technology. 42 (3), 203-210 (2014).
- Lazari, M., et al. Fully-automated synthesis of 16β-18F-fluoro-5α-dihydrotestosterone (FDHT) on the ELIXYS radiosynthesizer. Applied Radiation and Isotopes. 103, 9-14 (2015).
- Collins, J., et al. Production of diverse PET probes with limited resources: 24 18F-labeled compounds prepared with a single radiosynthesizer. Proceedings of the National Academy of Sciences. 114 (43), 11309-11314 (2017).
- Drake, C., et al. Enzymatic Radiofluorination of Biomolecules: Development and Automation of Second Generation Prosthetic on ELIXYS Radiosynthesizer. Journal of Nuclear Medicine. 58 (supplement 1), 1(2017).
- Gobbi, L. C., et al. Identification of Three Novel Radiotracers for Imaging Aggregated Tau in Alzheimer's Disease with Positron Emission Tomography. Journal of Medicinal Chemistry. 60 (17), 7350-7370 (2017).
- Ippisch, R., Maraglia, B., Sutcliffe, J. Automated production of [18F]-F-Py-peptides. Journal of Nuclear Medicine. 57, 275(2016).
- Chen, H., et al. AMG 580: A Novel Small Molecule Phosphodiesterase 10A (PDE10A) Positron Emission Tomography Tracer. Journal of Pharmacology and Experimental Therapeutics. 352 (2), 327-337 (2015).
- Waldmann, C. M., et al. An Automated Multidose Synthesis of the Potentiometric PET Probe 4-[18F]Fluorobenzyl-Triphenylphosphonium ([18F]FBnTP). Molecular Imaging and Biology. 20 (2), 205-212 (2018).
- Ravert, H. T., et al. An improved synthesis of the radiolabeled prostate-specific membrane antigen inhibitor, [18F]DCFPyL. Journal of Labelled Compounds and Radiopharmaceuticals. 59 (11), 439-450 (2016).
- Betthauser, T. J., et al. Characterization of the radiosynthesis and purification of [18F]THK-5351, a PET ligand for neurofibrillary tau. Applied Radiation and Isotopes. 130, 230-237 (2017).
- Shu, C. J., et al. Novel PET probes specific for deoxycytidine kinase. Journal of Nuclear Medicine. 51 (7), 1092-1098 (2010).
- Kim, W., et al. [18F]CFA as a clinically translatable probe for PET imaging of deoxycytidine kinase activity. Proceedings of the National Academy of Sciences. 113 (15), 4027-4032 (2016).
- Barrio, M. J., et al. Human Biodistribution and Radiation Dosimetry of 18F-Clofarabine, a PET Probe Targeting the Deoxyribonucleoside Salvage Pathway. Journal of Nuclear Medicine. 58 (3), 374-378 (2017).
- SOFIE. Sofie Probe Network. , Available from: http://www.sofienetwork.com/ (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon