Method Article
Îlots pancréatiques, enrobage pour les Sections de paraffine
Dans cet article
Résumé
Des études ex vivo îlots pancréatiques sont importants pour la recherche sur le diabète. Les techniques existantes pour étudier des îlots cultivés dans leur architecture 3D natif sont chronophages, inefficace et rarement utilisés. Cet ouvrage décrit une méthode nouvelle, simple et efficace pour générer des sections de paraffine de haute qualité des îlots cultivés ensemble.
Résumé
Expériences utilisant des îlots pancréatiques isolés sont importantes pour la recherche sur le diabète, mais les îlots sont coûteux et d’abondance limitée. Îlots contiennent une population de cellules mixtes dans une architecture structurée ayant une incidence sur la fonction et îlots humains varient largement dans la composition de type cellulaire. Cours méthodes fréquemment utilisées pour étudier les îlots cultivés comprennent des études moléculaires effectuées des îlots entiers, mettre types de cellules d’îlot disparates ensemble, ou microscopie ou études moléculaires sur des cellules des îlots dispersés, perturbant l’architecture de l’îlot. Pour les études in vivo îlot, coupes de pancréas de paraffine est une technique puissante pour évaluer les résultats spécifiques des cellules dans l’environnement natif du pancréas. Étude après culture des îlots en paraffine sectionnant offrirait plusieurs avantages : détection des résultats multiples sur le mêmes îlots (peut-être même les îlots exact-même, à l’aide de coupes sériées), mesures de cellule-type spécifique et maintien native Îlot cellule-cellule et cellule-substrat interactions tant pendant l’exposition expérimentale et pour l’analyse. Cependant, les techniques existantes pour l’enrobage isolement îlots après culture sont inefficaces, votre temps, enclins à la perte de matière et produisent généralement des sections avec des nombres insuffisants îlot utile pour quantifier les résultats. Installations de préparation de pathologie clinique laboratoire cellule bloc sont inaccessibles et peu pratique pour les laboratoires de recherche fondamentale. Nous avons développé une méthode de paillasse améliorée et simplifiée qui génère des sections avec rendement robuste et distribution des îlots. Îlots fixes sont remises en suspension en gel d’agarose histologique chaud et distribués dans un disque plat sur une lame de verre standard, tels que les îlots sont distribuées dans un plan. Après déshydratation standard et d’incorporation, plusieurs (10 +) 4-5 µm sections peuvent être coupées à partir du même bloc de l’îlot. En utilisant cette méthode, les analyses histologiques et immunofluorescence sont possibles sur les souris, rat et îlots humains. Il s’agit d’une approche efficace, peu coûteuse, gain de temps pour évaluer le type-spécifiques des cellules intactes-architecture issues des îlots cultivés.
Introduction
Pancréas, îlots de Langerhans, la seule source d’insuline, en circulation sont un tissu de critique pour les chercheurs étudient le diabète sucré. De tout organisme donné, les îlots ont taille variable, la fréquence de type cellulaire et architecture1,2,3. La stratégie conventionnelle à l’étude in vivo de structure et la composition de la cellule endocrine des îlots pancréatiques est en sectionnant le pancréas tissus4,5. Puisque les îlots composent seulement une petite fraction du total contenu cellulaire pancréatique, études moléculaires sont effectuées sur les îlots isolés. Ex vivo îlot cultures expérimentales test réponse aux nutriments, modulation de gène (transfection, transduction), ou des traitements expérimentaux donnent un aperçu important des mécanismes modulant la fonction, la prolifération et la survie des cellules endocrines 5 , 6.
Ex vivo des expériences îlot sont souvent analysées à l’aide des études moléculaires des îlots entiers ou des études histologiques ou moléculaires dispersé des cellules des îlots cultivés en monocouche5,6. Analyse moléculaire des îlots entiers introduit la mise en garde sérieuse de mélanger types de cellules, qui peut produire des résultats faussement négatifs ou des faux positifs lorsque extrapolés à n’importe quel type de cellule individuelle. Dispersion de cellule sur lamelles couvre-objet pour la microscopie après culture permet la mesure des résultats de la cellule-type spécifique, mais perturbe l’architecture de l’îlot, qui peut-être altérer la réponse à l’intervention et s’oppose à une identification des résultats axés sur l’architecture. En outre, en général seulement un seul résultat peut être mesuré ; par exemple, pour mesurer la prolifération des cellules bêta et la mort des cellules bêta dans les mêmes conditions, deux expériences distinctes doivent être effectuées. Ces approches sont aussi aveugles à la variabilité inter-îlot, un domaine d’intérêt croissant dans le domaine. Tri des cellules des îlots par cytométrie de flux pour cellule-type spécifique études moléculaires, ou unicellulaires RNA sont élégantes mais cher, beaucoup de temps, limité par l’abondance de tissus, architecture-éradication et pas bien adapté aux analyses de routine cell culture 5 , 7. imagerie confocale des îlots entiers immunomarquage fournit des données intactes-architecture de qualité, mais il est beaucoup de travail, et les données obtenues à partir de chaque échantillon sont limitées aux résultats identifiables dans un seul immunostaining8.
La capacité de générer des sections de paraffine de haute qualité des îlots entiers après culture permettrait de résoudre nombre de ces préoccupations. Tissu de l’îlot de desserte à coût élevé, faible abondance de modèles génétiques uniques ou de donneurs d’organes humains, ou îlots statut post in vivo ou in vitro la manipulation expérimentale, sont précieux. Obtention de plusieurs sections de paraffine d’îlots mêmes permettrait plusieurs analyses de cellule-type spécifique, intact-architecture de la même expérience.
Les techniques existantes pour générer des pastilles de l’îlot pour le sectionnement sont imparfaits. Histologie-optimisé agarose est un gel aqueux bas point de fusion qui est employé couramment dans le traitement des spécimens cytologiques et histologiques, y compris des échantillons de tissus petit ou fragmentée qui sont difficiles à processus9. Un îlot enraciner approche consiste à suspendre les îlots dans l’agarose dans un tube de microcentrifuge, centrifuger pour le matériel de granule, récupérer la fiche de gélose, puis traiter et intégrer pour le sectionnement10,11. Extraire l’échantillon solidifiée par le bas du tube est longue et difficile, conduisant à une fragmentation occasionnelle de l’échantillon et risque de blessures corporelles. Les îlots sont concentrés dans la pointe de la fiche, conduisant à une répartition inadéquate îlot aux points obtenues par cette méthode. Le fond rond du bouchon complique incorporation telle qu’une région pauvre en îlot peut être présentée à la section. Dans l’ensemble, cette méthode conduit à faible rendement et de la distribution d’îlot contagieuse dans les sections qui en résulte.
Cette nouvelle méthode est une approche simplifiée et améliorée pour la préparation des sections de l’îlot. Îlots sont concentrées dans un petit volume et ensuite placées sur la surface lisse d’une lame de microscope pour former un petit disque, avec les îlots dans un seul plan. Le disque Histogel-îlot est traité par la suite pour incorporation dans un protocole de l’infiltration de xylène et déshydratation raccourcie de paraffine. L’approche précédente, qui concentre les îlots dans le fond d’un tube à centrifuger, est également réalisée en guise de comparaison. Cette nouvelle technique améliore le rendement des îlots par section, la répartition des îlots dans chaque section et prend moins de temps pour transférer les blocs de l’îlot à cassettes. Cette technique est utile pour les biologistes de l’îlot ou autres scientifiques qui étudient les petits morceaux de tissu souhaitent maximiser productif utilisent un tissu de faible abondance en mesurant les résultats multiples sur un seul échantillon dans son architecture native de tissu.
Protocole
Toutes les procédures impliquant des animaux ont été approuvées par le Comité de l’utilisation et de UMass Medical School institutionnels Animal Care. Études des îlots pancréatiques humains ont été déterminées par la Commission de révision institutionnelle UMass à ne sont ne pas admissibles à l’examen de la CISR ou exemption parce qu’ils n’impliquent pas l’utilisation de sujets humains.
1. culture et l’isolement de l’îlot
- Isoler les îlots et séparer de contaminer le tissu exocrine et canalaire à l’aide de la méthode de votre choix.
Remarque : Cette méthode a été optimisée à l’aide des îlots isolés par insufflation canalaire collagénase et gradient de Ficoll séparation12 (rongeur) ou après l’expédition des îlots du programme intégré de Distribution îlot (IIDP13; l’homme). Îlots ont été triés sur le volet avec une micropipette P200. - Pour optimiser la morphologie de l’îlot, permettre aux îlots de récupérer pendant la nuit dans 10 mL de milieu d’îlot complet (RPMI avec 10 % FBS, pénicilline/streptomycine et 5,5 mmol/L de glucose) dans une chambre humidifiée contenant 5 % de CO2 à 37 ° C. Bien que cette étape n’est pas tenue d’obtenir des sections, les îlots sont plus intactes après une période de récupération (voir Figure 2).
2. Fixation de l’îlot
- Avec une faible liaison P200 pointe, cueillir à la main environ 250 îlots équivalents (IEQ)13 en utilisant une grille calibrée sous un stéréomicroscope dans un tube microtubes de 1,5 mL liaison faible. Faible liaison conseils et tubes réduisent les pertes de l’îlot.
- Permettre aux îlots à déposer au fond du tube à centrifuger. Retirez la plupart surnageant avec une pointe de pipette P200, en prenant soin de ne pour supprimer les îlots.
- Ajouter 1 mL de PBS. Centrifuger le tube dans une centrifugeuse seau oscillant jusqu'à ce que la vitesse atteigne 200 g x et puis arrêter la rotation. Retirez le surnageant. Répétez lavage PBS, pour un total de deux lavages.
- Ajouter 500 µL de solution de formol à 10 % ou 4 % fraîchement paraformaldéhyde. Difficulté à température ambiante pendant 30 minutes. Pour les résultats testés dans cette méthode, ces méthodes de fixation étaient impossibles à distinguer. Fixation plus courte peut également être possible ; Il est recommandé d’optimiser la durée de fixation pour le résultat souhaité.
- Retirez le fixateur avec une pointe de P200.
- Ajouter 1 mL de PBS. Centrifuger le tube jusqu'à ce que la vitesse atteigne 200 g x et puis arrêter la rotation. Retirez le surnageant. Répétez lavage PBS, pour un total de deux lavages.
- Procéder immédiatement à l’étape suivante.
3. préparation du disque de l’Islet (Figure 1)
- À la première utilisation, faire fondre le gel (p. ex., Histogel) à 70 ° C et faire aliquotes 1,5 mL microtubes pour stockage à long terme. Aliquote volume n’est pas critique, puisque les parties aliquotes peuvent être réutilisées.
- Chauffer le gel (environ 100 µL par exemple) à 70 ° C en plaçant le tube à centrifuger contenant l’aliquote de gel dans un bloc chauffant réglé à 70 ° C.
- Transfert d’agarose bleu perles (10 µL de chaque échantillon) dans un tube propre microtubes de 1,5 mL. Bien remettre en suspension les perles avant de pipetage.
NOTE : Perles bleues sont mélangés avec les îlots afin d’aider à l’identification visuelle du matériel embarqué dans le bouton d’agarose et le bloc de paraffine. Le nombre de perles bleues utilisé n’est pas critique pour le résultat, mais éviter les perles excessives (> 5 x le nombre d’îlots) pour permettre une distribution optimale des îlots dans les sections. - Laver les perles bleus avec 1mL de PBS, deux fois. Pour chaque lavage, essorage les perles 1 min à 800 g. Après le deuxième lavage, remettre en suspension les perles (n+ 2) x 10 µL PBS, où n est le nombre de tubes d’échantillons ; par exemple, pour 2 tubes échantillon, le volume de PBS à ajouter aux talons serait 40 µL.
- Centrifuger le tube à centrifuger contenant des îlots (bref essorage à 200 x g) et enlever la majeure partie du liquide surnageant. Couper l’extrémité d’une pointe de micropipette 10 µL avec des ciseaux ou une lame et ajouter 10 µL de billes dans chaque tube d’îlot, en utilisant un embout propre pour chaque échantillon. Ne pas mélanger (pour éviter de perdre des îlots).
- Centrifuger des îlots et des perles (bref essorage à 200 x g). Eliminez autant PBS que possible avec une pointe de micropipette 10 µL non circoncis.
- Les lames de microscope pour l’identification de l’échantillon de l’étiquette. Deux ou trois échantillons peuvent être préparés sur chaque diapositive. Placer la lame sur le banc près du bloc de chaleur avec gel réchauffé. Couper les extrémités des trois à cinq 20 conseils d’une micropipette de liaison faible µL par échantillon avec une lame de rasoir ou de ciseaux. Charger deux micropipettes P20 avec embouts coupés pour permettre rapidement passer de l’un à l’autre.
- À l’aide d’une micropipette premier, ajouter 15-20 µL de gel chaud dans le tube à centrifuger îlots/perles ; mélanger immédiatement, en évitant les bulles ; et appliquer le mélange liquide d’agar/îlots/perles à la diapositive pour former un < disque de diamètre de 1 cm. Placez le disque au bord de la diapositive, en laissant l’espace pour l’anneau extérieur gel (étape suivante). Cliquez sur la diapositive doucement plusieurs fois pour régler les îlots et les perles.
- À l’aide d’une micropipette deuxième, ajouter 20 µL de gel chaud dans le tube échantillon. La première micropipette mix nouveau gel avec n’importe quel autres îlots/perles, réchauffement dans le bloc chauffant si elle commence à se solidifier, puis appliquez ce mélange à la diapositive, entourant le disque original. Répéter au besoin, à l’aide des conseils supplémentaires de pré découpés, jusqu'à ce que le disque est la taille désirée et l’épaisseur.
Remarque : Le disque gélifié de manutention est plus facile si l’anneau extérieur est légèrement plus épais. 3 x 20 µL de gel est généralement suffisante. Cette étape minimise la perte des îlots en tube lavages et ajoute agarose pauvre en îlot à l’extérieur du disque pour faciliter la manipulation des disques. - Préparer chaque disque individuellement et suivre attentive de l’ordre d’échantillon si placer plusieurs disques sur chaque diapositive.
- Placez les diapositives sur une surface plane de glace mouillée, avec un couvercle, pendant 10 minutes ou jusqu'à ce que le gel se solidifie. Il est plus difficile à faire glisser le disque sur le verre si il se dessèche.
- Étiquette biopsie de traitement / d’incorporation des cassettes de tissu avec un crayon, un par exemple. Sécher le dos de la lame pour éviter de mouiller le papier bleu.
- En utilisant le bord émoussé d’une lame de rasoir, poussez doucement le disque dans chaque direction pour la libérer de la vitre. Quand elle glisse facilement, poussez lentement le disque de la lame de microscope sur le papier de soie bleu. Placez le disque, côté plat vers le bas, directement sur le papier.
- Garder le disque plat, pliez le papier autour du disque pour empêcher tout mouvement, placez le disque dans un papier plié dans la cassette et refermer la cassette. Si le disque ne glisse pas proprement sur le verre, ajouter plus de gel et/ou retourner la lame de glace pendant quelques minutes.
- Submerger la cassette dans du PBS dans un bécher. Procédé de paraffine incorporation le même jour pour la morphologie optimale.
4. enrobage de paraffine
NOTE : Processus le gel de l’îlot des disques à des blocs de paraffine à l’aide d’une série de déshydratation abrégée comme décrit ci-dessous. Cette technique a été optimisée à l’aide d’un processeur automatisé, mais traitement manuel devrait produire des résultats similaires.
- Immerger les cassettes en éthanol de 85 % pendant 15 minutes.
- Immerger les cassettes dans l’éthanol à 95 % pendant 15 minutes.
- Immerger les cassettes en éthanol à 100 % pendant 15 minutes. Répéter deux fois pour un total de trois lavages.
- Immerger les cassettes dans le xylène pendant 15 minutes. Répéter deux fois pour un total de trois lavages.
- Plonger les cassettes à la paraffine fondue pendant 10 minutes.
- Transfert de cassettes de paraffine fondue fraîche pendant 10 à 30 minutes.
- Ouvrir la cassette et déballer le papier bleu. Sortez la gel, garder une trace de la surface plane qui s’oppose au livre. Incorporer le disque dans un petit moule, avec la surface plane (contenant de l’îlot) vers le bas, parallèlement à la surface de coupe. Pour la fiche, soigneusement Retirez-la de la cassette et l’incorporer dans un petit moule avec la pointe dirigée vers la surface de coupe.
5. paraffine coupes et coloration
- Étiqueter les diapositives séquentiellement si des coupes sériées sont nécessaires.
- Avoir 5 sections de paraffine µm, coupées par un histologiste expérimenté. Pour maximiser le rendement, enregistrer toutes les sections contenant des matières. En règle générale, recueillant 20 sections permet de capture de la plupart des matériaux.
- Stocker des articles à la température ambiante. Les sections sont propices à des taches histologiques systématiques (par exemple, H & E) et immunofluorescence (p. ex., insuline, glucagon et DAPI). Optimiser la fixation d’autres antigènes, si nécessaire.
Résultats
Un schéma illustré des étapes pour préparer la Couronne gel est illustré à la Figure 1. Ce résultats de méthode gel disque en sections de paraffine qui contiennent un nombre suffisant d’îlots répartis dans un seul plan pour permettre une quantification significative des résultats. La figure 2 montre des images de faible grossissement des sections qui en résulte pour illustrer le nombre d’îlots capturé par section. En général, > 35 îlots étaient visibles dans chaque section lorsque IEQ 250 ont été utilisés pour la procédure, et > 10 sections (4-5 µm) contenant des îlots ont été extraites de chaque échantillon. La multiplication des îlots utilisé pour la procédure a augmenté le nombre d’îlots dans les sections. Îlots dans les sections ont été structurellement diverses et de différentes tailles, en appuyant la notion que les nouveaux et intéressants de données peuvent être obtenues à l’aide de sections plutôt que techniques aveugles aux différences inter-îlots. La méthode a fonctionné aussi bien pour les rongeurs îlots isolés en laboratoire (rat, souris) et pour les îlots humains reçus après l’envoi par le IIDP. Îlots rongeurs avaient sensiblement plus morphologie intacte après isolement après récupération du jour au lendemain dans le milieu de l’îlot, avec une surface arrondie lisse et compact de forme sphérique (Figure 2A). Morphologie des îlots pancréatiques humains était semblable lorsqu’il est incorporé le jour de votre arrivée ou lorsqu’ils sont incorporés après la récupération après l’expédition du jour au lendemain, peut-être parce que les îlots avaient déjà récupéré du stress d’isolement avant l’expédition. La méthode microtube a donné une plus petite zone transversale de tissu, avec des îlots moins par section et dense des îlots et des perles (Figure 2B). Les images de microtube illustrés à la Figure 2B étaient les meilleurs que nous avons pu obtenir avec cette méthode ; un des échantillons devait être renvoyés à des coupes plus car aucune îlots ont été trouvées dans le premier jeu de sections.
Cette technique génère des sections d’îlot de haute qualité pour histologique et immunofluorescence souillant (Figure 3). L’insuline et le glucagon coloration a montré la composition diverse et l’hétérogénéité de l’architecture de l’îlot. Les sections récapitulaient clairement des différences de connaissance de l’architecture entre homme, îlots de souris et le rat, avec des îlots humaines composées d’abondants α-cellules entremêlent avec des cellules bêta, alors que les îlots de souris et le rat ont montré une architecture similaire avec un noyau de la cellule bêta et les cellules alpha dans la périphérie. Coupes sériées ont été obtenus ; les panneaux à la Figure 3 montrent des coupes sériées de même îlot colorées pour H & E (à gauche) et immunofluorescence (à droite).
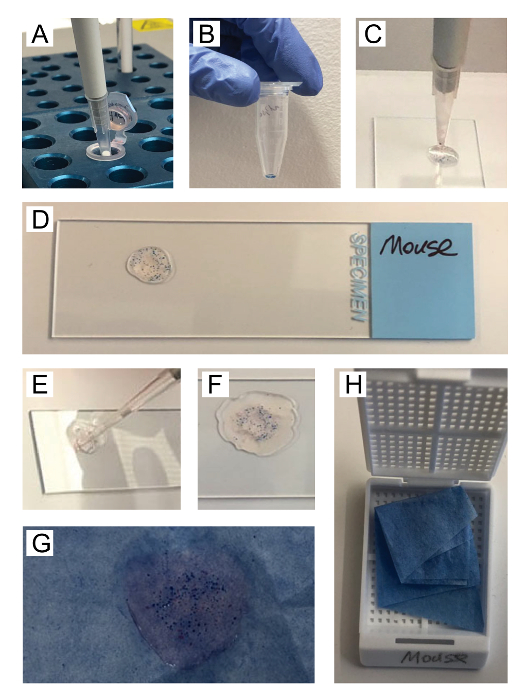
Figure 1 . Illustration des étapes essentielles pour faire la Couronne gel îlot. Gel chauffé à 70 ° C dans un bloc chauffant (A) est transféré dans le tube à centrifuger faible liaison contenant le culot d’îlot/perle (B). Les îlots sont remises en suspension en gel chaud et transférés à une lame de verre, répandre le matériel en forme de disque (C-D). Gel de nettoyage supplémentaire est transféré dans le tube à centrifuger, puis toutes les matières restantes sont retiré et se propager circonférentiellement autour du disque îlot/perle-contenant initial sur la lame de verre (E-F). Après gélification sur glace, le disque est transféré, plat côté vers le bas, au livre de l’histologie (G), qui est plié et placé dans une cassette (H) pour le traitement. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
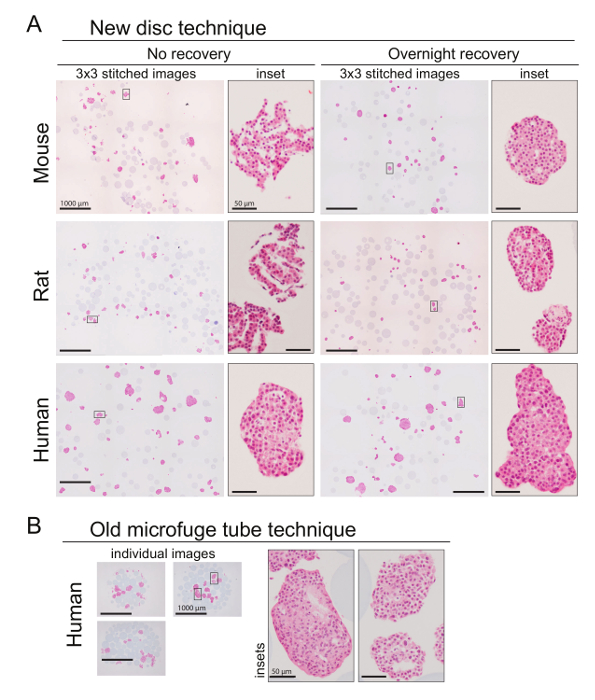
La figure 2. Sections de paraffine de gel disques contiennent un grand nombre d’îlots bien réparties. (A) panneaux de faible grossissement (40 X, 3 x 3 images cousues ensemble, avec 15 % de chevauchement) de souris, rat ou des îlots pancréatiques humains sections colorées avec H & E montrent que de nombreux îlots sont visibles dans chaque section. Encarts de fort grossissement (X 200) montrent des îlots représentant. Panneaux de gauche montrent des sections des îlots incorporés immédiatement après isolement (souris, rat) ou de l’expédition (humaine) ; panneaux de droite montre des îlots incorporés après récupération une nuit ou plus dans la culture. Les cercles bleus pâles dans 40 X images sont les perles inclus pour la visualisation au cours de l’incorporation et de sectionnement. Ces échantillons particuliers sont d’une souris C57BL/6N en DP (1 an) et le rat RSPD (4 semaines), îlots isolés par injection canalaire collagénase et séparation de Ficoll et humaine T2D îlots a reçu de la IIDP. (B) 250 IEQ des îlots humains incorporés par la vieille technique de tube microtubes, aux fins de comparaison. Panneaux de grossissement à faible (40 X ; un seul décousu image capturée tout le matériel) et encarts mag haute (200 X) montrent des sections représentatives. Milieu de culture a été RPMI avec 10 % FBS, pénicilline/streptomycine et 5,5 mmol/L de glucose. Barres d’échelle pour les panneaux de faible grossissement sont 1000 µm ; barres d’échelle pour les panneaux de fort grossissement sont 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 . Représentant histochimique et immunofluorescence coloration sur des sections de l’îlot série. Sections de souris, rat et îlots humains incorporé après culture une nuit ou plus ont été colorés pour H & E et imagé par microscopie à fond clair (200 X ; gauche). Une section adjacente était tachée de glucagon d’insuline (rouge), (verte), monté dans des milieux contenant du DAPI (bleu) et imagé par microscopie fluorescente (200 X ; droit). Barreaux de l’échelle : 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Cette méthode d’encastrement mis à jour le gel-disque-base fournit un simple, peu coûteux et un moyen efficace pour générer un rendement élevé des îlots par section. Construire la Couronne gel sur une surface de verre plat facilite l’épandage îlots dans une distribution uniforme sur une zone bien définie. Répandre les îlots dans un disque plat offre l’avantage de placer plusieurs îlots dans le plan de section, optimiser le rendement et permettant des îlots moins à utiliser. L’épaisseur du disque peut être ajusté pour répondre aux besoins des chercheurs. Puisque plusieurs sections peuvent être obtenues, des îlots mêmes coupes sériées peuvent être analysées, augmentant le nombre de résultats distincts qui peuvent être mesurés sur le même échantillon expérimental. Bien qu’optimisé ici pour les îlots pancréatiques, la technique pourrait être appliquée à d’autres documents de faible abondance, y compris ceux avec des petits morceaux, nature friable ou échantillons visqueux qui seraient autrement difficiles à processus. Cette méthode est optimisée pour les îlots de frais fixes et n’a pas été testée pour les autres types de matériel, comme des îlots décongelées. Ces sections peuvent être également utiles pour des dosages hybridation in situ détecter l’ADN ou ARN. L’ajout de gel supplémentaire sert à deux fins : pour maximiser la collection de l’îlot et de protéger le riche en îlot disc Centre de perturbations pendant la manutention/transfert. Le disque mince gel se solidifie rapidement et permet de xylène et déshydratation raccourcie étapes d’infiltration pour l’enrobage de paraffine. Formant le disque sur une surface plane, plutôt que dans un conteneur secondaire (microtubes tube ou culture plaque bien) rend plus facile de transférer physiquement le disque à la cassette à la transformation. En comparaison avec les résultats de technique de disque, la technique du microtube avait réduit le rendement de l’îlot et agglutiné distribution îlot, bien que l’arrangement des non-plane tissu pourrait générer un nombre plus élevé d’îlot contenant sections.
Les étapes critiques du protocole comprennent la fixation du tissu, formation de la Couronne gel, paraffine incorporation et la section. En ce qui concerne la fixation, car testés par H & E et immunofluorescence pour l’insuline et le glucagon, aucune différence a été détectée entre l’IFP et de formol ou la durée de fixation allant de 10 à 30 minutes (non illustrés). Toutefois, la durée et l’intensité de la fixation doivent être optimisés pour les besoins des utilisateurs finals. La principale innovation contenue dans le présent protocole est la préparation de la Couronne gel îlot ; étapes critiques sont résumées dans la Figure 1. Étapes clés incluent en utilisant une petite quantité de gel de concentrer les tissus dans une petite zone et formant le disque sur une surface plane afin d’organiser le tissu dans un seul plan de sectionnement. Utilisation des microtubes liaison faible et conseils et une centrifugeuse seau oscillant pour tous les spins améliore le rendement de tissu ; îlots collent au plastique après fixation. Ajout des perles facilement visibles aide avec formation de disque, l’incorporation et de sectionnement. Enlever autant PBS que possible avant d’ajouter que le gel est essentiel d’éviter de diluer l’agarose, conduisant à la solidification pauvre et difficulté à transférer le disque sur le papier. Garder le disque mince intact tout en glissant de la lame de verre sur le papier peut s’avérer difficile. Si un problème se produit dans le disque, laissez-le revenir à sa position d’origine, ajouter plus de gel et re-chill de la diapositive. En ce qui concerne l’intégration de la paraffine, il est important que le disque sont incorporées côté plat vers le bas et parallèle au plan de coupe. Un histologiste expérimenté avec couper des sections de paraffine est essentiel à la réussite de cette procédure, étant donné que le matériau est concentré à la fine pointe du bloc. Face excessive hors du bloc peut conduire à la perte de l’échantillon. Il est recommandé de commencer à collecter les articles dès que les perles bleues sont visibles.
Durée et l’intensité de la fixation doivent être optimisées pour des tissus spécifiques et les besoins de l’utilisateur final. Le nombre d’îlots utilisés par exemple peut être modifié si nécessaire ; Toutefois, réduisant le matériel de départ génère des sections avec moins d’îlots. Des disques plus épais ou plus peuvent être générés à l’aide de cette technique ; déshydratation et xylène infiltration étapes devrez peut-être être rallongé et doivent être optimisés. Si les sections qui en résultent contiennent seulement une forme partielle, envisager la possibilité que le disque n’a pas été incorporé parallèlement à la surface de coupe. Si trop peu de sections est obtenues, le technologue peut avoir perdu matériel lors de la préparation de bloc initial.
Cette méthode génère des sections contenant des tissus d’îlot fixe et, par conséquent, ne peut être utilisée pour les résultats histologiques. Pour obtenir un grand nombre d’îlots par section, 200-250 IEQ matériel de départ a été utilisé, qui est difficile à générer pour certains types d’expérience. Articles de haute qualité sont dépendants ayant un histologiste expérimenté.
La capacité de générer 10 + les sections contenant de nombreux îlots d’une seule condition expérimentale permettra de quantification de résultats multiples sur la même matière, amélioration de l’efficacité expérimentale. Analyse de routine des îlots intactes peut conduire à des progrès dans la compréhension dans l’hétérogénéité de tissu, non seulement au niveau cellulaire, mais aussi au niveau de l’îlot, sujet dont peu est actuellement entendu. Appliqué cette technique aux autres échantillons de tissus limitée-abondance peut offrir des avantages à d’autres domaines aussi bien.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous remercions le groupe de biologie cellules bêta au UMass Diabetes Center of Excellence pour discussions et conseils utiles. Des îlots pancréatiques humaines ont été fournis par le NIDDK-financé intégré îlot Distribution programme (IIDP) à la cité de l’espoir. Ce travail a été financé par le NIH/NIDDK : R01-DK114686 (LCA), R01-DK105837 (CY), 2UC4DK098085 (IIDP) et par l’American Diabetes Association subvention #1-15-BS-003 (LCA) en collaboration avec l’ordre de l’amarante.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Norgen Bioteck Corp | P/N 10113 | |
| Ranin Classic Starter Kit | ShopRanin | 17008708 | |
| Ranin ClassicPipette PR-2 | ShopRanin | 17008648 | |
| Low Binding Tip (1000 μL) | Genesee Scientific | 24-430 | |
| Low Binding Tip (200 μL) | Genesee Scientific | 24-412 | |
| Low Binding Tip (20 μL) | Genesee Scientific | 24-404 | |
| Low Binding Tip (10 μL) | Genesee Scientific | 24-401 | |
| 10% Formalin solution | Sigma | HT501128 | |
| Paraformaldehyde | Electron Microscopy Sciences | 15710-S | |
| Heatblock | VWR | 949312 | |
| HistoGel | Thermo Scientific | HG-4000-012 | |
| Agarose blue beads- Affi-gel | Bio-Rad | 153-7301 | |
| Dulbecco's PBS | Life technologies | 14190-144 | |
| Tissue processing cassette | Simport | M492-10 | |
| Bio-Wraps | Leica-Surgipath | 3801090 | |
| Citadel 2000 tissue processor | Thermo-Shandon LLC | ||
| Ethanol 200 proof | Decon Laboratories, INC | 2701 | |
| Xylene | Fisher Chemical | X5SK-4 | |
| Paraffin | McCormick Scientific | 39503002 | |
| Microtome | Thermo-Shandon LLC | Finesse ME+ | |
| Insulin antibody | DAKO | A0564 | |
| Glucagon antibody | Sigma | G2654 | |
| Fluoroshield with DAPI | Sigma | F6057 | |
| Alex fluor 594 secondary antibodies | Life technologies | A11076 | |
| Alex fluor 488 secondary antibodies | Life technologies | A11001 |
Références
- Kim, A., Miller, K., Jo, J., Kilimnik, G., Wojcik, P., Hara, M. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Steiner, D. J., Kim, A., Miller, K., Hara, M. Pancreatic islet plasticity: Interspecies comparison of islet architecture and composition. Islets. 2 (3), 135-145 (2010).
- Campbell-Thompson, M. L., Heiple, T., Montgomery, E., Zhang, L., Schneider, L. Staining protocols for human pancreatic islets. Journal of Visualized Experiments. (63), (2012).
- Da Silva Xavier, G. The Cells of the Islets of Langerhans. Journal of Clinical Medicine. 7 (3), (2018).
- Sharma, R. B., et al. Insulin demand regulates β cell number via the unfolded protein response. The Journal of Clinical Investigation. 125 (10), 3831-3846 (2015).
- Stamateris, R. E., et al. Glucose Induces Mouse β-Cell Proliferation via IRS2, MTOR, and Cyclin D2 but Not the Insulin Receptor. Diabetes. 65 (4), 981-995 (2016).
- Blodgett, D. M., et al. Novel observations from next-generation rna sequencing of highly purified human adult and fetal islet cell subsets. Diabetes. 64 (9), 3172-3181 (2015).
- Brissova, M., et al. Assessment of human pancreatic islet architecture and composition by laser scanning confocal microscopy. Journal of Histochemistry & Cytochemistry. 53 (9), 1087-1097 (2005).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGelTM-embedded specimens for use in veterinary diagnostic pathology. Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. 24 (4), 710-715 (2012).
- Cozar-Castellano, I., Takane, K. K., Bottino, R., Balamurugan, A. N., Stewart, A. F. Induction of beta-cell proliferation and retinoblastoma protein phosphorylation in rat and human islets using adenovirus-mediated transfer of cyclin-dependent kinase-4 and cyclin D1. Diabetes. 53 (1), 149-159 (2004).
- La Fortune, K. A., Randolph, M. L., Wu, H. H., Cramer, H. M. Improvements in cell block processing: The Cell-Gel method. Cancer Cytopathology. 125 (4), 267-276 (2017).
- Alonso, L. C., et al. Glucose infusion in mice: A new model to induce beta-cell replication. Diabetes. 56 (7), 1792-1801 (2007).
- Olack, B., Omer, A., Richer, B., Weir, G. Integrated Islet Distribution Program: Islet handling tips. at. , Available from: http://iidp.coh.org/ (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon