Method Article
Formation de Biofilm oral sur différents matériaux pour Implants dentaires
Dans cet article
Résumé
Nous présentons ici un protocole afin d’évaluer la formation de biofilm oral sur des matériaux titane et la zircone pour les culées de prothèses dentaires, y compris l’analyse de la viabilité de cellules bactériennes et des caractéristiques morphologiques. Un modèle in situ , associé à des techniques de microscopie puissant est utilisé pour l’analyse de biofilm oral.
Résumé
Implants dentaires et leurs composants prothétiques sont sujettes à une colonisation bactérienne et la formation de biofilm. L’utilisation de matériaux qui fournit la faible adhérence microbienne peut réduire la prévalence et la progression de maladies péri-implantaires. Compte tenu de l’environnement buccal complexité et oral biofilm hétérogénéité, microscopie techniques sont nécessaires et qui peut permettre une analyse de biofilm de la surface des dents et des matériaux dentaires. Cet article décrit une série de protocoles mis en œuvre pour comparer la formation de biofilm oral sur titane et matériaux céramiques pour des piliers prothétiques, ainsi que les méthodes impliquées dans les analyses de biofilms par voie orale aux niveaux cellulaires et morphologiques. Le modèle in situ pour évaluer la formation de biofilm oral sur des matériaux titane et la zircone pour les culées de prothèses dentaires, tel que décrit dans la présente étude fournit une préservation satisfaisante du biofilm 48 h, démontrant ainsi la pertinence méthodologique. La microscopie multiphoton permet l’analyse d’un représentant de la région du biofilm formé sur le matériel de test. En outre, l’utilisation de fluorophores et le traitement des images à l’aide de la microscopie multiphoton permet l’analyse de la viabilité bactérienne dans une population très hétérogène des micro-organismes. La préparation de spécimens biologiques pour la microscopie électronique encourage la protection structurelle du biofilm, des images avec une bonne résolution et sans artefacts.
Introduction
Biofilms bactériens sont complexes, fonctionnellement et structurellement organisée des communautés microbiennes, caractérisé par une diversité d’espèces microbiennes qui synthétisent un polymère extracellulaire, biologiquement active matrix1,2. L’adhérence bactérienne des surfaces biotiques ou abiotiques est précédée d’une formation de la pellicule acquise, principalement constituée de glycoprotéines salivaires1,3,4. Faibles interactions physico-chimiques entre les micro-organismes et la pellicule sont initialement mis en place et suivies par des rapports plus étroits entre les adhésines bactériennes et les récepteurs de la glycoprotéine de la pellicule acquise. La diversité microbienne augmente progressivement par le biais de la coagrégation des colonisateurs secondaires aux récepteurs des bactéries déjà attachés, formant une communauté multi-espèces1,3,4, 5.
L’homéostasie de la microflore orale et sa relation symbiotique avec l’hôte est important dans le maintien de la santé buccodentaire. La dysbiose au sein de biofilms orale peut accroître le risque pour le développement de la carie et la maladie parodontale2,5. Les études cliniques démontrent une relation de cause à effet entre l’accumulation du biofilm sur les dents ou implants dentaires et l’apparition de gingivite ou péri-implantaire mucosite6,7. La progression du processus inflammatoire entraîne péri-implantites et la perte conséquente de l' implant8.
Implants dentaires et leurs composants prothétiques sont sujettes à une colonisation bactérienne et la formation de biofilm9. L’utilisation de matériaux avec une composition chimique et la topographie de la surface qui offre une adhérence microbienne faible peut réduire la prévalence et la progression du péri-implantaire maladies9,10. Titane est le matériau le plus utilisé pour la fabrication des piliers prothétiques pour les implants ; Cependant, les matériaux céramiques ont été nouvellement introduites et gagnent en popularité comme alternative au titane en raison de leurs propriétés esthétiques et biocompatibilité11,12. Également important, les matériaux céramiques ont été associés à censé réduire les risques d’adhérer aux microorganismes, principalement en raison de leur rugosité, mouillabilité et énergie libre de surface10,13.
Des études in vitro ont contribué à des avancées significatives dans la compréhension de l’adhérence microbienne au pilier prothétique surfaces9,14,15,16,17. Cependant, l’environnement dynamique de la cavité buccale, caractérisée par ses variables de température et de pH et de la disponibilité des nutriments, ainsi que par la présence de forces de cisaillement, n’est pas reproductible dans in vitro des protocoles expérimentaux18, 19. Pour contourner ce problème, une alternative est l’utilisation de modèles de in situ de la formation de biofilm, qui avantageusement conserve sa structure tridimensionnelle pour ex vivo analyse10,20, 21 , 22 , 23 , 24.
L’analyse de la structure complexe du biofilm formé sur des substrats par voie orale nécessite l’utilisation des techniques de microscopie capables d’afficher la matière optiquement dense25. Laser multiphotonique, microscopie à balayage est une option moderne pour l’analyse structurale de biofilm26. Elle est caractérisée par l’utilisation de l’optique non linéaire avec une source d’éclairage proche de la longueur d’onde infrarouge, pulsé à femtosecondes27. Cette méthode est indiquée pour l’acquisition d’images de matières marquées par des fluorophores, en plus des images générées par signaux optiques non linéaires, dérivés d’un phénomène appelé la deuxième génération harmonique ou autofluorescence. Parmi les avantages de la microscopie multiphoton sont la profondeur de la grande image obtenue avec la cellule minimum dommages causés par l’intensité de la lumière d’excitation27.
Pour une analyse de la viabilité du biofilm sur les surfaces abiotiques par microscopie multiphoton, l’utilisation de l’acide nucléique fluorescent colorants présentant des caractéristiques spectrales différentes et une capacité de pénétration dans les cellules bactériennes est requis28. Fluorophores SYTO9 (vert fluorescent) et l’iodure de propidium (rouge-fluorescent) peuvent être utilisés pour une différenciation visuelle entre les bactéries vivantes et mortes28,29,30. L’iodure de propidium pénètre seuls bactéries avec membranes endommagées, tandis que SYTO9 pénètre dans les cellules bactériennes avec une membrane intacte et compromise. Lorsque les deux colorants sont présentes à l’intérieur d’une cellule, l’iodure de propidium a une plus grande affinité pour les acides nucléiques et déplace SYTO9, marquant rouge28,30.
Compte tenu de l’environnement buccal complexité et oral biofilm hétérogénéité, microscopie techniques sont nécessaires et qui peut permettre l’analyse de biofilm de la surface des dents et des matériaux dentaires. Cet article décrit une série de protocoles mis en œuvre pour comparer la formation de biofilm oral sur titane et matériaux céramiques pour des piliers prothétiques, ainsi que les méthodes impliquées dans les analyses de biofilms par voie orale aux niveaux cellulaires et morphologiques.
Protocole
Cette étude a été approuvée par la Commission institutionnelle de la faculté d’odontologie de Ribeirão Preto, et le participant volontaire signé le consentement écrit (processus 2011.1.371.583).
1. Biofilm Formation in Situ
-
Sélection des participants
- Sélectionner les patients selon les critères d’inclusion suivants : un individu sain avec une dentition complète et aucun signe clinique de maladies buccodentaires.
- Exclure les patients selon les critères d’exclusion suivants : grossesse, allaitement, carie dentaire, une maladie parodontale ou antibiothérapie dans les 3 derniers mois, fumeur ou n’importe quelle maladie systémique qui pourrait influer sur l’État parodontal.
-
Préparation du dispositif intra-oral
- Enregistrer l’arcade maxillaire au moyen d’une impression d’alginate.
- Préparer, Pierre IV type en ajoutant 19 mL d’eau pour 100 g de poudre de pierre. Versez la pierre dans le moule de l’alginate pour faire un modèle du maxillaire.
- Concevoir et fabriquer un appareil intra-oral acrylique pour prendre en charge les éprouvettes (disques en céramique et titane).
- Fabriquer des fermoirs rétentives du fil NiCr (0,7 mm de diamètre) à l’aide de pinces orthodontiques #139 et positionnez-les sur le modèle. Pour positionner la pince entre les prémolaires supérieures, pliez une extrémité de chaque fil pour qu’ils forment une boucle.
- Adapter la boucle dans la région de la papille interdentaire. Dans l’occlusion, insérez une courbure douce pour ne pas interférer avec les points de contact et l’occlusion. Faire un 90° Pliez à l’extrémité de la pince pour une conservation à l’acrylique.
- Pour fixer la pince dans la deuxième molaire supérieure, adapter la courbure du fil dans le troisième col de l’utérus (vestibulaire) de contour de la dent (distale) et de faire un 90° Pliez à l’extrémité de la pince pour une conservation à l’acrylique.
NOTE : Afin d’assurer une rétention/stabilité suffisante à l’appareil intra-oral, les fermoirs de rétention ont été placés entre les prémolaires supérieures et aspect distal de la deuxième molaire des deux côtés de l’arcade dentaire.
- Manipuler l’acrylique autopolymérisable selon les instructions du fabricant, puis appuyez sur la résine acrylique entre 2 plaques de verre (avec une entretoise épaisse de 3 mm interposé) au cours de la phase plastique, faire une feuille épaisse de 3 mm.
- Posez la feuille d’acrylique sur la région palatine du modèle, selon la conception de l’appareil et couper l’excédent acrylique avec un sculpteur, avant la polymérisation.
- Fabriquer des disques de cire en utilisant une matrice métallique [10 mm de diamètre, 2 mm d’épaisseur (superficie de 78,5 mm2)] en plaçant de cire fondue dans la matrice et attendez que la cire se pour solidifier. Manuellement intégrer 4 disques de cire dans la résine acrylique, 2 d'entre eux entre les prémolaires et les 2 autres à côté les deuxièmes molaires.
- Laissez la résine acrylique se polymérisent dans une cocotte sous pression, moins de 20 lb/po2 d’air comprimé pendant 20 min.
- Terminer l’installation intraorale un laboratoire dentaire électrique pièce à main et coupe- et polir avec des abrasifs en caoutchouc.
- Ajuster l’appareil pour une installation parfaite dans la bouche à l’aide de l’équipement décrit ci-dessus.
- Fabriquer des fermoirs rétentives du fil NiCr (0,7 mm de diamètre) à l’aide de pinces orthodontiques #139 et positionnez-les sur le modèle. Pour positionner la pince entre les prémolaires supérieures, pliez une extrémité de chaque fil pour qu’ils forment une boucle.
-
Préparation d’échantillons pour le titane et la zircone
Remarque : Les échantillons (n = 14) sont de 10 mm de diamètre et 2 mm d’épaisseur et avoir une surface de 78,5 mm2.- Polir les surfaces des spécimens avec refroidi à l’eau papiers sablés décroissant d’abrasivité (600, 1200 et 2000 grit), pendant environ 20 min.
Remarque : Le polissage des spécimens a été réalisé afin de normaliser la rugosité de surface à 0,2 µm. - Nettoyer et désinfecter les spécimens et dispositif intra-oral avec un détergent liquide et de l’eau du robinet et ensuite utiliser un bain à ultrasons d’alcool isopropylique pour 15 min. sécher avec des serviettes en papier absorbant.
- Difficulté les spécimens dans le dispositif oral intrabuccal environ 0,1 ml d’adhésif thermofusible non toxiques (Figure 1).
- Installer le périphérique contenant les échantillons dans la cavité buccale.
Remarque : L’appareil intra-oral contenant les échantillons doit être porté pendant 48 h. L’appareil a été retiré et rangé dans une solution saline tamponnée au phosphate (PBS), alors que le patient était manger et effectuer un nettoyage par voie orale.
- Polir les surfaces des spécimens avec refroidi à l’eau papiers sablés décroissant d’abrasivité (600, 1200 et 2000 grit), pendant environ 20 min.
2. évaluation de la viabilité bactérienne
Remarque : L’échantillon taille n = 10.
- Préparer une solution de teinture en ajoutant 3 µL de SYTO9 (vert colorant fluorescent des acides nucléiques) et 3 µL de l’iodure de propidium (colorant rouge fluorescent d’acide nucléique) à 1 mL de stérile de l’eau distillée.
NOTE : Préparer des solutions abrie de la lumière. - Transférer les échantillons à une plaque 24 puits et laver soigneusement avec du PBS pour enlever toutes les cellules non adhérentes.
- Ajouter le volume approprié (1 mL) de solution de colorant fluorescent pour couvrir l’échantillon contenant du biofilm. Ajouter le colorant très soigneusement pour ne pas désorganiser le biofilm.
- Incuber le spécimen pendant 20-30 min à température ambiante, abrie de la lumière.
- Laver délicatement l’échantillon de biofilm avec de l’eau distillée stérile pour enlever n’importe quel colorant excédentaire.
- Placer l’échantillon dans un plat en verre bas et effectuez laser multiphotonique, microscopie pour l’analyse de biofilm.
Remarque : L’analyse de la viabilité de cellules bactériennes a été effectué à l’aide d’un système de microscopie multiphoton. La fluorescence de l’iodure de propidium a été détectée à l’aide d’un filtre avec une longueur d’onde d’excitation/émission de 546/680 nm et 477/600 nm pour SYTO9. La taille des images obtenues a été 5.16188 x 5.16188 mm, ce qui correspond à 26,64 mm2 de la superficie totale de chaque échantillon (78,5 mm2) ou 33,94 % de la superficie totale. Les images étaient confectionnées dans la partie plus centrale de l’échantillon, avec une résolution de 1 024 x 1 024 pixels. Le canal rouge et les images de canal vert ont été analysés séparément à l’aide de logiciels de Fidji31. Chaque cellule a été sélectionnée à l’aide d’un outil de sélection et l’intensité de la fluorescence a été mesurée par la densité intégrée des pixels, soustrayant l’arrière-plan de l’image.
3. analyse de la Composition chimique des spécimens par spectroscopie Dispersive en énergie (EDS)
Remarque : L’échantillon taille n = 3.
- Sélectionnez 3 spécimens de chaque substance d’essai exempt de biofilm et évaluer la composition chimique en 2 zones différentes de chaque échantillon à l’aide d’un microscope électronique à balayage couplé à un spectromètre à dispersion d’énergie, avec une tension de faisceau d’électrons de 10 kV32.
4. analyse morphologique du Biofilm bactérien par microscopie électronique à balayage
Remarque : L’échantillon taille n = 1.
- Difficulté du biofilm en immergeant les spécimens dans le glutaraldéhyde 2,5 % dilué dans du tampon de cacodylate de sodium 0,1 M, pH 7,0 à 7,3, pendant 24 h.
- Laver l’échantillon dans le tampon PBS (pH = 7.6).
- Suffixe du biofilm avec 1 % de tétroxyde d’osmium pendant 1 h.
- Laver l’échantillon dans le tampon PBS (pH = 7.6).
- Déshydrater les échantillons de biofilm soigneusement, en les gardant immergé dans l’augmentation des concentrations des solutions d’éthanol (50 %, 70 %, 90 %, 95 % et 100 %).
Remarque : Effectuez 3 échanges d’éthanol à une concentration de 100 %. L’étape de déshydratation totale prend environ 2 h. - Passer les spécimens au point critique de séchoir et faire plusieurs substitutions avec le dioxyde de carbone (CO2) jusqu'à ce que les spécimens soient secs.
- Retirer les spécimens séchés de l’appareil et les monter sur les détenteurs du microscope électronique à balayage.
- Pulvérisation-manteau, une couche de 20 nm d’or sur surface de l’échantillon pour 120 s.
- Insérer les disques d’or-couché dans la chambre du microscope électronique à balayage. Obtenir des images provenant de 5 régions différentes de chaque spécimen, à 20-30 kV sous pression variable et à 650 X grossissement12.
Résultats
La densité de la colonisation du biofilm après 48 h d’in situ de la croissance était représentée dans cette étude, la proportion de la zone colonisée sur les disques de titane et la zircone en ce qui concerne la zone balayée totale de l’échantillon à l’aide de la microscopie multiphoton ( 26.64 mm2). La figure 2 représente la densité de la colonisation bactérienne à la surface des 3 matériaux testés. Une densité plus élevée de biofilm a été observée sur les surfaces de la distribution, ainsi que sur les disques de titane usiné (0,0292 µm2 et 0.0213 µm2, respectivement) que dans les disques de zircone (0,0099 µm2; p < 0,05 ; Test de Kruskal-Wallis, suivie de test de Dunn).
La figure 3 montre la viabilité de cellules bactériennes sur les surfaces de la zircone (Figure 3 a, 3 a ', et 3 a »), usinées titane (Figure 3 b, 3 b ', et 3 b ») et transtype titane (Figure 3, 3C ' , et 3 C ») disques. Dans ce protocole, l’iodure de propidium colorant acide nucléique pénètre seulement de bactéries avec une membrane endommagée et, par conséquent, émet un signal fluorescent rouge qui correspond aux cellules mortes. SYTO9 pénètre dans les cellules bactériennes avec membrane intacte ou compromis et émet un signal fluorescent vert de micro-organismes vivants. La viabilité cellulaire bactérienne était similaire entre les matériaux de test, avec une prédominance des micro-organismes vivants dans tous les groupes (Figure 4). Live/dead cellules proportions étaient 2,10 en zircone, 1,95 pour titane usiné et 1,63 pour titane coulé.
Fissures, cannelures ou les défauts de l’abrasion produites sur la surface de toutes les matières durant le processus de polissage et/ou usinage ont été observés, plus clairement en usinées et monter les disques de titane. Dans les disques de la zircone, grandes surfaces ont été observés avec une absence de micro-organismes ; petits agrégats microbiens polymorphes composé principalement de cocci et bacilles, bactéries filamenteuses ont également été observés (Figure 5 a et 5 a '). La présence de cocci et bacilles était éparpillée sur les surfaces des disques de titane usiné (Figure 5 b et 5 b '). Cast titanium spécimens présentés des colonies de micro-organismes impliqués dans une matrice avec une apparence de biofilm sur la surface (Figure 5 et 5C '). Moins matériel matriciel a été observée sur la surface des disques zircone par rapport au titane usiné et disques de fonte titane.
L’analyse de l’EDS a révélé 70.83 % de zircone, 22,84 % d’oxygène, 4,52 % d’yttrium et 1,57 % de hafnium dans les disques de la zircone ; 95,16 % de titane, 3,99 % d’oxygène et 0,85 % du carbone dans les disques de titane coulé ; et 89,86 % de titane, 7,53 % d’oxygène et 2,61 % du carbone dans les disques de titane usiné (Figure 6).

Figure 1 : L’appareil intra-oral pour la in situ étudier. Fermoirs de rétention ont été fabriqués avec fil corroyé et disques de test de titane et la zircone (10 mm de diamètre, 2 mm d’épaisseur) ont été placés au hasard dans les régions prémolaires et molaires, partiellement intégrées dans la guérison automatique de résine acrylique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Images de fluorescence de la densité de la cellule bactérienne. Voici les images de fluorescence de la titane de densité sur la zircone (A), (B) usinée cellule bactérienne, et (C) effectuer un cast des disques de titane après 48 h sur place. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
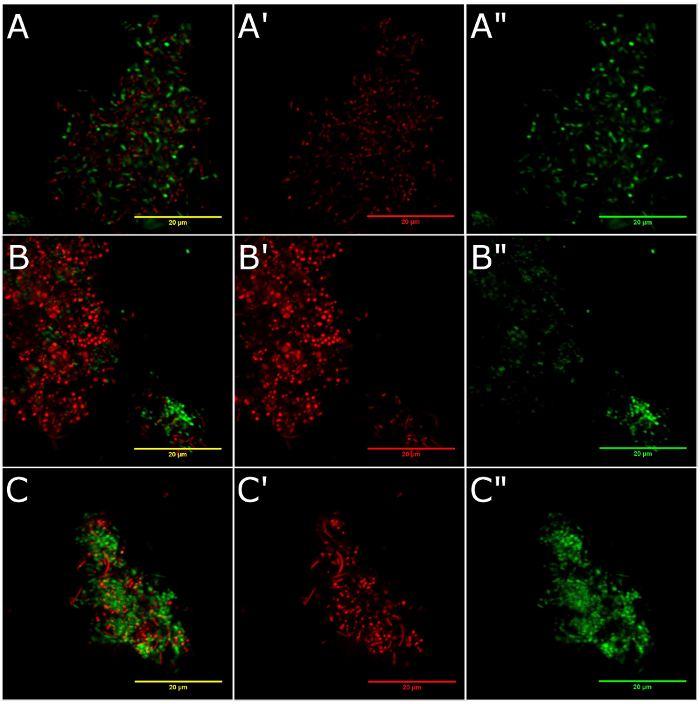
Figure 3 : La viabilité cellulaire de bactéries adhère aux surfaces. Ces panneaux montrent que la viabilité cellulaire de bactéries adhère aux surfaces des morts (A) vivre les cellules bactériennes sur la zircone, (B) morts et vivre les cellules bactériennes sur titane usiné et (C) morts et vivre les cellules bactériennes sur le titane coulé disques représentés par imagerie de fluorescence. Cellules mortes bactériennes sont souillés avec l’iodure de propidium (A', B', et C': signal rouge fluorescente). Bactéries vivantes sont souillées avec SYTO9 (A «, B «, et C »: signal de fluorescence verte). Panneaux A, Bet C montrent des images couleur : fusion. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Boîtes représentant le biofilm viabilité des matériaux différents test cellulaire. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Microscopie électronique à balayage. Ces panneaux montrent la microscopie électronique à balayage de (A, A') zircone, (B, B') usiné titane, et (C, C') monter les disques de titane avec biofilm, panoramique et gros plan vues, après 48 h in situ . S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : Une analyse élémentaire par énergie Dispersive Spectroscopy (EDS). Ces panneaux montrent les disques de zircone (A) (Zr = zircone, Y = yttrium, C = carbone, O = oxygène et Hf = hafnium) ; (B) usinées titane, et (C) effectuer un cast des disques de titane (Ti = titane, O = oxygène et C = carbone). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le protocole décrit dans la présente étude visait à évaluer la formation de biofilm sur les matériaux titane et la zircone pour piliers prothétiques, y compris l’analyse de la viabilité des cellules bactériennes et des caractéristiques morphologiques. Pour ce faire, un modèle in situ de la formation de biofilm a été conçu, composé d’un appareil intra-oral capable d’accueillir des échantillons du matériel test et gardez-les à l’exposé à l’environnement dynamique par voie orale pendant 48 h. L’appareil était considéré comme confortable et facile à insérer, supprimer et nettoyer par le volontaire. Pourtant, il a montré peu d’impact sur la phonétique et de l’esthétique était simple et peu coûteux à fabriquer et a permis une récupération aisée des spécimens sans perturbation de la structure des biofilms. En outre, la méthode a permis la préservation des cellules bactériennes et l’intégrité de la matrice extracellulaire. Le contact de la langue avec les échantillons et la perte accidentelle du disque lors de l’expérience sont les limites du modèle proposé. Afin de réduire les limites de la méthode, le positionnement des disques dans le dispositif intra-oral a été distribué au hasard ; en outre, les disques ont été résolus d’adhésif thermofusible non toxique et sans perte d’échantillon a été signalé.
En raison de l’hétérogénéité élevée des espèces bactériennes vivant dans le milieu buccal, puissant microscope sont obligatoires pour l’analyse des biofilms coloniser les surfaces dures. La microscopie multiphoton offre plusieurs avantages par rapport au analyses de microscopie confocale ou classiques, telles qu’une résolution en trois dimensions inhérente, une excitation proche infrarouge pour la pénétration optique supérieure, une réduction de photoblanchiment et photovieillissement lorsque l’imagerie de cellules vivantes et une capacité à fournir des informations quantitatives33,,34. Ces avantages sont créés grâce à l’excitation très localisée du processus d’absorption biphotonique et l’effet réduit de diffusion de la lumière chez les spécimens. Par conséquent, la microscopie multiphoton permet imagerie tissulaire profonde, dommage cellulaire minimal et une initiation de photochimie bien localisée,34. Échantillonnage aléatoire et à un nombre représentatif de champs doivent être élus pour des analyses précises35,,36. Le laser multiphotonique, microscopie à balayage a permis l’analyse des zones de 5161.88 x 5161.88 µm, correspondant à 33,94 % de surface de l’échantillon total. Microscopie confocale n’était pas utilisée en raison de la nécessité d’un grand nombre de champs pour l’analyse représentative et une longue période d’évaluation des spécimens. En outre, le signal d’out-of-focus fond limité l’utilisation de la microscopie de fluorescence. Malgré les avantages de la microscopie multiphoton, seulement quelques applications dans le domaine microbiologique sont déclarés37,38,,39. Parmi eux se trouve son utilisation comme un outil de manipulation ; par exemple, pour réaliser l’ablation localisée, l’apoptose/nécrose, le blanchiment ou la photoactivation d’un volume bien défini d’un biofilm cellules26. Une autre application de cette méthode consiste à évaluer l’efficacité des agents antibactériens contre plusieurs biofilm composants25,40,41.
Dans cette étude, la viabilité des cellules bactériennes collés a été évaluée avec les colorants fluorescents des acides nucléiques, qui pénètrent les cellules en fonction de leur membrane intégrité28. Iodure de propidium et de fluorophores SYTO9 ont été utilisés pour la différenciation visuelle entre les bactéries vivantes et mortes. Certaines limitations de l’utilisation de l’iodure de propidium et de SYTO9 sont rapportées dans la littérature, telles que la difficulté de SYTO9 pour colorer les bactéries à Gram négatif avec une membrane intacte parce qu’il doit traverser les deux membranes cellulaires présents dans la structure de30, 42. Ainsi, les cellules vivantes peuvent être sous-estimée par une coloration combinée. En outre, lorsque SYTO9 n’est pas complètement remplacée par l’iodure de propidium, fluorescence jaune peut être observée au lieu de rouge dans les cellules bactériennes30,,42. Une autre limitation est la diminution du signal SYTO9 au fil du temps. Il est recommandé que les microscopie des analyses sont effectuées dans les 30 minutes après l’exposition aux colorants29,30. Il est nécessaire d’examiner la fluorescence de fond pour calculer l’intensité du signal, depuis l’autofluorescence du substrat et la présence de colorant non lié peut interférer avec les résultats de30. Néanmoins, étant donné que ces limitations sont bien signalées, il est possible d’avoir les échantillons traités dans le délai spécifié, aussi bien quant à sélectionner soigneusement et à soustraire l’arrière-plan des images à l’aide du logiciel Fidji.
Forte irradiation vide et électrons en microscopie électronique à balayage représentent des conditions défavorables pour les échantillons contenant du matériel biologique. En plus des propriétés non conducteurs, le biofilm dans son état naturel est hydraté, qui interfère avec la génération et la détection système d’électrons, formant des artefacts43. Par conséquent, les échantillons contenant du matériel biologique doivent être préparées afin d’assurer la préservation de la structure et de la conduction de leurs électrons43,44. Les phases de protocole portant sur la fixation, déshydratation, séchage et du revêtement des spécimens avec un matériau conducteur ont été développés avec une attention particulière à la dilution et l’heure. La fixation de la matière biologique a été réalisée avec un aldéhyde dans un tampon de cacodylate et l’après fixation avec le tétroxyde d’osmium, afin de préserver la structure du biofilm collés43,45,46. Déshydratation a été réalisée avec une série ascendante de concentrations d’éthanol, avec l’eau peu à peu remplacé par le solvant organique44. Sécher avec un minimum de distorsion de l’architecture de biofilm a été réalisée par le point critique avec remplacements successifs de liquide CO2 pour l’élimination de l’éthanol, suivie d’une conversion de CO2 en phase gazeuse, une élimination du liquide / interface de gaz et l’élimination de la tension superficielle sur le spécimen43,44,45,46. Pour assurer la conductivité des électrons, prévenir ou réduire les dommages et l’image, que les artefacts, les spécimens ont été recouvertes d’une couche de nm de 10 à 20 d’or ou or/palladium. En outre, les spécimens d’une fine couche de métal de revêtement peut réduire l’accumulation de charges électriques dans un spécimen, améliorer le contraste et augmenter la résolution d’image46.
Malgré quelques limitations, le modèle in situ décrit dans cette étude était adéquat pour l’évaluation de la formation de biofilm oral sur les matériaux titane et la zircone, préservant le biofilm de 48 h. L’utilisation de fluorophores associé à l’imagerie par microscopie multiphoton a permis l’analyse de la viabilité de la cellule bactérienne dans une population très hétérogène des micro-organismes qui colonisent les matériaux de test. Les techniques employées dans la préparation de la biologique échantillons promu préservation structurelle du biofilm et a permis l’acquisition d’images de haute qualité pour la visualisation et la caractérisation morphologique des micro-organismes colonisant .
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier José Augusto Maulin du laboratoire de microscopie multi-utilisateurs (école de médecine de Ribeirão Preto) pour son aide généreuse avec l’EDS et SEM analyses et Hermano Teixeira Machado pour son assistance technique généreuse dans l’édition vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| Hydrogum 5 | Zhermack Dental | C302070 | |
| Durone IV | Dentsply | 17130500002 | |
| NiCr wire | Morelli | 55.01.070 | |
| JET auto polymerizing acrylic | Clássico | ||
| Dental wax | Clássico | ||
| Pressure pot | Essencedental | ||
| Sandpapers 600 grit | NORTON | T216 | |
| Sandpapers 1200 grit | NORTON | T401 | |
| Sandpapers 2000 grit | NORTON | T402 | |
| Metallographic Polishing Machine | Arotec | ||
| Isopropyl alcohol | SIGMA-ALDRICH | W292907 | |
| Hot melt adhesive | TECSIL | PAH M20017 | |
| Filmtracer LIVE/DEAD Biofilm Viability Kit | Invitrogen | L10316 | |
| Pipette Tips, 10 µL | KASVI | K8-10 | |
| Pipette Tips, 1,000 µL | KASVI | K8-1000B | |
| 24-well plate | KASVI | K12-024 | |
| Glass Bottom Dish | Thermo Scientific | 150680 | |
| AxioObserver inverted microscope | ZEISS | ||
| Chameleon vision ii laser | Coherent | ||
| Objective EC Plan-Neofluar 40x/1.30 Oil DIC | ZEISS | 440452-9903-000 | |
| SDD sensors - X-Max 20mm² | Oxford Instruments | ||
| Glutaraldehyde solution | SIGMA-ALDRICH | G5882 | |
| Sodium cacodylate Buffer | SIGMA-ALDRICH | 97068 | |
| Osmium tetroxide | SIGMA-ALDRICH | 201030 | |
| Na2HPO4 | SIGMA-ALDRICH | S9638 | Used for preparation of phosphate buffered saline |
| KH2PO4 | SIGMA-ALDRICH | P9791 | |
| NaCl | MERK | 1.06404 | |
| Kcl | SIGMA-ALDRICH | P9333 | |
| Ethanol absolute for analysis EMSURE | MERK | 1.00983 | |
| CPD 030 Critical Point Dryer | BAL-TEC | ||
| JSM-6610 Series Scanning Electron Microscope | JEOL | ||
| SCD 050 Sputter Coater | BAL-TEC |
Références
- Do, T., Devine, D., Marsh, P. D. Oral biofilms: molecular analysis, challenges, and future prospects in dental diagnostics. Clinical, Cosmetic and Investigational Dentistry. 5, 11-19 (2013).
- Samaranayake, L., Matsubara, V. H. Normal Oral Flora and the Oral Ecosystem. Dental Clinics of North America. 61 (2), 199-215 (2017).
- Larsen, T., Fiehn, N. E. Dental biofilm infections - an update. Acta Pathologica, Microbiologica, et Immunologica Scandinavica. 125 (4), 376-384 (2017).
- Marsh, P. D., Do, T., Beighton, D., Devine, D. A. Influence of saliva on the oral microbiota. Periodontology 2000. 70 (1), 80-92 (2016).
- Marsh, P. D., Zaura, E. Dental biofilm: ecological interactions in health and disease. Journal of Clinical Periodontology. 44 Suppl 18, S12-S22 (2017).
- Zitzmann, N. U., Berglundh, T., Marinello, C. P., Lindhe, J. Experimental peri-implant mucositis in man. Journal of Clinical Periodontology. 28 (6), 517-523 (2001).
- Meyer, S., et al. Experimental mucositis and experimental gingivitis in persons aged 70 or over. Clinical and biological responses. Clinical Oral Implants Research. 28 (8), 1005-1012 (2017).
- Salvi, G. E., Cosgarea, R., Sculean, A. Prevalence and Mechanisms of Peri-implant Diseases. Journal of Dental Research. 96 (1), 31-37 (2017).
- Hahnel, S., Wieser, A., Lang, R., Rosentritt, M. Biofilm formation on the surface of modern implant abutment materials. Clinical Oral Implants Research. 26 (11), 1297-1301 (2015).
- Nascimento, C., et al. Bacterial adhesion on the titanium and zirconia abutment surfaces. Clinical Oral Implants Research. 25 (3), 337-343 (2014).
- Nakamura, K., Kanno, T., Milleding, P., Ortengren, U. Zirconia as a dental implant abutment material: a systematic review. The International Journal of Prosthodontics. 23 (4), 299-309 (2010).
- Scarano, A., Piattelli, M., Caputi, S., Favero, G. A., Piattelli, A. Bacterial adhesion on commercially pure titanium and zirconium oxide disks: an in vivo human study. Journal of Periodontology. 75 (2), 292-296 (2004).
- Nascimento, C., et al. Microbiome of titanium and zirconia dental implants abutments. Dental Materials. 32 (1), 93-101 (2016).
- Rimondini, L., Cerroni, L., Carrassi, A., Torricelli, P. Bacterial colonization of zirconia ceramic surfaces: an in vitro and in vivo study. The International Journal of Oral & Maxillofacial Implants. 17 (6), 793-798 (2002).
- de Avila, E. D., Avila-Campos, M. J., Vergani, C. E., Spolidorio, D. M., Mollo Fde, A. Structural and quantitative analysis of a mature anaerobic biofilm on different implant abutment surfaces. Journal of Prosthetic Dentistry. 115 (4), 428-436 (2016).
- de Avila, E. D., et al. Impact of Physical Chemical Characteristics of Abutment Implant Surfaces on Bacteria Adhesion. Journal of Oral Implantology. 42 (2), 153-158 (2016).
- de Avila, E. D., et al. Effect of titanium and zirconia dental implant abutments on a cultivable polymicrobial saliva community. Journal of Prosthetic Dentistry. 118 (4), 481-487 (2017).
- Lin, N. J. Biofilm over teeth and restorations: What do we need to know?. Dental Materials. 33 (6), 667-680 (2017).
- Prada-Lopez, I., Quintas, V., Tomas, I. The intraoral device of overlaid disk-holding splints as a new in situ oral biofilm model. Journal of Clinical and Experimental Dentistry. 7 (1), e126-e132 (2015).
- Prada-Lopez, I., Quintas, V., Vilaboa, C., Suarez-Quintanilla, D., Tomas, I. Devices for in situ Development of Non-disturbed Oral Biofilm. A Systematic Review. Frontiers in Microbiology. 7, 1055 (2016).
- Burgers, R., et al. In vivo and in vitro biofilm formation on two different titanium implant surfaces. Clinical Oral Implants Research. 21 (2), 156-164 (2010).
- do Nascimento, C., et al. Oral biofilm formation on the titanium and zirconia substrates. Microscopy Research and Technique. 76 (2), 126-132 (2013).
- Al-Ahmad, A., et al. In vivo study of the initial bacterial adhesion on different implant materials. Archives of Oral Biology. 58 (9), 1139-1147 (2013).
- Al-Ahmad, A., et al. Bacterial adhesion and biofilm formation on yttria-stabilized, tetragonal zirconia and titanium oral implant materials with low surface roughness - an in situ study. Journal of Medical Microbiology. 65 (7), 596-604 (2016).
- Thomsen, H., et al. Delivery of cyclodextrin polymers to bacterial biofilms - An exploratory study using rhodamine labelled cyclodextrins and multiphoton microscopy. International Journal of Pharmaceutics. 531 (2), 650-657 (2017).
- Lakins, M. A., Marrison, J. L., O'Toole, P. J., van der Woude, M. W. Exploiting advances in imaging technology to study biofilms by applying multiphoton laser scanning microscopy as an imaging and manipulation tool. Journal of Microscopy. 235 (2), 128-137 (2009).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Stocks, S. M. Mechanism and use of the commercially available viability stain, BacLight. Cytometry Part A. 61 (2), 189-195 (2004).
- Johnson, M. B., Criss, A. K. Fluorescence microscopy methods for determining the viability of bacteria in association with mammalian cells. Journal of Visualized Experiments. (79), e50729 (2013).
- Stiefel, P., Schmidt-Emrich, S., Maniura-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. 15, 36 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Placko, H. E., Mishra, S., Weimer, J. J., Lucas, L. C. Surface characterization of titanium-based implant materials. The International Journal of Oral & Maxillofacial Implants. 15 (3), 355-363 (2000).
- So, P. T., Dong, C. Y., Masters, B. R., Berland, K. M. Two-photon excitation fluorescence microscopy. Annual Review of Biomedical Engineering. 2, 399-429 (2000).
- Benninger, R. K., Piston, D. W. Two-photon excitation microscopy for the study of living cells and tissues. Current Protocols in Cell Biology. , 11-24 (2013).
- Gardi, J. E., Nyengaard, J. R., Gundersen, H. J. The proportionator: unbiased stereological estimation using biased automatic image analysis and non-uniform probability proportional to size sampling. Computers in Biology and Medicine. 38 (3), 313-328 (2008).
- Melvin, N. R., Poda, D., Sutherland, R. J. A simple and efficient alternative to implementing systematic random sampling in stereological designs without a motorized microscope stage. Journal of Microscopy. 228 (Pt 1), 103-106 (2007).
- Neu, T. R., Kuhlicke, U., Lawrence, J. R. Assessment of fluorochromes for two-photon laser scanning microscopy of biofilms. Applied and Environmental Microbiology. 68 (2), 901-909 (2002).
- Neu, T. R., Woelfl, S., Lawrence, J. R. Three-dimensional differentiation of photo-autotrophic biofilm constituents by multi-channel laser scanning microscopy (single-photon and two-photon excitation). Journal of Microbiological Methods. 56 (2), 161-172 (2004).
- Neu, T. R., Lawrence, J. R. Innovative techniques, sensors, and approaches for imaging biofilms at different scales. Trends in Microbiology. 23 (4), 233-242 (2015).
- Lacroix-Gueu, P., Briandet, R., Leveque-Fort, S., Bellon-Fontaine, M. N., Fontaine-Aupart, M. P. In situ measurements of viral particles diffusion inside mucoid biofilms. Comptes Rendus Biologies. 328 (12), 1065-1072 (2005).
- Briandet, R., et al. Fluorescence correlation spectroscopy to study diffusion and reaction of bacteriophages inside biofilms. Applied and Environmental Microbiology. 74 (7), 2135-2143 (2008).
- Berney, M., Hammes, F., Bosshard, F., Weilenmann, H. U., Egli, T. Assessment and interpretation of bacterial viability by using the LIVE/DEAD BacLight Kit in combination with flow cytometry. Applied and Environmental Microbiology. 73 (10), 3283-3290 (2007).
- Bergmans, L., Moisiadis, P., Van Meerbeek, B., Quirynen, M., Lambrechts, P. Microscopic observation of bacteria: review highlighting the use of environmental SEM. International Endodontic Journal. 38 (11), 775-788 (2005).
- Hannig, C., Follo, M., Hellwig, E., Al-Ahmad, A. Visualization of adherent micro-organisms using different techniques. Journal of Medical Microbiology. 59 (Pt 1), 1-7 (2010).
- Knutton, S. Electron microscopical methods in adhesion. Methods in Enzymology. 253, 145-158 (1995).
- Fischer, E. R., Hansen, B. T., Nair, V., Hoyt, F. H., Dorward, D. W. Scanning electron microscopy. Current Protocols in Microbiology. , (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon