Method Article
Mündliche Biofilmbildung auf unterschiedlichen Materialien für Zahnimplantate
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll zur mündlichen Biofilmbildung auf Titan und Zirkonoxid Materialien für Zahnersatz Aufbauten, einschließlich der Analyse von Bakterienzellen Lebensfähigkeit und morphologische Eigenschaften zu bewerten. Der oralen Biofilm-Analyse dient eine in Situ -Modell mit mächtigen mikroskopiertechniken verbunden.
Zusammenfassung
Implantate und prothetischen Komponenten sind anfällig für bakterielle Kolonisation und Biofilmbildung. Die Verwendung von Materialien, die geringe mikrobielle Haftung bietet kann die Prävalenz und Fortschreiten der periimplantären Erkrankungen reduzieren. Angesichts der Mundmilieu Komplexität und oralen Biofilm Heterogenität, Mikroskopie, die Techniken benötigt werden, die eine Biofilm-Analyse der Oberflächen der Zähne und Dentalmaterialien aktivieren können. Dieser Artikel beschreibt eine Reihe von Protokollen für den Vergleich von mündlichen Biofilmbildung auf Titan und keramische Werkstoffe für prothetische Aufbauten sowie die Modalität in oralen Biofilmen Analysen auf morphologische und zellulärer Ebene umgesetzt. Das Modell in Situ , mündliche Biofilmbildung auf Titan und Zirkonoxid Materialien für Zahnersatz Widerlager zu bewerten, wie beschrieben in dieser Studie bietet eine befriedigende Erhaltung des Biofilms 48 h, so bekunden, methodische Angemessenheit. Multiphoton-Mikroskopie ermöglicht die Analyse eines Vertreters der Bereich des Biofilms auf der Testmaterialien gebildet. Darüber hinaus ermöglicht den Einsatz des Fluorophore und die Verarbeitung der Bilder multiphoton Mikroskopie mit die Analyse der bakteriellen Lebensfähigkeit in einer sehr heterogenen Bevölkerung von Mikroorganismen. Die Vorbereitung der biologischen Proben für Elektronenmikroskopie fördert die bauliche Erhaltung der Biofilm, Bilder mit guter Auflösung und keine Artefakte.
Einleitung
Bakterielle Biofilme sind komplex, funktionell und strukturell organisiert mikrobielle Gemeinschaften, gekennzeichnet durch eine Vielfalt an mikrobielle Spezies, die eine extrazelluläre, biologisch aktiven Polymer-Matrix1,2zu synthetisieren. Die bakterielle Adhäsion zu biotischen und abiotischen Oberflächen ist eine Formation von der erworbenen Häutchen, hauptsächlich bestehend aus Speichel Glykoproteine1,3,4vorangestellt. Schwache physikalisch-chemischen Wechselwirkungen zwischen Mikroorganismen und das Häutchen sind zunächst etabliert und gefolgt durch stärkere Wechselbeziehungen zwischen bakteriellen Adhesins und Glykoprotein-Rezeptoren von der erworbenen Häutchen. Mikrobielle Vielfalt allmählich durch die Coaggregation der sekundären Kolonisatoren an die Rezeptoren der bereits angeschlossenen Bakterien bilden eine gemischte Gemeinschaft1,3,4, 5.
Homöostase der mündlichen Mikrobiota und seine symbiotische Beziehung mit dem Host ist wichtig für die Erhaltung der Mundgesundheit. Die Dysbiose in oralen Biofilmen erhöht das Risiko für die Entwicklung von Karies und Parodontitis2,5. Klinische Studien zeigen eine Ursache-Wirkungs-Beziehung zwischen der Akkumulation von Biofilm auf den Zähnen oder Zahnimplantaten und die Entwicklung von Gingivitis oder periimplantären Mukositis6,7. Das Fortschreiten des entzündlichen Prozesses führt zu Periimplantitis und dem damit verbundenen Verlust der Implantat-8.
Implantate und prothetischen Komponenten sind anfällig für bakterielle Besiedlung und Biofilm-Bildung-9. Die Verwendung von Materialien mit einer chemischen Zusammensetzung und der Oberflächentopographie, die geringe mikrobielle Haftung bietet möglicherweise die Prävalenz und Fortschreiten der periimplantären Erkrankungen9,10reduzieren. Titan ist das am häufigsten verwendete Material für die Herstellung der prothetische Aufbauten für Implantate; jedoch keramische Werkstoffe wurden vor kurzem eingeführt und werden immer beliebter als Alternative zu Titan wegen ihrer ästhetischen Eigenschaften und Biokompatibilität11,12. Auch wichtig ist, wurden keramische Werkstoffe mit einem angeblich weniger Potenzial zur Einhaltung von Mikroorganismen, vor allem aufgrund ihrer Rauheit der Oberfläche, Benetzbarkeit und freien Oberflächenenergie10,13verbunden.
In-vitro- Studien haben bedeutende Fortschritte im Verständnis der mikrobiellen Adhäsion auf prothetische Abutment Oberflächen9,14,15,16,17beigetragen. Das dynamische Umfeld der Mundhöhle, zeichnet sich durch seine unterschiedlichen Temperatur und pH-Wert und nährstoffverfügbarkeit sowie durch die Anwesenheit von Scherkräften, ist jedoch nicht reproduzierbar in in-vitro- experimentelle Protokolle18, 19. Um dieses Problem zu überwinden, ist eine Alternative die Verwendung von in Situ -Modellen der Biofilmbildung, die vorteilhafterweise seine dreidimensionale Struktur für ex-Vivo Analyse10,20, bewahrt 21 , 22 , 23 , 24.
Die Analyse der komplexen Struktur des Biofilms auf mündliche Substraten gebildet erfordert den Einsatz von mikroskopiertechniken optisch dichter Materie25anzeigen kann. Multiphoton Laser-scanning-Mikroskopie ist eine moderne Option für Biofilm Strukturanalyse26. Es zeichnet sich durch die Verwendung der nichtlinearen Optik mit einer Lichtquelle in der Nähe der Infrarot-Wellenlänge, gepulst bis Femtosekunden27. Diese Methode ist für die Bildaufnahme der Autofluoreszenz Materialien oder Materialien geprägt von Fluorophore, neben Bildern erzeugt durch nichtlineare optische Signale, die ein Phänomen bekannt als zweite harmonische Generation abgeleitet angegeben. Zu den Vorteilen der multiphoton Mikroskopie ist die große Bildtiefe mit minimalen Zellschäden verursacht durch die Intensität der Anregung Licht27erhalten.
Für eine Rentabilität Analyse des Biofilms auf abiotischen Oberflächen durch multiphoton Mikroskopie die Verwendung von fluoreszierenden Nukleinsäure Farbstoffe mit unterschiedlichen spektralen Eigenschaften und eine Eindringen Kapazität in Bakterienzellen erforderlichen28. Fluorophores SYTO9 (grün-fluoreszierende) und Propidium Jodid (rot-fluoreszierend) können für eine visuelle Unterscheidung zwischen lebenden und toten Bakterien28,29,30verwendet werden. Propidium Jodid dringt nur Bakterien mit beschädigten Membranen, während SYTO9 Bakterienzellen mit einer intakten und kompromittiert Membran tritt. Wenn beide Farbstoffe innerhalb einer Zelle vorhanden sind, hat eine größere Affinität für Nukleinsäuren Propidium Jodid und verdrängt SYTO9, kennzeichnet es rot28,30.
Angesichts der Mundmilieu Komplexität und oralen Biofilm Heterogenität, Mikroskopie, die Techniken benötigt werden, die die Biofilm-Analyse der Oberflächen der Zähne und Dentalmaterialien aktivieren können. Dieser Artikel beschreibt eine Reihe von Protokollen für den Vergleich von mündlichen Biofilmbildung auf Titan und keramische Werkstoffe für prothetische Aufbauten sowie die Modalität in oralen Biofilmen Analysen auf morphologische und zellulärer Ebene umgesetzt.
Protokoll
Diese Studie wurde von der Institutional Review Board der School of Dentistry von Ribeirão Preto genehmigt, und die freiwilligen Teilnehmer unterzeichnete schriftliche Zustimmung (Prozess 2011.1.371.583).
1. die Biofilmbildung in Situ
-
Auswahl der Teilnehmer
- Wählen Sie anhand der folgenden Einschlusskriterien Patienten: ein gesunder Mensch mit einem vollständigen Gebiss und keine klinischen Anzeichen von Munderkrankungen.
- Patienten anhand der folgenden Ausschlusskriterien auszuschließen: Schwangerschaft, Stillzeit, Karies, Parodontitis oder Antibiotika-Behandlung in den letzten 3 Monaten, Raucher oder eine systemische Erkrankung, die den parodontalen Status beeinflussen könnten.
-
Vorbereitung der intraoralen Gerät
- Notieren Sie den Oberkiefer Bogen mittels Alginat Eindruck.
- Bereiten Sie Typ IV Stein durch Hinzufügen von 19 mL Wasser, 100 g Steinpulver vor. Gießen Sie die Stein in die Alginat-Form, ein Modell für den Oberkiefer Bogen zu machen.
- Entwerfen und fertigen ein Acryl Intraorales Gerät zur Unterstützung der Probekörper (Titan und keramikscheiben).
- Fabrizieren Sie remanente Spangen aus NiCr Draht (0,7 mm Durchmesser) mit kieferorthopädischen Zange #139 zu und positionieren Sie sie auf dem Modell. Um die Klammer zwischen den oberen Prämolaren zu positionieren, beugen Sie einem Ende jedes Drahtes so dass sie eine Schleife zu bilden.
- Passen Sie die Schleife in der Region von interdental Papillen. In der okklusalen Einfügen einer sanften Krümmung um nicht mit der Ansprechpartner und der Okklusion zu stören. Machen Sie eine 90° am Ende der Klammer für einen Verbleib in Acryl zu falten.
- Um die Klammer in der oberen zweiten molaren passen, passen die Krümmung des Drahtes im zervikalen Drittel (vestibulären) Kontur des Zahnes (distal) zu machen und eine 90° am Ende der Klammer für einen Verbleib in Acryl zu falten.
Hinweis: Um angemessene Aufbewahrung/Stabilität der intraoralen Gerät zu geben, wurden die remanenten Verschlüsse zwischen dem oberen Prämolaren und dem distalen Aspekt der zweiten molaren auf beiden Seiten des Zahnbogens positioniert.
- Manipulieren Sie selbsthärtenden Acrylharz gemäß den Anweisungen des Herstellers zu und drücken Sie die Acrylharz zwischen 2 Glasplatten (mit einem 3 mm dicken Abstandhalter dazwischen) während der Phase der Kunststoff eine 3 mm Dicke Platte machen.
- Lag die Acrylglasscheibe auf den palatinalen Bereich des Modells, nach der Gerätekonstruktion, und schneiden Sie die überschüssige Acrylharz mit einem Carver vor Polymerisation.
- Fabrizieren Sie Wachs Datenträger mit einer metallischen Matrix [10 mm im Durchmesser und 2 mm Dicke (Fläche von 78,5 mm2)] indem man geschmolzene Wachs in die Matrix und warten auf das Wachs zu festigen. In Acrylharz, 2 von ihnen zwischen die Backenzähne und die anderen 2 neben der zweiten molaren 4 Wachs Datenträger manuell einbinden.
- Lassen Sie die Acrylharz in einen drucktopf unter 20 Psi Druckluft für 20 min polymerisieren.
- Beenden Sie die intraorale Gerät mit einem elektrischen Dentallabor Handstück und Fräser zu und Polieren Sie es mit abrasiven Kautschuk.
- Stellen Sie das Gerät für einen korrekten Sitz im Mund mit der oben beschriebenen Ausrüstung.
- Fabrizieren Sie remanente Spangen aus NiCr Draht (0,7 mm Durchmesser) mit kieferorthopädischen Zange #139 zu und positionieren Sie sie auf dem Modell. Um die Klammer zwischen den oberen Prämolaren zu positionieren, beugen Sie einem Ende jedes Drahtes so dass sie eine Schleife zu bilden.
-
Vorbereitung der Titan und Zirkonoxid Exemplare
Hinweis: Proben (n = 14) sind 10 mm im Durchmesser und 2 mm dick und haben eine Fläche von 78,5 mm2.- Polieren der Proben Oberflächen mit wassergekühlten Sandpapers abnehmender Abrasivität (600, 1200 und 2000 Körnung), ca. 20 Minuten.
Hinweis: Das Polieren der Proben wurde durchgeführt, um die Rauheit der Oberfläche bei 0,2 µm zu standardisieren. - Reinigen Sie und Desinfizieren Sie die Proben und intraorale Gerät mit Spülmittel und Wasser aus dem Wasserhahn, und dann verwenden Sie Ultraschallbad Isopropyl-Alkohol für 15 min. mit saugfähigem Küchenpapier abtrocknen.
- Die Exemplare in der intraoralen mündliche Gerät mit etwa 0,1 mL ungiftig Schmelzklebstoff (Abbildung 1) befestigen.
- Installieren Sie das Gerät mit den Proben in der Mundhöhle.
Hinweis: Das intraorale Gerät mit der Proben sollte für 48 Stunden getragen werden. Das Gerät wurde entfernt und gespeichert in Phosphat gepufferte Kochsalzlösung (PBS), während der Patient aß und mündliche Reinigung.
- Polieren der Proben Oberflächen mit wassergekühlten Sandpapers abnehmender Abrasivität (600, 1200 und 2000 Körnung), ca. 20 Minuten.
2. Bewertung der bakteriellen Lebensfähigkeit
Hinweis: Der Stichprobenumfang n = 10.
- Bereiten Sie eine Färbe Lösung durch Zugabe von 3 µL SYTO9 (grüne fluoreszierende Nukleinsäure-Farbstoff) und 3 µL Propidium Jodid (rot fluoreszierende Nukleinsäure-Farbstoff), 1 mL sterilem destilliertem Wasser.
Hinweis: Bereiten Sie Lösungen vor Licht geschützt werden. - Übertragen Sie die Proben auf einer 24-Well-Platte und waschen Sie sie gründlich mit PBS, nicht-anhaftende Zellen zu entfernen.
- Fügen Sie das entsprechende Volumen (1 mL) Fluoreszenzfarbstoff Lösung zur Deckung der Biofilm-haltige Probe. Fügen Sie den Farbstoff sehr sorgfältig damit nicht um den Biofilm zu zerrütten.
- Inkubation der Probe für 20-30 min bei Raumtemperatur, vor Licht geschützt werden.
- Vorsichtig waschen der Biofilm-Probe mit sterilem destilliertem Wasser, überschüssige Farbstoff zu entfernen.
- Legen Sie die Probe in eine Glasschale unten und durchführen Sie multiphoton Laser-scanning-Mikroskopie der Biofilm-Analyse.
Hinweis: Die Analyse der Bakterienzellen Lebensfähigkeit erfolgte mit einem multiphoton Mikroskopie-System. Die Fluoreszenz des Propidium Jodid erkannt wurde, mithilfe eines Filters mit einer Anregung/Emissionswellenlänge von 546/680 nm und 477/600 nm für SYTO9. Die Größe der erhaltenen Bilder war 5.16188 x 5.16188 mm, das entspricht 26,64 mm2 Gesamtfläche von jeder Probe (78,5 mm2) oder 33.94 % der Gesamtfläche. Die Bilder wurden von den zentralen Teil der Probe mit einer Auflösung von 1.024 x 1.024 Pixel gemacht. Der Rotkanal und Grünkanal Bilder wurden separat mit Fidschi Software31analysiert. Jede Zelle wurde mit einem Auswahl-Werkzeug ausgewählt und die Intensität der Fluoreszenz durch die integrierte Dichte der Pixel, Subtraktion den Bildhintergrund gemessen wurde.
3. Analyse der chemischen Zusammensetzung der Proben durch Energy Dispersive Spektroskopie (Hg.)
Hinweis: Der Stichprobenumfang n = 3.
- Wählen Sie 3 Exemplare von jedem Biofilm-Kostenloses Testmaterial und bewerten Sie die chemische Zusammensetzung in 2 verschiedenen Bereichen von jeder Probe mit einem Rasterelektronenmikroskop, gekoppelt an eine dispersive Energie-Spektrometer mit einem Elektron Lichtstrahl Spannung von 10 kV32.
4. Morphologische Analyse des bakteriellen Biofilms durch Rasterelektronenmikroskopie
Hinweis: Der Stichprobenumfang n = 1.
- Den Biofilm durch Eintauchen der Proben in 2,5 % Glutaraldehyd verdünnt in 0,1 M Natrium Cacodylate Puffer, pH-Wert 7,0-7,3, 24 Stunden zu beheben.
- Waschen Sie die Probe in PBS-Puffer (pH = 7,6).
- Postfix den Biofilm mit 1 % Osmium ausgefällt für 1 h.
- Waschen Sie die Probe in PBS-Puffer (pH = 7,6).
- Der Biofilm-Proben sorgfältig zu entwässern, halten sie eingetaucht in steigenden Konzentrationen von Ethanol-Lösungen (50 %, 70 %, 90 %, 95 % und 100 %).
Hinweis: Führen Sie 3-Austausch von Ethanol in einer Konzentration von 100 %. Die totale Austrocknung Schritt dauert etwa 2 h. - Übertragen Sie die Proben auf der kritische Punkt Trockner und machen mehrere Ersetzungen mit Kohlendioxid (CO2) bis die Proben trocken sind.
- Die getrockneten Proben aus dem Gerät entfernen und Klebe sie auf das Raster-Elektronenmikroskop-Inhaber.
- Sputter-Mantel einer 20 nm Schicht aus Gold auf der Probenoberfläche für 120 s.
- Legen Sie die Gold-beschichtete Scheiben in der Raster-Elektronenmikroskop Kammer. Bilder aus 5 verschiedenen Bereichen von jeder Probe, bei 20-30 kV unter Variablen Druck und bei 650 X Vergrößerung12zu erhalten.
Ergebnisse
Die Dichte Besiedlung des Biofilms nach 48 h in Situ Wachstum wurde in dieser Studie durch den Anteil des Bereichs auf den Titan und Zirkonoxid Datenträgern in Bezug auf die gescannten Gesamtfläche der Probe mit multiphoton Mikroskopie (kolonisierten vertreten. 26.64 mm2). Abbildung 2 stellt die bakterielle Besiedlung Dichte auf der Oberfläche die 3 geprüften Materialien. Eine höhere Dichte von Biofilm wurde beobachtet, auf den Oberflächen der Stimmen und auf den bearbeiteten Titan-Platten (0,0292 µm2 und 0.0213 µm2, beziehungsweise) als in den Zirkonia-Scheiben (0.0099 µm2; p < 0,05; Kruskal-Wallis Test, gefolgt von Dunn's Test).
Abbildung 3 zeigt die Bakterienzellen Lebensfähigkeit auf den Oberflächen von Zirkonoxid (Abbildung 3A, 3A ", und 3A"), Titan gefräst (Abb. 3 b, 3 b ', und 3 b "), und Titan gegossen (Abbildung 3, 3 C" , und 3 C ") Festplatten. In diesem Protokoll die Nukleinsäure-Farbstoff Propidium Jodid dringt nur in Bakterien mit einer Membran beschädigt und daher gibt ein rot-fluoreszierend-Signal, das mit abgestorbenen Zellen zusammenhängt. SYTO9 dringt in die Bakterienzellen mit intakten oder gefährdete Membran und strahlt ein grünes Fluoreszenzsignal von lebenden Mikroorganismen. Zelluläre bakterielle Lebensfähigkeit war ähnlich zwischen den Testmaterialien mit einer Dominanz von lebenden Mikroorganismen in allen Gruppen (Abbildung 4). Lebenden/Toten Zellen Proportionen waren 2.10 für Zirkonoxid, 1.95 für maschinell bearbeitete Titan und 1,63 für Besetzung Titan.
Risse, Rillen oder Abrieb Defekte auf der Oberfläche aller Materialien während des Prozesses der Polieren und/oder Bearbeitung hergestellt wurden beobachtet, deutlicher bearbeitet und Titan-Platten gegossen. In die Zirkonoxid-Festplatten wurden größere Flächen mit einer Abwesenheit von Mikroorganismen beobachtet; kleinen polymorphe mikrobielle Aggregate bestehend Kokken, Bazillen und Fadenbakterien wurden auch beobachtet (Abb. 5A und 5A'). Die Anwesenheit von Kokken und Bazillen auf den Oberflächen der bearbeiteten Titan Datenträger verstreut worden (Abb. 5 b und 5 b '). Cast Titan Exemplare präsentiert Kolonien von Mikroorganismen beteiligt in einer Matrix mit einem Biofilm auf der Oberfläche (Abb. 5 und 5 C'). Weniger Matrixmaterial wurde auf die Oberfläche der Zirkon Scheiben im Vergleich zu den bearbeiteten Titan und Besetzung Titan Festplatten festgestellt.
Die EDS-Analyse ergab 70.83 % von Zirkonoxid, 22.84 % Sauerstoff, 4.52 % von Yttrium und 1,57 % von Hafnium in den Zirkonia-Scheiben; 95,16 % Titan, 3,99 % Sauerstoff und 0,85 % des Kohlenstoffs in den Guss-Titan-Scheiben; und 89.86 % Titan, 7,53 % Sauerstoff und 2,61 % des Kohlenstoffs in den bearbeiteten Titan Scheiben (Abbildung 6).

Abbildung 1 : Die intraorale Gerät für die in situ studieren. Remanente Spangen mit Schmiedeeisen Draht hergestellt wurden, und Titan und Zirkonoxid Test Festplatten (10 mm Durchmesser, 2 mm dick) wurden nach dem Zufallsprinzip in den Prämolaren und molaren Regionen, teilweise eingebettet in selbst Heilung Acrylharz positioniert. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Fluoreszenzbilder der Bakterienzelle Dichte. Fluoreszenzbilder der Bakterienzelle Dichte auf (A) Zirkonia, (B) bearbeitet Titan sind, und (C) warf Titan Festplatten nach 48 h in Situ. Bitte klicken Sie hier für eine größere Version dieser Figur.
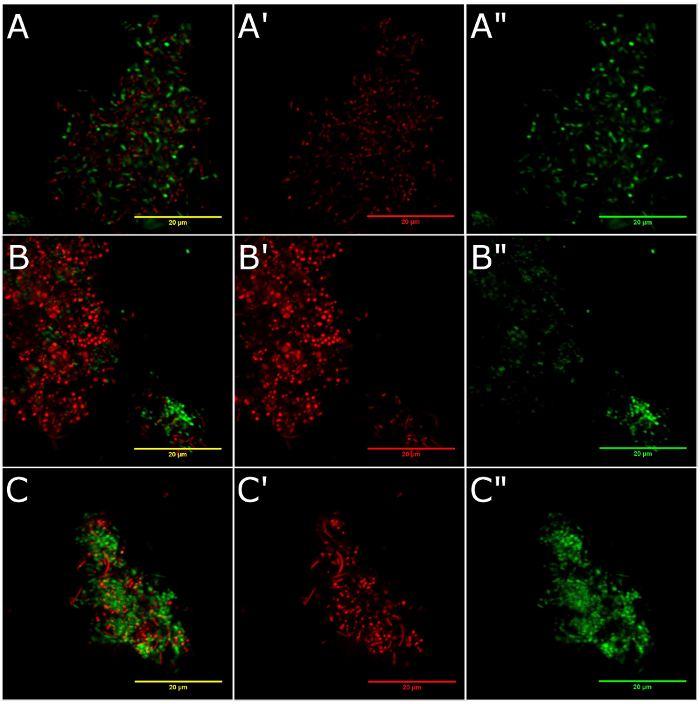
Abbildung 3 : Die Zellviabilität von Bakterien an den Oberflächen eingehalten. Diese Platten zeigen, dass die Oberflächen der Toten (A) die Zellviabilität Bakterien eingehalten und Bakterienzellen auf Zirkoniumoxid, (B) Toten zu leben und Leben Bakterienzellen auf bearbeiteten Titan und (C) tot und Leben Bakterienzellen auf Besetzung Titan Festplatten durch Fluoreszenz-Bildgebung dargestellt. Toten Bakterienzellen sind gefärbt mit Propidium Jodid (A', B', und C': rot-fluoreszierend-Signal). Lebende Bakterien sind mit SYTO9 gefärbt (A ", B", und C ": grüne Fluoreszenzsignal). Bereiche A, Bund C zeigen Farbe verschmolzen Bilder. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 : Boxplots repräsentieren des Biofilms Zelle Lebensfähigkeit auf verschiedene Testmaterialien. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5 : Rasterelektronenmikroskopie. Diese Tafeln zeigen die Rasterelektronenmikroskopie von (A, A') Zirkonia, (B, B') bearbeitet, Titan, und (C, C') Titan-Platten mit Biofilm, in Panorama und Ansichten, Nahaufnahme nach 48 h an Ort und Stelle gegossen . Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6 : Eine Elementaranalyse von Energy Dispersive Spektroskopie (EDS). Diese Tafeln zeigen (A) Zirkonia Festplatten (Zr Zirkonia, Y = = Yttrium, C = Kohlenstoff, O = Sauerstoff und Hf = Hafnium); (B) bearbeitet Titan, und (C) gegossen Titan Festplatten (Ti = Titan, O = Sauerstoff und C = Kohlenstoff). Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
In dieser Studie beschriebene Protokoll wurde entwickelt, um die Biofilmbildung auf Titan und Zirkonoxid Materialien für prothetische Aufbauten, einschließlich der Analyse der Bakterienzelle Lebensfähigkeit und morphologische Eigenschaften zu bewerten. Um dies zu erreichen, wurde eine in Situ -Modell der Biofilmbildung entwickelt, bestehend aus einer intraoralen Geräts in der Lage, Proben von der Testmaterialien unterzubringen und halten sie die dynamische Mundmilieu für 48 h ausgesetzt. Das Gerät wurde als bequem und einfach einfügen, entfernen und Reinigen von der Freiwilligen. Dennoch zeigte sich wenig Auswirkungen auf die Phonetik und Ästhetik, war einfach und billig herzustellen, und erlaubt eine einfache Wiederherstellung der Proben ohne Störung der Biofilm-Struktur. Darüber hinaus erlaubt die Methode der Bewahrung der bakteriellen Zellen und der extrazellulären Matrix Integrität. Der Kontakt der Zunge mit den Proben und den versehentlichen Verlust des Datenträgers während des Experiments sind Grenzen des vorgeschlagenen Modells. Um die Grenzen der Methode zu minimieren, wurde die Positionierung der Scheiben im Intraorales Gerät zufällig verteilt; Darüber hinaus die Scheiben wurden mit ungiftigen Schmelzkleber fixiert, und kein Verlust der Probe wurde berichtet.
Aufgrund der hohen Heterogenität der bakteriellen Arten bewohnen die Mundhöhle sind leistungsstarke mikroskopiertechniken für die Analyse von Biofilmen besiedeln die harten Oberflächen erforderlich. Multiphoton Mikroskopie bietet mehrere Vorteile über konventionelle oder konfokalen Mikroskopie Analysen, z. B. eine inhärente dreidimensionale Auflösung eine Nah-Infrarot-Anregung für überlegene optische eindringen, eine Reduzierung der Immunofluoreszenz und lichtbedingten beim lebenden Zellen und eine Fähigkeit zur quantitativen Angaben33,34abbilden. Diese Vorteile entstehen durch die stark lokalisierte Anregung von der zwei-Photonen-Absorption und die geringere Wirkung der Lichtstreuung in den Proben. Multiphoton-Mikroskopie ermöglicht somit, Tiefengewebe Imaging, minimale Zellschäden und eine Initiation gut lokalisierten Photochemie34. Stichproben und eine repräsentative Anzahl von Feldern sind für genaue Analysen35,36gewählt werden. Die multiphoton Laser-scanning-Mikroskopie erlaubt die Analyse der Bereiche der 5161.88 x 5161.88 µm, 33.94 % der gesamten Probe Fläche entspricht. Konfokale Mikroskopie wurde nicht wegen der Notwendigkeit für eine große Anzahl von Feldern für die repräsentative Analyse und einen langen Zeitraum der Auswertung der Proben verwendet. Darüber hinaus begrenzt die Out-of-Focus Hintergrundsignal die Verwendung von Fluoreszenz-Mikroskopie. Trotz der Vorteile der multiphoton Mikroskopie sind nur ein paar Anwendungen im mikrobiologischen Bereich gemeldeten37,38,39. Unter ihnen ist seine Verwendung als Manipulation Tool; um lokalisierten Ablation zu erreichen, Zellen Apoptose/Nekrose, Bleichen oder photoaktivierungen eines definierten Volumens des Biofilms26. Eine weitere Anwendung dieser Methode ist zur Bewertung der Wirksamkeit der antibakteriellen Wirkstoffe gegen mehrere Biofilm Komponenten25,40,41.
In dieser Studie wurde die Lebensfähigkeit der eingehalten Bakterienzellen mit fluoreszierenden Nukleinsäure-Farbstoffe, die in Abhängigkeit von ihrer Membran Integrität28Zellen eindringen bewertet. SYTO9 Fluorophore und Propidium Jodid wurden für die visuelle Unterscheidung zwischen lebenden und toten Bakterien verwendet. Einige Einschränkungen bei der Verwendung von SYTO9 und Propidium Jodid sind beschrieben, wie die Schwierigkeit, SYTO9, Gram-negativen Bakterien mit einer intakten Membrane zu färben, weil es hat zwei Zellmembranen vorhanden in der Struktur30zu überqueren, 42. Lebende Zellen können so durch eine kombinierte Färbung unterschätzt werden. Wenn SYTO9 nicht vollständig durch Propidium Jodid ersetzt wird, kann darüber hinaus gelbe Fluoreszenz anstelle von rot in Bakterienzellen30,42beobachtet werden. Eine weitere Einschränkung ist die Abnahme des SYTO9-Signals im Laufe der Zeit. Es wird empfohlen, dass die Mikroskopie-Analysen innerhalb von 30 min nach der Exposition auf die Farbstoffe29,30durchgeführt werden. Es ist zu prüfen, die Hintergrundfluoreszenz, die Signalintensität, seit die Autofluoreszenz des Substrates zu berechnen und das Vorhandensein von ungebundenen Farbstoff kann die Ergebnisse30stören. Jedoch da diese Einschränkungen auch gemeldet werden, ist es möglich, die Proben innerhalb des angegebenen Zeitrahmens sowie sorgfältig auswählen und subtrahieren die Bilder Hintergrund mit Hilfe der Fidschi-Software verarbeitet zu haben.
Hohes Vakuum und Elektron Bestrahlung während der Rasterelektronenmikroskopie repräsentieren widrigen Bedingungen für Proben, die biologisches Material. Zusätzlich zu den nicht-leitenden Eigenschaften wird der Biofilm in seinem natürlichen Zustand hydratisiert, die stört des Elektron Erzeugung und Erkennung Systems, bilden Artefakte43. Exemplare mit biologischem Material müssen daher bereit sein, um die Erhaltung der Struktur und Leitung ihrer Elektronen43,44zu gewährleisten. Die Protokoll-Phasen mit Fixierung, Dehydrierung, wurden mit besonderem Augenmerk auf die Verdünnungen und Zeit Trocknen und Beschichtung der Proben mit leitfähigem Material entwickelt. Die Fixierung des biologischen Materials erfolgte mit einem Aldehyd in einem Cacodylate-Puffer und die Post-Fixierung mit Osmium ausgefällt, um die Struktur des eingehalten Biofilm43,45,46zu bewahren. Dehydrierung wurde mit einer aufsteigenden Reihe von Ethanol-Konzentrationen, mit dem Wasser nach und nach ersetzt durch organische Lösungsmittel44erreicht. Trocknung mit minimaler Verzerrung der Biofilm-Architektur wurde durchgeführt durch den kritischen Punkt mit sukzessiven Ersatz flüssiges CO2 für die Ethanol-Entfernung, gefolgt von einer Umwandlung von CO2 in Gasphase, eine Entfernung der Flüssigkeit / Gas-Schnittstelle und die Beseitigung der Oberflächenspannung auf die Probe43,44,45,46. Um die Leitfähigkeit der Elektronen zu gewährleisten, verhindern Sie oder verringern Sie Beschädigung und Bild, das die Artefakte, die Exemplare mit einer 10-20 nm Schicht aus Gold oder Gold/Palladium beschichtet wurden. Darüber hinaus kann Beschichten die Exemplare mit einer dünnen Schicht aus Metall reduzieren die elektrische Ladung Aufbau innerhalb einer Probe, Kontrast verbessern und Bild Auflösung46zu erhöhen.
Trotz einiger Einschränkungen war der in Situ -Modell in dieser Studie beschriebenen ausreichend für die Bewertung der mündlichen Biofilmbildung auf Titan und Zirkonoxid Materialien, Erhaltung des 48 h-Biofilms. Die Verwendung von Fluorophore verbunden mit Bildgebung multiphoton Mikroskopie erlaubt die Analyse der Bakterienzelle Lebensfähigkeit in einer sehr heterogenen Bevölkerung von Mikroorganismen besiedeln die Testmaterialien. Die Techniken eingesetzt, bei der Vorbereitung der biologischen Proben befördert den Biofilm bauliche Erhaltung und erlaubt den Erwerb von qualitativ hochwertige Bilder für die Visualisierung und Morphologische Charakterisierung der Kolonisation Mikroorganismen .
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren danken José Augusto Maulin Mikroskopie Multiuser Laboratory (School of Medicine der Ribeirão Preto), für seine großzügige Unterstützung bei der EDS und SEM Analysen und Hermano Teixeira Machado für seine großzügige technische Hilfe bei der video-Ausgabe.
Materialien
| Name | Company | Catalog Number | Comments |
| Hydrogum 5 | Zhermack Dental | C302070 | |
| Durone IV | Dentsply | 17130500002 | |
| NiCr wire | Morelli | 55.01.070 | |
| JET auto polymerizing acrylic | Clássico | ||
| Dental wax | Clássico | ||
| Pressure pot | Essencedental | ||
| Sandpapers 600 grit | NORTON | T216 | |
| Sandpapers 1200 grit | NORTON | T401 | |
| Sandpapers 2000 grit | NORTON | T402 | |
| Metallographic Polishing Machine | Arotec | ||
| Isopropyl alcohol | SIGMA-ALDRICH | W292907 | |
| Hot melt adhesive | TECSIL | PAH M20017 | |
| Filmtracer LIVE/DEAD Biofilm Viability Kit | Invitrogen | L10316 | |
| Pipette Tips, 10 µL | KASVI | K8-10 | |
| Pipette Tips, 1,000 µL | KASVI | K8-1000B | |
| 24-well plate | KASVI | K12-024 | |
| Glass Bottom Dish | Thermo Scientific | 150680 | |
| AxioObserver inverted microscope | ZEISS | ||
| Chameleon vision ii laser | Coherent | ||
| Objective EC Plan-Neofluar 40x/1.30 Oil DIC | ZEISS | 440452-9903-000 | |
| SDD sensors - X-Max 20mm² | Oxford Instruments | ||
| Glutaraldehyde solution | SIGMA-ALDRICH | G5882 | |
| Sodium cacodylate Buffer | SIGMA-ALDRICH | 97068 | |
| Osmium tetroxide | SIGMA-ALDRICH | 201030 | |
| Na2HPO4 | SIGMA-ALDRICH | S9638 | Used for preparation of phosphate buffered saline |
| KH2PO4 | SIGMA-ALDRICH | P9791 | |
| NaCl | MERK | 1.06404 | |
| Kcl | SIGMA-ALDRICH | P9333 | |
| Ethanol absolute for analysis EMSURE | MERK | 1.00983 | |
| CPD 030 Critical Point Dryer | BAL-TEC | ||
| JSM-6610 Series Scanning Electron Microscope | JEOL | ||
| SCD 050 Sputter Coater | BAL-TEC |
Referenzen
- Do, T., Devine, D., Marsh, P. D. Oral biofilms: molecular analysis, challenges, and future prospects in dental diagnostics. Clinical, Cosmetic and Investigational Dentistry. 5, 11-19 (2013).
- Samaranayake, L., Matsubara, V. H. Normal Oral Flora and the Oral Ecosystem. Dental Clinics of North America. 61 (2), 199-215 (2017).
- Larsen, T., Fiehn, N. E. Dental biofilm infections - an update. Acta Pathologica, Microbiologica, et Immunologica Scandinavica. 125 (4), 376-384 (2017).
- Marsh, P. D., Do, T., Beighton, D., Devine, D. A. Influence of saliva on the oral microbiota. Periodontology 2000. 70 (1), 80-92 (2016).
- Marsh, P. D., Zaura, E. Dental biofilm: ecological interactions in health and disease. Journal of Clinical Periodontology. 44 Suppl 18, S12-S22 (2017).
- Zitzmann, N. U., Berglundh, T., Marinello, C. P., Lindhe, J. Experimental peri-implant mucositis in man. Journal of Clinical Periodontology. 28 (6), 517-523 (2001).
- Meyer, S., et al. Experimental mucositis and experimental gingivitis in persons aged 70 or over. Clinical and biological responses. Clinical Oral Implants Research. 28 (8), 1005-1012 (2017).
- Salvi, G. E., Cosgarea, R., Sculean, A. Prevalence and Mechanisms of Peri-implant Diseases. Journal of Dental Research. 96 (1), 31-37 (2017).
- Hahnel, S., Wieser, A., Lang, R., Rosentritt, M. Biofilm formation on the surface of modern implant abutment materials. Clinical Oral Implants Research. 26 (11), 1297-1301 (2015).
- Nascimento, C., et al. Bacterial adhesion on the titanium and zirconia abutment surfaces. Clinical Oral Implants Research. 25 (3), 337-343 (2014).
- Nakamura, K., Kanno, T., Milleding, P., Ortengren, U. Zirconia as a dental implant abutment material: a systematic review. The International Journal of Prosthodontics. 23 (4), 299-309 (2010).
- Scarano, A., Piattelli, M., Caputi, S., Favero, G. A., Piattelli, A. Bacterial adhesion on commercially pure titanium and zirconium oxide disks: an in vivo human study. Journal of Periodontology. 75 (2), 292-296 (2004).
- Nascimento, C., et al. Microbiome of titanium and zirconia dental implants abutments. Dental Materials. 32 (1), 93-101 (2016).
- Rimondini, L., Cerroni, L., Carrassi, A., Torricelli, P. Bacterial colonization of zirconia ceramic surfaces: an in vitro and in vivo study. The International Journal of Oral & Maxillofacial Implants. 17 (6), 793-798 (2002).
- de Avila, E. D., Avila-Campos, M. J., Vergani, C. E., Spolidorio, D. M., Mollo Fde, A. Structural and quantitative analysis of a mature anaerobic biofilm on different implant abutment surfaces. Journal of Prosthetic Dentistry. 115 (4), 428-436 (2016).
- de Avila, E. D., et al. Impact of Physical Chemical Characteristics of Abutment Implant Surfaces on Bacteria Adhesion. Journal of Oral Implantology. 42 (2), 153-158 (2016).
- de Avila, E. D., et al. Effect of titanium and zirconia dental implant abutments on a cultivable polymicrobial saliva community. Journal of Prosthetic Dentistry. 118 (4), 481-487 (2017).
- Lin, N. J. Biofilm over teeth and restorations: What do we need to know?. Dental Materials. 33 (6), 667-680 (2017).
- Prada-Lopez, I., Quintas, V., Tomas, I. The intraoral device of overlaid disk-holding splints as a new in situ oral biofilm model. Journal of Clinical and Experimental Dentistry. 7 (1), e126-e132 (2015).
- Prada-Lopez, I., Quintas, V., Vilaboa, C., Suarez-Quintanilla, D., Tomas, I. Devices for in situ Development of Non-disturbed Oral Biofilm. A Systematic Review. Frontiers in Microbiology. 7, 1055 (2016).
- Burgers, R., et al. In vivo and in vitro biofilm formation on two different titanium implant surfaces. Clinical Oral Implants Research. 21 (2), 156-164 (2010).
- do Nascimento, C., et al. Oral biofilm formation on the titanium and zirconia substrates. Microscopy Research and Technique. 76 (2), 126-132 (2013).
- Al-Ahmad, A., et al. In vivo study of the initial bacterial adhesion on different implant materials. Archives of Oral Biology. 58 (9), 1139-1147 (2013).
- Al-Ahmad, A., et al. Bacterial adhesion and biofilm formation on yttria-stabilized, tetragonal zirconia and titanium oral implant materials with low surface roughness - an in situ study. Journal of Medical Microbiology. 65 (7), 596-604 (2016).
- Thomsen, H., et al. Delivery of cyclodextrin polymers to bacterial biofilms - An exploratory study using rhodamine labelled cyclodextrins and multiphoton microscopy. International Journal of Pharmaceutics. 531 (2), 650-657 (2017).
- Lakins, M. A., Marrison, J. L., O'Toole, P. J., van der Woude, M. W. Exploiting advances in imaging technology to study biofilms by applying multiphoton laser scanning microscopy as an imaging and manipulation tool. Journal of Microscopy. 235 (2), 128-137 (2009).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Stocks, S. M. Mechanism and use of the commercially available viability stain, BacLight. Cytometry Part A. 61 (2), 189-195 (2004).
- Johnson, M. B., Criss, A. K. Fluorescence microscopy methods for determining the viability of bacteria in association with mammalian cells. Journal of Visualized Experiments. (79), e50729 (2013).
- Stiefel, P., Schmidt-Emrich, S., Maniura-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. 15, 36 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Placko, H. E., Mishra, S., Weimer, J. J., Lucas, L. C. Surface characterization of titanium-based implant materials. The International Journal of Oral & Maxillofacial Implants. 15 (3), 355-363 (2000).
- So, P. T., Dong, C. Y., Masters, B. R., Berland, K. M. Two-photon excitation fluorescence microscopy. Annual Review of Biomedical Engineering. 2, 399-429 (2000).
- Benninger, R. K., Piston, D. W. Two-photon excitation microscopy for the study of living cells and tissues. Current Protocols in Cell Biology. , 11-24 (2013).
- Gardi, J. E., Nyengaard, J. R., Gundersen, H. J. The proportionator: unbiased stereological estimation using biased automatic image analysis and non-uniform probability proportional to size sampling. Computers in Biology and Medicine. 38 (3), 313-328 (2008).
- Melvin, N. R., Poda, D., Sutherland, R. J. A simple and efficient alternative to implementing systematic random sampling in stereological designs without a motorized microscope stage. Journal of Microscopy. 228 (Pt 1), 103-106 (2007).
- Neu, T. R., Kuhlicke, U., Lawrence, J. R. Assessment of fluorochromes for two-photon laser scanning microscopy of biofilms. Applied and Environmental Microbiology. 68 (2), 901-909 (2002).
- Neu, T. R., Woelfl, S., Lawrence, J. R. Three-dimensional differentiation of photo-autotrophic biofilm constituents by multi-channel laser scanning microscopy (single-photon and two-photon excitation). Journal of Microbiological Methods. 56 (2), 161-172 (2004).
- Neu, T. R., Lawrence, J. R. Innovative techniques, sensors, and approaches for imaging biofilms at different scales. Trends in Microbiology. 23 (4), 233-242 (2015).
- Lacroix-Gueu, P., Briandet, R., Leveque-Fort, S., Bellon-Fontaine, M. N., Fontaine-Aupart, M. P. In situ measurements of viral particles diffusion inside mucoid biofilms. Comptes Rendus Biologies. 328 (12), 1065-1072 (2005).
- Briandet, R., et al. Fluorescence correlation spectroscopy to study diffusion and reaction of bacteriophages inside biofilms. Applied and Environmental Microbiology. 74 (7), 2135-2143 (2008).
- Berney, M., Hammes, F., Bosshard, F., Weilenmann, H. U., Egli, T. Assessment and interpretation of bacterial viability by using the LIVE/DEAD BacLight Kit in combination with flow cytometry. Applied and Environmental Microbiology. 73 (10), 3283-3290 (2007).
- Bergmans, L., Moisiadis, P., Van Meerbeek, B., Quirynen, M., Lambrechts, P. Microscopic observation of bacteria: review highlighting the use of environmental SEM. International Endodontic Journal. 38 (11), 775-788 (2005).
- Hannig, C., Follo, M., Hellwig, E., Al-Ahmad, A. Visualization of adherent micro-organisms using different techniques. Journal of Medical Microbiology. 59 (Pt 1), 1-7 (2010).
- Knutton, S. Electron microscopical methods in adhesion. Methods in Enzymology. 253, 145-158 (1995).
- Fischer, E. R., Hansen, B. T., Nair, V., Hoyt, F. H., Dorward, D. W. Scanning electron microscopy. Current Protocols in Microbiology. , (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten