Method Article
Évaluation de la Coagulation du Plasma sur le tissu hépatique dans un grand modèle Animal In Vivo
Dans cet article
Résumé
Nous présentons ici un protocole pour évaluer expérimentalement la coagulation plasmatique dans le tissu hépatique in vivo. Dans un modèle porcin, microcirculation est examinée par laser Doppler, profondeur de la coagulation est mesurée sur le plan histologique, température au site de coagulation par thermomètre infrarouge et caméra thermographique et conduit en effet d’étanchéité est documentée par la pression d’éclatement expériences.
Résumé
Coagulation plasmatique en guise de bistouri électrique est utilisée en chirurgie hépatique pendant des décennies pour sceller la grande surface coupée du foie après hépatectomie majeure pour prévenir les hémorragies à un stade ultérieur. Les effets exacts de coagulation du plasma sur le tissu hépatique sont faiblement examinés. Dans notre modèle porcin, les effets de la coagulation peuvent être examinés à proximité de l’application clinique. Un combiné laser Doppler débitmètre et spectrophotomètre documents microcirculation est modifiée au cours de la coagulation à la profondeur de tissu de 8 mm non invasive, fournissant des informations quantifiables sur hémostase au-delà de l’impression clinique subjective. La température au site de coagulation est évaluée avec une coagulation préalable et post de thermomètre infrarouge et une caméra thermographique lors de la coagulation, une mesure de la température de faisceau de gaz n’est pas possible en raison de la valeur de la limite supérieure des appareils. La profondeur de la coagulation est mesurée au microscope par l’hématoxyline/éosine coupes coloré après étalonnage avec un micromètre objet et donne une information exacte sur la coagulation réglage profondeur-relation de pouvoir. L’effet d’étanchéité est examiné sur les voies biliaires car il n’est pas possible de coagulateur plasma sceller les gros vaisseaux sanguins. Expériences de pression éclatement dehors sur des organes explantés pour écarter la pression artérielle des effets liés.
Introduction
La coagulation plasma argon (APC) est un instrument utilisé en chirurgie abdominale pendant plus de trois décennies,1,2. C’est une technique standard pour la réalisation de l’hémostase secondaire après que hépatectomie majeure en scellant le foie coupé surface pour éviter plus tard des hémorragies3. Coagulation plasmatique est une forme spécialisée de radiofréquence électrocautérisation, qui fournit l’énergie électrique à travers un arc de gaz ionisé. Fournissant une hémostase électrothermique monopolaire, cette technique sans contact a l’avantage d’empêcher l’électrode à coller sur le tissu4. Le faisceau de gaz ionisé est automatiquement dirigé vers la zone de la plus faible résistance électrique et est détourné lorsque la résistance augmente en raison de la dessiccation à d’autres domaines non encore desséchés. Il en résulte une profondeur limitée uniforme de coagulation5,6. Facteurs qui influent sur l’effet de coagulation sont l’activation du temps, le réglage de la puissance de l’appareil de coagulation et de la distance entre la sonde et le tissu. L’hélium est un gaz porteur, qui peut être utilisé pour plasma coagulation7. Cliniques récentes études concentré sur les résultats cliniques plutôt que8,3,les résultats histologiques et fonctionnelles9, tandis que des études expérimentales in vitro enquêtes10 a été consacrée ou des expériences sur des organes perfusés isolés11.
Le protocole sous-jacent permet l’étude des effets de coagulation du plasma dans un modèle animal grand proche de l’application clinique à l’aide de matériel humain standard sur les porcs : Microcirculation est évaluée de façon non invasive par un débitmètre Doppler laser et spectrophotomètre, qui est un outil clinique standard pour cette indication12,13. Les changements de température lors de la coagulation sont contrôlés avec un thermomètre infrarouge et une caméra thermographique. La profondeur de la coagulation est mesurée sur l’hématoxyline/éosine histologique coupes coloré après la récolte d’échantillons de tissus. Pour la comparaison avec d’autres moyens pour l’hémostase secondaire, rafale pression expériences réalisées. Contrairement aux techniques précédemment décrites,14, elles sont menées sur les organes explantés d’exclure de la pression artérielle des effets liés. Outre les investigations décrites sur les effets locaux de coagulation plasmatique, standard des tests sanguins peuvent aussi être exercées dans le modèle porcin.
Protocole
Règles régies par la législation allemande pour les études chez l’animal comme principes of Laboratory Animal Care (National Institutes of Health publication éd. 8, 2011) ont été suivis. Il est permis officiel de l’office gouvernemental de protection des animaux (Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen, Recklinghausen, Allemagne).
1. les animaux
- Utilisez des porcs landrace Allemand femelle (pesant de 25 à 30 kg) logés dans des cages ouvertes.
- Utilisez 5 animaux par groupe (argon et hélium).
- Que les animaux puissent s’acclimater à l’environnement pendant au moins une semaine avant les expériences. Animaux rapides pendant 24 h avant la chirurgie avec libre accès à l’eau.
2. anesthésie
- Premedicate les animaux avec une injection intramusculaire de xylazine (10 mg/kg de poids vif), la kétamine (15 mg/kg de poids corporel [BW]) et l’atropine (0,1 mg/kg de poids vif) 10 min avant l’induction de l’anesthésie.
- Accès veineux périphérique est établi par la mise en place d’une canule de calibre 22 dans une veine de l’oreille.
- Induire l’anesthésie générale par une injection i.v. de propofol 2 mg/kg de poids corporel.
- Placez l’animal en décubitus dorsal et effectuer une incision longitudinale de la peau dans le sillon jugulaire sur une longueur de 2 cm. Locate veine de la préparation émoussée des tissus sous-cutanés. Insérer la canule, puis les fils de Seldinger.
- Retirer la canule et insérez 14 Fr. cathéter sur le guide métallique. Rentrer le fil de guidage. Raccorder le cathéter à l’extension et fixer le cathéter par une sangle ou une suture.
- Tirez sur la languette et insérez le laryngoscope droite. Utilisez la pointe du laryngoscope pour tirer vers le bas de l’épiglotte. Insérer le tube par les cordes vocales. Placez le brassard sous la glotte et gonfler.
- Ventiler avec 40 % d’oxygène à 20-26 respirations/min et un volume de marée de 10 ml/kg pour maintenir la tension de dioxyde de carbone partielle fin d’expiration entre 36 et 42 mm Hg.
- Maintenir l’anesthésie à l’isoflurane à une concentration de 1 à 1,5 % et de fentanyl à une concentration de 3 à 4 µg/kg/h.
- Fournir une solution de Ringer lactate à un taux initial de 4 mL/kg/h et d’augmenter après laparotomie pour un débit de perfusion constante de 8 mL/kg/h.
3. chirurgie et Coagulation plasmatique
- Placer l’animal dans une position couchée sur une table chirurgicale standard.
- Désinfecter la peau en appliquant un désinfectant chirurgical standard (2-Propanol 45 g/100 g, 1-Propanol 10 g / 100g, biphényle-2-ol 0,2 g/100 g) avec un écouvillon chirurgical pour 3 fois.
- Effectuer une laparotomie médiane large du processus xiphoïde au pubis avec un scalpel et d’installer des écarteurs chirurgicaux.
- Allumez l’appareil de coagulation du plasma, ouvrir la bouteille de gaz argon ou hélium, selon le gaz porteur utilisé. Régler le débit de gaz 3 L/min. coagulation Select puissance de sortie du dispositif tel que désiré.
Remarque : Les deux gaz nobles, Argon ou hélium, peut être utilisés pour la coagulation du plasma. Effets de coagulation sont comparables. Voir référence7 pour plus de détails. - Effectuer la coagulation plasmatique sur le lobe gauche du foie comme décrit précédemment7. Utilisez un moule de titane (ouverture carré 1 x 1 cm2) pour standardiser la zone de coagulation. Coaguler pendant 5 s avec une distance de sonde de 1 cm. Les coagulations avec réglages de puissance différente peuvent être effectuées aux côtés de courte distance entre les coagulations de 5 mm (Figure 1).
- Pour la récolte du foie, diviser toutes les connexions ligamentaire au foie. Isoler et diviser le pédicule hépatique au-dessus de la flexure duodénale supérieure tout en conservant les parties longues de la veine porte et de la voie biliaire principale. Diviser la veine cave au-dessus et au-dessous du foie et récupérer l’orgue.
- Après la récolte le foie, les porcs ont été euthanasiés par administration i.v. de 0,16 g/kg BW pentobarbital.
- Pour les expériences de pression d’éclatement, résection de la moitié du lobe hépatique gauche médial avec des ciseaux pointus. La découpe plasma-coaguler (100W-puissance de sortie) de la surface ou de sceller la surface coupée avec la fibrine (Figure 2).
4. mesure de la microcirculation
NOTE : La spectroscopie Laser Doppler permet de déterminer la circulation sanguine dans les tissus en mesurant l’effet Doppler causé par le mouvement des érythrocytes. Le signal du Laser est en corrélation avec le nombre d’érythrocytes mobiles. Spectroscopie Doppler laser est en utilisation clinique (p. ex. médecine de transplantation) et a été validé plusieurs fois15.
- Allumez le débitmètre Doppler laser et le spectrophotomètre. Utiliser une sonde de plate.
- Prendre des mesures de base pour le débit et la vitesse. Enregistrer ou noter les valeurs.
- Apportez la coagulation comme indiqué sous 3,5.
- Placez la sonde plane sur les sites de coagulation et de mesure de débit et de vitesse. Encore une fois, enregistrer ou noter les valeurs.
- Répétez pour tous les paramètres d’alimentation de l’appareil de coagulateur.
5. mesure de la température
- Basculez le système (caméra thermographique, portable et thermomètre infrarouge) et laissez-le tourner pendant au moins 1 h avant d’effectuer les mesures.
- Ajuster le foyer et Découvre le châssis sur la caméra thermographique sur le site de la coagulation. Des séquences infrarouges peuvent être détectés avec la résolution spatiale de 1024 x 768 pixels avec une résolution de température plus grande que 20 mK. Prendre en compte, que la région de coagulation et les tissus environnants — affectés par le transfert de chaleur — est situé au milieu de la vue.
Remarque : Il doit comprendre comme nombre de pixels de l’image que possible pour une résolution spatiale optimale. - Enregistrer le processus de coagulation avec la coagulateur de plasma sur la surface du foie avec la caméra thermographique sur une durée de 2 min.
- Analyser les séquences d’images avec le logiciel d’analyse de thermographie : définir des zones d’intérêt.
Remarque : Le logiciel calcule le parcours de la température moyenne correspondant au fil du temps.
6. mesure de profondeur de coagulation
- Récolter le lobe hépatique médial gauche avec des ciseaux pointus.
- Exciser les sites de coagulation avec 1 cm d’épaisseur. Coupés en segments longitudinaux épais de 3 mm pour un traitement ultérieur.
- Des échantillons de tissus de Fix à 4 ° C durant la nuit avec neutre 10 % tamponnée au formol. Faire chauffer la paraffine 2 ° C au-dessus du point de fusion et incorporer les tranches. Processus du jour au lendemain.
- Effectuer une coloration hématoxyline/éosine.
- Déparaffiner et hydrater le tissu en plongeant par la suite dans 2 x xylène, 100 % d’éthanol (EtOH), 95 % EtOH, 70 % EtOH, déionisée H2O 2 mn chacun.
- Colorez l’échantillon de tissu avec une solution de Meyer hématoxyline pendant 3 min.
- Maintenant, rincer à l’eau du robinet pendant 5 min.
- Tacher le tissu avec la solution d’éosine pendant 3 min.
- Rincez dans 2 x EtOH 95 %, puis de xylène pendant 3 min chaque. Monter avec le milieu de montage standard.
- Allumez le système (microscope caméra connectée, logiciels d’imagerie). Découvre toutes les sections avec un grossissement de 40 X.
- Prendre une image d’un micromètre objet à un grossissement de 40 X. Appuyez sur le bouton Recalibrer dans la fenêtre des objectifs. Sélectionnez étalonnage manuel. Tracez une ligne sur l’image de micromètre de 100 µm. entrée 0,1 mm de la boîte de dialogue, puis appuyez sur OK.
- Sélectionnez la longueur dans la vue > analyse contrôles > fenêtre d’Annotations et de mesures. Mesure de la surface du foie à la marge de coagulation avec la souris. Exporter ou notez le résultat. Recommencez la mesure sur un autre emplacement sur la même lame.
NOTE : Profondeur de la Coagulation peut facilement différencier le tissu hépatique normal par la marge nette entre les cordons des hépatocytes normaux et la zone de nécrose avec cytoplasme ratatiné, noyaux pycnotiques et zones d’hémorragie. - Calculer la moyenne des deux mesures.
7. mesure de pression d’éclatement
- Allumez le système (pompes automatiques, manomètre). Préparer les échantillons de foie selon l’étape de 3,7.
Remarque : Utilisez deux pompes parallèles reliés par un robinet à 3 voies. La pression maximale de 1 500 mm de mercure ne peut être obtenue avec une seule pompe. - Isoler la veine porte, artère hépatique commune et canal cholédoque avec des ciseaux dans le pédicule haptique. Serrez la veine avec une pince overholt et ligaturer avec une suture monofil 4-0. Pince d’artère hépatique commune une pince overholt et ligaturer avec une suture monofil 4-0.
- Insérer le cathéter Ch-16 dans le canal cholédoque et ligaturer avec une suture de soie de 2-0. Raccorder le cathéter sur les pompes automatiques, installer le robinet à 3 voies avec manomètre (Figure 3).
- Remplir la seringue de perfusion avec du sérum physiologique.
- Démarrer les pompes automatiques avec un taux de livraison de 99 mL/h.
- Surveiller le foie compteur coupe de surface et de pression pour fuite et enregistrement pression d’éclatement.
Remarque : Pour une reconnaissance plus facile des fuites, brevet bleu peut être ajouté à une solution saline (2 mL bleu brevet + 18 mL de solution saline). Il est plus facile d’observer la pression d’éclatement en remarquant le moment de la perte de pression sur le manomètre.
Résultats
Microcirculation : Utilisant l’appareil de diagnostic pour l’hémostase après coagulation plasmatique peut être démontrée par les modifications de la microcirculation. Débit (affiché comme unités arbitraires (UA)) de sang capillaire diminue d’une valeur de référence de 142,7 ± 76,08 AU ± 57.78 49.57 à 25 W périphérique sortie alimentation, à 48,5 ± 7.26 UA à 50 W et pour 5,04 ± 1,31 à 100 W (Figure 4).
Température : La température sur les sites de coagulation a été mesurée avec une caméra thermographique (Figure 5). Les changements de température insignifiants seulement ont été documentés avec un thermomètre infrarouge. Il a montré une température de référence de 32.42 2,27 ° C. Après la coagulation avec 25 W, la température était de ± 33,33 1,81 ° C. Coagulation au laser 50 W a produit une température de ± 31.17 2,13 ° C. Après la coagulation avec le réglage de la puissance maximale de 100 W, la température était essentiellement inchangée avec 30,17 ± 3,19 ° C (Figure 6).
Profondeur de coagulation : Coagulation plasmatique crée une zone superficielle de la nécrose avec peuvent être aisément distinguées des parenchyme hépatique normal (Figure 7). La profondeur de la nécrose peut être mesurée à plusieurs sections et montre une augmentation pas complètement linéaire avec des niveaux de puissance montante de la coagulateur de plasma. Après la coagulation plasma hélium, la profondeur de la coagulation est 230.2 ± 57.83µm à 25W, 314,6 µm ± 87,39 à 50 W, 292.2 ± 45,65 µm à 75W et 412.9 ± 160,9 µm à 100 W puissance de sortie périphérique (Figure 8). La puissance de sortie de l’appareil peut être choisie librement et a choisi une corrélation positive avec la coagulation profondeur7.
Pression d’éclatement : Mesures de pression d’éclatement n’effectuée sur la surface coupée du lobe de foie médial gauche explantés montre aucune différence après hélium (1254±578.7 mmHg) ou coagulation plasmatique d’argon (1003 ± 554,4 mmHg) (Figure 9). Pressions d’éclatement sont plus faible comparativement à la fibrine scellants7 mais semblent appropriées pour l’usage clinique.

Figure 1 : lobe de foie médial gauche après coagulation plasma argon. Huit sites de coagulation sur le lobe de foie médial gauche (du haut à gauche en bas à droite : 10 W, 15 L, 20 L, 25 L, 30 L, 50 W, 75 W, 100 W). La mesure de la coagulation standardisée avec le moule. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
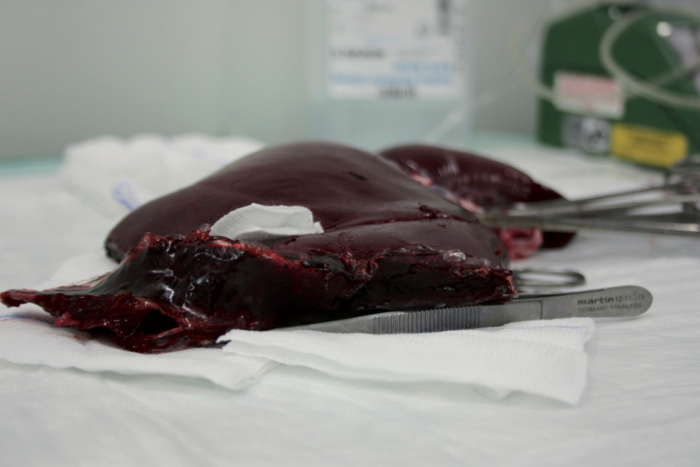
Figure 2 : préparation du greffon hépatique pour les mesures de pression d’éclatement. La moitié du lobe du foie est réséqué et surface coupée du foie est scellée avec la fibrine. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : équipements pour les mesures de pression d’éclatement. Pompe automatique (seringue remplie de sérum physiologique) et manomètre reliés par un robinet à 3 voies. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : modifications de la Microcirculation. Changements dans la circulation (affichée en unités arbitraires) sanguine avant et après la coagulation plasma argon à 25 W, 50 W et 100 W appareil puissance de sortie (n = 3-6). * = P< 0,05, 1-way ANOVA. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : sur les sites de la coagulation, la température mesurée avec une caméra thermographique. L’image exemplaire avec une caméra thermographique lors de la coagulation plasma hélium avec puissance de sortie 40W périphérique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
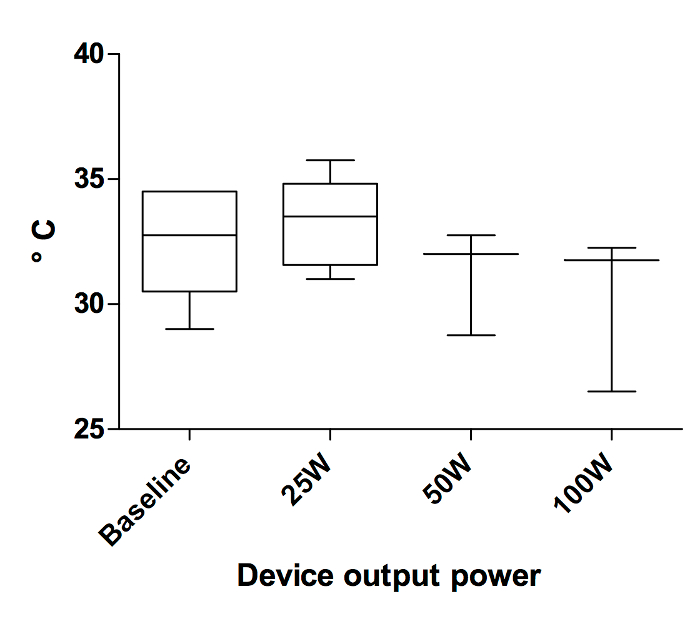
Figure 6 : sur les sites de la coagulation, la température mesurée avec un thermomètre infrarouge. La température sur les sites de coagulation mesurée avec un thermomètre infrarouge avant et après la coagulation du plasma argon (n = 3-6). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
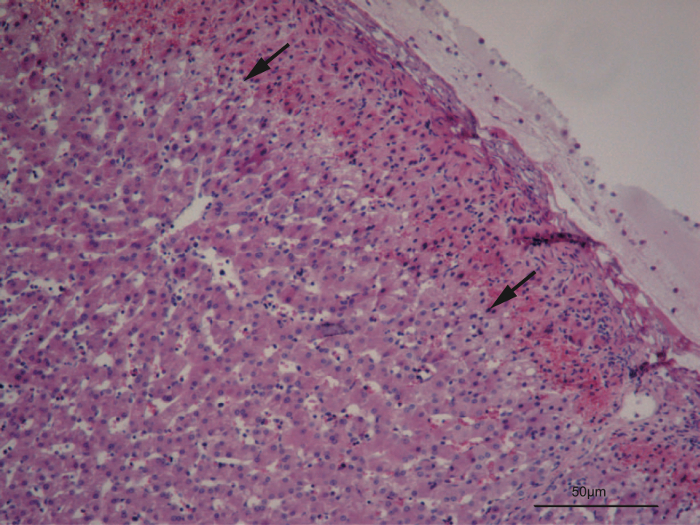
Figure 7 : Zone de nécrose superficielle après coagulation du plasma hélium. L’hématoxyline/éosine colorées section du foie à un grossissement de 40 X. La zone de nécrose montre une perte de l’architecture de hepatocyte de cordon, cellules à cytoplasme ratatiné et zones d’hémorragie. Les flèches indiquent la profondeur de la coagulation à deux endroits différents. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
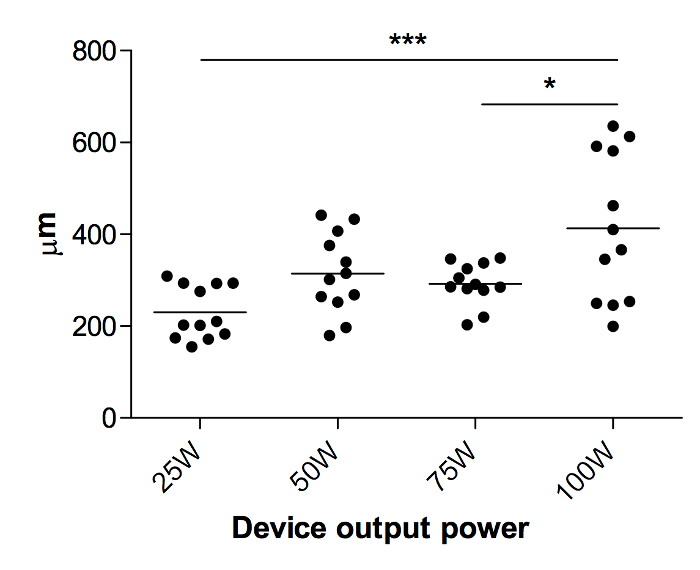
Figure 8 : profondeur de Coagulation après coagulation du plasma hélium. Profondeur de la coagulation à des niveaux différents (25W, 50W, 75W et 100W, n = 6). * = P< 0,05, *** = P< 0,001, 1-way ANOVA. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
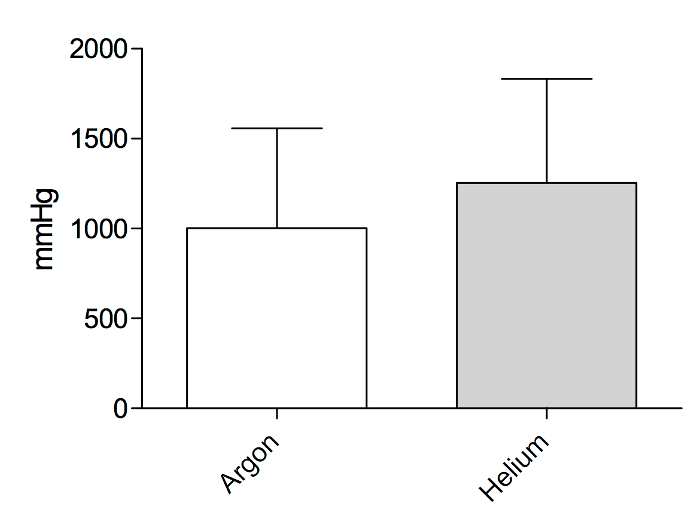
Figure 9 : pression d’éclatement. Éclater les mesures de la pression sur la surface coupée du foie après coagulation plasma argon ou hélium. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
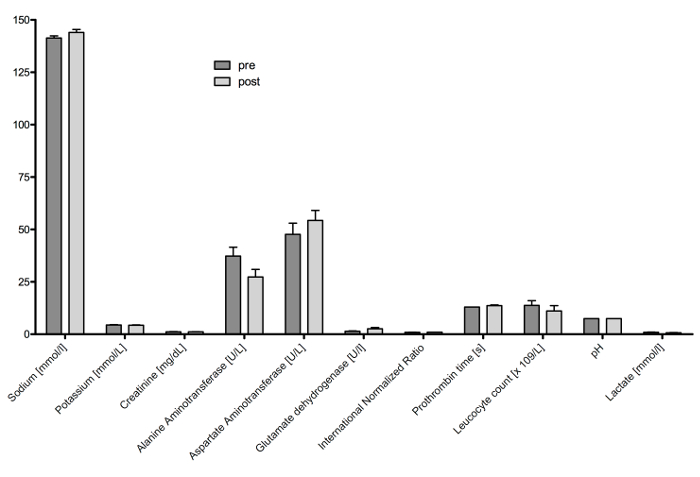
Figure 10 : résultats des tests sanguins. Sélectionné paramètres clinique gaz de biochimie et de sang résultats s’affichent avant et suivant coagulation de plasma d’argon. Pas de changements significatifs se produisent, démontrant les effets de coagulation plasmatique limité aux modifications locales sur le site de la coagulation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Modèles de rongeurs pour chirurgie hépatique sont établies pour une longue période16. Néanmoins, les modèles animaux de grande taille présentent des avantages : aucun équipement de microchirurgie n’est nécessaire comme équipement du dispositif standard pour les êtres humains peut être appliqué, techniques chirurgicales sont comparables à l’utilisation clinique et méthodes d’évaluation clinique standard peuvent être transférés aux expériences. Par exemple, des tests sanguins cliniques standards est réalisable sans la nécessité de méthodes d’essai de laboratoire (Figure 10).
Porcs sont des animaux de laboratoire approprié pour la recherche cardiorespiratoire que leur physiologie ressemble étroitement à l' humain17. En raison de la similitude de taille, de structure segmentaire et d’histologie, porcs sont aussi parmi les animaux de laboratoire standard pour chirurgie hépatique expérimentale18. Coagulation plasmatique a été évaluée dans le modèle porcin en raison des avantages (similitude à la physiologie humaine et évaluation des équipements cliniques)7. Contrairement aux techniques chirurgicales, gestion anesthesiologic ne peut être facilement appliquée. En particulier la gestion des voies respiratoires peut être difficile de17. La distance entre les incisives et la glotte est très longue et l’anatomie est différente pour les humains, ce qui rend l’intubation orotrachéale difficile pour le chercheur inexpérimenté. En outre, ventilation de masque est presque impossible chez les porcs, stratégiesent de récupération (par exemple trachéotomie) devrait donc être présents.
Pour obtenir des résultats comparables à la coagulation du plasma, le chercheur devrait strictement prendre attention à normaliser la distance de la sonde et la durée de la coagulation. S’il est relativement facile de maintenir la distance de la sonde, un chronomètre peut être utilisé pour compter le 5 s de la coagulation. La technique décrite de coagulation du plasma sur la surface du foie a été utilisée dans la recherche fondamentale sur les effets sous-jacents de coagulation du plasma sur le foie en vivo7. Les techniques décrites ci-dessus de la coagulation de l’anesthésie, la chirurgie et plasma porcine permet également d’examiner la résection hépatique majeure et de comparer les différentes techniques de coupe surface d’étanchéité par la suite.
Le débitmètre Doppler laser et le spectrophotomètre pour les mesures de la microcirculation est un outil clinique standard19 , s’est avéré très utile pour l’évaluation de la circulation directement sur le parenchyme d’orgue. Valeurs pour la circulation sanguine et la vitesse d’écoulement de sang sont calculées avec l’avantage de non-invasivité. Microcirculation paramètres sont uniquement des mesures indirectes de l’effet de coagulation, ainsi mesures Doppler doivent être corrélés avec un paramètre objectif pour la coagulation. Dans nos expériences, nous avons utilisé la profondeur histologique de coagulation pour la corrélation.
Une lacune de la mesure de la température est l’impossibilité de mesurer la température du faisceau plasma lors de la coagulation, car la température de la poutre de plasma est au-dessus de la limite maximale des deux appareils. Le thermomètre infrarouge est facile à appliquer, alors que la configuration de la caméra thermographique est plus complexe, mais fournit des données plus précises. La température de référence avant la coagulation est plus faible que prévu (organe porcin température ~38.5 ° C17), démontrant les effets perturbateurs de la laparotomie sur la température corporelle. La température mesurée n’augmente pas pendant et après la coagulation, ce qui démontre l’excellente perfusion du foie. Cet effet thermique voler du foie est connu d’ablation par radiofréquence20. Directions de pression d’éclatement ont été menées sur le système de la voie biliaire principale, plutôt que sur des vaisseaux hépatiques pour une raison simple : il est impossible pour peu de plasma (comme c’est pour les mastics de fibrine) pour sceller les plus gros bateaux. Les deux moyens de l’hémostase secondaire sceller la surface coupée de l’orgue réséqué, tandis que les plus gros navires sont ligaturés au cours de la résection. Nos expériences de pression d’éclatement ont été légèrement modifiés par rapport à la technique signalé14. Nous avons mesuré la pression d’éclatement sur des organes explantés pour des raisons d’organisation. Ces règles sur la pression artérielle des effets liés et sont beaucoup plus faciles à appliquer que d’utiliser perfusé ou organes in vivo . Perfusé de valeurs de la pression des expériences pourraient, par conséquent, diffèrent des / mesuresin vivo en raison de foie altéré structurent (pressions généralement supérieures sur les organes explantés). La technique de pression d’éclatement décrits ci-dessus peut également être réalisée in vivo.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs n’ont aucun remerciements.
matériels
| Name | Company | Catalog Number | Comments |
| Xylazine 20 mg/mL | Vetoquinol GmbH | Xylapan | |
| Ketamine 100 mg/mL | Ceva GmbH | Ceva Ketamine Injection | |
| Atropine 100 mg / 10 mL | Dr. Franz Köhler Chemie GmbH | Atropinsulfat Köhler 100mg Amp. | |
| Propofol | Fresenius Kabi GmbH | Propofol 1% MCT Fresenius | |
| Fentanyl | KG Rotexmedica GmbH | Fentanyl 0,5mg Rotexmedica | |
| Isoflurane | Abbot GmbH | Forene 100% (V/V) 250 mL | |
| Ringer's lactate solution | Baxter Deutschland GmbH | sodium 131mmol/l, potassium 5 mmol/l, calcium 2 mmol/l, cloride 111 mmol/l, lactate 29 mmol/l | |
| Surgical disinfactant | Schülke & Mayr GmbH | Kodan Tinktur forte gefärbt 1l 104804 | |
| Motorized microscope | Nikon Instruments Europe | Eclipse TE2000-E | |
| Microscope camera | Nikon Instruments Europe | Digitalsight DS-Qi1Mc | |
| Imaging software | Nikon Instruments Europe | NIS elements Vers. 4.40 | |
| Plasma coagulator | Söring GmbH | CPC-1000 | |
| Argon gas | Linde AG | Argon 4.8 | |
| Helium gas | Linde AG | Helium 4.8 | |
| O2C | LEA Medizintechnik GmbH | O2C Version 1212 | with LF-2 or LF-3 probe |
| Infrared thermometer | Voltcraft | VOLTCRAFT IR 260-8S | |
| Thermographic camera | InfraTec GmbH | VarioCAM HD head 820 | |
| Thermographic analysis software | InfraTec GmbH | IRBIS 3 | |
| Mayer's Hematoxylin solution | Merck 1.09249 | ||
| Eosin solution | VWR International GmbH | Merck 1.09844 | |
| Rollerpump Masterflex L/S easy Load | Cole-Parmer Instrument Company | model 7518-10 | |
| Perfusorpump | B. Braun Melsungen AG | Perfusor secura FT | |
| Digital pressure meter | Greisinger electronic | GMH 3161 | |
| Perfusorsyringe, 50 mL | B. Braun Melsungen AG | REF 8728810 F | |
| Perfusor line, Type IV Standard, PVC Luer lock | B. Braun Melsungen AG | REF 8722960 | |
| 3-Way stopcock, Dicofix C35C | B. Braun Melsungen AG | REF 16494 C | |
| Silk 2-0. 3 metric | Resorba | REF H5F | |
| Vicryl 4-0 Sutupak | Ethicon | V1224H | |
| NaCl 0.9 % | B. Braun Melsungen AG |
Références
- Link, W. J., Incropera, F. P., Glover, J. L. A plasma scalpel: comparison of tissue damage and wound healing with electrosurgical and steel scalpels. ArchSurg. 111, 392-397 (1976).
- Kwon, A. H., Inui, H., Kamiyama, Y. Successful laparoscopic haemostasis using an argon beam coagulator for blunt traumatic splenic injury. EurJSurg. 167, 316-318 (2001).
- Frilling, A., et al. Effectiveness of a new carrier-bound fibrin sealant versus argon beamer as haemostatic agent during liver resection: a randomised prospective trial. Langenbecks ArchSurg. 390, 114-120 (2005).
- Raiser, J., Zenker, M. Argon plasma coagulation for open surgical and endoscopic applications: state of the art. J Phys Appl Phys. 39 (16), 3520-3523 (2006).
- Farin, G., Grund, K. E. Technology of argon plasma coagulation with particular regard to endoscopic applications. EndoscSurgAllied Technol. 2, 71-77 (1994).
- Grund, K. E. Argon plasma coagulation (APC): ballyhoo or breakthrough?. Endoscopy. 29, 196-198 (1997).
- Glowka, T. R., Standop, J., Paschenda, P., Czaplik, M., Kalff, J. C., Tolba, R. H. Argon and helium plasma coagulation of porcine liver tissue. J Int Med Res. , (2017).
- Dowling, R. D., Ochoa, J., Yousem, S. A., Peitzman, A., Udekwu, A. O. Argon beam coagulation is superior to conventional techniques in repair of experimental splenic injury. JTrauma. 31, 717-720 (1991).
- Go, P. M., Goodman, G. R., Bruhn, E. W., Hunter, J. G. The argon beam coagulator provides rapid hemostasis of experimental hepatic and splenic hemorrhage in anticoagulated dogs. JTrauma. 31, 1294-1300 (1991).
- Brand, C. U., Blum, A., Schlegel, A., Farin, G., Garbe, C. Application of argon plasma coagulation in skin surgery. Dermatology. 197, 152-157 (1998).
- Carus, T., Rackebrandt, K. Collateral tissue damage by several types of coagulation (monopolar, bipolar, cold plasma and ultrasonic) in a minimally invasive, perfused liver model. ISRNSurg. , 518924 (2011).
- Bludau, M., Vallbohmer, D., Gutschow, C., Holscher, A. H., Schroder, W. Quantitative measurement of gastric mucosal microcirculation using a combined laser Doppler flowmeter and spectrophotometer. DisEsophagus. , (2008).
- Beckert, S., Witte, M. B., Konigsrainer, A., Coerper, S. The impact of the Micro-Lightguide O2C for the quantification of tissue ischemia in diabetic foot ulcers. Diabetes Care. 27, 2863-2867 (2004).
- Erdogan, D., de Graaf, W., van Gulik, T. M. Adhesive strength of fibrinogen-coated collagen patch or liquid fibrin sealant in an experimental liver resection model in pigs. Eur Surg Res Eur Chir Forsch Rech Chir Eur. 41 (3), 298-302 (2008).
- Knobloch, K., et al. Microcirculation of the sternum following harvesting of the left internal mammary artery. ThoracCardiovascSurg. 51, 255-259 (2003).
- Kanzler, S., et al. Recommendation for severity assessment following liver resection and liver transplantation in rats: Part I. Lab Anim. 50 (6), 459-467 (2016).
- Pehböck, D., Dietrich, H., Klima, G., Paal, P., Lindner, K. H., Wenzel, V. Anesthesia in swine optimizing a laboratory model to optimize translational research. Anaesthesist. 64 (1), 65-70 (2015).
- Nykonenko, A., Vávra, P., Zonča, P. Anatomic Peculiarities of Pig and Human Liver. Exp Clin Transplant Off J Middle East Soc Organ Transplant. 15 (1), 21-26 (2017).
- Fechner, G., von Pezold, J., Luzar, O., Hauser, S., Tolba, R. H., Müller, S. C. Modified spectrometry (O2C device) of intraoperative microperfusion predicts organ function after kidney transplantation: a pilot study. Transplant Proc. 41 (9), 3575-3579 (2009).
- Patterson, E. J., Scudamore, C. H., Owen, D. A., Nagy, A. G., Buczkowski, A. K. Radiofrequency ablation of porcine liver in vivo: effects of blood flow and treatment time on lesion size. AnnSurg. 227, 559-565 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon