Method Article
Acellulaire biochimique dosage fluorimétrique pour haut débit mesure de peroxydation des lipides dans les lipoprotéines de haute densité
Dans cet article
Résumé
Nous décrivons ici un dosage fluorimétrique acellulaire biochimique pour dosage du HDL-la peroxydation lipidique. Ce test rapid et reproductible peut servir à déterminer la fonction de HDL dans les études à grande échelle et peut contribuer à notre compréhension de la fonction de HDL dans la maladie humaine.
Résumé
Les lipoprotéines de haute densité faible taux de cholestérol (HDL-C) est l’un des plus puissants prédicteurs négatifs indépendants d’athérosclérose cardiovasculaire (MCV). La structure et la fonction des HDL et non HDL-C peuvent prédire avec plus de précision l’athérosclérose. Plusieurs HDL protéines et lipides de compositions changements qui portent atteinte à la HDL se produisent dans les États inflammatoires telles que l’athérosclérose. Fonction de HDL est généralement déterminée par la cellule en fonction des tests comme le test de l’efflux de cholestérol, mais ces tests ont plusieurs inconvénients manque de normalisation. Dosages acellulaire peuvent accorder des mesures plus robustes de fonction de HDL par rapport aux analyses cellulaires. Oxydation de HDL altère la fonction de HDL. HDL a un rôle majeur dans le transport de peroxydes lipidiques et élévé de peroxydes lipidiques est liée à la fonction anormale de HDL. Les interactions lipide-sonde devraient considérer quelle interprétation des résultats de la fluorescence non enzymatique tests pour mesurer l’état d’oxydation lipidique. Cela a motivé nous développions une méthode enzymatique acellulaire biochimique pour évaluer des HDL peroxyde contenu lipidique (HDLox) qui contribue à la dysfonction de HDL. Cette méthode s’inspire de la peroxydase de raifort (HRP) de l’enzyme et le fluorochrome rouge Amplex qui permet de quantifier (sans oxydase de cholestérol) la teneur en lipides peroxydes par mg de HDL-C. Voici un protocole describedfor détermination de la peroxydation lipidique HDL utilisant le réactif de fluorochrome. Variabilité du dosage peut être réduite par une normalisation stricte des conditions expérimentales. HDLox des valeurs plus élevées sont associés à la fonction d’antioxydant HDL réduite. La lecture de ce test est associée de lectures d’essais basés sur les cellules validés, les mesures de substitution des maladies cardiovasculaires, l’inflammation systémique, dysfonctionnement immunitaire et phénotypes de risques cardiovasculaires et métaboliques. Cette approche technique est une méthode fiable pour évaluer la fonction des HDL dans la maladie humaine où l’inflammation systémique, le stress oxydatif et lipides oxydés ont un rôle clé (telles que l’athérosclérose).
Introduction
Les maladies cardiovasculaires athérosclérotiques (CVD) sont la principale cause de décès dans le monde1,2. Les études épidémiologiques ont montré que les faibles niveaux de cholestérol des lipoprotéines de haute densité (HDL) sont généralement inversement associés au risque pour le développement de l’athérosclérose1,2. Bien que plusieurs études prend en charge un rôle atheroprotective HDL1,2, le mécanisme par lequel les HDL atténue l’initiation et la progression de l’athérosclérose est complexe 3,4. Ainsi, il a été suggéré que la structure complexe et la fonction de HDL au lieu du niveau absolu peuvent prédire avec plus de précision l’athérosclérose 5,6,7,8. Plusieurs HDL protéines et lipides de compositions changements qui portent atteinte à la HDL se produisent dans les États inflammatoires telles que l’athérosclérose. Ces i) réduire son cholestérol efflux potentiels 9, ii) réduction anti-inflammatoires et augmentation des protéines pro-inflammatoires associées aux HDL 6,7, niveaux de facteur d’antioxydants diminution iii) et de l’activité et de HDL capacité d’inhiber l’oxydation des lipoprotéines de basse densité (LDLox)10 et iv) augmenter les lipides hydroperoxyde contenu et redox activité (HDLox)9,11. Dosages robustes qui évaluent les fonctions pleotropic de HDL (par exemple l’efflux de cholestérol, fonction antioxydante) peuvent compléter le dosage du HDL-C-HDL dans la clinique.
La fonction de HDL est habituellement évaluée par des méthodes basées sur les cellules comme les efflux de cholestérol dosage8,12,13,14. Ces méthodes ont des limites importantes, y compris une hétérogénéité significative en ce qui concerne les types de cellules utilisées, le type de lecture a signalé, l’absence de normalisation et effets confusionnels des triglycérides 7,15. Ces inconvénients soulèvent des difficultés pour les grandes études cliniques16. Dosages acellulaire peuvent accorder des mesures plus robustes de fonction de HDL par rapport aux analyses cellulaires. L’efflux de cholestérol est l’une des fonctions plus importantes de HDL, mais il ne peut être déterminée par des analyses cellulaires. Autres approches pour déterminer la fonction de HDL comme protéomique17,18,19,20,21,22,23, essais chimiotactisme sur les cellules monocytes de HDL fonction 17,22,25 et 24 n’ont pas été normalisées et ne peut être utilisés dans les études chez l’homme à grande échelle.
HDL a important antioxydant atheroprotective effet5,6,7,8. La fonction antioxydante de HDL a été déterminée en présence de LDL dans la précédente cellule dosages fluorimétrique libre 26. Ces méthodes fluorimétrique biochimiques de la fonction antioxydante HDL ont été développées par Mohamad Navab et Alan Fogelman et leurs collègues26. Bien que plusieurs études sur les humains ont utilisé ces méthodes pour déterminer les HDL fonction 17,18,19,20,21,22,23 ,24, lipides (HDL)-lipides (LDL) et les interactions lipide-fluorochrome peuvent limiter la reproductibilité de ces épreuves biochimiques non-enzymatique libre cellulaire du HDL fonction27,28.
Intérêt récent a mis l’accent sur les conséquences fonctionnelles de l’oxydation de HDL qui est le résultat de l’oxydation des lipides et de protéines dans les HDL 27,29,30. Des études antérieures ont démontré que l’oxydation du HDL altère HDL fonction 27,29,30. HDL a un rôle majeur dans le transport de peroxydes lipidiques et élévé de peroxydes lipidiques est liée à la fonction anormale de HDL. Ainsi les teneur en peroxyde lipidique HDL peut être utilisée pour déterminer les HDL fonction 9,17,20,31 et étant donné les limitations connues des essais préalables de HDL fonction7, 15,27,32, nous avons développé une méthode fluorimétrique alternative qui quantifie les HDL lipides teneur en peroxyde (HDLox) 32. Cette méthode s’inspire de la peroxydase de raifort (HRP) de l’enzyme et le fluorochrome rouge Amplex qui permet de quantifier (sans oxydase de cholestérol) la teneur en lipides peroxydes par mg de HDL-C 32. Principe du dosage biochimique est montré dans la Figure 1. Nous avons montré que cette approche axée sur la fluorescence n’a pas les limites des tests de la fonction de HDL préalable27,28. Ce test a été encore raffiné et standardisé dans notre laboratoire afin qu’il fiable peut être utilisé dans les études chez l’homme à grande échelle même avec cryoconservés plasma 32,33,34, 35 , 36 , 37 , 38 , 39 , 40 , 41 , 42. la lecture de ce test est associée avec lectures d’essais basés sur les cellules validés, les mesures de substitution des maladies cardiovasculaires, l’inflammation systémique, dysfonctionnement immunitaire et phénotypes de risques cardiovasculaires et métaboliques 32 , 33 , 34 , 35 , 36 , 37 , 38 , 39. nous décrivons ici, cette méthode simple mais robuste pour mesurer la teneur en peroxyde lipidique HDL (HDLox). Ce dosage peut servir comme un outil pour répondre à des questions de recherche importantes concernant le rôle de fonction de HDL dans la maladie humaine où l’inflammation systémique, le stress oxydatif et lipides oxydés ont un rôle clé (telles que l’athérosclérose)32.
Protocole
toutes les expériences à l’aide d’échantillons biologiques humains ont été effectués avec l’approbation de l’éthique de l’Université de Californie à Los Angeles, Los Angeles et le Comité de l’éthique humaine Alfred Hospital, Melbourne.
Remarque : il existe de nombreuses variations de la fonction de fluorochrome HDL Assay (Voir discussion) 32. Ci-dessous, nous allons décrire le protocole qui donne des résultats plus cohérents et reproductibles. Une vue d’ensemble du test est illustré à la Figure 2.
1. spécimen de traitement
- utilisation frais, non hémolysé sérum (peuvent être recueillis dans des tubes de séparateur de sérum) ou le citrate plasma obtenu après 12 à 14 heures de jeûne. Si vous utilisez des échantillons cryoconservés, inclure un contrôle approprié tel que décrit dans le présent protocole.
2. Jour 0-préparation pour le dosage
- Prepare travail présentation d’expérience avec les contrôles appropriés, d’échantillons et réplique. Exécuter chaque échantillon au moins en géométrie. Une disposition bien représentant 96 est illustrée à la Figure 3.
- Calculer tous les volumes de réactifs qui seront utilisés pour l’analyse basée sur le nombre d’échantillons et analyses répétées.
NOTE : Inclure un volume supplémentaire de 10 % dans chaque stock de travail pour s’assurer qu’il y a assez de volume pour chaque réactif pour l’expérience spécifique. - Identifier tous les tubes pour toutes les différentes étapes de l’essai par exemple pour la séparation des HDL, mesure de HDL-C (en option) et le fluorochromeassay.
3. Jour 1-Preparation de commandes
- préparation du contrôle commun spécifique à l’étude
- créer un exemple de contrôle de sérum ou de plasma d’étude tous les échantillons. Si en cours d’exécution 20 échantillons dans chaque assiette en trois exemplaires, combiner 10 µL de chaque échantillon dans un contrôle 200 µL mis en commun. Donner une portion distincte de ce contrôle de la mise en commun pour les laboratoires cliniques pour déterminer la valeur de HDL-C de ce contrôle.
Remarque : Utilisez ce contrôle commun pour standardiser l’analyse et à rendre compte de connu de tous les possibles (par exemple type de sérum de matrice ou plasma, cycles gel-dégel, cryoconservation) et des facteurs de confusion inconnus qui peuvent affecter la variabilité expérimentale 27 ,, 28.
- créer un exemple de contrôle de sérum ou de plasma d’étude tous les échantillons. Si en cours d’exécution 20 échantillons dans chaque assiette en trois exemplaires, combiner 10 µL de chaque échantillon dans un contrôle 200 µL mis en commun. Donner une portion distincte de ce contrôle de la mise en commun pour les laboratoires cliniques pour déterminer la valeur de HDL-C de ce contrôle.
- Préparation spécifiques du laboratoire de contrôle de qualité (QCs)
- préparer un stock important de HDL dans chaque laboratoire (par exemple les HDL isolée de 5 mL de plasma provenant de donneurs sains 10) et cryoconservé plusieurs parties aliquotes de cette stock pour réduire les cycles de gel-dégel.
- Utiliser au moins 10 différentes réplique à partir de ce stock pour déterminer la valeur moyenne des HDLox. Une gamme acceptable de HDLox mesurée les valeurs pour chaque échantillon QC inclus dans chaque essai est dans < 15 % du coefficient de variation de cette valeur moyenne.
- Donner une portion distincte de ce contrôle de la mise en commun pour les laboratoires cliniques pour déterminer la valeur de HDL-C de ce contrôle (par exemple 40 mg/dL).
Remarque : Une approche détaillée l’utilisation de sang de banques de sang pour créer ces contrôles a déjà été décrit 27 , 28 , 32. Utiliser des QCs supplémentaire au besoin (p. ex. un provenant d’un donneur sain, connu pour avoir la fonction normale de HDL et l’autre provenant d’un donneur connu pour avoir largement anormale fonction HDL.
- Optimisation du signal de fond et les valeurs vierges (facultatifs)
- pour minimiser le fond, ajouter la quantité appropriée de la catalase (1 à 4 U/mL) dans le milieu d’incubation pour enlever rapidement la formé H 2 O 2 en raison de l’oxydation de l’air spontané des tampons.
Remarque : Étant donné que les valeurs des puits vides (aucun HDL) sont être soustraites des valeurs des échantillons HDL et les résultats sont rapportés par rapport à un contrôle commun (qui est inclus dans la même assiette bien 96), nous avons trouvé que cette étape n’est pas pratiquement influencent t les résultats. Ainsi, optimisation du signal d’arrière-plan avec la catalase peut être omise, si nécessaire.
- pour minimiser le fond, ajouter la quantité appropriée de la catalase (1 à 4 U/mL) dans le milieu d’incubation pour enlever rapidement la formé H 2 O 2 en raison de l’oxydation de l’air spontané des tampons.
4. Jour 1-séparation de cholestérol HDL, à l’aide de précipitations de HDL
Remarque : utilisez un réactif de précipitation HDL cholestérol standardisé disponible commercialement pour isoler apoB appauvri sérum selon le fabricant ' s instructions. Ces réactifs sont largement utilisés dans les dosages colorimétriques pour déterminer les niveaux de cholestérol HDL.
- Utiliser fraîche (ou décongeler) échantillon de sérum ou de plasma.
- Mélanger des quantités égales (par ex. 80 µL) de plasma et réactif précipitant de HDL cholestérol (20 % p/v polyéthylène glycol dans un tampon glycine à pH 10,0 (25 ° C)).
- Mix bien en pipettant également, up et down.
- Centrifuger à 1000-2000 x g pendant 10 min.
- Aspirer le surnageant (fraction HDL).
- Idéalement utiliser immédiatement le HDL isolée pour le fluorochromeassay de la peroxydation lipidique HDL. Toutefois, si plusieurs échantillons sont exécutés dans le même jour et autres étapes comme la mesure de la concentration de HDL-cholestérol sont également fait, puis stocker le HDL isolé à 4 ° C et l’utiliser le lendemain pour la fonction fluorochromeHDL Assay.
5. Jour 1-Détermination du HDL-C HDL isolée
Remarque : cette partie est facultative si la valeur de HDL-C de laboratoire clinique est utilisée pour normaliser les HDLox par la quantité de HDL-C.
- Quantifier le HDL-cholestérol de plasma, à l’aide de la norme colorimétrique dosages 27. Ajouter 50 µL de réactif de cholestérol dans chaque puits et déterminer la concentration de cholestérol à l’aide de colorimétrique d’un lecteur et un cholestérol standard fournis dans chaque kit.
6. Jour 2-préparation des réactifs
- solutions préparer HRP et cholestérol de HRP 5 U/mL de solution (1 et 10 U/mL).
- Préparer 20 mM fluorochrome (p. ex., Amplex rouge) solutions : Décongeler un flacon de réactif fluorochrome et DMSO à température ambiante. Avant utilisation, dissoudre réactif fluorochrome (1 mg) dans 200 µL de DMSO. Stocker la solution-mère congelée à ≤-20 ° C, abri de la lumière.
- Préparer des témoins positifs et négatifs : utilisation 1 X ' tampon de réaction ' sans cholestérol et 20 mM H 2 O 2 solution de travail comme un contrôle positif et négatif, respectivement.
7. Jour 2-Fluorochrome dosage
- Ajouter 50 µL de 1 x tampon de réaction comme vide (témoin négatif).
- Facultatif : ajouter la solution de travail de 20 mM H 2 O 2 comme témoin positif dans chaque assiette.
- Pour minimiser la variabilité expérimentale et faire en sorte que l’addition des réactifs et des échantillons est effectués régulièrement et en temps opportun, effectuer tous les ajouts des échantillons dans une plaque 96 séparée de bien fond rond, clair, en polystyrène ou polypropylène (photo 1). Puis utilisez une pipette multicanaux pour transférer des volumes spécifiques dans 3 plaques à 96 puits (plaques 2-4 : bot en polypropylène, platTom, noir) (qui ont une disposition identique) ( Figure 2, Figure 3).
- Par exemple, tout d’abord ajouter 160 µL de HDL isolée dans chaque puits/échantillon de plaque 1 et ensuite à l’aide de la pipette multicanaux transférer 50 µL de HDL-cholestérol de chaque puits/échantillon dans les plaques 96 puits. Changer les conseils entre chaque ligne/colonne et utiliser les embouts non filtrés pour toutes les cessions.
- Laisser des échantillons dans les puits. Ne pas jeter. Il n’y a aucune étape de lavage entre addition des réactifs.
- Ajouter 50 µL de solution HRP 5 U/mL (0,25 U) dans chaque puits.
Remarque : Utilisez HRP avant l’addition du réactif fluorochrome. - Incuber 30 min à 37 ° C. Ne pas jeter des échantillons après incubation (aucune étape de lavage entre les ajouts de réactifs).
- Ajouter 50 µL de fluorochromereagent pour une concentration finale de 300 µM. À ce stade, volume de réaction totale est de 150 µL. bien mélanger et protéger de la lumière.
- Évaluer l’affichage fluorescent (dans l’obscurité) chaque minute pendant 120 min à 37 ° C avec un lecteur de plaque fluorescente (filtres de 530/590 nm).
Remarque : Utilisez un intervalle de 60 minutes plus court avec les échantillons frais. Nous avons trouvé ce test 120 minutes donne plus de données reproductibles avec l’utilisation d’échantillons cryoconservés. - Enregistrer des données à l’aide de logiciels appropriés.
8. Analyse des données 3 jour
- enregistrer les unités (unités arbitraires) de la fluorescence à 120 minutes après l’addition de la fluorochrome réactif de tous les échantillons, y compris les blancs et tous les contrôles.
- Calculer la valeur moyenne des unités de fluorescence (basé sur au moins triplicates) (HDL ox_sample). Ne prenez pas de valeurs aberrantes (> 2 SDs de la valeur moyenne) en considération.
- Soustraire la fluorescence de fond à l’aide de l’équation suivante :

- normalisation pour la quantité de cholestérol HDL (HDL-C) : normaliser la valeur de la peroxydation lipidique HDLox pour chaque échantillon (y compris le contrôle commun) par le HDL-C) (mg/dl). Tout au long de la section résultats, HDL ox est présenté comme n (HDL-C) HDLox mesure pour tenir compte de l’ajustement pour HDL-C. Utiliser l’équation suivante :

- uniformiser l’expression de HDLox valeur de peroxydation lipidique de chaque échantillon contre la valeur d’un contrôle commun. Normaliser le n (HDL-C) HDLox valeur de peroxydation lipidique pour chaque échantillon (corrigé de HDL-C) par la n (HDL-C) HDLox valeur de peroxydation lipidique du contrôle commun. Tout au long de la section résultats, HDL ox est présenté comme nHDL ox mesure pour tenir compte de l’adaptation aux variations expérimentales et HDL-C. Utiliser l’équation suivante :
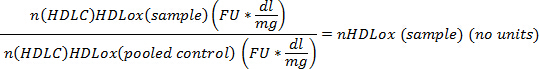
Remarque : cette approche est similaire aux autres approches expérimentales établies afin de réduire la variabilité des mesures expérimentale telles que international normalized ratio (INR) 44 , 45. Cette approche a été validée dans les études cliniques 32 , 33 , 34 , 35 , 36 , 37 , 38 , 39. - effectuer le contrôle de la qualité des résultats expérimentaux à l’aide d’échantillons de contrôle de qualité standard. Chaque laboratoire doit établir ses propres contrôles de qualité (QCs). Idéalement, il y a un pour nHDLox auprès d’un échantillon avec HDL dysfonctionnel connu et un QC pour nHDLox auprès d’un échantillon de donneurs sains [p. ex. utilisation échantillon de jeunes adultes qui sont les donateurs de la Banque de sang établie et n’ont pas connu la comorbidité et facteurs de risque maladies cardiovasculaires notamment fumer]. Le contrôle de ce dernier standardise les résultats entre les différents laboratoires. Les valeurs moyennes de ces QCs sont établies sur la base répétitions au moins 5 (en général, nous utilisons 10 séries pour cette étape importante).
- Cocher si QCs mesuré dans chaque essai ont des valeurs dans l’intervalle prévu des valeurs. En supposant une variabilité expérimentale maximale acceptable de 15 %, toutes les valeurs mesurées expérimentales doivent tomber dans 15 % des valeurs moyennes connues d’établies au Québec. Utiliser les équations suivantes :


Remarque : si soit du contrôle qualité inclus samples () normal par rapport aux HDL dysfonctionnelle) donne des valeurs HDLox en dehors de la plage attendue (mis en place dans chaque laboratoire) puis répéter l’expérience.
- Cocher si QCs mesuré dans chaque essai ont des valeurs dans l’intervalle prévu des valeurs. En supposant une variabilité expérimentale maximale acceptable de 15 %, toutes les valeurs mesurées expérimentales doivent tomber dans 15 % des valeurs moyennes connues d’établies au Québec. Utiliser les équations suivantes :
- Effectuer le contrôle de la qualité des résultats expérimentaux à l’aide du coefficient de variation (CV) pour quantifier la variabilité expérimentale : répéter tous les échantillons avec CV % > 15 %. Utiliser l’équation suivante :

Remarque : une typique intra-essai (dans la même assiette) et la variabilité expérimentale inter-essai (entre les différentes plaques) est < 15 %. 2) typique intra-série CV se situe entre 1 à 7 % et un interassay typique CV est entre 3 et 10 %.
Résultats
50 µL de chaque échantillon de HDL sont ajoutés dans chaque puits comme au point 7.3. 50 µL de solution HRP 5 U/mL (0,25 U) sont ensuite ajoutés dans chaque puits comme à l’étape 7,5. Les échantillons sont incubés pendant 30 min à 37 ° C, comme dans l’étape 7,6. 50 µL de réactif de fluorochrome sont ensuite ajoutés dans chaque puits comme à l’étape 7,7 (concentration finale de 300 µM). L’affichage fluorescent (en foncé) est ensuite évalué chaque minute pendant 120 minutes à 37 ° C avec un lecteur de plaque fluorescente (filtres de 530/590 nm). Données de fluorescence représentatif pour un contrôle vide et mise en commun, échantillon avec HDL dysfonctionnel connu et avec HDL normal sont indiquées à la Figure 4. Premières données représentatives et étape par étape l’analyse des résultats en utilisant les équations décrites à l’article 8 du protocole sont indiqués dans Table 1. Dans cet exemple, les échantillons frais de HDL ont été utilisés et HDLox des valeurs plus élevées sont généralement obtenus avec HDL fraîche. Par exemple, HDL, connu pour être dysfonctionnelles essais indépendants sur la base de fonction de HDL et de personne infectée par le VIH avait environ 2 fois montant relativement plus élevée de lipide peroxyde par rapport aux HDL mise en commun des participants en bonne santé. La figure 5 illustre les résultats représentatifs d’une étude avec des sujets qui ont une déficience HDL fonction28,32. Les personnes infectées par le VIH avaient environ 60 % plus élevés : HDL-lipide peroxyde contenu (par mg de HDL-C) par rapport aux personnes non infectées. Dans nos études antérieures publiées avec HDL cryoconservé, cette méthode a pu démontrer au moins 10 % des différences relatives à HDLox par rapport aux HDL de contrôle des groupes (sans maladie chronique infection à VIH par exemple)36,37, 38.

Figure 1 : Détermination de la teneur en peroxyde lipidique HDL pour une quantité spécifique d’HDL-C.
Dans les États de l’inflammation systémique et stress oxydatif HDL a augmenté les peroxydes lipidiques (LOOH) (HDLox) qui sont associés à la fonction altérée de HDL. HRP catalyse l’oxydation du fluorochrome non fluorescent à résorufine fluorescent rouge. Cette oxydation peut être entraînée par les peroxydes endogènes présents dans la réaction (OH-) et HDL-lipides peroxydés (LOOH-). Sans oxydase de cholestérol, résorufine (avec HRP) permet de quantifier la teneur intrinsèque peroxyde lipidique de HDL d’un montant spécifique de cholestérol HDL. La production de fond de OH - en raison de l’oxydation de l’air de la mémoire tampon est soustraite de l’affichage fluorescent de chaque puits. Résorufine a autofluorescence minime dans la plupart des échantillons. Ce chiffre a été mis à jour le 32. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Vue d’ensemble du flux de travail pour le fluorochromeassay de la peroxydation lipidique HDL.
Jour 0 : La préparation pour le dosage : A) concevoir des mises en page de 96 puits plaque, estimer le volume du besoin d’échantillons (sérum) et réactifs (enzyme HRP, fluorochrome réactif, tampons, PEG réactif), label tubes
Jour 1 : Préparation pour le dosage et l’isolement de HDL : A) préparation des précipitations de HDL B) contrôles (contrôle d’étude spécifiques mis en commun, des contrôles de qualité, contrôles positifs et négatifs) utilisant le réactif de PEG.
Jour 2 : Préparation pour le dosage (si ne pas fait en 1 jour) et le dosage du fluorochrome : A) préparation des contrôles (contrôle d’étude spécifiques mis en commun, des contrôles de qualité, contrôles positifs et négatifs) A) ajout d’échantillons de HDL : afin de minimiser la variabilité expérimentale et veiller à ce que l’addition des réactifs et échantillons seront fera de manière cohérente et en temps opportun, il est recommandé que tous les ajouts d’échantillons (par exemple 160 µL) sont tout d’abord faits dans une plaque 96 séparée de bien fond rond, clair, en polystyrène ou polypropylène (photo 1). Puis une pipette multicanaux peut être utilisée pour transférer des volumes spécifiques (par ex. 50 µL) dans 3 plaques à 96 puits (plaques 2-4 : polypropylène, fond plat, plaques noires) (qui ont une disposition identique). B) addition de HRP : Ajouter 50 µL de 5 U/mL (0,25 U) pour chaque bien en utilisant une pipette multicanaux C) Incuber à 37 ° C pendant 30 min D) Ajouter 50 µL de 300 µM/bien du fluorochrome réactif pour chaque bien en utilisant une pipette multicanaux E) évaluer l’affichage fluorescent (en foncé) chaque minute plus de 120 minutes à 37 ° C avec un lecteur de plaque fluorescente (filtres de 530/590 nm).
Jour 3 : Analyse des données. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
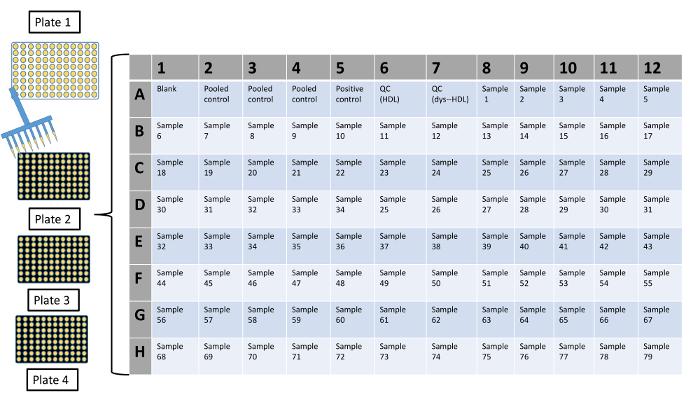
Figure 3 : Mise en page représentant des 96 plaques puits qui sont généralement utilisés dans la fonction fluorochrome HDL Assay.
Différences au moment de l’addition des échantillons de HDL dans le puits d’une plaque peuvent conduire à des différences dans l’oxydation spontanée entre les différents puits. Pour minimiser la variabilité expérimentale, d’éviter une oxydation spontanée variable entre les différents puits et de faire en sorte que l’addition des réactifs et des échantillons se fera systématiquement et en temps opportun, il est recommandé que toutes les additions d’échantillons (par exemple 160 µL) sont tout d’abord fait dans un séparé polystyrène fond bien rond, clair, 96 ou une plaque en polypropylène (photo 1). Puis une pipette multicanaux peut être utilisée pour transférer des volumes spécifiques (par ex. 50 µL) dans 3 plaques à 96 puits (plaques 2-4 : polypropylène, fond plat, plaques noires) (qui ont une disposition identique). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Données représentatives du dosage de la peroxydation lipidique HDL.
L’affichage fluorescent (dans l’obscurité) est ensuite évalué chaque minute pendant 120 minutes à 37 ° C avec un lecteur de plaque fluorescente (filtres de 530/590 nm). Des données représentatives (unités arbitraires) sont indiquées pour vide (aucun HDL ; contrôles négatifs), contrôle positif (H2O2), contrôle de HDL regroupée et HDL de patients connus pour avoir des HDL dysfonctionnel (basé sur deux fonction indépendante de HDL efflux de cholestérol-essais et analyse de chimiotactisme des monocytes). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Le dosage de peroxydes lipidiques de fonction de HDL peut détecter élevée en lipides peroxyde contenu pour une quantité spécifique d’HDL-C in vivo.
HDL est isolé et HDLox a été déterminé comme indiqué dans le protocole pour 50 sujets sains et 100 patients infectés par le VIH. Les personnes infectées par le VIH aient plus HDLox (1.59±0.53) par rapport aux contrôles (1.01±0.31) (p < 0,001). Ce chiffre a été mis à jour le 32. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le protocole décrit ici offre un outil robuste pour répondre à des questions de recherche importantes concernant le rôle de fonction de HDL dans l’athérosclérose et des maladies humaines. L’essai quantifie la teneur en peroxyde lipidique HDL par mg de HDL-C en utilisant l’amplification enzymatique (HRP). Cette approche évite les limitations connues de tests de fonction HDL préalables (par exemple l’essai de l’efflux de cholestérol) y compris une hétérogénéité significative en ce qui concerne les types de cellules utilisées, le type de lecture a signalé, l’absence de normalisation et effets confondants de triglycérides7,15,32. Détermination de biochimique plutôt que des propriétés biologiques (p. ex. efflux de cholestérol) de HDL peut être plus reproductible. La variabilité expérimentale inter-essai de < 10 % se compare favorablement avec les analyses cellulaires de fonction de HDL, où la variabilité expérimentale inter-essai est souvent > 15 % (ou non détectée). En outre, cette approche peut limiter les interactions biochimiques entre lipides et32de sondes fluorescentes. Détermination de l’oxydation des HDL est pertinente dans le contexte des maladies cardiovasculaires, compte tenu du rôle clé du stress oxydatif dans la paroi artérielle dans la pathogenèse de l’athérogenèse 46. Nous avons utilisé le test de fonction de HDL fluorochrome pour détecter la fonction altérée de HDL dans les États de stress oxydatif chronique telles que l’athérosclérose et le Virus de l’immunodéficience humaine (VIH) l’infection32. À l’aide de dosage biochimique de la fonction de HDL, plusieurs études ont confirmé l’association de HDLox avec l’obésité et les maladies cardiovasculaires 19,21,27,34,35 ,36,47. Significativement, dans les études pilotes humains, nous avons démontré associations d’HDLox avec essais validés à base de cellules, de remplacement des mesures de maladies cardiovasculaires, l’inflammation systémique, dysfonctionnement immunitaire et associés à des risques cardiovasculaires et métaboliques phénotypes32,36. Bien que ce test a été utilisé dans plusieurs études pour examiner le rôle de la fonction de HDL dans différentes maladies telles que le VIH chronique infection32,38, athérosclérose 32 et l’obésité36, il reste à validées par des études à grande échelle avec des paramètres cliniques disponibles des maladies cardiovasculaires (infarctus, par exemple).
La réaction du fluorochrome avec les peroxydes en présence de HRP pour produire très fluorescent résorufine est bien établie 48,49. HRP catalyse l’oxydation du fluorochrome non fluorescent à résorufine fluorescent rouge50,,51. Cette oxydation peut être entraînée par les peroxydes endogènes présents dans la réaction (OH-) et HDL-lipides peroxydés (LOOH-). Sans oxydase de cholestérol, résorufine (avec HRP) permet de quantifier la teneur intrinsèque peroxyde lipidique de HDL d’un montant spécifique de cholestérol HDL. La production de fond de OH - en raison de l’oxydation de l’air de la mémoire tampon est soustraite de l’affichage fluorescent de chaque puits. Résorufine a autofluorescence minime dans la plupart des échantillons. Addition de catalase (1 à 4 U/mL) dans le tampon de réaction peut atténuer rapidement les peroxydes endogènes afin que l’augmentation de l’affichage fluorescent au fil du temps est entraînée par les peroxydes lipidiques HDL. Le dosage est polyvalent et peut évaluer la teneur en lipide peroxyde en esters de cholestérol HDL versus gratuit HDL cholestérol32,48,,49 .
Il y a beaucoup de variations de la fonction de HDL fluorochrome Assay32. Brièvement, il y a au moins 3 principales approches : un) ajoutez un volume spécifique d’HDL (par ex. 50 µL) / puits et plus tard normaliser la valeur de la peroxydation lipidique HDL par le niveau de HDL-C, tel que déterminé dans les laboratoires cliniques ; b) déterminer la concentration de HDL-C dans chaque échantillon issu des dosages du cholestérol colorimétrique standard et puis ajoutez un montant spécifique de HDL-C (par exemple 1 µg) par puits ; et c) normaliser l’affichage de fonction de HDL par HDL ou apoA-I protéine contenu32. Il y a aussi au moins 3 approches importantes sur la façon d’isoler les HDL pour essais de peroxydation lipidique HDL : cholestérol HDL) une précipitation par exemple avec du polyéthylène glycol ; b) capture d’immunoaffinité ; et c) autres méthodes pas haut débit standard pour l’isolement de HDL comme µLtracentrifugation32. En outre, le test est polyvalent et peut évaluer la teneur en lipide peroxyde en esters de cholestérol HDL contre gratuit HDL cholestérol 32. Il y a plusieurs façons de déclarer que les résultats par exemple arbitraire fluorescence unités, résorufine normalisés fluorescence, normalisé ratio à un contrôle commun32. Ici, nous présentons la démarche plus reproductible.
Si le plasma est utilisé il est important de préparer plasma dans des tubes disposant de citrate de sodium comme l' anticoagulant 27,28. EDTA40 et héparine sulfate peut interférer avec l’oxydation réactions 41,,42. Sulfate d’héparine peut interférer avec les dosages biochimiques de HDL fonction 27,28. Bien que cryoconservé sérum et le plasma sont pas optimaux pour la détermination des lipides, fonction de HDL et la peroxydation des lipides HDL, échantillons cryoconservés peuvent de quantifier les différences relatives à la peroxydation des lipides HDL par mg de HDL. Il est important de traiter tous les échantillons dans une étude spécifique dans exactement la même manière (par exemple les mêmes cycles de congélation / décongélation) et inclure un contrôle commun dans chaque assiette pour tenir compte des facteurs de confusion potentiels, liés aux différences de traitement entre les différentes études. Cryopréservation à long terme peut compromettre les résultats de HDL fonction dosages43 , mais des différences relatives à la peroxydation des lipides HDL parmi les échantillons au sein d’une étude encore peuvent être évaluées que si un contrôle approprié de mise en commun est utilisé 27, 28.
Ce qui est important, des essais de fonction de HDL préalables ne sont pas normalisées. Nous décrivons ici une approche où l’utilisation de contrôles appropriés assure normalisation de l’affichage. Plus spécifiquement, il y a plusieurs paramètres connus susceptibles d’affecter la lecture des épreuves biochimiques de HDL fonctionnent comme des effets de matrice (sérum vs méthode de préparation de plasma), de la présence d’albumine et d’autres protéines, cryoconservation, gel-dégel 32. test de fluorochrome fonction le HDL peut être normalisée avec l’utilisation de normes commercialement disponibles et réactifs de laboratoire32. Cependant, il y a aussiplusieurs facteurs de confusion inconnus (ou mal caractérisées) dans chaque étudient et entre les différentes personnes qui peuvent affecter le dosage du HDL fonctionnent résultats. Ainsi, dans chaque assiette, nous utilisons un contrôle HDL regroupé préparé à partir de spécimens spécifiques d’intérêt au sein d’une étude donnée (qui ont été traitées de manière identique) qui minimise les artefacts et les facteurs de confusion32. Utilisation des échantillons de plasma sanguin Banque et HDL-C valeurs de laboratoire clinique peut normaliser davantage le dosage32.
Nous avons déjà montré que différentes méthodes d’isolement de HDL peuvent affecter considérablement la lecture des épreuves biochimiques de HDL fonction 27,28,32 , mais le fluorochrome peut mesurer de manière fiable indépendamment de HDLox de l' isolement de HDL 32. Méthodes d’isolation de HDL sont un facteur limitatif important pour des études de haut débit de fonction de HDL. Ultracentrifugation est considéré aujourd'hui comme la méthode de référence, mais il reste une méthode chronophage52. L’électrophorèse est imprécis et non standardisé 53. Méthodes de précipitation de HDL impliquent l’utilisation de polyanions comme le polyéthylène glycol (PEG) à précipiter des lipoprotéines de faible densité, laissant le HDL dans le surnageant 54. Bien que ces méthodes affichent certains inconvénients tels que des résultats variables avec les sérums lipémiques et interférences avec modifications préalables de cholestérol enzymatique procédures 55 sur l’en utilisant la procédure originale normalisé disponible dans le commerce réactifs donnent une procédure simple, fiable et précis de56. Bien que les précipitations PEG sont une méthode couramment utilisée pour isoler les HDL21,57 du sérum du patient, un enjeu majeur est la présence de non-HDL protéines comme l’albumine,58. Isolement d’immuno-affinité peut être utilisé pour réduire au minimum l’effet de l’albumine sur HDL fonction 32. Bien que des différences relatives au HDLox pour une méthode de capture spécifiques peuvent être évalués, des anticorps spécifiques contre les HDL peuvent capturer pas pleinement des structures complexes de HDL. En utilisant des contrôles appropriés, tel que décrit dans le présent protocole, différences relatives au HDLox chez les spécimens de HDL (isolés par précipitation de PEG) peuvent être déterminées de manière fiable.
Ce test, comme tous les autres essais de fonction de HDL, a ses limites clés. In vivo l’oxydation des HDL dans la paroi artérielle est assez complexe et hétérogène et teneur en lipide peroxyde peut refléter que partiellement HDLox46. Fonction et structure de HDL continuellement changes in vivo et mesure de la fonction de HDL en un validant peut-être ne pas refléter l’impact du dysfonctionnement des HDL dans la maladie fin orgue au fil du temps,59. On ne sait pas si l’affichage de la HDLox doit être normalisé de HDL-C, ou HDL protéine 22. Les études cliniques futures devraient valider l’importance de la lecture de l’essai (contenu peroxyde lipidique HDL par mg de HDL-C).
En conclusion, l’essai de fonction de HDL de fluorochrome est une méthode fiable pour la détermination de la teneur en peroxyde lipidique HDL pour une quantité spécifique d’HDL (HDLox). HDLox des valeurs plus élevées sont associés à la fonction d’antioxydant HDL réduite. La lecture de ce test est associée à des essais validés sur les cellules, des mesures de substitution des maladies cardiovasculaires, l’inflammation systémique, dysfonctionnement immunitaire et risques cardiovasculaires et métaboliques des phénotypes 19, 21,27,32,34,35,36,37,38,39, 47. cette méthode offre un outil pratique et robuste, pour examiner le rôle de la fonction de HDL dans la maladie humaine.
Déclarations de divulgation
Ce protocole et le dosage sont pertinentes pour le brevet PCT/US2015/018147.
Remerciements
Les auteurs remercient les travaux du Dr Mohamad Navab, Alan Fogelman et Reddy Srinivasa pour leur rôle clé dans le développement d’itérations précédentes de ce modèle. T.A.A. est pris en charge par un RMIT University rectorale bourse postdoctorale. AJ et AH sont pris en charge par NHMRC projet grant 1108792. TK est pris en charge par NIH accorde NIH K08AI08272, Grant NIH/NCATS # µL1TR000124.
matériels
| Name | Company | Catalog Number | Comments |
| Experimental Reagents | |||
| HDL PEG (Polyethylene Glycol) Precipitating Reagent | Pointe Scientific | H7511 | |
| Amplex Red reagent. | Life Technologies, Grand Island, NY | A12216 | Amplex Red Cholesterol Assay Kit. • ≤–20°C • Desiccate • Protect from light |
| DMSO. | Life Technologies, Grand Island, NY | A12216 | Amplex Red Cholesterol Assay Kit. • ≤–20°C • Desiccate • Protect from light |
| Horse Radish Peroxidase (HRP) | Life Technologies, Grand Island, NY | A12216 | Amplex Red Cholesterol Assay Kit. • ≤–20°C • Desiccate • Protect from light |
| Cholesterol Esterase. | Life Technologies, Grand Island, NY | A12216 | Amplex Red Cholesterol Assay Kit. • ≤–20°C • Desiccate • Protect from light |
| Cholesterol Reference standard | Life Technologies, Grand Island, NY | A12216 | Amplex Red Cholesterol Assay Kit. • ≤–20°C • Desiccate • Protect from light |
| Resorufin fluorescense Reference standard | Life Technologies, Grand Island, NY | A12216 | Amplex Red Cholesterol Assay Kit. • ≤–20°C • Desiccate • Protect from light |
| 5x Reaction Buffer. | Life Technologies, Grand Island, NY | A12216 | Amplex Red Cholesterol Assay Kit. • ≤–20°C • Desiccate • Protect from light |
| HDL Cholesterol Automated Reagent | ThermoFisher Scientific Co., San Jose, CA, USA. | TR39601 | |
| Name | Company | Catalog Number | Comments |
| Plasticware | |||
| 96-well plates (polypropylene, flat bottom, clear). | Sigma Aldrich | M0687 | |
| 96-well plates (polypropylene, flat bottom, black). | Sigma Aldrich | M9936 | |
| 1.5 mL Eppendorf tubes | Eppendorf | 0030 125.150 | |
| ClipTip 200, sterile | ThermoFisher Scientific Co., San Jose, CA, USA. | 14-488-058 | |
| Thermo Scientific Multichannel Pipettes, 8-channel, 125 | ThermoFisher Scientific Co., San Jose, CA, USA. | 14-387--955 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Gen5 2.01 software | Biotek, Vermont, USA | NA | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Gen5 Plate reader | Biotek, Vermont, USA | NA |
Références
- Gordon, D. J., Rifkind, B. M. High-density lipoprotein--the clinical implications of recent studies. N Engl J Med. 321, 1311-1316 (1989).
- Rubins, H. B., et al. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. N Engl J Med. 341, 410-418 (1999).
- Voight, B. F., et al. Plasma HDL cholesterol and risk of myocardial infarction: a mendelian randomisation study. Lancet. 380, 572-580 (2012).
- Navab, M., Reddy, S. T., Van Lenten, B. J., Fogelman, A. M. HDL and cardiovascular disease: atherogenic and atheroprotective mechanisms. Nat.Rev Cardiol. 8, 222-232 (2011).
- Navab, M., et al. The double jeopardy of HDL. Ann Med. 37, 173-178 (2005).
- Navab, M., Reddy, S. T., Van Lenten, B. J., Anantharamaiah, G. M., Fogelman, A. M. The role of dysfunctional HDL in atherosclerosis. J Lipid Res. 50, Suppl . S145-S149 (2009).
- Navab, M., Reddy, S. T., Van Lenten, B. J., Fogelman, A. M. HDL and cardiovascular disease: atherogenic and atheroprotective mechanisms. Nat Rev Cardiol. 8, 222-232 (2011).
- Patel, S., et al. Reconstituted high-density lipoprotein increases plasma high-density lipoprotein anti-inflammatory properties and cholesterol efflux capacity in patients with type 2 diabetes. J Am Coll Cardiol. 53, 962-971 (2009).
- Navab, M., et al. HDL and the inflammatory response induced by LDL-derived oxidized phospholipids. Arterioscler Thromb Vasc Biol. 21, 481-488 (2001).
- Hayek, T., Oiknine, J., Brook, J. G., Aviram, M. Role of HDL apolipoprotein E in cellular cholesterol efflux: studies in apo E knockout transgenic mice. Biochem Biophys Res Commun. 205, 1072-1078 (1994).
- Van Lenten, B. J., et al. Anti-inflammatory HDL becomes pro-inflammatory during the acute phase response. Loss of protective effect of HDL against LDL oxidation in aortic wall cell cocultures. J Clin Invest. 96, 2758-2767 (1995).
- Undurti, A., et al. Modification of high density lipoprotein by myeloperoxidase generates a pro-inflammatory particle. J Biol Chem. 284, 30825-30835 (2009).
- Van Lenten, B. J., et al. Lipoprotein inflammatory properties and serum amyloid A levels but not cholesterol levels predict lesion area in cholesterol-fed rabbits. J Lipid Res. 48, 2344-2353 (2007).
- Watson, C. E., et al. Treatment of patients with cardiovascular disease with L-4F, an apo-A1 mimetic, did not improve select biomarkers of HDL function. J Lipid Res. 52, 361-373 (2011).
- Annema, W., et al. Impaired HDL cholesterol efflux in metabolic syndrome is unrelated to glucose tolerance status: the CODAM study. Sci Rep. 6, 27367(2016).
- Movva, R., Rader, D. J. Laboratory assessment of HDL heterogeneity and function. Clin Chem. 54, 788-800 (2008).
- Charles-Schoeman, C., et al. Abnormal function of high-density lipoprotein is associated with poor disease control and an altered protein cargo in rheumatoid arthritis. Arthritis Rheum. 60, 2870-2879 (2009).
- Imaizumi, S., et al. L-4F differentially alters plasma levels of oxidized fatty acids resulting in more anti-inflammatory HDL in mice. Drug Metab Lett. 4, 139-148 (2010).
- Khera, A. V., et al. Cholesterol efflux capacity, high-density lipoprotein function, and atherosclerosis. N Engl J Med. 364, 127-135 (2011).
- Morgantini, C., et al. Anti-inflammatory and antioxidant properties of HDLs are impaired in type 2 diabetes. Diabetes. 60, 2617-2623 (2011).
- Patel, P. J., Khera, A. V., Jafri, K., Wilensky, R. L., Rader, D. J. The anti-oxidative capacity of high-density lipoprotein is reduced in acute coronary syndrome but not in stable coronary artery disease. J Am Coll Cardiol. 58, 2068-2075 (2011).
- Watanabe, J., et al. Proteomic profiling following immunoaffinity capture of high-density lipoprotein: association of acute-phase proteins and complement factors with proinflammatory high-density lipoprotein in rheumatoid arthritis. Arthritis Rheum. 64, 1828-1837 (2012).
- Watanabe, J., et al. Differential association of hemoglobin with proinflammatory high density lipoproteins in atherogenic/hyperlipidemic mice. A novel biomarker of atherosclerosis. J Biol Chem. 282, 23698-23707 (2007).
- Watanabe, J., et al. Hemoglobin and its scavenger protein haptoglobin associate with apoA-1-containing particles and influence the inflammatory properties and function of high density lipoprotein. J Biol Chem. 284, 18292-18301 (2009).
- Wang, X. S., et al. A sensitive and specific ELISA detects methionine sulfoxide-containing apolipoprotein A-I in HDL. J Lipid Res. 50, 586-594 (2009).
- Navab, M., et al. A cell-free assay for detecting HDL that is dysfunctional in preventing the formation of or inactivating oxidized phospholipids. J Lipid Res. 42, 1308-1317 (2001).
- Kelesidis, T., et al. A biochemical fluorometric method for assessing the oxidative properties of HDL. J Lipid Res. 52, 2341-2351 (2011).
- Kelesidis, T., et al. Effects of lipid-probe interactions in biochemical fluorometric methods that assess HDL redox activity. Lipids Health Dis. 11, 87(2012).
- Navab, M., et al. Mechanisms of disease: proatherogenic HDL--an evolving field. Nat Clin Pract Endocrinol Metab. 2, 504-511 (2006).
- Navab, M., et al. The oxidation hypothesis of atherogenesis: the role of oxidized phospholipids and HDL. J Lipid Res. 45, 993-1007 (2004).
- Morgantini, C., et al. HDL lipid composition is profoundly altered in patients with type 2 diabetes and atherosclerotic vascular disease. Nutr Metab Cardiovasc Dis. 24, 594-599 (2014).
- Kelesidis, T., et al. A high throughput biochemical fluorometric method for measuring lipid peroxidation in HDL. PLoS One. 9, e111716(2014).
- Kelesidis, T., Yang, O. O., Kendall, M. A., Hodis, H. N., Currier, J. S. Dysfunctional HDL and progression of atherosclerosis in HIV-1-infected and -uninfected adults. Lipids Health Dis. 12, 23(2013).
- Zanni, M. V., et al. HDL redox activity is increased in HIV-infected men in association with macrophage activation and non-calcified coronary atherosclerotic plaque. Antivir Ther. 19, 805-811 (2014).
- Roberts, C. K., Katiraie, M., Croymans, D. M., Yang, O. O., Kelesidis, T. Untrained young men have dysfunctional HDL compared with strength-trained men irrespective of body weight status. J Appl Physiol (1985). , 1043-1049 (2013).
- Davidson, W. S., et al. Weight loss surgery in adolescents corrects high-density lipoprotein subspecies and their function. Int J Obes (Lond). 41, 83-89 (2017).
- Kelesidis, T., et al. Predictors of impaired HDL function in HIV-1 infected compared to uninfected individuals. J Acquir Immune Defic Syndr. , (2017).
- Kelesidis, T., et al. Oxidized lipoproteins are associated with markers of inflammation and immune activation in HIV-1 infection. AIDS. 30, 2625-2633 (2016).
- Kelesidis, T., et al. Changes in plasma levels of oxidized lipoproteins and lipoprotein subfractions with atazanavir-, raltegravir-, darunavir-based initial antiviral therapy and associations with common carotid artery intima-media thickness: ACTG 5260s. Antivir Ther. , (2016).
- Bhattacharyya, D. K., Adak, S., Bandyopadhyay, U., Banerjee, R. K. Mechanism of inhibition of horseradish peroxidase-catalysed iodide oxidation by EDTA. Biochem J. 295 (Pt 2), 281-288 (1994).
- Rees, M. D., Pattison, D. I., Davies, M. J. Oxidation of heparan sulphate by hypochlorite: role of N-chloro derivatives and dichloramine-dependent fragmentation. Biochem J. 391, 125-134 (2005).
- Mani, K., Cheng, F., Fransson, L. A. Heparan sulfate degradation products can associate with oxidized proteins and proteasomes. J Biol Chem. 282, 21934-21944 (2007).
- Finley, P. R., Schifman, R. B., Williams, R. J., Lichti, D. A. Cholesterol in high-density lipoprotein: use of Mg2+/dextran sulfate in its enzymic measurement. Clin Chem. 24, 931-933 (1978).
- von Schenck, H., Jacobsson, M. L. Prothrombin assay standardized with an international normalization ratio (INR): goal and reality. Clin Chem. 33, 342(1987).
- de Kok, J. B., et al. Normalization of gene expression measurements in tumor tissues: comparison of 13 endogenous control genes. Lab Invest. 85, 154-159 (2005).
- Stocker, R., Keaney, J. F. Jr Role of oxidative modifications in atherosclerosis. Physiol Rev. 84, 1381-1478 (2004).
- Holzer, M., et al. Aging affects high-density lipoprotein composition and function. Biochim Biophys Acta. 1831, 1442-1448 (2013).
- Amundson, D. M., Zhou, M. Fluorometric method for the enzymatic determination of cholesterol. J Biochem Biophys Methods. 38, 43-52 (1999).
- Mishin, V., Gray, J. P., Heck, D. E., Laskin, D. L., Laskin, J. D. Application of the Amplex red/horseradish peroxidase assay to measure hydrogen peroxide generation by recombinant microsomal enzymes. Free Radic Biol Med. 48, 1485-1491 (2010).
- Lombardi, A., et al. UCP3 translocates lipid hydroperoxide and mediates lipid hydroperoxide-dependent mitochondrial uncoupling. J Biol Chem. 285, 16599-16605 (2010).
- Bhattacharya, A., et al. Denervation induces cytosolic phospholipase A2-mediated fatty acid hydroperoxide generation by muscle mitochondria. J Biol Chem. 284, 46-55 (2009).
- Havel, R. J., Eder, H. A., Bragdon, J. H. The distribution and chemical composition of µLtracentrifugally separated lipoproteins in human serum. J Clin Invest. 34, 1345-1353 (1955).
- Dyerberg, J. Comments on the quantitation of lipoproteins by agarose-gel electrophoresis. Clin Chim Acta. 61, 103-104 (1975).
- Warnick, G. R., Cheung, M. C., Albers, J. J. Comparison of current methods for high-density lipoprotein cholesterol quantitation. Clin Chem. 25, 596-604 (1979).
- Demacker, P. N., Hijmans, A. G., Vos-Janssen, H. E., van't Laar, A., Jansen, A. P. A study of the use of polyethylene glycol in estimating cholesterol in high-density lipoprotein. Clin Chem. 26, 1775-1779 (1980).
- Izzo, C., Grillo, F., Murador, E. Improved method for determination of high-density-lipoprotein cholesterol I. Isolation of high-density lipoproteins by use of polyethylene glycol 6000. Clin Chem. 27, 371-374 (1981).
- Patel, P. J., Khera, A. V., Wilensky, R. L., Rader, D. J. Anti-oxidative and cholesterol efflux capacities of high-density lipoprotein are reduced in ischaemic cardiomyopathy. Eur J Heart Fail. 15, 1215-1219 (2013).
- Roche, M., Rondeau, P., Singh, N. R., Tarnus, E., Bourdon, E. The antioxidant properties of serum albumin. FEBS Lett. 582, 1783-1787 (2008).
- Panzenbock, U., Kritharides, L., Raftery, M., Rye, K. A., Stocker, R. Oxidation of methionine residues to methionine sulfoxides does not decrease potential antiatherogenic properties of apolipoprotein A-I. J Biol Chem. 275, 19536-19544 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon