Method Article
Activation des cellules Müller Glia dans une dégénérescence rétinienne induite par Laser et le modèle de régénération chez le poisson zèbre
Dans cet article
Résumé
Le poisson-zèbre est un populaire modèle animal pour étudier les mécanismes de dégénérescence rétinienne/régénération chez les vertébrés. Ce protocole décrit une méthode pour induire des lésions localisées perturbant la rétine externe avec un minimum de dommages à la rétine interne. Par la suite, nous surveillons in vivo la morphologie de la rétine et la réponse de glia Müller tout au long de la régénération rétinienne.
Résumé
Une fascinante différence entre téléostéen et mammifères est le potentiel tout au long de la rétine chez les téléostéens pour neurogenèse rétinienne et la régénération après des dommages graves. Enquête sur les voies de la régénération chez le poisson zèbre pourrait apporter de nouvelles connaissances pour élaborer des stratégies innovantes pour le traitement des maladies dégénératives de la rétine chez les mammifères. Dans les présentes, nous nous sommes concentrés sur l’induction d’une lésion focale à la rétine externe chez le poisson zèbre adulte au moyen d’un laser à diode 532 nm. Une lésion localisée permet l’étude des processus biologiques qui ont lieu au cours de la dégénérescence rétinienne et de régénération directement à la zone de dommages. En utilisant la tomographie à cohérence optique non invasif (OCT), nous avons pu définir l’emplacement de la régénération ultérieure de zone et moniteur endommagée in vivo. En effet, l’imagerie OCT produit des images haute résolution et transversales de la rétine de poisson-zèbre, fournissant des informations qui étaient auparavant uniquement disponibles avec les analyses histologiques. Afin de confirmer les données de l’OCT en temps réel, les coupes histologiques ont été réalisées et régénératrice après l’induction de la lésion rétinienne a été étudiée par immunohistochimie.
Introduction
Vision est probablement le sens essentiel de l’être humain et son atteinte a une forte incidence socio-économique. Dans le monde industrialisé, maladies dégénératives de la rétine constituent la majorité de la perte de la vision et de cécité chez la population adulte1. Rétinite pigmentaire (RP) est la cause héréditaire la plus fréquente de cécité chez les personnes âgées de 20 à 60, affectant environ 1,5 millions de personnes dans le monde entier2,3. C’est une famille hétérogène de rétiniennes héréditaires caractérisées par une perte progressive des photorécepteurs (PRs) suivie d’une dégénérescence de l’épithélium pigmentaire rétinien et, par la suite, une gliose et remodelage des neurones interne4. L’évolution de la maladie peut s’expliquer par la perte progressive des deux types de cellules PR, généralement en commençant avec les tiges, qui sont responsables de la vision achromatique dans la pénombre et les cônes, qui sont essentielles pour la vision et l’acuité de la couleur5. Un défaut génétique unique suffit à provoquer des RP. Jusqu'à présent, plus de 130 mutations dans les gènes de plus de 45 ont été associées à la maladie6. Cela conduit à divers phénotypes de la maladie et est une des raisons que la thérapie génique est non généralisables et donc une approche thérapeutique complexe. Par conséquent, il y a un besoin urgent de développer de nouvelles approches thérapeutiques générales pour traiter la dégénérescence rétinienne en aveuglant les maladies.
Souvent la dégénérescence rétinienne implique la perte de PR ; par conséquent, la mort cellulaire PR est une caractéristique des processus dégénératifs dans la rétine7. Il a déjà été démontré que la mort des cellules PR stimule Müller glia cellulaire (MC) activation et la prolifération des8. MCs, le type de cellules gliales majeur dans la rétine des vertébrés, étaient autrefois considéré comme rien de plus qu’une « colle » entre les neurones de la rétine. Ces dernières années, de nombreuses études ont montré que MCs agissent comme plus que simple structurels soutiennent le9. Parmi les différentes fonctions, MCs participent également à la neurogenèse et réparer10. En effet, en réponse à des facteurs diffusibles par la dégénérescence rétine, MCs augmentent considérablement expression de protéine fibrillaire acide gliale (GFAP). Par conséquent, GFAP étiquetage peut servir comme marqueur pour l’activation du MC en réponse secondaire à des lésions rétiniennes et dégénérescence11.
Récemment, nous avons développé une nouvelle adaptation de lésion focale en utilisant un laser pour induire la dégénérescence rétinienne chez le poisson zèbre (Danio rerio). Lésion focale est avantageuse pour l’étude de certains processus biologiques tels que la migration des cellules dans le site lésé et le calendrier précis des événements qui se produisent pendant la régénération rétinienne12. En outre, le poisson-zèbre est devenu important dans la recherche visuelle en raison des similitudes entre son système visuel et celui des autres vertébrés. Les caractéristiques morphologiques et histologiques bruts de rétines humaines et téléostéens présentent des différences peu. En conséquence, les rétines humaines et poisson-zèbre contiennent les mêmes classes de cellule majeur organisés dans le même modèle en couches, où les photorécepteurs de détection de lumière occupent la couche la plus externe, tandis que les neurones de projection rétinienne, les cellules de ganglion, résident dans la plus profonde couche neuronale, proximale de la lentille. Les interneurones rétiniens, les amacrines, bipolaire et les cellules horizontales, localiser entre les photorécepteurs et ganglion cellule couches13. En outre, la rétine du poisson-zèbre est dominée par les cônes et donc plus proche de la rétine humaine que, par exemple, la rétine rongeur étudiée. Une fascinante différence entre téléostéen et mammifères est la neurogenèse persistante dans rétine de poisson et de la régénération rétinienne après avarie. Chez le poisson zèbre, MCs peuvent dédifférenciation et médiation de régénération dans la rétine blessé14,15. Dans le poulet, MCs ont certaines capacité aussi à réintégrer le cycle cellulaire et de dédifférenciation. Suite à une lésion rétinienne chez les poissons adultes, MCs adoptent certaines caractéristiques des cellules souches et progénitrices, migrent vers le tissu rétinien endommagé et produisent de nouveaux neurones16. Le profil d’expression génique des mammifères MCs révèle inattendus similitudes avec cellules souches rétiniennes, et preuve intrinsèque potentiel neurogène des MCs dans le poulet, les rongeurs et rétine même humaine croît17. Néanmoins, pourquoi la réponse régénératrice chez les oiseaux et les mammifères est plus faible comparativement à la réponse robuste chez les poissons n’est pas encore compris. Par conséquent, la compréhension des mécanismes de réparation endogène chez le poisson zèbre peut suggérer des stratégies pour stimuler la régénération rétinienne chez les mammifères et les êtres humains. Utilisant le mécanisme de réparation endogène des MCs comme un outil thérapeutique pour le traitement des patients atteints de dégénérescence rétinienne aurait un impact exceptionnel pour notre société.
Ici, nous fournissons les étapes nécessaires pour utiliser le modèle de dégénérescence/régénération dans la recherche ophtalmologique. Nous nous sommes concentrés d’abord sur induisant des dommages focal dans la rétine neurosensorielle, puis sur l’imagerie des événements de développement sur le site de la blessure et enfin visualisation implication des MCs adjacents. Le protocole général est relativement facile à réaliser et ouvre un large éventail de possibilités pour l’évaluation de la rétine par la suite.
Protocole
toutes les expériences ont adhéré à la déclaration pour l’utilisation des animaux en ophtalmiques et de la recherche de la Vision de l’Association for Research in Vision and Ophthalmology (ARVO) et respecter les règlements connexes des autorités gouvernementales.
1. animaux
- TgBAC maintenir (gfap:gfap-GFP) poisson zèbre 167 souche (AB) âgés de 6 à 9 mois dans des conditions normales dans l’eau avec une température de 26.5 ° C et un cycle lumière/obscurité de 14/10 h 18.
- Suivre les directives de protection des animaux des institutions impliquées pour l’expérimentation animale après approbation par les autorités gouvernementales.
2. Réversible anesthésie systémique
- préparer la solution de sel de méthanesulfonate 3-aminobenzoate d’éthyle (tricaïne) dissoudre 400 mg de poudre de tricaïne dans 97,9 mL de l’eau du réservoir et 2,1 mL de 1 M de Tris buffered saline (TBS). Ajuster le pH 7.0 avec 1 M Tris (pH 9) et les conserver à 4 ° C dans l’obscurité jusqu'à un mois.
NOTE : Tricaïne devrait être établi dans l’eau comme les conditions de vie naturelle de l’animal, de préférence original réservoir d’eau doit être utilisé. - Diluer la solution mère 01:25 dans réservoir d’eau et consommez immédiatement.
- Placer le poisson-zèbre dans une boîte de Pétri contenant 50 mL de solution d’anesthésie jusqu'à ce qu’ils deviennent immobiles et ne répondent pas aux stimuli externes (environ 2-5 min, selon le poids et l’âge) de 10 cm.
- Transférer chaque poisson à la main sur un support de broche silicone sur mesure pour le traitement au laser ( Figure 1 a).
MISE EN GARDE ! Le poisson peut rester anesthésié à l’extérieur du réservoir jusqu'à 10 min seulement. - Pour inverser l’anesthésie après traitement et/ou d’imagerie, mettre le poisson-zèbre dans le récipient contenant le réservoir d’eau.
- Pour soutenir la reprise, créer un flux d’eau fraîche sur les branchies en déplaçant le poisson-zèbre en arrière dans l’eau.
3. Une lésion focale sur la rétine au laser
Remarque : laser à diode A 532 nm est utilisé pour créer des dommages légers focal sur la rétine du poisson-zèbre. Le montage expérimental du laser permet la mise en place d’une lésion rétinienne focale reproductible chez le poisson zèbre adulte.
- Mis en place la puissance du laser : 70 mW ; diamètre de l’antenne : 50 µm ; durée de l’impulsion : Mme 100
attention ! L’utilisation de la lumière laser nécessite de protection individuelle appropriée et à l’étiquetage de la zone. - Appliquer 1 à 2 gouttes d’hydroxypropylméthylcellulose de 2 % par voie topique dans les yeux avant le traitement et une lentille laser de 2,0 mm du fond de œil permet de focaliser le faisceau de pointage laser sur la rétine.
MISE EN GARDE ! hydroxypropylméthylcellulose gouttes sont visqueux et peut provoquer des problèmes respiratoires si il va sur les branchies. - Place quatre laser taches autour du nerf optique sur la gauche les yeux et utilisez le œil droit et non traitée comme contrôle interne.
4. In vivo Imagerie de la morphologie de la rétine
- au jour J0, visualiser la rétine zebrafish directement après l’induction de laser sans raviver leur fin de l’anesthésie. Dans tous les autres points dans le temps, employer l’anesthésie générale (voir la Section 2 : anesthésie systémique réversible). Placer le poisson-zèbre immobilisé sur un support de broche silicone sur mesure ( Figure 1 B, B.1).
- D’obtenir des images optimales, couper une lentille de contact hydrogel disponibles dans le commerce pour s’adapter à le œil de poisson-zèbre (Ø = 5,2 mm, r = 2,70 mm, épaisseur centrale = 0,4 mm) au moyen d’une perforatrice. Remplir la surface concave de la lentille de méthylcellulose et placez-le sur la cornée.
- Équiper le système OCT avec un objectif de lampe de fente sans contact de 78D.
- Focus image infrarouge (IR) dans l’IR + mode OCT ( Figure 2 a) à visualiser le fond de le œil et l’IR photos en cliquant sur le " Acquire " bouton ( Figure 2 b) pour localiser le taches sur la rétine à l’aide du système au laser ' logiciel de s. Mode de
- visualiser un article en trois dimensions des couches rétiniennes dans l’IR + OCT et prendre les photos en cliquant sur le " Acquire " bouton ( Figure 2 b). Observer la gravité des blessures dans la couche nucléaire externe (ONL) (voir la Section 3 : blessure focal sur la rétine au Laser) dans ces images.
- D’inverser l’anesthésie après traitement et/ou d’imagerie a placé le poisson-zèbre dans un récipient contenant de l’eau du réservoir.
- Pour soutenir la reprise, créer un flux d’eau fraîche sur les branchies en déplaçant le poisson-zèbre en arrière dans l’eau.
- Effectuer similaire en vivo imagerie rétinienne morphologie au jour 1, 3, 7, 14 et la semaine 6.
5. L’hématoxyline & éosine (H & E) coloration
- euthanasier zebrafish par submersion dans le froid (4 ° C) solution anesthésie sur la glace pendant au moins 10 min et enucleate les yeux immédiatement par le biais de petites pinces courbées.
- Fixer les yeux tout en paraformaldéhyde à 4 % (PFA) en tampon phosphate salin (PBS) à 4 ° C pendant 20 h et puis déshydrater les échantillons en une série graduée de l’alcool (xylène 100 % pendant 5 minutes deux fois, éthanol 100 % pendant 5 minutes deux fois, éthanol 96 % pendant 3 min deux fois et l’éthanol 70 % 3 mi n une fois).
MISE EN GARDE ! PFA peut être irritant pour les yeux, du nez et des voies respiratoires supérieures. PFA est un carcinogène humain connu et un danger pour la reproduction présumé. - Intégrer les échantillons à la paraffine, µm 5 coupes au niveau de la papille optique et montez-les sur lames de verre.
- Tacher les sections déparaffinées avec solution à 0,1 % acide hématoxyline pendant 5 min et tremper les lames deux fois dans l’eau distillée après trempage des diapositives dans le mélange de l’acide chlorhydrique (HCl dans 250 mL de 2 mL 25 % eau distillée eau) et ammoniac mélanger (2 mL 25 % d’ammoniaque dans 250 mL eau distillée). Tacher les sections avec l’éosine G solution aqueuse 0,5 % pendant 3 min après le développement de l’hématoxyline taches provoquées par l’eau du robinet pendant au moins 10 mn
- Monter les lames déshydratées dans milieu de montage de résine acrylique et d’observer les diapositives sous microscope photonique.
6. Immunohistochemistry pour l’Activation de MC
- chauffer les coupes déparaffinées dans le tampon de récupération de l’antigène (Tris-EDTA + 0,05 % de détergent non ionique, pH 9,0) pendant 3 min dans un cuit vapeur approprié ou un four à micro-ondes pendant 10-15 min et laver trois fois avec le SCT pour 5 min chaque.
- Cercle les sections avec un silicone stylo et ajouter 100 µL bloquant la solution (SCT + sérum normal de chèvre 10 % + 1 % d’albumine sérique bovine, pH 7,6) à température ambiante pendant 1 h.
- Tache avec des anticorps polyclonaux de lapin anti-gliales protéine fibrillaire acide (GFAP) et avec l’anticorps monoclonal de souris anti-glutamine synthétase (GS), tous deux dans une dilution de 1 : 200 (40 µL par exemple). Incubez la diapositive dans une chambre humidifiée à 4 ° C durant la nuit. Laver trois fois avec TBS + 0,1 % Tween 20 pour chaque 5 min. Anticorps secondaires
- finition visualisation avec le cas échéant. Ce protocole utilisé une chèvre de anti-lapin IgG H & anticorps secondaire L vert GFAP et une chèvre anti-souris IgG H & rouge vif L GS, aussi bien dans une dilution de 1/500 à température ambiante pendant 1 h.
- Monter les diapositives avec support de montage contenant DAPI et observer les diapositives sous le microscope de fluorescence.
Résultats
OCT en temps réel: afin d’analyser le rôle des MCs en réparation rétinienne, nous utilisons un modèle de blessure de laser induisant une zone bien délimitée de dommages à la rétine de poisson-zèbre. Le site de dommages a été photographié au moyen de in vivo OCT pour la première fois (jour 0) dans les 60 minutes suivant la lésion (Figure 3). Pour compenser l’optique de le œil de poisson, une lentille de contact sur mesure a été placée sur la cornée. Immédiatement après le traitement au laser, un signal hyper réfléchissant diffus a été localisé à la rétine externe (flèches). S’étendait de l’épithélium pigmentaire rétinien (RPE) à la couche plexiforme externe (OPL). Un signal analogue a été également décelable au jour 1. Après jour 3, ce signal diffus est devenu plus organisé et plus dense. Il a constamment observé dans la couche nucléaire externe (ONL) qui s’étend dans la couche des photorécepteurs. Après la première semaine (7 jours), il y avait une diminution significative de la taille de la lésion moyenne et seulement un petit signal hyper réfléchissant a été détecté. À partir de 14 jours, jusqu'à ce que le dernier point de temps étudié (semaine 6), les taches de laser n’étaient plus visibles dans les images IR et OCT.
L’évaluation histologique de la dégénérescence rétinienne/régénération: afin d’enquêter sur l’étendue et la cinétique de retinal degeneration/régénération, H & E coloration travaillait à des moments différents après induction de dommages (jour 0, 1, 3, 7, 14 et semaine 6) (Figure 4). Des expériences ont été effectuées sur trois yeux de trois poissons. Cependant, aucune analyse statistique a été effectuée car l’objectif de ce manuscrit est de démontrer la méthode. Des changements subtils dans la couche nucléaire interne (INL) et ONL peut être vu laser post immédiat (p. ex. léger oedème dans l’ONL) et espace intercellulaire réduit dans l’INL dans les 60 minutes suivant le traitement au laser. La dégénérescence a été suivie pendant 6 semaines après l’induction de la blessure de laser. Modifications morphologiques ont été régulièrement observées après 1 journée avec désorganisation du SPE et avec une formation de cavité dans l’ONL et dans l’espace sous-rétinienne. En effet, il y a une perte de noyaux dans l’ONL dans la zone de dommages entre 1 et 7 jours. La perte maximum de PR a été trouvée au jour 3. À partir de 14 jours à 6 semaines, la rétine externe avait rétabli sa morphologie normale.
Gliales implication lors de rétine dégénérescence/régénération: pour évaluer l’activation MC à différents moments (jour 0, 3, 14) après l’induction de la dégénérescence rétinienne, nous avons effectué des analyses immunohistochimiques pour les marqueurs des cellules gliales GS et GFAP (Figure 5). Encore une fois, expériences ont été effectuées sur trois yeux de trois poissons sans analyse quantitative. GS joue un rôle important en contrôlant le niveau de glutamate extracellulaire et est considéré comme exclusivement exprimée dans le soma de MC et ses processus19,20. GFAP est augmentée pendant le vieillissement et lorsque la rétine est endommagée ou a souligné. Il est localisé dans les MC-embouts et traite21. Faible GFAP expression a été également trouvée dans la partie interne de la rétine-témoins indemnes étiquetage d’autres types de cellules gliales, par exemple, les astrocytes. L’autofluorescence des segments extérieurs PR a également fourni un signal à l’ONL, mais cela pourrait être clairement distingué. Le signal de la GFAP a augmenté à post-traumatique du jour 3. Ainsi, les analyses effectuées au 3e jour après le traitement au laser a montré MCs GFAP-positive que dans le site de la lésion à l’ONL de la rétine. Du 14e, la régénération a été en grande partie terminée et le signal de la GFA a été diminuée au niveau de base en matière de dommages. Contrairement à la GFA, il n’y avait aucun changement considérable dans le niveau d’expression de la GS. Cependant, il aurait pu être une diminution localisée de GS sur le site de la lésion.

Figure 1 : le programme d’installation pour l’induction de la blessure de laser de rétine de poisson-zèbre et après analyse OCT. (A) arrangement du système laser avant le traitement. Le poisson-zèbre (A.1) placé sur porte-broche silicone avec lentilles de contact du fond de œil en place juste avant l’application du faisceau laser. (B) préparation du système avant l’imagerie OCT. Le poisson-zèbre (B.1) placé avant 78D fente lampe lentille avant la détection des sites dommages au moyen d’octobre s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
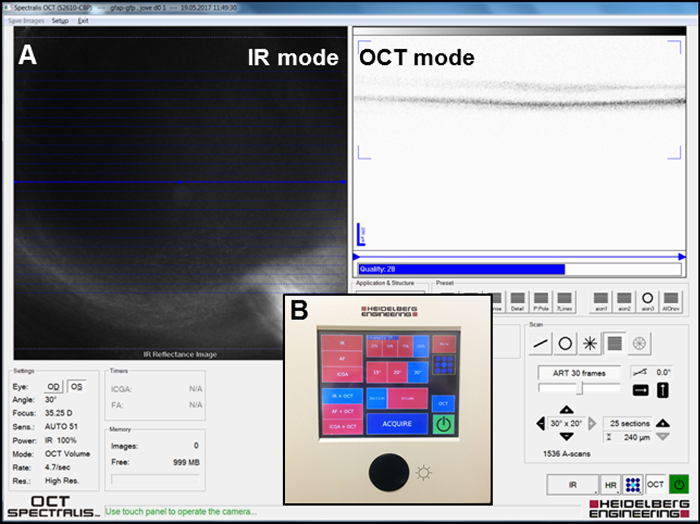
Figure 2 : configuration pour acquérir les images IR et OCT. (A) capture d’écran de la fenêtre du logiciel pendant la formation image. Modes d’IR et les PTOM sont représentés. (B) vue d’ensemble du panneau utilisé pour acquérir les images. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
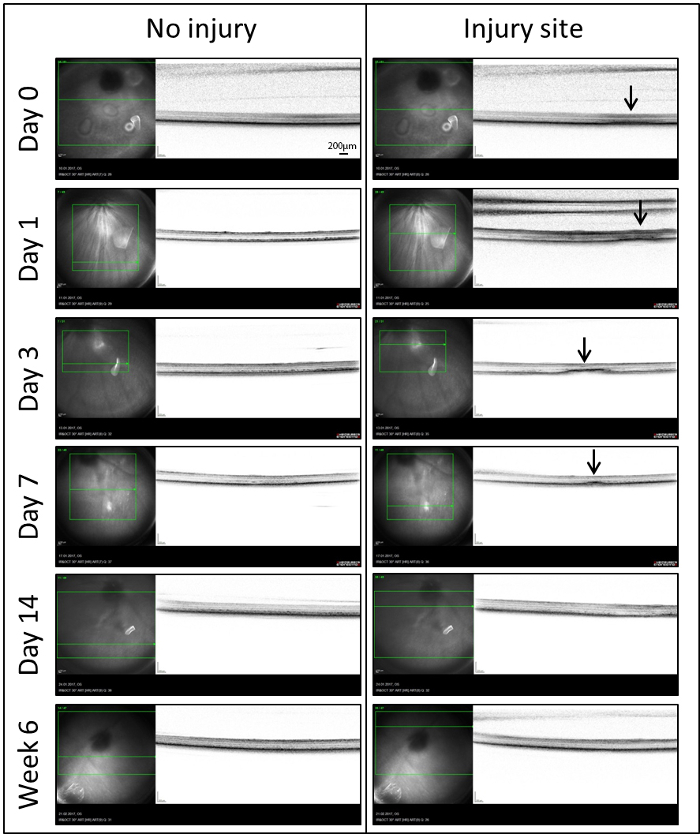
Figure 3 : IR (à gauche) et images (à droite) OCT des sites accidentés et blessés de la rétine dans le même œil en des temps différents points (jours 0, 1, 3, 7, 14 et 6 semaine) après induite par laser de la dégénérescence rétinienne. Dans les images IR, une boîte verte indique la portion de la rétine qui a analysé et la ligne verte indique l’emplacement des images OCT sur la rétine. Les flèches indiquent les sites des spots laser détectés comme signaux hyper réfléchissant dans la barre d’échelle octobre = 200 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : H & E la coloration des blessés et la controlatérale indemnes oeil de poisson-zèbre en des temps différents points (jours 0, 1, 3, 7, 14 et 6 semaine) après induite par laser de la dégénérescence rétinienne. GC, couche de cellules ganglionnaires ; INL, couche nucléaire interne ; ONL, couche nucléaire externe. Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
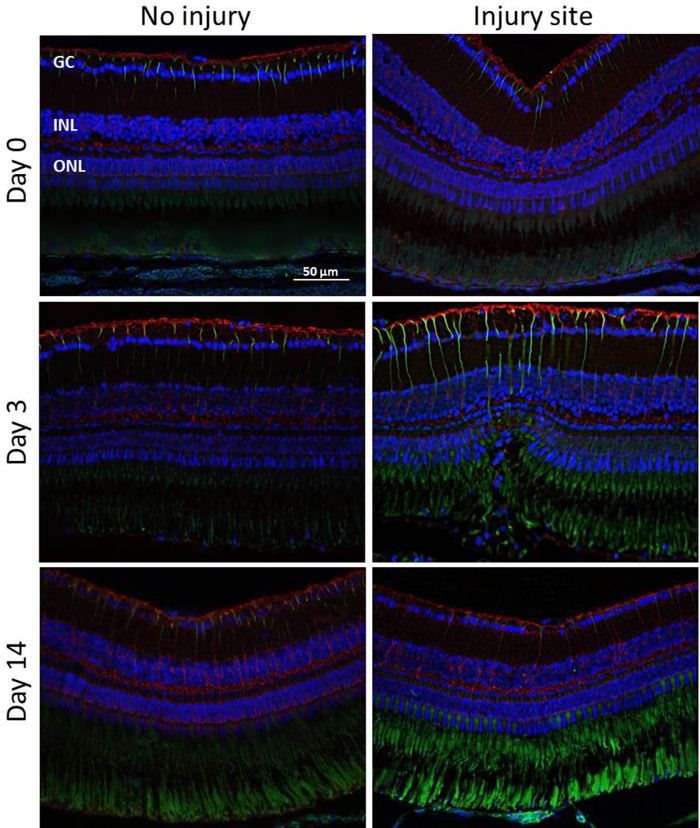
Figure 5 : Détection immunohistochimique de l’activation de MC. GFAP (vert) et GS (rouge) coloration dans la rétine de poisson zèbre blessé et blessés lors de différents points (jours 0, 3, 14) après induite par laser de la dégénérescence rétinienne. Le signal vert dans l’ONL est due à l’autofluorescence du PR osegments d’uter. Noyaux cellulaires sont colorées au DAPI (bleus). Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Régénération/dégénérescence rétinienne chez le poisson-zèbre a étudié différentes approches telles que de mort cellulaire cytotoxine22, une lésion mécanique23et lésion thermique24. Nous avons utilisé un laser à diode 532 nm à endommager la rétine de poisson-zèbre. Ainsi, notre modèle offre plusieurs avantages. Par exemple, nous avons créé rapidement une zone bien définie de lésions localisées dans la rétine externe, plus précisément dans la couche de PRs. En outre, ce système expérimental peut être modifié pour produire de plus grands secteurs des dommages d’étudier d’autres processus biologiques, par exemple, en endommageant la membrane de Bruch pour induire la néovascularisation choroïdienne. Il y a un minimum de dommages collatéraux et le moment où la réponse régénératrice peut être modulé avec précision et de façon reproductible.
Pour suivre les changements phénotypiques au fil du temps, nous avons utilisé le système Spectralis de Heidelberg et le logiciel Heidelberg Eye Explorer. Ainsi, l’imagerie du fond de œil IR s’est avéré particulièrement utile chez le poisson zèbre. À la différence du fundus autofluorescence (AF), qui montre un faible contraste entre le faisceau laser et ses environs, les sites endommagés sont plus faciles à localiser en imagerie IR. Cela nous permet de détecter les changements et à suivre la régénération en vivo, qui ne serait pas possible avec le mode AF. Comme indiqué précédemment25, OCT peut servir à surveiller les processus dégénératifs/régénératrice dans la rétine de poisson-zèbre. Dans notre modèle, lésion de la rétine laser a été détectée comme une bande hyper réfléchissant dans l’ONL (Figure 3), qui est similaire à ce qui a été signalé chez les mammifères,26. Pendant la régénération, le signal hyper réfléchissant a diminué jusqu'à ce qu’il a totalement disparu au jour 14.
Les images OCT sont en corrélation avec des changements morphologiques observés dans les lésions de laser (Figure 4). Le signal hyper réfléchissant diffus en images OCT (jour 0) représente les changements post-laser vus dans l’INL de poisson-zèbre euthanasié dans l’heure suivant le traitement au laser. Le signal hyper réfléchissant subtil et bien défini, détecté au 3e jour correspond à la formation de la cavité dans l’ONL en raison de la perte de la tige. À partir de jour 14, les deux OCT et analyses histologiques confirment que la rétine externe avait rétabli sa morphologie normale.
Dans la présente étude, nous avons également évalué la réponse de MC pendant la régénération rétinienne (Figure 5). Beaucoup de groupes ont déjà étudié l’activation des cellules gliales, en particulier de MCs, comme une première réponse régénératrice à endommager. Plus précisément, ils ont suggéré que physiopathologiques MC activation peut induire des MCs à adopter des caractéristiques de cellules souches, fournissant une source endogène de nouveaux types de cellule fonctionnement qui peuvent être intégrés dans des zones endommagées de la rétine27. Comme prévu, nous avons constaté que les blessures laser rétinien stimulent MC activation comme en témoigne l’augmentation de l’accord-cadre. En effet, une expression accrue GFAP a été remarquablement détectée à 3 jours après lésion et se limitait à la zone de dommages. À partir de 14 jours, la régénération a été en grande partie terminée et le signal de la GFA a été diminuée au niveau de base en matière de dommages. Ainsi, nous avons démontré que les MCs jouent un rôle actif dans la réorganisation rétinienne et potentiellement la régénération, après une blessure.
En conclusion, le modèle de dégénérescence/régénération rétinienne induite par laser est un outil polyvalent pour produire des dommages rapides et focal à la rétine de poisson-zèbre et la régénération suivante peut être visualisée par l’imagerie non invasive de OCT. En outre, nous avons pu montrer que le laser-retinal degeneration s’accompagne d’activation MC et que la gliose qui s’ensuivie est renversée par la régénération. Cependant, une étude détaillée des voies et des types de cellules impliquées (p. ex., la microglie, macrophages) doit être effectuée. Diverses modifications essentielles peuvent être nécessaires, surtout en direct suivi des MCs pour mieux comprendre leur comportement pendant le processus de régénération (p. ex., la migration de leur emplacement d’origine dans l’INL dans la rétine externe, surtout dans la couche de PRs) et leur différenciation vers les cellules de PR. Alternativement, dommages légers paradigmes pourraient servir à induire la perte généralisée et cohérente de tige et cône PRs28. Toutefois, l’avantage du modèle décrit est une zone de blessure plus définie, où on peut étudier les interactions locales entre la dégénérescence des photorécepteurs et MCs activés.
En général, nous croyons que le modèle aidera à mieux comprendre les processus dégénératifs/régénératrice dans la rétine sensorielle et peut permettre la comparaison de ces développements avec le système des mammifères. Il pourrait également être utilisé pour étudier l’influence du système immunitaire inné et les effets de substances neuroactives. À l’avenir, on pourrait être en mesure d’utiliser ces résultats pour modifier le système visuel humain dégénérescence.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Martin Zinkernagel, MD, PhD et Miriam Reisenhofer, PhD pour son apport scientifique à mettre en place le modèle et Federica Bisignani pour son aide technique excellente.
matériels
| Name | Company | Catalog Number | Comments |
| Acid hematoxylin solution | Sigma-Aldrich, Buchs, Switzerland | 2852 | |
| Albumin | Sigma-Aldrich, Buchs, Switzerland | A07030 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, Buchs, Switzerland | 5470 | |
| Dako Pen | Dako, Glostrup, Danmark | S2002 | |
| DAPI mounting medium | Vector Labs, Burlingame, CA, USA | H-1200 | |
| Eosin G aqueous solution 0.5% | Carl Roth, Arlesheim, Switzerland | X883.2 | |
| Ethanol | Sigma-Aldrich, Buchs, Switzerland | 2860 | |
| Ethylene diamine tetraacetic acid (EDTA) | Sigma-Aldrich, Buchs, Switzerland | ED | |
| Eukitt | Sigma-Aldrich, Buchs, Switzerland | 3989 | |
| Goat anti-rabbit IgG H&L Alexa Fluor® 488 | Life Technologies, Zug, Switzerland | A11008 | |
| Goat anti-mouse IgG H&L Alexa Fluor® 594 | Life Technologies, Zug, Switzerland | A11020 | |
| Goat normal serum | Dako, Glostrup, Danmark | X0907 | |
| Hydrogel contact lens | Johnson & Johnson AG, Zug, Switzerland | n.a. | 1-Day Acuvue Moist |
| Hydroxypropylmethylcellulose 2% | OmniVision, Neuhausen, Switzerland | n.a. | Methocel 2% |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma-Aldrich, Buchs, Switzerland | A5040 | Tricaine, MS-222 |
| Visulas 532s | Carl Zeiss Meditec AG, Oberkochen, Germany | n.a. | 532 nm laser |
| Mouse anti-GS monoclonal antibody | Millipore, Billerica, MA, USA | MAB302 | |
| HRA + OCT Imaging System | Heidelberg Engineering, Heidelberg, Germany | n.a. | Spectralis |
| Heidelberg Eye Explorer | Heidelberg Engineering, Heidelberg, Germany | n.a. | Version 1.9.10.0 |
| Paraformaldehyde (PFA) | Sigma-Aldrich, Buchs, Switzerland | P5368 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Buchs, Switzerland | P5368 | |
| Rabbit anti-GFAP polyclonal antibody | Invitrogen, Waltham, MA, USA | 180063 | |
| Silicone pin holder | Huco Vision AG Switzerland | n.a. | Cut by hand from silicone pin mat of the sterilization tray accordingly. |
| Slit lamp BM900 | Haag-Streit AG, Koeniz, Switzerland | n.a. | |
| Slit lamp adapter | Iridex Corp., Mountain View, CA, USA | n.a. | |
| Superfrost Plus glass slides | Gehard Menzel GmbH, Braunschweig, Germany | 10149870 | |
| TgBAC (gfap:gfap-GFP) zf167 (AB) strain | KIT, Karlsruhe, Germany | 15204 | http://zfin.org/ZDB-ALT-100308-3 |
| Tris buffered saline (TBS) | Sigma-Aldrich, Buchs, Switzerland | P5912 | |
| Tween 20 | Sigma-Aldrich, Buchs, Switzerland | P1379 | |
| 78D non-contact slit lamp lens | Volk Optical, Mentor, OH, USA | V78C | |
| Xylene | Sigma-Aldrich, Buchs, Switzerland | 534056 | |
| Ocular fundus laser lens | Ocular Instruments, Bellevue, WA, USA | OFA2-0 | |
| 2100 Retriever | Aptum Biologics Ltd., Southampton, United Kingdom | R2100-EU | Steamer |
Références
- Haddad, S., Chen, C. A., Santangelo, S. L., Seddon, J. M. The genetics of age-related macular degeneration: a review of progress to date. Surv. Ophthalmol. 51 (4), 316-363 (2006).
- Stefano Ferrari, S., Di Iorio, E., Barbaro, V., Ponzin, D., Sorrentino, F. S., Parmeggiani, F. Retinitis Pigmentosa: Genes and Disease Mechanisms. Curr Genomics. 12 (4), 238-249 (2011).
- Berson, E. L. Retinitis pigmentosa. The Friedenwald Lecture. Invest Ophthalmol Vis Sci. 34 (5), 1659-1676 (1993).
- Strettoi, E. A Survey of Retinal Remodeling. Front Cell Neurosci. 9, 494(2015).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368, 1795-1809 (2006).
- Wang, D. Y., Chan, W. M., Tam, P. O., Baum, L., Lam, D. S., Chong, K. K., Fan, B. J., Pang, C. P. Gene mutations in retinitis pigmentosa and their clinical implications. Clin Chim Acta. 351 (1-2), 5-16 (2005).
- Pierce, E. A. Pathways to photoreceptor cell death in inherited retinal degenerations. BioEssays. 23, 605-618 (2001).
- Tackenberg, M. A., Tucker, B. A., Swift, J. S., Jiang, C., Redenti, S., Greenberg, K. P., Flannery, J. G., Reichenbach, A., Young, M. J. Muller cell activation, proliferation and migration following laser injury. Mol. Vis. , 1886-1896 (2009).
- Newman, E., Reichenbach, A. The Müller cell: a functional element of the retina. Trends Neurosci. 19 (8), 307-312 (1996).
- Kubota, R., Hokoc, J. N., Moshiri, A., McGuire, C., Reh, T. A. A comparative study of neurogenesis in the retinal ciliary marginal zone of homeothermic vertebrates. Brain Res Dev Brain Res. 134, 31-41 (2002).
- Zhao, T. T., Tian, C. Y., Yin, Z. Q. Activation of Müller cells occurs during retinal degeneration in RCS rats. Adv Exp Med Biol. 664, 575-583 (2010).
- DiCicco, R. M., Bell, B. A., Kaul, C., Hollyfield, J. G., Anand-Apte, B., Perkins, B. D., Tao, Y. K., Yuan, A. Retinal Regeneration Following OCT-Guided Laser Injury in Zebrafish. Invest Ophthalmol Vis Sci. 55 (10), 6281-6288 (2014).
- Bilotta, J., Saszik, S. The zebrafish as a model visual system. Int. J. Dev. Neurosci. , 621-629 (2001).
- Fausett, B. V., Goldman, D. A role for alpha1 tubulin-expressing Müller glia in regeneration of the injured zebrafish retina. J Neurosci. 26 (23), 6303-6313 (2006).
- Yurco, P., Cameron, D. A. Responses of Müller glia to retinal injury in adult zebrafish. Vision Res. 45, 991-1002 (2005).
- Ashutosh, P. J., Roesch, K., Cepko, C. L. Development and neurogenic potential of Müller gial cells in the vertebrate retina. Prog Retin Eye Res. 28 (4), 249-262 (2009).
- Xia, X., Ahmad, I. Unlocking the Neurogenic Potential of Mammalian Müller Glia. Int J Stem Cells. 9 (2), 169-175 (2016).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish: A Practical Approach. Nüsslein-Volhard, C., Dahm, R. , IRL Press. 7-38 (2002).
- Riepe, R. E., Norenburg, M. D. Müller cell localisation of glutamine synthetase in rat retina. Nature. 268 (5621), 654-655 (1977).
- Derouiche, A., Rauen, T. Coincidence of L-glutamate/L-aspartate transporter (GLAST) and glutamine synthetase (GS) immunoreactions in retinal glia: evidence for coupling of GLAST and GS in transmitter clearance. J Neurosci Res. 42 (1), 131-143 (1995).
- Bignami, A., Dahl, D. The radial glia of Müller in the rat retina and their response to injury. An immunofluorescence study with antibodies to the glial fibrillary acidic (GFA) protein. Exp Eye Res. 28 (1), 63-69 (1979).
- Sherpa, T., Fimbel, S. M., Mallory, D. E., Maaswinkel, H., Spritzer, S. D., Sand, J. A., Li, L., Hyde, D. R., Stenkamp, D. L. Ganglion cell regeneration following whole-retina destruction in zebrafish. Dev Neurobiol. 68 (2), 166-181 (2008).
- Cameron, D. A., Carney, L. H. Cell mosaic patterns in the native and regenerated inner retina of zebrafish: implications for retinal assembly. J Comp Neurol. 416 (3), 356-367 (2000).
- Raymond, P. A., Barthel, L. K., Bernardos, R. L., Perkowski, J. J. Molecular characterization of retinal stem cells and their niches in adult zebrafish. BMC Dev Biol. 6, 36(2006).
- Bailey, T. J., Davis, D. H., Vance, J. E., Hyde, D. R. Spectral-domain optical coherence tomography as a noninvasive method to assess damaged and regenerating adult zebrafish retinas. Invest Ophthalmol Vis Sci. 53 (6), 3126-3138 (2012).
- Koinzer, S., Saeger, M., Hesse, C., Portz, L., Kleemann, S., Schlott, K., Brinkmann, R., Roider, J. Correlation with OCT and histology of photocoagulation lesions in patients and rabbits. Acta Ophthalmol. 91 (8), e603-e611 (2013).
- Wan, J., Zheng, H., Chen, Z. L., Xiao, H. L., Shen, Z. J., Zhou, G. M. Preferential regeneration of photoreceptor from Müller glia after retinal degeneration in adult rat. Vision Res. (2), 223-234 (2008).
- Thomas, J. L., Thummel, R. A novel light damage paradigm for use in retinal regeneration studies in adult zebrafish. J Vis Exp. (80), e51017(2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon