Method Article
Activación de la célula de Müller glía en un modelo de regeneración en el pez cebra y degeneración retiniana inducida por láser
En este artículo
Resumen
El pez cebra es un popular modelo animal para estudiar mecanismos de degeneración/regeneración retiniana en vertebrados. Este protocolo describe un método para inducir lesiones localizadas interrumpir la retina externa con mínimo daño a la retina interna. Posteriormente, hacemos un seguimiento en vivo la morfología retiniana y la respuesta de la glía de Müller durante la regeneración retiniana.
Resumen
Una fascinante diferencia entre Teleosteos y mamíferos es el potencial de toda la vida de lo teleósteos retina retina neurogénesis y regeneración después de daño severo. Investigar los caminos de la regeneración en el pez cebra podría traer nuevas ideas para desarrollar estrategias innovadoras para el tratamiento de enfermedades degenerativas de la retina en los mamíferos. En este documento, nos centramos en la inducción de una lesión focal en la retina externa en pez cebra adulto por medio de un láser de diodo de 532 nm. Una lesión localizada permite investigar los procesos biológicos que tienen lugar durante la degeneración retiniana y regeneración directamente en el área de daño. Usando la tomografía de coherencia óptica no invasivos (OCT), hemos sido capaces de definir la ubicación de la regeneración posterior área y monitor dañada en vivo. De hecho, la proyección de imagen OCT produce imágenes de alta resolución, transversales de la retina de pez cebra, proporcionando información que antes sólo estaba disponible con análisis histológicos. Para confirmar los datos de OCT en tiempo real, se realizaron cortes histológicos y la respuesta regenerativa después de la inducción de la lesión retiniana fue investigado por immunohistochemistry.
Introducción
La visión es probablemente el sentido más esencial del ser humano y su deficiencia tiene un alto impacto socio-económico. En el mundo industrializado, enfermedades degenerativas de la retina responsables de la mayoría de la pérdida de la visión y ceguera entre la población adulta1. Retinitis pigmentosa (RP) es la causa hereditaria más común de ceguera en personas entre las edades de 20 y 60 años, que afecta a aproximadamente 1,5 millones de personas en todo el mundo2,3. Es una familia heterogénea de enfermedades hereditarias de retinales caracterizada por la pérdida progresiva de los fotorreceptores (PRs) seguida por degeneración del epitelio retiniano del pigmento y, posteriormente, gliosis y remodelación del interior de las neuronas4. El curso de la enfermedad puede explicarse por la pérdida incremental de los dos tipos de células de PR, generalmente a partir de barras, que son responsables de la visión acromática en luz dévil y conos, que son esenciales para color visión y agudeza visual5. Un defecto genético único es suficiente para causar RP. Hasta ahora más de 130 mutaciones en genes de más de 45 se han asociado con la enfermedad6. Esto conduce a diferentes fenotipos de la enfermedad y es una de las razones que la terapia génica no generalizables y así un acercamiento terapéutico complicado. Por lo tanto, hay una necesidad urgente de desarrollar nuevos enfoques terapéuticos generales para el tratamiento de degeneraciones retinianas en cegar enfermedades.
Degeneración retiniana a menudo implica la pérdida de PR; por lo tanto, la muerte celular PR es una característica distintiva de los procesos degenerativos de la retina7. Ya se ha demostrado que estimula la muerte celular de PR Müller glia celular (MC) activación y proliferación8. MCs, el tipo de célula glial importante en la retina vertebrado, se consideraban ser nada más que un "pegamento" entre las neuronas de la retinales. En los últimos años, muchos estudios han demostrado que MCs actuar como algo más que mera estructural de apoyo9. Entre las diferentes funciones, MCs participa también en la neurogénesis y reparación de10. De hecho, en respuesta a factores difusibles de la retina degeneración, MCs aumentan significativamente la expresión de la proteína ácida fibrilosa glial (GFAP). Por lo tanto, el etiquetado de GFAP puede utilizarse como un marcador de activación de MC como una respuesta secundaria a lesión de retina y degeneración11.
Recientemente, hemos desarrollado una adaptación de la novela de lesión focal usando un laser para inducir la degeneración retiniana en el pez cebra (Danio rerio). Lesión focal es ventajoso para el estudio de ciertos procesos biológicos como la migración de células en el sitio lesionado y la sincronización precisa de eventos que tienen lugar durante la regeneración retiniana12. Además, el pez cebra se ha convertido en importante en la investigación visual debido a las similitudes entre su sistema visual y la de otros vertebrados. Brutas características morfológicas e histológicas de las retinas de humanas y teleósteos muestran algunas diferencias. Por consiguiente, las retinas de humanos y de pez cebra contienen las mismas clases de células principales en el mismo modelo de capas, donde fotorreceptores sensibles a la luz ocupan la capa más externa, mientras que las neuronas de proyección retiniana, las células del ganglio, residen en el interior capa neuronal, próxima a la lente. Las interneuronas retinianas, amacrinas, bipolar y células horizontales, localización entre los fotorreceptores y del ganglio celular capas13. Además, la retina de pez cebra es dominado por el cono y por lo tanto más cerca de la retina humana que, por ejemplo, la retina roedor intensamente estudiada. Una fascinante diferencia entre Teleosteos y mamíferos es la neurogénesis persistente en la retina de peces y la regeneración retiniana después del daño. En el pez cebra, MCs puede dedifferentiate y mediar la regeneración en la retina lesionada14,15. En pollo, MCs tienen cierta capacidad también para volver a entrar en el ciclo celular y dedifferentiate. Después de lesión retiniana en peces adultos, MCs adoptar ciertas características del progenitor y las células madre migran al tejido retiniano dañado y producir nuevas neuronas16. Perfil de expresión génica de MCs mamíferos reveló inesperadas similitudes con progenitores retinianos, y evidencia de potencial neurogénico intrínseco de MCs en pollo, roedor y retina incluso humana crece17. Sin embargo, por qué la respuesta regenerativa en aves y mamíferos es menor comparada con la respuesta robusta en peces no se entiende todavía. Por lo tanto, la comprensión de los mecanismos de reparación endógena en el pez cebra puede sugerir estrategias para estimular la regeneración retiniana en mamíferos y humanos. Empleando el mecanismo de reparación endógena de MCs como una herramienta terapéutica para el tratamiento de pacientes con la degeneración retiniana tendría un impacto excepcional para nuestra sociedad.
En el presente, ofrecemos los pasos necesarios para emplear el modelo de la degeneración y regeneración en investigación oftálmica. Nos centramos primero en inducir daño focal en la retina neurosensorial, luego en la proyección de imagen de eventos a la sitio de la lesión y finalmente visualizable de las MCs adyacentes. El protocolo general es relativamente fácil de realizar y abre una amplia variedad de posibilidades para evaluar la retina luego.
Protocolo
todos los experimentos se adhirió a la declaración para el uso de animales en investigación de visión de la Asociación para la investigación en visión y Oftalmología (ARVO) y oftálmica y respetar las normas relacionadas de las autoridades gubernamentales.
1. animales
- TgBAC mantener (gfap:gfap-GFP) pez cebra 167 tensión de (AB) de edades comprendidas entre 6-9 meses en condiciones normales en el agua con una temperatura de 26,5 ° C y 14/10 h luz/oscuridad 18.
- Siga las pautas de cuidado de los animales de las instituciones involucradas para los experimentos con animales después de la aprobación por las autoridades gubernamentales.
2. Anestesia sistémica reversible
- Prepare la solución de sal de metanosulfonato de etilo 3-aminobenzoato (Metanosulfonato) disolviendo 400 mg de polvo de Metanosulfonato en 97,9 mL de agua del tanque y 2.1 mL de 1 M de Tris tampón salino (TBS). Ajustar a pH 7,0 con 1 M Tris (pH 9) y almacenar a 4 ° C en el oscuro hasta un mes.
Nota: Metanosulfonato debe estar preparado en agua como las condiciones naturales del animal, preferentemente agua de tanque original. - Diluir la solución madre 1:25 en agua del tanque y utilizar de inmediato.
- Colocar el pez cebra en una placa de Petri que contenga 50 mL de solución de la anestesia hasta que se vuelven inmóviles y no responden a los estímulos externos (aproximadamente 2-5 min, dependiendo de la edad y peso) de 10 cm.
- Transferir cada pescado con la mano a un soporte de silicona a medida para el tratamiento de láser ( figura 1A).
¡PRECAUCIÓN! Los peces pueden permanecer anestesiados fuera de la pecera hasta 10 min solamente. - Para invertir anestesia tras el tratamiento o la proyección de imagen, coloque el pez cebra en envase que contiene el tanque de agua.
- Para apoyar la recuperación, crear un flujo de agua de tanque fresco sobre las branquias moviendo el pez cebra y hacia atrás en el agua.
3. Lesión Focal en la Retina con láser
Nota: A 532 nm láser de diodo se utiliza para crear daño luz focal sobre la retina del pez cebra. El montaje experimental del laser permite el establecimiento de una lesión retiniana focal reproducible en pez cebra adulto.
- Configurar la potencia del láser: 70 mW; diámetro de antena: 50 μm, duración del pulso: 100 ms.
PRECAUCIÓN! El uso de luz laser requiere una protección personal adecuada y el etiquetado de la zona. - Aplique 1-2 gotas de hidroxipropilmetilcelulosa 2% tópico en el ojo antes del tratamiento y usar un lente de laser de fondo de 2,0 mm para enfocar el haz láser-que apunta en la retina.
¡PRECAUCIÓN! hidroxipropilmetilcelulosa gotas son viscosas y puede causar problemas en la respiración si va en las branquias. - Lugar cuatro láser alrededor del nervio óptico a la izquierda del ojo y utilizar el ojo justo, no tratado como control interno.
4. En vivo Proyección de imagen de la morfología de la retina
- en el día 0, visualizar la retina de pez cebra directamente después de la inducción de láser sin revivir de la anestesia. En todos los demás puntos de tiempo, emplear anestesia general (ver sección 2: anestesia sistémica Reversible). Poner el pez cebra inmovilizado en un soporte de silicona a medida ( figura 1 B, B.1).
- Para obtener imágenes óptimas, cortar una lente de contacto de hidrogel comercialmente disponibles para el ojo del pez cebra (Ø = 5,2 mm, r = 2,70 mm, grueso de centro = 0,4 mm) mediante una perforadora. La superficie cóncava de la lente se llenan de metilcelulosa y colóquelo sobre la córnea.
- Equipar el sistema de OCT con un lente de lámpara de hendidura sin contacto 78D.
- Enfocar la imagen infrarroja (IR) en el IR + modo de OCT ( figura 2A) para visualizar el fondo del ojo y tomar el IR fotos haciendo clic en el " adquirir " botón ( figura 2B) para localizar el manchas en la retina mediante el sistema del laser ' software s.
- Visualiza una sección tridimensional de las capas retinianas en el IR + OCT modo y tomar las fotos haciendo clic en el " adquirir " botón ( figura 2B). Observar la gravedad de la lesión en la capa nuclear externa (ONL) (ver sección 3: lesión focal en la retina con láser) en estas imágenes.
- Para revertir la anestesia después del tratamiento o la proyección de imagen de pez cebra en un recipiente que contiene el tanque de agua.
- Para apoyar la recuperación, crear un flujo de agua de tanque fresco sobre las branquias moviendo el pez cebra y hacia atrás en el agua.
- Realizar similares en vivo la proyección de imagen de morfología retiniana en el día 1, 3, 7, 14 y 6 semana.
5. La hematoxilina & eosina (H & E) tinción
- eutanasia pez cebra por inmersión en frío (4 ° C) solución de anestesia en hielo durante al menos 10 minutos y enucleate los ojos inmediatamente por medio de pinzas curvas pequeñas.
- Fijar los ojos todo en paraformaldehído al 4% (PFA) en tampón fosfato salino (PBS) a 4 ° C durante 20 h y luego deshidratar las muestras en una serie gradual de alcohol (xileno, etanol 100% durante 5 minutos dos veces, 100% durante 5 minutos dos veces y etanol 70%, etanol 96% por 3 min dos veces 3 mi n una vez).
¡PRECAUCIÓN! PFA puede ser irritante a los ojos, la nariz y la vía respiratoria superior. PFA es un conocido cancerígeno humano y un sospecha peligro reproductivo. - Incrustar las muestras en parafina, corte 5 μm secciones en el nivel de la cabeza del nervio óptico y montar en portaobjetos de vidrio.
- Mancha las secciones deparaffinized con solución de hematoxilina ácido 0,1% durante 5 minutos y sumergir el portaobjetos dos veces en agua destilada después de sumergir el portaobjetos en la mezcla de ácido clorhídrico (HCl en 250 mL de 2 mL 25% agua destilada agua) y amonio (amoníaco de 25% de 2 mL en 250 mL de la mezcla agua destilada). Mancha las secciones con solución acuosa de eosina G 0.5% por 3 min después del desarrollo de la hematoxilina manchas por agua del grifo durante al menos 10 min
- Montar las diapositivas deshidratadas en medio de montaje de resina acrílica y observe los portaobjetos en el microscopio de luz.
6. Inmunohistoquímica para la activación de MC
- calentar las secciones deparaffinized en tampón de recuperación de antígeno (Tris-EDTA + 0.05% detergente no iónico, pH 9.0) durante 3 minutos en un apropiado de vapor o en microondas 10-15 min y lavar tres veces con TBS para 5 minutos cada uno.
- Bloqueo de círculo las secciones con una silicona de la pluma y añadir 100 μl solución (TBS + suero normal de cabra 10% + 1% albúmina de suero bovino, pH 7,6) a temperatura ambiente durante 1 h.
- Tinción con anticuerpos policlonales de conejo anti-glial proteína ácida fibrilar (GFAP) y la glutamina sintetasa (GS) anticuerpo monoclonal de ratón, tanto en una dilución de 1: 200 (40 μl por muestra). Incubar el portaobjetos en una cámara humidificada a 4 ° C durante la noche. Lavar tres veces con TBS + 0,1% Tween 20 durante 5 minutos. Anticuerpos secundarios
- visualización de acabado con el apropiado. Este protocolo utiliza una cabra anti-conejo IgG H & anticuerpo secundario L verde para GFAP y una cabra anti-ratón IgG H & rojo brillante L de GS, en una dilución de 1: 500 a temperatura ambiente durante 1 h.
- Montar el portaobjetos con medio de montaje con DAPI y observe los portaobjetos en el microscopio de fluorescencia.
Resultados
OCT en tiempo real: para analizar el papel de MCs en reparación retiniana, utilizamos un modelo de lesión láser induce una zona bien delimitada de daño en la retina de pez cebra. El sitio de daño era reflejado por medio de OCT en vivo por primera vez (día 0) en 60 minutos después de la lesión (figura 3). Para compensar la óptica del ojo de pescado, una lente de contacto a medida se puso en la córnea. Inmediatamente después del tratamiento láser, una señal hiper reflexivo difusa fue localizada en la retina externa (flechas). Extendido desde el epitelio pigmentado retiniano (RPE) a la capa plexiforme externa (OPL). Una señal similar también era perceptible en el día 1. Después de 3 días, esta señal difusa llegó a ser más organizada y densa. Se vio constantemente en la capa nuclear externa (ONL) que se extiende en la capa de fotorreceptores. Después de la primera semana (día 7), hubo una disminución significativa en el tamaño promedio de la lesión y se detectó sólo una pequeña señal hiper reflexivo. A partir del día 14 hasta el último momento investigados (semana 6), los puntos de láser ya no eran visibles en las imágenes IR y OCT.
Evaluación histológica de la retina degeneración/regeneración: con el fin de investigar el alcance y la cinética de la retina degeneración/regeneración, H & E tinción fue empleada en diferentes momentos después de la inducción de daño (día 0, 1, 3, 7, 14 y la semana 6) (figura 4). Los experimentos fueron realizados en tres ojos de tres peces. Sin embargo, ningún análisis estadístico se realizan ya que el objetivo de este manuscrito es el método. Cambios sutiles en la capa nuclear interna (INL) y ONL puede ser visto láser posterior inmediata (p. ej., leve edema en la ONL) y reducido espacio intercelular en el INL en 60 minutos después del tratamiento láser. La degeneración fue seguida por 6 semanas después de la inducción de lesiones del laser. Cambios morfológicos fueron observadas constantemente después de 1 día con desorganización de la ERP y con una formación de cavidad en la ONL y en el espacio subretinal. De hecho, hubo una pérdida de núcleos dentro de la ONL en el área de daños entre los días 1 y 7. La pérdida máxima de PR fue encontrada el día 3. A partir de 14 días a 6 semanas, la retina externa había reestablecido su morfología normal.
Participación glial durante retiniana degeneración/regeneración: para evaluar la activación de la MC en diferentes puntos temporales (día 0, 3, 14) después de la inducción de la degeneración retiniana, se realizaron análisis de immunohistochemical para los marcadores de células gliales GS y GFAP (figura 5). Otra vez se realizaron experimentos en tres ojos de tres peces sin análisis cuantitativo. GS desempeña un papel importante en controlar el nivel de glutamato extracelular y se considera para ser expresado exclusivamente en MC soma y sus procesos19,20. GFAP es upregulated durante el envejecimiento y cuando la retina está dañada o tensionada. Se localiza en el extremo-pies de MC y procesos21. Débil expresión de GFAP fue encontrado también en la parte interna de la retina de ileso de control etiquetado otros tipos de células gliales, por ejemplo, los astrocitos. La autofluorescencia de los segmentos externos de PR también proporciona una señal en la ONL, pero esto podría ser claramente distinguido. La GFAP es upregulated en poste-lesión de día 3. Por lo tanto, los análisis realizados en el día 3 después del tratamiento laser demostrada MCs GFAP positivas sólo en el sitio de lesión en la ONL de la retina. Desde el día 14, la regeneración era en gran parte completa y la señal GFAP fue regulada a nivel basal en la zona de daños. A diferencia de GFAP no hubo ningún cambio considerable en el nivel de expresión de GS. Sin embargo, habría una downregulation localizada de GS en el sitio de la lesión.

Figura 1: configuración para la inducción de la lesión de láser de retina de pez cebra y análisis OCT. (A) disposición del sistema laser antes del tratamiento. Pez cebra (A.1) se coloca en porta silicona con lente de contacto del fondo en su lugar justo antes de la aplicación del rayo láser. (B) arreglo del sistema OCT antes de la proyección de imagen. Pez cebra (B.1) colocado antes de lente de la lámpara de hendidura del 78D antes de la detección de los sitios de daño por medio de octubre por favor haga clic aquí para ver una versión más grande de esta figura.
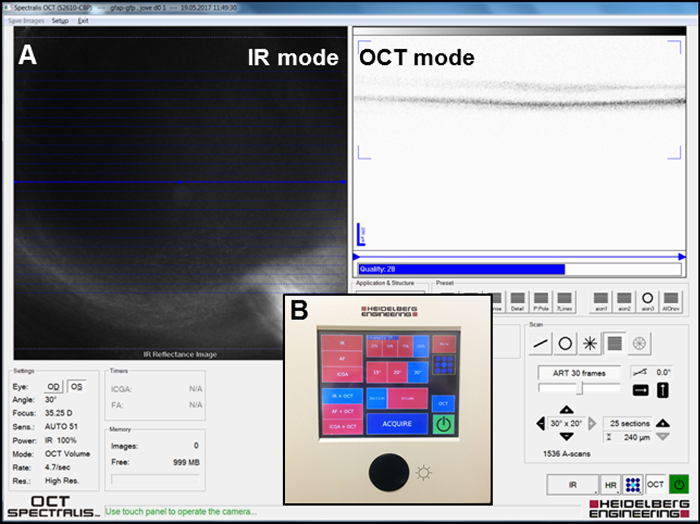
Figura 2: configuración para la adquisición de las imágenes IR y OCT. (A) captura de pantalla de la ventana del software durante proyección de imagen. Modos de IR y OCT están representados. (B) Resumen del panel utilizado para la adquisición de las imágenes. Haga clic aquí para ver una versión más grande de esta figura.
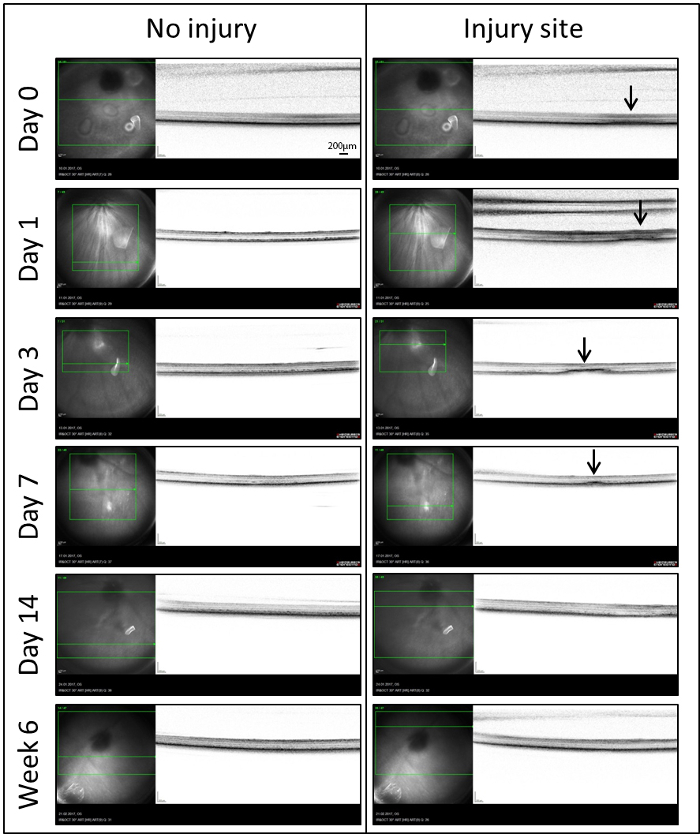
Figura 3: IR (izquierda) e imágenes (derecha) OCT de los lesionados y lesionadas de retina en el mismo ojo en momento diferentes puntos (días 0, 1, 3, 7, 14 y 6 semana) después de la degeneración retiniana inducida por láser. En las imágenes IR, una caja verde indica la porción de la retina que ha ser analizado y la línea verde muestra la ubicación de las imágenes de OCT en la retina. Las flechas indican los sitios de los puntos de láser detectados señales hiper reflexivo en la barra de escala de octubre = 200 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 4: H & E la coloración de los heridos y el contralateral ileso ojo de pez cebra en momento diferentes puntos (días 0, 1, 3, 7, 14 y 6 semana) después de la degeneración retiniana inducida por láser. GC, capa de células ganglionares; INL, capa nuclear interna; ONL, capa nuclear externa. Barra de escala = 50 μm. haga clic aquí para ver una versión más grande de esta figura.
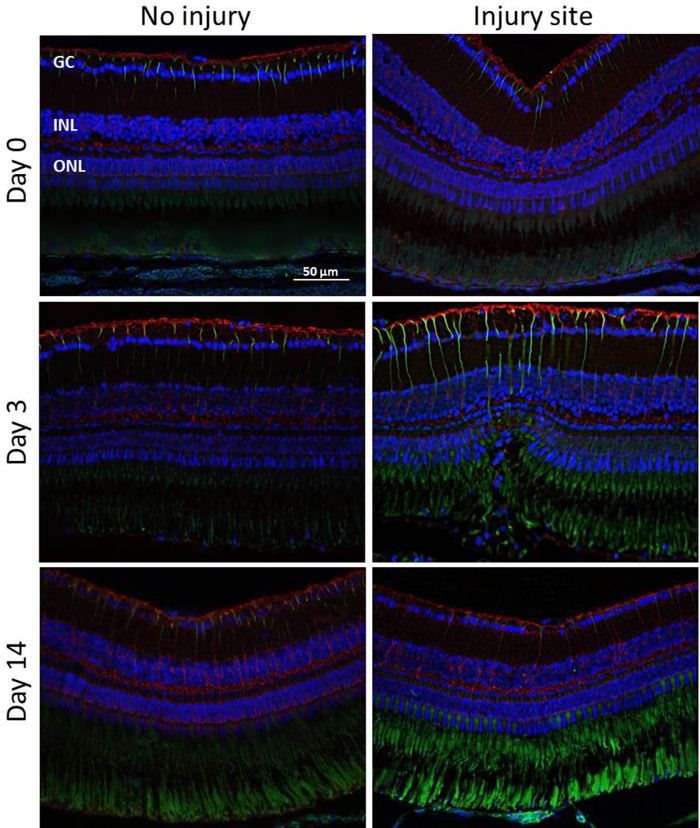
Figura 5: detección de Immunohistochemical de la activación de MC. GFAP (verde) y GS (rojo) manchas en la retina de pez cebra lesionados y lesionadas en momento diferentes puntos (días 0, 3, 14) después de la degeneración retiniana inducida por láser. La señal verde en la ONL es debido a la autofluorescencia de la PR osegmentos del útero. Núcleos celulares son teñidos con DAPI (azul). Barra de escala = 50 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Regeneración, degeneración retiniana en el pez cebra ha sido investigada por diferentes enfoques como de muerte celular mediada por la citotoxina22, lesión mecánica23y lesiones térmicas24. Se empleó un 532 nm diodo láser para dañar la retina de pez cebra. Por lo tanto, nuestro modelo ofrece varias ventajas. Por ejemplo, creamos rápidamente un área bien definida de lesión localizada en la retina externa, específicamente en la capa de PRs. Además, este montaje experimental puede ser modificado para producir áreas más grandes del daños para el estudio de otros procesos biológicos, por ejemplo, al dañar la membrana de Bruch para inducir neovascularización coroidea. Hay daño colateral mínimo y el tiempo de la respuesta regenerativa puede ser modulado precisa y reproducible.
Para seguir los cambios fenotípicas con el tiempo, se emplean el sistema de Heidelberg Spectralis y el software de Heidelberg ojo explorador. Así, la proyección de imagen del fondo IR resultó para ser especialmente útil en el pez cebra. A diferencia del fondo Autofluorescencia (AF), que demuestra el bajo contraste entre el foco del láser y sus alrededores, los sitios dañados son más fáciles de localizar por la proyección de imagen IR. Esto nos permite detectar cambios y monitorear regeneración en vivo, que no sería posible con el modo AF. Como previamente divulgados25OCT puede utilizarse para supervisar procesos degenerativos/regenerativos en la retina del pez cebra. En nuestro modelo, lesión retiniana laser fue detectado como una banda hiper reflexivo en la ONL (figura 3), que es similar a lo que se ha divulgado en mamíferos26. Durante la regeneración, la señal hiper reflexivo disminuyó hasta que desapareció totalmente en el día 14.
Las imágenes de OCT se correlacionaron con cambios morfológicos en las lesiones del láser (figura 4). La señal hiper reflexivo difusa en imágenes de OCT (día 0) representa los cambios post-laser en la INL del pez cebra sacrificado dentro de 1 hora después del tratamiento láser. La señal hiper reflexivo sutil y bien delineada en día 3 corresponde a la formación de cavidad en la ONL debido a la pérdida de la barra. A partir del día 14, ambos OCT y análisis histológicos confirman que la retina externa había reestablecido su morfología normal.
En el presente estudio, se evaluó también la respuesta de MC durante la regeneración retiniana (figura 5). Muchos grupos ya han investigado la activación de células gliales, especialmente de MCs, como una respuesta regenerativa inicial a dañar. En concreto, sugirieron que activación MC fisiopatológica puede inducir el MCs a adoptar las características de la célula de vástago, proporcionando una fuente endógena de nuevo funcionamiento tipos celulares que pueden ser integrados en las áreas dañadas de la retina27. Como era de esperar, encontramos que lesión retiniana laser estimula la activación de MC como se indica por el upregulation de GFAP. De hecho, mayor expresión de GFAP notable fue detectada en lesiones después de 3 días y se restringió a la zona de daños. A partir del día 14, la regeneración era en gran parte completa y la señal GFAP fue regulada para el nivel inicial en el área de daño. Así, hemos demostrado que MCs juega un papel activo en la reorganización retinal y potencialmente regeneración, después de lesión.
En conclusión, el modelo de degeneración/regeneración retiniana inducida por láser es una herramienta versátil para producir daño rápido y focal a la retina de pez cebra y se puede visualizar la siguiente regeneración por proyección de imagen de OCT no invasivo. Además, hemos sido capaces de mostrar que degeneración de la retina y láser se acompaña de activación del MC y que la gliosis resultante se invierte en regeneración. Sin embargo, una investigación detallada de los tipos de células implicadas (por ejemplo, microglia, macrófagos) y vías debe realizarse. Modificaciones críticas pueden ser necesario, vivir sobre todo seguimiento de las MCs para entender mejor cómo se comportan durante el proceso de regeneración (por ejemplo, migración de su ubicación original en el INL en la retina externa, especialmente en la capa de PRs) y su diferenciación hacia células de PR. Alternativamente, paradigmas de luz daño podrían utilizarse para inducir la pérdida generalizada y constante de la barra y cono PRs28. Sin embargo, la ventaja del modelo descrito es un área de lesión más definida donde uno puede estudiar las interacciones locales entre degeneración de fotorreceptores y MCs activados.
En general, creemos que el modelo ayudará a entender mejor procesos degenerativos/regenerativos en la retina sensorial y puede permitir la comparación de estos desarrollos con el sistema mamífero. También podría ser utilizado para estudiar la influencia del sistema inmune innato y los efectos de sustancias neuroactivas. En el futuro, uno podría ser capaz de utilizar estos resultados para modificar el sistema visual humano degeneración.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Martin Zinkernagel, MD, PhD y Miriam Reisenhofer, PhD por su aportación científica a establecer el modelo y Federica Bisignani su excelente asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| Acid hematoxylin solution | Sigma-Aldrich, Buchs, Switzerland | 2852 | |
| Albumin | Sigma-Aldrich, Buchs, Switzerland | A07030 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, Buchs, Switzerland | 5470 | |
| Dako Pen | Dako, Glostrup, Danmark | S2002 | |
| DAPI mounting medium | Vector Labs, Burlingame, CA, USA | H-1200 | |
| Eosin G aqueous solution 0.5% | Carl Roth, Arlesheim, Switzerland | X883.2 | |
| Ethanol | Sigma-Aldrich, Buchs, Switzerland | 2860 | |
| Ethylene diamine tetraacetic acid (EDTA) | Sigma-Aldrich, Buchs, Switzerland | ED | |
| Eukitt | Sigma-Aldrich, Buchs, Switzerland | 3989 | |
| Goat anti-rabbit IgG H&L Alexa Fluor® 488 | Life Technologies, Zug, Switzerland | A11008 | |
| Goat anti-mouse IgG H&L Alexa Fluor® 594 | Life Technologies, Zug, Switzerland | A11020 | |
| Goat normal serum | Dako, Glostrup, Danmark | X0907 | |
| Hydrogel contact lens | Johnson & Johnson AG, Zug, Switzerland | n.a. | 1-Day Acuvue Moist |
| Hydroxypropylmethylcellulose 2% | OmniVision, Neuhausen, Switzerland | n.a. | Methocel 2% |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma-Aldrich, Buchs, Switzerland | A5040 | Tricaine, MS-222 |
| Visulas 532s | Carl Zeiss Meditec AG, Oberkochen, Germany | n.a. | 532 nm laser |
| Mouse anti-GS monoclonal antibody | Millipore, Billerica, MA, USA | MAB302 | |
| HRA + OCT Imaging System | Heidelberg Engineering, Heidelberg, Germany | n.a. | Spectralis |
| Heidelberg Eye Explorer | Heidelberg Engineering, Heidelberg, Germany | n.a. | Version 1.9.10.0 |
| Paraformaldehyde (PFA) | Sigma-Aldrich, Buchs, Switzerland | P5368 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Buchs, Switzerland | P5368 | |
| Rabbit anti-GFAP polyclonal antibody | Invitrogen, Waltham, MA, USA | 180063 | |
| Silicone pin holder | Huco Vision AG Switzerland | n.a. | Cut by hand from silicone pin mat of the sterilization tray accordingly. |
| Slit lamp BM900 | Haag-Streit AG, Koeniz, Switzerland | n.a. | |
| Slit lamp adapter | Iridex Corp., Mountain View, CA, USA | n.a. | |
| Superfrost Plus glass slides | Gehard Menzel GmbH, Braunschweig, Germany | 10149870 | |
| TgBAC (gfap:gfap-GFP) zf167 (AB) strain | KIT, Karlsruhe, Germany | 15204 | http://zfin.org/ZDB-ALT-100308-3 |
| Tris buffered saline (TBS) | Sigma-Aldrich, Buchs, Switzerland | P5912 | |
| Tween 20 | Sigma-Aldrich, Buchs, Switzerland | P1379 | |
| 78D non-contact slit lamp lens | Volk Optical, Mentor, OH, USA | V78C | |
| Xylene | Sigma-Aldrich, Buchs, Switzerland | 534056 | |
| Ocular fundus laser lens | Ocular Instruments, Bellevue, WA, USA | OFA2-0 | |
| 2100 Retriever | Aptum Biologics Ltd., Southampton, United Kingdom | R2100-EU | Steamer |
Referencias
- Haddad, S., Chen, C. A., Santangelo, S. L., Seddon, J. M. The genetics of age-related macular degeneration: a review of progress to date. Surv. Ophthalmol. 51 (4), 316-363 (2006).
- Stefano Ferrari, S., Di Iorio, E., Barbaro, V., Ponzin, D., Sorrentino, F. S., Parmeggiani, F. Retinitis Pigmentosa: Genes and Disease Mechanisms. Curr Genomics. 12 (4), 238-249 (2011).
- Berson, E. L. Retinitis pigmentosa. The Friedenwald Lecture. Invest Ophthalmol Vis Sci. 34 (5), 1659-1676 (1993).
- Strettoi, E. A Survey of Retinal Remodeling. Front Cell Neurosci. 9, 494 (2015).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368, 1795-1809 (2006).
- Wang, D. Y., Chan, W. M., Tam, P. O., Baum, L., Lam, D. S., Chong, K. K., Fan, B. J., Pang, C. P. Gene mutations in retinitis pigmentosa and their clinical implications. Clin Chim Acta. 351 (1-2), 5-16 (2005).
- Pierce, E. A. Pathways to photoreceptor cell death in inherited retinal degenerations. BioEssays. 23, 605-618 (2001).
- Tackenberg, M. A., Tucker, B. A., Swift, J. S., Jiang, C., Redenti, S., Greenberg, K. P., Flannery, J. G., Reichenbach, A., Young, M. J. Muller cell activation, proliferation and migration following laser injury. Mol. Vis. , 1886-1896 (2009).
- Newman, E., Reichenbach, A. The Müller cell: a functional element of the retina. Trends Neurosci. 19 (8), 307-312 (1996).
- Kubota, R., Hokoc, J. N., Moshiri, A., McGuire, C., Reh, T. A. A comparative study of neurogenesis in the retinal ciliary marginal zone of homeothermic vertebrates. Brain Res Dev Brain Res. 134, 31-41 (2002).
- Zhao, T. T., Tian, C. Y., Yin, Z. Q. Activation of Müller cells occurs during retinal degeneration in RCS rats. Adv Exp Med Biol. 664, 575-583 (2010).
- DiCicco, R. M., Bell, B. A., Kaul, C., Hollyfield, J. G., Anand-Apte, B., Perkins, B. D., Tao, Y. K., Yuan, A. Retinal Regeneration Following OCT-Guided Laser Injury in Zebrafish. Invest Ophthalmol Vis Sci. 55 (10), 6281-6288 (2014).
- Bilotta, J., Saszik, S. The zebrafish as a model visual system. Int. J. Dev. Neurosci. , 621-629 (2001).
- Fausett, B. V., Goldman, D. A role for alpha1 tubulin-expressing Müller glia in regeneration of the injured zebrafish retina. J Neurosci. 26 (23), 6303-6313 (2006).
- Yurco, P., Cameron, D. A. Responses of Müller glia to retinal injury in adult zebrafish. Vision Res. 45, 991-1002 (2005).
- Ashutosh, P. J., Roesch, K., Cepko, C. L. Development and neurogenic potential of Müller gial cells in the vertebrate retina. Prog Retin Eye Res. 28 (4), 249-262 (2009).
- Xia, X., Ahmad, I. Unlocking the Neurogenic Potential of Mammalian Müller Glia. Int J Stem Cells. 9 (2), 169-175 (2016).
- Brand, M., Granato, M., Nüsslein-Volhard, C., Nüsslein-Volhard, C., Dahm, R. Keeping and raising zebrafish. Zebrafish: A Practical Approach. , 7-38 (2002).
- Riepe, R. E., Norenburg, M. D. Müller cell localisation of glutamine synthetase in rat retina. Nature. 268 (5621), 654-655 (1977).
- Derouiche, A., Rauen, T. Coincidence of L-glutamate/L-aspartate transporter (GLAST) and glutamine synthetase (GS) immunoreactions in retinal glia: evidence for coupling of GLAST and GS in transmitter clearance. J Neurosci Res. 42 (1), 131-143 (1995).
- Bignami, A., Dahl, D. The radial glia of Müller in the rat retina and their response to injury. An immunofluorescence study with antibodies to the glial fibrillary acidic (GFA) protein. Exp Eye Res. 28 (1), 63-69 (1979).
- Sherpa, T., Fimbel, S. M., Mallory, D. E., Maaswinkel, H., Spritzer, S. D., Sand, J. A., Li, L., Hyde, D. R., Stenkamp, D. L. Ganglion cell regeneration following whole-retina destruction in zebrafish. Dev Neurobiol. 68 (2), 166-181 (2008).
- Cameron, D. A., Carney, L. H. Cell mosaic patterns in the native and regenerated inner retina of zebrafish: implications for retinal assembly. J Comp Neurol. 416 (3), 356-367 (2000).
- Raymond, P. A., Barthel, L. K., Bernardos, R. L., Perkowski, J. J. Molecular characterization of retinal stem cells and their niches in adult zebrafish. BMC Dev Biol. 6, 36 (2006).
- Bailey, T. J., Davis, D. H., Vance, J. E., Hyde, D. R. Spectral-domain optical coherence tomography as a noninvasive method to assess damaged and regenerating adult zebrafish retinas. Invest Ophthalmol Vis Sci. 53 (6), 3126-3138 (2012).
- Koinzer, S., Saeger, M., Hesse, C., Portz, L., Kleemann, S., Schlott, K., Brinkmann, R., Roider, J. Correlation with OCT and histology of photocoagulation lesions in patients and rabbits. Acta Ophthalmol. 91 (8), e603-e611 (2013).
- Wan, J., Zheng, H., Chen, Z. L., Xiao, H. L., Shen, Z. J., Zhou, G. M. Preferential regeneration of photoreceptor from Müller glia after retinal degeneration in adult rat. Vision Res. (2), 223-234 (2008).
- Thomas, J. L., Thummel, R. A novel light damage paradigm for use in retinal regeneration studies in adult zebrafish. J Vis Exp. (80), e51017 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados