Method Article
PCR de fusion haute résolution pour le complément du récepteur 1 Polymorphisme de longueur Le génotypage: un outil novateur pour l'évaluation de la sensibilité des gènes de la maladie d'Alzheimer
Dans cet article
Résumé
Ici, nous décrivons une méthode innovante pour déterminer les polymorphismes de la longueur du récepteur 1 (CR1) pour une utilisation dans plusieurs applications, en particulier l'évaluation de la sensibilité à des maladies telles que la maladie d'Alzheimer (AD). Cette méthode pourrait être utile pour mieux comprendre le rôle des isoformes CR1 dans la pathogenèse de l'AD.
Résumé
Le récepteur de complément 1 (CR1), une glycoprotéine transmembranaire qui joue un rôle clé dans le système immunitaire inné, est exprimé sur de nombreux types cellulaires, mais surtout sur les globules rouges (globules rouges). En tant que récepteur pour les composants du complément C3b et C4b, le CR1 régule l'activation de la cascade du complément et favorise la phagocytose des complexes immuns et des débris cellulaires, ainsi que le peptide amyloïde-bêta (Aβ) dans la maladie d'Alzheimer (AD). Plusieurs études ont confirmé des polymorphismes de nucléotide unique (SNP) associés à AD, ainsi qu'une variation de nombre de copies (CNV) dans le gène CR1 . Ici, nous décrivons une méthode innovante pour déterminer le polymorphisme de longueur du récepteur CR1. Le récepteur comprend trois domaines, appelés longues répétitions homologues (LHR) -LHR-A, LHR-C et LHR-D-et un domaine n, LHR-B, où n est un nombre entier compris entre 0 et 3. En utilisant une seule paire D'amorces spécifiques, le matériel génétique est utilisé pour amplifier un premier fragment du domaine LHR-B (thE variant l'amplicon B) et un second fragment du domaine LHR-C (l'amplicon invariant). Le variant amplicon B et l'amplicon invariant affichent des différences à cinq nucléotides en dehors des zones d'hybridation desdites amorces. Le nombre d'amplicons variant B et d'amplicons invariants est déduit à l'aide d'un outil quantitatif (courbes de fusion à haute résolution (HRM)), et le rapport du variant amplicon B à l'amplicon invariant diffère selon le polymorphisme de longueur CR1. Cette méthode présente plusieurs avantages par rapport à la méthode du phénotype canonique, car elle ne nécessite pas de matière fraîche et est moins coûteuse, plus rapide et donc applicable à des populations plus importantes. Ainsi, l'utilisation de cette méthode devrait être utile pour mieux comprendre le rôle des isoformes CR1 dans la pathogenèse de maladies telles que l'AD.
Introduction
L'AD, la cause la plus fréquente de démence, touche plus de 30 millions de personnes à travers le monde et constitue un problème majeur de santé publique 1 . Cliniquement, l'AD se caractérise par des troubles neurocognitifs conduisant à une perte progressive d'autonomie 2 . L'AD se caractérise par deux caractéristiques neuropathologiques, à savoir les dépôts amyloïdes extra-cellulaires et les enchevêtrements neurofibrillaires intracellulaires 3 .
Traditionnellement, selon l'âge d'apparition de la maladie, AD est classé sous deux formes. D'abord, l'apparition anticipée de l'AD (EOAD), où l'apparition survient le plus souvent avant l'âge de 65 ans; Ce formulaire représente moins de 5% des cas d'AD. C'est une forme rare, autosomique de l'AD, qui entraîne des mutations totalement pénétrantes dans la protéine précurseur amyloïde ( APP) 4 , la préséniline 1 ( PSEN1 ) 5 ou la préséniline 2 ( PSEN2 )> 6 gènes. Deuxièmement, la forme la plus fréquente de la maladie (> 90% des cas de MA) est appelée «AD sporadique» tardive (LOAD) et apparait le plus souvent chez les personnes de 65 ans et plus. Il résulte de multiples facteurs de risque génétiques et environnementaux 7 . Dans LOAD, l'allèle 4 du gène apolipoprotéine E ( APOE ) est le principal facteur de risque génétique 8 , 9 . En outre, plus de 20 loci de gènes ont été identifiés par des études d'association à l'échelle du génome (GWAS) comme étant associées au risque d'AD, dont le gène 10 du récepteur 1 ( CR1 ) du composant complément (3b / 4b), situé sur Chromosome 1q32 dans un groupe de protéines liées au complément. Le gène CR1 code pour la protéine du récepteur du complément 1 (CR1), une composante des régulateurs de l'activité du complément.
CR1 (le récepteur C3b / C4b, CD35), une glycoprotéine transmembranaire de approximationEly 200 kDa 11 , se lie au C3b, C4b, C3bi, C1q, la lectine de liaison au mannan (MBL) et les protéines du complément ficolin 12 . La fonction biologique de CR1 varie avec les types de cellules dans lesquels il est exprimé. Chez l'homme, 90% du CR1 circulant total se retrouve dans les globules rouges (RBC) 13 . Présent à la surface des globules rouges, le CR1 se lie aux microorganismes opsonisés C3b ou C4b ou aux complexes immuns, ce qui facilite leur clairance de la circulation. Les complexes liés à CR1 sont en effet transférés vers des phagocytes lorsque les globules rouges traversent le foie et la rate 11 , 14 . En limitant le dépôt de C3b et C4b, CR1 pourrait empêcher une activation excessive du complément. Par conséquent, l'expression de CR1 sur les globules rouges est considérée comme un élément essentiel dans la protection des tissus, tels que le système nerveux cérébral, contre le dépôt du complexe immunitaire et les maladies qui en résultent. Le CR1 sur les globules rouges est également connu pourJouent un rôle important dans l'infection pathogène 15 , 16 . En outre, CR1, en tant qu'acteur clé en immunité innée, participe à la régulation de la cascade du complément et au transport et à l'élimination des complexes immuns. Le CR1 exerce cette activité en liant les fragments C3b et C4b et en dissociant les convertases classiques et alternatives (dissociation de C2a du complexe C4b2a et dissociation de C3b du complexe C3bBb). En tant que cofacteur du facteur de serine protease plasmatique I (FI), le CR1 inhibe les voies de complément classiques et alternatives en augmentant le clivage de C4b et C3b par FI, une propriété connue sous le nom d'activité de cofacteur (CA) et en inhibant la boucle d'amplification C3 , À son tour, empêchant une nouvelle activation du complément. Rogers et ses collègues prouvent que le peptide Aß peut se lier et activer la voie du complément en l'absence d'anticorps 17 et suggérer que le peptide Aß est clSortit de la circulation par adhérence dépendante du complément au CR1 exprimé sur les globules rouges 18 .
Le CR1 présente trois types de polymorphismes: polymorphismes structurels ou de longueurs, polymorphismes de densité et polymorphismes du groupe sanguin Knops 11 , 19 . Le polymorphisme structurel est lié à une variation du nombre de répétitions homologues longues (LHR) et définit ainsi quatre isoformes. En fait, le domaine extracellulaire de la protéine CR1 est composé d'une série d'unités récurrentes, appelées répétitions de consensus courtes (SCR) ou répétitions de contrôle du complément (CCP). Ces SCR ont été démontrés à partir de l'acide désoxyribonucléique complémentaire (ADNc) codant CR1. Les SCR sont organisés en groupes en tandem de sept, appelés LHR. CR1 est disposé en quatre LHR, désignés par LHR-A, -B, -C et -D, découlant de la duplication d'une unité sept-SCR 19 , 20 ,21 .
Dans l'ordre croissant de fréquence, ces isoformes CR1 déterminées par Western Blot (WB) sont CR1 * 1 (A / F) (migration rapide sur électrophorèse sur gel), CR1 * 2 (B / S) (migration lente sur électrophorèse sur gel), CR1 * 3 (C / F`) et CR1 * 4 (D). Les deux isoformes les plus courantes, CR1 * 1 (A / F) et CR1 * 2 (B / S) sont composées de quatre et cinq LHR, respectivement, alors que CR1 * 3 (C / F`) et CR1 * 4 (D ) Sont composés de 3 et 6 LHR, respectivement. L'isoforme la plus commune (CR1 * 1), composée de 30 SCR, contient trois sites de liaison C4b (SCR 1-3, 8-10 et 15-17) et deux sites de liaison C3b (SCR 8-10 et 15-17) , Tandis que les SCR 22-28 lient C1q, ficolins et MBL 12 , 20 , 21 , 22 , 23 , 24 , 25 . Ainsi, CR1 * 2 contient un site de liaison C3b / C4b supplémentaire comparéD à CR1 * 1. La figure 1 illustre les structures, les nomenclatures et les poids moléculaires des quatre isoformes différentes de CR1.
Le polymorphisme de densité correspond à un phénotype stable qui représente le niveau d'expression constitutive de CR1 sur les globules rouges. Chez les sujets sages en bonne santé, il a été démontré que le nombre de molécules CR1 par RBC peut varier jusqu'à un facteur dix (variant de 150 à 1 200 molécules par cellule) 26 . Les globules rouges du phénotype de Helgeson ont une densité de CR1 très faible, ce qui était inférieur à 150 molécules par cellule 27 , 28 . La densité de CR1 sur les globules rouges est génétiquement associée à un système bialélique codominien autosomique sur le gène CR1 , corrélée avec un polymorphisme de longueur de fragment de restriction Hin dIII (RFLP) 29 . Une mutation à un seul point dans Intron 27 du gène CR1, entre les exons codant la secondeSCR dans LHR-D, entraîne la génération d'un site polymorphique Hin dIII dans cette région 30 . Les fragments Genomic Hin dIII de 7,4 et 6,9 kDa identifient les allèles associés à la densité élevée (H allèle) ou faible (L allele) CR1 sur les globules rouges, respectivement. Cependant, aucune corrélation n'a été trouvée entre la densité CR1 sur les globules rouges et les polymorphismes Hin dIII dans certaines populations de l'Afrique de l'Ouest 31 , 32 . Le mécanisme reliant la régulation de la densité CR1 à un polymorphisme Hin DIII non codant reste inconnu. Parmi plusieurs polymorphismes, Q981H dans SCR16 et P1786R dans SCR28 ont été signalés comme étant liés à la densité CR1 sur les globules rouges 30 , 33 .
Le polymorphisme Knops (KN), selon la nomenclature internationale, est le 22ème système de groupe sanguin à indexer par la Société internationale de transfusion sanguine. Il contient 9 spécimens antigéniquesLes expressions exprimées par le CR1 sur les globules rouges, y compris trois paires antigéniques antithétiques, KN1 / KN2, KN3 / KN6 et KN4 / KN7, ainsi que 3 antigènes isolés, KN5, KN8, KN9. Les antigènes KN1, KN3, KN4 et KN5 sont des antigènes à haute fréquence du système KN ( c'est-à-dire exprimés dans plus de 99% de la population générale). Cependant, le rôle de ce polymorphisme dans AD reste à déterminer 13 .
Le protocole décrit dans ce travail a été conçu pour déterminer les génotypes de polymorphisme de longueur CR1 impliqués dans la susceptibilité à plusieurs maladies, telles que AD, lupus érythémateux systémique et paludisme. Notre méthode pour la détermination du polymorphisme de longueur CR1 profite du nombre de LHR-Bs comprenant les isoformes CR1 et des différences de séquence entre LHR-B et LHR-C ( Figure 2 ).
Protocole
Le protocole pour la collecte et la manipulation du sang humain a été examiné et approuvé par le comité régional d'éthique (CPP Est II) et le numéro de protocole 2011-A00594-37.
REMARQUE: Le protocole suivant décrit la manipulation du sang humain. Suivez les directives institutionnelles tout en éliminant les matières dangereuses. Des équipements de sécurité de laboratoire, tels que des blouses de laboratoire et des gants, devraient être portés. Un diagramme décrivant le protocole est affiché à la figure 3 .
1. Extraction d'ADN du sang et du fluide corporel
- Pipeter 20 μL de protéinase K (15 μg / μL) dans le fond d'un tube de 1,5 ml.
- Ajouter 200 μl d'échantillon au tube de 1,5 ml. Utiliser jusqu'à 200 μl de sang entier, plasma, sérum, couche buffy ou fluides corporels, ou jusqu'à 5 x 10 6 lymphocytes dans 200 μL de PBS.
- Ajouter 200 μL de tampon de lyse à l'échantillon. Mélanger par vortex-impulsion pendant 15 s.
- Incuber à 56 ° C pendant 10 min dans un bain d'eau.
- Centrifuger brièvement le tube de 1,5 ml pour enlever les gouttes de l'intérieur du couvercle.
- Ajouter 200 μL d'éthanol (96-100%) à l'échantillon et mélanger à nouveau par vortex-impulsion pendant 15 s. Après le mélange, centrifuger brièvement le tube de 1,5 ml pour enlever les gouttes de l'intérieur du couvercle.
- Appliquer soigneusement le mélange de l'étape 1.6 à la colonne de membrane (dans un tube de collecte de 2 mL). Sans mouiller la jante, fermez le bouchon et centrifugez à 6000 xg pendant 1 min. Placez la colonne de membrane dans un tube de collecte propre de 2 ml et jeter le tube contenant le filtrat.
- Ouvrez soigneusement la colonne de membrane et ajoutez 500 μL de tampon de lavage 1 sans mouiller la jante. Fermez le capuchon et centrifuger à 6 000 xg pendant 1 min. Placez la colonne de membrane dans un tube de collecte propre de 2 ml et jeter le tube contenant le filtrat.
- Ouvrir soigneusement la colonne de membrane et ajouter 500 μL de tampon de lavage 2 sans mouillerE rim. Fermez le capuchon et centrifugez à pleine vitesse (20 000 xg) pendant 3 min.
- Placez la colonne de membrane dans un nouveau tube de collecte de 2 ml et jeter le tube de collecte avec le filtrat. Centrifuger à 20 000 xg pendant 1 min.
- Placez la colonne de membrane dans un tube propre de 1,5 ml et jeter le tube de collecte contenant le filtrat.
- Ouvrez soigneusement la colonne de membrane et ajoutez 200 μl d'eau distillée. Incuber à température ambiante pendant 5 min, puis centrifuger à 6000 xg pendant 1 min.
- Passez à la détermination de l'étape de concentration d'ADN ou congéluez les échantillons d'ADN à -20 ° C
2. Détermination de la concentration d'ADN
REMARQUE: voir la figure 4 .
- Appuyez sur 1 pour sélectionner le mode ADN sur un spectrophotomètre. Sélectionnez une longueur de chemin de 5 mm en utilisant les flèches gauche et droite. Sélectionnez un facteur de dilution de 1 en utilisant les flèches gauche et droite.
- Sélectionnez l'unité (μg / mL) en utilisantE flèches gauche et droite. Sélectionnez un facteur de 50 en utilisant les flèches gauche et droite. Appuyez sur OK .
- Pipeter 10 μL d'eau distillée dans la cuvette. Mettez la cuvette dans le spectrophotomètre. Appuyez sur le bouton OA / 100% T.
- Pipeter 10 μL de l'échantillon d'ADN (dilution 1/4 dans de l'eau distillée) dans la cuvette. Mettez la cuvette dans le spectrophotomètre. Appuyez sur le bouton vert (lecture / démarrage). Notez la concentration.
- Geler l'échantillon d'ADN à -20 ° C.
3. Protocole HRM-PCR
- Décongeler les échantillons d'ADN. Diluer les échantillons d'ADN dans des tubes de 1,5 mL avec de l'eau pour les ajuster à une concentration de 10 ng / μL
NOTE: Le volume total d'ADN dilué doit être compris entre 2 μL et 10 μL. - Décongeler les solutions d'apprêt. Diluer les solutions d'amorces dans des tubes de 1,5 mL avec de l'eau pour les ajuster à la même concentration de 6 μM.
NOTE: Les séquences d'amorces et les conditions de réaction sont fournies dans TCapable 1.

Tableau 1: Primaires et paramètres utilisés dans l'analyse de fusion à haute résolution.
- Décongeler les solutions du kit HRM-PCR et mélanger soigneusement par vortex pour assurer la récupération de tous les contenus. Centrifuger brièvement les trois flacons contenant le mélange enzymatique avec un colorant de liaison d' ADN, MgCl 2, et de l' eau dans une microcentrifugeuse avant de les ouvrir. Rangez-les à température ambiante.
- Dans un tube de 1,5 ml à température ambiante, préparer le mélange PCR pour une réaction de 20 μL en ajoutant les composants suivants dans l'ordre indiqué ci-dessous:
- 10 μL de mélange enzymatique avec colorant de liaison à l'ADN;
- 2 ul de 25 mM MgCl 2;
- 1 μl d'amorce 1, 6 μM (concentration finale: 300 nM);
- 1 μl d'amorce 2, 6 μM (concentration finale: 300NM); et
- 5 μL d'eau.
REMARQUE: Pour préparer le mélange PCR pour plus d'une réaction, multipliez les volumes ci-dessus par le nombre de réactions à exécuter, plus une réaction supplémentaire.
- Mélanger soigneusement par vortex.
- Pipeter 19 μL de mélange PCR, préparé ci-dessus, dans chaque puits d'une plaque multi-puits blanche.
- Ajouter 1 μL de gabarit d'ADN ajusté en fonction de la concentration, préparé à l'étape 3.1.
REMARQUE: pour les réactions de contrôle, exécutez toujours un contrôle négatif avec les échantillons. Pour préparer un contrôle négatif, remplacez l'ADN modèle par de l'eau. - Sceller la plaque multi-puits blanche avec du film d'étanchéité.
- Placez la plaque multi-puits blanche dans la centrifugeuse et équilibrez-la avec un contrepoids approprié ( c.-à-d. Une autre plaque à puits multiples). Centrifuger pendant 1 min à 1.500 xg dans une centrifugeuse standard à godets oscillants contenant un rotor pour plaques multi-puits avec des adaptateurs appropriés.
- Chargez la plaque multi-puits blanche dans l'instrument HRM-PCR.
- Démarrez le programme HRM-PCR avec les conditions de PCR suivantes:
Dénaturation: 95 ° C pendant 10 min; 1 cycle.
Amplification: 95 ° C pendant 10 s, 62 ° C pendant 15s et 72 ° C pendant 20s; 47 cycles.
Courbe de fusion: 95 ° C; Taux de rampe: 0,02 ° C / s; 25 acquisitions par ° C; 1 cycle.
Refroidissement: 40 ° C pendant 30 s; Taux de rampe 2,2 ° C / s; 1 cycle.
4. Analyse HRM pour déterminer le polymorphisme de la longueur CR1
REMARQUE: la méthodologie décrite ( figure 5 ) est spécifique à notre logiciel (voir la table des matières ), même si d'autres logiciels peuvent être utilisés.
- Ouvrez un logiciel de balayage génétique pour effectuer l'analyse de la recherche de polymorphisme à longueur CR1.
- Ouvrez l'expérience contenant le programme d'amplification et le programme de courbe de fusion.
- Cliquez sur Éditeur d'exemple dans la barre de module , puis sélectionnez SFlux de travail de mise en conserve .
- Définissez les propriétés des échantillons ( c.-à-d. Nom, contrôle inconnu ou négatif).
- Cliquez sur Analyse dans la barre du module .
- Dans la liste Créer une nouvelle analyse , sélectionnez Analyse génétique.
- Cliquez sur l'onglet Normalization pour normaliser les courbes de fusion.
- Cliquez sur l'onglet de changement de température pour réinitialiser l'axe de la température (axe des x) des courbes de fusion.
REMARQUE: Le graphique inférieur montre les courbes de fusion à la fois normalisées et décalées par la température. - Cliquez sur le bouton Calculer pour analyser les résultats et déterminer le regroupement.
- Cliquez sur l'onglet Différentiel dans la zone des graphiques pour afficher les courbes de fusion normalisées et décalées et le parcours de différence normalisé et modifié en température .
Résultats
La figure 6 A montre le phénotypage du polymorphisme de longueur CR1 par WB. La figure 6 B et C affiche les courbes qui sont obtenues lors de l'analyse HRM-PCR, ce qui permet de déterminer le polymorphisme de longueur CR1. L'analyse des courbes de fusion à l'aide du logiciel après la fusion à haute résolution des amplicons dérivés de la PCR de l'ADN génomique de sujets avec différentes isoformes CR1 produit des courbes qui discriminaient les sujets en fonction de leurs phénotypes allotypiques d'expression CR1.
La figure 6 B affiche un premier mode de présentation, appelé «Courbes de fusion normalisées et décalées», tandis que la figure 6 C affiche un deuxième mode de présentation, appelé «parcelle de différence normalisée et temporisée».
Les profils des courbes sont répartis selon les groupes qui représentent les phénotypes affichés à la Figure 6 A : (CR1 * 3, CR1 * 1); (CR1 * 1, CR1 * 2); CR1 * 1; CR1 * 2; Et (CR1 * 2, CR1 * 4). Cela permet le génotypage du polymorphisme de longueur CR1 en utilisant cette nouvelle méthode de biologie moléculaire.

Figure 1: Représentation schématique de la structure et polymorphismes de la protéine du récepteur 1 du complément. Chaque répétition de consensus (SCR) ou protéine de contrôle du complément (CCP) est représentée par un cercle. Les SCR sont regroupés dans des structures répétitives et d'ordre supérieur appelées LHR. Du domaine extracellulaire à la membrane cellulaire, les LHR sont: LHR-A, -B, -C, -D et -S (LHR supplémentaire ou supplémentaire). Dans l'isoforme CR1 la plus commune(CR1 * 1), le site de liaison de l'activité d'accélération C4b / décomposition (DAA) est situé à LHR-A (SCRs 1-3, cercles verts), le site de liaison C3b / C4b / cofactor (CA) se trouve dans le 3 Les SCR N-terminaux de LHR-B (SCR 8-10, cercles rouges) et LHR-C (SCR 15-17, cercles violets) et le site de liaison pour C1q / MBL et ficolin se trouvent dans le LHR-D (SCRs 22-28, cercles bleus). Les structures homologues sont colorées de manière identique. L'isoforme CR1 * 2 (S) présente un LHR supplémentaire (LHR-S) et contient donc un site de liaison supplémentaire C3b / C4b. KDa, kilodalton. NRC, conditions non réduites. RC, conditions réduites. TM, domaine transmembranaire. Ce chiffre a été adapté de Brouwers et al. 36 avec la permission de Nature Publishing Group. Cliquez ici pour voir une version plus grande de ce chiffre.
"/files/ftp_upload/56012/56012fig2.jpg" />
Figure 2 : Représentation schématique de la structure de l'isoforme CR1 avec des positions d'amplicon séquentielles obtenues par HRM-PCR. Chaque case représente un SCR. Les SCR sont regroupés en LHR: LHR-A, -B, -C et -D. Les structures homologues sont colorées de manière identique. Les isoformes CR1 * 2 et CR1 * 4 présentent des LHR supplémentaires (LHR-B) et contiennent donc une zone d'amplicon supplémentaire (amplicon B, en rouge). CR1 * 3 manque de LHR-B et contient moins d'amplicon (manque d'amplicon B). Les différences de nucléotides entre l'amplicon B (196 pb) et l'amplicon invariant (197 pb) sont représentées respectivement en rouge et en bleu. Les différences dans le rapport: (l'amplicon B, dans l'amplicon rouge / invariant, en bleu) entre chaque isoforme CR1 sont déterminés par HRM-PCR, permettant le génotypage. Les séquences d'amorces CN3 et CN3re sont soulignées. TM, domaine transmembranaire. CYT, queue cytoplasmique.Pg "target =" _ blank "> Cliquez ici pour voir une version plus grande de ce chiffre.
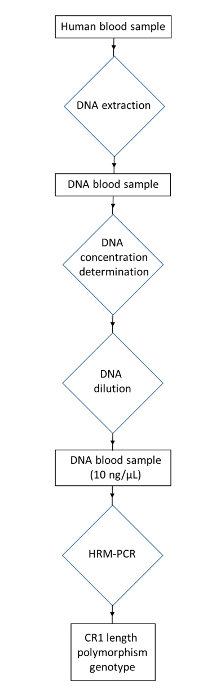
Figure 3: Organigramme du protocole pour le génotypage du polymorphisme de longueur CR1 à partir d'échantillons de sang humains. Recueillir un échantillon d'ADN humain. Extraire l'ADN pour obtenir un échantillon de sang d'ADN. Déterminer la concentration d'ADN et diluer pour obtenir la concentration d'ADN à 10 ng / μL. Utilisez HRM-PCR pour obtenir le génotype de polymorphisme de longueur CR1. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4 : Captures d'écran du spectrophotomètre nous Pour déterminer la concentration d'ADN. Appuyez sur 1 ( A ) pour sélectionner le mode ADN sur le spectrophotomètre. Sélectionnez une longueur de trajet de 5 mm ( B ) à l'aide des flèches gauche et droite ( C ). Sélectionnez l'unité (μg / mL) ( D ) en utilisant les flèches gauche et droite ( C ). Sélectionnez le facteur de dilution 1 ( E ) en utilisant les flèches gauche et droite ( C ). Sélectionnez un facteur de 50 ( F ) à l'aide des flèches gauche et droite. Appuyez sur OK ( G ). Pipeter 10 μL d'eau distillée dans la cuvette. Mettez la cuvette dans le spectrophotomètre ( H ). Appuyez sur le bouton OA / 100% T ( I ). Pipeter 10 μL d'échantillon d'ADN (dilution 1/4 dans de l'eau distillée) dans la cuvette. Mettez la cuvette dans le spectrophotomètre ( K ). Appuyez sur le bouton vert (lecture / démarrage) ( L ). Notez la concentration ( M ).Es / ftp_upload / 56012 / 56012fig4large.jpg "target =" _ blank "> Cliquez ici pour voir une version plus grande de cette figure.

Figure 5: Captures d'écran de l'interface graphique du logiciel utilisé à l'étape 4 du protocole. ( A ) Ouvrez le logiciel de recherche de gènes. ( B ) Programme d'amplification et programme de courbe de fusion. ( C ) Cliquez sur Éditeur d'échantillons dans la barre du module . ( D ) Sélectionnez Numérisation . ( E ) Définir les propriétés des échantillons. ( F ) Cliquez sur Analyse dans la barre du module . ( G ) Cliquez sur l'onglet Normalization pour normaliser les courbes de fusion. ( H ) Cliquez sur l'onglet de changement de température pour afficher les courbes de fusion qui sont à la foisNormalisé et décalé par la température. ( I ) Cliquez sur le bouton Calculer pour analyser les résultats et déterminer le regroupement. ( J ) Cliquez sur l'onglet Différentiel pour visualiser les courbes de fusion normalisées et décalées et le diagramme de différence normalisé et modifié en température . ( K ) Groupement coloré des échantillons selon les génotypes de longueur CR1. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 6: Phénotypage des polymorphismes de longueur CR1 observés dans la WB et leurs courbes de profil correspondantes obtenues par HRM-PCR. ( A ) Phénotypage des polymorphismes de longueur CR1 utilisant WB. ( B ) et ( C ) Génotypage de polymorphismes à longueur CR1 en utilisant une analyse HRM-PCR. L'analyse de la courbe HRM des amplicons de PCR obtenus à partir de l'ADN génomique de sujets présentant différentes isoformes CR1 a conduit à l'identification de profils de courbes spécifiques: (CR1 * 3, CR1 * 1) (pourpre); (CR1 * 1, CR1 * 2) (bleu); CR1 * 1 (vert); CR1 * 2 (rouge); Et (CR1 * 2, CR1 * 4) (gris). Ceux-ci correspondent aux allèles de polymorphisme à longueur CR1. Comme le montrent les deux modes de présentation: "Courbes de fusion normalisées et décalées" (B) et "Tracé de différence normalisé et temporisé" (C) - les profils de courbe sont répartis selon CR1 * 3, CR1 * 1) ; (CR1 * 1, CR1 * 2); CR1 * 1; CR1 * 2; Et (CR1 * 2, CR1 * 4). Ce chiffre a été adapté de Mahmoudi et al. 38 avec l'autorisation d'Elsevier. Cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Ici, nous décrivons une méthodologie largement accessible pour étudier les polymorphismes de longueur CR1. Les techniques de biologie moléculaire pour l'amplification ou l'hybridation segmentaire n'ont jamais été en mesure de donner des résultats satisfaisants permettant la détermination de polymorphismes de longueur CR1 chez tous les individus. Ceci est dû à la structure répétitive du gène CR1 ( c.-à-d. Les SCR hautement répétitifs de CR1). La méthode de biologie moléculaire décrite ici exploite la distribution quantitative de LHR-B dans la molécule CR1. La molécule CR1 comprend n domaines LHR-B, où n est un nombre compris entre 0 et 3, et un seul domaine LHR-C, comme décrit et illustré à la figure 2 . La détection quantitative de domaine B permet de discriminer parfaitement un domaine B ou autre.
Du matériel génétique extrait, un premier fragment d'ADN de LHR-B est amplifié par PCR en utilisant une seule paire d'amorces spécifiques, représentantUne variante caractéristique de LHR-B appelée "variante amplicon B." Un deuxième fragment d'ADN, appelé "amplicon invariant" et appartenant à LHR-C, est également amplifié. Ce second fragment d'ADN est un fragment de LHR-C, mais un autre fragment invariant de LHR-A ou -D pourrait également être utilisé.
Les deux fragments d'ADN, le variant de l'amplicon B et l'amplicon invariant sont amplifiés par les mêmes amorces et présentent cinq différences dans les séquences nucléotidiques. Cette caractéristique permet dans l'étape suivante de déterminer le nombre de variantes d'amplicon B et le nombre d'amplicons invariables en utilisant un outil de biologie moléculaire quantitative, HRM, qui a été adapté à cet effet. Le rapport entre le nombre d'amplicon B et l'amplicon invariant (rapport: amplicon B / amplicon invariant) varie en fonction de la longueur de la molécule CR1. En effet, CR1 * 4 affiche 3 unités B d'amplicon à 1 amplicon invariant, CR1 * 2 affiche 2 unités B d'amplicon à 1 amplicon invariant, CR1 * 1 affiche 1 amplicon B à 1 amplicon invariant et CR1 * 3 affiche 0 unités amplicon B à 1 amplicon invariant ( Figure 2 ). Ainsi, cette méthode HRM-PCR permet le génotypage du polymorphisme de longueur CR1.
Néanmoins, au début de l'étude, cette technique nécessite l'utilisation de sujets de référence dont les phénotypes CR1 sont déjà connus ( c.-à-d. Préalablement établis par WB) afin de pouvoir établir le génotypage de CR1 selon le profil de référence des courbes obtenues Par HRM-PCR. Deux types de représentation, à savoir "Courbes de fusion normalisées et décalées" et "Tracé de différence normalisé et temporisé", sont disponibles. Ils présentent des groupes distincts de profils de courbes colorés selon le phénotypage du polymorphisme de longueur CR1 obtenu par WB ( Figure 6 ). À partir de l'étape "Courbes de fusion normalisées et décalées", notre méthode permet de discriminerE groupes distincts de courbes correspondant aux isoformes de CR1, groupées par couleur. Cependant, le «Plot de différence temporel et différencié temporairement», qui correspond à une représentation mathématique différente, permet une visualisation plus simple des différents groupes de courbes. Bien que le logiciel du fabricant ait été utilisé habituellement dans cette étude, d'autres logiciels (tels que uANALYSE) pourraient être utilisés comme programme d'extraction de données pour l'analyse des courbes.
À ce jour, la technique d'analyse WB est la technique originale qui permet d'identifier les différents polymorphismes de longueur CR1 au niveau de la protéine. Cependant, cette technique présente un certain nombre d'inconvénients. En particulier, l'analyse des protéines par WB ne peut être effectuée qu'après l'extraction des membranes cellulaires. En conséquence, il est complexe et prend beaucoup de temps. En outre, cette technique nécessite l'obtention d'un échantillon de sang frais dans des conditions appropriées au début de la procédure pour obtenir des réponses utilesUlts. Au contraire, la HRM-PCR réalisée sur l'ADN permet d'utiliser même des taches de sang sec ou des échantillons après un stockage à long terme. HMR-PCR nécessite un instrument spécialisé en fusion d'ADN, soit un instrument dédié, soit un thermocycleur à capacité HMR avec un logiciel HRM. La détection de SNP dépend de plusieurs facteurs: i) Les SNP inclus dans les grands fragments de PCR sont plus difficiles à détecter que les mêmes SNP dans les petits fragments de PCR; Ii) Les SNP appartenant aux classes III et IV sont plus difficiles à détecter que ceux des classes I et II 34 ; Et iii) les SNP qui sont flanqués par la symétrie de base de voisinage le plus proche ( par exemple, 5'-G (G / C) C-3 ') ne peuvent pas être triés par fusion, quelle que soit la puissance de résolution de la plate-forme HMR. Il peut être utile de tester les fragments de PCR prévus contenant le SNP d'intérêt avec le logiciel uMELT 35 pour évaluer la validité de l'analyse. Enfin, HMR-PCR est une méthode analogique, ce qui signifie que la similitude des courbes de fusion parieUne référence et un modèle n'impliquent pas nécessairement que la séquence du modèle soit identique à la référence, car la séquence du modèle peut être différente de la référence mais équivalente thermodynamiquement. Cependant, ces limitations ne s'appliquent pas à la méthode décrite ici, qui est basée sur la fusion d'un mélange d'amplicons qui diffèrent en termes de 5 séquences nucléotidiques.
En outre, la technique décrite ici, basée sur l'analyse de HRM, présente de nombreux avantages. Tout d'abord, les polymorphismes de longueur CR1 sont déterminés plus rapidement, puisque les résultats sont obtenus en environ 2 h une fois que l'extraction du matériel génétique a été réalisée. À l'inverse, les techniques biochimiques traditionnelles basées sur l'analyse de la protéine WB nécessitent des étapes relativement longues: l'électrophorèse des extraits de membrane cellulaire à travers un gel d'acrylamide, une étape pour transférer les protéines à une membrane de nitrocellulose ou de fluorure de polyvinylidène (PVDF) et une étape pour identifier les Isoformes de laMolécule CR1 par immunochemiluminescence. Deuxièmement, la technique HRM-PCR a également l'avantage de ne pas être trop coûteuse, ce qui est particulièrement important pour une méthode susceptible d'être appliquée à de nombreux individus ( c'est-à-dire à grande échelle) pour déterminer leur susceptibilité au développement de pathologies telles que la maladie d'Alzheimer, Le lupus ou le paludisme.
Récemment, nous et d'autres ont montré que l'isoforme CR1 * 2, qui contient un site de liaison C3b / C4b supplémentaire, était associée à la norme AD 36 , 37 , 38 . Dans notre étude publiée précédemment, les polymorphismes de longueur CR1 au niveau du gène et de la protéine étaient cohérents dans 98,9% des sujets 38 . Les résultats discordants obtenus lors de la comparaison des polymorphismes de longueur obtenus par HRM-PCR avec ceux obtenus par WB correspondaient à des sujets ayant un profil de génotype (CR1 * 1, CR1 * 2) déterminé par HRM (gene) mais exEn appuyant uniquement sur l'isoforme CR1 * 1 à la surface de l'érythrocyte selon WB (protéine). Dans notre étude, le manque d'expression de l'isoforme CR1 * 2 (individus portant un allèle silencieux) était reproductible lorsque la WB a été réalisée avec un temps d'exposition plus long et s'explique par l'existence d'un allèle CR1 silencieux (CR1 * 2), décrit Dans la littérature par Helgeson 39 . Néanmoins, d'autres études sur les populations plus importantes sont nécessaires pour étayer cette hypothèse.
Il convient de noter que les SNP privés (SNPs qui se produisent uniquement dans un petit groupe familial ou même dans un seul individu) ont conduit à des profils de courbes distincts qui doivent être déchiffrés en utilisant la détermination de phénotype de référence (WB) mais qui ne peuvent pas être confondus avec le profil canonique pour éviter Toute interprétation erronée du génotype de polymorphisme à longueur CR1.
Déclarations de divulgation
Les auteurs sont les inventeurs d'un brevet appartenant à l'Université de Reims Champagne-Ardenne (URCA) (brevet WO 2015166194)
Remerciements
Nous remercions tous les membres de la Plateforme Régionale de Biologie Innovante, le personnel du Département d'Immunologie et le personnel du Département de médecine interne et de gériatrie, qui ont contribué à l'optimisation et à la validation du protocole. Ce travail a été financé par les hôpitaux universitaires de Reims (numéro de subvention AOL11UF9156). Nous remercions également Fiona Ecarnot (EA3920, Hôpital universitaire de Besançon, France) pour une assistance éditoriale.
matériels
| Name | Company | Catalog Number | Comments |
| Lab coat | protection | ||
| SensiCareIce powder-free Nitrile Exam gloves | Medline Industries, Inc, Mundelein, IL 60060, USA | 486802 | sample protection |
| Eppendorf Reference 2 pipette, 0,5-10µL | Eppendorf France SAS, F-78360 Montesson, France | 4920000024 | sample pipetting |
| Eppendorf Reference 2 pipette, 20-100µL | Eppendorf France SAS, F-78360 Montesson, France | 4920000059 | sample pipetting |
| Eppendorf Reference 2 pipette, 100-1000µL | Eppendorf France SAS, F-78360 Montesson, France | 4920000083 | sample pipetting |
| TipOne 10µL Graduated, filter tip | Starlab GmbH, D-22926 Ahrenburg, Germany | S1121-3810 | sample pipetting |
| TipOne 1-100µL bevelled, filter tip | Starlab GmbH, D-22926 Ahrenburg, Germany | S1120-1840 | sample pipetting |
| ART 1000E Barrier Tip | Thermo Fischer Scientific , F-67403 Illkirch, France | 2079E | sample pipetting |
| Eppendorf Safe-Lock Tubes, 1.5 mL, Eppendorf Quality | Eppendorf France SAS, F-78360 Montesson, France | 0030120086 | mix |
| Vortex-Genie 2 | Scientific Industries, Inc, Bohemia, NY 111716, USA | SI-0236 | mix |
| QIAamp DNA Mini Kit (250) | Qiagen SA, F-91974 Courtaboeuf, France | 51306 | DNA Extraction |
| Buffer AL | Qiagen SA, F-91974 Courtaboeuf, France | 19075 | Lysis buffer |
| QIAamp Mini Spin Column | Qiagen SA, F-91974 Courtaboeuf, France | 1011706 | DNA binding |
| Buffer AW1 | Qiagen SA, F-91974 Courtaboeuf, France | 19081 | Wash buffer |
| Buffer AW2 | Qiagen SA, F-91974 Courtaboeuf, France | 19072 | Wash buffer |
| Biowave DNA spectrophotometer | Biochrom Ltd, Cambridge CB4 OFJ, England | 80-3004-70 | DNA concentration |
| Mikro 200 centrifuge | Hettich Zentrifugen, D-78532, Germany | 0002020-02-00 | centrifugation |
| Multipette E3 | Eppendorf France SAS, F-78360 Montesson, France | 4987000010 | distribution |
| Light Cycler 480 multiwell plate 96, white | Roche Diagnostics GmbH, D-68305 Mannheim, Germany | 04729692001 | reaction place |
| Light Cycler 480 sealing foil | Roche Diagnostics GmbH, D-68305 Mannheim, Germany | 04429757001 | coverage |
| Heraeus Megafuge 11R centrifuge | Thermo Fischer Scientific , F-67403 Illkirch, France | 75004412 | centrifugation |
| LightCycler 480 Instrument II, 96-well | Roche Diagnostics GmbH, D-68305 Mannheim, Germany | 05015278001 | high resolution melting polymerase chain reaction |
| LightCycler 480 High Resolution Melting Master | Roche Diagnostics GmbH, D-68305 Mannheim, Germany | 04909631001 | reaction reagents |
| light cycler 480 SW 1.5.1 software | Roche Diagnostics GmbH, D-68305 Mannheim, Germany | software used for HRM PCR CR1 polymorphism data analysis | |
| CN3 primer: 5'ggccttagacttctcctgc 3' | Eurogentec Biologics Division, B- 4102 Seraing, Belgium | reaction reagent | |
| CN3re primer: 5'gttgacaaattggcggcttcg 3' | Eurogentec Biologics Division, B- 4102 Seraing, Belgium | reaction reagent |
Références
- Prince, M., et al. World Alzheimer Report 2015, The Global Impact of Dementia: An analysis of prevalence, incidence, cost and trends. Alzheimer's Disease International. , (2015).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7 (3), 263-269 (2011).
- Serrano-Pozo, A., Frosch, M. P., Masliah, E., Hyman, B. T. Neuropathological alterations in Alzheimer disease. Cold Spring Harb Perspect Med. 1 (1), 006189 (2011).
- Goate, A., et al. Segregation of a missense mutation in the amyloid precursor protein gene with familial Alzheimer's disease. Nature. 349 (6311), 704-706 (1991).
- Sherrington, R., et al. Cloning of a gene bearing missense mutations in early-onset familial Alzheimer's disease. Nature. 375 (6534), 754-760 (1995).
- Levy-Lahad, E., et al. A familial Alzheimer's disease locus on chromosome 1. Science. 269 (5226), 970-973 (1995).
- Mayeux, R., Stern, Y. Epidemiology of Alzheimer disease. Cold Spring Harb Perspect Med. 2 (8), (2012).
- Corder, E. H., et al. Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer's disease in late onset families. Science. 261 (5123), 921-923 (1993).
- Yu, J. T., Tan, L., Hardy, J. Apolipoprotein E in Alzheimer's disease: an update. Annu Rev Neurosci. 37, 79-100 (2014).
- Lambert, J. C., et al. Genome-wide association study identifies variants at CLU and CR1 associated with Alzheimer's disease. Nat Genet. 41 (10), 1094-1099 (2009).
- Liu, D., Niu, Z. X. The structure, genetic polymorphisms, expression and biological functions of complement receptor type 1 (CR1/CD35). Immunopharmacol Immunotoxicol. 31 (4), 524-535 (2009).
- Jacquet, M., et al. Deciphering complement receptor type 1 interactions with recognition proteins of the lectin complement pathway. J Immunol. 190 (7), 3721-3731 (2013).
- Pham, B. N., et al. Analysis of complement receptor type 1 expression on red blood cells in negative phenotypes of the Knops blood group system, according to CR1 gene allotype polymorphisms. Transfusion. 50 (7), 1435-1443 (2010).
- Cosio, F. G., Shen, X. P., Birmingham, D. J., Van Aman, M., Hebert, L. A. Evaluation of the mechanisms responsible for the reduction in erythrocyte complement receptors when immune complexes form in vivo in primates. J Immunol. 145 (12), 4198-4206 (1990).
- Krych-Goldberg, M., Moulds, J. M., Atkinson, J. P. Human complement receptor type 1 (CR1) binds to a major malarial adhesin. Trends Mol Med. 8 (11), 531-537 (2002).
- Cohen, J. H., Geffriaud, C., Caudwell, V., Kazatchkine, M. D. Genetic analysis of CR1 (the C3b complement receptor, CD35) expression on erythrocytes of HIV-infected individuals. Aids. 3 (6), 397-399 (1989).
- Rogers, J., et al. Complement activation by beta-amyloid in Alzheimer disease. Proc Natl Acad Sci USA. 89 (21), 10016-10020 (1992).
- Rogers, J., et al. Peripheral clearance of amyloid beta peptide by complement C3-dependent adherence to erythrocytes. Neurobiol Aging. 27 (12), 1733-1739 (2006).
- Krych-Goldberg, M., Atkinson, J. P. Structure-function relationships of complement receptor type 1. Immunol Rev. 180, 112-122 (2001).
- Klickstein, L. B., et al. Human C3b/C4b receptor (CR1). Demonstration of long homologous repeating domains that are composed of the short consensus repeats characteristics of C3/C4 binding proteins. J Exp Med. 165 (4), 1095-1112 (1987).
- Hourcade, D., Miesner, D. R., Atkinson, J. P., Holers, V. M. Identification of an alternative polyadenylation site in the human C3b/C4b receptor (complement receptor type 1) transcriptional unit and prediction of a secreted form of complement receptor type 1. J Exp Med. 168 (4), 1255-1270 (1988).
- Krych, M., Hourcade, D., Atkinson, J. P. Sites within the complement C3b/C4b receptor important for the specificity of ligand binding. Proc Natl Acad Sci USA. 88 (10), 4353-4357 (1991).
- Krych-Goldberg, M., et al. Decay accelerating activity of complement receptor type 1 (CD35). Two active sites are required for dissociating C5 convertases. J Biol Chem. 274 (44), 31160-31168 (1999).
- Klickstein, L. B., Barbashov, S. F., Liu, T., Jack, R. M., Nicholson-Weller, A. Complement receptor type 1 (CR1, CD35) is a receptor for C1q. Immunity. 7 (3), 345-355 (1997).
- Ghiran, I., et al. Complement receptor 1/CD35 is a receptor for mannan-binding lectin. J Exp Med. 192 (12), 1797-1808 (2000).
- Cornillet, P., Philbert, F., Kazatchkine, M. D., Cohen, J. H. Genomic determination of the CR1 (CD35) density polymorphism on erythrocytes using polymerase chain reaction amplification and HindIII restriction enzyme digestion. J Immunol Methods. 136 (2), 193-197 (1991).
- Moulds, J. M., Nickells, M. W., Moulds, J. J., Brown, M. C., Atkinson, J. P. The C3b/C4b receptor is recognized by the Knops, McCoy, Swain-langley, and York blood group antisera. J Exp Med. 173 (5), 1159-1163 (1991).
- Moulds, J. M., Moulds, J. J., Brown, M., Atkinson, J. P. Antiglobulin testing for CR1-related (Knops/McCoy/Swain-Langley/York) blood group antigens: negative and weak reactions are caused by variable expression of CR1. Vox Sang. 62 (4), 230-235 (1992).
- Wilson, J. G., et al. Identification of a restriction fragment length polymorphism by a CR1 cDNA that correlates with the number of CR1 on erythrocytes. J Exp Med. 164 (1), 50-59 (1986).
- Wong, W. W., et al. Structure of the human CR1 gene. Molecular basis of the structural and quantitative polymorphisms and identification of a new CR1-like allele. J Exp Med. 169 (3), 847-863 (1989).
- Herrera, A. H., Xiang, L., Martin, S. G., Lewis, J., Wilson, J. G. Analysis of complement receptor type 1 (CR1) expression on erythrocytes and of CR1 allelic markers in Caucasian and African American populations. Clin Immunol Immunopathol. 87 (2), 176-183 (1998).
- Rowe, J. A., et al. Erythrocyte CR1 expression level does not correlate with a HindIII restriction fragment length polymorphism in Africans; implications for studies on malaria susceptibility. Genes Immun. 3 (8), 497-500 (2002).
- Birmingham, D. J., et al. A polymorphism in the type one complement receptor (CR1) involves an additional cysteine within the C3b/C4b binding domain that inhibits ligand binding. Mol Immunol. 44 (14), 3510-3516 (2007).
- Venter, J. C., et al. The sequence of the human genome. Science. 291 (5507), 1304-1351 (2001).
- Dwight, Z., Palais, R., Wittwer, C. T. uMELT: prediction of high-resolution melting curves and dynamic melting profiles of PCR products in a rich web application. Bioinformatics. 27 (7), 1019-1020 (2011).
- Brouwers, N., et al. Alzheimer risk associated with a copy number variation in the complement receptor 1 increasing C3b/C4b binding sites. Mol Psychiatry. 17 (2), 223-233 (2012).
- Hazrati, L. N., et al. Genetic association of CR1 with Alzheimer's disease: a tentative disease mechanism. Neurobiol Aging. 33 (12), 2945-2949 (2012).
- Mahmoudi, R., et al. Alzheimer's disease is associated with low density of the long CR1 isoform. Neurobiol. Aging. 36, 1712-1765 (2015).
- Helgeson, M., Swanson, J., Polesky, H. F. Knops-Helgeson (Kna), a high-frequency erythrocyte antigen. Transfusion. 10 (3), 137-138 (1970).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon