Method Article
High Throughput Mesure de l'ADN extracellulaire de sortie et quantitative Formation NET dans les neutrophiles humains
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
High throughput assays are presented that in combination provide excellent tools to quantitate NET release from human neutrophils.
Résumé
Neutrophil granulocytes are the most abundant leukocytes in the human blood. Neutrophils are the first to arrive at the site of infection. Neutrophils developed several antimicrobial mechanisms including phagocytosis, degranulation and formation of neutrophil extracellular traps (NETs). NETs consist of a DNA scaffold decorated with histones and several granule markers including myeloperoxidase (MPO) and human neutrophil elastase (HNE). NET release is an active process involving characteristic morphological changes of neutrophils leading to expulsion of their DNA into the extracellular space. NETs are essential to fight microbes, but uncontrolled release of NETs has been associated with several disorders. To learn more about the clinical relevance and the mechanism of NET formation, there is a need to have reliable tools capable of NET quantitation.
Here three methods are presented that can assess NET release from human neutrophils in vitro. The first one is a high throughput assay to measure extracellular DNA release from human neutrophils using a membrane impermeable DNA-binding dye. In addition, two other methods are described capable of quantitating NET formation by measuring levels of NET-specific MPO-DNA and HNE-DNA complexes. These microplate-based methods in combination provide great tools to efficiently study the mechanism and regulation of NET formation of human neutrophils.
Introduction
NET formation is a novel mechanism by which neutrophils fight pathogens.1 The core of NETs is nuclear DNA.1 This DNA network is associated with neutrophil granule proteins and histones.1 The main form of NET formation requires the death of neutrophils characterized by chromatin decondensation, disappearance of granular and nuclear membranes, translocation of neutrophils elastase to the nucleus, citrullination of histones and finally the spill of DNA-based NETs.2 NETs entrap and kill a wide variety of microbes and are an essential part of the innate immune weapon repertoire. Uncontrolled NET formation has, however, been linked to numerous autoinflammatory diseases.3,4 Despite their increasingly established relevance, little is known about the mechanism and regulation of NET release.
Neutrophils dying by releasing NETs are different from apoptotic or necrotic neutrophils.3,5 NET-releasing neutrophils show several features that are characteristic for NET formation. Granule components are associated with DNA in NETs.1 Myeloperoxidase (MPO) and human neutrophil elastase (HNE) are both found in primary granules in resting cells but are translocated to the nucleus to bind to DNA in NETs.1 MPO-DNA and HNE-DNA complexes are specific for NETs, do not occur in apoptotic or necrotic neutrophils.1,3,5 Chromatin decondensation is another feature typical for NETosis.2 NET release also requires citrullination of histones by peptidyl aminidase 4 (PAD4).6 Citrullinated histones are hallmarks of neutrophils that underwent NET release.6
Here three methods are introduced that in combination provide excellent tools to quantitate NETs on a high-throughput scale. The first assay has been used on the field with different changes and quantitates extracellular DNA release in a microplate format. The second and third assays provide confirmation of NETs by measuring NET-specific MPO-DNA and HNE-DNA complexes.
Protocole
Le Conseil de l'Université de Géorgie Institutional Review a approuvé l'étude sur des sujets humains pour recueillir le sang périphérique de volontaires sains (UGA N ° 2012-10769-06). 5,7,8 bénévoles ont signé le formulaire de consentement éclairé nécessaire avant le prélèvement de sang. La recherche effectuée dans cet article est en conformité avec les directives éthiques pour la recherche médicale impliquant des sujets humains de la Déclaration d'Helsinki.
1. Isolement des cellules neutrophiles du sang périphérique humain (Figure 1)
Remarque: Il existe plusieurs façons d'isoler les neutrophiles du sang périphérique. Le protocole suivant fournit une possibilité. Ce protocole donne un grand nombre de neutrophiles non activés humains capables de libérer les TNE lors d'une stimulation externe. Utilisez 40 ml de sang total obtenu à partir de volontaires sains par ponction veineuse. 7,9
- Aliquoter 20 ml de sang en deux 50 ml tubes coniques. Ajouter 10 ml de 6% de dextran. Mélanger délicatement.
- Après 20 min de transfert leucocyte-rich phase supérieure sans prendre de globules rouges sédimentées dans 50 ml propres tubes coniques, et le remplir avec du PBS stérile.
- Centrifugeuse à 400 g 10 min. Resuspendre le culot dans 4 ml de PBS stérile.
- Préparer une 5 étape de gradient de Percoll 85% -80% -75% -70% -65% dans deux tubes de 15 ml coniques et la couche leucocytaire 2 ml de suspension au-dessus de chaque gradient.
- Centrifugeuse 800 xg pendant 30 min avec freins hors.
- Recueillir toutes les cellules (neutrophiles) dans les couches à 75% / 80% et 70% d'interface / 75%.
- Laver les cellules deux fois dans du PBS (350 x g, 10 min, RT) et compter les cellules en utilisant un hémocytomètre.
2. Mesure de la cinétique de l'ADN extracellulaire édition à l'aide d'une microplaque fluorimètre
Remarque: Cette méthode permet de mesurer des changements dans la fluorescence d'une membrane imperméable à l' ADN se liant à un colorant indiquant la libération d' ADN dans un format de microplaque à 96 puits (figure 2).
- Préparer une suspension de neutrophiles dans le milieu de dosage (HBSS +1% (v / v) de sérum autologue + 5 mM de glucose) à une concentration de 2 x 10 6 cellules / ml.
- Ajouter 5 umol / L de l'imperméable colorant liant l'ADN membranaire. Mélanger délicatement.
- neutrophiles humains aliquotes (50 pl / puits) sur 96 puits noir, fond transparent microplaques. Assurez-vous que le milieu d'essai couvre la totalité du fond du puits. Sinon, appuyez doucement la plaque sur le côté.
- Réchauffez la plaque contenant des neutrophiles pendant 10 min à 37 ° C.
- En attendant de préparer des solutions de stimuli à deux de leurs concentrations finales à utiliser (en 37 ° C milieu d'essai chaud). En tant que contrôle positif NET utiliser neutrophiles humains avec 100 nM phorbol-myristate-acétate (PMA) pendant 4 heures pour déclencher NET libération maximale. 5,8 PMA stimulation pendant 4 heures assure NET libération maximale tandis que la formation NET spontanée reste faible 5,8.
- Préparer fluorimètre à microplaques pour la mesure (4 h, 37 ° C, 530 nm pour l'excitation et 590 nm pour l'émission).
- Stimulez neutrophiles en ajoutant une solution de relance de 50 pi à 50 pi suspensions de neutrophiles. Utiliser 0,5 pg / ml de saponine dans un puits pour mesurer le signal maximal ADN de libération.
- Placer la plaque dans le lecteur et mesurer les changements dans la fluorescence pendant 4 heures à toutes les 2 min sans agitation.
- Pour l'analyse des données, calculer les augmentations normalisées de fluorescence au fil du temps.
- Soustraire base de fluorescence à partir des valeurs d'extrémité pour tous les puits , y compris la saponine (figure 2A, B). Hausse de la fluorescence de la saponine devrait être le signal le plus élevé. Il est appelé « la libération d'ADN maximale" (Figure 2A).
- Calculer les pourcentages de libération d'ADN dans des échantillons inconnus en divisant l'augmentation de la fluorescence d'échantillons inconnus par la libération d'ADN maximale.
- Les résultats moyens de répétitions et les présentent comme "% de la libération d'ADN maximal" (figure 2C).
3. Quantification du formulaire NETtion par FTU-ADN et ADN-HNE analyses ELISA
Remarque: Ces tests (MPO-ADN) modifiés ou (HNE-ADN) établie dans notre laboratoire de quantifier la formation NET en mesurant les niveaux de MPO-ADN et complexes ADN-5 HNE.
- Manteau de 96 puits à haute capacité de liaison des plaques ELISA pendant une nuit avec des anticorps de capture (50 pl / puits): anti-MPO (1: 2000 dilution) ou anti-HNE (1: 2000).
- Laver les plaques ELISA à trois reprises avec du PBS (200 ul / puits) et les bloquer avec 5% de BSA et 0,1% d'albumine de sérum humain pendant 2 heures à la température ambiante (200 ul / puits). Laver trois fois avec du PBS.
- neutrophiles de semences sur microplaques de 96 puits à une densité de 100.000 cellules / puits dans 100 milieu d'essai de pi, et stimuler la formation NET. Incuber les cellules: 4 h pour 37 ° C.
- Effectuer une digestion DNase limitée par addition de 2 U / ml de DNase à surnageants de neutrophiles, mélangez-les bien. Gardez-les à température ambiante.
- Arrêter la DNase après 15 min par addition de 11 ul de 25 mM d'EGTA (concentration finale 2,5 mM). Bien mélanger. Collecter susurnageants dans des tubes de microcentrifugation propres. échantillons de spin pour se débarrasser des débris de cellules à 300 xg pendant 5 min à température ambiante. Transférer leurs surnageants dans des tubes de microcentrifugation propres. Gardez-les sur de la glace jusqu'au moment.
- Utilisez une aliquote d'un "standard NET" préparé précédemment.
Remarque: Le NET-standard est un mélange de surnageants de DNase digéré de neutrophiles stimulées par PMA obtenues à partir d'au moins 5 différents, donneurs humains indépendants.- Pour utiliser la même norme pour une longue période, recueillir et aliquoter un volume important de surnageants de neutrophiles de chaque donateur individuel. Collecte par exemple 2 ml de surnageants de DNase digéré de neutrophiles stimulées par PMA se traduira par 200 aliquotes (10 pi chacun) suffisamment pour 200 plaques ELISA. Les données caractérisant la norme NET se trouvent dans la figure 5.
- Stimulez neutrophiles humains avec 100 nM PMA pendant 4 heures et appliquer DNase digérer à leurs surnageants selon les étapes 3,4-3,5.
- Collecter, piscine, aliquote (10 pi) et libreLes surnageants ze (-20 ° C) de neutrophile.
- Pour préparer le "NET-standard", décongeler un aliquote / donneur obtenu à partir d'au moins cinq bailleurs de fonds distincts, les mélanger et de les garder sur la glace.
- Jeter les échantillons décongelés et d'utiliser les frais pour l'expérience suivante.
- Préparer une dilution 1: série 2 du NET-standard dans PBS + EGTA.
- Diluer les échantillons DNase1 digérées (standard et inconnus) surnageants 20 fois dans du PBS + EGTA et les aliquoter sur des plaques ELISA revêtues d'anticorps de capture.
- Incuber plaques ELISA pendant la nuit à 4 ° C et les laver trois fois avec du PBS.
- Appliquer une solution d'anticorps de détection (100 pl / puits): peroxydase de raifort conjuguée à un anticorps de cheval anti-ADN (1: 500, souris). Incuber pendant 1 heure dans l'obscurité.
- Après quatre lavages avec du PBS ajouter substrat de peroxydase TMB: 100 ul / puits, 30 mn. La coloration bleue est une indication de l'activité de la peroxydase (filets présents).
- Arrêter la réaction en ajoutant 100 pl / puits de 1 M HCl. lesolutions bleues deviennent jaunes (figure 5A).
- Mesurer l'absorbance à 450 nm en utilisant un photomètre de microplaques.
- Pour l'analyse des données, calculer la quantité de MPO-ADN ou des complexes ADN-HNE par rapport à la norme NET.
- Soustraire la valeur de densité optique de base du milieu d'essai de tous les échantillons.
- Tracer les valeurs d'absorbance (axe X) des échantillons standards dilués contre leur contenu NET relative (axe Y) (figure 5A).
- Utilisation de la gamme de cette courbe non saturé norme établit une ligne de tendance (utiliser le meilleur ajustement exponentielle à partir du logiciel utilisé) (figure 5A). L'équation de cette ligne de tendance détermine la conversion des valeurs de DO quantitatifs quantités de TNE.
- Insérez les valeurs de DO mesurées des inconnues dans l'équation ligne de tendance à partir de 3.13.3 qui donnera la quantité de TNE dans l'échantillon inconnu en pourcentage du NET-standard (figure 5A).
- Calculermoyennes des répétitions (triplicats) et présenter les données finales comme «quantité de MPO-ADN ou des complexes ADN-(HNE% de la norme)" (Figure 5C).
Résultats
Les chiffres de ce manuscrit décrivent le procédé d'isolement des cellules neutrophiles, les procédures expérimentales et présentent des résultats représentatifs avec l' explication de l' analyse des données. La figure 1 montre les étapes successives de préparation neutrophile humaine. Ce protocole représente qu'une seule façon possible de l'isolement des neutrophiles. Il donne de grandes quantités de repos neutrophiles capables de libérer les TNE lors de la stimulation. Figure 2 montre comment l'ADN test de libération à base de fluorescence fonctionne. En utilisant une fluorescence lecteur de microplaques cinétique de la libération d' ADN dans les neutrophiles humains sont suivis en microplaques de 96 puits. Figure 3 explique chaque étape de l'analyse de données. Tout d' abord, le calcul de signal d'ADN maximal dans les neutrophiles traités avec de la saponine (figure 3A). Augmentation de la fluorescence est toujours calculée comme la différence entre la valeur la plus élevée de la fluorescence et le niveau de fluorescence de fond ( La figure 3A). Cette valeur est calculée pour chaque puits. L'exemple montre des données représentatives de neutrophiles humains laissés non stimulées ou activées avec PMA ou P. aeruginosa (PAO1) (figure 3B). P. aeruginosa déclenche la formation nette dans les PMN humains. 5,8,10 Il a été démontré que plusieurs P. aeruginosa souches y compris PAO1 que les bactéries seules (sans neutrophiles) ne se lient pas le colorant d'ADN de détection utilisé. 8 PAO1 P. aeruginosa a été obtenue auprès de l' ATCC, cultivées dans un milieu Luria-Bertani milieu pendant une nuit, récoltées en phase tardive exponentielle, lavées dans du milieu de dosage et utilisé pour stimuler les neutrophiles à une multiplicité d'infection (MOI) de 10: 1 (figure 3B, C, 4B, C). Les moyennes des augmentation de la fluorescence des puits répliqués sont calculés, sur la fluorescence normalisée maximale (saponine) et sont exprimées sous forme " d' ADN libération (% du maximum)" (figure 3C). La figure 3D montre fluores représentatifsimages cence de neutrophiles non traitées ou stimulées par PMA.
La figure 4A représente le schéma expliquant les principes de la FTU-ADN et ADN-HNE dosages ELISA. La figure 4B montre des images d'immunofluorescence représentatives des non stimulées, et PMA- neutrophiles humains activés par PAO1. ADN extracellulaire montre la morphologie NET typique et co-localise avec MPO et citrullinated histone H4, un marqueur de la formation NET. 6 Figure 4C montre MPO-ADN et HNE-libération d' ADN dans les neutrophiles humains dans les mêmes conditions précédentes (comme la figure 3B, 3C et 4B). ILe méthodes ELISA "NET" ont été précédemment caractérisés. 5 En bref, 2 U / ml de traitement à la DNase (équivalent de 1 ug / ml de concentration de DNase utilisé) pendant 15 min à température ambiante conduit à des signaux FTU à ADN et HNE-ADN les plus élevés . 5 échantillons de course (100 ng / voie) sur un gel d' agarose a révélé que la longueur de l' ADNdans la gamme des rendements inférieurs kb d' ADN 5 optimale digestion excessive ELISA signaux. (DNase dose initiale supérieure à 20 U / ml) ou en omettant soit la capture ou l'anticorps de détection supprimé les signaux ELISA. 5
En outre, voici les essais et la «norme NETWORK» sont en outre caractérisé (figure 5A). Le NET standard contient en moyenne 19,5 pg / ml d'ADN extracellulaire (mesurée en utilisant un standard avec des concentrations d'ADN connues), 399 ng / ml MPO et 103,4 ng / ml HNE (de ELISAkits commerciaux) (n = 8). Sur la base des poids moléculaires totaux de FTU (84 kDa) et la HNE (29,5 kDa) et le fait que 1 pg d' ADN contient 9,91 x 10 14 nucleotides, le filet standard contient 109 HNE molécules et 147 molécules FTU par 1000 nucleotides (ADN kb ). Deux-fold expériences de dilution en série du NET standard ont révélé que les plages dynamiques à la fois du MPO-ADN et ADN-ELISA HNE dosages sont entre 19,0 à 609,0 ng /Les concentrations ml d' ADN (figure 5B). Dilutions de inférieure à 32 fois la norme NET ont donné lieu à saturation alors que des dilutions de supérieur à 1.024 fois ne différaient pas de l'arrière - plan (figure 5B). Le traitement de la norme NET avec des inhibiteurs de la protéase n'a pas modifié les résultats obtenus par les analyses d' ADN et d' FTU-HNE-ADN , indiquant que les protéases ne pas interférer avec ces dosages (Figure 5C). Ainsi, les résultats obtenus dans le même échantillon standard NET par le FTU-ADN ou ADN-HNE essais ELISA fortement en corrélation les uns avec les autres (figure 5D). Pour montrer que les surnageants de PMN congelés peuvent aussi être utilisés dans ces essais sans perte d'efficacité, des aliquotes de la norme NET ont été laissées non traitées ou autres ont été exposées à un ou deux gel / dégel effectuées à -20 ° C ou -80 ° C, (1 intervalle de h). Aucun des traitements de congélation / décongélation a affecté les FTU-ADN ou ADN-HNE résultats (figure 5E). En résumé, leNET-norme fournit un point de référence fiable dans ces essais de NET-quantification permettant la comparaison quantitative des résultats NET entre expériences indépendantes.

Figure 1. Isolement des granulocytes humains ont été isolés neutrophiles polynucléaires neutrophiles dans le sang périphérique des volontaires , selon le protocole décrit. Le sang contenant un anticoagulant a été utilisé pour isoler des cellules neutrophiles par sédimentation et centrifugation en gradient de dextran. Le sang sans anticoagulant a été utilisé pour préparer du sérum. La viabilité des préparations de neutrophile est évaluée par exclusion au bleu Trypan essai. La pureté des neutrophiles est évaluée par cytocentrifugation ou cytométrie en flux (CD16, CD66abcd cellules double positives). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
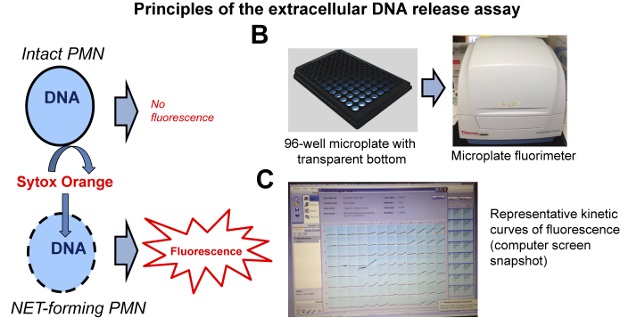
Figure 2:. Principes de l'essai de libération de l' ADN extracellulaire (A) Fluorescence est obtenue seulement dans les neutrophiles dont le plasma et les membranes nucléaires ont été compromises et le colorant de liaison à l' ADN membrane imperméable peut se lier à leur ADN. (B) L'essai est réalisé sur fond noir à 96 puits en utilisant un fluorimètre à microplaques. (C) Le fluorimètre enregistre des courbes de fluorescence en temps réel dans chaque puits. Un des résultats représentatifs dans montré. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
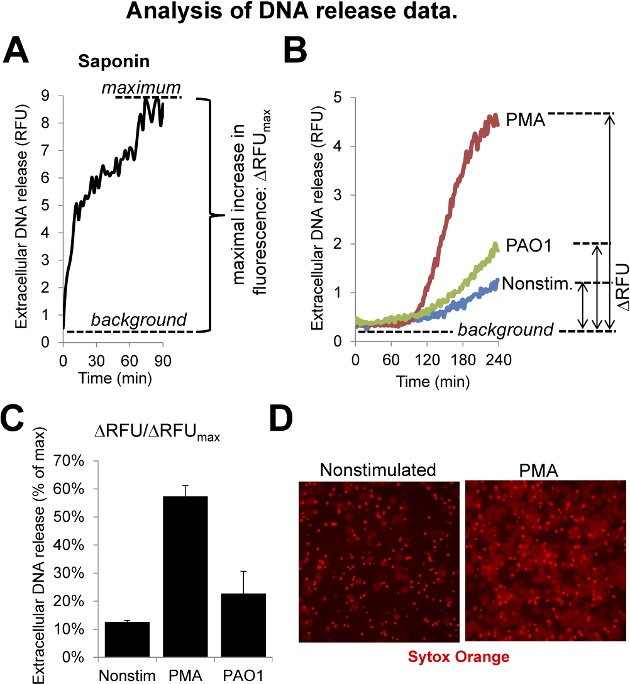
Figure 3: Analyse des données de sortie ADN (. A) , la saponine est utilisée pour créer la valeur maximale , car il lyse entièrement neutrophiles et expose leur ADN. La cinétique de la fluorescence induite par la saponine est signalée. (B) Cinétique de l' ADN de neutrophiles libération induite par le PMA (100 nM) et des bactéries (Pseudomonas aeruginosa PAO1, 10 MOI). (C) Normalized résumé des données de libération d'ADN obtenus dans des expériences utilisant un quadriplicates. (D) des images de fluorescence représentatifs de neutrophiles humains non traités et stimulées par PMA (Sytox Orange, 4 heures d' incubation). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4: MPO-ADN et ADN-ELISA HNE Assays:. Principe et résultats représentatifs (A) Schéma expliquering comment le MPO-ADN et ADN-ELISA HNE travail de tests. (B) Les résultats représentatifs des images immunofluorescence préparés sur les neutrophiles humains exposés à 100 nM PMA ou P. souche PAO1 aeruginosa (10 MOI) pendant 4 heures. Extracellulaires ADN (DAPI, bleu) co-localise dans TNE avec MPO (vert) et histone H4 citrulliné (rouge). Un résultat représentatif, n = 3. (C) libération nette a été mesurée dans les neutrophiles humains exposés aux mêmes stimuli comme ci - dessus par le FTU ADN et des tests ELISA ADN-HNE. Moyenne ± SEM, n = 3. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5: Caractérisation des "NET-standard" (A) Des dilutions en série. (1: 2) de la norme NET ont été préparéset soumis à un test ELISA MPO-ADN. Les valeurs de DO mesurées sont portées contre% du contenu de NET-standard. Rouge "X" indique une valeur de DO mesurée d'un échantillon inconnu. flèche grise indique comment la "concentration NET" (bleu "X") de l'échantillon inconnu est déterminée en utilisant la gamme centrale de la courbe standard équipée. Concentrations (B) d'ADN dans des échantillons de NET standard dilués en série ont été déterminées et tracées en fonction des valeurs de DO mesurées du MPO-ADN ou ADN-HNE tests ELISA. Les zones grises indiquent les plages dynamiques des essais. (C) le traitement inhibiteur de la protéase (inhibiteur de protéase de cocktail, 1%) n'a aucune incidence sur le résultat du MPO-ADN ou des tests ADN (HNE-NET-standard). Moyenne ± SEM, n = 2. (D) Corrélation de MPO-ADN et les résultats d'ADN (HNE DO 450 nm) de dilué en série des échantillons "NET standard" dans leurs plages dynamiques (Voir 5B). (E) congélation et décongélation cycles (-20 ° C ou -80 ° C; one ou deux) n'affectent les résultats du MPO-ADN et des tests ADN (HNE-NET-standard, moyenne ± SEM, n = 2). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
EVF représentent un nouveau mécanisme fascinant par lequel les neutrophiles tuer les agents pathogènes. 1 Bien que la littérature de TNE a connu une expansion continue au cours des dix dernières années , depuis leur découverte, plusieurs questions importantes liées à leur rôle dans la biologie, le mécanisme et la réglementation demeurent obscures. Une méthodologie appropriée doit être développée pour mesurer les TNE, ce mécanisme antimicrobien unique. Cet article décrit des procédés qui peuvent être utilisés pour quantifier EVF d'une manière à haut débit. Le premier test suit la cinétique de la fluorescence d'un colorant de liaison à l'ADN à la membrane imperméable. Ce test fournit grande quantité d'informations sur la pente et la vitesse de libération de l'ADN à partir des neutrophiles. Cette information est cruciale dans les enquêtes qui étudient les événements de signalisation précoce conduisant à la formation NET. Toutes ces informations sont perdues dans les essais de point de terminaison mesure la libération d'ADN à la fin de l'incubation. Le dosage à base de colorant de l'ADN extracellulaire est pas spécifique de TNE. Ilne mesure que la libération d'ADN. Pour confirmer les TNE, il est largement accepté d'effectuer immunofluorescence sur les neutrophiles NET formant et montrer la co-localisation de l'ADN soit avec des marqueurs granulaires (MPO, HNE) ou histones. Quantification des données d'immunofluorescence est cependant très fastidieux et subjective.
Ici, une modification d'une détection de complexes d'ADN-FTU test ELISA développé précédemment est présenté. Un test mesure complexes HNE-ADN ELISA similaires qui représentent des mesures de NET spécifiques sont également décrits. 3,5 Les deux essais ont été caractérisées en détail. 5 Le MPO-ADN et HNE-ADN dosages ELISA sont quantitatifs et NET-spécifique en même temps . 5 Ces caractéristiques ne sont pas remplies par toute autre méthode actuelle. Les dosages sont faciles à réaliser et fournir des données reproductibles. 5 Une étape DNase de digestion limitée est inclus qui assure un traitement rapide et standardisé de TNE directement sur les neutrophiles. 5 Ces essais sont adaptés à comrogner plusieurs échantillons en même temps. Dans les nouvelles, les mesures de contrôle, il est montré que les cycles de gel / dégel et les protéases n'affectent le résultat des MPO-ADN et ADN-tests HNE. On ignore, cependant, si les protéines connues pour se lier à l' ADN dans les TNE (y compris les histones et LL-37) 1,11 entraveraient ces essais.
Les étapes critiques des protocoles présentés sont les suivants. Il est important de récolter les neutrophiles qui sont en repos, état de repos et ne libèrent pas grande quantité de TNE spontanément. L'absence d'une étape de lyse hypotonique pour éliminer les globules rouges dans le protocole d'isolement neutrophile présenté est crucial d'obtenir des neutrophiles non activés. Pour inhiber l'activation des neutrophiles après que les cellules ont été purifié, il est également important pour remettre en suspension les neutrophiles dans un milieu contenant du sérum de leur propre donneur. Pour obtenir les cellules au repos, il est également crucial d'utiliser des réactifs pyrogène et sans contamination lors de la préparation des neutrophiles. SPONTAlibération NET tanément neutrophiles pendant le test ADN de libération extracellulaire pourrait également se produire. En ajoutant 1% de sérum autologue au moyen d'essai est important pour l'empêcher. Des doses plus élevées ou plus faibles du sérum autologue pourraient être testés pour obtenir des résultats optimaux. Il est essentiel lors de la FTU à ADN et des tests ELISA ADN-HNE qui a libéré l'ADN ne doit pas être trop digéré par une DNase, car elle entraîne une perte complète du signal. Par conséquent, la dose optimale doit être déterminée pour chaque nouveau lot de DNase. Les paramètres de la digestion de l'ADN peuvent être légèrement modifiés pour obtenir la meilleure méthode ELISA signaux possibles. Il est également important de mélanger la DNase et TNE à fond pour assurer que la DNase aura un accès clair à l'ADN. Lors de la récolte des TNE digérés, laver le bien à grande échelle pour recueillir tous les TNE.
La limite de détection de l' ADN de la FTU ADN et les analyses d' ADN est HNE-ADN d' environ 10 à 20 ng / ml (figure 5B). Sérum et de l'ADN libre plasmatique niveaux de several cent à mille ng / ml ont été rapportés dans les maladies ( le cancer, le lupus érythémateux disséminé, l' infection du myocarde) qui ont été associés à la formation anormale de 12 à 14 NET. Cela suggère que le MPO-ADN et d' ADN-HNE dosages ELISA ont également le potentiel pour pouvoir quantifier les TNE dans des échantillons cliniques humains. Cette application future du MPO-ADN et ADN-ELISA HNE essais permettra de relier quantitativement TNE à la pathogenèse de la maladie.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Special thanks to the personnel of the University of Georgia Health Center laboratory for their continuous support of our work on isolating human neutrophils. This work was supported by the start-up fund of Dr. Rada provided by UGA Office of Vice President for Research.
matériels
| Name | Company | Catalog Number | Comments |
| Anti-Human Neutrophil Elastase Rabbit Ab | Calbiochem | 481001 | 1:2,000x coated |
| Anti-Myeloperoxidase Ab (Rabbit) | Millipore | 07-496 | 1:2,000x coated |
| DNase-1 | Roche | 10-104-159-001 | 1 µg/ml used for digestion |
| 20 mM EGTA/ PBS | Sigma-Aldrich | E3889-25G | |
| 2.5 mM EGTA/PBS | Sigma-Aldrich | E3889-25G | |
| Cell death detection ELISA Anti-DNA POD | Roche | 11544675001 | 1:500x |
| Eon Microplate Spectrophotometer | Biotek | ||
| Gen5 All-in-One microplate software | Biotek | analytical tool (ELISA) | |
| Sytox orange | Life Technology | S11368 | 0.2% final concentration/volume |
| 1 M Hepes | Cellgro | 25-060-Cl | Use 10 mM final concentration. |
| 1 M glucose | Sigma | Use 5 mM final concentration. | |
| HBSS | Corning | 21-023-CM | |
| Varioskan Flash Ver.2.4.3 | Thermoscientific | ||
| PMA | Sigma | P 8139 | 100 nM final used |
| ELISA Plate | Greiner bio-one | 655061 | |
| Conical tubes 15 ml | Thermoscientific | 339650 | |
| Conical tubes 50 ml | Thermoscientific | 339652 | |
| Percoll (pH 8.5-9.5) | Sigma | P 1644 | Sodium Chloride, Sigma, S7653-250G |
| Dextran | Spectrum | D1004 | |
| RPMI 1640 media | Corning Cellgro | 17-105-CV | |
| 96 well assay plate black plate clear bottom | Costar | 3603 |
Références
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303, 1532-1535 (2004).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol. 176, 231-241 (2007).
- Kessenbrock, K., et al. Netting neutrophils in autoimmune small-vessel vasculitis. Nat Med. 15, 623-625 (2009).
- Leffler, J., et al. Degradation of neutrophil extracellular traps co-varies with disease activity in patients with systemic lupus erythematosus. Arthritis Res Ther. 15, R34(2013).
- Yoo, D. G., Floyd, M., Winn, M., Moskowitz, S. M., Rada, B. NET formation induced by Pseudomonas aeruginosa cystic fibrosis isolates measured as release of myeloperoxidase-DNA and neutrophil elastase-DNA complexes. Immunol Lett. 160, 186-194 (2014).
- Wang, Y., et al. Histone hypercitrullination mediates chromatin decondensation and neutrophil extracellular trap formation. J Cell Biol. 184, 205-213 (2009).
- Pang, L., Hayes, C. P., Buac, K., Yoo, D. G., Rada, B. Pseudogout-associated inflammatory calcium pyrophosphate dihydrate microcrystals induce formation of neutrophil extracellular traps. J Immunol. 190, 6488-6500 (2013).
- Yoo, D. G., et al. Release of cystic fibrosis airway inflammatory markers from Pseudomonas aeruginosa-stimulated human neutrophils involves NADPH oxidase-dependent extracellular DNA trap formation. J. Immunol. 192, 4728-4738 (2014).
- Brinkmann, V., Laube, B., Abu Abed,, Goosmann, U., Zychlinsky, C., A, Neutrophil extracellular traps, how to generate and visualize them. J. Vis. Exp. , (2010).
- Rada, B., et al. Pyocyanin-enhanced neutrophil extracellular trap formation requires the NADPH oxidase. PLoS One. 8, e54205(2013).
- Neumann, A., et al. The antimicrobial peptide LL-37 facilitates the formation of neutrophil extracellular traps. Biochem J. 464, 3-11 (2014).
- Leon, S. A., Shapiro, B., Sklaroff, D. M., Yaros, M. J. Free DNA in the serum of cancer patients and the effect of therapy. Cancer Res. 37, 646-650 (1977).
- Raptis, L., Menard, H. A. Quantitation and characterization of plasma DNA in normals and patients with systemic lupus erythematosus. J Clin Invest. 66, 1391-1399 (1980).
- Chang, C. P., et al. Elevated cell-free serum DNA detected in patients with myocardial infarction. Clin Chim Acta. 327, 95-101 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon