Method Article
Isolement des cellules endothéliales humaines lymphatique par multi-paramètres fluorescence tri cellulaire activé
Dans cet article
Résumé
L'objectif de ce protocole est d'isoler les cellules endothéliales lymphatiques qui tapissent malformation lymphatique navires et prépuces kystiques humains en utilisant des cellules activées par fluorescence (FACS). La culture de cellules et de l'expansion ultérieure de ces cellules permet un nouveau niveau de sophistication expérimental pour les études génétiques, protéomiques, fonctionnels et de différenciation cellulaire.
Résumé
Troubles du système lymphatique tels que le lymphoedème primaire, malformations lymphatiques et les tumeurs lymphatiques sont des conditions rares qui causent une morbidité significative, mais peu de choses sont connues sur leur biologie. Isoler des cellules lymphatiques humaines très pures endothéliales (ESL) à partir de tissus malades et en bonne santé serait de faciliter les études de l'endothélium lymphatique aux niveaux génétiques, moléculaires et cellulaires. Il est prévu que ces enquêtes peuvent révéler des cibles pour de nouvelles thérapies qui peuvent changer la gestion clinique de ces conditions. Un protocole décrivant l'isolement de prépuce humain ESL et malformation lymphatique de cellules endothéliales lymphatiques (LM ESL) est présenté. Pour obtenir un tissu de la suspension de cellules a été hachée et traitée par voie enzymatique en utilisant de la collagénase et la dispase II II. La suspension cellulaire unique résultant a été ensuite marqué avec des anticorps à grappe de différenciation (CD) marqueurs CD34, CD31, Vascular Endothelial Growth Factor-3 (VEGFR-3) et podoplanin. Stailes cellules viables ont été triées nies sur un trieur de cellules activé par fluorescence (FACS) pour séparer le CD34 CD31 faible VEGFR-3 Pos Pos population podoplanin Pos LM LEC autre endotheliales et de cellules non endotheliales. Les ESL LM triées ont été cultivées et élargi de flacons revêtues de fibronectine pour un usage plus expérimentale.
Introduction
Une fonction importante du système vasculaire lymphatique est d'absorber la lymphe, un excès de liquide interstitiel contenant des lipides, des protéines et des composants cellulaires, et la conduire vers le système veineux sanguin. Un réseau de capillaires lymphatiques lymphatiques dirige vers les ganglions lymphatiques où il est criblée pour la présence d'antigènes étrangers, un processus important dans la surveillance immunitaire et le déploiement de globules blancs pour neutraliser les antigènes étrangers.
Le système lymphatique unidirectionnelle dans des tissus commence avec le capillaire lymphatique initiale, une structure unique d'une couche unique de cellules endotheliales discontinue plates à paroi mince avec des jonctions de cellules spécialisées qui permettent la saisie de la lymphe 1,2. Ces capillaires sont fixés à la matrice du tissu conjonctif voisin par l'intermédiaire d'ancrage des filaments pour empêcher l'effondrement de la cuve en présence d'augmentation de la pression interstitielle 3. Les capillaires lymphatiques premiers vides dans la collecte des capillaires lymphatiquesqui confluent en vaisseaux lymphatiques ou des veines plus grandes. En comparaison initiale vaisseaux capillaires lymphatiques, les vaisseaux lymphatiques ont collecter plus épaisses parois des vaisseaux lymphatiques, des soupapes jumelées et sont enfermés par une membrane basale discontinue dans laquelle quelques cellules de muscle lisse sont noyés 4. Universel Coordonné ouverture et la fermeture des vannes lymphatiques et la contraction des cellules musculaires lisses facilite l'écoulement de lymphe 3. Chez les humains, les veines lymphatiques provenant de diverses régions du corps se rejoignent pour former troncs lymphatiques qui fusionnent pour former deux canaux lymphatiques: le canal thoracique et le canal lymphatique droit. Le canal thoracique draine la lymphe du côté gauche du corps et de la droite en dessous de la poitrine tandis que la droite lymphatique drains de conduit lymphe du bras droit et sur le côté droit de la tête, du cou et du thorax. Les deux conduits mènent lymphe dans les veines sous-clavière dans le cou 5.
Troubles du système lymphatique sont regroupés en un acquise congénitale (Tableau 1). Des exemples de conditions sont acquises lymphangite et lymphoedème secondaire. Lymphangitis est une inflammation d'un vaisseau lymphatique due à une infection bactérienne. Les lymphatiques touchés se dilatent et se remplissent de polynucléaires contenant de l'exsudat. Dans la peau, ces vaisseaux lymphatiques sont visibles en rouge, stries sous-cutanée douloureuse souvent accompagnée par l'élargissement du noeud associé drainage lymphatique (adénopathie) 6. Le lymphoedème secondaire se pose comme une conséquence des dommages ou une obstruction à la cuve ou des ganglions lymphatiques obstruction lymphatique. Cela conduit à un gonflement chronique progressive due à l'accumulation de lymphe distale au dommage ou obstruction. Dans les pays développés, lymphoedème secondaire est le plus souvent associé à la malignité des tumeurs où des métastases obstruent les vaisseaux lymphatiques ou ganglions lymphatiques régionaux, ou comme une conséquence de la thérapie anti-cancer après l'ablation chirurgicale des ganglions lymphatiques, la fibrose post-irradiation et Throm post-inflammatoirebose et des cicatrices 7. Dans d'autres régions du monde, le lymphoedème secondaire peut être secondaire à une obstruction lymphatique causée par des vers parasites tels que Wuchereria bancrofti 6.
| Troubles du système lymphatique vasculaire | |||
| Acquis | Congénital | ||
| Lymphadénite Le lymphoedème secondaire | Le lymphoedème primaire 10 | Sporadiques malformations lymphatiques 13 | Lymphatique malformations associées à des syndromes 13 |
| par exemple, Syndrome Milroy Syndrome de Meige | Simple: Malformations lymphatiques | par exemple, Syndrome de Klippel-Tranaunay Syndrome Weber Parcs Syndrome de Sturge-Weber | |
| Combiné: malformations capillaires-lymphatique Malformation capillaire lymphatique-veineuse Malformation capillaire lymphatique-artérioveineuse Capillaire lymphatique malformation veineuse-artérioveineuse | |||
Tableau 1. Aperçu des troubles du système vasculaire lymphatique.
Affections congénitales du système lymphatique comprennent primaire (idiopathique) lymphoedème pensé pour être causée par des mutations génétiques, lymphangiectasie et les anomalies du système lymphatique de 8,9. Lymphoedème primaire peut être sporadique vraisemblablement causée par des mutations de novo, ou hérité. Troubles lymphatiques peut aussi être isolé ou comprendre une partie d'un syndrome plus généralisé 10. Dans la population pédiatrique, 97% de la lympheœdème est sporadique à des anomalies dans la structure des vaisseaux lymphatiques qui nuisent drainage lymphatique régional 11. Maladie Milroy est un exemple de lymphoedème primaire causée par une mutation dans le gène VEGFR-3 évidents à la naissance ou peu après 12. Bien que la plupart du temps l'état familial, la maladie Milroy peut également être identifié chez les nourrissons sans antécédents familiaux de la maladie Milroy 32. La gravité de tout le lymphœdème est fonction de la quantité de production de la lymphe et la capacité de transporter lymphe retour à la circulation veineuse 6.
En fonction du tableau clinique et in situ prolifération des cellules endotheliales, des anomalies du système lymphatique sont classés comme des tumeurs ou malformations lymphatiques lymphatiques 13. Kaposiforme lymphangiomatose est un exemple d'une tumeur 14 LEC. Malformations lymphatiques sont pensés pour survenir au cours du développement embryonnaire et de croître en proportion de l'enfant 15,16. Ils régressent rarement mais peuvent REMAIn asymptomatique jusqu'à un traumatisme ou une infection précipités croissance rapide conduisant à des complications cliniques. La structure ordonnée du réseau lymphatique et la conduction de la lymphe du tissu à la circulation veineuse décrite ci-dessus est perturbé dans les malformations lymphatiques qui se composent de collections localisées de structures anormales kystiques remplies de liquide lymphatique. Bien qu'il n'y ait aucune preuve clinique ou expérimentale que ces navires kystiques sont reliés à la circulation lymphatique ou qu'ils contiennent des valvules lymphatiques fonctionnels, leur identité lymphatique est confirmée par l'expression de la gamme de marqueurs de cellules lymphatiques tels que podoplanin, CD31, lymphatique navire endothéliale Receptor 1 (LYVE-1), Prospero protéine homéoboîte 1 (PROX-1) et VEGFR-3 15,17,18. Ces structures kystiques peuvent être soit petite (microkystique) ou grande (macrokystique), mais la plupart des malformations lymphatiques contenir à la fois microkystique et composants macrokystiques (figure 1) 16. Après la chirurgie, injection sclérothérapie et / ou l'ablation par radiofréquence les malformations lymphatiques se reproduisent souvent.
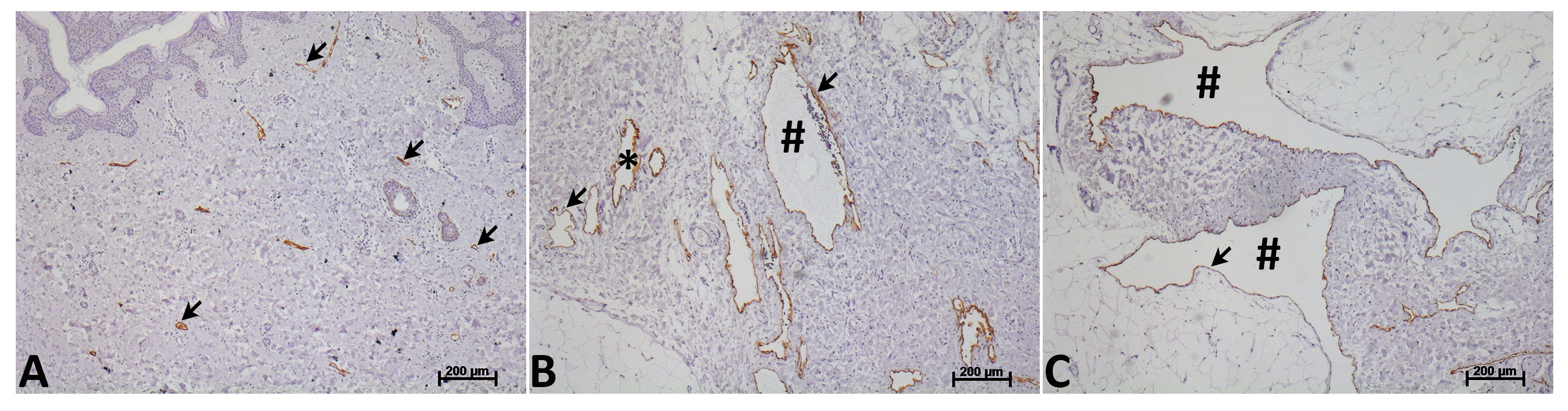
Figure 1. Morphologie des vaisseaux lymphatiques humaines et malformations lymphatiques. Lymphatique humain normal (A) et les vaisseaux lymphatiques de malformation (B et C) marqués avec des anticorps à podoplanin (étiquette brune, flèche). Vaisseaux lymphatiques malformations humaines sont caractérisées par une dilatation marquée et une variation considérable dans la taille de la lumière. Ces structures kystiques anormales localisées peuvent être soit petite (microkystique, *) (B) ou grande (macrokystique, #) (C). La plupart des malformations lymphatiques contiennent des composants microkystiques et macrokystiques. S'il vous plaît cliquer ici pour voir une version plus grande de la figure.
Certains chercheurs ont suggéré que les malformations lymphatiques représentent un trouble du développement de la vascularisation lymphatique dans lequel les ESL ne présentent un potentiel de croissance anormale mais ont échoué à se connecter à la circulation normale 19. Cependant, nous avons constaté que les ESL LM prolifèrent plus rapidement et sont plus résistantes à l'apoptose de prépuce ESL 15 qui suggère qu'il ya un défaut primaire dans le LM ESL. Quand LM ESL sont implantées dans un modèle de xénogreffe de souris, ils forment des structures qui rappellent malformations lymphatiques 15. Cela confirme l'hypothèse selon laquelle les malformations lymphatiques peuvent être causés par une ou plusieurs mutations somatiques provenant de LM ESL au cours du développement foetal. En effet, des rapports récents ont identifié une telle mutation dans la sous-unité catalytique p110 de phosphoinositide 3-kinase (PIK3CA) gène 20.
Compte tenu des progrès de la technologie de séquençage de l'ADN, des mutations pertinentes could être plus facilement identifiés dans isolées LM ESL, guider les futures études de ces conditions. L'isolement des ESL viables serait de faciliter les comparaisons entre les ESL anormales et normales dans des dosages tels que la migration, la prolifération, tube formant capacité et la survie en réponse à la disponibilité réduite des nutriments ou des agents pro-apoptotiques 15. ESL isolées seraient en outre nous permettre d'effectuer l'expression du gène spécifique des cellules et des études protéomiques, pour délimiter de nouveaux sous-populations de LEC et de découvrir de nouveaux agents pharmacologiques appropriés pour la gestion clinique des malformations lymphatiques.
Nous avons déjà publié une méthode d'isolement LEC basé sur la séparation des billes magnétiques des ESL de prépuce néonatal et malformations lymphatiques 15. Nous avons rapporté une stratégie de séparation ESL normales et pathologiques à partir de cellules endothéliales vasculaires sur la base de l'absence d'expression de CD34, puis en soumettant la fraction de cellules CD34 Neg à une sélection positive pour CD31.Cependant, cette méthode a été entravée par la présence de cellules non endotheliales résiduels. Ceci est indépendant de l'élimination subséquente épiderme avant digestion du tissu conjonctif. Ces contaminants ont proliféré généralement plus rapidement, et donc éventuellement overgrew les cultures de cellules endothéliales, malgré les tentatives ultérieures de répéter LEC isolement. En effet, une contamination initiale de cellules non endotheliales aussi faibles que 2% à 5% est suffisante pour submerger la population 15 LEC. Cela nous a incité à explorer la méthode de tri cellulaire par fluorescence activé comme une option pour améliorer le rendement des cellules LEC et la pureté. En outre, nous avons utilisé plusieurs paramètres de tri pour améliorer la spécificité des populations LEC, ajoutant VEGFR-3 et podoplanin aux marqueurs de sélection pour identifier CD34 CD31 faible Pos VEGFR-3 Pos podoplanin Pos ESL.
La justification du choix de ces marqueurs a été basé sur les rapports que si les ESL et vasculaire endothéliale de sang CElls ont de nombreux marqueurs de surface de cellule en commun, tels que CD31, ESL montrer variation phénotypique dans leur expression de CD34, podoplanin et VEGFR-3 marqueur de surface cellulaire par rapport aux cellules endothéliales vasculaires sanguines 21-23. CD31 est une glycoprotéine transmembranaire de 130 kDa également connu sous le nom plaquettes molécule d'adhésion des cellules endotheliales 1 (PECAM-1). Il est considéré comme un marqueur de cellules pan-endothélial, car il est exprimé sur tous types de vaisseaux sanguins et lymphatiques 21,24,25. CD34 est de 110 kDa glycoprotéine transmembranaire présente sur progénitrices hématopoïétiques les plus et les cellules souches, les cellules endothéliales vasculaires et certains vaisseaux lymphatiques 26.
VEGFR-3, le récepteur pour la croissance de l'endothélium vasculaire Facteurs de C et D, est initialement présent sur les veines en développement dans l'embryon de souris, mais la boîte HMG SRY liés spécification suivante lymphatique régulée par les facteurs de transcription (SOX) -18, c Hicken o u valbumin pstream p t romoter ranscription f acteur 2 (COUPTF-II) et PROX-1, VEGFR-3 expression veineux est perdue et il devient restreint à ESL 25,27 embryonnaire. Podoplanin, une membrane 38 kDa mucoprotéine, est d'abord noté sur les vaisseaux lymphatiques à environ embryonnaires de 11 jours (~ de E11.0) de la souris développement embryonnaire 28 et tandis qu'il est fortement exprimé par microvasculaires vaisseaux lymphatiques, podoplanin expression par l'endothélium lymphatique macrokystique des malformations lymphatiques est plus variable 15. La cytométrie en flux expériences suggèrent qu'au moins certaines des cellules endotheliales CD34 CD31 haut Pos expriment le marqueur podoplanin 29 lymphatique. Bien que l'évaluation systématique des LYVE-1 et podoplanin coloration des malformations lymphatiques humaines a montré que les deux sont efficaces à coloration lymphatique malformation endothélium 30, dans les tissus normaux, LYVE-1 a été signalé à être fortement présente dans le système lymphatique initialeendothélium capillaire, mais réduite et même absent dans l'endothélium lymphatique collecte 31. Comme notre objectif est d'isoler à la fois les cellules endothéliales lymphatiques initiaux et la collecte, nous avons choisi de ne pas utiliser LYVE-1 dans le cadre de notre stratégie de sélection de cellule. Enfin, la décision d'employer ces marqueurs était également fondée sur la disponibilité d'anticorps qui sont utilisés pour l'étiquetage diagnostique vaisseaux lymphatiques pour l'imagerie microscopique, une fonctionnalité qui permettrait corrélation entre la cytométrie en flux et des études d'immunofluorescence.
Cet article décrit la méthode de digestion du tissu, la coloration des cellules et les paramètres FACS nécessaire pour permettre l'isolement de cellules CD34 Faible CD31 Pos VEGFR-3 Pos podoplanin Pos ESL ainsi que les cellules endothéliales CD34 haut CD31 Pos VEGFR-3 Pos podoplanin Pos du prépuce et une malformation lymphatique tissu.
Protocole
Déclaration éthique: approbation éthique pour la collecte des tissus de malformation du prépuce et lymphatiques a été obtenu à partir des comités d'éthique de la recherche de l'homme à l'Hôpital de Royal Children, Melbourne, Australie. Consentement signé a été reçu par les parents de patients avant la chirurgie. Des échantillons de tissus ont été prélevés chez des patients diagnostiqués avec LM subissant des interventions chirurgicales dans le cadre de leur prise en charge clinique et les patients subissant une circoncision élective. Toutes les expériences ont été réalisées conformément aux lignes directrices du Conseil de recherches médicales de la santé nationale et, en Australie.
1. Préparation d'une suspension de cellules de prépuce et lymphatique Malformation tissus
- Tampons et la préparation du média.
- Préparez le support complet des cellules endothéliales en utilisant disponible dans le commerce EGM-2 Kit de Bullet MV par le réchauffement EGM-2 médias et doucement décongélation des composants du kit à 37 ° C bain d'eau. En classe II biosécurité cabinet, de façon aseptiqueajouter chaque composant pour les EGM-2 médias. Une fois que tous les composants sont ajoutés aux médias, se réfèrent à ce media comme «médias complète des cellules endothéliales. Utilisez stérile de 50 ml pipette pour mélanger le contenu avant utilisation.
NOTE: Toutes les étapes relatives à la culture cellulaire sont effectuées dans un danger biologique armoire de classe II. Toutes les solutions sont conservées à 4 ° C selon les instructions du fabricant et sont chauffés à température ambiante avant de les utiliser. Les milieux complets de cellules endothéliales, des tampons de cultures cellulaires et des solutions d'enzyme sont chauffés à 37 ° C pendant 20 min avant utilisation. - Supplément médias complète des cellules endothéliales avec 50 ng / ml de VEGF-C. Aliquoter les médias des cellules endothéliales complétée dans 50 ml tubes stériles et conserver à 4 ° C jusqu'à utilisation. Le support est stable pendant au moins 4 semaines lorsqu'il est conservé à 4 ° C.
- Préparer le calcium et le magnésium libre saline tamponnée au phosphate (PBS) en dissolvant 8,752 g de NaCl, 1,416 g de Na 2 HPO 4, 2H 2 O et0,395 g KH 2 PO 4 dans 1000 ml d'eau. Ajuster le pH à 7,4. Filtre stériliser PBS en utilisant filtre de 0,22 um et conserver à 4 ° C. Avant l'utilisation, ajouter une solution antibiotique / antifongique (utilisé à 1: 100).
- Pour préparer la fibronectine humaine, dissoudre 1 mg de fibronectine dans 10 ml d'eau stérile. Solution dans des aliquotes de 100 pi magasin reconstitué à -20 ° C. Le jour de l'utilisation, ajouter 10 ml de PBS stérile à 100 ul d'aliquote de la fibronectine (pour donner une concentration de travail finale de 10 ug / ml).
- Pour le support de l'enzyme, de préparer une solution contenant 0,04% de dispase II, 0,25% de collagénase II et 0,01% de DNase I dans du PBS stérile. Tout d'abord, peser dispase et de la collagénase, place dans un tube de 50 ml stérile, ajouter le volume requis de PBS et incuber pendant 30 min sous agitation à 37 ° C pour dissoudre. Une fois dissous, solution dispase / collagénase filtre à stériliser (0,22 um filtre) en matière de biosécurité capot. Ajouter de façon aseptique la DNase I. magasin la solution enzymatique à 37 ° C jusqu'à ce queutiliser.
REMARQUE: DNase I est un réactif de qualité culture cellulaire disponible dans le commerce sous forme de poudre lyophilisée stérile.
- Préparez le support complet des cellules endothéliales en utilisant disponible dans le commerce EGM-2 Kit de Bullet MV par le réchauffement EGM-2 médias et doucement décongélation des composants du kit à 37 ° C bain d'eau. En classe II biosécurité cabinet, de façon aseptiqueajouter chaque composant pour les EGM-2 médias. Une fois que tous les composants sont ajoutés aux médias, se réfèrent à ce media comme «médias complète des cellules endothéliales. Utilisez stérile de 50 ml pipette pour mélanger le contenu avant utilisation.
2. Préparation d'une suspension de cellules de prépuce et lymphatiques Malformations
- Peser un tube de 50 ml contenant 10 ml de / 2% de solution antibiotique antimycotique DMEM. Ce tube sera utilisé pour la collecte de tissu.
- À la suite de l'ablation chirurgicale des tissus lymphatiques et malformation du prépuce, ajouter aseptiquement spécimen de tissu dans le tube et transfert sur de la glace au laboratoire de culture cellulaire.
- Peser le tube contenant le tissu et le calcul de poids de tissu. Utiliser ce poids pour calculer le volume de solution enzymatique nécessaire à la digestion du tissu.
- Dans une enceinte de sécurité biologique de classe II, utiliser des pinces stériles pour transférer le tissu et les médias dans une boîte de culture de tissu de 100 mm. Utilisez des ciseaux stériles pour émincer finement le tissu dans ~ 1 mm 3 pièces.
- Transfert tissu haché mélangé avec les médias into un tube de 50 ml contenant 10 ml supplémentaires de solution à 2% antimycotique stérile DMEM / antibiotique. Mélanger par inversion à remettre en suspension le tissu. Centrifuger l'échantillon à 300 g pendant 5 min.
- Retirer le surnageant. Basé sur le poids des tissus, ajouter 1 ml de pré-chauffé (37 ° C) collagénase II de solution de digestion / DNase I / II Dispase pour 100 mg de tissu haché. En général, en utilisant 10 ml de solution d'enzyme à environ 1 g de tissu haché.
- Incuber le tissu dans un incubateur à 37 ° C pendant de 20 à 90 min avec agitation constante à 200 tours par minute. A la fin de cette période, veiller à ce que la quasi-totalité du tissu est digéré en fragments fines.
NOTE: L'exposition des cellules à de la collagénase et de la dispase au moment de l'isolement à partir des tissus influences survie des cellules primaires. Nous avons trouvé empiriquement que la plupart des échantillons de prépuce néonatal exigent optimale 20-30 min de la digestion, tandis que les échantillons de malformations lymphatiques fibrotiques peuvent nécessiter 60-90 min de la digestion. Rendement LEC LMs sont influencées par le montant de la fibrose présente, plus de tissu fibreux qui donne moins de cellules, probablement en raison d'effets délétères de l'exposition prolongée à la collagénase II et dispase II. - Après la digestion, transférer le tube à l'armoire de biosécurité et passer la solution de tissu digéré à travers une passoire 70 um placé dans un tube de 50 ml stérile. Utilisation seringue de 3 ml piston avec piston en caoutchouc, broyer le tissu restant jusqu'à ce que seuls de faibles traces de matrice extracellulaire sont observées.
- Laver le tamis cellulaire avec un volume de cellule endothéliale moyen équivalent au volume de milieu de dissociation enzymatique à récupérer les cellules collées à tamis et pour inactiver les enzymes. Par exemple, pour 2 ml de milieu de dissociation enzyme de digérer le tissu haché, ajouter 2 ml de milieu de cellules endotheliales pour inactiver les enzymes.
- Centrifuger la solution de cellules à 300 g pendant 5 min et aspirer le surnageant. R> e-suspendre les cellules dans 10 ml de PBS. Centrifuger les cellules à 300 xgpendant 5 min, retirer le surnageant puis répétez lavage des cellules deux fois. > Remettre en suspension le culot cellulaire dans 20 ml de milieu de cellules endotheliales. Compter les cellules en utilisant du bleu trypan puis semences 2 x 10> 6 cellules dans 150 cm> 2 flacon pré-revêtu de fibronectine dans un volume final de 20 ml de milieu de cellules endothéliales. Culture à 37 ° C dans un 5% de CO> 2 incubateur humidifié dans l'air.>
NOTE: Il est prévu que 75% à 90% des cellules nucléées survivre à la digestion du tissu tel qu'estimé par l'exclusion du bleu trypan. Le nombre de cellules initial reflète toutes les cellules nucléées dans la suspension de cellules (par exemple les kératinocytes, les macrophages, les leucocytes, les cellules du tissu conjonctif et des cellules des vaisseaux sanguins). Le nombre de cellules à 5-7 jours reflète cellules qui ont attachés, survécu et proliféré au cours de la culture cellulaire. Revêtement flacons de culture tissulaire avec la fibronectine améliore également LEC ultérieur et la survie LM LEC. - Après une nuit d'incubation, laver les cellules non liées à une distance de trois lavages avec Psolution de BS / 1% d'antibiotique-antimycotique et ajouter du milieu frais des cellules endotheliales. Effectuer trois lavages pour éliminer efficacement les cellules non liées et les globules rouges présents dans le ballon. Changer de support tous les deux jours. Les cellules seront ~ 80% de confluence après 5-7 jours.
3. Anticorps coloration des cellules endothéliales pour lymphatique marqueurs de surface cellulaire pour cytométrie en flux
- Après que les cellules ont atteint 80% de confluence, le milieu de cellules aspirer et de rinçage avec du PBS.
- Détacher les cellules adhérentes par l'incubation des cellules avec 7 ml d'une solution de détachement cellulaire tel que Accutase par 150 cm 2 de ballon 5-7 min à 37 ° C.
- Récolte des cellules enlevé, inactivent la solution de détachement cellulaire en ajoutant trois volumes de milieu de cellules endotheliales et de transférer la suspension de cellules dans un nouveau tube stérile.
- Centrifuger les cellules à 300 g pendant 5 min.
- Aspirer le surnageant et remettre en suspension les cellules dans 5 ml de PBS. Centrifuger les cellules à 300 g pendant 5 min, retirez la supernatant puis répétez lavage des cellules. Remettre en suspension les cellules dans 5 ml de PBS.
- Comptez le nombre de cellules viables. Mélanger 10 ul de suspension cellulaire avec 90 ul de 0,4% de bleu trypan. Transférer 10 ul de cette suspension à hémocytomètre pour le comptage.
NOTE: Le rendement cellulaire finale dépendra de la taille de l'échantillon traité. Le rendement de la cellule d'habitude par les plages 150 cm 2 du ballon à partir de 7 x 10 5 à 1,2 x 10 6 de cellules viables. - Préparer les solutions d'anticorps pour la coloration des cellules.
REMARQUE: Les dilutions suivantes ont été titrés pour la coloration 1 x 10 6 dans un volume de 100 ul de coloration.- Diluer PE souris conjugué anticorps humain anti VEGFR-3 (01h50); PE-Cy7 anti- CD34 de souris conjugué humain conjugué (1: 200); Anti- CD31 conjugué APC-humain de souris (1: 100) et Alexa 488-rat conjugué anti- humain podoplanin (1: 200) dans le volume total de 100 ul de FBS à 5% stérile de la solution PBS / par échantillon de tissu. Après la préparation dusolution d'anticorps, garder sur la glace jusqu'à utilisation. Préparer même mélange dilué d'anticorps de contrôle d'isotype pour faciliter la mise en cytométrie de flux de portes.
- Pour réduire la liaison non spécifique des anticorps, les cellules de centrifugation à 300 g pendant 2 min, retirez surnageant puis suspendre les cellules dans 100 pi stérile 5% de FBS / solution PBS par échantillon à être colorés. Incuber les cellules sur de la glace pendant 20 min à 4 ° C.
- Centrifuger les cellules à 300 g pendant 5 min, puis les cellules supprimer surnageant dans le cocktail d'anticorps conjugué remettre en suspension. Aussi une tache plus petite aliquote de cellules (1 x 10 5) dans le mélange d'anticorps de contrôle d'isotype de 100 ul. Incuber les cellules sur de la glace pendant 20 min.
- Pour retirer l'anticorps non lié, ajouter 2 ml de solution 2% de FBS / PBS et centrifuger les cellules à 300 g pendant 5 min. Aspirer le surnageant et répéter le lavage.
- Remettre en suspension le culot cellulaire pour le contrôle isotypique et l'échantillon d'anticorps teinté à trier dans 300 ul de 0,5 mg / ml de propidium ioDide / solution à 2% de FBS / PBS. Placer les tubes sur la glace jusqu'à ce que le tri.
4. Tri cellulaire
- Utilisez les matériaux suivants pour mettre en place l'instrument; des billes d'alignement tels que des particules fluorescentes disponibles dans le commerce, à base de solution saline liquide de gainage tamponnée au phosphate et des perles de retard de chute, comme Accudrop perles fluorescentes.
- Isoler les ESL humains purifiés sur un tri cellulaire instrument activé par fluorescence multi-paramètre. Mettre en place l'instrument et l'aligner selon les recommandations du fabricant. En outre, exécutez simples contrôles de compensation de tache avec chaque sorte de générer la matrice de compensation et d'éliminer ainsi purge substantielle travers de l'émission de fluorochromes tels que le PE dans le canal PE-Cy.
REMARQUE: Une plus grande proportion des cellules triées par FACS survivre l'isolement si une buse de 100 um est utilisé et les cellules sont classifiées dans le milieu des cellules endothéliales.
5. Culture Cellulaire Poster FACS TrierING
- Après le tri, centrifuger les cellules à 300 g pendant 5 min. Aspirer le surnageant et remettre en suspension les cellules dans 5 à 10 ml de milieu (en fonction du ballon utilisée pour ensemencer la cellule). Si moins de 50 000 cellules sont triées, les cellules sont cultivées dans revêtues de fibronectine de 25 cm 2 ballon.
- Sinon, les cellules de culture de 75 cm2 de fibronectine ballon revêtu à 37 ° C dans un CO 2, l'air incubateur humidifié à 5%. Changer les médias après 2 jours.
REMARQUE: les médias Cell est changé tous les deux jours en raison de prolonger le temps entre les changements des médias semble favoriser la survie des cellules non-endothéliales. Nous validons le phénotype des cellules endothéliales lymphatique utilisant la détection immunohistochimique de marqueurs: PROX-1, VEGFR-3, podoplanin, CD34 et CD31 lorsque les cellules sont d'abord fendu d'expansion 15.
Résultats
Après la digestion de tissu initial, après 24 heures de culture dans des échantillons non fractionnés, des colonies de cellules endotheliales distinctes peuvent être observées (figure 2A) avec des cellules de type fibroblaste et les cellules musculaires lisses. Après le tri et après 24 heures de culture de cellules, les cellules CD34 CD31 faible Pos VEGFR-3 cellules Pos podoplanin Pos attacher et montrer la morphologie pavée typique (figure 2B et C). En utilisant la méthode décrite ci-dessus FACS, nous sommes en mesure de purifier les cellules jusqu'à 99,8% de pureté et de les distinguer de haut CD34 CD31 Pos VEGFR-3 cellules endothéliales Pos podoplanin Pos. Les résultats représentatifs de gating stratégie et de tri sont présentés dans la figure 3. Cela a résolu les problèmes rencontrés lors de l'utilisation méthode d'isolation magnétique perle. À ce jour, nous avons des passages de ces cellules jusqu'à passage 13. Après ce passage, le LM ESL et le prépuce LECCommençons à la sénescence, accompagnée par des changements morphologiques et la division cellulaire réduite.
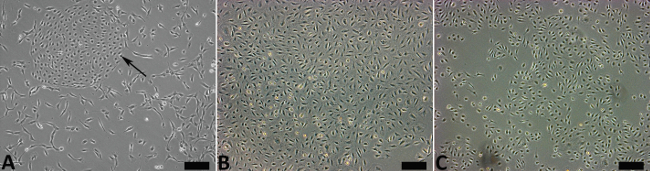
Figure 2. prépuce ESL et LM-LEC. Vingt-quatre heures après la digestion enzymatique, les cellules non triés contiennent à la fois endothéliale (flèche) et les cellules non endothéliales (A). Après l'isolement de cellules CD34 faible CD31 Pos VEGFR-3 Pos podoplanin Pos FACS, prépuce ESL (B) et LM-ESL (C) sont dépourvus de cellules non endothéliales et maintenir pavée morphologie. S'il vous plaît, cliquez ici pour voir une version plus grande de la figure .

Figure 3. cellulaire activé par fluorescence tri stratégies de déclenchement pour le tri de cellules vasculaires et des cellules endotheliales lymphatiquess. (A) Les cellules vivantes sont d'abord débloqué CD34 et CD31 expression, suivies par les cellules endothéliales lymphatiques (C) VEGFR-3 et podoplanin déclenchement de sorte vasculaire (B) et respectivement. (D) Re-analyse de haut triés CD34 CD31 Pos VEGFR-3 Pos podoplanin Pos cellules spectacles> 98% vasculaire phénotype des cellules endothéliales. (E) cellules LEC triées sur CD34 Faible CD31 Pos VEGFR-3 Pos podoplanin Pos phénotype sont également> 98%. S'il vous plaît cliquer ici pour voir une version plus grande de la figure.
Discussion
ESL jouent un rôle important dans le maintien de l'homéostasie fluide, la réponse immunitaire à des antigènes étrangers et l'absorption et le transport de certains nutriments. Homéostasie LEC peut être affectée par des processus pathologiques tels que les infections bactériennes et les métastases tumorales, mais peut aussi se développer ESL mutations somatiques qui se traduisent par la formation de vaisseaux lymphatiques dysfonctionnelles et une morbidité significative pour les patients affectés. Pour obtenir plus de compréhension de malformation lymphatique étiologie par implantation in vivo et ex vivo d'expérimentation, et de découvrir de nouvelles options de traitement, nous avons d'abord développé une méthode d'isolement LEC basée sur la stratégie de sélection de bille magnétique utilisant CD34 CD31 Nég Pos stratégie de sélection 15. Cependant, les cultures résultantes contenaient souvent des cellules autres que les cellules endotheliales qui ont été difficiles à enlever. Par la suite, la méthode a été affinée en utilisant FACS pour trier ESL qui expriment CD34 Faible CD31 Pos VEGR3 Pos podoplanin Pos phénotype. Cette approche a donné lieu à des cultures LEC relativement homogènes contenant <0,5% de cellules CD34 non Faible CD31 Pos VEGR3 Pos podoplanin Pos sur chèque post-tri. En termes pratiques, l'avantage du tri des cellules par FACS est que la réduction de la non- présence ESL de <0,5%. ESL culture et LM ESL ont une morphologie pavée typique et deviennent sénescentes autour passage 13.
Dans cette étude, nous avons décrit un protocole à base de cytométrie de flux pour l'isolement et la culture des ESL hautement enrichis à partir de tissus normaux et anormaux sur la base de leur expression d'un ensemble de marqueurs de surface cellulaire (CD34 CD31 faible Pos Pos VEGR3 podoplanin Pos). Les cellules ont été triées à partir de tissus primaires suivant 5-7 jours d'expansion in vitro, une étape qui a abouti à un enrichissement considérable de LEC par rapport à leur fréquence dans les tissus au moment de l'isolement. Pendant snterventionschirurgic ales nous obtenons tissus allant de quelques microgrammes à quelques dizaines de grammes en poids. Ce tissu peut varier considérablement dans sa composition par rapport au volume des vaisseaux lymphatiques présents malformation, la cicatrisation des tissus et la présence de malformation lymphatique kyste thrombus. Tous ces éléments auront une influence sur le nombre de cellules peut être isolé à partir du tissu malade. Ainsi, le nombre de cellules de départ peut varier de quelques milliers à plusieurs millions de cellules des cellules. De même, ce qui influencera la composition de la suspension cellulaire de départ et le nombre de cellules qui signifie que le nombre de cellules triées également varier d'un échantillon à l'autre.
La fréquence des ESL dans les échantillons de prépuce non triés suivant 5-7 jours de culture varie de 0,52% à 4,7%, alors que LM ESL vont de 0,8% à 12,43%. Les cultures de LEC constitués> 99% CD34 CD31 faible Pos VEGR3 Pos podoplanin Pos cellules après post-tri ré-analyse et maintenu un cobbleston typiquee morphologie en culture jusqu'à la sénescence au passage ~ 13 sans prolifération par des éléments non-endothéliales.
Il est nécessaire d'élargir les cellules ex vivo après digestion initiale du tissu et de tri parce que le rendement des cellules soit de malformation du prépuce ou lymphatiques est généralement faible. Ainsi, avant l'expansion des cellules endothéliales lymphatiques i n vitro permet la génération des ~ 2x10 6 cellules nécessaires pour ensemencer une chambre de souris. Cela nécessite une étape d'expansion in vitro de 5-7 jours. Bien que l'on accepte que la culture cellulaire peut induire des changements phénotypiques dans les cellules primaires, nous avons montré que ces cellules en culture conservent leur capacité à former des structures ressemblant à de malformations lymphatiques dans un modèle de xénogreffe de souris 15.
Il ya plusieurs étapes critiques dans le protocole qui déterminent le degré de succès lors du tri des cellules par FACS. L'étape la plus critique est le temps d'exposition des cellules à collagénaseet Dispase lors de l'isolement des tissus primaires comme décrit dans l'étape 2.7. Ceci est non seulement influencée par la quantité et le type de tissu présente, mais aussi par le lot d'enzymes utilisées. En outre, les anticorps marqués par fluorescence utilisées pour caractériser les populations de cellules ont besoin d'être titrée et de préférence monoclonal. Nous avons testé plusieurs solutions de détachement des cellules différentes telles que la trypsine / EDTA, EDTA, TrypLE Select et la solution de détachement cellulaire. Nous avons constaté que l'EDTA a dû être utilisé pendant une période prolongée de temps pour détacher les cellules et amas de cellules résiduelle souvent restés. En revanche, les suspensions monocellulaires ont été générées à l'intérieur de 3 à 5 minutes d'incubation dans de la trypsine / EDTA, la solution de détachement cellulaire et TrypLE Select. Nous avons trouvé aucune différence substantielle de l'expression de CD31, CD34, podoplanin et VEGFR-3 après traitement avec l'une des solutions d'enzymes. Échantillons colorés simples devraient également être faites avec toutes les expériences de tri pour assurer que les spectres d'émission fluorochrome ne se chevauchent pas etdonc donner des lectures incorrectes. Ces étapes critiques constituent également des étapes où des modifications au protocole cellulaire pourraient être nécessaires ou de dépannage au cours de la cytométrie de flux de tri.
Par rapport à notre isolement de billes magnétiques précédemment publié des ESL 15, l'avantage d'isoler ESL par FACS comprend les éléments suivants: l'isolement plus rapide des cellules avec une grande pureté et d'identification des sous-ensembles de cellules discrètes et les populations rares dans un échantillon hétérogène. Les principales limites de LEC base-FACS et LM LEC isolement tourne nombre de cellules disponibles pour la validation des résultats suivants tri cellulaire autour limités. En outre, alors que chaque tentative est faite pour normaliser nos tests et instruments mis en place, ces mêmes paramètres peuvent pas nécessairement être reproductible dans d'autres laboratoires. Par conséquent, une certaine variabilité dans les résultats peut se produire. En outre, l'une des questions que les biologistes lymphatiques doivent faire face est l'absence de marqueurs spécifiques des cellulesce serait la différence entre les marqueurs capillaire LEC initiales et la collecte des marqueurs ESL capillaires. A ce stade, nous avons pas encore identifié des marqueurs ESL qui distinguer entre ESL sains et LM ESL. Depuis tissu malformation lymphatique contient également d'aspect normal vaisseaux lymphatiques (figure 1A), le CD34 résultant Faible CD31 Pos VEGR3 Pos podoplanin Pos contiendra une proportion de ESL normales ainsi que ceux du phénotype malade. Futures études examinant ESL et l'expression génique et protéomique LM LEC peuvent être en mesure de nous orienter vers des marqueurs ESL LM plus spécifiques qui pourraient distinguer LM ESL d'ESL dans le même tissu.
Dans l'avenir, nous nous attendons à utiliser FACS et ces nouveaux marqueurs ESL dans la tentative d'identifier des sous-populations rares de LEC à la fois dans le prépuce et les malformations lymphatiques. Cela nous permettrait d'isoler ces populations de cellules et d'étudier leur rôle dans le développement de la lympsystème vasculaire hatic et des malformations lymphatiques.
ESL isolement et LM ESL basé sur CD34 Faible CD31 Pos VEGR3 Pos podoplanin Pos réduit considérablement la contamination de cellules non-endothélial. En outre, la technologie de FACS permet de séparer les ESL en sous-types sur la base de l'expression de CD31, podoplanin et VEGFR-3 marqueurs de surface cellulaire et de comprendre ce dans le cadre du développement de la lignée cellulaire. Pour ESL malades, ce qui permet à des études spécifiques des cellules qui nous éclairera davantage sur les gènes causant des maladies LEC LEC et la capacité à répondre à divers stimuli cellulaires in vitro et dans des modèles de xénogreffe animale.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Les auteurs tiennent à remercier la Fondation Baker et «les Femmes et la Science Fellowship 'Fondation du Royal Children soutien de Zerina Lokmic. Andrew G. Elefanty et Edouard G. Stanley sont NHMRC seniors de bourses de recherche. Travaux dans leurs laboratoires a été soutenue par NHMRC et les cellules souches Australie.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Life Technologies (Gibco) | 11965-092 | Used to collect tissue samples from the operating theatre. |
| EGM-2 MV Bullet Kit | Lonza | CC-3202 | EGM-2 MV Bullet Kit contains 500 ml of EBM-2 media and human EGF, hydrocortisone, gentamycin (GA-1000), fetal bovine serum (FBS), VEGF, human FGF-b, R3-IGF-1 and ascorbic acid. |
| VEGF-C | R&D Systems | 2179-VC-025 | Complete endothelial cell media is supplemented with 50 ng/ml VEGF-C |
| Antibiotic-antimycotic solution (100x) | Life Technologies (Gibco) | 15240-062 | This solution contains 10,000 U/ml of penicillin, 10,000 mg/ml of streptomycin and 25 mg/ml of Fungizone antimycotic. Use at 1:100 dilution. |
| Fibronectin from human plasma | Sigma-Aldrich | F2006 | Used at 10 mg/ml concentrations. It can be re-used for up to 1 month if kept at 4 °C and maintained sterile. Use 7 ml to coat 150 cm2 flask. |
| StemPro Accutase Cell dissociation reagent | Life Technologies (Gibco) | A11105-01 | StemPro®Accutase® is used at 0.05 ml per cm2 to cover the entire surface area of the flask. Using lesser volumes may result in incomplete cell detachment. |
| 0.4% Trypan Blue dye | Life Technologies (Gibco) | 15250-061 | Used as a viability stain. |
| Dispase II | Roche Applied Biosciences | 4942078001 | Used at 0.04% |
| Collagenase II | Worthington Lab | 4176 | Used at 0.25% |
| DNase I | Roche Applied Biosciences | 11284932001 | Used at 0.01% |
| 70 mm nylon cell strainers | BD Falcon | 352350 | |
| [header] | |||
| PE-conjugated VEGFR-3 clone 9D9F9, clone WM59 | BioLegend | 356204 | Used at 1:50 dilution |
| PE-Cy7-conjugated CD34, clone 581 | BioLegend | 343516 | Used at 1:200 dilution |
| APC-conjugated mouse anti human CD31, clone WM59 | BioLegend | 303116, | Used at 1:100 dilution |
| Alexa 488-conjugated rat anti human Podoplanin, clone NC-80. | BioLegend | 337006 | Used at 1:200 dilution |
| PE-conjugated mouse IgG1, k isotype, clone MOPC-21 | BioLegend | 400112 | Used at 1:50 dilution |
| PE-Cy7-conjugated mouse IgG1, k isotype, clone MOPC-21 | BioLegend | 400126 | Used at 1:200 dilution |
| APC-conjugated mouse IgG1, k isotype, clone MOPC-21 | BioLegend | 400120 | Used at 1:100 dilution |
| Alexa 488-conjugated mouse IgG2a, k isotype, clone RATK2758 | BioLegend | 400525 | Used at 1:200 dilution |
Références
- Baluk, P., et al. Functionally specialized junctions between endothelial cells of lymphatic vessels. J Exp Med. 204 (10), 2349-2362 (2007).
- Yao, L. C., Baluk, P., Srinivasan, R. S., Oliver, G., McDonald, D. M. Plasticity of button-like junctions in the endothelium of airway lymphatics in development and inflammation. Am J Pathol. 180 (6), 2561-2575 (2012).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Witte, M. H., et al. Structure function relationships in the lymphatic system and implications for cancer biology. Cancer Metastasis Rev. 25 (2), 159-184 (2006).
- Andrade, M., Jacomo, A. Anatomy of the human lymphatic system. Cancer Treat Res. 135, 55-77 (2007).
- Kumar, V., Abbas, A. K., Aster, J. C., Ch Fausto, N. Cotran Pathologic Basis of Disease. 43-78. 2, Elsevier Saunders. Robbins. (2009).
- Shayan, R., Achen, M. G., Stacker, S. A. Lymphatic vessels in cancer metastasis: bridging the gaps. Carcinogenesis. 27 (9), 1729-1738 (2006).
- Mulliken & Young's Vascular Anomalies Hemangiomas and. , University Press. Oxford. 1059-1076 (2013).
- Mulliken & Young's Vascular Anomalies Hemangiomas. 14, University Press. Oxford. 562-594 (2013).
- Bellini, C., Hennekam, R. C. Clinical disorders of primary malfunctioning of the lymphatic system. Adv Anat Embryol Cell Biol. 214, 187-204 (2014).
- Schook, C. C., et al. Primary lymphedema: clinical features and management in 138 pediatric patients. Plast Reconstr Surg. 127 (6), 2419-2431 (2011).
- Brouillard, P., Boon, L., Vikkula, M. Genetics of lymphatic anomalies. J Clin Invest. 124 (3), 898-904 (2014).
- for the Study of Vascular Anomalies (ISSVA) classification. Available from: http://www.issva.org/classification.com. , (2014).
- Croteau, S. E., et al. Kaposiform lymphangiomatosis: a distinct aggressive lymphatic anomaly. J Pediatr. 164 (2), 383-388 (2014).
- Lokmic, Z., et al. Isolation of human lymphatic malformation endothelial cells, their in vitro characterization and in vivo survival in a mouse xenograft model. Angiogenesis. 17 (1), 1-15 (2014).
- Smith, R. J. Lymphatic malformations. Lymphat Res Biol. 2 (1), 25-31 (2004).
- Chen, E. Y., et al. Similar histologic features and immunohistochemical staining in microcystic and macrocystic lymphatic malformations. Lymphat Res Biol. 7 (2), 75-80 (2009).
- Norgall, S., et al. Elevated expression of VEGFR-3 in lymphatic endothelial cells from lymphangiomas. BMC cancer. 7 (2), 75-80 (2007).
- Garzon, M. C., Huang, J. T., Enjolras, O., Frieden, I. J. Vascular malformations. Part I. J Am Acad Dermatol. 56 (3), 353-370 (2007).
- Osborn, A., Dickie, P., Adams, D., Dickie, B. 20th International workshop on Vascular Anomalies. ISSVA. , Melbourne, Australia. (2014).
- Baluk, P., McDonald, D. M. Markers for microscopic imaging of lymphangiogenesis and angiogenesis. Ann N Y Acad Sci. 1131, 1-12 (2008).
- Lokmic, Z., Mitchell, G. M. Engineering the microcirculation. Tissue engineering. Part B, Reviews. 14 (1), 87-103 (2008).
- Lokmic, Z., Mitchell, G. M. Visualisation and stereological assessment of blood and lymphatic vessels. Histol Histopathol. 26 (6), 781-796 (2011).
- Hagerling, R., et al. A novel multistep mechanism for initial lymphangiogenesis in mouse embryos based on ultramicroscopy. EMBO J. 32 (5), 629-644 (2013).
- Pollmann, C., Hagerling, R., Kiefer, F. Visualization of lymphatic vessel development, growth, and function. Adv Anat Embryol Cell Biol. 214, 167-186 (2014).
- Breiteneder-Geleff, S., et al. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. Am J Pathol. 154 (2), 385-394 (1999).
- Kaipainen, A., et al. Expression of the fms-like tyrosine kinase 4 gene becomes restricted to lymphatic endothelium during development. Proc Natl Acad Sci U S A. 92 (8), 3566-3570 (1995).
- Schacht, V., et al. T1alpha/podoplanin deficiency disrupts normal lymphatic vasculature formation and causes lymphedema. EMBO J. 22 (14), 3546-3556 (2003).
- Kriehuber, E., et al. Isolation and characterization of dermal lymphatic and blood endothelial cells reveal stable and functionally specialized cell lineages. J Exp Med. 194 (6), 797-808 (2001).
- Florez-Vargas, A., et al. Comparative analysis of D2-40 and LYVE-1 immunostaiing in lymphatic malformations. Lymphology. 41 (3), 103-110 (2008).
- Makinen, T., et al. PDZ interaction site in ephrinB2 is required for the remodeling of lymphatic vasculature. Genes Dev. 19 (3), 397-410 (2005).
- Connell, F. C., et al. Analysis of coding regions of VEGFR3 and VEGFRC in Milroy disese and other primary lymphoedemas. Hum Genet. 124 (6), 625-631 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon