Method Article
3D organotypiques Co-culture Modèle Soutenir médullaire thymique des cellules épithéliales prolifération, la différenciation et Promiscuous Gene Expression
Dans cet article
Résumé
Studying medullary thymic epithelial cells in vitro has been largely unsuccessful, as current 2D culture systems do not mimic the in vivo scenario. The 3D culture system described herein - a modified skin organotypic culture model - has proven superior in recapitulating mTEC proliferation, differentiation and maintenance of promiscuous gene expression.
Résumé
Le développement des cellules T intra-thymique nécessite un maillage tridimensionnel complexe composé de diverses cellules stromales, à savoir, les cellules non-T. Thymocytes traversent cette échafaudage dans un ordre temporel et spatial très coordonnée en passant séquentiellement points de contrôle obligatoires, à savoir, l'engagement de la lignée de cellules T, suivie par récepteur des cellules T génération et la sélection du répertoire avant leur exportation vers la périphérie. Les deux types de cellules résident principaux formant ce échafaudage sont des cellules épithéliales thymiques corticales (CTEC) et médullaires (mTECs). Une caractéristique clé de mTECs est l'expression que l'on appelle la promiscuité de nombreux antigènes tissulaires restreint. Ces antigènes de tissus soumis à des restrictions sont présentés pour les thymocytes immatures directement ou indirectement par mTECs thymiques ou les cellules dendritiques, ce qui entraîne respectivement à une auto-tolérance.
Appropriés modèles in vitro imitant les voies de développement et les fonctions du CTEC et mTECs sont actuellement lacroi. Ce manque de modèles expérimentaux adéquats a entravé par exemple l'analyse de l'expression génique promiscuité, qui est encore mal comprise au niveau cellulaire et moléculaire. Nous avons adapté un modèle organotypique 3D co-culture à la culture ex vivo mTECs isolés. Ce modèle a été conçu à l'origine pour cultiver des kératinocytes de manière à produire un équivalent de peau in vitro. Le modèle 3D conservé des caractéristiques fonctionnelles clés de mTEC biologie: (i) la prolifération et la différenciation terminale des CD80 lo, Aire-négatif en CD80 salut, Aire-positif mTECs, (ii) la réactivité de RANKL, et (iii) l'expression soutenue de Foxn1, Aire et les gènes de tissus restreinte dans CD80 mTECs hi.
Introduction
Thymocytes en voie de développement représentent environ 98% du thymus, tandis que les 2% restants se compose d'une variété de cellules qui composent collectivement le stroma thymique (c.-à cellules epitheliales, les cellules dendritiques, les macrophages, les cellules B, les fibroblastes, cellules endothéliales). Les cellules épithéliales corticales extérieures (CTEC) procurent immigration de cellules pro-T de la moelle osseuse, T lignée cellulaire induction dans les cellules multipotentes pré-T et la sélection positive de soi-CMH limités thymocytes immatures. Les cellules médullaires thymiques épithéliales internes (mTECs) sont impliqués dans l'induction de tolérance de ces thymocytes avec une haute affinité pour les complexes TCR auto-peptide / CMH soit par induction sélection négative ou leur déviation dans la lignée de cellules T régulatrices. Dans le cadre de la tolérance centrale induction, mTECs sont uniques en ce qu'ils expriment un large spectre des auto-antigènes tissulaires restreint (EMR) reflétant ainsi l'auto périphérique. Ce phénomène est appelé l'expression du gène de promiscuité (PGE)1,2.
La plupart des études actuelles sur ce type de cellule fascinante comptent sur ex vivo des cellules isolées, que divers systèmes de culture 2D à court terme invariablement entraîné la perte de PGE et des molécules régulatrices clés comme le CMH de classe II, Foxn1 et Aire dans les 2 premiers jours 3-6 . Il restait toutefois incertaine, les composants et caractéristiques de la maillage 3D intacte du thymus particuliers étaient manquantes dans les modèles 2D. La culture d'organe thymique ré-agrégation (RTOC) a été jusqu'à présent le seul système 3D qui permet l'étude du développement des lymphocytes T, d'une part, et de la biologie des cellules stromales, d'autre part, dans un microenvironnement thymique intacte 7. Cependant, RTOCs ont certaines limites, à savoir, ils contiennent déjà un mélange complexe de cellules, exiger l'entrée de cellules stromales fœtales et supporter une période de culture maximal de 5 à 10 jours.
Le manque de réductionniste dans les systèmes de culture in vitro a entravé l'étude deplusieurs aspects du développement des cellules T et thymique organogenèse pas moins la régulation moléculaire de pGE et sa relation à la biologie du développement de mTECs.
En raison de la proximité-apparentement de l'organisation structurée des cellules épithéliales de la peau et du thymus, nous avons opté pour un système 3D culture organotypique (OTC) qui avait été développé à l'origine pour émuler la différenciation des kératinocytes in vitro et donc de créer un équivalent dermique. Le système se compose d'un OTC matrice inerte recouvert d'échafaudage avec des fibroblastes dermiques qui sont piégés dans un gel de fibrine, sur lequel les kératinocytes sont ensemencés 8,9. Ici, nous avons remplacé les kératinocytes avec mTECs purifiés. Tout en gardant les caractéristiques de base de ce modèle, nous avons optimisé certains paramètres.
Dans le modèle de gré à gré adoptée mTECs proliféré, a subi une différenciation terminale et maintenu identité mTEC et PGE, imitant ainsi étroitement vivo développement des mTECs dans 10. Cette note technique fournit un protocole détaillé permettant la mise en place progressive d'OTC thymus.
Protocole
Cette étude a été approuvée par le comité d'éthique de la Regierungspräsidium Karlsruhe. Tous les animaux ont été logés dans des conditions exemptes d'organismes pathogènes spécifiques du Centre de recherche allemand sur le cancer (DKFZ). Pour tous les petits expériences de culture de souris allant de 1 à 7 jours d'âge ont été utilisés.
1. Isolement de mTECs de Thymus
REMARQUE: Les étapes de digestion suivantes ont été réalisées comme décrit précédemment 1 dans des conditions stériles avec quelques modifications comme suit.
- Décapiter les souriceaux et retirer le thymus. Placez le thymus sur de la glace dans une boîte de Pétri contenant du milieu RPMI 1640 (contenant 5% de FCS).
- Couper le thymus en fines, de petits morceaux et les mettre dans un tube à fond rond avec ~ 5-30 ml du milieu RPMI et remuer doucement en utilisant un aimant pendant 10 min à température ambiante.
- Par la suite, décanter le surnageant contenant principalement thymocytes et digérer séquentiellement de tissu restant avec un tour de Collagenasoi de type IV (0,2 mg / ml et 57 U / ml concentartion finale) pendant 15 minutes chacun à 37 ° C, suivi par de la collagénase / dispase (0,2 mg / ml et la concentration finale de 1,2 U / ml) pendant 25 minutes chaque à 37 ° C dans un bain d'eau sous agitation magnétique jusqu'à ce que le thymus est complètement digéré. Utilisez 1 ml enzyme par deux à trois thymus.
- Agiter le tissu une fois tous les 7 à 10 min avec une pipette Pasteur. Réunir les fractions de la collagénase / dispase et filtrer à travers une gaze de 70 um.
- Enrichir les mTECs par la cellule tri magnétique (MACS). Effectuer la purification de mTECs par tri cellulaire magnétique 11 tel que décrit précédemment, et représenté sur la figure 1.
NOTE: Pour tri magnétique des mTECs nous avons utilisé les anticorps suivants: anti-CD80-PE (16-10A1, utilisation à dilution 1: 100) et anti-EpCAM-bio (G8.8, l'utilisation à dilution 1: 100) 12. MTECs immatures et matures utilisant MACS ont été définies comme suit: CD45 - EpCAM + CD80 - et CD45 - CD80 + respectivEly. - Après MACS purification (pureté de mTECs immatures = 83,1 ± 6,3% et mTECs matures = 79,23 ± 3,42%), ensemencer les mTECs sur les cultures organotypiques comme décrit ci-dessous (section 2.3).
- Alternativement, tri mTECs par FACS (en utilisant 100 buse de um) après CD45 MACS appauvrissement utilisant les anticorps suivants: anti-CD45-PerCP (30-F11, l'utilisation à dilution 1: 100), anti-Ly51-FITC (6C3, utiliser au 1 : 100 dilution), anti-EpCAM-Alexa647 (G8.8, l'utilisation à dilution 1: 500) et l'utilisation anti-CD80-PE (16-10A1, au dilution 1: 100). Exclure les cellules mortes en utilisant l'iodure de propidium (1: 5000) (Jour 4). MTECs immatures et matures utilisant FACS ont été définies comme suit: PI - CD45 - Ly51 - EpCAM + CD80 - et PI - CD45 - Ly51 - EpCAM + CD80 +, respectivement.
2. 3D organotypiques Co-cultures (OTSC)
NOTE: Les constructions 3D-cutanée pour la culture organotypique de keratinocytes ont été préparés comme décrit ci-dessus 9,13. A toutes les étapes cellules ont été incubées à 37 ° C et 5% de CO 2. Les médicaments en vente libre en utilisant mTECs ont été préparés avec de légères modifications comme suit.
- Préparation des fibroblastes humains
REMARQUE: Les fibroblastes dermiques humains ont été obtenus à partir de cultures d'explants de dé-épidermisé derme comme décrit précédemment neuf.- En bref, couper des bandes de peau humaine (~ 5 cm de longueur) et traiter avec la thermolysine (0,5 mg / ml dans une solution saline avec 10 mM Hepes pH 7,4) O / N à 4 ° C.
- Par la suite, séparer l'épiderme du derme à l'aide de forceps.
- Coupez finement le derme en petits morceaux, dans une plaque de 10 cm de Pétri et laisser sécher pendant 1-2 heures sous flux d'air stérile. Compléter les explants régulièrement avec DMEM contenant 20% de FBS.
- Diviser les fibroblastes sur plus quand confluentes (généralement autour de 3 semaines) en utilisant 0,1% de trypsine faire en sorte que les explants continuent à adhérer à la plaque pour plus contours consécutifs de l'excroissance.
- Développer les fibroblastes provenant de la même explants pour un maximum de trois fois dans du DMEM avec 10% de FBS et cryo-préservation eux 14. Utiliser le même lot de fibroblastes pour chaque série expérimentale.
NOTE: Les fibroblastes ont pas été irradiées pendant le set-up des équivalents de derme.
- Préparation de la Échafaudages
- Couper les 0,4-0,6 mm d'épaisseur de viscose, matériau fibreux non tissé (des détails du produit à soutenir feuille Excel) dans les cercles bien délimitées en utilisant une forte 11 mm de diamètre perforateur métallique pour correspondre exactement en 12 inserts bien-filtre. Ensuite, placer dans le puits 12 insert de filtre (polyester membrane capillaire des pores, 3 um de taille de pores) comme échafaudage. Placez la configuration complète de filtre dans une plaque de 12 puits stérile.
- Préparer le gel de fibrine en utilisant un kit de colle de fibrine pour la chirurgie constitué d'une combinaison de fibrinogène et de thrombine. Pré-diluer le fibrinogène et la thrombine en tant que composants du kit à 8 mg / ml et 10unités / ml, respectivement. Pour un seul puits d'une plaque de 12 puits, procéder comme suit.
- Diluer 100 ul de fibrinogène (8 mg / ml) avec 100 ul de phosphate saline tamponnée (PBS) sans Ca2 + et Mg2 +, pH 7,0. Diluer 100 ul de thrombine (10 unités / ml) avec 100 ul de FCS contenant 270.000 fibroblastes.
- Distribuer 200 pl de la thrombine contenant des fibroblastes de cellules se mélangent sur l'échafaudage, ce qui ajoute à 200 ul de fibrinogène (mélange 1: 1), ce qui entraîne une concentration finale de fibrinogène de 2 mg / ml de thrombine et de 2,5 unités / ml. Mélangez bien et répartir uniformément sur toute la surface de l'échafaudage par pipetage doux (jour 1).
Remarque: Au bout de 30 min à 37 ° C renfermant un caillot les fibroblastes se sera formée, remplissant complètement les espaces internes de l'échafaudage et en formant une surface supérieure lisse.
- Co-culture avec mTECs
- Pour pré-culture, plonger les cultures d'organes enDMEM avec 10% de FBS, 50 ng / ml d'acide L-ascorbique et de 1 ng / ml de TGF-β1 avec un changement de milieu tous les deux jours pendant 4-5 jours.
- Le jour de l'ensemencement mTEC, remplacer le milieu par du milieu FRDA (1: 1 de DMEM + DMEM / F12) avec 10% de FBS, 10 -10 M toxine du choléra, 0,4 mg / ml d'hydrocortisone, 50 pg / ml d'acide L-ascorbique, RANK ligand (0,1 pg / ml) et 500 unités / ml d'aprotinine, empêchant ainsi la fibrinolyse précoce par des serine proteases sécrétées par les fibroblastes.
- 7-8 heures plus tard, les co-cultures mis en place par l'ensemencement 250.000 mTECs (soit mTECs complets, ou CD80 lo et hi CD80 sous-ensembles), dans un volume de 100 l par puits sur le dessus de l'échafaudage des fibroblastes. Compter les cellules en utilisant un Neubauer (Jour 4).
NOTE: En tout temps les cultures organotypiques 3D thymus sont immergés dans les médias, contrairement OTC de la peau qui sont air-levée. - Après 24 heures d'incubation, fournir les cultures avec un milieu (de change moyen total) comme mentionné ci-dessus (étape 2.3.2) maintenant containing réduit les montants de l'aprotinine, 250 unités / ml (Jour 5).
- Afin d'évaluer l'activité proliférative des mTECs, ajouter EdU (6,7 uM / ml, soit 10 uM / puits) de médicaments en vente libre pendant 4 heures avant la fin des cultures. Effectuer la coloration de gré à gré cryo-sections comme décrit dans le Kit EdU imagerie combinée avec le co-coloration de la kératine 14. Déterminer les indices de prolifération de mTECs, soit par les cellules de la K14 + Edu + comptage dans deux sections de chaque spécimen de culture ou de débit cytométrie (EdU cytométrie de flux, la section 1.7, mais au lieu de Ly51-FITC utilisent CDR1-PB 15 à une dilution de 1: 100 et 2.3.6.4).
- Après 4-7 jours de co-culture, de résilier les OTC et le processus d'isolement de l'ARN, cryo-sectionnement ou analyse FACS (jour 8-11).
- Mettre fin à la culture à l'aide d'une pince, en séparant l'équivalent échafaudage / dermique à partir du filtre de l'insert de puits.
- Pour cryo-sectionnement, intégrer l'ensemble de gré à gré dans le composé PTOM et geler en livapeur d'azote quid avant cryo-sectionnement. Préparer 5-7 sections um d'épaisseur de gré à gré en utilisant un cryostat et conserver à -20 ° C jusqu'à utilisation. Pour immuno-histochimie des OTC de cryo-coupe utiliser anti-kératine 14 (AF64, l'utilisation au 1: 1000 dilution), et anti-vimentine (gp53, l'utilisation au 1: 100 dilution) anticorps. Effectuer la coloration immuno-histochimie indirecte utilisant des anticorps secondaires respectifs.
- Pour l'isolement de l'ARN, ajouter 1 ml de solution (contenant du phénol et de guanidinium thiocyanate) dans un bouchon à vis d'un tube 2 ml sans RNase de dénaturation. Couper l'ensemble de gré à gré en morceaux avec un scalpel et ajouter dans le tube contenant la solution de dénaturation. Mécaniquement déchiqueter les médicaments en vente libre avec l'instrument FastPrep deux fois pendant 30 secondes à une vitesse de 6,0, se placent entre sur la glace pendant 2 min (l'échantillon peut être conservé à -80 ° C après ce point). Si congelé à -80 ° C, dégel sur la glace. Centrifuger les tubes à 11,500-13,000 rpm pendant 10 min à 4 ° C. Transférer le surnageant dans un tube frais, incuber pendant 5 minutes à température ambiante et fprotocoles d'isolement d'ARN en utilisant l'acide uivez guanidinium thiocyanate-extraction au phénol-chloroforme comme décrit par le fabricant.
- Pour l'analyse FACS, retirez l'échafaud et séparer la membrane de la / des fibroblastes gel de fibrine / mTEC. Finement coupé le gel avec un scalpel et digérer dans un tube FACS pour ~ 20 minutes, ou jusqu'à complètement digéré avec 2 ml de collagénase / dispase à 37 ° C dans un bain d'eau sous agitation magnétique. Agiter la solution d'enzyme avec une pipette Pasteur, une fois toutes les 5 min. Après digestion complète, on filtre la suspension de cellules à travers un filtre de 70 um; tacher la suspension de cellules individuelles en utilisant les anticorps tels que décrits en 1.7 et analysent par cytométrie de flux.
Résultats
Nous avons adopté une organotypique modèle de co-culture 3D (3D OTC) qui avait été développé à l'origine pour une longue terme de culture in vitro de kératinocytes 9. MTECs MACS-enrichis (voir MACS enrichissement régime Figure 1) ont été ensemencées sur un échafaudage comprenant un gel de fibrine et de fibroblastes piégées. Les fibroblastes fournissent la matrice extracellulaire essentiel (ECM) supportant mTECs in vitro. MTECs ont été cultivées dans OTC pour 4-14 jours en présence de RANKL dans les cultures submergées contrairement kératinocytes, qui sont exposées à l'air imitant leur environnement in vivo (voir OTC set-up régime Figure 2).
Les deux sous-ensembles MTEC analysés ici (c.-à-CD80 lo et hi CD80 mTECs) ont survécu pendant la période de jusqu'à 14 jours de culture entière. MTECs ont été identifiés par la kératine 14 expression et étaient facilement reconnaissables à partir de fibroblastes de vimentine positif (Figure 3A, 3B). Fait intéressant, mTECs immatures et matures ont augmenté dans différents modèles dans la culture. Le CD80 lo mTECs typiquement formée bi-couches (en contact étroit avec des fibroblastes), tandis que CD80 mTECs hi ont tendance à former des agrégats cellulaires compacts délimités par les fibroblastes. Ces modèles ont été hautement reproductible.
Les sous-ensembles MTEC non seulement survécu mais aussi proliféré dans des conditions 3D de gré à gré comme évalué par EdU incorporation (figure 3C, 3D). Fait intéressant, le CD80 lo mTECs proliféré à une vitesse plus élevée en présence de RANKL, alors que l'inverse était vrai pour CD80 mTECs hi 10.
En outre, CD80 lo mTECs différenciée en CD80 mTECs hi en présence de RANKL dans les 4 jours de culture, comme indiqué par la forte régulation positive de CD80. Les mTECs différenciées également maintenu l'expression d'Aire, Foxn1 (gène et protein) ainsi que la promiscuité exprimé Aire-indépendante et dépendante EMR 10.

Figure 1. MACS enrichissement de TEC. Après filtration, mTECs ont été enrichies de la suspension thymus d'une seule cellule en utilisant cellulaire tri magnétique (MACS). Tout d'abord, les lignées de cellules hématopoïétiques ont été épuisées en utilisant des microbilles anti-CD45. Les cellules CD45 - ont ensuite été incubées avec un anticorps anti-CD80 PE, suivie par des microbilles anti-PE. L'éluat contenant CD80 + -mature mTECs était directement cultivées sur l'OTC, tandis que l'écoulement contenait CD80 - mTECs immatures et d'autres cellules stromales. MTECs se sont encore étoffés à l'aide d'anticorps et streptavidine microbilles anti-EpCAM-bio. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Schéma de l'installation progressive de l'OTC 3D. Une matrice d'échafaudage a été placé dans une cartouche filtrante 12 de puits. Les fibroblastes dermiques de la peau explantée (270 000 cellules / OTC puits) ont été inoculées dans un gel de fibrine (composé de 1: 1 rapport de fibrinogène et de thrombine). Ces équivalents dermiques ont été soutenus pendant 4-5 jours avec DMEM + nutriments jusqu'à mTECs (250.000 cellules / OTC puits) ont été ensemencées sur le dessus et cultivées avec milieu enrichi en nutriments différents (FRDA + nutriments).
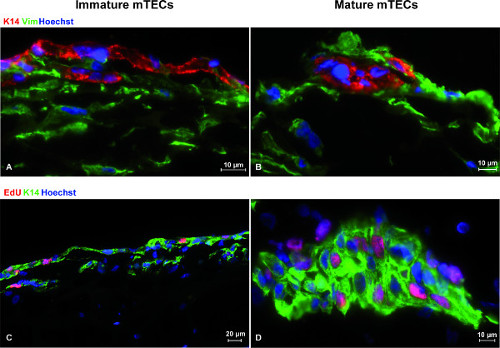
Figure 3. Les schémas de croissance et la prolifération des mTECs au sein de l'OTC. La enrichi CD80 lo mTECs ont tendance à grandir comme une bi-couche en contact étroit avec les fibroblastes (A), wh EREA les CD80 mTECs hi différenciés poussent comme des agrégats de cellules ou grappes serrées (B). OTC ont été marqués au jour 4 de la culture avec des anti-kératine 14 (rouge) et des anticorps anti-vimentine (vert) ainsi que la coloration nucléaire (Hoechst, bleu). Pour évaluer la prolifération des mTECs, les médicaments en vente libre ont été puisées avec Edu (6,7 uM / ml, soit 10 uM / puits) pendant 4 heures avant la cessation des cultures. Les cryo-sections de gré à gré ont ensuite été colorées avec des anticorps anti-kératine 14 (vert), et le mélange réactionnel EdU-Cliquez-iT (magenta) avec coloration nucléaire (Hoechst, bleu). Des images représentatives dépeignant prolifération EdU + CD80 lo mTECs (C) et Edu + CD80 mTECs hi (D) sont présentés. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
Tableau 1. Comparaison entre deux systèmes de culture thymiques 3D.
Discussion
Parallèlement RTOCs, l'OTC 3D ont été de loin supérieur en termes de différenciation des TEC et pGE entretien / induction (tableau 1) par rapport aux autres (i) «cultures 3D simplifiées 'aide - fibroblastes seul, sans l'échafaud; (Ii) les systèmes 2D utilisant - cellules fibroblastes / nourricier co-cultivées avec les TEC 10, (iii) les cellules 3T3-J2 dans laquelle clones TEC développent, mais pGE est perdu, (iv) matrigel ou (v) les composants de l'ECM (données non publiées). PGE a été maintenue pendant jusqu'à 7 jours à l'OTC 3D, 4 jours étant le point de temps optimal par la suite, pGE commence à décliner. Autres caractéristiques morphologiques TEC ont été maintenus pendant jusqu'à 14 jours. Curieusement, l'OTC a soutenu le stade terminal de différenciation mTEC vu par les Hassall-comme des structures parfois formés 10.
Le thymus utilisé pour OTC ont été prélevé sur de jeunes souris post-natales car ils ont une plus forte propension à survivre dans la culture par rapport à thymus adulte. TEC dérivé from thymus embryonnaire n'a pas encore été testée dans OTC. Plus encore, après la période de digestion de temps (sans usage de la trypsine due au clivage de certains epitopes) les cellules sont apparues plus viable en utilisant MACS plutôt que des cellules de tri FACS. L'utilisation d'un protocole en deux étapes d'enrichissement positif sur colonnes MACS (perles anti-PE) de CD80 + mTECs pureté en outre améliorée de TEC.
Pour la configuration de gré à gré, il est essentiel de veiller à ce que la viscose, matériau fibreux non tissé est découpé en cercles tranchants, bien délimitées, sans fragments détachés ou dentelé extrémités comme indiqué ci-dessus que correspondre exactement en 12 inserts bien-culture. Alternativement, échafaudages tels que BEMCOT- viscose glace M-3 (http://www.bemliese.com) peuvent également être utilisés. La taille de puits pour le DUT est également critique et doit être testé, si les formats de plaques autres que les formats à 6 puits et 12 puits devraient être utilisés.
Le gel de fibrine doit être préparé de telle sorte que les composants de fibrinogène et de thrombine ne viennent pas en contact uns avec les autres avant d'être mis sur le gré à gré, assurez-vous d'échanger la pointe de la pipette. Mélanger les deux composants dans la plaque au-dessus de l'échafaudage pour former une surface supérieure lisse. Toujours préparer un gel de test à côté dans un puits sans échafaudage pour vérifier la formation de caillots adéquate et d'avoir une bonne estimation du temps nécessaire pour la coagulation. Assurez-vous que le gel de fibrine dans l'OTC a complètement coagulé avant d'alimenter les cultures avec les médias.
Lors de la résiliation des cultures les mTECs ensemencées peuvent être facilement récupérés par digestion enzymatique (collagénase / dispase) du gel de fibrine, qui peut être utilisé pour la caractérisation des mTECs cultivées par exemple, par cytométrie en flux ou PCR.
Les médicaments en vente libre 3D décrits ici a le potentiel d'étudier ou de manipuler plusieurs paramètres TEC à savoir: 1) d'étudier et / ou de manipuler (via siRNA, oligos morpholino) les voies de développement et les fonctions de mTECs; 2) d'étudier le rôle des cellules T dans mTECs développerment; 3) CTEC de culture; 4) à tester le potentiel de progéniteurs de cellules souches dérivées du thymus; 5) à la culture TEC humains et les cellules souches; 6) pour effectuer des analyses clonales TEC simples. L'OTC 3D représentent une technique de culture élaborée émulant partie du thymus vivo microenvironnement. Il convient de souligner que les analyses supplémentaires appliquées aux CET dans la configuration actuelle de gré à gré devront être soigneusement testés et optimisés séparément.
Déclarations de divulgation
Les auteurs déclarent aucun conflit financier ou d'intérêt commercial.
Remerciements
This work has been supported by the German Cancer Research Center (DKFZ), the EU-consortium “Tolerage”, the Deutsche Forschungsgemeinschaft (SFB 938) and the Landesstiftung Baden-Württemberg.
matériels
| Name | Company | Catalog Number | Comments |
| Pregnant C57BL/6 mice | Charles River WIGA | ||
| LS columns | Miltenyi Biotec | 130-042-401 | |
| MS columns | Miltenyi Biotec | 130-042-201 | |
| CD45 Microbeads, mouse | Miltenyi Biotec | 130-052-301 | |
| Anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| Streptavidin Microbeads | Miltenyi Biotec | 130-048-101 | |
| EpCAM (G8.8 -Alexa 647 and -biotin) | Ref. 12 | ||
| CD80-PE antibody | BD Pharmingen | 553769 | |
| CD45-PerCP antibody | BD Pharmingen | 557235 | |
| Ly51-FITC antibody | BD Pharmingen | 553160 | |
| CDR1-Pacific Blue | Ref. 15 | ||
| Keratin 14 antibody | Covance | PRB-155P | |
| Vimentin antibody | Progen | GP58 | |
| Cy3-conjugated AffiniPure Goat anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 111-165-003 | |
| Alexa 488-conjugated AffiniPure F(ab')2 Fragment Goat anti-Guinea Pig IgG (H+L) | Jackson ImmunoResearch | 106-546-003 | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Molecular Probes (Invitrogen GmbH) | A-11008 | |
| Click-iT EdU Alexa Fluor 594 Imaging Kit | Invitrogen | C10339 | |
| Click-iT EdU Alexa Fluor 488 Flow Cytometry Assay Kit | Invitrogen | C10425 | |
| 12-well filter inserts (thincerts) | Greiner bio-one | 657631 | |
| 12-well plate | Greiner | 665180-01 | |
| Jettex 2005/45 | ORSA, Giorla Minore, Italy | ||
| Fibrinogen TISSUECOL-Kit Immuno | Baxter | ||
| Thrombin TISSUECOL-Kit Immuno | Baxter | ||
| PBS | Serva | 47302.03 | |
| DMEM | Lonza | BE12-604F | |
| DMEM/F12 | Lonza | BE12-719F | |
| HEPES | Gibco | 15630-049 | |
| FBS Gold | GE Healthcare | A11-151 | |
| Aprotinin (Trasylol) | Bayer | 4032037 | |
| Cholera toxin | Biomol | G117 | |
| Hydrocortisone | Seromed (Biochrom) | K3520 | |
| L-ascorbic acid | Sigma | A4034 | |
| TGF-ß1 | Invitrogen | PHG9214 | |
| RANKL | R&D systems | 462-TR-010 | |
| Thermolysin | Sigma Aldrich | T-7902 | |
| OCT Compound | TissueTek | 4583 | |
| Trizol (aka. Denaturing solution - Acid guanidinium thiocyanate-phenol-chloroform extraction) | Invitrogen | 10296028 | |
| FastPrep FP120 | Thermo Scientific | ||
| Collagenase Type IV | CellSystems | LS004189 | 0.2 mg/ml and 57U/ml final conc. |
| Neutrale Protease (Dispase) | CellSystems | LS002104 | 0.2 mg/ml and 1.2U/ml final conc. |
| DNase I | Roche | 11 284 932 001 | 25 µg/ml final conc. |
Références
- Derbinski, J., Schulte, A., Kyewski, B., Klein, L. Promiscuous gene expression in medullary thymic epithelial cells mirrors the peripheral self. Nat Immunol. 2, 1032-1039 (2001).
- Kyewski, B., Klein, L. A central role for central tolerance. Annual review of immunology. 24, 571-606 (2006).
- Bonfanti, P., et al. Microenvironmental reprogramming of thymic epithelial cells to skin multipotent stem cells. Nature. 466, 978-982 (2010).
- Kont, V., et al. Modulation of Aire regulates the expression of tissue-restricted antigens. Molecular Immunology. 45, 25-33 (2008).
- Mohtashami, M., Zuniga-Pflucker, J. C. Three-dimensional architecture of the thymus is required to maintain delta-like expression necessary for inducing T cell development. J Immunol. 176, 730-734 (2006).
- Palumbo, M. O., Levi, D., Chentoufi, A. A., Polychronakos, C. Isolation and characterization of proinsulin-producing medullary thymic epithelial cell clones. Diabetes. 55, 2595-2601 (2006).
- White, A., Jenkinson, E., Anderson, G. Reaggregate thymus cultures. Journal of visualized experiments : JoVE. , (2008).
- Stark, H. J., et al. Epidermal homeostasis in long-term scaffold-enforced skin equivalents. J Investig Dermatol Symp Proc. 11, 93-105 (2006).
- Boehnke, K., et al. Effects of fibroblasts and microenvironment on epidermal regeneration and tissue function in long-term skin equivalents. Eur J Cell Biol. 86, 731-746 (2007).
- Pinto, S., et al. An organotypic coculture model supporting proliferation and differentiation of medullary thymic epithelial cells and promiscuous gene expression. J Immunol. 190, 1085-1093 (2013).
- Gabler, J., Arnold, J., Kyewski, B. Promiscuous gene expression and the developmental dynamics of medullary thymic epithelial cells. Eur J Immunol. 37, 3363-3372 (2007).
- Farr, A., Nelson, A., Truex, J., Hosier, S. Epithelial heterogeneity in the murine thymus: a cell surface glycoprotein expressed by subcapsular and medullary epithelium. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 39, 645-653 (1991).
- Stark, H. J., et al. Authentic fibroblast matrix in dermal equivalents normalises epidermal histogenesis and dermoepidermal junction in organotypic co-culture. Eur J Cell Biol. 83, 631-645 (2004).
- Schoop, V. M., Mirancea, N., Fusenig, N. E. Epidermal organization and differentiation of HaCaT keratinocytes in organotypic coculture with human dermal fibroblasts. J Invest Dermatol. 112, 343-353 (1999).
- Rouse, R. V., Bolin, L. M., Bender, J. R., Kyewski, B. A. Monoclonal antibodies reactive with subsets of mouse and human thymic epithelial cells. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 36, 1511-1517 (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon