Method Article
Dans injections intra-cardiaque Utero tomate-lectine sur les embryons de souris pour évaluer le flux sanguin rénal
Dans cet article
Résumé
This manuscript describes a technique for visualization of the developing vasculature. Here we utilized in utero intra-cardiac FITC-labeled tomato lectin microinjections on mouse embryos. Using this technique, we delineate the perfused and unperfused vessels throughout the embryonic kidney.
Résumé
La formation et la perfusion de développer des vaisseaux sanguins rénaux (en dehors de glomérules) sont grandement sous-étudiées. Comme vasculaire développe via l'angiogenèse (qui est l'embranchement des gros vaisseaux) et la vasculogenèse (formation de novo de la cuve), des techniques de cartographie de perfusion telles que des moulages en résine, l'imagerie in vivo de l'échographie, et les micro-dissection ont été limitées à démontrer les relations intimes entre ces deux processus et les structures rénales en développement au sein de l'embryon. Ici, nous décrivons la procédure in utero intra-cardiaques marqués au FITC tomates microinjections de lectine ultrasons guidées sur des embryons de souris pour mesurer l'ontogenèse de la perfusion rénale. Tomate lectine (TL) a été perfusé dans tout l'embryon et les reins récoltés. Les tissus ont été co-colorées pour diverses structures rénaux y compris: progéniteurs néphron, les structures de néphrons, urétéral épithélium, et la vascularisation. À partir de E13.5 grands navires de gros calibre ont été perfusé, cependant périphériqueles navires sont restés unperfused. Par E15.5 et E17.5, petits vaisseaux périphériques ainsi que glomérules a commencé à devenir perfusé. Cette technique expérimentale est essentielle pour l'étude du rôle du système vasculaire et la circulation sanguine au cours du développement embryonnaire.
Introduction
Pendant le développement embryonnaire, deux processus vasculaires discrets, mais simultanées ont lieu: l'angiogenèse, le processus par lequel un navire se développe à partir d'un grand navire et vasculogenèse pré-existante, qui est une formation de novo de vaisseaux de progéniteurs endothéliaux résidentiels 1,2. Respectivement, le premier est synonyme de flux sanguin, tandis que le second est pensé à prendre largement en l'absence de celui-ci.
Simultanée à la formation des vaisseaux sanguins, un processus cyclique et dynamique de la synthèse rénale des cellules progénitrices, la prolifération et la différenciation commence à se dérouler le jour embryonnaire 9,5 (de E9.5). À ce stade, le bourgeon urétéral (UB) envahit le dos en entourant mésenchyme métanéphrique (MM), et se poursuit jusqu'à la naissance 3. Répétées ramification de la condensation dans UB rapidement métanéphrique bouchon mésenchyme commence la formation des unités fonctionnelles du rein, néphron. Avec chaque nouvelle génération de UB et nephron, les générations plus âgées sont déplacés dans des régions intérieures corticales et médullaires, où ils subissent ensuite encore maturation et la différenciation dans des environnements essentiellement vasculaire denses. Comme le montre Dressler et al., 3, ce procédé est précipité par embryologique signalisation inductive, telle que la diaphonie entre UB et MM, et une myriade de facteurs extracellulaires 6.3. Deux facteurs extracellulaires récemment étudiés dans le pancréas et les reins en développement comprennent la tension d'oxygène et la circulation sanguine 7,8. Ce dernier sera discuté plus en détail ci-dessous en relation avec le développement du rein.
Afin d'exposer le rôle inductive que le flux sanguin peut jouer dans la différenciation néphrons des cellules progénitrices, ainsi que dans d'autres processus d'organogenèse, méthodes précises et exactes de cartographie de flux sanguin embryonnaire est impératif.
D'autres méthodes de mesurer le flux sanguin comprennent la prescription de ulimagerie trasound et de résine jette 9,10. En conclusion, ces modes ont été montré à faire défaut en soi dans leur capacité à dévoiler simultanément juxtapositions temporelles et spatiales entre la circulation sanguine et différenciation des cellules souches. moulages en résine, par exemple, offrent un modèle valide de formation de motifs de navire dans les tissus adultes, mais dans des vaisseaux immatures, tels que les points de temps avec embryonnaires, les navires sont nettement sous-développé et qui fuit. Par conséquent, la résine jette ne parviennent pas à tenir dans les petits vaisseaux, souvent poreuse,.
Pour ces obstacles apparents, entre autres, nous avons choisi d'intégrer guidée par échographie in vivo intra-cardiaques lectine de tomate embryonnaire (TL) en micro-injections dans nos enquêtes de développement du rein. Dans cette procédure, nous utilisons une sonde à ultrasons pour guider l'aiguille d'une manière synchrone monté micropipette remplie de 2,5 pi de solution de TL dans le ventricule gauche d'embryons de souris E11.5 en des points, E13.5, E15.5 et E17.5 temps. E170,5 est le stade de développement plus tard que les aiguilles ne sont pas assez fort pour pénétrer l'embryon plus développé.
Les avantages de ce procédé de micro-injection sont abondants. microinjection guidée par échographie permet un positionnement précis d'une aiguille d'injection dans le ventricule embryonnaire gauche, l'expulsion passif et contrôlée de solution dans le cœur battant de l'animal, un minimum de dommages à cœur et les tissus environnants, et la prévention de l'insuffisance cardiaque soudaine et la mort du embryon avant la perfusion de plein-corps. Avec l'utilisation d'un TL marqué au FITC, ne importe quel système vasculaire perfusé maintiendra le marqueur le long de sa membrane apicale endothéliale. En combinaison avec l'immunohistochimie, en utilisant Pecam (CD31, plaquettes endothéliale molécule d'adhésion cellulaire) et divers autres marqueurs vasculaires, nous sommes en mesure de distinguer clairement entre les navires perfusés et ONU-perfusé, ainsi que de caractériser toute coloration anormale de tissus environnants.
Protocole
NOTE: L'Université de Pittsburgh institutionnel de protection des animaux et l'utilisation Comité a approuvé toutes les expériences.
1. Préparation des instruments échographie microinjection et d'embryons
- Mettre en place scène, montage, et la sonde (Figure 1) ainsi que les instruments chirurgicaux (figure 2). Lieu tampon phosphate salin (PBS) (pH 7,4) dans un bain C de réchauffement de 37 °. Remplir entièrement l'aiguille de micro-injection d'huile minérale, en utilisant une seringue ml fixée à une seconde aiguille souple 25 G, à travers sa base.
- Fixer aiguille sur la rotation bras monter, et l'aiguille vide de la solution de l'huile minérale. Re-remplir de 2,5 pi de solution de TL. Veiller à ce que les bulles d'air sont présents au sein de l'aiguille d'injection. Tournez bras d'aiguille vers le mur, loin de la scène.
- Anesthésier la femme enceinte dans la chambre anesthésie par perfusion continue de l'isoflurane. Quand la mère est rendu inconscient, transférer l'anesthésie au tube de nez positionné sur le caudal côté de la scène, la mère et le lieu en position couchée avec le museau dans le tube de nez pour permettre la continuation d'un état complètement anesthésiés.
- membres de bande en angle de 45 °, ou avec les mains et les pieds reposaient et positionnés Overtop ECG onglets / de contrôle de la température. Il est important que le barrage enceinte est surveillé en permanence pour se assurer que l'anesthésie est suffisante et que dans une pommade appliquée sur les yeux pour réduire le séchage.
- Appliquer le produit d'épilation dans le bas-ventre de la mère, essuyer doucement avec des cotons-tiges sèches, puis de nouveau avec 70% des cotons-tiges éthanol saturé de supprimer ne importe quel produit et l'excès de poils. Assurez-vous de nettoyer la peau abdominale hors de tous les cheveux sur le site de l'incision (Figure 3).
- Effectuez une laparotomie sur la mère enceinte en utilisant des pinces et ciseaux chirurgicaux fines. Prenez soin d'éviter de couper les gros vaisseaux ou organes viscéraux. Faire la première incision droite de l'épiderme 1,5-2 cm au-dessus du vagin et continuent couper vers les côtes pour approximatEly 2-3 cm. Exposer la membrane sous-cutanée, repérez la ligne blanche ("ligne blanche") (figure 3), et une coupe parallèle à l'incision initiale, le long de la même longueur, pour exposer interne organes viscéraux et saccules utérines.
2. Extraction des embryons
- Utilisez applicateurs de coton-tige de 6 pouces à manoeuvrer mère et embryons. Poussez doucement (ne pas forcer) sur la peau avec applicateur à manipuler premier embryon de l'ouverture de l'incision. Après extraction de la première saccule de l'embryon, doucement et lentement tirer le reste de la corne de l'utérus à travers et sur l'extérieur de la mère. Évitez de tirer intestin ou d'autres organes via une incision à ce stade.
- Quantifier embryons et placez doucement corne utérine arrière gauche en mère. Puis commencer à placer la corne utérine droit de retour dans la mère en commençant par le plus embryon de saccule du vagin sur la corne et le déplacement vers le bas. Continuer ainsi jusqu'à ce que deux embryons restent exposés (Figure 4). Enfin, les embryons de position dans une colonne ci-dessus et parallèle à la ligne incision, en étant conscient de ne pas couper la circulation de l'utérus.
- Placer des blocs d'argile et de la situation entre les bras et le corps, ainsi que des pattes et la queue. Veiller à ce que les surfaces d'argile sont approximativement au niveau de laparotomie. Mouiller la boîte de Pétri fenestré avec 37 ° C PBS.
- Saisissez étendant pince de la main droite et le plat fenêtrée Petri avec la main gauche (fenestration parallèle à embryons) et porter fermé pince ~ 5 cm à travers fenestration, du haut de la boîte de Pétri. Pince complètement ouvert sans déchirer fenestration maille.
- Manœuvrer mains au-dessus des embryons et de se concentrer vue sur les deux saccules d'embryons. Sans (ou légèrement) toucher saccules avec maillage de fenestration ou une pince, les glisser par la fente et mis boîte de Pétri sur l'abdomen de la mère. Avec des pinces encore étendues, manipuler maille fenêtrée pour asseoir sur chaque côté et à la base de chaque embryon (figure 5 ) et tirez forceps sur l'ouverture de la fente.
- Ensuite, placez caoutchouc bleu contenant mur dans boîte de Pétri, sans pincement ou de blesser embryons (Figure 6). Assurez-vous que les blocs d'argile sont fermement équilibrage boîte de Pétri, embryon, et le mur contenant du caoutchouc. Enfin, remplissez boîte de Pétri avec 37 ° C jusqu'à ce que PBS embryons sont complètement submergés (Figure 6), tout en contrôlant les fuites au maillage fenêtrée.
3. Procédure d'injection
- Étage inférieur d'injection avec la mère et les embryons vers le bas en utilisant le réglage de niveau Z bouton (Figure 1), puis tourner l'aiguille d'injection et le bras de montage et aligner directement avec sonde à ultrasons, avec ½ aiguille cm à gauche et sous la pointe de la sonde (Figure 7) . Poussez l'aiguille-bras (pas aiguille) 45 ° par rapport à la sonde. Veillez à ne pas frapper la pointe de l'aiguille avec la sonde de plat ou ultrasons.
- Levez étape d'injection revenir à hauteur d'origine, avec des ultrasons probe directement au-dessus de la sonde embryons doit être légèrement submergé et dans 3-4 mm du tissu embryonnaire. Utilisez X & Y ajustement stade boutons (figure 8) de modifier la position embryon / mère / étape pour localiser systématiquement cœur battant embryonnaire.
- Directement centre de l'écran de l'échographie observer un marqueur cible centrale noire dessinée (*). Localiser ventricule gauche (de préférence) ou atrium en utilisant les boutons de réglage de scène X & Y (Figure 8), puis augmenter ou diminuer la scène avec le bouton tournant sur la scène pour positionner la cible d'injection précisément sur le centre marqueur noir sur l'écran de l'échographie.
- Utilisez X bouton de réglage de scène pour déplacer embryon vers la droite, hors de l'écran de l'échographie. Repositionner l'aiguille de microinjection et le bras en place, ½ cm de distance et 90 ° à la sonde à ultrasons (figure 7).
- Avec microinjection montage boutons de réglage (Figure 9C-G), l'aiguille de position avec la pointe clairement alSIGNÉ avec le repère central. Ajuster l'angle d'injection (en utilisant les boutons de la figure 9C & EG), et X, Y, Z et vecteurs de micro-aiguille pour assurer pointe de l'aiguille est concentrée dans le bon plan. Rentrer aiguille de microinjection utilisant uniquement le bouton "injection" (figure 9F), attention de ne pas ajuster les autres dimensions.
- Encore une fois, en utilisant uniquement l'X fine bouton de réglage de scène mouvement embryon de retour sous la sonde, avec la cible exactement sur la marque centrale sur l'écran de l'échographie. Assurez-vous que le ventricule gauche est maintenant exactement sur la même X, Y, et Z avion.
- Ensuite, avec juste la "injection" bouton sur le micro-injection de montage, percer lentement embryon avec l'aiguille de microinjection et porter doucement pointe dans le ventricule gauche. Injecter la totalité des 2,5 pi de solution de TL dans le ventricule gauche ou jusqu'à ce que les avertissements sonores vides, en tenant «vide» et en tapant "remplir" une fois (Figures 2A et B). À ce momentinjection d'observer une ombre émanant de la pointe de l'aiguille qui est la TL entrant dans la chambre cardiaque (figure 10). À l'inverse, se rétracter rapidement aiguille de microinjection tournant le "injection" bouton (Figure 9F) sur la micro-injection de montage lorsque l'injection est terminée.
- Continuer à côté embryon et répétez cette procédure pour embryons restants suivants cette série d'étapes et enfin placer les embryons finales retour dans l'abdomen de la mère. Mettez l'anesthésie à la boîte de chambre et déplacez doucement mère ici pour 15 min de temps de la dernière injection.
4. récolte embryons et analyse
- Sacrifiez barrage par dislocation cervicale. Développez la laparotomie pour enlever facilement cornes utérines de la mère. Garder les embryons dans les utérine sac. Placez les embryons in réfrigérés PBS.
- Disséquer embryons de l'utérus sac (si le tissu collecte nécessaires pour le génotypage) et placer le tout embryon in 4% paraformaldéhyde (PFA) pendant la nuit, puis dans 30% de saccharose nuit, geler en coupe cryostat moyenne. Ensuite, couper l'cryosection et le placer sur des lames pour l'analyse immunohistochimique. Vous pouvez éventuellement utiliser des tissus pour l'ensemble de montage par déshydratation dans 100% de méthanol, après fixation dans 4% PFA.
- Pour l'analyse immunohistochimique placer les cryosections dans PBS pour éliminer les PTOM. Puis bloquer les sections avec 10% de sérum de âne normale pendant 30 min. Puis ajouter anticorps primaire PECAM au 1: 100 dilution nuit à 4 ° C. Le lendemain, laver les lames dans PBT trois fois pendant 10 min chacun et ajouter d'âne anti rat 594 secondaire et incuber pendant 1 heure à température ambiante.
NOTE: Ce est une technique très exigeantes nécessitant l'optimisation et la coordination de l'échographie et de la micro-injection. Il ya une courbe d'apprentissage très raide liés à cette technique et nécessite de quatre à six semaines d'injections encadrés avant on devient compétent.
Résultats
Formation vasculaire précède flux dans le développement de reins
Une majorité de tissu embryonnaire (y compris le rein) contient une vascularisation dense (deux unperfused et perfusé), même au début des points de temps embryonnaires. Pour mieux mesurer et analyser le flux sanguin dans le rein en développement, nous avons utilisé une méthode in utero embryonnaires micro-injections intracardiaques. Avec l'utilisation d'une haute résolution ultrasons pour identifier le coeur embryonnaire E11.5 à E17.5 travers, et à la suite de l'extraction et de l'exposition d'un seul saccule utérine par une laparotomie, nous étions en mesure d'injecter 2,5 pi de TL (isothiocyanate de fluorescéine (FITC)).
Nous avons trouvé le plus grand succès injection E13.5 et E15.5 embryonnaires points de temps, avec un débit d'environ ~ 80% de réussite à 90%, respectivement. En raison de la présence d'un coeur relativement immature à E11.5 et une existence dense du cartilage et de la formation de l'os à E17.5, le ti périphérieme les points sont relativement difficiles à injecter, avec une probabilité de succès nettement inférieure par rapport aux points de temps moyen embryonnaires. On peut se attendre au moins ~ 50% et ~ 30% taux de réussite avec des points de E11.5 et E17.5 temps, respectivement.
En tissu co-marquage avec Pecam (CD31), un marqueur endothélial universelle, nous sommes en mesure de classer qualitativement navires fluorescentes et les tissus en trois groupes: vascularisation perfusé (Pecam positif et TL positif), vasculaire unperfused (Pecam positif), et aberrante perfusé structures (TL positif). Ce schéma de coloration particulière nous permet de distinguer l'espace entre les zones de perfusion et non-perfusion (figure 11).
À E11.5, nous avons découvert que les navires perfusés encapsulent le rein en développement dans un motif en forme de bande sans réellement pénétrer dans l'organe (figure 12B). Par E13.5, gros vaisseaux ont été perfusés avec quelques-uns des plus petitsnavires accessoires coloration avec TL (figure 12C). Coloration pourrait également être vu à travers une partie de l'épithélium urétéral, cela peut être soit de glomérules qui sont déjà perfusé ou en raison de la perméabilité des vaisseaux inhérente embryonnaires. En gros vaisseaux E15.5 ont été perfuses, mais un grand nombre de glomérules pourrait également être observée en maintenant la tache de TL, ce qui suggère que le filtrage significatif se produit (figure 12D). Aussi à cette époque pointer un certain nombre de petits vaisseaux de calibre apparaît perfusé, mais une proportion importante de la zone néphrogénique externe apparaît dépourvu de la circulation sanguine. Enfin, cependant, par une majorité E17.5 du rein a été perfusé à l'exception de la vascularisation de la zone néphrogénique, qui est essentiellement dépourvue de perfusion (cependant dense dans les vaisseaux positifs PECAM) indiquant ainsi une absence de l'angiogenèse dans les régions périphériques. Les navires de plus petit calibre contenir des TL et le nombre moyen de glomérules a perfusés de façon spectaculaire dansaugmenté par rapport à des points de temps antérieurs (Figure 12E).

Sonde Figure 1. Échographie, étape chirurgicale, système de micro-injection, système ferroviaire, et l'ECG / moniteur de Température configuration de base.

Figure 2. Équipement nécessaire chirurgicale, solutions et dispositifs. (A) applicateurs de coton-tige. (B) Extension (anneau) forceps. (C) de ciseaux chirurgicaux. Pince (D) à bout émoussé. (E) pince fine. (F) microinjection aiguille (Origio, # C060609). (H) Injection / Remplir contrôleur. (I) tampon phosphate salin (PBS). (J) d'huile minérale (Sigma Aldrich).

Figure 3. A 2 cm laparotomie est effectuée sur la mère anesthésié, exposant la couche sous-cutanée (de la paroi abdominale) ci-dessus l'utérus. En utilisant les ciseaux chirurgicaux et des pinces fines, exposer la ligne blanche et de faire l'incision parallèle à épidermique coupe. Se il vous plaît cliquez ici pour voir une version plus grande de la figure.

Figure 4. 1-2 E15.5 saccules utérines extraits par laparotomie et exposés. Se il vous plaît cliquer ici pour voir une plus grandela version de la figure.

Figure 5. Exposed saccules utérines guidés à travers fente dans boîte de Pétri en utilisant une pince fenêtrée étendant. Fenêtrée maillage sièges câlins à la base des saccules.

Figure 6. Bleu de paroi contenant placé à droite de saccules utérines. Boîte de Pétri remplie de 37 ° C jusqu'à ce que PBS embryons et contenant mur sont complètement submergé. blocs d'argile placés solidement sous boîte de Petri / embryon entre les bras et le corps et les jambes et la queue.

Figure 7. Système d'injection positio Ned ½ cm à gauche et en bas, et 90 ° par rapport à la sonde à ultrasons.

Figure 8. Etape X et Y mécanismes d'ajustement.

Figure 9. Vide / dispositif, un système de micro-injection, Fill et le stade de montage. (A) bouton Remplir. (B) bouton Injecter. (C) Aiguille circulaire du bouton de réglage de l'angle. (E) Beaux X bouton de réglage. (F) Bouton "Injection". (G) Course X bouton de réglage. (H) plateau tournant le bouton de réglage en hauteur.
98fig10.jpg "/>
Figure 10. D'image échographique des E15.5 bout de l'aiguille intra-cardiaque TL microinjection. Est positionné dans la chambre cardiaque, solution TL est indiqué par ombre noire dans les deux chambres. Péricarde et la cavité péricardique sont facilement différenciés.
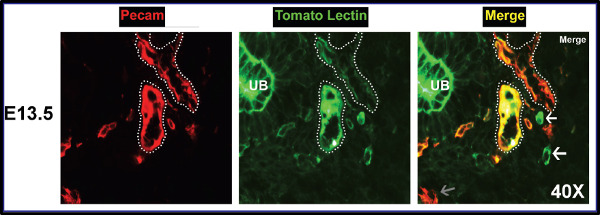
Figure 11. Zones entre perfusion, unperfusion, et la coloration aberrante discerné. Le premier panneau montre la tache de Pecam. Le panneau du milieu affiche la tache de TL plus exactement de la même zone de tissu. Bourgeon urétéral est aberrante teinté; gros vaisseaux sont entourés par des lignes pointillées blanches. Le dernier panneau est la fusion. Les flèches blanches indiquent les fuites du navire, et les flèches grises montrent une transition vers un navire devenir perfusé. Structures jaunes représentent vasculaire totalement perfusé.ADO / 52398 / 52398fig11large.jpg "target =" _ blank "> Se il vous plaît cliquer ici pour voir une version plus grande de la figure.

Figure 12. embryon et les reins perfusion ontogenèse est étudiée. (A) Le total des E11.5 embryon est perfusé, avec les vaisseaux très périphériques au sein des régions de tête et de queue de fixation du TL. (B) aux navires perfusés ont été vus entourant mais pas incorporés dans le rein en développement à E11.5 dans un motif en forme de bande, il ya aussi une assez grande quantité de coloration diffuse à ce point. (C) E13.5 rénale montre grands, grands navires de calibre sont perfusés à travers les reins (flèche blanche et jaune), avec perfusion absent dans la zone néphrogénique (blanc pointillé). (D) E15.5 rénale montre tout au long de la perfusion de petit calibre, les vaisseaux périphériques (flèches jaunes),dans certains glomérules (flèches blanches), et encore une absence de perfusion au périphérique reins cheminée. (E) E17.5 rénale montre vaste perfusion à travers glomérules (flèches blanches) et les petits bateaux de calibre (flèches jaunes). La zone néphrogénique est indiscernable du reste du rein à ce grossissement. Se il vous plaît cliquer ici pour voir une version plus grande de la figure.
Discussion
Microinjection anesthésie et délais
En ce qui concerne l'anesthésie de la mère, il est essentiel de maintenir constant d'air (2-3 L / min) et à faible PSI. Le débit de la sédatif doit être maintenue à environ 1,75 à 2 L / min. Simultanément, les délais dans lesquels les injections ont lieu doivent être étroitement surveillés et contrôlés pour chaque portée. Pour chaque portée de la procédure d'injection doit être maintenu sous 45 min. L'importance de ce délai est primordiale à l'expérience, que chaque embryon doit être maintenue dans une constante, la gamme de fréquence cardiaque normale afin de faciliter la perfusion contrôlée et invariable dans tout le corps et organe d'intérêt. Nous avons constaté que l'allongement injections résultats dans les résultats et les fluctuations douteuses dans les habitudes de perfusion entre embryons et abaisse les taux d'injections réussies (ce est à dire, ralentissement du rythme cardiaque, une mort cardiaque). Enfin, après l'injection finale dans la litière, il est essentielpour permettre à environ 15 min avant embryons sont récoltés pour faciliter appropriée, perfusion complet dans chaque embryon.
Traitement procédural et les soins d'embryons
Lors de l'extraction des embryons, nous avons constaté des taux plus élevés de succès avec des injections qui sont accompli en participant constamment à la santé et l'intégrité de la muqueuse utérine et d'embryons globale lors de l'extraction de l'embryon. En utilisant les applicateurs de coton-tige délicates (saturés avec du PBS) pour manipuler et manœuvrer le sac de l'utérus et saccules est impératif pour assurer la survie de la mère et embryons pendant toute la procédure. Tout d'abord, il est important de veiller à ce que l'intégrité physique de l'utérus et le placenta est correctement maintenue. Eviter tordant les saccules d'une manière qui va obstruer le flux sanguin vers les embryons ou de provoquer des ruptures importantes dans les vaisseaux sanguins qui alimentent le flux sanguin vers le placenta. Ceci peut être réalisé par extraction d'une Maximum de 1-2 embryons à la fois (à moins que l'extraction de l'ensemble de sac utérine pour compte initial) et en positionnant applicateurs loin des grands vaisseaux sanguins à la base du placenta.
Localisation de l'injection du site embryonnaire
Guider l'aiguille de micro-injection dans l'emplacement approprié de la machine à ultrasons est également critique pour chaque tentative d'injection. Une attention particulière doit être donnée à la localisation et le centrage du ventricule gauche sur le repère central. Suite à cela, l'aiguille doit être situé et centrée précisément sur le marqueur de centre ainsi d'aligner l'aiguille et le site d'injection sur le même X et le plan Y. Une fois cette opération terminée, tirer lentement la pointe de l'aiguille plus près du site d'injection et d'éviter l'application de pression excessive sur le péricarde et le cœur. Cela se fait en permettant à l'aiguille de passer progressivement à travers les couches de tissu, plutôt que de forcer le passage de l'aiguille à travers eux. Lors de l'injection, il est également important de look pour une ombre noire émanant de la pointe de l'aiguille (figure 10). Ce est indicative de la solution de remplissage du ventricule TL. Si la pointe de l'aiguille est dans la position correcte, l'ombre doit apparaître et disparaître en permanence que TL est éjecté dans l'aorte. Cependant, si la cavité péricardique semble engorge, ce est une indication que l'aiguille est à côté du ventricule gauche et la solution de TL remplit la cavité péricardique qui entoure le coeur. Ce est une erreur commune qui est facilement corrigée par le repositionnement de l'aiguille d'injection sur son plan x et y, avec les légers ajustements qui ont lieu avec l'aiguille toujours dans l'embryon. Éviter d'extraire l'aiguille de l'embryon à ce stade.
L'échographie-guidé dans les limites de microinjection in vivo
Intrinsèquement, la micro-injection d'ultrasons possède un certain nombre de limitations techniques fondamentales. Tout d'abord, le volume de l'aiguille de microinjectionla capacité limite de la tranche d'âge des injections à E17.5 chez la souris. 2,5 ul de solution TL a été démontré dans nos études pour perfuser complètement embryons E15.5 jusqu'à. Cependant, juste après ce point de temps, le TL par rapport au volume de sang devient de minuscules et dilué de marquer efficacement membranes endothéliales rénales périphériques. Ainsi, une image réduite de l'écoulement de sang est présent à des injections ultérieures points de temps. En outre, la formation de l'os et du cartilage dans l'embryon crée une barrière naturelle pour la pointe de l'aiguille, conduisant ainsi à allongées temps d'injection et les fissures fréquentes dans la tête d'aiguille. Ces limitations peuvent être surmontées par l'utilisation d'un système avec de nouvelles injections de plus grandes capacités de résistance de l'aiguille et de volume.
D'autres techniques de cartographie de flux sanguin embryonnaires
À ce jour, d'autres méthodes de cartographie embryonnaire flux de sang de souris comprennent la mise en œuvre des moulages en résine, coloration immunohistochimique et haute résolut ion imagerie ultrasonore. Comme moulages en résine (avec l'intégration des techniques d'imagerie de pointe) sont actuellement l'alternative la plus populaire, cette question sera examinée plus en détail ci-dessous. moulages en résine permettent la création des représentations tridimensionnelles précises de débit au sein des organes postnatales. Cependant, peu de succès a été eu avec le tissu rénal prénatale imagerie vasculaire poreuse en raison de sang et les limites dans la résolution. En comparaison, les taches TL conjugués permettent la liaison à des antigènes de membranes endotheliales conduisant à un plus haut degré de précision. Dans d'autres cas, la viscosité de coulée de résine tronque prématurément circuler dans les vaisseaux glomérules et minuscules lits capillaires, créant limitation expérimental à des grossissements plus élevés. A faible grossissement, cette technique est clairement viable à établir les modèles d'écoulement par rapport aux régions en développement. Inversement, TL permet une analyse à haute résolution de la circulation sanguine par rapport aux structures de développement au niveau cellulaire.
ent "> l'application et les orientations futuresNos données suggèrent que la circulation sanguine et l'oxygénation sont des facteurs critiques en ce qui concerne la différenciation des progéniteurs néphron. Pour élucider leurs rôles dans le développement rénal, enquêtes futures doivent délimiter les mécanismes sous-jacents anatomiques précipitants ce processus physiologique ainsi que d'examiner les voies de signalisation de la transcription qui interviennent dans ce phénomène ainsi. Une hypothèse, en ce qui concerne combler le fossé entre phénomène et le mécanisme, est que les agrégats de cellules musculaires lisses et péricytes jouent un rôle contributif dans l'orchestration de la troncature transitoire de flux sanguin dans les régions de cellules souches d'organes en développement. Pour tester cela, outre la coloration et l'analyse immunofluorescence doivent être menées avec un accent sur ces types de cellules dans la zone frontière néphrogénique. En termes de futures enquêtes de sous-jacente des voies de signalisation, nous aimerions explorer les rôles des facteurs inductibles hypoxie et laVon Hippen Lindau voies de signalisation. Ces deux éléments ont été largement impliqués à travers la littérature comme jouant un rôle important dans le maintien inductives hypoxique et environnements oxygénés au sein des régions de cellules souches (largement vu comme hypoxique) et les zones de différenciation (zones en ont le plus besoin d'oxygénation), respectivement. En outre, nous voudrions interroger le rôle de l'érythropoïétine (EPO) dans la médiation des processus de l'angiogenèse et la vasculogenèse au long du développement du rein vasculaire. L'EPO est une glycoprotéine rénale qui joue un rôle crucial dans la différenciation endotheliale et la maintenance. Son rôle dans la différenciation endothéliale médiée par du sang est en grande partie inconnue. Enfin, nous tenons à mener des expériences de microinjection in vivo avec des composés de vasodilatation de renforcer davantage la validité de ces enquêtes.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
The authors would like to thank Dr. George Gittes for advice and expertise throughout this study. SSL was supported by an American Heart Association fellowship (11POST7330002). Further to this SSL and this study was supported by an NIDDK Mentored Research Scientist Development Award (DK096996) and by the Children’s Hospital of Pittsburgh.
matériels
| Name | Company | Catalog Number | Comments |
| DAPI | Sigma Aldrich | 022M4004V | concentration 1:5,000 |
| Pecam | BD Biosciences | 553370 | concentration 1:100 |
| FITC-Tomato Lectin | Vector Laboratories | FL-1321 | concentration 2.5 µl / embryo |
| Alexa Fluor-594 (Donkey Anti-Rat) | Jackson Immunoresearch | 712-585-150 | concentration 1:200 |
| Microinjection Needle | Origio Mid Atlantic Devices | C060609 | |
| Mineral Oil | Fisher Scientific | BP26291 | |
| 1 ml syringe | Fisher Scientific | 03-377-20 | |
| Clay Blocks | Fisher Scientific | HR4-326 | |
| Surgical Tape | Fisher Scientific | 18-999-380 | |
| PBS | Fisher Scientific | NC9763655 | |
| Hair Removal Product | Fisher Scientific | NC0132811 | |
| Surgical Scissors | Fine Science tools | 14084-08 | |
| Fine Forceps | Fine Science tools | 11064-07 | |
| Surgical Marking Pen | Fine Science tools | 18000-30 | |
| Right angle forceps (for hysterectomy) | Fine Science tools | 11151-10 |
Références
- Abrahamson, D. R., Robert, B., Hyink, D. P., St John, P. L., Daniel, O. P. Origins and formation of microvasculature in the developing kidney. Kidney international. Supplement. 67, S7-S11 (1998).
- Sims-Lucas, S., et al. Endothelial Progenitors Exist within the Kidney and Lung Mesenchyme. PloS one. 8 (6), e65993(2013).
- Dressler, G. R. Advances in early kidney specification, development and patterning. Development. 136 (23), 3863-3874 (2009).
- Costantini, F. Genetic controls and cellular behaviors in branching morphogenesis of the renal collecting system. Wiley Interdiscip Rev Dev Biol. 1 (5), 693-713 (2012).
- Costantini, F., Kopan , R. Patterning a complex organ: branching morphogenesis and nephron segmentation in kidney development. Dev Cell. 18 (5), 698-712 (2010).
- Das, A., et al. Stromal-epithelial crosstalk regulates kidney progenitor cell differentiation. Nat Cell Biol. 15 (9), 1035-1044 (2013).
- Rymer, C., et al. Renal blood flow and oxygenation drive nephron progenitor differentiation. Am J Physiol Renal Physiol. , (2014).
- Shah, S. R., et al. Embryonic mouse blood flow and oxygen correlate with early pancreatic differentiation. Developmental biology. 349 (2), 342-349 (2011).
- Andres, A. C., et al. EphB4 receptor tyrosine kinase transgenic mice develop glomerulopathies reminiscent of aglomerular vascular shunts. Mech Dev. 120 (4), 511-516 (2003).
- Wagner, R., et al. High-resolution imaging of kidney vascular corrosion casts with Nano-CT. Microsc Microanal. 17 (2), 215-219 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon