Method Article
En Utero Inyecciones intra-cardiaca-lectina de tomate en embriones de ratón para medir el flujo sanguíneo renal
En este artículo
Resumen
This manuscript describes a technique for visualization of the developing vasculature. Here we utilized in utero intra-cardiac FITC-labeled tomato lectin microinjections on mouse embryos. Using this technique, we delineate the perfused and unperfused vessels throughout the embryonic kidney.
Resumen
La formación y la perfusión de desarrollar vasos sanguíneos renales (aparte de los glomérulos) han sido poco estudiados en gran medida. Como vasculatura se desarrolla a través de la angiogénesis (la cual es la ramificación fuera de los grandes vasos) y vasculogénesis (de novo la formación de vasos), técnicas de mapeo de perfusión como moldes de resina, vivo de imágenes de ultrasonido en y micro-disección se han limitado en la demostración de las relaciones íntimas entre estos dos procesos y estructuras renales en desarrollo en el embrión. Aquí se describe el procedimiento de In Utero intra-cardíacos guiadas por ultrasonido marcados con FITC microinyecciones lectina de tomate en embriones de ratón para medir la ontogenia de la perfusión renal. Tomate lectina (TL) se perfundió todo el embrión y los riñones cosechado. Los tejidos fueron co-teñidos para diversas estructuras renales que incluyen: progenitores nefrona, estructuras nefrona, el epitelio uretral y la vasculatura. A partir de E13.5 vasos de gran calibre se perfundieron, sin embargo periféricavasos permanecieron no perfundido. Por E15.5 y E17.5, pequeños vasos periféricos, así como glomérulos comenzado a ser perfundido. Esta técnica experimental es fundamental para estudiar el papel de la vasculatura y el flujo sanguíneo durante el desarrollo embrionario.
Introducción
Durante el desarrollo embrionario dos procesos discretos, pero simultáneas, vasculares tienen lugar: la angiogénesis, el proceso por el cual un recipiente crece de un vaso principal, y la vasculogénesis pre-existente, que es una formación de novo de los vasos a partir de progenitores endoteliales residenciales 1,2. Respectivamente, el primero es sinónimo de flujo de sangre, mientras que el último se cree que tener lugar en gran medida en ausencia de la misma.
Simultáneamente a la formación de vasos sanguíneos, un proceso cíclico y dinámico de la síntesis renal de células progenitoras, la proliferación y la diferenciación comienza a desarrollarse en el día embrionario 9,5 (E9.5). En este punto la yema ureteral (UB) invade dorsal en los alrededores mesénquima metanéfrico (MM), y continúa hasta el nacimiento 3. Repetida de ramificación de la UB en condensación rápidamente mesénquima metanéfrico tapa comienza la formación de las unidades funcionales del riñón, la nefrona. Con cada nueva generación de la UB y nephron, las generaciones mayores son desplazados en regiones corticales y medulares interiores, donde luego se someten a más de maduración y diferenciación dentro de los entornos principalmente vascular-densos. Como se desprende de Dressler et al., 3, este proceso embriológico se precipita por la señalización inductiva, como diafonía entre UB y MM, y una miríada de factores extracelulares 3-6. Dos factores extracelulares recientemente investigados dentro del páncreas y los riñones incluyen el desarrollo de la tensión de oxígeno y el flujo sanguíneo 7,8. Este último será discutido en más detalle a continuación en relación con el desarrollo del riñón.
Con el fin de exponer el papel inductivo que el flujo sanguíneo potencialmente juega en la diferenciación de células progenitoras nefrona, así como en otros procesos de organogénesis, métodos precisos y exactos de mapeo de flujo de sangre embrionaria es imprescindible.
Los métodos alternativos para medir el flujo sanguíneo incluyen la prescripción de ultrasound de imágenes y resina yesos 9,10. En conclusión, estos modos se ha demostrado que ser inherentemente carente de su capacidad para dar a conocer simultáneamente yuxtaposiciones temporales y espaciales entre el flujo sanguíneo y diferenciación de células madre. Moldes de resina, por ejemplo, proporcionan un modelo válido de patrón embarcación dentro de los tejidos adultos, sin embargo en los vasos inmaduros, como con los puntos de tiempo embrionarias, los vasos son muy poco desarrollado y con goteras. Por lo tanto, la resina arroja fallar para mantener dentro de los vasos pequeños, a menudo porosa.
Por estas aparentes obstáculos, entre otros, se optó por incorporar guiada por ultrasonido vivo intra-cardíacos lectina de tomate embrionario (TL) en microinyecciones en nuestras investigaciones sobre el desarrollo del riñón. En este procedimiento utilizamos una sonda de ultrasonido para guiar sincrónicamente una aguja montada micropipeta llena con 2,5 l de solución de TL en el ventrículo izquierdo de embriones de ratón en los puntos de E11.5, E13.5, E15.5, E17.5 y de tiempo. E170.5 es la última edad de desarrollo como las agujas no son lo suficientemente fuertes como para penetrar en el embrión más desarrollado.
Las ventajas de este método de microinyección son abundantes. Microinyección guiada por ultrasonido permite la colocación precisa de una aguja de inyección dentro del ventrículo izquierdo embrionario, la expulsión pasiva y controlada de solución en el corazón de la animal, un daño mínimo al corazón y los tejidos circundantes, y la evitación de la insuficiencia cardiaca súbita y la muerte de la embrión antes de la perfusión de todo el cuerpo. Con el uso de un TL marcado con FITC, cualquier vasculatura perfundido mantendrá el marcador a lo largo de su membrana apical endotelial. En combinación con la inmunohistoquímica, utilizando Pecam (CD31, plaquetas molécula de adhesión celular endotelial) y varios otros marcadores vasculares, somos capaces de distinguir claramente entre los vasos perfundidos y un-perfundido, así como caracterizar cualquier tinción aberrante de los tejidos circundantes.
Protocolo
NOTA: La Universidad de Pittsburgh Institucional Cuidado de Animales y el empleo Comisión aprobó todos los experimentos.
1. Elaboración de Instrumentos Ultrasonido-microinyección y embriones
- Establecer el escenario, montaje, y la sonda (Figura 1), así como los instrumentos quirúrgicos (Figura 2). Solución salina tamponada (PBS) Place solución de fosfato (pH 7,4) en un baño a 37 ° C el calentamiento. Llenar aguja de microinyección completamente con aceite mineral, usando 1 ml jeringa conectada a un segundo G aguja flexible 25, a través de su base.
- Fijar la aguja en la rotación de montaje del brazo, y la aguja vacía de solución de aceite mineral. Vuelva a llenar con 2,5 l de solución TL. Asegúrese de que no hay burbujas de aire dentro de la aguja de inyección. Gire el brazo de la aguja hacia la pared, fuera de los escenarios.
- Anestesiar la madre embarazada en la cámara de anestesia mediante infusión continua de isoflurano. Cuando la madre está inconsciente, la transferencia de la anestesia para tubo nariz colocada en el caudal lado del escenario, y el lugar madre en posición supina, con el hocico en el tubo de la nariz para permitir la continuación de un estado totalmente anestesiado.
- Extremidades de cinta en ángulos de 45 °, o con las manos y los pies descansados y posicionados overtop ECG pestañas / monitor de temperatura. Es importante que la presa embarazada se monitoriza continuamente para asegurar que la anestesia es suficiente y que la pomada en aplicada a los ojos para reducir el secado.
- Aplique el producto a través de la eliminación del vello inferior del abdomen de la madre, limpie suavemente con hisopos de algodón seco, y luego de nuevo con un 70% hisopos de algodón con etanol saturado para eliminar cualquier exceso de producto y el cabello. Asegúrese de limpiar la piel abdominal fuera de todo el pelo en el sitio de la incisión (Figura 3).
- Realice una laparotomía en la madre embarazada utilizando pinzas y tijeras quirúrgicas finas. Tenga cuidado de no cortar ninguna vasos principales u órganos viscerales. Hacer primero, incisión recta de epidermis 1,5-2 cm por encima de la vagina y continuar cortar hacia las costillas para approximately 2-3 cm. Exponer la membrana subcutánea, busque la línea alba ("línea blanca") (Figura 3), y corte paralela a la incisión inicial, a lo largo de la misma longitud, para exponer interno órganos viscerales y sáculos uterinos.
2. Extracción de embriones
- Utilice bastoncillos de algodón de 6 pulgadas de maniobrar madre y embriones. Presione suavemente (no la fuerza) en la piel con aplicador para manipular primer embrión de la apertura de la incisión. Después de la extracción del primer sáculo embrión, suave y lentamente tire del resto del cuerno uterino a través y hacia el exterior de la madre. Evite tirar intestino u otros órganos a través de la incisión en esta etapa.
- Cuantificar los embriones y coloque suavemente cuerno uterino izquierdo de nuevo en madre. Entonces comenzar a colocar el cuerno uterino derecho de nuevo en madre a partir de la más lejana sáculo embrión de la vagina en el cuerno y se mueve hacia abajo. Continúe hasta que sólo dos embriones permanecen expuestos (Fifigura 4). Por último, los embriones de posición en una columna anterior y paralela a la línea de incisión, siendo consciente de no cortar la circulación uterina.
- Coloque bloques de arcilla y posición entre los brazos y el cuerpo, así como las piernas y la cola. Asegúrese de que las superficies de arcilla son aproximadamente la altura de laparotomía. Moje la placa de Petri fenestrado con 37 ° C PBS.
- Agarre extienden fórceps con la mano derecha y el plato de Petri fenestrado con la mano izquierda (fenestración paralelo a los embriones) y llevar cerrado fórceps ~ 5-cm a través de la fenestración, desde la parte superior de la placa de Petri. Fórceps abierto completamente sin desgarrar la malla fenestración.
- Maniobra manos por encima de los embriones y enfocar la vista en los dos sáculos embrión. Sin (o poco) tocando sáculos con mallado fenestración o fórceps, deslice a través de ranura y fija una placa de Petri en el abdomen de la madre. Con pinzas todavía extendidos, manipular malla fenestrado para asentarlo en ambos lados y en la base de cada embrión (Figura 5 ) y tire de pinzas de apertura de hendidura.
- Luego, coloque goma azul que contiene la pared en una placa de Petri, sin pellizcar o dañar embriones (Figura 6). Hacer bloques de arcilla estén equilibrando firmemente placa de Petri, embrión, y la pared que contiene goma. Por último, llenar el plato de Petri con 37 ° C PBS hasta que los embriones se sumergen por completo (Figura 6), mientras que el control de fugas en el mallado fenestrado.
Procedimiento 3. Inyección
- Etapa de inyección inferior con la madre y embriones abajo utilizando la perilla de ajuste de nivel Z (Figura 1) y luego gire la aguja de inyección y montaje en brazo y se alinea directamente con sonda de ultrasonido, con ½ aguja cm a la izquierda y debajo de la punta de la sonda (Figura 7) . Empuje aguja-brazo (no de la aguja) 45 ° lejos de la sonda. Tenga cuidado de no golpear la punta de la aguja con la sonda plato o una ecografía.
- Levante etapa de inyección de nuevo a la altura original, con ultrasonido pbata directamente encima de la sonda embriones debe estar sumergida ligeramente y dentro de 3-4 mm de tejido embrionario. Utilice X & Y mandos de ajuste etapa (Figura 8) para modificar la posición del embrión / madre / etapa de localizar sistemáticamente el corazón embrionario de latir.
- Directamente Centro de pantalla del ultrasonido observar un objetivo central negro marcador dibujado (*). Busque ventrículo izquierdo (preferible) o atrio utilizando los botones de ajuste etapa X & Y (Figura 8) y luego subir o bajar del escenario con el botón giratorio en la etapa de posicionar objetivo inyección con precisión sobre el marcador central negro en la pantalla del ultrasonido.
- Utilice la perilla de ajuste etapa X para mover embrión hacia la derecha, fuera de la pantalla del ultrasonido. Vuelva a colocar la aguja de microinyección y el brazo en su lugar, ½ cm de distancia de y 90 ° a la sonda de ultrasonido (Figura 7).
- El uso de microinyección montaje mandos de ajuste (Figura 9C-G), aguja posición con la punta claramente alDiseñada con el marcador central. Ajustar el ángulo de inyección (usando perillas en la figura 9C y EG), y X, Y, Z y vectores de micro-aguja para asegurar punta de la aguja se centra en el plano correcto. Repliegue aguja de microinyección usando únicamente el mando de "inyección" (Figura 9F), cuidado de no ajustar otras dimensiones.
- De nuevo, usando únicamente el ajuste fino perilla etapa movimiento embrión X de nuevo bajo la sonda, con la meta exactamente en el punto central de la pantalla del ultrasonido. Asegúrese de que el ventrículo izquierdo es ahora exactamente en la misma X, Y, y Z avión.
- A continuación, con montaje sólo la perilla de "inyección" en la microinyección, perfore lentamente embrión con la aguja de microinyección y llevar lentamente la punta hacia el ventrículo izquierdo. Inyectar la totalidad de 2,5 l de solución TL en el ventrículo izquierdo o hasta que suena la señal vacías, mediante la celebración de "vacío" y pulsando "llenar" una vez (Figuras 2A y B). En este momentode la inyección observar una sombra que emana de la punta de la aguja que es el TL entrar en la cámara cardiaca (Figura 10). A la inversa, retraer rápidamente aguja de microinyección girar la "inyección" perilla (Figura 9F) en la microinyección se monta cuando la inyección se ha completado.
- Continúa en el próximo embrión y repita este procedimiento para los embriones restantes que siguen esta serie de pasos y finalmente colocar los embriones finales de nuevo en el abdomen de la presa. Cambie la anestesia a la caja de la cámara y mover suavemente madre aquí durante 15 minutos desde el momento de la última inyección.
4. La recolección de embriones y Análisis
- Sacrificar presa a través de la dislocación cervical. Ampliar la laparotomía para eliminar fácilmente los cuernos uterinos de la madre. Mantener los embriones dentro de saco uterino. Coloque embriones en PBS enfriado.
- Diseccionar embriones de saco uterino (si el tejido cobrar necesaria para el genotipado) y coloque todo el embrión in 4% paraformaldehído (PFA) durante la noche, y luego en el 30% de sacarosa durante la noche, se congele en criostato seccionar medio. A continuación, corte la criosección y colocarlo en portaobjetos para el análisis inmunohistoquímico. Opcionalmente, utilice toallitas para todo el montaje por deshidratación en el 100% de metanol, después de la fijación en el 4% PFA.
- Para el análisis inmunohistoquímico colocar los cryosections en PBS para eliminar la OCT. Entonces bloquear las secciones con 10% de suero normal de burro durante 30 min. A continuación, agregue PECAM anticuerpo primario a dilución 1: 100 la noche a 4 ° C. Al día siguiente, se lavan los portaobjetos en PBT 3 veces durante 10 minutos cada uno y agregar burro anti rata 594 secundaria e incubar durante 1 hora a temperatura ambiente.
NOTA: Esta es una técnica muy exigente que requiere la optimización y coordinación de la ecografía y la microinyección. Hay una curva de aprendizaje muy grande en relación con esta técnica y requiere cuatro a seis semanas de inyecciones mentor antes de que uno se convierte en dominio.
Resultados
Formación Vascular precede flujo en el desarrollo del riñón
Una mayoría de tejido embrionario (incluyendo el riñón) contiene una vasculatura densa (ambos no perfundido y perfundidos), incluso en los primeros puntos de tiempo embrionarias. Para un mejor calibre y analizar el flujo de sangre dentro del riñón en desarrollo se utilizó un método de In Utero microinyecciones intracardiaco embrionarias. Con el uso de un ultrasonido de alta resolución para identificar el corazón embrionario a través de E11.5 E17.5, y después de la extracción y la exposición de un solo sáculo uterina a través de una laparotomía, hemos sido capaces de inyectar 2,5 l de TL (isotiocianato de fluoresceína (FITC) y conjugado).
Hemos encontrado el mayor éxito inyectando E13.5 y E15.5 puntos temporales embrionarias, con una tasa de éxito de alrededor de ~ 80% a 90%, respectivamente. Debido a la presencia de un corazón relativamente inmaduro en E11.5 y una existencia de cartílago densa y la formación de hueso en E17.5, la TI periféricome puntos son comparativamente difícil de inyectar, con una probabilidad sustancialmente menor de éxito en comparación con los puntos de tiempo embrionarias medias. Uno puede esperar que por lo menos ~ 50% y ~ 30% de éxito con E11.5 y E17.5 tiempo puntos, respectivamente.
Por tejido co-etiquetado con Pecam (CD31), un marcador endotelial universales, somos capaces de clasificar cualitativamente vasos y tejidos fluorescentes en tres grupos: vasculatura perfundido (Pecam positivo y TL positivo), la vasculatura no perfundido (Pecam positivo), y de manera aberrante perfundido estructuras (TL positivo). Este patrón de tinción particular, nos permite distinguir el espacio entre las áreas de perfusión y un-perfusión (Figura 11).
En E11.5, descubrimos que los vasos perfundidos encapsulan el riñón en desarrollo en un patrón en forma de banda sin tener que penetrar en el órgano (Figura 12B). Por E13.5, los grandes vasos fueron perfundidos con algunos de los más pequeñosvasos accesorios tinción con TL (Figura 12C). La tinción también podría ser visto a lo largo de algunos de epitelio ureteral, esto puede ser ya sea de glomérulos que ya son perfundidos o debido a la permeabilidad inherente de los vasos embrionarias tempranas. Por E15.5 fueron perfundidos vasos principales, sin embargo, un gran número de glomérulos también se pudo observar que sostiene la mancha TL, lo que sugiere que el filtrado significativa se está produciendo (Figura 12D). También en este tiempo apuntar un número de vasos de menor calibre aparecerá perfundidos, aunque una proporción significativa de la zona nefrogénica exterior parece estar desprovisto de flujo de sangre. Por último, sin embargo, por E17.5 una mayoría del riñón se perfundió a excepción de la vasculatura de la zona nefrogénica, que es predominantemente carente de perfusión (sin embargo densa PECAM en los vasos positivos), indicando por lo tanto una ausencia de la angiogénesis en las regiones periféricas. Vasos de menor calibre contener TL y el número promedio de los glomérulos perfundidos tiene dramáticamente enaumentado en comparación con los puntos de tiempo anteriores (Figura 12E).

Sonda de la figura 1. Ultrasonido etapa quirúrgica, sistema de microinyección, sistema ferroviario, y ECG / monitor Temperatura configuración básica.

Figura 2. Equipo necesario quirúrgico, soluciones y dispositivos. Bastoncillos de algodón (A). (B) La extensión (anillo) fórceps. (C) Tijeras quirúrgicas. (D) pinzas de punta roma. (E) unas pinzas finas. (F) La microinyección aguja (Origio, # C060609). (H) de inyección / Llenar controlador. (I) tampón fosfato salino (PBS). (J) aceite mineral (Sigma Aldrich).

Figura 3. Una laparotomía de 2 cm se realiza en madre anestesiada, dejando al descubierto la capa subcutánea (pared abdominal) por encima del útero. Utilizando las tijeras quirúrgicas y unas pinzas finas, exponga la línea alba y hacer incisión paralela al corte epidérmica. Haga clic aquí para ver una versión más grande de la figura.

Figura 4. 1-2 sáculos uterinos E15.5 extraídos a través de incisión de laparotomía y expuestos. Haga clic aquí para ver una mayorversión de la figura.

Figura 5. Expuesto sáculos uterinos guiados por la ranura de fenestrado placa de Petri con unas pinzas que se extienden. Fenestrado mallado asientos cómodamente en la base de los sáculos.

Figura 6. Pared que contiene azul situado a la derecha de sáculos uterinos. Cápsula de Petri llena con 37 ° C PBS hasta embriones y muro de contención están completamente sumergido. Bloques de arcilla colocados con seguridad bajo placa Petri / embrión entre los brazos y el cuerpo y las piernas y la cola.

Figura 7. Positio Sistema de inyección Ned ½ cm a la izquierda y abajo, y 90 ° a la sonda de ultrasonido.

Figura 8. Etapa mecanismos de ajuste X e Y.

Figura 9. vaciado / llenado dispositivo, sistema de microinyección y estadificar montaje. (A) botón Fill. (B) botón Inyectar. (C) Mando de ajuste del ángulo de la aguja circular. Botón de ajuste (E) Fine X. (F) Mando "inyección". Botón de ajuste (G) X Curso. (H) Etapa giratoria perilla de ajuste de altura.
98fig10.jpg "/>
Imagen ecográfica de E15.5 intracardiaca TL microinyección. Punta de la aguja Figura 10. Se posiciona dentro de las cavidades cardíacas, solución TL se indica mediante negro sombra dentro de las dos cámaras. Pericardio y la cavidad pericárdica se diferencian fácilmente.
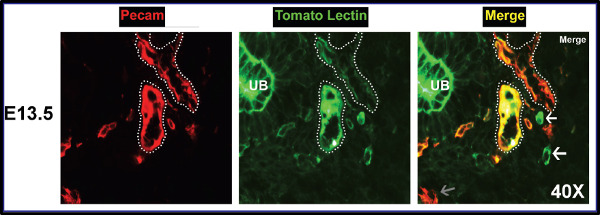
Figura 11. Las áreas entre la perfusión, unperfusion, y tinción aberrante discernido. El primer panel muestra la mancha Pecam. El panel central muestra la mancha TL sobre exactamente la misma zona de tejido. Yema ureteral es aberrante manchada; principales vasos están encerrados por líneas de puntos blancos. El último panel es la fusión. Las flechas blancas indican derrame de los vasos, y flechas grises demuestran una transición hacia un recipiente convertirse perfusión. Estructuras amarillas representan vasculatura totalmente perfundido.oad / 52398 / 52398fig11large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de la figura.

Figura 12. Embriones y ontogenia perfusión renal se investiga. (A) Total embrión E11.5 es perfundido, con los vasos muy periférica a las regiones de la cabeza y de la cola que sujetan la TL. (B) los buques perfundidos se observaron rodea pero no incorporados en el riñón en desarrollo en E11.5 en un patrón en forma de banda, también hay una gran cantidad bastante de tinción difusa en este punto. (C) E13.5 riñón muestra grandes, vasos de gran calibre son perfundidos a lo largo de los riñones (flecha blanca y amarilla), con la perfusión ausente dentro de la zona nefrogénica (línea punteada blanco). (D) E15.5 riñón muestra perfusión a lo largo de pequeño calibre, vasos periféricos (flechas amarillas),en algunos glomérulos (flechas blancas), y de nuevo la ausencia de perfusión en Mantel riñón periférica. (E) del riñón E17.5 muestra vasta perfusión durante todo glomérulos (flechas blancas) y vasos de pequeño calibre (flechas amarillas). La zona nefrogénica es indistinguible del resto del riñón con este aumento. Por favor, haga clic aquí para ver una versión más grande de la figura.
Discusión
Anestesia Microinyección y marco de tiempo
Con respecto a la anestesia de la madre, es esencial para mantener constante el flujo de aire (2-3 L / min) y a baja PSI. El flujo del sedante debe mantenerse a aproximadamente 1,75 a 2 L / min. Al mismo tiempo, los plazos en que las inyecciones se realizan deben ser monitoreados y controlados para con cada camada de cerca. Para cada camada el procedimiento de inyección debe mantenerse en 45 min. La importancia de este límite de tiempo es de suma importancia para el experimento, ya que cada embrión se debe mantener dentro de un rango de frecuencia cardiaca constante, normal con el fin de facilitar la perfusión controlada y invariable en todo el cuerpo y órgano de interés. Hemos encontrado que el alargamiento de las inyecciones de resultados en los resultados y las fluctuaciones de dudosos en los patrones de perfusión entre embriones y baja los tipos de inyecciones de éxito (es decir, la frecuencia cardíaca lenta, muerte cardíaca). Por último, después de la inyección final dentro de la camada, es esencialpara permitir aproximadamente 15 minutos antes de que se cosechan embriones para facilitar la correcta, la perfusión completo dentro de cada embrión.
Tratamiento y cuidado de embriones Procesal
Durante la extracción de los embriones, hemos encontrado mayores tasas de éxito con inyecciones que se logra mediante la constante atención a la salud y la integridad del revestimiento del útero y los embriones en general durante la extracción del embrión. El uso de los bastoncillos de algodón delicadas (saturadas con PBS) para manipular y maniobrar el saco uterino y sáculos son imprescindibles para garantizar la supervivencia de la madre y los embriones durante todo el procedimiento. En primer lugar, es importante asegurarse de que la integridad física del útero y la placenta se mantiene correctamente. Evitar contorting los sáculos de manera que obstruya el flujo de sangre a los embriones o causar roturas significativas en los vasos sanguíneos que suministran el flujo de sangre a la placenta. Esto se puede lograr mediante la extracción de un maximum de 1-2 embriones a la vez (a menos que la extracción de todo el saco uterino para el recuento inicial) y mediante la colocación de aplicadores de distancia de los principales vasos sanguíneos en la base de la placenta.
Ubicación de la inyección del sitio embrionarias
Guiar la aguja de microinyección en el lugar adecuado con la máquina de ultrasonido también es fundamental para cada intento de inyección. La atención cuidadosa se debe dar a la localización y centrado del ventrículo izquierdo en el marcador central. Después de esto, la aguja debe estar situado y centrado precisamente en el marcador central así para alinear la aguja y el lugar de la inyección en el mismo plan de X y Y. Una vez completado esto, lentamente dibujar la punta de la aguja más cerca del sitio de la inyección y evitar la aplicación de una tensión indebida en el saco pericárdico y el corazón. Esto se hace permitiendo que la aguja para pasar gradualmente a través de capas de tejido, en lugar de forzar el paso de la aguja a través de ellos. Durante la inyección, también es importante para look por una sombra negro que emana de la punta de la aguja (Figura 10). Esto es indicativo de la solución TL llenar el ventrículo. Si la punta de la aguja está en la posición correcta, la sombra continuamente debe aparecer y desaparecer como TL es expulsada a la aorta. Sin embargo, si la cavidad pericárdica parece engorge, esto es indicativo de que la aguja es desviado del ventrículo izquierdo y la solución TL está llenando la cavidad pericárdica que rodea el corazón. Este es un error común que se remedia fácilmente por el reposicionamiento de la aguja de inyección en su plano X e Y, con los ajustes leves que tienen lugar con la aguja todavía dentro del embrión. Evitar la extracción de la aguja del embrión en esta etapa.
Guiada por ultrasonido en las limitaciones de microinyección vivo
Inherentemente, la microinyección de ultrasonido posee una serie de limitaciones técnicas fundamentales. , El volumen de la aguja primero y más importante microinyeccióncapacidad restringe el rango de edad de las inyecciones a E17.5 en el ratón. 2,5 l de solución de TL se ha demostrado en nuestros estudios para perfundir completamente embriones hasta E15.5. Sin embargo, justo después de este punto en el tiempo, el TL relación de volumen de sangre que se convierte a minúsculas y se diluyó a etiquetar de manera efectiva las membranas endoteliales renales periféricos. Por lo tanto, una imagen disminuida de flujo de sangre está presente en inyecciones en los puntos de tiempo posteriores. Además, la formación de hueso y cartílago en el embrión crea una barrera natural para la punta de la aguja, lo que conduce a tiempos de inyección alargado y grietas frecuentes en la cabeza de la aguja. Estas limitaciones pueden ser superadas mediante la utilización de un sistema novedoso inyecciones con mayor fuerza la aguja y el volumen capacidades.
Técnicas embrionarias alternativas de mapeo de flujo sanguíneo
Hasta la fecha, los métodos alternativos de mapeo embrionario flujo sanguíneo ratón incluyen la implementación de moldes de resina, la tinción inmunohistoquímica y alta resoluc ecografía de iones. Como moldes de resina (con la integración de técnicas avanzadas de imagen) son actualmente la alternativa más popular, esto se discutirá con más detalle a continuación. Moldes de resina permiten la creación de representaciones tridimensionales precisas de flujo dentro de los órganos postnatal. Sin embargo, poco éxito ha tenido con el tejido renal prenatal de imágenes debido a la vasculatura arterial poroso y limitaciones en la resolución. En comparación, las manchas TL conjugados permiten la unión a antígenos de la membrana endotelial que conduce a un mayor grado de precisión. En otros casos, la viscosidad de resina fundido prematuramente trunca el flujo en los vasos pequeños glomérulos y los lechos capilares, creando limitación de investigación a ampliaciones superiores. A aumentos inferiores, esta técnica es claramente viable a establecer patrones de flujo en relación con las regiones en desarrollo. Por el contrario, TL permite el análisis de alta resolución de flujo de sangre en relación con las estructuras de desarrollo a nivel celular.
ent "> aplicación Futuro y direccionesNuestros datos sugieren que el flujo sanguíneo y la oxigenación son factores críticos en lo que respecta a la diferenciación de nefronas progenitor. Para aclarar aún más su papel en el desarrollo renal, las investigaciones futuras deben delinear mecanismos anatómicos subyacentes que precipitaron este proceso fisiológico, así como examinar las vías de señalización de la transcripción que median este fenómeno también. Una hipótesis, en lo que respecta a la reducción de la brecha entre fenómeno y mecanismo, es que los agregados de células musculares lisas y pericitos desempeñan papeles contributivas en orquestar el truncamiento transitoria del flujo sanguíneo en las regiones de células madre de órganos en desarrollo. Para probar esto, además de tinción y el análisis de inmunofluorescencia deben llevarse a cabo con un enfoque en estos tipos de células en el borde de la zona nefrogénica. En términos de las futuras investigaciones de las vías de señalización subyacente, nos gustaría explorar el papel de los factores inducibles por hipoxia y laVon Hippen Lindau vías de señalización. Ambos en gran medida han sido implicados en toda la literatura como jugar un importante papel en el mantenimiento de inducción hipóxica y ambientes oxigenados dentro de las regiones de células madre (en gran parte ser visto hipóxica) y áreas de diferenciación (áreas con mayor necesidad de oxigenación), respectivamente. Además, nos gustaría interrogar el papel de la eritropoyetina (EPO) en la mediación de los procesos de angiogénesis y vasculogénesis durante todo el desarrollo vascular renal. La EPO es una glicoproteína renal que juega un papel crítico en la diferenciación endotelial y mantenimiento. Su papel en la sangre mediada endotelial diferenciación es en gran parte desconocido. Por último, nos gustaría llevar a cabo en los experimentos de microinyección vivo con compuestos vasodilatación para fortalecer aún más la validez de estas investigaciones.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
The authors would like to thank Dr. George Gittes for advice and expertise throughout this study. SSL was supported by an American Heart Association fellowship (11POST7330002). Further to this SSL and this study was supported by an NIDDK Mentored Research Scientist Development Award (DK096996) and by the Children’s Hospital of Pittsburgh.
Materiales
| Name | Company | Catalog Number | Comments |
| DAPI | Sigma Aldrich | 022M4004V | concentration 1:5,000 |
| Pecam | BD Biosciences | 553370 | concentration 1:100 |
| FITC-Tomato Lectin | Vector Laboratories | FL-1321 | concentration 2.5 µl / embryo |
| Alexa Fluor-594 (Donkey Anti-Rat) | Jackson Immunoresearch | 712-585-150 | concentration 1:200 |
| Microinjection Needle | Origio Mid Atlantic Devices | C060609 | |
| Mineral Oil | Fisher Scientific | BP26291 | |
| 1 ml syringe | Fisher Scientific | 03-377-20 | |
| Clay Blocks | Fisher Scientific | HR4-326 | |
| Surgical Tape | Fisher Scientific | 18-999-380 | |
| PBS | Fisher Scientific | NC9763655 | |
| Hair Removal Product | Fisher Scientific | NC0132811 | |
| Surgical Scissors | Fine Science tools | 14084-08 | |
| Fine Forceps | Fine Science tools | 11064-07 | |
| Surgical Marking Pen | Fine Science tools | 18000-30 | |
| Right angle forceps (for hysterectomy) | Fine Science tools | 11151-10 |
Referencias
- Abrahamson, D. R., Robert, B., Hyink, D. P., St John, P. L., Daniel, O. P. Origins and formation of microvasculature in the developing kidney. Kidney international. Supplement. 67, S7-S11 (1998).
- Sims-Lucas, S., et al. Endothelial Progenitors Exist within the Kidney and Lung Mesenchyme. PloS one. 8 (6), e65993(2013).
- Dressler, G. R. Advances in early kidney specification, development and patterning. Development. 136 (23), 3863-3874 (2009).
- Costantini, F. Genetic controls and cellular behaviors in branching morphogenesis of the renal collecting system. Wiley Interdiscip Rev Dev Biol. 1 (5), 693-713 (2012).
- Costantini, F., Kopan , R. Patterning a complex organ: branching morphogenesis and nephron segmentation in kidney development. Dev Cell. 18 (5), 698-712 (2010).
- Das, A., et al. Stromal-epithelial crosstalk regulates kidney progenitor cell differentiation. Nat Cell Biol. 15 (9), 1035-1044 (2013).
- Rymer, C., et al. Renal blood flow and oxygenation drive nephron progenitor differentiation. Am J Physiol Renal Physiol. , (2014).
- Shah, S. R., et al. Embryonic mouse blood flow and oxygen correlate with early pancreatic differentiation. Developmental biology. 349 (2), 342-349 (2011).
- Andres, A. C., et al. EphB4 receptor tyrosine kinase transgenic mice develop glomerulopathies reminiscent of aglomerular vascular shunts. Mech Dev. 120 (4), 511-516 (2003).
- Wagner, R., et al. High-resolution imaging of kidney vascular corrosion casts with Nano-CT. Microsc Microanal. 17 (2), 215-219 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados