Method Article
Activation et évaluation de NLRP3 Inflammasome activité de l'IL-1β Utilisation dans des cellules dendritiques humaines dérivées de monocytes
Dans cet article
Résumé
Les cellules dendritiques (DCs) sécrètent de l'IL-1β en réponse à la reconnaissance de la purine TLR8 synthétique, R848, suivie de l'activation de l'inflammasome NLRP3 avec nigéricine, par conséquent, l'IL-1β peut être utilisé pour mesurer l'activité de inflammasome NLRP3. Coloration des cytokines intracellulaires, immuno, et ELISA sont utilisés pour mesurer avec précision NLRP3 inflammasome amorçage et l'activation par l'IL-1β expression.
Résumé
Les processus inflammatoires résultant de la sécrétion de l'interleukine (IL) -1 cytokines de la famille par les cellules immunitaires conduisent à l'inflammation locale ou systémique, le remodelage et la réparation tissulaire, et le contrôle virologique 1, 2. L'interleukine-1β est un élément essentiel de la réponse immunitaire innée et contribue à éliminer les pathogènes envahisseurs, tout en empêchant l'établissement d'une infection persistante 5.1.
Inflammasomes sont la plate-forme de signalisation clé pour l'activation de l'enzyme de conversion de l'interleukine 1 (ICE ou la caspase-1). L'inflammasome NLRP3 nécessite au moins deux signaux dans les PED pour provoquer l'IL-1β sécrétion 6. Pro-IL-1β expression de la protéine est limitée dans les cellules au repos; par conséquent, un signal d'amorçage est nécessaire pour l'IL-1β transcription et l'expression de la protéine. Un second signal détecté par les résultats NLRP3 dans la formation de la protéine multi-NLRP3 inflammasome. La capacité des cellules dendritiques à responsabilitéd pour les signaux nécessaires pour l'IL-1β sécrétion peut être testée en utilisant une purine synthétique, R848, qui est détecté par TLR8 dans monocyte humain dérivé des cellules dendritiques (moDCs) aux cellules de premier, suivie de l'activation de l'inflammasome NLRP3 avec la toxine bactérienne et ionophore de potassium, la nigéricine.
Monocytes PED dérivés sont facilement produites dans la culture et fournissent beaucoup plus de cellules que des DC myéloïdes humaines purifiées. La méthode présentée ici se distingue d'autres dosages de inflammasome en ce qu 'il utilise en humaine in vitro, à la place de la souris dérivée, DCs permettant ainsi l'étude de l'inflammasome dans la maladie humaine et l'infection.
Introduction
Activation du système immunitaire inné est nécessaire pour orienter les réponses immunitaires adaptatives cours de l'infection, la maladie et la vaccination 7. Les cellules dendritiques sont le plus puissant antigène présentant des cellules du système immunitaire inné; ils sont spécialisés pour l'absorption des antigènes, la migration vers les ganglions lymphatiques, et l'activation des naïfs CD4 + et CD8 + cytolytiques des cellules T 8-10. Pour activer la détection rapide des agents pathogènes du système immunitaire inné utilise de nombreuses lignées germinales codé reconnaissance de formes récepteurs (PRR) qui reconnaissent pathogènes conservé motifs dérivés ou des marqueurs d'accueil dérivé de stress cellulaire et les dommages. Toll récepteurs (TLR) sont liés à la membrane reconnaissance de formes récepteurs qui reconnaissent certains pathogène phagocyté extracellulaire des motifs associés moléculaires (PAMP) et danger motifs moléculaires associés (atténue). En revanche clin d'œil comme récepteurs (NLR) sont cytosolique et de répondre à un large éventail de PAMP et Damps. Nod comme récepteurs représenter une deuxième ligne de défense contre les agents pathogènes qui échappent surface de la cellule et PRR d'endocytose. L'interaction de l'agent pathogène dérivé, ou «danger» associée, facteurs avec TLR et NLR ligands conduit à un état de maturation des DC entraînant une augmentation de l'interaction DC avec d'autres cellules immunitaires et la promotion des cellules T et l'activation naturelle des cellules tueuses 11.
L'interleukine-1β est un élément essentiel de la défense de l'hôte contre l'infection. Dès la reconnaissance d'un micro-organisme, la cytokine hautement pro-inflammatoire, l'IL-1β, est sécrétée et fonctionne comme un appât de chimio et activateur des cellules immunitaires innées et adaptatives. In vivo d'IL-1β est en grande partie responsable de la réponse de phase aiguë, y compris la fièvre et de cytokines inflammatoires synthèse 12.
La plupart des NLR contiennent un domaine de répétition riche en C terminal de la leucine qui est pensé à fonctionner dans le ligand de détection, un domaine de liaison de nucleotide central (NACHT) qui est important pour NLRP3 oligomérisation, et un domaine effecteur borne N (PYD dans NLRP3) qui médie la transduction du signal de cibles en aval à travers des interactions de protéines de protéines. La protéine NLRP3 définit complexe inflammasome le plus intensément étudié. Cette protéine est un membre de la famille NLR et a la capacité de former un complexe moléculaire de la protéine composée de plusieurs NLRP3, PYCARD la protéine adaptatrice (également connu sous le nom ASC) et ICE. Lors de l'activation inflammasome PYCARD lie à NLRP3 domaines N terminaux et recrute ICE via l'activation des caspases et le domaine de recrutement (carte) domaines. L'interleukine-1 'enzyme de conversion est d'abord généré en tant que zymogène contenant un motif CARD à son extrémité N-terminale. Les résultats de la formation inflammasome dans la mise deux molécules ICE suffisamment proche pour induire leur activation autocatalytique. Le complexe de l'inflammasome est nécessaire pour activer ICE lui permettant ainsi de convertir la pro-IL-1β cytoplasmique de mûrir cytokine.
Le succès de la sécrétion d'IL-1β dans les PED nécessite la détection de deux signaux de danger différentes et indépendantes. Tout d'abord, la détection de TLR PAMP, amortit, ou la signalisation des cytokines (TNFa ou l'IL-1β) provoque une régulation positive de l'expression de protéines pro-IL-1β cytoplasmique. Un second souvent différente, signal, est nécessaire pour la formation du complexe inflammasome amont de la CIE maturation. Un peu inflammasome stimulant signaux comprennent des toxines bactériennes des pores de la membrane formant (comme nigéricine), lysosomales perturber cristaux (tels que des cristaux d'urate monosodique, MSU), et l'ATP extracellulaire. Le mécanisme en amont menant à NLRP3 activation inflammasome par ces divers activateurs n'est pas claire. Les études portant sur la signalisation en amont de la formation inflammasome propose que les événements intracellulaires, comme l'induction d'une hypokaliémie ou d'espèces réactives de l'oxygène (ROS) activent indirectement l'inflammasome 13-28.
Parmi les différents activateurs viraux de l'inflammasome NLRP3 est la grippe, qui fournit des bOTH le signal primaire et secondaire nécessaire pour la sécrétion d'IL-1β 3, 29-33. En utilisant des modèles NLRP3 huitièmes de finale de la souris, il a été constaté que l'IL-1β la sécrétion dans les PED est NLRP3 dépendante 32. En outre, les souris knock-out NLRP3 attiré moins de leucocytes vers le site de l'infection et ont connu une mortalité plus élevée 2, 5. Deux articles récents suggèrent un mécanisme pour l'activation de l'inflammasome NLRP3 cours de l'infection par le virus de la grippe; en premier lieu, par la reconnaissance d'amorce d'ARN viral par TLR7 ou TLR8 (en fonction de l'expression de TLR de la cellule de répondre) ou par détection de bactéries commensales par d'autres TLR pour induire l'expression pro-IL-1β cytoplasmique, suivi d'un second signal, l'activation de NLRP3 formation inflammasome par la protéine virale de canal ionique M2 sur le réseau trans de Golgi 33, 34. Dans la dernière étape, le déclenchement de l'inflammasome NLRP3 est accompli par les perturbations de l'ionique intracellulaire milieu conduisant à la production de ROS, qui est, tout simplement, détectée par NLPR3 comme un signal pour former l'inflammasome. Cependant, le mécanisme précis de l'inflammasome amont de l'activation de l'activité ICE lors de l'infection grippale demeure encore incertain.
Ce travail décrit une technique précieuse pour l'étude de l'inflammasome NLRP3 dans moDCs humaines qui peut être utilisé comme une base pour une enquête plus approfondie de la voie sous-jacent DC sur la base d'IL-1β sécrétion en réponse à TLR8 ligature avec R848 suivie de l'activation de l'inflammasome par un puits activateur connu de NLRP3, nigéricine. Des variantes de ce procédé peuvent être utilisés avec d'autres types de cellules, y compris, mais sans s'y limiter: les monocytes, les macrophages, les autres sous-ensembles à courant continu, et les cellules épithéliales.
Protocole
Déclaration d'éthique: les échantillons de recherche sont obtenus et stockés pour la recherche avec le consentement des donateurs. Tous les échantillons doivent être codées ou rendues anonymes avant de les utiliser. Ce protocole suit les lignes directrices de notre comité d'examen institutionnel.
1. Différenciation des droits de périphériques monocytes sanguins dans les cellules dendritiques dérivées de monocytes.
Remarque: couches leucocytaires humaines servent comme source de cellules du sang périphérique (CMSP) humaines et ont été obtenues à partir du Centre de New York Blood (New York, NY). Les donneurs de sang sont des volontaires sains. La procédure de 5 jours commence par le dépôt de cellules mononucléaires du sang périphérique humain (PBMC) sur des fioles de culture tissulaire 35,36. Différences notables des protocoles publiés sont les suivants:
- Utiliser 225 cm 2 non pyrogènes des flacons de culture tissulaire en polystyrène avec un couvercle de filtre à adhérer un total de 2x10 8 PBMC par flacon de 10 cm au lieu de polystyrène plaque de culture tissulaires (58 cm 2) (étape 1).
- Préparer des milieux avec 5% de sérum humain mis en commun (PHS, 30 ml) dans 500 ml de RPMI-1640 + L-glutamine, 5 ml de tampon HEPES 1 M, et 1,4 ml de 50 mg / ml de gentamicine (5% PHS médias) suivie d'une filtration à travers un filtre de 20 uM. Ajouter un total de 50 ml 5% PHS médias par 225 cm 2 flacon de culture tissulaire.
- Laver les cellules adhèrent à trois reprises avec 25 ml frais RPMI-1640. Agiter vigoureusement pendant 5 secondes lors de chaque lavage et aspirer les cellules non adhérentes (étape 4).
- Ajouter 190 ul de 400 UI / pl d'IL-4 et de 380 ul de 100 UI / pl de GM-CSF par flacon (étape 3) au jour 0, 2, et 4. Jour 0 est défini comme les PBMC de jour sont d'abord déposées dans l'étape 1 (étape 8).
- jour de récolte 5 moDCs à une concentration de 1x10 6 cellules / ml (étape 15).
- Utilisez moDCs immédiatement dans leur état de repos. Étapes 17-22 sont jamais réalisées. Note: Les échantillons doivent être traités dès que possible après la collecte pour de meilleurs résultats.
- moDCs aliquotes à une concentrationtion de 2x10 5 cellules / puits (200 pl / puits de la 1x10 6 cellules / ml) dans une plaque à 96 puits à fond rond (western blot, ELISA, FACS) ou sur un chamberslide poly-L-lysine traitée (microscopie) pour l'expérimentation . Remarque: Il ya au moins quatre conditions: Complètement non stimulées (contrôle négatif), d'apprêt, activation uniquement, et l'amorçage suivie de l'activation. Les conditions peuvent être élargis pour inclure des contrôles de diluant pour R848 et nigéricine si désiré. Si le dosage en aval est ICS, les doublons sont nécessaires pour contrôles isotypiques.
. 2 Amorçage de la Inflammasome - Signal 1
- Reconstituer R848 lyophilisé dans du DMSO, selon les instructions du fabricant. Diluer le stock de travail à température ambiante avec du RPMI-1640.
- Ajouter R848 à une concentration finale de 10 uM dans les puits pour 18 h. Placer les cellules dans un incubateur à 37 ° C et 5% de CO 2.
3 Activation du NLRP3 Inflammasome -. Signal2
- Reconstituer nigéricine lyophilisé dans de l'éthanol, conformément aux instructions du fabricant. Diluer le stock de travail à température ambiante avec du RPMI-1640 avant d'ajouter des conditions appropriées.
- Ajouter la nigéricine à la concentration finale de 20 uM et revenir à l'étuve à 37 ° C et 5% de CO2 pendant 6 heures. Aucune des étapes de lavage ont lieu entre l'amorçage et lors de l'activation. Remarque: La sécrétion d'IL-1β est augmentée par la présence des ionophores calciques, la bréfeldine A, la monensine, le dinitrophénol ou le cyanure de carbonyle chlorophenylhydrazone 37, 38. Par conséquent, l'addition de ces inhibiteurs de sécrétion ne sont pas recommandés lors de l'analyse d'amorçage ou d'une activité inflammasome car il va modifier la sécrétion de l'IL-1β.
4. L'IL-1ß prélèvement des échantillons
- Centrifuger la plaque avec des cellules et des surnageants à 974 g pendant 3 min.
- Sans perturber le culot cellulaire, aspirer le surnageant et transférer souseparate fond rond plaque afin de mesurer la sécrétion de cytokines à partir des surnageants. Remarque: Les surnageants peuvent être stockés temporairement à -20 ° C ou -80 ° C pour stockage à long terme.
- Laver les culots cellulaires à trois reprises avec 200 ul de 1 x PBS à 974 x g pendant 3 min pour enlever toute l'IL-1β extracellulaire à partir des échantillons cellulaires. Remarque: Lors du lavage des culots cellulaires à partir d'une plaque de 96 puits, enlever le lavage par inversion rapide plaque dans un bac de collecte afin de ne pas perturber l'échantillon.
5. Mesure IL-1ß De cellulaires et de surnageant échantillons
- Intracellulaire de cytokines coloration (ICS): Le protocole ICS est décrit ci-dessous 39, 40. Remarque: ne pas suspendre les cellules si le dosage en aval est la microscopie. Tous les lavages et les aspirations doivent être effectués sans perturber la couche de cellules / granulés (en fonction du dosage en aval).
- Ajouter 100 pi de 5% PHS médias dans les puits appropriés. Ajoutervolume approprié (environ 1 μl/2x10 5 de cellules, ou une pl / puits) de marquage fluorescent α-CD11c et α-CD14 (marqueurs phénotypiques; clone B-LY6 et MφP9, respectivement) ou de contrôle d'isotype à des cellules pendant 10 min à RT dans l'obscurité.
- Laver trois fois avec PBS 1x à 974 g pendant 3 min.
- Fixer les cellules par addition de 100 pl de 4% de PFA pendant 20 min à température ambiante dans l'obscurité.
- Pause Point: Laver avec 100 pi de PBS 1x à 974 g pendant 3 min et conserver à 4 ° CO / N en 1x PBS.
- Ajouter 100 ul de tampon de perméabilisation de cellules pendant 30 min. Note: Le tampon de perméabilisation est composé de 1 x PBS avec 0,3% de Triton X-100, et de 1% d'albumine de sérum bovin (BSA) pour la perméabilisation. Ne pas déranger les cellules adhérentes lorsqu'un dosage en aval est la microscopie.
- Ajouter le volume approprié (environ 62 ng antibody/2x10 5 cellules, environ 2,5 ou pl / puits) de α-IL-1β-FITC (clone 8516) ou isotype contrôle pour2 h dans un incubateur à 37 ° C.
- Laver les cellules trois fois avec 200 ul de tampon de perméabilisation à 974 x g pendant 3 min dans le noir.
- Facultatif: Teinture au DAPI, ajoutez milieu de montage, et placer délicatement la lamelle sur une lame de verre. Autoriser milieu de montage pour guérir O / N avant de capturer des images de microscopie.
- Acquérir les données par FACS ou microscopie. Remarque: Comparer l'isotype pour chaque condition de la coloration appropriée lors de l'analyse par FACS ou microscopie.
- CAA: Acquérir un échantillon à la fois. Réglez le / porte SSC FSC sur les cellules vivantes, suivies par le fenêtrage CD11c + CD14 - cellules avant l'analyse de la population MODC pro-IL-1β coloration.
- Microscopie: Réglez le temps d'exposition en utilisant l'échantillon de coloration positive - R848 traité. Utilisez DAPI + pro-IL-1β et + DAPI + pro-IL-1β - pour déterminer le pourcentage de pro-IL-1β + moDCs exprimant.
- Dakota du SudS-Page: Immunoblotting est effectué pour détecter pro-IL-1β. Remarque: La technique décrite ci-dessous combine technique standard d'immuno-empreinte, le gel de polyacrylamide à gradient de 4-20%, et la détection de fluorescence ou de chimioluminescence 41, 42.
- Lyse des cellules directement dans 10 ul de tampon de lyse dénaturant (5 pi β-mercaptoethanol/950 de tampon d'échantillon de Laemmli ul On dilue à 1:1 avec du tampon de lyse cellulaire). Transférer le lysat à 1,5 ml des tubes Eppendorf.
- lysat de chaleur sur une plaque sèche pendant 10 min à 100 ° C.
- Spin lysat à 20 800 xg sur une minicentrifuge pendant 1 min à concentrer le volume de liquide. Pause points: les échantillons peuvent être congelés à -20 ° C pour le stockage à court terme.
- Charger le volume total sur le gel de polyacrylamide. Run 140 V à travers la zone de gel pendant environ 1 heure, ou jusqu'à ce que le front de colorant de glisser sur le fond du gel.
- Transférer la protéine dans le gel de polyacrylamide sur un membr PVDF Immobilon-FLane pendant 90 min à 100 V. Bloquer la membrane avec 5% de BSA dans de la solution saline tamponnée au Tris / 0,1% Tween-20 (TBS-T) pendant 1 heure. Remarque: PVDF Immobilon-FL est meilleur pour une utilisation avec détection par fluorescence. Une membrane avec une composition différente est recommandée pour les autres techniques de détection pour augmenter le rapport signal sur fond.
- Diluer les anticorps primaires et secondaires dans 10 ml de 5% de BSA / TBS-T. Effectuer les incubations d'anticorps primaires à 4 ° CO / N tout en agitant et anticorps secondaire à la température ambiante pendant 1 heure en agitant.
- Laver la membrane trois fois avec du TBS-T pendant 5 min, tout en agitant entre les incubations d'anticorps primaires et secondaires et de nouveau entre les incubations secondaires et d'imagerie. Note: Les bandes peuvent être détectés en utilisant fluorescent ou la détection de chimioluminescence. Suivez les instructions du fabricant pour la détection.
- ELISA: Les échantillons sont congelés pour le stockage doivent s'équilibrer à la température ambiante avant l'analyse. Isoler des échantillons dans une centrifugeuse pour consolider condenseur surnageantation. Suivez les instructions du fabricant pour la mesure de l'IL-1β. Remarque: Dans ce protocole d'IL-1β est spécifiquement mesurée; Toutefois, la mesure simultanée de TNFa, IL-6, et l'immunomodulateur cytokine IL-10 assurer des conditions appropriées ont été amorcées.
Résultats
Ces techniques mesurent TLR8 amorçage avec R848. Coloration des cytokines intracellulaires pour la pro-IL-1β permet de microscopie et AAAF lectures du CD14 - CD11c + moDCs. Les deux techniques peuvent être quantifiés par rapport à une non apprêté, ou de repos, de contrôle de cellules ainsi que d'un contrôle isotypique (figures 1 et 2). Pour cent des cellules pro-IL-1β + coloration est multiplié par la moyenne géométrique de cette population de fournir l'intensité de fluorescence médiane (MFI). Le MFI est comparable à la quantité de pro-IL-1β présente dans les cellules à coloration positive.
Immunoblot mesures pro-IL-1β à partir de lysat de cellules, qui est ensuite quantifiée par rapport à un contrôle interne cellulaire, tel que β-tubuline ou β-actine (figure 3). Immunoblot pour la pro-IL-1β dans les cellules nigéricine traité devrait révéler une diminution de la pro-IL-1β. Il est complété par unaugmentation simultanée de l'IL-1β dans les surnageants, mesurés par ELISA, que dans des conditions R848 suivie par la nigéricine (figures 3 et 4). Toutes les autres conditions doivent entraîner aucune extracellulaire IL-1β présent. Mesure simultanée d'autres cytokines inflammatoires, telles que le TNFa, IL-10 et IL-6, en sorte que la nigéricine est déterminée en provoquant la sécrétion d'IL-1β. Le niveau d'amorçage est le temps (figure 3) et de la dose (figure 4) en fonction, d'une réponse réfléchie dans le degré de pro-IL-1β en intracellulaire et extracellulaire R848 apprêté IL-1β (ainsi que TNFa, IL-10, et IL-6) dans la sécrétion tous R848 traitée conditions (Figure 4).

Figure 1. Cytoplasmique pro-IL-1β est détecté par f faible cytométrie. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Cytoplasmique pro-IL-1β est détectée par microscopie. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
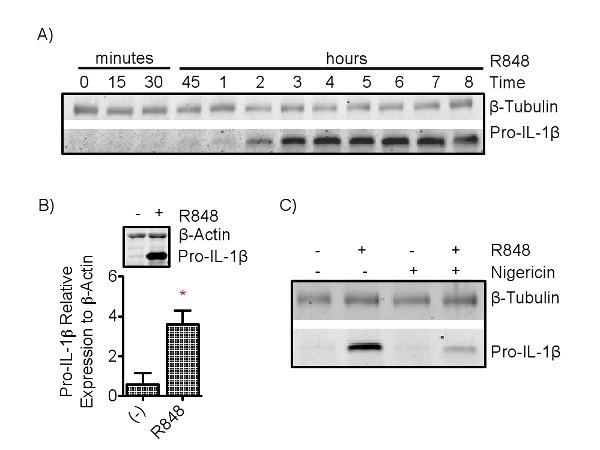
Figure 3. Cytoplasmique pro-IL-1β est détectée par SDS-PAGE.res.jpg "target =" _blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
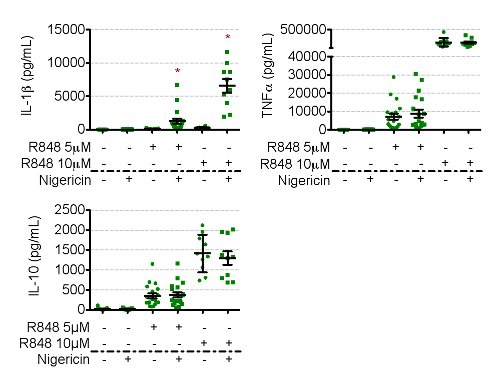
Figure 4. Sécrétée IL-1β est détecté par ELISA. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Cytokines inflammatoires font partie intégrante de pilotage de la réponse immunitaire innée et adaptative pour combattre l'infection virale. IL-1β sécrétée a été démontré que l'augmentation lors de l'infection d'influenza 3, 43, 44. Les mécanismes précis par lequel ces cytokines sont traitées en réponse à la reconnaissance du virus dans les cellules dendritiques humaines sont pas entièrement comprises. Kits d'isolement DC myéloïdes sont coûteux et fastidieux. kits d'isolement et FAC tri peut involontairement stress ou activer les cellules. En outre, il existe souvent une quantité insuffisante de cellules isolées pour l'expérimentation. Heureusement, la biologie de moDCs humains étroitement modèles de DC myéloïdes humaines primaires in vitro 45, 46. Deux types de cellules ont besoin de deux signaux, TLR amorçage et NLRP3 activation, pour atteindre la maturité sécrétion d'IL-1β. Par conséquent, moDCs fournissent et le type de cellule modèle DC abordable et simple d'étudier et de pariter comprendre la pertinence et le rôle de l'inflammasome NLRP3 dans la santé humaine et la maladie.
La détection de l'IL-1β en utilisant les méthodes décrites ici fournit divers dosages immunologiques simples et efficaces pour étudier les maladies avec des pathologies associées inflammatoire, y compris l'infection virale de l'ARN; spécifiquement, la façon de mesurer l'IL-1β dans une variété de manières, en réponse à une stimulation R848 et nigéricine. D'autres agonistes des TLR (par exemple, poly (I: C) et LPS) et des activateurs de NLRP3 inflammasome (tels que l'ATP et MSU) peuvent être utilisés pour mesurer cette activité lors de la stimulation dans le contexte d'autres pathologies de la maladie; Toutefois, il faudra peut être ajustée durée et les conditions de stimulation. temps et les concentrations d'exposition des réactifs devront également être ajusté en cas de modification de ce protocole pour l'utilisation dans d'autres types cellulaires et des espèces.
Toutes les conditions doivent être exécutés en trois exemplaires et la réponse soigneusement pesées à des fins de contrôle de qualité; il est fréquent quegrande variabilité des bailleurs de fonds d'exister. DC dérivées de monocytes sont un type de cellule, et non pas d'une lignée cellulaire, et l'hétérogénéité existe au sein d'une culture MODC.
L'amorçage peut être confirmé ICS pour la pro-IL-1β et de comparer moDCs repos à la condition R848-amorcée. MoDCs repos ne doivent pas entraîner une coloration positive. L'amorçage peut également être validé par immunoblot de l'expression de la pro-IL-1β. Des résultats positifs d'amorçage R848 dans la sécrétion de cytokines pro-inflammatoires TNF, IL-6, et l'immunomodulateur cytokine IL-10 avec un minimum de sécrétion de l'IL-1β. cellules activées de l'inflammasome ne devraient pas montrer une nouvelle augmentation de TNF, IL-6 et IL-10 sécrétion mais auront une augmentation des concentrations d'IL-1β sécrétées par rapport aux cellules non activées.
Pro-IL-1β peut être passivement libéré lors de la mort cellulaire nécrotique donc des essais de biodisponibilité peuvent être d'intérêt. En variante, immuno-empreinte peut être effectuée sur supernatants pour déterminer le poids moléculaire de l'IL-1β sécrétée à assurer l'IL-1β active est la forme de la cytokine sécrétée; IL-1β maturité est de 17 kDa tandis que le précurseur est de 31 kDa. Pour mesurer l'IL-1β à partir de surnageants, la concentration cellulaire devra être ajustée pour obtenir un signal positif au-dessus de la limite de détection. Caspase-1 activation peut également être mesurée par une variété de méthodes pour déterminer l'activation inflammasome.
Déclarations de divulgation
Les auteurs n'ont aucun conflit d'intérêt à divulguer.
Remerciements
Les auteurs tiennent à remercier Olivier Manches, Ph.D., Davor Frleta, Ph.D., et Meagan O'Brien, MD pour leur soutien et vos commentaires. Cette recherche a été financée par l'Institut national des allergies et des maladies infectieuses et a terminé avec un financement du NIH accorde Ruth L. Kirschstein Distinctions pour services de recherche nationaux pour les bourses Predoctoral individuels (F31) pour la promotion de la diversité dans la recherche liés à la santé (AI089030) et RO1 (AI081848 ).
matériels
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| IL-4 | R&D | ||
| GM-CSF | Genzyme | NDC 58468-0180-2 | We acquire this item through our local pharmacy with a prescription |
| RPMI 1640 with L-glutamine | Cellgro | 10-040-CV | |
| Peripheral blood mononuclear cells | New York Blood Center | PBMCs were isolated from the blood of healthy donors | |
| 12-well tissue culture plates | Sigma-Aldrich | 3516 | |
| 96-well round bottom tissue culture plates | Sigma-Aldrich | 3799 | |
| α-IL-1β-FITC | R&D | IC201F | |
| FITC isotype control | Miltenyi Biotec | 130-092-213 | |
| α-β-Tubulin | Santa Cruz | SC-9014 | |
| α-IL-1β | R&D | mab201 | |
| PVDF Immobilon-FL membrane | Millipore | IPFL00010 | |
| gradient 4-12 % polycrylamide gel | Bio Rad | 161-1159 | |
| laemmli sample buffer | Bio Rad | 161-0737 | |
| BSA | Equitech Bio Inc | 30% solution sterile/filtered | |
| PFA | Electron Microscopy Sciences | 15710 | 16% solution |
| human inflammatory cytokine bead array kit | BD | 551811 | |
| nigericin | Invivogen | tlrl-nig | |
| R848 | 3M Corp. | ||
| α-CD14 | BD | 340436 | |
| α-CD11c | BD | 555392 | |
| β-mercaptoethanol | Sigma-Aldrich | M6250-10ML | |
| TBS | On site stock room | ||
| Tween-20 | Sigma-Aldrich | P2287-100mL | |
| Nunc EasYFlask 225cm2, Filter Cap, 70mL working volume, 30/Cs | Thermo Scientific | 159933 | |
| 20 μM Sterile Disposable Filter Units | Thermo Scientific | 569-0020 | |
| Gentamicin | Invitrogen | 15750060 | |
| Hepes | Invitrogen | 15630080 | |
| goat α-mouse IRDye 800CW | Licor | 926-32210 | |
| donkey α-rabbit IRDye 680RD | Licor | 926-68073 | |
| Spectra multicolor broad range protein ladder | Thermo Scientific | 26634 | |
| Tris Glycine SDS 10x | Bio Rad | 1610732 | |
| Tris Glycine 10x | Bio Rad | 161-0734 | |
| Methanol - 4L | Fisher Scientific | A433P-4 | |
| Prolong Gold antifade Reagent with DAPI | Life Technologies | P-36931 | |
| 8 chamber polystyrene vessel tissue culture treated glass slide | BD Falcon | 354108 | |
| Poly-L-Lysine | Sigma | P4707 |
Références
- Durrant, D. M., Robinette, M. L., Klein, R. S. IL-1R1 is required for dendritic cell-mediated T cell reactivation within the CNS during West Nile virus encephalitis. The Journal of Experimental Medicine. 210, 503-516 (2013).
- Thomas, P. G., et al. The intracellular sensor NLRP3 mediates key innate and healing responses to influenza A virus via the regulation of caspase-1. Immunity. 30, 566-575 (2009).
- Schmitz, N., Kurrer, M., Bachmann, M. F., Kopf, M. Interleukin-1 is responsible for acute lung immunopathology but increases survival of respiratory influenza virus infection. Journal of Virology. 79, 6441-6448 (2005).
- Pang, I. K., Ichinohe, T., Iwasaki, A. IL-1R signaling in dendritic cells replaces pattern-recognition receptors in promoting CD8(+) T cell responses to influenza A virus. Nat Immunol. 14, 246-253 (2013).
- Allen, I. C., et al. The NLRP3 inflammasome mediates in vivo innate immunity to influenza A virus through recognition of viral RNA. Immunity. 30, 556-565 (2009).
- Bauernfeind, F. G., et al. Cutting edge: NF-kappaB activating pattern recognition and cytokine receptors license NLRP3 inflammasome activation by regulating NLRP3 expression. J Immunol. 183, 787-791 (2009).
- Zabel, F., Kundig, T. M., Bachmann, M. F. Virus-induced humoral immunity: on how B cell responses are initiated. Current Opinion in Virology. , (2013).
- Steinman, R. M. Lasker Basic Medical Research Award. Dendritic cells: versatile controllers of the immune system. Nature Medicine. 13, 1155-1159 (2007).
- Bhardwaj, N., et al. Influenza virus-infected dendritic cells stimulate strong proliferative and cytolytic responses from human CD8+ T cells. The Journal of Clinical Investigation. 94, 797-807 (1994).
- Sheng, K. C., Day, S., Wright, M. D., Stojanovska, L., Apostolopoulos, V. Enhanced Dendritic Cell-Mediated Antigen-Specific CD4+ T Cell Responses: IFN-Gamma Aids TLR Stimulation. Journal of Drug Delivery. 2013, (2013).
- Pohl, C., Shishkova, J., Schneider-Schaulies, S. Viruses and dendritic cells: enemy mine. Cellular Microbiology. 9, 279-289 (2007).
- Dinarello, C. A. Cytokines as mediators in the pathogenesis of septic shock. Curr Top Microbiol Immunol. 216, 133-165 (1996).
- Petrilli, V., et al. Activation of the NALP3 inflammasome is triggered by low intracellular potassium concentration. Cell Death and Differentiation. 14, 1583-1589 (2007).
- Hussen, J., Duvel, A., Koy, M., Schuberth, H. J. Inflammasome activation in bovine monocytes by extracellular ATP does not require the purinergic receptor P2X7. Developmental and Comparative Immunology. 38, 312-320 (2012).
- Rajamaki, K., et al. Extracellular Acidosis Is a Novel Danger Signal Alerting Innate Immunity via the NLRP3 Inflammasome. The Journal of Biological Chemistry. 288, 13410-13419 (2013).
- Ayna, G., et al. ATP release from dying autophagic cells and their phagocytosis are crucial for inflammasome activation in macrophages. PLoS One. , (2012).
- Vyleta, M. L., Wong, J., Magun, B. E. Suppression of ribosomal function triggers innate immune signaling through activation of the NLRP3 inflammasome. PLoS One. 7, (2012).
- Lacroix-Lamande, S., et al. Downregulation of the Na/K-ATPase pump by leptospiral glycolipoprotein activates the NLRP3 inflammasome. J Immunol. 188, 2805-2814 (2012).
- Segovia, J., et al. TLR2/MyD88/NF-kappaB pathway, reactive oxygen species, potassium efflux activates NLRP3/ASC inflammasome during respiratory syncytial virus infection. PLoS One. 7, (2012).
- Hamon, M. A., Cossart, P. K. K+ efflux is required for histone H3 dephosphorylation by Listeria monocytogenes listeriolysin O and other pore-forming toxins. Infection and Immunity. 79, 2839-2846 (2011).
- Schorn, C., et al. Sodium overload and water influx activate the NALP3 inflammasome. The Journal of Biological Chemistry. 286, 35-41 (2011).
- Said-Sadier, N., Padilla, E., Langsley, G., Ojcius, D. M. Aspergillus fumigatus stimulates the NLRP3 inflammasome through a pathway requiring ROS production and the Syk tyrosine kinase. PLoS One. 5, (2010).
- Arlehamn, C. S., Petrilli, V., Gross, O., Tschopp, J., Evans, T. J. The role of potassium in inflammasome activation by bacteria. The Journal of Biological Chemistry. 285, 10508-10518 (2010).
- Chu, J., et al. Cholesterol-dependent cytolysins induce rapid release of mature IL-1beta from murine macrophages in a NLRP3 inflammasome and cathepsin B-dependent manner. Journal of Leukocyte Biology. 86, 1227-1238 (2009).
- Silverman, W. R., et al. The pannexin 1 channel activates the inflammasome in neurons and astrocytes. The Journal of Biological Chemistry. 284, 18143-18151 (2009).
- Piccini, A., et al. ATP is released by monocytes stimulated with pathogen-sensing receptor ligands and induces IL-1beta and IL-18 secretion in an autocrine way. Proc Natl Acad Sci U S A. 105, 8067-8072 (2008).
- Wickliffe, K. E., Leppla, S. H., Moayeri, M. Anthrax lethal toxin-induced inflammasome formation and caspase-1 activation are late events dependent on ion fluxes and the proteasome. Cellular Microbiology. 10, 332-343 (2008).
- Franchi, L., Kanneganti, T. D., Dubyak, G. R., Nunez, G. Differential requirement of P2X7 receptor and intracellular K+ for caspase-1 activation induced by intracellular and extracellular bacteria. The Journal of Biological Chemistry. 282, 18810-18818 (2007).
- Owen, D. M., Gale, M. Fighting the flu with inflammasome signaling. Immunity. 30, 476-478 (2009).
- Pang, I. K., Iwasaki, A. Inflammasomes as mediators of immunity against influenza virus. Trends in Immunology. 32, 34-41 (2011).
- Kanneganti, T. D., et al. Critical role for Cryopyrin/Nalp3 in activation of caspase-1 in response to viral infection and double-stranded RNA. The Journal of Biological Chemistry. 281, 36560-36568 (2006).
- Ichinohe, T., Lee, H. K., Ogura, Y., Flavell, R., Iwasaki, A. Inflammasome recognition of influenza virus is essential for adaptive immune responses. The Journal of Experimental Medicine. 206, 79-87 (2009).
- Ichinohe, T., Pang, I. K., Iwasaki, A. Influenza virus activates inflammasomes via its intracellular M2 ion channel. Nat Immunol. 11, 404-410 (2010).
- Ichinohe, T., et al. Microbiota regulates immune defense against respiratory tract influenza A virus infection. Proc Natl Acad Sci U S A. 108, 5354-5359 (2011).
- O'Neill, D. W., Bhardwaj, N. Differentiation of peripheral blood monocytes into dendritic cells. Current Protocols in Immunology. 22, (2005).
- Sabado, R. L., Miller, E., Spadaccia, M., Vengco, I., Hasan, F., Bhardwaj, N. Preparation of Tumor Antigen-loaded Mature Dendritic Cells for Immunotherapy. J. Vis. Exp. (78), (2013).
- Rubartelli, A., Cozzolino, F., Talio, M., Sitia, R. A novel secretory pathway for interleukin-1 beta, a protein lacking a signal sequence. The EMBO Journal. 9, 1503-1510 (1990).
- Ritchie, H., Booth, N. A. Secretion of plasminogen activator inhibitor 2 by human peripheral blood monocytes occurs via an endoplasmic reticulum-golgi-independent pathway. Experimental Cell Research. 242, 439-450 (1998).
- Lamoreaux, L., Roederer, M., Koup, R. Intracellular cytokine optimization and standard operating procedure. Nature Protocols. 1, 1507-1516 (2006).
- He, H., Courtney, A. N., Wieder, E., Sastry, K. J. Multicolor Flow Cytometry Analyses of Cellular Immune Response in Rhesus Macaques. J Vis Exp. 38, (2010).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American journal of Medical Sciences. 4, 429-434 (2012).
- Alegria-Schaffer, A., Lodge, A., Vattem, K. Performing and optimizing Western blots with an emphasis on chemiluminescent detection. Methods in Enzymology. 463, 573-599 (2009).
- Hennet, T., Ziltener, H. J., Frei, K., Peterhans, E. A kinetic study of immune mediators in the lungs of mice infected with influenza A virus. J Immunol. 149, 932-939 (1992).
- Pirhonen, J., Sareneva, T., Kurimoto, M., Julkunen, I., Matikainen, S. Virus infection activates IL-1 beta and IL-18 production in human macrophages by a caspase-1-dependent pathway. J Immunol. 162, 7322-7329 (1999).
- Anderson, J., Gustafsson, K., Himoudi, N. Licensing of killer dendritic cells in mouse and humans: functional similarities between IKDC and human blood gammadelta T-lymphocytes. Journal of Immunotoxicology. 9, 259-266 (2012).
- Waithman, J., Mintern, J. D. Dendritic cells and influenza A virus infection. Virulence. 3, 603-608 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon