Method Article
Une seule usine, microcosmes stériles pour la nodulation et la croissance de la plante des légumineuses
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Croissance des plantes de Medicago truncatula en symbiose avec la bactérie fixatrice d'azote Sinorhizobium meliloti dans des microcosmes individuels stériles fabriqués à partir de plaques de laboratoire standard permet un examen fréquent des systèmes de racines et de nodules sans compromettre la stérilité. Les plantes peuvent être maintenues dans ces chambres de croissance pour un maximum de 9 semaines.
Résumé
Bactéries rhizobium forment symbiotiques, nodules fixateurs d'azote sur les racines des légumineuses hôtes compatibles. L'un des systèmes les modèles les plus développés pour l'étude de ces interactions est la plante Medicago truncatula cv. Jemalong A17 et la bactérie rhizobium Sinorhizobium meliloti 1021. Imagerie répétée des racines des plantes et la notation des phénotypes symbiotiques exige des méthodes qui sont non destructif soit à des plantes ou des bactéries. Les phénotypes symbiotiques de certaines plantes et mutants bactériens deviennent apparents après des périodes relativement courtes de la croissance, et ne nécessitent pas d'observation à long terme de l'interaction hôte / symbiote. Cependant, des différences subtiles dans l'efficacité et la sénescence des nodosités phénotypes symbiotiques qui n'apparaissent pas dans les premiers stades du processus de nodulation nécessitent des périodes de croissance relativement longue avant de pouvoir être reçu. Plusieurs méthodes ont été développées pour la croissance à long terme et de l'observation de ce couple hôte / symbiote.Cependant, beaucoup de ces méthodes nécessitent l'arrosage répété, ce qui augmente la possibilité de contamination par d'autres microbes. D'autres méthodes nécessitent un espace relativement important pour la croissance d'un grand nombre de plantes. La méthode décrite ici, la croissance symbiotique de M. truncatula / S. meliloti dans des microcosmes seule usine stériles, présente plusieurs avantages. Plantes à ces microcosmes ont humidité et les éléments nutritifs suffisants pour assurer que l'arrosage n'est pas nécessaire pour jusqu'à 9 semaines, prévenir la contamination croisée lors de l'arrosage. Cela permet phénotypes à être quantifiés qui pourraient manquer dans les systèmes de croissance à court terme, tels que les retards subtiles dans le développement de nodules et au début de la sénescence des nodosités. En outre, les racines et les nodules dans le microcosme sont facilement visualisables à travers le couvercle de la plaque, de sorte déracinement des plantes pour l'observation n'est pas obligatoire.
Introduction
L'interaction entre la plante hôte de légumineuse Medicago truncatula A17 et la bactérie rhizobium Sinorhizobium meliloti 1021 est l'un des systèmes modèles les plus dociles de l'étude de développement des racines des nodules et symbiose fixatrice d'azote. Les génomes des deux partenaires symbiotiques ont été séquencés et 1,2 fois l'usine et de la bactérie se prêtent à la manipulation génétique 3,4. L'analyse des phénotypes de deux plantes et mutants bactériens nécessite la capacité à observer les étapes du développement de nodules et de quantifier la productivité symbiotique avec le temps. Ici, nous décrivons une méthode pour l'observation du développement de nodules de racines de M. truncatula cv. Jemalong A17 inoculées avec S. meliloti 1021 dans des microcosmes individuels fabriqués à partir de standard, diamètre rond de 100 mm, 15 mm plaques de laboratoire profondes (figure 1A). Le tournage est exposée et se développe par le biais d'un portail à encoches dans le côté de la plaque (Figures 1B, 1C, et 1E). Les racines sont contenus dans les microcosmes et maintenues stériles, tout en permettant une observation à travers le couvercle de la plaque (figure 1D). Etant donné que le tournage est accessible, sa croissance n'est pas limitée et elle peut être mesurée à des intervalles périodiques, sans compromettre la stérilité de la racine. La méthode de création de microcosmes-plaque crantée a été initialement développé par Leigh, et al. 5 pour la culture de plants de luzerne, mais il n'a pas été largement adopté en dépit de ses nombreux avantages par rapport aux autres méthodes. Une variante de cette méthode a également été développé pour l'analyse de l'interaction entre les racines des plantes et des mycorhizes 6. Nous avons maintenant conçu et optimisé cette méthode pour la croissance de M. centrales truncatula. Les avantages de ce protocole sur les plus couramment utilisés méthodes sont décrites ci-dessous.
Il existe plusieurs méthodes qui sont actuellement largement utilisés pour les études de nodulation de M. truncatula inoculationlated avec S. meliloti 7. La méthode la plus couramment utilisée pour la préparation à grande échelle de racinaires est la croissance dans des caissons aéroponique 7. Dans ce procédé, des plantes sont suspendus au-dessus d'un grand récipient et des racines sont aérées avec un mélange de S. meliloti et solution nutritive 7. Cette méthode est pratique si un seul génotype de S. meliloti est à tester. Etant donné qu'il nécessite l'aérosolisation des concentrations élevées de bactéries, il existe une forte probabilité de contamination croisée entre les caissons inoculés avec différentes souches bactériennes. Un autre procédé qui est souvent utilisé pour préparer de grandes quantités de plantes inoculées est une croissance dans des bacs ou des pots de la perlite, de la vermiculite, du sable ou de l'argile calcinée qui sont perfusée avec une solution nutritive et on l'inocule avec S. meliloti 7. Cette méthode nécessite l'utilisation de cuves ouvertes ou des pots, et nécessite un arrosage et de reconstitution de la solution nutritive. Un autre inconvénient de pots est que les plantesdoivent être retirés de cette matrice particulaire à l'examen des racines et des nodules. Un autre inconvénient de cette méthode est qu'une grande partie de l'espace de l'incubateur est nécessaire quand beaucoup différente S. génotypes meliloti sont à comparer, à cause d'un pot séparé doit être utilisé pour chaque génotype bactérien. Le "pot de Leonard" est une variante de cette méthode 8,9. Un pot Leonard est composé de deux récipients stérilisés empilés l'un au-dessus de l'autre et reliés par une mèche. Le milieu de croissance est placé dans la cuve inférieure et aspiré à travers la mèche par action capillaire dans une matrice de perlite, de la vermiculite, du sable ou de l'argile calcinée dans le récipient supérieur croissance. La plantule (s) sont placés dans la matrice de croissance et inoculées avec S. meliloti. Cette méthode ne nécessite pas d'arrosage, mais l'examen des racines et des nodules exige que la plantule être retiré de la matrice de croissance de particules.
Il existe plusieurs méthodes qui ne permettent examen facile de roots. L'un d'entre eux est la "poche de croissance" de matière plastique transparente 7. Un inconvénient de cette méthode est que l'arrosage fréquent est nécessaire étant donné que seule ≤ 10 ml de milieu liquide est optimale pour la croissance de M. truncatula dans des sachets 7. expériences de poche sont également généralement limités à ~ 2 semaines 7, suite à une panne de la mèche de papier dans la poche. Deux autres méthodes qui sont couramment utilisés sont similaires à notre méthode en ce que les plantes sont cultivées sur gélose et les racines sont visibles, mais ces méthodes ont aussi des inconvénients que notre procédure évite. Dans ces procédés, les plantes sont entièrement contenues dans 24,5 cm x 24,5 cm plaques d'agar scellés autour du sommet avec du ruban adhésif chirurgical poreux ou cultivés dans des tubes de gélose-pente bouchés avec des bouchons de coton ou de bouchons en plastique 7. Ces deux méthodes permettent examen facile des racines et peut être maintenu stérile. Cependant, les tubes inclinés d'agar-agar sont généralement cultivées avec seulement 20 ml de gélose à moyen 7 et nécessitent un arrosage et un nutrimentJOUT pour la croissance à long terme des plantes. Les plantes cultivées dans les 24,5 cm x 24,5 cm agar microcosmes de la plaque ont l'humidité et nutriments pour la croissance à long terme suffisant, mais le tournage de plus en plus devient rapidement limités dans le microcosme de la plaque ci-joint et de l'éthylène gazeux peuvent s'accumuler inhiber la nodulation 7. Dans la procédure décrite ici, le tournage est exposée et se développe librement en dehors du microcosme qui contient ~ 70 ml de milieu, permettant une croissance à long terme.
Le procédé décrit ici peut être utile non seulement pour l'étude de la nodulation de légumineuses, mais également pour l'étude des phénotypes de racines d'autres plantes de taille moyenne. La différence entre ces microcosmes et un pot traditionnel de culture tissulaire végétale de polycarbonate est que les racines dans des microcosmes de plaques décrits ici se développent sur la surface verticale de l'agar-agar, plutôt que vers le bas dans une couche horizontale de gélose au fond du pot. Cela permet à la racine de se dégager de la surface de la gélose avec un minimum dAMAGE de poils absorbants et l'adhérence de la gélose minimale à la surface de la racine, ce qui facilite l'examen de poils absorbants par microscopie.
Protocole
Effectuer les étapes 1, 2, 4 et 6 dans une hotte à flux laminaire stérile est recommandée.
Une. Préparation de M. truncatula A17 semis
Remarque: M. truncatula A17 graines utilisées dans ces études sont réalisées dans des conditions de serre refroidis à ~ 22 ° C, ou dans une chambre de croissance des plantes maintenue à 22-26 ° C avec ~ 150-400 mmol / m -2 s -1 lumière.
- Verser plaques de germination: Utilisez 100 mm plaques carrées (15 mm de profondeur) et verser autoclave 1.1-1.2% p / v purifié agar 10 à une profondeur de 3-5 mm. Chaque plaque sera utilisé pour germer ~ 0,25-0,5 g de graines (équivalent à 63-125 graines / plaque).
Remarque: Il est essentiel d'utiliser la culture cellulaire testée, agar purifié des plantes pour toutes les plaques décrites dans le présent protocole. Le vendeur et le numéro de catalogue de l'agar-agar est répertorié dans le tableau des réactifs et des équipements spécifiques. - Scarifier / stériliser le M. truncatula A17 semencess: Peser suffisamment de semences pour le nombre désiré de semis. (M. truncatula A17 graines sont ~ 4 mg chacun) Placer les semences stériles dans des flacons de 125 ml avec des couvertures de feuilles stériles (0,25-0,5 g de graines / flacon, ce qui est ~ 63 à 125 graines) et la pipette 20 ml de concentré (96%) H 2 SO 4, le long des parois du ballon.
Remarque: la scarification acide permet de stériliser les graines. En outre, l'acide par pipetage le long des parois du ballon, il sera ré-stériliser l'intérieur de la fiole qui a été en contact avec les graines non stérilisées. - Briser les mottes de semences avec une pipette en verre stérile. Agiter chaque flacon souvent pour 10-12 min. Petites fosses brunes seront visibles sur les graines. Ce sont de minuscules trous dans le tégument de la graine 11.
Remarque: Porter des lunettes de protection et des gants pour travailler avec H 2 SO 4 concentré. - Retirer H 2 SO 4 et rincer les graines: Lorsque au moins 10% des graines ont de petites fosses brun, ou 12 min se sont écoulées, selonvient d'abord, enlever tout l'acide dans les fioles avec une pipette en verre stérile. (Place de l'acide résiduaire dans un bêcher de 1 à 2 L contenant au moins 300 ml d'eau du robinet. Cela diluer l'acide et d'éviter toute surchauffe.) Incliner le ballon pour recueillir l'acide restant dans la courbe de la fiole et en utilisant une petite pipette en verre pour éliminer tout l'acide restant. Si de l'acide résiduel, il réagit avec l'eau de rinçage, chauffer les graines et de les tuer.
- Rincer les graines en versant rapidement 100 ml d'eau ultrapure stérile dans chaque fiole. L'excès de volume d'eau va diluer l'acide et d'éviter la surchauffe et de semences dommages pendant la réaction de l'acide avec l'eau. Décanter l'eau et stériliser à la flamme de la lèvre du flacon.
- Rincer les graines 8-10x avec 50 ml d'eau ultra-pure stérile. Agiter le ballon lors de chaque rinçage. Le ballon doit être considéré comme stérile à ce point et la lèvre de la bouteille doit être brûlé avant chaque rinçage.
- Laissez les graines s'imbibent nuit: Après l'dernier rinçage, versez 50 ml d'eau ultra-pure stérile dans chaque flacon, replacez le couvercle de la feuille stérile sur chaque flacon et laisser reposer à 4 ° C dans l'obscurité pendant une nuit.
- Placer les semences sur la plaque de germination: Après graines laisser s'imprégner de la nuit, verser l'eau, rincer 2x avec ~ 25 ml d'eau ultra-pure, puis ajouter 20 ml d'eau ultra-pure stérile, remous pour remettre en suspension les graines et versez-les sur une plaque de gélose de germination 1.1-1.2% par rapport à l'étape 1.1. Si les graines restent dans le flacon, ajouter de l'eau et verser à nouveau. Distribuer les graines de chaque flacon à une plaque (63 à 125 graines / plaque).
- Agiter la plaque de distribuer les semences. Les graines doivent être répartis uniformément dans une bande de 4 à 5 cm, à une extrémité de la plaque. Ce sera le "top" de la plaque. Le "fond" 5-6 cm doit être exempte de graines (figure 2A).
- Prélever l'eau avec une pipette stérile. Incliner la plaque à un angle de 45 ° pour permettre à l'écoulement de l'eau restant au fond de la plaque. Remettre le couvercle sur le tilplaque de TED et de protéger de la lumière. Les plaques doivent être autorisés à vider 10-20 min. (Figure 2B).
- Mettre en place la germination: Retirer toute l'eau qui s'est accumulée au fond de la plaque inclinée avec une pipette stérile.
- Remettre le couvercle et sceller la plaque avec du parafilm. Porter des gants et garder stérile (figure 2C).
- Empilez les plaques de germination et puis tourner tous vers le haut à un angle de 90 °. Les semences seront couchés sur la surface verticale de l'agar-agar. Graines entièrement imbibés doivent adhérer facilement à l'agar-agar. Les racines se développeront vers le bas (figure 2D).
- Enveloppez la pile de plaques de germination dans du papier pour bloquer la lumière et conserver à 25 ° C pendant 3 jours.
Remarque: Si le produit de germination pour moins de 3 jours, les racines peuvent être trop court pour atteindre la gélose dans des microcosmes. Si la germination procède plus de 4 jours avant le transfert des plaques de microcosme, la survie des plantulesêtre pauvre. Si M. écotypes truncatula ou mutants avec plus lents taux de germination sont à comparer, l'écotype lentement germination devrait être autorisé à germer plus de 3 jours.
2. Préparation des microcosmes des plaques individuelles
- Préparer moyen 12 (voir le tableau 1 pour la composition), permettant ~ 70 ml de milieu de Jensen pour chaque microcosme. Préparer dans des cruches ou des flacons qui sont pratiques pour la coulée rapide (pas plus de 1-2 L par pichet) et laisser un barreau magnétique dans le pichet pendant l'autoclavage.
- Après moyen a refroidi à ~ 55-65 ° C, les suppléments ont été ajoutés et le pH a été contrôlé (voir le tableau 1), verser dans diamètre rond de 100 mm, 15 mm assiettes creuses. Les plaques doivent être versés ~ 0,9-1 cm de profondeur (~ 70 ml / plaque).
- Composants de milieu de Jensen peuvent former un précipité nuageux, il est donc important de revenir au lanceur de la plaque d'agitation magnétique périodiquement pour empêcher les composants de décantation. Précipités peuvent être vistible dans la plaque après leur solidification, et à ne pas affecter les performances dans la mesure où ils sont uniformément répartis entre les plaques.
- Empiler des plaques au cours de la coulée pour éviter la formation de condensation sur les couvercles des plaques.
- Après les plaques de Jensen ont solidifié, cochez les deux plaques et couvercles avec une spatule de pesée qui a été plié en forme de U 5 (figure 3A). Chauffer le virage de la spatule avec un brûleur jusqu'à rouges chauds, notch 5-6 plaques, puis chauffer à nouveau. Lorsque le couvercle à encoche est placée sur la plaque à encoches, ce qui créera un portail ovale à travers laquelle la tige de la plantule va croître (figure 3B). Si les plaques entaillées doivent être stockés, envelopper individuellement avec un film de paraffine ..
3. Préparation de Sinorhizobium meliloti Cultures
Deux jours avant inoculation de plantes, commencer les cultures de tous les S. meliloti souches à être inoculés sur des plants. Cultures doivent être cultivées dans LBMC (Luria-Bertani [Miller]) moyen 13 supplémenté avec 2,5 mM MgSO4, CaCl2 2,5 mM, et les antibiotiques appropriés (milieu TY fonctionne aussi bien). Aussi peu que 2-3 ml de chaque culture seront suffisantes.
- Croître à 30 ° C avec agitation pendant 2 jours jusqu'à ce que les cellules sont denses.
- Pour la plupart des inoculations de plantes, la phase de la croissance de S. meliloti n'est pas critique. En règle générale, la fin connecter ou cellules en phase stationnaire début sont utilisés.
4. Mise en M. truncatula semis sur microcosmes individuels
- Après 3 jours, ouvrez une plaque de germination (préparé à l'étape 1) et rincez-les immédiatement avec de l'eau ultra-pure stérile. Dip forceps dans de l'éthanol et brièvement flamme à stériliser. Utilisez des pinces stériles pour pousser doucement les pointes des racines de tous les plants sous l'eau pour éviter le dessèchement. Les racines vont de 2-6 cm de long. La majorité sera de 3-4 cm. Sélectionnez plants à racines droites et pas évidentedéfauts.
- Vérifier les couvercles des microcosmes moyennes de la Jensen pour l'accumulation de condensation. Basculez le couvercle pour éliminer la condensation ou le remplacer par un nouveau couvercle cranté. Si il ya un excès de condensation sur le couvercle, la racine de semis peut adhérer au couvercle puis mourir après la condensation sèche.
- En utilisant les forceps, ramasser délicatement un semis de la plaque de germination par les cotylédons et était la racine sur un milieu microcosme d'un Jensen. Assurez-vous que l'extrémité de la racine est en contact avec l'agar-agar.
- Retirez délicatement le tégument de la graine si elle est toujours présente. Les enveloppes devraient être lâche après trempage dans l'eau pendant 5-10 min. Doucement taquiner le tégument de la graine avec la pince jusqu'à ce qu'il cède, et le jeter. Les cotylédons et environ 0,5 cm de tournage doivent faire saillie hors de l'échancrure en U dans la plaque (figure 4A). Replacez soigneusement le couvercle de la plaque avec le U-encoche du couvercle sur le semis, la création d'un portail pour le semis (figure 4B).Réglez plaques de côté en piles horizontales jusqu'à ce que tous les plants ont été placés sur des microcosmes.
- Utilisez tous les plants de chaque plaque de germination que regarder viable et avoir une racine droite. (Si possible, laissez une plaque de semis fermés à utiliser en remplacement des plants flétris juste avant l'inoculation.)
- Après la pose de tous les plants, leur permettre de s'asseoir sur les microcosmes de l'horizontale Jensen alors que le S. suspensions d'inoculum meliloti sont en cours de préparation.
5. Préparation de S. meliloti inoculum Suspensions
- Vérifiez S. meliloti cultures périodiquement après l'inoculation pour être sûr qu'ils sont de plus en plus. Après une croissance de 2 jours, la DO 600 doit être comprise entre 2 et 4.
- Pipette 0,5 ml de chaque culture dans un tube de 1,5 ml stérile et centrifuger pour sédimenter. Retirer le surnageant.
- Laver les cellules deux fois dans les deux 0,85% de l'eau stérile ultrapure NaCl ou stérile. Remettre les cellules dans 0,5 ml de 0,85% sterile NaCl ou de l'eau ultra-pure.
- Mesurer la DO 600 d'une dilution 1/10 de remise en suspension S. meliloti cultures de l'étape 5.3. Sur la base de cette lecture, faire une suspension de chaque culture dans l'eau ultra-pure stérile à DO 600 = 0,05. Si la densité de cellules est trop élevée, la formation de nodules peut être inhibée. Faire suffisamment de la suspension diluée de sorte que 100 pl peuvent être inoculées sur chaque plant. Le trouble de la DO 600 = 0,05 suspension devrait être à peine perceptible à l'oeil.
6. Inoculation et scellement des microcosmes
- Immédiatement avant inoculations compter, vérifier les plants flétris qui n'ont pas survécu au transfert de microcosmes moyennes de la Jensen. Remplacez les plants avec des plants frais à partir de plaques de germination.
- Ouvrez chaque microcosme et inoculer 100 ml de l'S. approprié meliloti suspension sur la racine des plantules. Remettre le couvercle et mettre de côté dans STAC horizontaleks de 6-10 microcosmes. Pour chaque S. souche meliloti à comparer, ensemencer au moins 15 plantes. Pour les souches qui ont des différences subtiles dans la productivité symbiotique, inoculer 30-35 plantes. Laissez au moins 10 plantes non inoculées comme contrôle négatif. Inoculer 30-35 plantes avec S. meliloti 1021 ou d'une autre souche de type sauvage approprié pour servir de contrôle positif.
- Après l'S. suspension meliloti a eu le temps de s'adsorber sur la surface de la racine et le liquide de suspension a trempé dans la gélose (au moins 20 min.), envelopper individuellement chaque plaque avec un film de paraffine. Les plaques doivent être enveloppés au bord de l'encoche, mais le film de paraffine ne doivent pas bloquer la croissance de la plantule (figure 4C).
- Au moment de l'emballage, faire un contrôle final pour les racines ont adhéré à l'intérieur du couvercle de plaque. Pour enlever les racines adhéré du couvercle, poser la plaque à plat sur le banc et tapez ou feuilleter le couvercle de frapper la racine vers le bas sur la gélose surface.
- Alignez les portails de semis de chaque pile de plaques 6-10. Placez la pile à un angle de 90 ° avec les plants pointant vers le haut (figure 4D). La rigidité du film de paraffine tiendra les plaques en place assez longtemps pour envelopper toute la pile en papillote, en laissant une bande de 1-2 cm déballé où les plantules apparaissent (figure 4E). Le film sera de protéger les racines de la lumière.
- Placez les feuilles enveloppé piles dans une chambre de croissance éclairée ou chambre de croissance à 21-25 ° C, 60-70% d'humidité relative et 100-175 pmol / m -2 s -1 lumière sur un cycle de 16 heures de lumière sombre / 8 h ( Figure 1A). Dans ces conditions de croissance, une incubation prolongée à des niveaux de lumière supérieure à 200 umol / m -2 s -1 peut avoir un effet néfaste sur la croissance des plantes.
7. Examen des systèmes de racines et quantification des phénotypes symbiotiques
Les plantes peuvent être maintenus enmicrocosmes pour jusqu'à 9 semaines.
- nombre de nodules peut être quantifiée à une série de points de temps par déballer la feuille de chaque pile et comptage des nodules. Développer des nodules sur les plantes inoculées avec S. meliloti 1021 de type sauvage sont apparents par 10-14 jours après l'inoculation.
- Productivité symbiotique peut également être mesurée à chaque point de temps en mesurant la longueur de la tige émergente.
- Quantification finale de la productivité symbiotique est généralement effectuée à 7 semaines après l'inoculation en détachant le tournage et la mesure du poids frais de la pousse. Cette étape peut être réalisée aussi tard que si plus de 9 semaines de croissance est souhaitée.
Résultats
La préparation et l'inoculation de ces microcosmes de la plaque est relativement simple par rapport à la plupart des autres méthodes décrites dans l'introduction. L'utilisation de ces microcosmes permet également la croissance des plantes prolongée (jusqu'à 9 semaines) sans arrosage ou suppléments nutritionnels, maintien de la stérilité de la racine, à la fois faciliter l'examen des racines et de la protection des racines de la lumière, la croissance sans contrainte de la plante tire, un accès facile à la séance pour mesure de la longueur, et la suppression des plantes des microcosmes avec un minimum de dommages à poils racinaires. figure 1A montre les jeunes plants qui poussent dans des microcosmes dans un incubateur. Les images des figures 1B-1E montrent plusieurs vues différentes de microcosmes contenant M. truncatula A17 plantes inoculées avec type sauvage S. meliloti 1021. Si entassés,> 220 microcosmes tiendront sur un 73,8 cm x 67,5 cm incubateur plateau. Figures 1B et 1C montrent microcosmes dans unfeuille-pile enveloppée avec des plantes issues des portails dans les microcosmes. figure 1D montre un seul microcosme avec la feuille et la racine enlevé et montrant des nodules par la face avant de la plaque. figure 1E montre le même microcosme couché à plat avec la plante émergeant d' le portail dans la plaque. La longueur des pousses peut être mesurée à partir du point d'émergence du microcosme (figure 1C) sans déranger la plante. Figure 5A montre des données de longueur de tournage pour M. truncatula A17 plantes inoculées avec type sauvage S. meliloti 1021 par rapport aux plantes non inoculées à 7 semaines et 9 semaines après l'inoculation. La croissance dans les microcosmes est idéal pour la collecte d'une série de points dans le temps de développement des nodules et la longueur des pousses. Au point de temps finale, les pousses sont coupées hors de mesure de la pousse de poids frais (figure 5B). Figure 6 montre des exemples de trois phénotypes symbiotiques à 7 semaines post-inoculation. La productivité par rapport symbiotique de M. truncatula A17 plantes inoculées avec différentes S. souches meliloti est quantifiée par la longueur des pousses (figure 6A) et tirer le poids frais (figure 6B). Le nombre de nodules sur les racines des plantes inoculées avec ces souches est illustrée sur la figure 6C. Une couleur rose en raison de la production de léghémoglobine indique que les nodules sont fonctionnelles et capables de fixer l'azote, tandis que les petits nodules blancs sont habituellement non fonctionnel et / ou interrompu et les nodules sont brunes de sénescence et nécrotique 14-18. La comparaison de la figure 6 montre que la productivité symbiotique de M. truncatula A17 plantes inoculées avec S. meliloti 1021 portant le plasmide PSTB-LAFR5-exoY, qui surexprime le ExoY undécaprényl-phosphate-phosphotransférase galactose, est supérieure à celle du type sauvage de S. meliloti 1021 et souches portant le c négatif ontrol plasmide PSTB-LAFR5. Ces ExoY sur-exprimant souches produisent plus de l'exopolysaccharide symbiotique succinoglycane que les souches témoins. La capacité de quantifier les différences de phénotypes symbiotiques qui prennent plusieurs semaines à se manifester est un avantage majeur de cette méthode. Pour toutes les mesures de la productivité symbiotique sur M. truncatula A17, le Sinorhizobium medicae souches WSM419 et ABS7 de meilleurs résultats que S. meliloti 1021 (figures 6A-6C). (Les données de la figure 6 a été publié dans Jones (2012) 19.) Au moment où le microcosme est démonté et tirer les poids frais sont évalués, les racines peuvent également être visualisés par microscopie. Figure 7 montre une vue représentatifs de M. truncatula A17 racines après le retrait de microcosmes. Les poils absorbants ont subi des dommages minimes car les racines s'étendent sur la surface de l'agar-agar et ne sont pas déracinés d'une couche horizontale de gélose.
_content "> Les plantes peuvent être maintenues jusqu'à 9 semaines dans ces microcosmes, car il est ~ 70 ml de milieu de croissance agar dans la plaque. Après des périodes de croissance plus longues, certaines plantes peuvent commencer à sécher. Sept semaines de croissance est optimale pour la symbiose avec S. meliloti 1021. Par la symbiose plus efficace de M. truncatula A17 avec S. medicae WSM419 ou S. medicae ABS7, une période de croissance plus courte de 4-5 semaines est optimal.| Concentration finale par L | Quantité de solution mère | concentration de Stock |
| 1 g CaHPO4 | NA | NA |
| 0,2 g MgSO 4 · 7H 2 0 | 1 ml | 0,2 g / ml |
| 0,2 g de K 2 HP0 4 | 1 ml | 0,2 g / ml |
| 0,2 g de NaCl | 1 ml | 0,2g / ml |
| 0,1 g de FeCl 3 · 6H20 | 1 ml | 0,1 g / ml |
| 11,5 g d'agar purifié (voir le tableau des réactifs spécifiques pour les spécifications de gélose) | ||
| milliQ H 2 0 à 1 L |
Tableau 1. Le protocole milieu de gélose de Jensen pour microcosmes de la plaque. Des instructions de préparation pour le milieu de Jensen.
Étapes:
- Ajouter les ingrédients ci-dessus, et mélanger avec la barre d'agitation magnétique.
- Autoclave 45 min, cycle de liquide, avec la barre d'agitation dans le pichet.
Remarque: CaHPO 4 et FeCl 3 seront précipiter pendant l'autoclavage. Remuer pour les remettre en suspension, les médias resteront encore nuageux - Refroidir sous agitation jusqu'à ce que ce n'est pas douloureux pour ramasser le pot avec vos mains nues.
- Ajouter 1 ml d'oligo-éléments par L (voir ci-dessous pour la recette) WHagitation ile
Remarque: Assurez-vous de remettre en suspension le précipité dans les oligo-éléments avant la distribution. - Ajouter 0,25 ml NaOH 4 N par L, tout en remuant.
- Vérifier le pH en enlevant ~ 100 ul support avec une pipette stérile et l'application au papier pH
Remarque: pH 5-10 papier de gamme fonctionne bien. pH doit être ~ 7 Laissez quelques secondes pour le développement complet de la couleur. Si le pH n'est pas correct, il peut y avoir eu une erreur de préparation. - Verser plaques épaisses que possible, le remixage ballon en revenant à la plaque d'agitation magnétique,
Remarque: si une plaque est trop remplie (c'est à dire le liquide aspire dans le fond du couvercle),
Remarque: Attendez-vous à ~ 15 plaques par litre.
Oligo-éléments stock 1 L (stériliser à l'autoclave)
| 1 g H 3 BO 3 |
| 1 g de ZnSO 4 · 7H 2 0 |
| 0,5 g de CuSO 4 · 5H 2 0 |
| 0,5 g de MnCl 2 · 4H 2 0 |
| 1 g Namoo 4 · 2H 2 0 |
| mili-Q H 2 0 à 1 L |

Figure 1. Vues de microcosmes contenant des plantes inoculées avec S. meliloti 1021 A) Plantes en plaques microcosme de plus en plus dans un incubateur. B) M. truncatula A17 plantes inoculées avec S. meliloti 1021 de type sauvage de plus en plus à travers l'encoche en haut de microcosmes de gélose de Jensen. C) Autre vue du close-up des plaques en B montrant la culture de plantes par des encoches dans les microcosmes. D) Une des plaques de microcosme de B et C à la racine nodules de représentation à travers le couvercle. E) La plaque vientm D plat avec le tournage sortir de l'encoche.
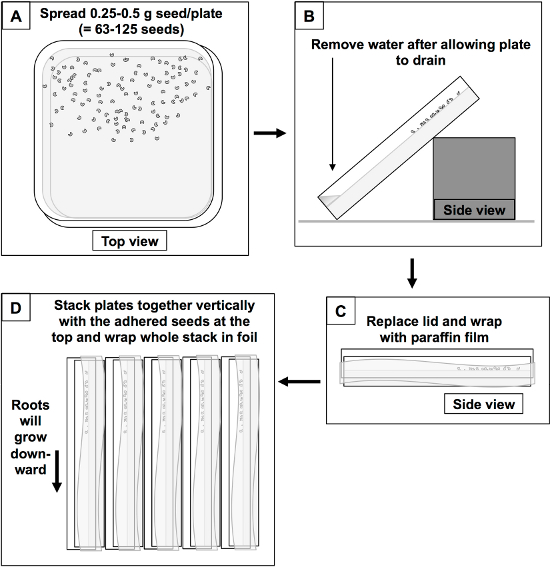
Figure 2. Plaque graine de germination set-up. A) Les semences sont distribuées à travers un demi-bon de 100 mm plaque carrée. B) surface Agar est évacuée en laissant l'eau pour recueillir au fond d'une plaque inclinée. C) Les plaques sont emballées dans une pellicule de paraffine, empilés et D) de la pile tourné à un angle de 90 o et enveloppés dans une feuille.
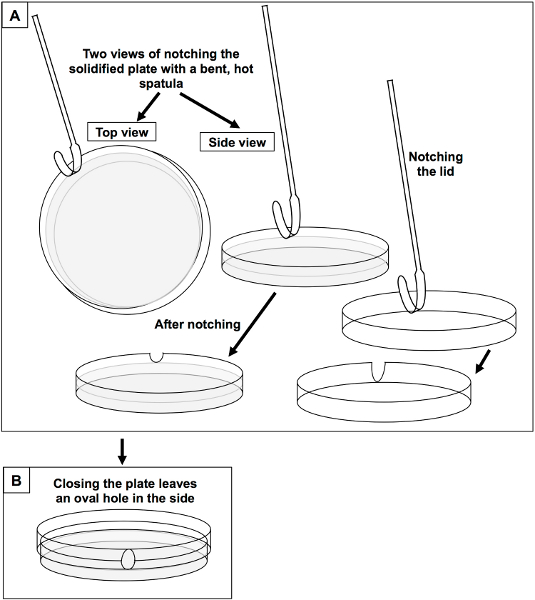
Figure 3. Construction de microcosmes en cochant les plaques de Jensen avec une spatule coudée. A) Une spatule métallique de pesage qui a été pliée pour former un ovale flamme est chauffé et utilisé pour entailler un trou en forme de U dans le côté de l'et dans la plaque latérale du couvercle. Le fond de l'entaille en U dans la plaque doit être au dessus de la surface de la gélose. Le fond de l'entaille en U, le couvercle doit être tout le chemin dans la partie supérieure du couvercle. B) En remplaçant le couvercle sur la plaque crée un portail de forme ovale à travers laquelle le plant peut faire saillie.

Figure 4. Insertion des jeunes plants dans des microcosmes. A) Deux vues montrent comment la racine de semis doit poser sur la surface de la gélose avec les cotylédons et ~ 0,5 cm de tournage saillie hors de l'U-entaille dans la plaque. B) et C) Placer le couvercle sur la plaque avec des encoches alignées va créer un portail ovale pour le semis. Enrouler la plaque hermétiquement avec un film de paraffine permet de garder le couvercle de se déplacer et éviter le dessèchement. D) Les plaques peuvent ensuite être empilés en groupes de 6-10, et E) enveloppé de papier d'aluminium. Cliquez ici pour agrandir la figure .

Figure 5. Phénotypes symbiotiques représentatifs après 7 semaines de croissance et 9 semaines croissance de M. truncatula A17 dans des microcosmes individuels. A) La longueur des pousses de plantes inoculées avec S. meliloti 1021, et la longueur des pousses de plantes non inoculées ont été mesurés à 7 semaines sans enlever les plantes à partir des microcosmes. À 9 semaines après l'inoculation, la longueur des pousses a été mesurée (A), puis les pousses ont été coupé et pesé (B).
. Jpg "/>
Figure 6. Phénotypes symbiotiques représentatifs après 7 semaines de croissance de M. truncatula A17 dans des microcosmes individuels. souches de S. exoY surexprimant meliloti 1021 ont amélioré la symbiose sur la plante hôte Medicago truncatula A17. La productivité symbiotique de S. meliloti 1021 sur M. truncatula A17 est améliorée dans les souches qui surexpriment le galactose phosphotransférase undécaprényl-phosphate codée par exoY. Productivité symbiotique est mesurée par (A) la longueur des pousses en cm et (B) tirer poids frais en grammes. Le nombre de nodules roses fonctionnels (bas de la barre de graphique); blancs, nodules inefficaces (barre graphique du milieu), et brun, des nodules nécrotiques (en haut de la barre de graphique) sont présentés dans (C). La productivité et nodule nombre symbiotique des plantes inoculées avec S. medicae souches WSM419 et ABS7 sont également présentés. Astérisques plus de barres du graphique représentent une statistiquedifférence significative ment de la souche de référence 1021 de type sauvage dans un test t non apparié. Les plants inoculés avec un mutant nul exoY :: Tn5 qui ne produit pas de succinoglycane avaient longueurs de pousses similaires et poids frais pour les plantes non inoculées, et n'ont produit que blancs, nodules inefficaces. Les graphiques en (A) et (B) ont été publiées à l'origine dans 19. Cliquez ici pour agrandir la figure .
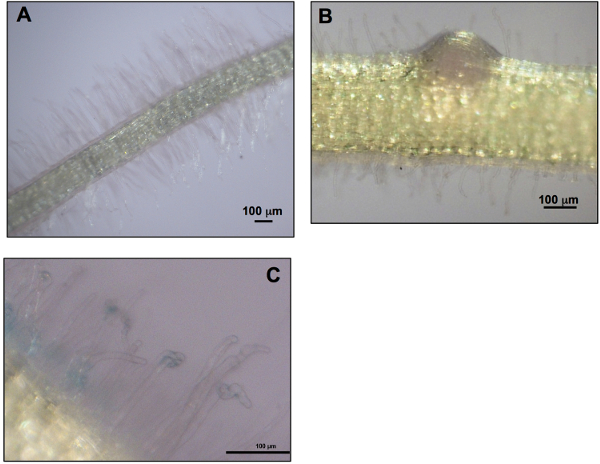
Figure 7. Roots imagées sur un microscope à dissection après élimination de microcosmes. Roots peuvent être facilement retirés des microcosmes pour l'imagerie avec des dommages minimes pour les poils absorbants, car ils se trouvent sur la surface de la gélose. Images montrent racines de M. truncatula A17 à 10 jours après l'inoculation (A, B) et 14 jours post-inoculation (C). Les racines affichés ont été inoculés avec S. meliloti 1021 de type sauvage (A), un S. meliloti souche portant une fusion EGLC :: GUS (B), et un S. meliloti souche portant un SMc00911 :: GUS 20 fusion (C). La coloration GUS de S. cellules meliloti portant la fusion SMc00911 :: GUS est visible sur la racine des poils et la surface de la racine dans E. Bar correspond à 100 um. Cliquez ici pour agrandir la figure .
Discussion
Il ya plusieurs étapes du protocole qui sont essentiels pour le succès: 1) La nécessité d'utiliser, plante de culture cellulaire purifié testé agar ne peut pas être surestimée. Ce n'est pas critique pour plantules de luzerne, mais il est essentiel pour la croissance de M. truncatula A17. 2) Il est important de faire germer les semis sur des plaques d'agar vertical, comme décrit à l'étape 1. La technique largement utilisée de la germination des plants sur une surface horizontale inversée dans une assiette creuse de 15 mm 7 n'est pas conseillé pour ce protocole parce que les racines des plantules seront trop courtes et / ou non linéaire. Plants à racines directement la croissance de 2-4 cm de longueur sont idéales pour le transfert de plaques de germination de microcosmes. Trois jours de croissance dans les plaques de germination verticales est généralement idéal pour les racines pour atteindre cette longueur. 3) Il est également essentiel pour éviter la contamination des plants avec des rhizobiums avant l'inoculation. Avant le transfert des plantules à partir des plaques de germination à microcosms, la zone de travail doit être soigneusement nettoyé avec de l'éthanol et tous les instruments utilisés dans le transfert devrait être difficilement souvent stérilisé. Une autre source potentielle de contamination peut être évitée en préparant le S. suspensions de contrainte meliloti pour l'inoculation des microcosmes dans une zone séparée de travail de celui utilisé pour la préparation des semis. La contamination fongique des microcosmes peut également être évitée en supprimant tous les restes de l'enveloppe de la graine de l'intérieur du microcosme, car les spores fongiques peuvent être incorporés dans le revêtement. 4) la survie des semis peut être maximisée en gardant les racines des semis humide et en contact avec de l'agar en tout temps, et par un traitement très doux pendant le transfert. Toute semis avec la racine piégé dans de la gélose dans la plaque de germination doit être excisée avec soin pour éviter tout dommage à la racine. Un rendement élevé de plantes viables peut être obtenu en faisant une vérification finale pour les semis fanées dans les piles de microcosmes avant inoculations débutants, et leur remplacement esprith nouveaux plants. Si les plantules sont en bon état et qui n'ont pas adhéré à l'intérieur du couvercle de plaque, moins de 5% des plants devrait besoin d'être remplacé, à ce stade. Obstruction de la croissance des pousses du microcosme peut être évité en faisant en sorte que les débris d'enveloppe de la graine sont contraignantes les cotylédons et que le microcosme est parafilm-enveloppé avec soin afin que le tournage ne sera pas entravée.
Nous utilisons régulièrement cette méthode pour étudier la symbiose dans les plantes hôtes M. truncatula A17 et de la luzerne, et nous sommes en train de l'optimisation de la technique pour la croissance de l'autre M. cultivars de truncatula, d'autres espèces de Medicago et des espèces de Melilotus (mélilot). Nous n'avons pas encore testé cette méthode avec M. truncatula A20, qui est un écotype qui est utilisé en tant que partenaire de cartographie génétique avec A17. Nous avons découvert que M. truncatula cv. R108 ne pousse pas bien sur l'ag de plante de culture cellulaire testée purifiéear que nous utilisons actuellement et nous essayons d'identifier une autre préparation d'agar agar ou un substitut pour une utilisation comme un microcosme de croissance substrat pour ce cultivar.
En comparaison de la méthode décrite ici avec d'autres méthodes couramment utilisées pour l'analyse de l'M. truncatula A17 / S. meliloti symbiose, nous avons trouvé que c'était de loin la meilleure méthode pour comparer simultanément les performances symbiotique d'un grand nombre de S. meliloti souches. Nous systématiquement mis en place 250 microcosmes à la fois (10 souches différentes de S. meliloti inoculés sur 25 sujets de chacune.) Si un seul génotype de S. meliloti ou S. medicae doit être utilisé, et la contamination croisée n'est pas un risque, caissons aéroponique ou des poches de croissance peuvent être une méthode plus appropriée. Cette méthode plaque de microcosme est également la meilleure méthode pour faire des observations périodiques de la progression du développement de nodules et de la productivité symbiotique sur une longue période detemps. Phénotypes qui se manifestent dans les derniers stades de la symbiose, tels que la sénescence des nodules, peuvent être étudiés plus facilement avec cette méthode qu'avec les autres protocoles.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été financé par l'Institut national de l'USDA pour l'alimentation et l'agriculture, de l'agriculture et de l'Initiative de recherche alimentaire subvention 2010-65108 - 20582 à KMJ Nous remercions Brian K. Washburn examen critique du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Agar purified, plant cell culture-tested | Sigma | A7921 |
Références
- Galibert, F., et al. The composite genome of the legume symbiont Sinorhizobium meliloti. Science. 293, 668-672 (2001).
- Young, N. D., et al. The Medicago genome provides insight into the evolution of rhizobial symbioses. Nature. 480, 520-524 (2011).
- Glazebrook, J., Walker, G. C. Genetic techniques in Rhizobium meliloti. Methods Enzymol. 204, 398-418 (1991).
- Cheng, X., Wen, J., Tadege, M., Ratet, P., Mysore, K. S. Reverse genetics in medicago truncatula using Tnt1 insertion mutants. Methods Mol Biol. 678, 179-190 (2011).
- Leigh, J. A., Signer, E. R., Walker, G. C. Exopolysaccharide-deficient mutants of Rhizobium meliloti that form ineffective nodules. Proc. Natl. Acad. Sci. USA. 82, 6231-6235 (1985).
- Wong, K. K. Y., Fortin, J. A. A Petri Dish Technique for the Aseptic Synthesis of Ectomycorrhizae. Canadian Journal of Botany-Revue Canadienne De Botanique. 67, 1713-1716 (1989).
- Barker, D. G., et al. The Medicago truncatula handbook. Mathesius, U., Journet, E. P., Sumner, L. W. , (2006).
- Leonard, L. T. A Simple Assembly for Use in the Testing of Cultures of Rhizobia. J Bacteriol. 45, 523-527 (1943).
- Trung, B. C., Yoshida, S. Improvement of Leonard jar assembly for screening of effective rhizobium. Soil Sci Plant Nutr. 29, 97-100 (1983).
- Penmetsa, R. V., Cook, D. R. Production and characterization of diverse developmental mutants of Medicago truncatula. Plant Physiol. 123, 1387-1398 (2000).
- Garcia, J., Barker, D. G., Journet, E. P. The Medicago truncatula handbook. Mathesius, U., Journet, E. P., Sumner, L. W. , (2006).
- Vincent, J. M. A Manual for the Practical Study of the Root-Nodule Bacteria. , Blackwell. (1970).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning: a laboratory manual. , 2nd, Cold Spring Harbor Laboratory Press. (1982).
- Pladys, D., Vance, C. P. Proteolysis during Development and Senescence of Effective and Plant Gene-Controlled Ineffective Alfalfa Nodules. Plant Physiology. 103, 379-384 (1993).
- Vasse, J., de Billy, F., Truchet, G. Abortion of infection during the Rhizobium meliloti-alfalfa symbiotic interaction is accompanied by a hypersensitive reaction. The Plant J. 4, 555-566 (1993).
- Johnson, L. E. B., Vance, C. P. Histological and Biochemical Comparisons of Plant Induced Ineffective Nodules. Phytopathology. 71, 884(1981).
- Vance, C. P., Johnson, L. E. B., Hardarson, G. Histological Comparisons of Plant and Rhizobium Induced Ineffective Nodules in Alfalfa. Physiological Plant Pathology. 17, 167(1980).
- Van de Velde, W., et al. Aging in legume symbiosis. A molecular view on nodule senescence in Medicago truncatula. Plant Physiol. 141, 711-720 (2006).
- Jones, K. M. Increased production of the exopolysaccharide succinoglycan enhances Sinorhizobium meliloti 1021 symbiosis with the host plant Medicago truncatula. J Bacteriol. 194, 4322-4331 (2012).
- Queiroux, C., et al. A comparative genomics screen identifies a Sinorhizobium meliloti 1021 sodM-like gene strongly expressed within host plant nodules. BMC Microbiol. 12, 74(2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon