Method Article
Cytométrie de masse: Protocole pour Tuning quotidien et échantillons cellulaires course sur un cytomètre de masse CyTOF
Dans cet article
Résumé
Les mesures nécessaires pour la syntonisation par jour et d'optimisation de la performance d'un cytomètre de masse CyTOF sont décrits. Commentaires sur la préparation optimale de l'échantillon et le débit sont discutés
Résumé
Ces dernières années, l'analyse rapide de cellules individuelles a souvent été réalisée en utilisant la cytométrie en flux et des anticorps à marquage fluorescent. Toutefois, la question du chevauchement spectral d'émission des fluorophores a limité le nombre de sondes simultanées. En revanche, le cytomètre de masse nouvelle CyTOF par des couples Sciences DVS un système d'introduction de liquide à cellule unique à un ICP-MS. 1 Plutôt que de fluorophores, les polymères chélateurs métalliques contenant des isotopes hautement enrichi sont couplés à des anticorps ou d'autres sondes spécifiques 2-5. En raison de la pureté du métal et de la résolution en masse du cytomètre de masse, il n'existe pas de "chevauchement spectral" des isotopes voisins, et donc pas de nécessité pour les matrices de compensation. De plus, en raison de l'utilisation de métaux lanthanides, il n'y a pas d'arrière-plan biologique et donc pas d'équivalent de l'autofluorescence. Avec une fenêtre de masse couvrant masse atomique 103-203, théoriquement jusqu'à 100 étiquettes peuvent être distingués en même temps. Actuellement, Plus de 35 chaînes sont disponibles en utilisant les réactifs chélateur disponible à partir Sciences DVS, ce qui permet une dissection sans précédent du profil immunologique des échantillons. 6-7
Inconvénients de la cytométrie de masse comprennent l'exigence stricte d'un isotope métallique séparé par la sonde (pas d'équivalent de la diffusion vers l'avant ou sur le côté), et le fait qu'il s'agit d'une technique destructrice (pas de possibilité de tri de récupération). La configuration actuelle du cytomètre de masse a également un taux de transmission de cellules de seulement ~ 25%, ce qui nécessite un nombre élevé de cellules d'entrée.
Optimal performance quotidienne de l'cytomètre de masse nécessite plusieurs étapes. L'objectif de base de l'optimisation est de maximiser l'intensité du signal mesuré des isotopes métalliques désirés (M), tout en minimisant la formation d'oxydes (+16 M) qui va diminuer l'intensité du signal M et interférer avec un signal désiré à M +16. La première étape consiste à chauffer la machine pour un climat chaud et stable, jeCP plasma a été mis en place. Deuxièmement, les paramètres de débit de gaz actuelle et le maquillage doit être optimisée sur une base quotidienne. Lors de la collecte de l'échantillon, le taux cellulaire maximale événement est limitée par l'efficacité du détecteur et de la vitesse de traitement de 1000 cellules / seconde. Toutefois, en fonction de la qualité de l'échantillon, un taux plus lent cellule événement (300-500 cellules / seconde) est généralement souhaitable de permettre une meilleure résolution entre les événements cellules et donc de maximiser maillots intactes au cours des doublets et des débris. Enfin, un nettoyage adéquat de la machine à la fin de la journée contribue à réduire le signal de fond en raison de métal libre.
Protocole
Tous les échantillons cellulaires pour la CyTOF doivent être fixées et perméabilisées. Cela permet une plus grande entrée de la intercalant d'ADN contenant de l'iridium, et empêche également la lyse des cellules pendant le lavage de l'eau MilliQ et des mesures de remise en suspension immédiatement avant l'injection dans le cytomètre de masse.
1. Démarrage de la cytomètre de masse
- Ouvrez le logiciel CyTOF. Sélectionnez Configuration de l'instrument. Dans l'onglet Cage carte, allez dans le coin en bas à droite et cliquez sur Chauffe bouton «ON». Allumer le chauffage au moins 15 minutes avant l'heure souhaitée pour laisser suffisamment de temps pour le manteau chambre de pulvérisation pour atteindre 200 ° C.
- Remplacez le blanc Norm-Ject seringue de 3 ml dans la seringue avec une seringue remplie d'eau fraîche MilliQ.
- Nettoyage du nébuliseur. Rincer l'nébuliseur en utilisant la seringue et le tube de retirer 5% Citranox 2-3 fois à la fois par le port plus petit d'introduction de liquide et le port de gaz plus important introduction. Répétez rinçage avec de l'eau MilliQ to retirer Citranox résiduelle.
- Vérifiez pour confirmer que les voyants sur le panneau avant de l'CyTOF sont allumés comme dans la figure 1.

Figure 1. CyTOF voyants du panneau avant démarrage.
- Ouvrez le robinet de réservoir de gaz argon. Cela devrait provoquer la "ARGON" lumière sur le devant pour l'allumer.
- Fixez le nébuliseur au maquillage entrée de gaz. Dévissez le make-up raccord de tuyau de gaz et retirez le noir joint torique en caoutchouc et le blanc pièce conique en plastique. Noter la plus large "articulation" sur la tige de mise en place d'orifice de gaz du nébuliseur. Placer le connecteur sur l'orifice d'introduction de gaz. Placer le joint torique noir sur l'extrémité de l'orifice de gaz, et forcer le joint torique passé la plus grande partie de la tige de port. Placer le blanc pièce conique en plastique sur le dessus avec l'extrémité étroite souligné, et le visser sur le tube gaz d'appoint.
- Fixer le nébuliseur à la tubulure d'introduction de liquide. Soigneusement insérer le tube dans la petite ouverture à l'extrémité du nébuliseur. Il y aura deux arrêts, semblables à se sentir à l'arrêt sur une micropipette. Tout d'abord, appuyez sur jusqu'à ce que vous rencontrer de la résistance de la lumière; la fin du petit tube doit être à la fin de la section droite de verre. Deuxièmement, appuyer plus fort pour forcer la fin de la section droite de verre plus loin dans le raccord et serrez la vis de fixation à sceller. Insérer l'extrémité du nébuliseur dans l'ouverture de blanc dans le chauffe-ballon.
- Dans l'onglet Contrôleur RFG de la fenêtre de configuration de l'instrument, appuyez sur "Start plasma". Depuis le nébuliseur est déjà inséré, appuyez sur "OK". Le logiciel se mettra en marche le refroidisseur, démarrer le flux de gaz et allumer un plasma. Le détecteur de tension augmentera progressivement. Il y aura une fenêtre pop-up disant "Plasma séquence de démarrage est terminée avec succès" lorsque vous avez terminé, appuyez sur "OK". Nouvel éclairage devrait être sur le panneau avant (Figure 2 >).

Figure 2. Voyants du panneau de CyTOF après plasma enflammé et le démarrage réussi.
- Mise en marche de la pompe seringue. Dans le coin supérieur droit, appuyez sur le vert bouton "play" pour démarrer la pompe seringue et commencer à verser le liquide à travers le tube et la pulvérisation hors du nébuliseur. Les réglages par défaut sont seringues de 3 ml d'eau. Pour que l'échantillon soit circulant dans la boucle d'échantillonnage, le pousse-seringue doit être changé périodiquement quand il est à court d'eau. Dans la partie supérieure de l'écran, il ya un compteur indiquant la quantité de liquide a coulé sur la pompe à seringue. La pompe à seringue s'arrête lorsque ce compteur atteint "3,000" ou le plongeur atteint la fin de la seringue. Lors du remplissage de la seringue, vous devez cliquez sur "stop" plutôt que le bleu bouton "pause" pour réinitialiser le compteur.
- Le cytomètre de masse aura besoin d'environ 20 minutes pour obtenir un chaud, un plasma stable avant l'étalonnage. Le but de l'incrément de fréquence est de maximiser le signal désiré de Tm169 ou Tb159 tout en gardant "Gd155" (oxyde; La139 + O16) signaux de moins de 3% de la valeur supérieure. Cliquez sur le bouton Acquisition Paramètres pour ouvrir la fenêtre des paramètres d'acquisition de données. Dans l'onglet analytes, cliquez sur le tableau périodique pour ouvrir le panneau de sélection des isotopes. Sélectionnez les isotopes présents dans la solution DVS Sciences réglage indiqué dans le manuel, puis cliquez sur "Enregistrer".
- Cliquez sur les isotopes Par Reading bouton pour ouvrir la Masse (s) Par la fenêtre de lecture. Sélectionnez "impulsions de comptage", et redimensionnez l'axe des y en entrant un nouveau numéro et en appuyant sur "Entrée".
- Remplissez un vert 1 ml Norm-Ject seringue avec une solution de réglage. Tournez le sélecteur de port à échantillon "LOAD", injecter 450 ul de la solution mise au point, puis tourner le sélecteur sur "INJECT". Dans l'onglet Étalonnage selon la masse de l'Acquisit données ion fenêtre Paramètres, appuyez sur "Exécuter" pour contrôler les masses qui affluent par. Le côté gauche de la fenêtre est plus faible masse, tandis que le côté droit est plus élevée masse. Remarque: il y aura déjà des signaux dans la région TOF 9400-9800, en raison des isotopes de xénon dans le gaz d'argon (figure 3). Attendez jusqu'à ce que la solution de réglage isotopes commencent à apparaître sous forme de traînées de cet écran (figure 4).
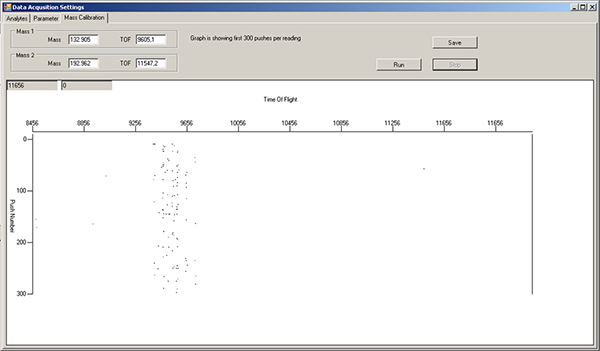
Figure 3. Fenêtre de l'onglet masse d'étalonnage, indiquant les niveaux de fond pour les différents isotopes après la solution de lavage et de rinçage à l'eau. La région autour de TOF 9400-9800 correspond aux isotopes de xénon dans le gaz argon, et doit toujours être présent. Cliquez ici pour agrandir la figure .
4 "src =" / files/ftp_upload/4398/4398fig4.jpg "/>
Figure 4. Fenêtre de l'onglet masse d'étalonnage, montrant des stries verticales pour divers isotopes en solution réglage DVS. Cliquez ici pour agrandir la figure .
- Retour à la page Masse (s) Par la fenêtre de lecture et appuyez sur le vert bouton "Play" dans le coin supérieur gauche. Chaque isotope sélectionné à l'étape 2,1 est représentée par une ligne de couleur différente. La valeur par défaut est l'axe des x "Time", en sec. Surveiller les niveaux des différents isotopes jusqu'à ce qu'ils soient stables.
- Réglage du courant. Dans l'onglet Paramètres de la fenêtre des paramètres d'acquisition de données, sélectionnez "courant" dans le menu déroulant. Commençons = 0, finition = 10 valeur de l'étape = 0,5, temps de stabilisation = 200, et appuyez sur "Enregistrer". Cliquez de nouveau sur l'Masse (s) Par la fenêtre de lecture et appuyez sur Lecture. L'axe des abscisses est maintenant "en cours". Noter le cas des signaux du pic isotopes (figure 5), et r ECORD. Sous l'onglet Configuration du CAD canaux de la fenêtre de configuration de l'instrument, faites défiler vers le bas pour "Current" et entrez la nouvelle valeur. Appuyer sur "Set la valeur actuelle réelle", puis "enregistrer".

Figure 5. Profil de réglage actuel.
- Réglage du gaz d'appoint. Changer le menu déroulant de «gaz d'appoint." Commençons = 0,55, fin = 0,95 valeur de l'étape = 0,05, temps de stabilisation = 200. Appuyez sauver. Retour à la messe (s) par la fenêtre de lecture et appuyez sur Lecture. L'axe des abscisses est maintenant «gaz d'appoint" débit. Enregistrer lorsque les signaux de la crête isotopes. Observez l'augmentation rapide de la "Gd155" signal vers la fin (figure 6). Revenez à l'onglet Configuration du CAD canaux, faites défiler jusqu'à «gaz d'appoint", et entrez la nouvelle valeur. Appuyer sur "Set la valeur actuelle réelle", puis "enregistrer".
igure 6 "src =" / files/ftp_upload/4398/4398fig6.jpg "/>
Figure 6. Make-up profil de réglage du gaz.
- Taux d'enregistrement désiré isotope vs oxyde. Faire une deuxième injection de 450 pi de solution de tuning. Dans l'onglet Paramètres, sélectionnez "Time" dans le menu déroulant, commençons = 0, fin = 10, valeur du pas = 1, le temps de stabilisation = 200. Appuyez sur "Enregistrer". Cliquez sur "play" en Masse (s) Par la fenêtre de lecture. Après les lignes se sont stabilisés (Figure 7), utilisez le curseur pour lire la valeur dans les cases en haut à gauche pour Tm169 ou Tb159 (valeur supérieure) et aussi le "Gd155" valeur (<3% de la valeur supérieure). Ces valeurs peuvent également être enregistrés dans un fichier de réglage pour référence future.

Figure 7. Mesure des intensités de réglage de solutions de signal après l'optimisation de gaz actuelle et maquillage.
- Nettoyage de samboucle exemple. Injecter 3 ml d'eau MilliQ à travers la boucle d'échantillon, puis 500 ul de solution de lavage DVS. Surveiller la progression du nettoyage en appuyant sur "Exécuter" dans l'onglet Etalonnage de masse. Lavez jusqu'à ce que l'intensité des raies (figure 4) commence à diminuer, puis suivez par 3 ml d'eau MilliQ et le moniteur jusqu'à ce que le bas des niveaux de fond (figure 3).
3. Des échantillons en cours d'exécution
- Ouvrez la fenêtre d'acquisition. Les paramètres par défaut: Do Analysis = On-The-Fly, Signal Analyser = double, d'étalonnage comptage double = données. Réduction du bruit est activée. N'importe lequel de ces peuvent être modifiées si nécessaire. Entrez le nom du fichier. Tous les fichiers doivent être enregistrés à l'E :/ / lecteur.
- Réglage des retards d'acquisition. Il y aura un léger retard dans l'enregistrement des événements cellulaires d'environ 30 secondes en raison de la longueur du tuyau entre la boucle d'échantillonnage et le nébuliseur. Par conséquent, la somme de «retard d'acquisition" et "st détecteurretard capacité »doit être d'au moins 30 secondes. retard stabilité détecteur doit être d'au moins 20 sec.
- Réglage de l'heure de collecte de données. "Le temps d'acquisition" représente le nombre de secondes que vous voulez exécuter votre échantillon. Remplissage de la boucle d'échantillon entier 450 ul exigerait 600 sec pour terminer. Il est suggéré que 50-100 sec est ajouté à la fin de la durée de fonctionnement afin de minimiser l'échantillon report.
- La remise en suspension de l'échantillon. Pour réduire au minimum l'accumulation de sels dans la machine, il est suggéré qu'au moins deux lavages dans de l'eau MilliQ être fait à la fin de la coloration des cellules, suivie d'une remise en suspension dans de l'eau MilliQ finale. Le volume d'eau MilliQ utilisé pour remettre en suspension le culot cellulaire varie en fonction du nombre de cellules que vous avez commencé avec la cellule et la récupération après la procédure de coloration entier. Un bon point de départ est 10 6 (départ) les cellules / ml. Après remise en suspension, filtrer à travers un tamis cellulaire pour éliminer les agrégats.
- Échantillon de départ courir. Entrez un nouveau nom de fichier pour l'échantillon courant. Placez la vanne de boucle d'échantillon sur «LOAD», injecter l'échantillon, revenir à "injecter", puis cliquez sur "Exécuter" dans la fenêtre d'acquisition.
- Enregistrement des événements cellulaires. Les cellules seront représentés dans la fenêtre aperçu que des collections de marques horizontales dans chaque isotope vertical / marqueur de voie (Figure 8). Alors que le cytomètre de masse peut enregistrer 1000 cellules / sec, une meilleure résolution entre les événements cellulaires est généralement obtenue à 300-500 cellules / sec. Cela correspond à une moyenne de ~ 1 cellule / rafraîchissement de l'écran. Il peut prendre jusqu'à 30 secondes avant que le compteur d'événements cellule commence à monter. Cela est dû à «on-the-fly" traitement des données; aucune informations sur les événements cellule est perdue.
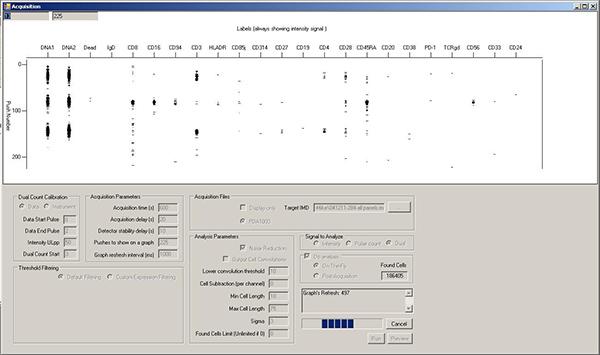
La figure 8. Fenêtre d'acquisition au cours de l'échantillon en cours d'exécution, montrant les lignes horizontales de points correspondant aux éléments associés à trois événements séparés de cellules.ww.jove.com/files/ftp_upload/4398/4398fig8large.jpg "target =" _blank "> Cliquez ici pour agrandir la figure.
- Qualité d'événements cellulaires. Avis n'importe quel fond de stries dans chaque canal isotopes, ainsi que le taux d'événements cellule. Le cytomètre de masse reconnaît un «événement cellulaire» comme une certaine augmentation de signal au-dessus de fond, donc le signal de fond en métal libre ou non liée anticorps peut modifier l '«événement cellule" count. En outre, la course cellules à une concentration trop élevée peut causer une augmentation du nombre d'événements doublet. Le fond peut être diminuée par des lavages supplémentaires ou de dilution plus grande cellule. Doublets peuvent être minimisés par une dilution plus grande cellule, au prix de temps d'exécution accrue.
- Finition échantillon acquisition de données. Lorsque le temps d'acquisition a été atteint, la collecte des données se terminera. Il y aura un peu de retard devant une fenêtre pop-up avec un bouton "OK" apparaît de nouveau, cela est dû à «à la volée» de traitement des données. L'acquisition de l'échantillon peut également être arrêté Prematurely en cliquant sur le bouton "Stop". Dans ce cas, tous les événements cellulaires déjà inscrits seront comptés et transformés en fichiers de sortie.
- Injection d'au moins 500 pi d'eau MilliQ entre chaque échantillon permet également de minimiser contamination de l'échantillon.
4. Nettoyage de la machine après utilisation
- La solution de lavage. Après que l'échantillon final est réalisé et la boucle d'échantillon rincé à l'eau, injecter 450 pi de solution de lavage dans la boucle d'échantillonnage. Surveiller la libération de métal libre dans l'onglet Etalonnage de masse de la fenêtre d'acquisition de données des paramètres comme à l'étape 2.8 (figure 9). Lorsque le signal sans métal commence à diminuer, rincer avec 3 ml d'eau MilliQ et surveiller jusqu'à ce que les niveaux de fond sont atteints.

Figure 9. Fenêtre de l'onglet Masse de calibrage, au cours de l'après-cycle de nettoyage avec la solution de lavage DVS. Les stries verticales dans la région TOF sont 9800-11000 anticorps-isotopes étiquette en cours de nettoyage de la machine. Les stries verticales autour TOF 11500 correspondent aux deux isotopes intercalant Ir. Cliquez ici pour agrandir la figure .
5. Arrêter la machine
- Dans l'onglet Contrôleur RFG de la fenêtre de configuration de l'instrument, sélectionnez "Stop plasma". Lorsque la procédure est terminée, il y aura une fenêtre pop-up vous demandant de retirer le nébuliseur. Appuyez sur "OK". Dans l'onglet Cage carte, éteignez l'appareil. Fermez le robinet de l'alimentation d'argon.
- Retrait du nébuliseur. Retirer le nébuliseur de la chambre de pulvérisation en tirant doucement vers l'arrière. Dévissez le tuyau d'introduction d'échantillon de 1,6 Step et mettre de côté. Dévissez le make-up de connexion d'introduction de gaz pour desserrer légèrement, puis tirez le nébuliseur hors tension. Laissant le raccord vissé permettra de réduire les chances de lOsing le noir joint torique en caoutchouc et blanc pièce conique en matière plastique.
- Nettoyage du nébuliseur. Backflush les deux ports du nébuliseur avec Citranox 5% en utilisant la seringue et des tubes comme à l'étape 1.3. Couvrir et conserver au Citranox 5% jusqu'à la prochaine utilisation.
Résultats
En suivant le protocole ci-dessus doivent accomplir quatre choses. Tout d'abord, permettant échauffement adéquat du temps pour le cytomètre de masse produira une chaude, plasma stable nécessaire pour un signal optimal et la formation de l'oxyde minime. Deuxièmement, lavage adéquat du cytomètre de masse avec de l'eau MilliQ et la solution de lavage DVS (figure 9) aidera à réduire les niveaux de métal d'adsorption à la tubulure et d'autres parties de la machine, en aidant à réduire le fond lors de l'acquisition de l'échantillon (figure 8). Il contribuera également à éliminer toutes les cellules qui pourraient se coincer dans la machine et minimisant ainsi le report d'un échantillon à. Troisièmement, alors que la formation d'oxyde ne peut pas être complètement évité, bon réglage du cytomètre de masse (figures 5-7) aidera à optimiser le signal total à la masse M désirée, tout en minimisant arrière-plan à la masse d'oxyde M +16. Comme le montre la figure 10, le réglage incorrect (magenta) augmente significativement la formation d'oxyde àM 16 par rapport à l'échantillon correctement réglé (bleu foncé). Cela a pour effet de diminuer légèrement signal désiré en M, et augmenter considérablement l'interférence de fond indésirable à M +16.
Enfin, le lavage adéquat de l'échantillon dans des tampons et enfin dans de l'eau MilliQ devrait permettre de réduire le signal de fond en métal / anticorps à des niveaux acceptables. Les lavages à l'eau MilliQ et remise en suspension sont essentielles pour maintenir constants les paramètres actuels tout au long de plusieurs heures d'autonomie. Dilution appropriée de l'échantillon dans de l'eau MilliQ doit être déterminée sur la base d'un échantillon quotidien. Cependant, la dilution à ~ 10 6 (départ) les cellules / ml est un bon endroit pour commencer. Sur la base du premier échantillon d'un ensemble, une dilution plus ou moins importante pour les échantillons suivants peuvent être logés. Lavage approprié et adéquat assureront la dilution de fond minimal et la plus grande résolution des cellules, tout en équilibrant le besoin de vitesse (Figure 8).
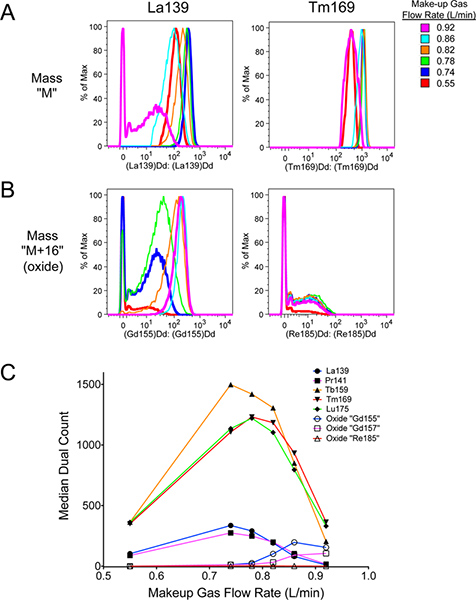
Figure 10. Effet de la mise au point correcte sur le signal désiré, et la différence dans la formation d'oxyde entre différents métaux lanthanides. Contenant des billes de polystyrène naturel abondance La139, Pr141, Tb159, Tm169 et Lu175 de Sciences DEP ont été exécutés en mode d'acquisition cellule. Des échantillons distincts des perles ont été effectués à l'indiqués Make-up débits de gaz (comparer avec la figure 6). Les données ont été analysées à l'aide FlowJo v9.4.9 pour Mac, y compris les débris de déclenchement de rupture du talon. L'échantillon a été correctement réglé à 0,74 L / min. Cela a eu des intensités de signaux plus élevés que les débits inférieurs, et plus de signal aux masses "M" en métal avec moins de signal "M 16" masses d'oxyde que le signal incorrectement réglé. A. Signal à "M" masse La139 et Tm169. Notez que La139 intensité du signal est affectée par plus de Tm169 Make-up débit de gaz. B. Signal à la masse "M 16" oxydees 155 et 185, correspondant à La139 + O16 O16 et Tm169 + oxydes, respectivement. Il n'ya pas de réelle "Gd155" ou "Re185" présent dans les billes. Le signal d'oxyde dans le "Gd155" canal est particulièrement forte, en raison de La139 être facilement oxydé. Cela représente l'un des niveaux les plus élevés d'oxyde, on peut s'attendre à rencontrer. Graphique C de "M" et "M" 16 intensités de signal en fonction de maquillage débit de gaz. Pleins représentent les icônes de masse "M", alors que les icônes vides représentent la masse "M 16". La couleur des lignes correspondent à la masse respective "M". Notez que La139 et Pr141 sont fortement touchés par les Make-up débit de gaz, même à un point où plus de masse "M 16" oxyde est présent à la masse "M". Cliquez ici pour agrandir la figure .
Discussion
Pour les dernières décennies, la cytométrie en flux par fluorescence a été une méthode bourreau de travail pour l'analyse de cellules uniques, à la fois en termes d'expression de surface et dans des tests fonctionnels. Cependant, les problèmes de chevauchement spectrales des colorants fluorescents a limité le nombre de marqueurs simultanées. Bien que les expériences qui utilisent plus de 12 marqueurs simultanées ont été signalés, le montant de la compensation nécessaire en fait techniquement difficile.
Au lieu de fluorophores, cytométrie de masse lancée par Sciences DVS utilise des polymères avec des sites chélateurs de métaux comme étiquettes pour les anticorps 1-3. Grâce à la pureté des métaux et la résolution en masse de l'ICP-MS, il n'y a effectivement pas de "chevauchement spectral». Comme la plupart des éléments utilisés ne sont pas biologiquement pertinente, il ya aussi peu de fond de causer "autofluoresence." Ces faits permettent l'utilisation de plus de 30 marqueurs simultanément au sein d'une seule expérience. 6,7 Il ya aussi une plus grande dymique plage du signal en ICP-MS que dans une expérience typique de fluorescence.
Cependant, la cytométrie de masse a ses limites. Il s'agit d'une technique destructrice: les cellules ne peuvent pas être récupérés pour le tri et l'expérimentation plus loin. Le cytomètre de masse a une exigence stricte pour la présence de métaux: si un métal n'est pas présent, une cellule ne sera pas détectée. C'est la raison principale de l'utilisation des intercalants d'ADN chélateurs de métaux pour assurer correctes pour cent-de-mères statistiques, comme toutes les cellules sera détecté indépendamment du fait que les sondes anticorps se lient tout. 3,6-7 Enfin, l'efficacité actuelle de transmission de cellule de la machine est d'environ 25%, par rapport à un rendement de> 90% pour un cytomètre de flux fluorescente. Par conséquent, un plus grand nombre de cellules de départ est souvent nécessaire, en particulier pour les populations de cellules rares. Cependant, ce qui est généralement compensé par le fait que la masse d'un échantillon unique cytomètre remplace souvent plusieurs échantillons fluorescents. Enfin, la cellule maximale acquisition taux est beaucoup plus lent que la norme cytomètres fluorescentes à environ 1000 cellules / sec; taux optimal est souvent la moitié. Par conséquent, chaque échantillon prend plus de temps pour s'exécuter.
Plusieurs articles ont été publiés récemment sur la coloration de divers types d'échantillons de cellules. 3,5-7 Le but de cet article est de fournir des informations sur l'utilisation appropriée d'un cytomètre de masse CyTOF TM pour les échantillons en cours d'exécution. Entretien du nébuliseur par rinçage avec et le stockage dans Citranox 5% sera réduit au minimum l'accumulation de débris cellulaires et les métaux, réduisant ainsi la probabilité de sabots. L'entretien de la machine pour un rendement optimal est en deux parties. Tout d'abord, le bon réglage (courant, gaz d'appoint) de la machine sur au moins une base quotidienne contribue à assurer une mesure correcte. Deuxièmement, lavage adéquat à l'eau MilliQ entre chaque échantillon et avec la solution de lavage à la fin du court pour enlever bâties débris organiques et inorganiques aidera à minimiser fond en général et le reportentre les échantillons. Enfin, la qualité de la préparation des échantillons a un grand impact sur la qualité de l'acquisition de données. Multiples lavages en tampon et enfin dans de l'eau MilliQ aider à éliminer tout métal-fond de intercalants ou contraignants anticorps non spécifique. Dilution appropriée de l'échantillon cellulaire aidera à équilibrer résolution optimale entre les événements cellulaires tout en minimisant les temps d'exécution total par échantillon. Dilution appropriée permet également de minimiser le risque de causer une obstruction dans le nébuliseur.
Dépannage des problèmes courants
1. La machine ne dépasse pas le «RFG Préparer" étape lors du démarrage
Sous l'onglet Cage carte de l'Instrument Set-up, appuyez sur "Reset" dans RFG. Essayez de démarrer la machine. Si cela ne résout pas le problème, fermez le logiciel, ouvrez à nouveau, appuyez sur "Reset" à nouveau, et essayer de démarrer. Si cela ne résout toujours pas le problème, vérifiez l'interrupteur du générateur RFG disjoncteur sur le coin arrière gauche de la machine. Si déclenché,repositionner sur "On", cliquez sur "Reset", et essayez de démarrer. Si cela ne résout toujours pas le problème, contactez DVS.
2. La machine s'arrête pendant l'exécution de
- Vérifier l'alimentation en argon. Si la pression d'argon atteindre la machine passe en dessous d'environ 40 psi, le logiciel exécute un arrêt automatique.
- RFG dépassé 100W erreur. Cela se produit lorsque la demande de puissance pour le plasma sort du 1300 + / - 100W fenêtre, le logiciel exécute un arrêt automatique. Ceci est habituellement causé par pulvérisation inégale du nébuliseur, en particulier les grandes gouttelettes. Cette refroidit excessivement le plasma, ce qui nécessite plus d'énergie pour maintenir le plasma. Ceci peut se produire en raison de la force excessive utilisée pour fixer le tube de seringue à la seringue pendant le changement de la pompe à seringue. Cela provoque une pulvérisation de gouttelettes grande, le refroidissement du plasma. Si c'est le cas, il suffit de redémarrer la machine.
Cela peut également se produire en raison de grosses gouttes qui commencent àse forment lorsque le nébuliseur commence à se boucher. Si cette erreur se reproduit, supprimez le nébuliseur pour le nettoyage, insérez un nébuliseur propre et redémarrez-le.
Beaucoup moins souvent, le tube échantillon mince entre la boucle d'échantillonnage et le nébuliseur peut se boucher. Ce peut être diagnostiquée par anormalement faible débit de liquide lorsque le tube est retiré du nébuliseur. Si c'est le cas, retirez le tuyau et les raccords affectée à reconstruire avec des tubes fraîche, et remplacez-le par un nébuliseur nouveaux raccords et tubes en kit.
3. Pas de traces d'isotopes (ou événements cellulaires) visible lors de l'acquisition échantillon de cellules (Figure 8), ou en regardant la fenêtre de l'onglet Masse de calibrage (figures 3, 4, 9)
- Contrôler la pompe à seringue. Cela se produit souvent en raison d'oublier de cliquer sur "play" au cours de l'évolution de la seringue de la pompe seringue. Cela peut aussi se produire si "pause", plutôt que "stop", est frappé pendant le changement de seringue. "Pause" ne réinitialise pas le compteur de volume sur la pompe à seringue, Et il s'arrêtera à 3.000 ml de volume distribué, indépendamment du fait que les restes de liquide. Enfin, la seringue peut-être à court d'eau.
- Clapet anti-retour de l'échantillon. Veillez à charger l'échantillon tandis que sur "Load", puis passer à "Inject" juste avant de commencer l'échantillonnage.
- Épuisées ou trop diluer l'échantillon. Vous avez peut être exécuté la totalité de votre échantillon, vérifier les calculs de temps d'acquisition (voir l'étape 3.3). Alternativement, vous pouvez avoir mal calculé le facteur de dilution et / ou perdu plus de cellules que prévu au cours du traitement de l'échantillon.
- Bouché nébuliseur. Ceci est habituellement précédée d'une erreur RFG (voir 2b émission), mais un sabot peut notiecably réduire l'efficacité de transmission cellulaire avant de provoquer un arrêt.
Questions 3c et 3d peut également être vérifié en exécutant un échantillon des perles Eu contenant de calibrage de polystyrène. Ils sont fournis à environ 1 million / mL (vortex bien avant de tirer l'échantillon!). Par conséquent, le remplissage de la boucle 450 uL d'échantillon donnerait apron 450.000 perles. L'efficacité CyTOF TM transmission cellulaire est dépendante de la machine, mais environ 15-30%. Par conséquent, les événements 67,500-135,000 perles qu'on attendrait de cette injection. Numéros ci-dessous qui sont compatibles avec une obstruction dans le tuyau ou d'un nébuliseur.
La cellule / efficacité de la transmission perle est quelque chose à tester de temps en temps, de noter les tendances à long terme.
Déclarations de divulgation
Les auteurs travaillent tous les deux au Centre de surveillance immunitaire humain, un centre de service à l'Université de Stanford qui perçoit des redevances d'utilisation uniquement pour recouvrer le coût des analyses, y compris la cytométrie de masse.
Remerciements
Nous tenons à remercier le Dr Evan Newell et le Dr Sean Bendall des commentaires. Nous tenons également à remercier Sciences DEP et le Dr Sean Bendall pour un échantillon de billes de polystyrène multi-lanthanide contenant. Nous sommes reconnaissants pour le financement du NIH subvention de 2 U19 AI057229.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| CyTOF TM masse cytomètre | Sciences DVS | ||
| Solution de lavage | Sciences DVS | 201071 | 0,05% d'acide fluorhydrique dans de l'eau |
| Tuning solution | Sciences DVS | 201072 | 0,5 ppm La, Cs, Tb, Tm, Ir, trace d'acide nitrique |
| Des billes de polystyrène contenant de l'UE | Sciences DVS | 201073 | Contient naturelle de l'abondance des isotopes de l'UE; perles fournis à environ 1 million / ml |
| Multi-lanthanide contenant (La / Pr / Tb / Tm / Lu) - billes de polystyrène | Sciences DVS | Pas encore disponible dans le commerce | Contient naturelle de l'abondance des isotopes de lanthanides cotées |
| L'acide nitrique (concentré) | Fisher Scientific | A467-500 | Optima oligo-métal pur ICP-MS de qualité |
| Polystyrène à fond rond tube avec crépine cellule-cap-5mL | BD | 352235 | utilisé pour filtrer des échantillons de cellules avant l'injection |
| Norm-Ject tuberkulin seringue de 1 ml | Henke Sass Loup | 4010-200V0 | sans silicone, sans latex |
| Norm-Ject seringue 3 ml | Henke Sass Loup | 4010.000V0 | sans silicone, sans latex |
| De l'eau MilliQ | Eau de 18 MQ pur; ne doivent pas être stockés dans bouteilles en verre ou en plastique qui ont été lavés avec un détergent commercial (en raison de leurs niveaux élevés de présence de baryum). | ||
| Citranox | Sigma-Aldrich | Z273236 | détergent acide |
| Gaz argon | Praxair | AR 5.0UH-T | 99,999% ultra haute pureté |
Références
- Bandura, D. R. Mass cytometry: Technique for real time single cell multitarget immunoassay based on inductively coupled plasma Time-of-Flight mass spectrometry. Anal. Chem. 81, 6813-6822 (2009).
- Lou, X. Polymer-based elemental tags for sensitive bioassays. Angew. Chem., Int. Ed. 46, 6111-6114 (2007).
- Majonis, D. Curious results with palladium- and platinum-carrying polymers in mass cytometry bioassays and an unexpected application as a dead cell stain. Biomacromolecules. 12, 3997-4010 (2011).
- Leipold, M. D. Development of mass cytometry methods for bacterial discrimination. Anal. Biochem. 419, 1-8 (2011).
- Bendall, S. C. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332, 687-696 (2011).
- Newell, E. W. Cytometry by Time-of-Flight shows combinatorial cytokine expression and virus-specific cell niches within a continuum of CD8+ T cell phenotypes. Immunity. 36, 142-152 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon