Introducción a la titulación
Visión general
Fuente: Laboratorio de Dr. Yee Nee Tan — Agencia de ciencia, tecnología e investigación
Valoración es una técnica común utilizada para determinar cuantitativamente la concentración desconocida de un analito identificada. 1-4 también se le llama análisis volumétrico, como la medición de los volúmenes es fundamental en la titulación. Hay muchos tipos de valoraciones basadas en los tipos de reacciones que explotan. Los tipos más comunes son ácido-base y titulaciones redox. 5-11
En un proceso de valoración típica, una solución estándar del titulador en una bureta se aplica poco a poco para que reaccione con un analito con una concentración desconocida en un matraz Erlenmeyer. Para la titulación ácido-base, un indicador de pH se agrega generalmente en la solución de analito para indicar el punto final de titulación. 12 en lugar de agregar indicadores de pH, pH puede también controlarse usando un medidor de pH durante un proceso de titulación y el punto final se determina gráficamente por una curva de titulación de pH. El volumen del titulador en el extremo puede utilizarse para calcular la concentración del analito basada en la estequiometría de la reacción.
Para la valoración ácido-base presentada en este video, el Titulador es una solución estandarizada de hidróxido de sodio y el analito es vinagre doméstico. El vinagre es un líquido ácido que con frecuencia se utiliza como condimento culinario o saborizantes. Vinagre consiste principalmente en agua y ácido acético (CH3COOH). El contenido de ácido acético del vinagre comercial puede variar ampliamente y el objetivo de este experimento es determinar el contenido de ácido acético del vinagre comercial por titulación.
Principios
La determinación de ácido acético en vinagre se basa en el principio de un método de titulación acido-base. La reacción entre el NaOH y CH3COOH se muestra en la ecuación 1:
CH3COOH(aq) + NaOH(aq) → H2O(l) + NaCH3CO2(aq) (1)
La solución estandarizada de NaOH progresivamente se añade el vinagre con la concentración del desconocido ácido acético hasta alcanzar el punto final. Durante la valoración acido-base, el pH se puede trazar como una función del volumen del titrant agregado. El punto de inflexión en la curva, el punto en el cual hay una igual cantidad estequiométrica de ácido y base en una solución, se llama el punto de equivalencia. Mayoría de los ácidos y bases son incoloras, con ninguna reacción visible en el punto de equivalencia. Para observar cuando se ha alcanzado el punto de equivalencia, se agrega un indicador de pH. El punto final no es el punto de equivalencia pero un punto en el que el indicador de pH cambia de color. Es importante seleccionar un indicador de pH adecuado para que el punto final está tan cercano al punto de equivalencia de titulación como sea posible.
En el punto final de esta reacción, el conjugado base NaCH3CO2 es ligeramente básico. Indicador fenolftaleína tiene un rango de pH de trabajo de 8.3-10.0, que es incolora en solución ácida y magenta por encima de pH 8.2. Por lo tanto, fenolftaleína es un indicador recomendado: como cambia de incoloro a rosa en esta condición. Al realizar el experimento, es mejor mantener la concentración de indicador de pH bajo porque los indicadores de pH se son generalmente los ácidos que reaccionan con la base.
El volumen de solución estandarizada de NaOH añadido en el punto final puede utilizarse entonces para calcular las concentraciones molares de ácido acético partiendo de la estequiometría de la ecuación anterior. En este experimento, es un fuerte titulación NaOH alcalino y el analito el ácido acético es un ácido débil.
Antes de realizar el experimento, es importante considerar la naturaleza higroscópica de NaOH. Esta propiedad requiere su solución para estandarizarse con un estable nivel primario tales como potasio hidrógeno ftalato (KHC8H4O4). La exacta concentración molar de la solución de NaOH puede ser determinada con precisión después de la normalización. La reacción entre el ácido principal estándar y NaOH se muestra en la ecuación 2:
KHC8H4O4(aq) + NaOH(aq) → H2O(l) + NaKC8H4O4(aq) (2)
Un protocolo de titulación paso a paso detallado se presenta en la siguiente sección.
Procedimiento
1. estandarización de NaOH con potasio Hydrogenphthalate (KHC8H4O4)
- Para empezar, debe estandarizarse el titrant, hidróxido de sodio. Preparar un stock de solución de NaOH disolviendo aproximadamente 4 g de pellets de NaOH en 100 mL de agua desionizada. Tenga en cuenta que el NaOH es un producto químico peligroso que es corrosivo para la piel e irritante a los ojos, ser prudentes y usar equipos de protección personal apropiado (EPP) para evitar contacto con los ojos o la piel.
- Hacer un 1:10 dilución de la solución de hidróxido de sodio mediante la adición de 25 mL de la solución de hidróxido de sodio stock a una botella de 500 mL. Hidróxido de sodio absorbe dióxido de carbono. Es importante prevenir esto al asegurarse de usar agua desionizado hervido, una botella de secado al horno y para colmo la botella rápidamente. La solución a 250 mL con agua desionizada y agitar para mezclar.
- 4 – 5 g de la primaria estándar ácido, KHC8H4O4 a 110 ° C por 4 h en un horno de secado en seco y luego enfriar el sólido en un desecador durante 1 hora.
- Disolver aproximadamente 4 g de secas KHC8H4O4 en 250 mL de agua desionizada. Registrar la masa con precisión. Calcular la concentración molar de la solución KHC8H4O4 .
- Pipetear 25 mL de KHC8H4O4 en un erlenmeyer limpio y seco. Añadir 2 gotas de fenolftaleína y agitar suavemente para mezclar bien. Tenga en cuenta que la fenolftaleína es irritante y tóxico, tener cuidado para evitar contacto con los ojos o la piel.
- Limpiar una bureta de 50 mL y un embudo con agua y detergente. Enjuagar la bureta con agua y enjuagar 3 veces con agua desionizada. Enjuagar la bureta con la solución diluida de NaOH 3 x, asegurándose de que el NaOH moja toda la superficie interior y drenar los desechos a través de la punta. Monte la bureta lavada en una ringstand con una abrazadera y asegúrese de que está parado verticalmente.
- Llene la bureta limpia con la solución diluida de NaOH. Cabe señalar que la cantidad de NaOH diluida necesita no estar exactamente en la marca del cero pero debe estar dentro de la escala y suficiente para al menos una valoración. Burbujas de aire pueden afectar la exactitud del volumen de lectura. Revise cuidadosamente la bureta para burbujas de aire y golpear suavemente la bureta para liberarlos y abrir la llave de paso para permitir que unos pocos mL de Titulador para fluir a través de y al mismo tiempo liberar el aire atrapado. Leer el volumen mediante la visualización de la parte inferior del menisco después de 10 s. expediente este volumen inicial. Preste atención a las cifras significativas de la lectura. Registre el valor a dos posiciones decimales en mL.
- Coloque el matraz Erlenmeyer que contenga potasio hidrógeno ftalato (KHC8H4O4) debajo de la bureta y ajustar correctamente la altura de la bureta. Valorar la solución KHC8H4O4 añadiendo lentamente solución de NaOH en incrementos de 1 – 2 mL usando una mano para controlar el flujo mediante el ajuste de la llave de paso y el otro girando el frasco.
- Cuando cerca de la meta, comenzar agregando la titulación gota a gota. El punto final se alcanza cuando la solución adopta un color rosa tenue y persistente. Registrar el volumen final de NaOH diluido en la bureta.
- Repetir la valoración al menos dos veces más para obtener datos consistentes. Calcular la concentración molar de la solución diluida de NaOH.
2. valoración de vinagre con solución estandarizada de hidróxido de sodio
- La solución de hidróxido de sodio ahora está estandarizada y puede utilizarse como un Titulador para analizar vinagre. Para reducir el aroma picante del vinagre, diluir 10 mL de la solución de vinagre en un 1:10 de la ración hasta un volumen total de 100 mL.
- Pipetear 25 mL de analito, a un matraz Erlenmeyer limpio y seco (conocido como VA). Añadir 2 gotas de fenolftaleína.
- Llene la bureta con la solución estandarizada de NaOH de la primera parte del procedimiento. Registrar el volumen inicial del titulador (V1).
- Progresivamente, añadir la solución de NaOH estandarizada para el vinagre. Cuando el volumen del titulador acerca el valor esperado, ajustar la llave de paso para agregar la titulación gota a gota. Seguir a agitar el frasco con una mano y mantenga la otra mano cerrar la llave de paso. Una vez que la solución de analito cambia a color rosa claro, agitar durante unos segundos ver si el color se desvanecerá. Si el color persiste, la titulación alcanza el punto final. Registrar el volumen final del titulador (V1'). Si se desvanece el color de la solución, añadir una gota más del titulador. Lavar la punta de la parte inferior de la bureta con la botella de lavado. Recoge la mezcla de lavado y ver el color de cambian de la solución del analito. Continuar la valoración hasta el punto final. Registra la cantidad de titrant es necesitada (Vt1 = V1' V1).
- Repetir la valoración al menos dos veces hasta tres valores concordantes que están dentro de 0,1 mL de uno a otro se obtiene (Vt2 yt3de la V).
- Calcular el valor medio del volumen del titulador con los tres valores obtenidos en tres titulaciones diferentes: Vt = (Vt1 +t2 de V + Vt3) / 3. La concentración molar de ácido acético en vinagre puede así calcular usando la ecuación 3.

Resultados
| Unidad | Ensayo 1 | Ensayo 2 | Ensayo 3 | |||
| Volumen de ácido de vinagre diluido (VA) | mL | 25.00 | ||||
| Concentración molar de NaOH (NaOHde c) | mol/L | 0.09928 | ||||
| Lectura inicial de la bureta NaOH | mL | 0.10 | 0. 05 | 1.20 | ||
| Lectura de la bureta final de NaOH | mL | 18.75 | 18.60 | 19.80 | ||
| Volumen de NaOH dispensada | mL | 18.65 | 18.55 | 18.60 | ||
| Volumen de NaOH dispensada (Vt) | mL | 18.60 | ||||
Tabla 1. Resultados de la valoración.
Cálculos de la muestra:
Masa de KC8H5O4 = 4,0754 g
Masa molar de KC8H5O4 = 204.22 g/mol
Número de moles de KC8H5O4 en 25,00 mL de solución estándar =
Según la ecuación 2,
Concentración de la solución diluida de NaOH =
Moles de NaOH dispensadas = concentración de NaOH × volumen promedio de NaOH dispensada = 0.09928 mol/L × 18,60 mL = 1.847 × 10-3 mol
Según la ecuación 1,
Número de moles de CH3COOH en 25,00 mL de vinagre diluido = 1.847 × 10-3 mol
Concentración de vinagre diluido =
Por lo tanto, concentración de vinagre sin diluir = 10 × 7,388 102 mol/L = 0.7388 mol/L
Los pasos anteriores se presentan para ilustrar el procedimiento de cálculo; simplemente podemos aplicar ecuación 3 para obtener la concentración de vinagre sin diluir en un solo paso.
Por lo tanto 1,000 L de vinagre sin diluir contiene 0.7388 mol de CH3COOH.
Volumen de CH3COOH =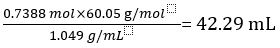
Por ciento volumen de vinagre = 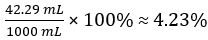
Aplicación y resumen
Titulación es un método químico importante que se aplica con frecuencia en la investigación química actual. Por ejemplo, titulación base ácido se aplica para determinar el valor de amino o hidroxilo de una muestra. El valor de la amina se define como el número de miligramos de KOH equivalente para el contenido de la amina en un gramo de muestra. Para determinar el valor de hidroxilo, el analito es acetilado primero utilizando anhídrido acético y luego graduado con KOH. La masa en miligramos de KOH entonces corresponde a grupos hidroxilos en un gramo de muestra. 13 otro ejemplo es la prueba de Winkler, un tipo específico de titulación redox utilizado para determinar la concentración de oxígeno disuelto en el agua para estudios de calidad de agua. Oxígeno disuelto se reduce utilizando sulfato de manganeso (II), que entonces reacciona con el yoduro de potasio para producir yodo. Puesto que el yodo así liberado es directamente proporcional al contenido de oxígeno, la concentración de oxígeno se determina por valoración del yodo con tiosulfato utilizando un indicador de almidón. 14
Además de aplicaciones en la investigación química básica, valoración también ha sido adoptado ampliamente en uso industrial y todos los días. En la industria de biodiesel, aceite vegetal inútil (WVO) primero debe ser neutralizado para eliminar ácidos grasos libres que reaccionaría normalmente para hacer jabón no deseado. Una porción de aceite usado se titula con una base para determinar la acidez de la muestra, por lo que el resto del lote puede ser neutralizado adecuadamente. 15 método de Benedicto XVI, una prueba para la cuantificación del nivel de glucosa en orina, es otro ejemplo que muestra la importancia de la valoración en la atención médica. En esta titulación, los iones cúpricos se reducen a iones cuprosas por glucosa, que luego reaccionan con el sulfocianuro de potasio para formar un precipitado blanco, que indica el punto final. 16
Referencias
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Introducción a la titulación
General Chemistry
423.4K Vistas

Cristalería de laboratorio y usos comunes
General Chemistry
653.4K Vistas

Soluciones y concentraciones
General Chemistry
273.1K Vistas

Determinación de la densidad de un sólido y líquido
General Chemistry
554.7K Vistas

Determinación de la composición porcentual en masa de una solución acuosa
General Chemistry
383.1K Vistas

Determinación de la fórmula empírica
General Chemistry
180.0K Vistas

Determinación de las reglas de solubilidad de compuestos iónicos
General Chemistry
141.1K Vistas

Uso del medidor de pH
General Chemistry
344.3K Vistas

Ley del Gas ideal
General Chemistry
78.1K Vistas

Determinación espectrofotométrica de la constante de un equilibrio
General Chemistry
158.3K Vistas

Principio de le Châtelier
General Chemistry
264.0K Vistas

Depresión del punto de congelación para determinar un compuesto desconocido
General Chemistry
160.4K Vistas

Determinación de las leyes de la velocidad y el orden de la reacción
General Chemistry
195.7K Vistas

Uso de la calorimetría diferencial para medir los cambios en la entalpía
General Chemistry
44.4K Vistas

Complejos de coordinación
General Chemistry
91.2K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados