Method Article
Mediciones de microscopía de fuerza atómica de cartílago en extremidades de ajolote intactas y en regeneración
* Estos autores han contribuido por igual
En este artículo
Resumen
En este protocolo, mostramos cómo preparar tejido de ajolote para microscopía de fuerza atómica (AFM) y realizar mediciones de indentación en cartílago de extremidades intacto y en regeneración.
Resumen
Las fuerzas mecánicas proporcionan señales importantes para la función celular normal y la formación de patrones en los tejidos en desarrollo, y su papel ha sido ampliamente estudiado durante la embriogénesis y la patogénesis. Comparativamente, se sabe poco de estas señales durante la regeneración animal.
El ajolote es un organismo modelo importante para el estudio de la regeneración, dada su capacidad para restaurar completamente muchos órganos y tejidos después de una lesión, incluidos los cartílagos y huesos faltantes. Debido a su papel crucial como principal tejido de soporte en el cuerpo de los vertebrados, la recuperación de la función esquelética durante la regeneración requiere tanto la restauración de las estructuras faltantes como sus propiedades mecánicas. Este protocolo describe un método para procesar muestras de extremidades de ajolote para microscopía de fuerza atómica (AFM), que es el estándar de oro para sondear las propiedades mecánicas de células y tejidos a alta resolución espacial.
Aprovechando las capacidades regenerativas del ajolote, este estudio midió la rigidez del cartílago de la extremidad durante la homeostasis y dos etapas de la regeneración de la extremidad: la histólisis tisular y la condensación del cartílago. Demostramos que la AFM es una herramienta valiosa para obtener información sobre la reestructuración dinámica de los tejidos y los cambios mecánicos que ocurren durante la regeneración.
Introducción
El esqueleto, especialmente el cartílago y los huesos, proporciona el principal soporte mecánico para los tejidos blandos del cuerpo en los vertebrados. Por lo tanto, es probable que cualquier daño en el sistema esquelético comprometa en gran medida la funcionalidad e incluso la supervivencia. En los seres humanos, las fracturas óseas son una de las lesiones traumáticas más comunes1, la mayoría de las cuales se reparan en cuestión de semanas, pero entre el 5% y el 10% de ellas tendrán retrasos en la curación o nunca se recuperarán por completo 2,3. Además, los seres humanos no son capaces de recuperarse de una pérdida extensa de hueso o cartílago 4,5. Algunas salamandras, sin embargo, pueden regenerar una variedad de estructuras corporales,incluidas las extremidades completas, lo que las convierte en un modelo ideal para el estudio de la regeneración esquelética.
El ajolote (Ambystoma mexicanum) es un tipo de salamandra cuya regeneración de extremidades ha sido ampliamente estudiada. Este proceso ocurre en cuatro fases principales secuenciales pero superpuestas: 1) cicatrización de heridas, 2) inflamación/histólisis, 3) formación de blastema y 4) crecimiento/diferenciación del blastema (revisado en 7,8). Después de la amputación, los queratinocitos que bordean el sitio de la lesión migran rápidamente, cerrando la herida y formando el epitelio de la herida (WE). Durante la inflamación y la histólisis subsiguientes, se eliminan los patógenos, se eliminan los residuos y las células dañadas, y se remodela la matriz extracelular (MEC) debajo de la superficie de amputación9. La histólisis tisular es esencial para que se produzca la regeneración de la extremidad10, donde la secreción de enzimas proteolíticas es crucial no solo para la remodelación general de la MEC, sino también para la liberación de las células que dan lugar al blastema y para la liberación de moléculas bioactivas secuestradas en la propia MEC8. De hecho, los estudios en muchos contextos regenerativos y organismos modelo han demostrado que las propiedades materiales únicas de la MEC durante la histólisis son capaces de inducir procesos de desdiferenciación o dirigir la migración de las células hacia el sitio de la lesión (revisado en11). Además, la reabsorción del tejido calcificado durante las últimas etapas de la histólisis ha demostrado ser clave para la correcta integración de los elementos esqueléticos de las extremidades recién formados12. Después de la etapa de histólisis, el blastema se forma debajo del epitelio de la herida (WE) como una acumulación de progenitores indiferenciados y multilinaje que resultan de células de tejido maduro desdiferenciadas o células madre residentes. Las células de blastema proliferan y se diferencian en todos los tipos de células faltantes. Finalmente, tiene lugar la morfogénesis de las extremidades, donde el tejido esquelético se regenera a través de la condensación de condroprogenitores derivados de células periskeletales y fibroblastos dérmicos transdiferenciados 13,14,15.
Aunque se han identificado muchas de las señales bioquímicas que regulan los cambios en la identidad celular y la composición de la MEC 10,13,14,16,17,18, las propiedades mecánicas de los tejidos durante las diferentes fases de la regeneración de las extremidades, así como su influencia en la regeneración, han permanecido en gran medida inexploradas. Muchos estudios han demostrado que las células detectan e integran señales mecánicas que regulan su destino y comportamiento en varios contextos (revisado en19,20). Por lo tanto, complementar nuestro conocimiento celular y molecular de la regeneración de extremidades con mediciones mecánicas de tejidos mejorará en gran medida nuestra comprensión de estos procesos.
Se han desarrollado diferentes técnicas que permiten la caracterización mecánica y la manipulación forzada de muestras biológicas21. Entre estas técnicas, la microscopía de fuerza atómica (AFM) se ha convertido en el estándar de oro en mecanobiología, en la que las propiedades viscoelásticas de las muestras biológicas se sondean a alta resolución espacial mediante indentación con un sensor de fuerza ultrasensible, el AFM cantilever22. Dado que esta técnica requiere contacto directo con la muestra, por lo general, se generan cortes de tejido, lo que puede ser un desafío en algunos casos. Por lo tanto, las condiciones de preparación deben adaptarse y optimizarse para cada muestra en particular, de modo que pueda permanecer lo más cerca posible de las condiciones fisiológicas y se generen artefactos mínimos23. Este protocolo describe cómo medir la rigidez del tejido en las extremidades de los ajolotes utilizando AFM, centrándose en los tejidos cartilaginosos en condiciones intactas, mientras se someten a histólisis y en las etapas de condensación del cartílago (Figura 1 y Figura 2). Este método también puede ampliarse para la medición de otros tipos de tejidos.
Protocolo
Los ajolotes (Ambystoma mexicanum) se cultivaron en las instalaciones de Axolotl del Centro de Terapias Regenerativas de Dresde (CRTD) de la Universidad Tecnológica de Dresde (TUD). Una descripción completa de las condiciones de cría se puede encontrar en24. Brevemente, las habitaciones se mantuvieron a 20-22 °C con un ciclo día/noche de 12/12 h. Todos los procedimientos quirúrgicos y de manipulación se llevaron a cabo de acuerdo con las directrices del comité de ética local y fueron aprobados por la Landesdirektion Sachsen, Alemania.
Este estudio utilizó ajolotes blancos (d/d) para todos los experimentos, una cepa mutante natural que carece de pigmentación corporal (pocos o ningún melanóforo y xantóforos), con iridóforos solo en el iris de los ojos. En este estudio se utilizaron ajolotes que miden entre 8 y 15 cm desde el hocico hasta la cola (5 a 7 meses de edad) sin sesgos específicos por sexo.
1. Preparación
- Prepare una solución madre de benzocaína al 10% (p/v) que se utilizará para la anestesia y la eutanasia de los ajolotes (ver más abajo). Para ello, mezcle en una botella volumétrica 50 g de benzocaína con etanol al 100% hasta alcanzar el límite de 500 mL.
- Prepare una solución madre de benzocaína al 0,03% (p/v).
- Para 1 L, mezcle 50 mL de solución salina tamponada (TBS) 10x Tris con 30 mL de benzocaína al 10% (p/v) y 5 mL de soluciones Holtfreter al 4000% (p/v) con 915 mL de agua destilada y mezcle durante la noche con una barra de agitación magnética.
- Para 1 litro de solución 10x TBS, mezcle 24,2 g de base Trizma y 90 g de NaCl con 990 ml de agua desionizada. Mezcle bien con una barra magnética para agitar. Luego, agregue aproximadamente 10 mL de HCl concentrado (12 M o 37%) y ajuste a pH 8.
- Para 1 L de solución Holtfreter al 4000% (p/v), mezcle 158,4 g de NaCl, 11,13 g de MgSO4,7H 2O, 5,36 g de CaCl 2,2H2O y 2,88 g de KCl con agua desionizada hasta 1 L.
- Prepare una dilución de benzocaína al 0,01% (p/v) en el agua del tanque de retención para anestesia diluyendo la solución madre al 0,03% (p/v) 1:3.
- Para 1 L de solución, use 333 mL de la solución madre de benzocaína más 666 mL de agua del tanque de retención.
- Prepare una solución madre de tartrato de butorfanol de 5 mg/mL para la analgesia. Para ello, mezcle 100 mg de sal de butorfanol (+)-tartrato con 20 mL de agua ultrapura. Almacene las alícuotas a 4 °C.
- El día de las amputaciones, prepare una solución de trabajo de tartrato de butorfanol de 0,5 mg/L para disminuir el dolor de los animales después de los procedimientos quirúrgicos diluyendo la solución madre 1:10.000 en el agua del tanque de retención.
- Para animales de menos de 8 cm de largo, mezcle 20 μl de solución madre en 200 ml de agua del tanque de retención.
- Para animales más grandes, mezcle 60 μL de solución madre en 600 mL de agua del tanque de retención.
- Prepare solución salina estéril tamponada con fosfato de anfibio (APBS), una solución de PBS al 80% (v/v), y manténgala a temperatura ambiente (RT) mezclando 800 mL de DPBS con 200 mL de agua desionizada.
- Prepare 1 mg/mL de solución madre de insulina. Para ello, mezcle 250 mg de insulina en polvo con 25 mL de HCl 0,1 M y agite lentamente hasta que se disuelva. Mientras agita, agregue 225 mL de APBS hasta que la solución esté clara. Filtre estérilmente y almacene 4 mL de alícuotas a -20 °C.
- Prepare un medio de cultivo estéril (todo % (v/v): 62,5% medio L15, 10% FBS inactivado por calor, 1% penicilina/estreptomicina, 1% insulina, 1% L-glutamina) y manténgalo a 4 °C hasta el día de su uso. En el día experimental, equilibre a RT antes de usar.
- Para 400 mL de medio de cultivo, use 250 mL de medio L15, 40 mL de FBS inactivado por calor, 4 mL de penicilina/estreptomicina, 4 mL de solución de insulina (del Paso 1.7), 4 mL de L-glutamina y 98 mL de agua estéril desionizada. Prepare en condiciones estériles y con un filtro estéril después de mezclar todos los componentes. Prepare 15 mL de alícuotas.
- Prepare 2,5% y 3% (p/v) de bajo punto de fusión (lmp)-agarosa en una solución de APBS y caliente a 70 °C para disolver la agarosa por completo. Prepare las alícuotas en tubos de 1,5 ml y almacene a 4 °C hasta el día de su uso.
- Para 20 mL de lmp-agarosa al 2,5% (p/v), mezcle 0,5 g de lmp-agarosa con 20 mL de APBS en un tubo de 50 mL y caliente en un baño de agua a 70 °C hasta que la agarosa se haya derretido completamente. La solución tiene que ser clara y transparente. Prepare las alícuotas mientras aún están calientes.
- Para 20 mL de lmp-agarosa al 3% (p/v), mezcle 0,6 g de lmp-agarosa con 20 mL de APBS y proceda como se indica arriba.
- (Opcional): Para 20 mL de lmp-agarosa al 1% (p/v), mezcle 0,2 g de lmp-agarosa con 20 mL de APBS y proceda como se indica arriba.
NOTA: El tiempo de fusión depende de la concentración de lmp-agarosa y puede oscilar aproximadamente entre 15 y 40 min.
- Para la amputación y el montaje de tejidos, utilice un estereoscopio de campo claro.
- Ensamble placas de Petri de plástico de 100 mm de diámetro, pinzas, bisturí y tijeras quirúrgicas para amputaciones y recolección de tejidos.
- Prepare placas de Petri de plástico de 35 mm de diámetro para las mediciones de indentación.
- Prepare cilindros de ~1 cm de largo y ~1 cm de diámetro. Para ello, calienta un cortador de cartón bajo la llama de un mechero Bunsen y corta un tubo de 15 mL con la cuchilla calentada.
- Corta pequeños 1 cm2 cuadrados de parafilm y guárdalos.
- Prepare un bloque metálico o frío a -20 °C dejándolo en el congelador durante al menos 1 h.
- Prepare pipetas Pasteur de plástico.
- (Opcional): Prepare la solución fijadora MEMFa (ácido 3-(N-morfolino)propanosulfónico [MOPS] 0,1 M pH 7,4, etilenglicol-bis (2-aminoetiléter)-N,N,N',N'-tetraacético [EGTA] 2 mM, MgSO4·7H2O 1 mM, 3,7% formaldehído). Para ello, añadir 10,465 g de MOPS, 0,123 g de MgSO4·7H2O, 2 mL de 0,5 M de EDTA pH 8,0, y añadir agua hasta 45 mL. Agregue 5 mL de formaldehído al 37% (p/v) a un volumen total de 50 mL.
2. Reactivos
- Consulte la Tabla de materiales para conocer los reactivos utilizados para este trabajo, pero también se pueden utilizar otros proveedores comerciales.
3. Amputación de ajolote y regeneración de extremidades
- Antes de todos los procedimientos experimentales, anestesiar al animal en benzocaína al 0,01% (p/v) diluida en el agua del tanque de retención (paso 1.3) durante 20 min, asegurándose de que los animales estén profundamente anestesiados y no respondan a los estímulos táctiles.
- Retire el ajolote de la anestesia y colóquelo encima de una placa de Petri de 100 mm que contenga un pañuelo de papel humedecido con agua que contenga anestesia. Oriente la extremidad perpendicular al eje del cuerpo y coloque la placa debajo del estereoscopio para una mejor visualización.
NOTA: Aquí se utilizó un estereoscopio con una lámpara compacta de cuello de cisne. - Amputar la extremidad con un bisturí estéril afilado inmediatamente distal a la zona calcificada de la región zeugopodial (radio/cúbito) (Figura 1A).
NOTA: Siguiendo el principio de bienestar animal de las 3R, se recomienda utilizar las extremidades que fueron inicialmente extraídas por la amputación como controles intactos. - Deje al animal en el plato y cúbralo con un pañuelo de papel humedecido empapado con agua que contenga benzocaína durante 15 minutos para permitir que se produzca la coagulación de la sangre y el cierre de la herida.
- Devolver los animales a un tanque que contenga agua dulce de retención con analgésicos (tartrato de butorfanol, 0,5 mg/L, a partir del paso 1.5).
- Trasladar los animales a su tanque original que contiene agua fresca de retención 24 h después del tratamiento analgésico postoperatorio.
- Permita que los animales se regeneren hasta la etapa deseada de interés.
NOTA: Las extremidades analizadas se recolectaron el día de la amputación para la fase intacta y 5 días después de la amputación (dpa) para la fase de histólisis en animales de 5 meses de edad. La etapa de condensación del cartílago se midió a 21 dpa en animales de 7 meses de edad.
4. Montaje y procesamiento de tejidos para mediciones
- Calentar los tubos de 1,5 mL que contienen un 2,5% o un 3% (p/v) de lmp-agarosa (a partir del paso 1.9) en un termobloque a 70 °C hasta que la agarosa se haya derretido por completo. Cambie los tubos a un termobloque diferente a 37 °C y deje que la temperatura se equilibre antes de usar.
NOTA: En este caso, se utilizó un 2,5% de lmp-agarosa para medir los tejidos en regeneración y un 3% para los tejidos intactos. - Cubra un lado de los cilindros de 1 cm de largo (del paso 1.13) con una de las piezas del parafilm (paso 1.14) para que queden completamente sellados en su parte inferior.
- Equilibrar 15 mL de alícuotas de medio de cultivo a RT (desde el paso 1.8)
- Anestesiar a los animales sumergiéndolos en agua que contenga anestésico (benzocaína al 0,01% (p/v) diluida en el agua del tanque de retención) durante al menos 20 min.
- Obtenga imágenes de las extremidades bajo un estereoscopio con software que permita mediciones cuantitativas. Mida la longitud de la estructura de interés y calcule la cantidad de tejido que debe extraerse del extremo distal de la extremidad hasta alcanzar la sección de interés.
- Para regenerar las extremidades, recójalas cortándolas con un bisturí y/o tijeras quirúrgicas a la altura del codo y diseccionando el exceso de tejido de la extremidad. Deje el tejido en la solución APBS mientras prepara el siguiente paso. Asegúrese de que el corte sea transversal (90°) al eje del brazo inferior para crear una superficie uniforme. Para las extremidades intactas, retire la mano cortando a través de la región del carpo.
- Eutanasiar a los animales exponiéndolos a una dosis letal de anestesia (benzocaína al 0,1%) durante al menos 20 minutos. Para ello, añada el volumen necesario de solución de benzocaína al 10% (p/v) para alcanzar una concentración del 0,1% (p/v).
- Si los animales fueron anestesiados en 100 mL de solución de benzocaína al 0,01% (p/v), agregue 900 μL de la solución de benzocaína al 10% (p/v).
- Enjuague las extremidades sumergiéndolas en una solución de APBS.
- Asegúrese de que las pipetas Pasteur y el termobloque (estabilizado a 37 °C con alícuotas de agarosa) estén cerca de la estación de trabajo. Saque el bloque frío del congelador a -20 °C y coloque el cilindro con el extremo cubierto de parafilm hacia abajo encima de él.
- Agarre la extremidad disecada y retire suavemente el exceso de líquido con papel de seda. Coloque la extremidad en un plato limpio, agregue la lmp-agarosa derretida encima y mueva brevemente la extremidad en la agarosa para desplazar cualquier APBS restante de la superficie de la piel.
- Trabajando rápidamente, coloque la rama dentro del cilindro, asegurándose de que esté orientada verticalmente, con el área de interés hacia arriba.
- Mientras sujeta suavemente la extremidad con fórceps, agregue lmp-agarosa dentro del cilindro hasta que el tejido esté completamente cubierto. Retire suavemente las pinzas antes de que la agarosa se solidifique.
- Retire el cilindro del bloque frío y deje que la agarosa se solidifique completamente a RT durante aproximadamente 30 s.
- Lleve el bloque de agarosa que contiene tejido inmediatamente a la sala de vibratomos, junto con las alícuotas del medio de cultivo estéril y APBS, en RT.
- Retire el parafilm de la parte inferior del cilindro y fije la agarosa que contiene el tejido a la etapa de vibratomo con pegamento de cianoacrilato. Asegúrese de que tanto la agarosa como la muestra estén pegadas a la plataforma.
- Sumerja la platina en APBS para seccionarla.
NOTA: Los tejidos intactos incluyen el hueso/cartílago más rígido, mientras que los tejidos en regeneración son más blandos. Por lo tanto, los parámetros del vibratomo deben ajustarse en consecuencia. En este estudio se utilizaron los siguientes parámetros: Tejidos intactos (amplitud 1,2 mm y velocidad 0,1 mm/s) y tejidos en regeneración (amplitud 0,9 mm y velocidad 0,4 mm/s). - Comience a seccionar la agarosa en pasos cortos (por ejemplo, en pasos de 100 μm) hasta llegar a la punta del tejido. A continuación, corte el bloque de tejido hasta que se extraiga la porción distal de tejido (calculada en el paso 4.5). De esta manera, se podrá acceder fácilmente a una sección transversal del área de interés.
NOTA: La sección de tejido extraída contendrá la superficie inmediatamente adyacente a la que se palpa con AFM y puede servir como referencia para la estructura del tejido. Por lo tanto, se puede utilizar para análisis complementarios directos o fijar para tinciones posteriores (ver sección 6). - Retire con cuidado el bloque que contiene tejido de la etapa de vibratomo con una cuchilla de afeitar y elimine todos los restos de pegamento. Pegue inmediatamente el bloque en una placa de Petri de plástico de 35 mm con pegamento adhesivo para tejido quirúrgico y agregue aproximadamente 2 mL de medio de cultivo en RT para asegurarse de que el tejido esté completamente cubierto.
NOTA: La superficie de tejido expuesta en el bloque de agarosa es la superficie que se va a sondear.
5. Mediciones con AFM
- Al menos 1 día antes de las mediciones, prepare el voladizo para las mediciones.
NOTA: Para este trabajo, los voladizos de silicona sin punta se funcionalizaron con perlas de poliestireno (diámetro 20 μm), y la unión del cordón-voladizo se dejó fortalecer durante al menos 1 día antes de ser utilizada para las mediciones de indentación.- Fije las cuentas a los voladizos con pegamento epoxi con un tiempo de procesamiento de 5 min.
- Baje rápidamente el voladizo con un contacto mínimo sobre un portaobjetos de vidrio recubierto de pegamento para que se forme una pequeña gota de pegamento en su extremo, y póngalo inmediatamente después en contacto con un cordón adecuado.
- Sostenga el contacto entre el voladizo y el talón durante ~ 10 minutos antes de levantar el voladizo con un cordón atado de la superficie.
- Calibre el voladizo antes de las mediciones.
NOTA: El voladizo modificado se calibró antes de cada conjunto de experimentos mediante el método de ruido térmico utilizando procedimientos incorporados del software AFM. - Inserte la placa de Petri con el bloque de tejido (del paso 4.18) y el medio de cultivo en el soporte de la placa de Petri del AFM y obtenga una imagen general en microscopía de campo claro (Figura 1B).
NOTA: Para las pruebas de indentación, se utiliza una configuración equipada con una etapa motorizada en la parte superior de un microscopio óptico vertical. Monte el cabezal AFM y coloque el voladizo sobre el tejido y acerque el voladizo a la superficie. - Elija la región específica de interés y registre una matriz de curvas de fuerza-distancia (Figura 2A).
NOTA: Se utilizaron puntos de ajuste de fuerza relativa de 2-25 nN para alcanzar profundidades de indentación comparables de ~1-4 μm para tejidos de diferente rigidez, con una velocidad de aproximación y retracción de 7,5 μm/s, longitud z de 50 μm, tamaño de rejilla de 70 μm x 70 μm con 3 x 3 puntos. - Para cada región sondeada, adquiera una imagen de microscopía de campo claro para asociar los valores obtenidos a cada región particular en la sección de la extremidad.
- Para todas las muestras, sondee al menos 3 regiones diferentes por tipo de tejido.
NOTA: En todos los casos, este estudio midió 4 regiones en el centro del cartílago y 3 regiones en la periferia de la región del cartílago y mantuvo el tejido bajo el microscopio durante un máximo de 1 h. - Una vez que hayan terminado las mediciones de la indentación, deseche o fije el tejido para un análisis más detallado.
NOTA: Las muestras se fijaron después de concluir las mediciones colocándolas en tubos de 2 mL que contenían solución de MEMFa y se fijaron durante la noche a 4 °C. Se utilizó MEMFa (paso 1.17), pero también se puede usar una solución de formaldehído al 4% (p/v) en PBS.
6. (Opcional) Procesamiento de secciones de tejido adyacentes
- Si las secciones de tejido adyacentes se utilizan para la tinción posterior, colóquelas inmediatamente después de la sección en un pequeño tubo de 2 ml que contenga fijador y fije durante la noche a 4 °C.
- Para revelar la arquitectura del tejido a través del marcaje del citoesqueleto y los núcleos de actina, lavar 3 veces con PBS durante 5 minutos cada una para eliminar el fijador y la tinción con una solución que contenga Alexa Fluor 488 Phalloidin conjugada (1:250) y Hoechst 33258 (1:10000) en PBS durante 1 h en RT en una plataforma oscilante.
- A continuación, inmovilice las muestras teñidas sobre placas con fondo de vidrio utilizando lmp-agarosa al 1% (p/v) en APBS estabilizado a 37 °C (a partir del paso 1.9). Asegúrese de que la superficie de interés esté orientada hacia el vidrio. Una vez que la agarosa se solidifique, cubra las muestras con PBS para evitar la deshidratación.
NOTA: Las muestras intactas y de histólisis se visualizan con un microscopio confocal invertido (aumento de 10x y secciones ópticas de 8 μm). Las imágenes de la Figura 1C son proyecciones máximas de 8 secciones ópticas.
- Si la sección de tejido adyacente se utiliza para análisis posteriores inmediatos que requieren tejido fresco (como extracción de ARN, incubación con tintes vivos, etc.), asegúrese de trabajar rápidamente y de utilizar un medio de cultivo celular (a partir del paso 1.8) para garantizar la mayor integridad posible del tejido.
7. Análisis y visualización de datos
- Para calcular el módulo de Young aparente, analice las curvas de fuerza-distancia utilizando el modelo de Hertz/Sneddon (Ec.1) para un indentador esférico utilizando el software de procesamiento de datos JPK/Bruker, asumiendo una relación de Poisson de 0,5.
 (Ec.1)
(Ec.1)
Donde R: radio del indentador, E: módulo elástico, ν: relación de Poisson, a: radio del área de contacto circular entre el indentador y la muestra, δ: profundidad de indentación. - Para el análisis viscoelástico, analice las partes de aproximación de las curvas de fuerza-indentación en PyJibe 0.15.0 con la extensión "Modelo de Hertz corregido por viscoelasticidad usando Kelvin-Voigt-Maxwell (KVM)" (escrito por Paul Müller, https://github.com/AFM-analysis/PyJibe)25. La función de ajuste se basa en un modelo descrito por Abuhattum et al.26, integrando elementos del modelo de Kelvin-Voigt-Maxwell.
- Preprocese las curvas de indentación de fuerza para estimar el punto de contacto utilizando un ajuste a trozos con una línea (línea base) y una función de ajuste polinómico para la parte de aproximación.
- Ajuste las curvas de fuerza-indentación al "modelo de Hertz corregido por viscoelasticidad utilizando el modelo Kelvin-Voigt-Maxwell (KVM)". A partir del ajuste, obtenga el módulo de Young no relajado, el módulo de Young aparente y la viscosidad aparente. El modelo también le da a Maxwell tiempos de relajación y sangría.
NOTA: En varias curvas de indentación de fuerza analizadas (en particular el tejido intacto), los tiempos de relajación de Maxwell fueron significativamente mayores o menores que el tiempo de indentación, lo que indica un comportamiento bastante elástico o un comportamiento mecánico de Kelvin-Voigt, respectivamente.
- Exporte todas las mediciones a una hoja de cálculo y calcule la mediana aparente de los módulos de Young por tipo de tejido y muestra.
- Trazar y analizar estadísticamente los datos con el software adecuado.
NOTA: Aquí se utiliza GraphPad Prism, y al describir los resultados, el estudio se refiere a la media ± SD de la mediana aparente de los módulos de Young por muestra (que se muestra en la Figura 2D-F). - Visualice cortes ópticos de imágenes confocales proyectándolas con la función de proyección máxima de Fiji. Ajuste el brillo y el contraste de cada canal individual para una visualización óptima de las tinciones fluorescentes.
- Genere un panel de figuras con el software adecuado.
NOTA: Se utiliza Affinity Designer para generar los paneles, y el modelo de la Figura 1A se dibuja con Affinity Designer.
Resultados
Utilizando el protocolo descrito anteriormente, medimos el módulo de Young aparente de los tejidos cartilaginosos de las extremidades de ajolote en condiciones homeostáticas ("intactas"), durante las etapas tempranas de histólisis del cartílago y posteriores de condensación del cartílago (Figura 1A). También probamos las propiedades mecánicas de los elementos esqueléticos en diferentes regiones, incluyendo su centro y periferia, como se muestra en las imágenes que muestran la posición en voladizo (Figura 1B). Para mostrar la arquitectura del tejido y correlacionarla con las mediciones de rigidez, se fijaron secciones transversales de tejido o el bloque de tejido donde se realizaron las mediciones y se tiñeron para los filamentos y núcleos de actina con Alexa Fluor 488 conjugado con faloidina y Hoechst, respectivamente (Figura 1C). En las extremidades intactas, el radio es claramente mayor que el cúbito, pero ambos elementos esqueléticos cartilaginosos tienen una morfología similar, con núcleos redondos distribuidos uniformemente en el centro, rodeados por un anillo de núcleos aplanados correspondientes al pericondrio24. Durante la fase de histólisis, se detectaron cambios drásticos en la arquitectura de los tejidos, con núcleos desorganizados y menos densamente empaquetados dentro de los elementos esqueléticos. En la fase posterior de condensación del cartílago, los núcleos se organizan de nuevo, con una clara delimitación entre el cartílago recién formado y los tejidos regeneradores circundantes. Sin embargo, en esta etapa, la mayoría de los núcleos están aplanados y no hay diferencias morfológicas claras entre el centro y la periferia.
Cuando se midieron las secciones transversales de ambos elementos esqueléticos presentes en la región zeugopodial (radio y cúbito), se detectaron módulos de Young aparentes indistinguibles en miembros intactos, con valores medianos de 10,95 ± 11,69 kPa y 15,71 ± 6,49 kPa, respectivamente (Figura 2D, izquierda), lo que concuerda con sus similitudes anatómicas (Figura 1C). Curiosamente, el análisis del centro del cartílago frente a la periferia mostró que, en condiciones intactas, los módulos de Young aparentes en el centro eran más altos que en la periferia, con valores medios de 16,48 ± 6,86 kPa frente a 7,53 ± 4,63 kPa, respectivamente (Figura 2E, izquierda). El día 5 después de la amputación, correspondiente a la fase de histólisis, los módulos de Young aparentes en el radio y el cúbito disminuyeron considerablemente (0,03 ± 0,02 kPa y 0,13 ± 0,09 kPa, respectivamente, Figura 2D, derecha), pero también desaparecieron las diferencias entre el centro y la periferia, con módulos de Young medianos de 0,11 ± 0,07 kPa y 0,27 ± 0,34 kPa, respectivamente (Figura 2E, derecha). Al analizar las propiedades del cartílago durante una etapa de regeneración posterior, en el momento en que el cartílago comienza a condensarse, se detectó un aumento significativo en los módulos de Young aparentes, alcanzando valores intermedios entre las fases intacta e histolítica (0,77 ± 0,29 kPa, Figura 2F).
Como se puede ver en las curvas de ejemplo proporcionadas (Figura 2B), la histéresis ocurrió entre la mayoría de los pares de curvas de aproximación y retracción, lo que indica una respuesta viscoelástica del tejido bajo fuerza. Además, nos propusimos analizar con más detalle las propiedades viscoelásticas de los diferentes tejidos. Dado que las mediciones oscilatorias en múltiples frecuencias requieren mucho tiempo y son algo críticas con respecto a la preservación de la integridad del tejido, especialmente cuando se mapean múltiples regiones de tejido, utilizamos un método publicado anteriormente por Abuhattum et al. que permite ajustar la parte de aproximación de las curvas de fuerza-distancia antes de la retracción inmediata del voladizo26. El modelo se basa en los elementos del modelo de Kelvin-Voigt Maxwell y se ha aplicado previamente para el análisis de las propiedades viscoelásticas de células e hidrogeles26, así como de tejido pancreático27. La mediana de los módulos no relajados (Intacto: 23,05 kPa, Histólisis: 0,20 kPa y Cartílago de condensación: 1,60 kPa) y los módulos aparentes de Young (Intactos: 17,54 kPa, Histólisis: 0,07 kPa y Cartílago de condensación: 1,54 kPa) derivados para los tejidos en las diferentes etapas de regeneración revelaron diferencias significativas (Figura 2G-H). En general, se observó una respuesta predominantemente elástica de los tejidos a la deformación a la tasa de deformación elegida, como se refleja en la gran similitud de los módulos elásticos no relajados y aparentes (Figura 2G, H). Se obtuvieron valores de viscosidad aparente mediana significativamente más bajos para la etapa histolítica (0,72 Pa·s) en comparación con las etapas de cartílago intacto (2,06 Pa·s) y de cartílago condensante (2,32 Pa·s) (Figura 2I). Como era de esperar, los módulos aparentes de Young del análisis PyJjibe (Figura 2H) estuvieron en alta concordancia con los valores obtenidos por el software de procesamiento de datos JPK (Figura 2F).
En conclusión, la caracterización mecánica refleja la reestructuración dinámica de los tejidos durante el proceso de regeneración. Estas mediciones están de acuerdo con las observaciones anatómicas, donde la rigidez del tejido disminuye junto con las alteraciones observadas en la arquitectura del tejido (Figura 1C) y se recupera gradualmente durante la regeneración.

Figura 1: Mediciones de la indentación del cartílago de la extremidad del ajolote durante la regeneración. (A) Representación esquemática de las etapas de regeneración. La línea discontinua indica el sitio aproximado de la sección transversal generada por el vibratomo donde se realizaron las mediciones. (B) Imágenes representativas de las mediciones del centro (arriba) y la periferia (abajo) en el cartílago de la extremidad. La punta negra es el voladizo. Barra de escala: 100 μm. (C) Arquitectura de tejido en extremidades intactas (izquierda), tejido sometido a histólisis (centro) y cartílago en condensación (derecha). Verde: núcleos (Hoechst), magenta: filamentos de actina (Phalloidin). Barra de escala: 500 μm. C' Región ampliada delineada en el panel. Barra de escala: 100 μm. Las cuadrículas de sangría de 70 μm x 70 μm se indican con cuadrados punteados blancos (centro) y amarillos (periferia). En los paneles B y C, las letras R y U indican el radio y el cúbito, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
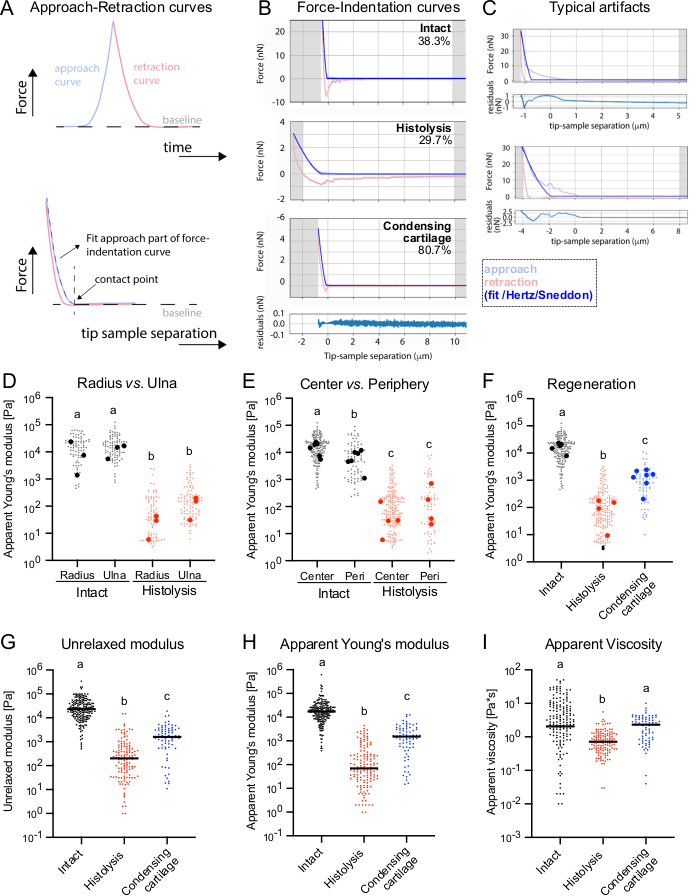
Figura 2: Medición de la rigidez del cartílago durante la regeneración de la extremidad del ajolote con AFM. (A) Esquemas del experimento de indentación de AFM que se muestra como fuerza en función del tiempo (arriba) y fuerza en función de la distancia entre el indentador y la muestra (abajo). Las curvas de aproximación y retracción se muestran en azul y rojo, respectivamente. El punto de contacto se muestra mediante una línea discontinua vertical negra. Las curvas de fuerza-indentación se ajustaron dentro de la parte de aproximación de la curva, ya sea utilizando el modelo Hertz/Sneddon (software de procesamiento de datos JPK y Pyjibe) o la extensión del modelo KVM viscoelástico en Pyjibe. (B) Curvas representativas de fuerza-distancia de las mediciones de AFM en extremidades intactas y en regeneración durante las etapas de histólisis y cartílago de condensación. El porcentaje de curvas analizables (es decir, sin artefactos) se indica en la esquina superior derecha de cada curva. (C) Ejemplos de artefactos típicos en curvas de fuerza-indentación, por ejemplo, debido a un contacto inadecuado del indentador con la superficie. Los ejemplos mostrados corresponden a extremidades intactas, pero se observaron tipos equivalentes de artefactos en todas las condiciones. Para B-C: Se ajustaron curvas representativas de fuerza-distancia y se mostraron utilizando Pyjibe. La curva azul claro representa la parte de aproximación de la curva y la curva roja clara es la parte de retracción. La línea azul más oscura es el Hertz/Sneddon aplicado apto para un dentador esférico. A continuación se muestran los residuos respectivos del ajuste para las curvas de fuerza-distancia inferiores. Los valores residuales trazados representan la diferencia entre los valores de fuerza real y de ajuste. (D) Módulos aparentes de Young de radio y centros de cúbito medidos en extremidades intactas y sometidas a histólisis. (E) Módulos de Young aparentes del centro del cartílago frente a la periferia (Peri) en extremidades intactas y durante la histólisis. (F) Módulos de Young aparentes medidos para el centro del cartílago en las etapas analizadas de la regeneración. Para D-F: Cada punto se deriva de una curva de fuerza-distancia analizada con éxito, y los puntos más grandes corresponden a los valores medianos por muestra. Los módulos aparentes de Young se obtuvieron utilizando el ajuste del modelo Hertz/Sneddon del software JPK Bruker. (G-I) Módulo (G) no relajado, módulo de Young aparente (H) y viscosidad aparente (I) calculados utilizando PyJibe (extensión KVM) a partir de mediciones del centro del cartílago en las etapas analizadas de la regeneración. Cada punto se deriva de una curva de fuerza-distancia analizada con éxito. Las líneas corresponden a los valores medianos de todas las mediciones por condición. Para D-I: Kruskal-Wallis con la prueba de comparaciones múltiples de Dunn. Diferentes letras representan condiciones que son estadísticamente diferentes entre sí (p < 0.05). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, demostramos una técnica para la medición de la rigidez del cartílago en extremidades de ajolote con AFM. Sin embargo, este método también puede ampliarse para sondear otros tipos de tejidos. Un paso clave para el éxito de las mediciones de AFM es la preparación de la muestra, que resultó ser especialmente difícil con las muestras de ajolotes. Descubrimos que sondear la superficie del tejido que aún estaba incrustada en el bloque de agarosa era la mejor manera de preservar la integridad del tejido. Esto se debe a que la piel del ajolote segrega altos niveles de moco en la superficie de la epidermis, lo que impide la incrustación estable de la sección de tejido en rodajas en la agarosa.
Algunas muestras pueden presentar desafíos adicionales, como una alta adhesividad. Experimentamos este problema, particularmente en muestras en la fase de histólisis, que eran relativamente conformes y adhesivas. En estas muestras, también observamos múltiples curvas de fuerza-distancia en las que la parte de la indentación tenía un aspecto "dentado", lo que indicaba que el cordón estaba deformando la superficie de la muestra de forma no continua (Figura 2C), por ejemplo, debido a que la superficie cedía bajo tensión. Tales curvas de fuerza-distancia tuvieron que ser descartadas ya que no podían ser ajustadas al modelo de Hertz-Sneddon. Para reducir la adherencia, la pasivación del indentador puede ser útil28, es decir, recubriendo la perla del indentador con agentes que reducen su pegajosidad, como el polietilenglicol (PEG) o la albúmina sérica bovina. Además, se pueden utilizar modelos alternativos para ajustar curvas de fuerza-distancia, por ejemplo, el modelo JKR (Johnson-Kendall-Roberts)29. Dado que los tejidos analizados aquí mostraron variaciones relativamente grandes en los módulos elásticos de más de un orden de magnitud para las regiones de tejido adyacentes y las diferentes condiciones probadas, esto hizo que la selección de un único voladizo/indentador ideal (constante de resorte/tamaño del indentador) fuera un desafío. Las variaciones bastante grandes en la rigidez del tejido también requirieron la adaptación de la fuerza de contacto aplicada para mantener la profundidad de indentación comparable y dentro de un rango adecuado (alrededor del 5%-25% del diámetro del indentador).
Otro parámetro crítico para preservar las propiedades mecánicas del tejido de la manera más fisiológica posible es mantener la máxima integridad del tejido. Esto se logró midiendo muestras frescas que se procesaron inmediatamente después de la recolección y se mantuvieron a una temperatura adecuada bajo un medio de cultivo celular con pH estabilizado.
Recientemente, otros grupos han realizado mediciones de microindentación en elementos esqueléticos de ajolotes utilizando formas alternativas de procesamiento de muestras30. Sin embargo, en estos experimentos, el tejido se congeló de antemano y las piezas esqueléticas en regeneración se diseccionaron manualmente de sus tejidos circundantes para medirlas in situ. Hasta que se demuestre empíricamente, no está claro si estas manipulaciones tienen un efecto sobre la integridad del tejido cartilaginoso y las propiedades mecánicas. También se han reportado análisis de músculos de salamandra y blastemas31,32. En estos casos, sin embargo, se extirpó la piel y no se seccionaron las muestras; Por lo tanto, solo se obtuvo información de la superficie inmediatamente debajo del epitelio eliminado. Aunque este tipo de cuantificación es precisa, más bien proporciona información sobre la superficie lateral del músculo, sin tener en cuenta la información mecánica de las capas musculares internas. Se utilizó un indentador de 20 μm, por lo que las mediciones no fueron masivas como las mediciones de microindentación reportadas 30,31,32, sino a escala celular y extracelular. Por lo tanto, obtenemos una resolución que refleja las señales mecánicas a las que realmente están expuestas las células, además de revelar la heterogeneidad de los tejidos (Figura 2D-I).
En las mediciones, se detectaron valores aparentes de módulos de Young más bajos en la periferia de los elementos esqueléticos intactos, lo que implica que el pericondrio del ajolote es más dócil que el cartílago. Sin embargo, no podemos descartar que los tejidos adyacentes a los elementos esqueléticos también se hayan sondeado debido a la configuración de la cuadrícula de 70 μm x 70 μm. Durante la fase histolítica, no se observaron tales diferencias, lo que sugiere que la histólisis en las extremidades en regeneración de ajolotes puede progresar de manera equivalente en el cartílago, el pericondrio circundante y los tejidos vecinos. El radio y el cúbito comparten una estructura similar pero tienen diferencias anatómicas significativas, como que el radio tiene un diámetro mayor y el cúbito es más largo24. Sin embargo, hasta el momento no se ha reportado un análisis comparativo de su rigidez, excepto por su respuesta a cargas mecánicas con fines médicos33. Aquí, describimos las medidas de indentación en secciones transversales de estos dos elementos esqueléticos en extremidades intactas y en regeneración. Demostramos que no existen diferencias significativas en la rigidez entre los radios y los cúbilos en las extremidades de los ajolotes, lo que concuerda con las densidades minerales óseas equivalentes detectadas en sus homólogos humanos34. Sin embargo, se observó una tendencia a la disminución de los módulos de Young aparente en el radio, particularmente durante la histólisis. Para determinar si esta observación es biológicamente significativa, sería preferible un mayor número de muestras. Con base en los datos obtenidos en este estudio, proponemos un mínimo de 5 muestras por condición. Durante la fase de histólisis, ambos elementos esqueléticos se vuelven más dóciles, lo que concuerda con el remodelado de la MEC descrito en esta etapa9. Finalmente, las mediciones obtenidas en este estudio implican que la rigidez del cartílago aumenta gradualmente durante la fase posterior de condensación del cartílago. Estas observaciones concuerdan con las mediciones de indentación reportadas recientemente en huesos intactos y cartílago en condensación29, así como con la evaluación in vivo de las propiedades mecánicas del cartílago con microscopía confocal Brillouin35.
En conjunto, este trabajo amplía el potencial de AFM como una herramienta valiosa para estudiar las propiedades mecánicas de las extremidades de los ajolotes. Con esta técnica, pretendemos complementar nuestro conocimiento sobre la expresión génica y las trayectorias de transdiferenciación celular16,13 con el fin de comprender mejor cómo la mecánica tisular está moldeando e influyendo en el proceso regenerativo.
Divulgaciones
Los autores declaran no tener conflictos de intereses
Agradecimientos
Agradecemos a todos los miembros del laboratorio Sandoval-Guzmán por su continuo apoyo y compañerismo durante el desarrollo de este trabajo. También agradecemos a Anja Wagner, Beate Gruhl y Judith Konantz por su dedicación al cuidado del ajolote. También agradecemos a Paul Müller por proporcionar códigos para el análisis de datos de AFM. Este trabajo contó con el apoyo de la Instalación de Microscopía Óptica de la Plataforma Tecnológica CMCB de la Universidad Técnica de Dresde. AT es miembro del Mildred Scheel Early Career Center Dresden P2, financiado por la Ayuda Alemana contra el Cáncer (Deutsche Krebshilfe). RA está financiada por un puesto temporal de PI (Eigene Stelle) de la Deutsche Forschungsgemeinschaft (DFG, Fundación Alemana de Investigación) – AI 214/1-1.
Materiales
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
Referencias
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966 (2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711 (2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036 (2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016 (2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268 (2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17 (2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341 (2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados