Method Article
Predicción de farmacología en red y validación metabolómica del mecanismo de Fructus phyllanthi contra la hiperlipidemia
* Estos autores han contribuido por igual
En este artículo
Resumen
El presente protocolo describe una estrategia integrada para explorar los objetivos y mecanismos clave de Fructus Phyllanthi contra la hiperlipidemia basada en la predicción de la farmacología de la red y la verificación metabolómica.
Resumen
La hiperlipidemia se ha convertido en un factor de riesgo principal para enfermedades cardiovasculares y lesiones hepáticas en todo el mundo. Fructus Phyllanthi (FP) es un fármaco eficaz contra la hiperlipidemia en la medicina tradicional china (MTC) y las teorías de la medicina india, sin embargo, el mecanismo potencial requiere una mayor exploración. La presente investigación tiene como objetivo revelar el mecanismo de PF contra la hiperlipidemia basado en una estrategia integrada que combina la predicción de farmacología en red con la validación metabolómica. Se estableció un modelo de ratones inducido por una dieta alta en grasas (HFD) mediante la evaluación de los niveles de lípidos plasmáticos, incluido el colesterol total (CT), los triglicéridos (TG), el colesterol de lipoproteínas de baja densidad (LDL-C) y el colesterol de lipoproteínas de alta densidad (HDL-C). Se aplicó farmacología en red para conocer los principios activos de la PF y las posibles dianas contra la hiperlipidemia. Se realizó metabolómica del plasma y el hígado para identificar metabolitos diferenciales y sus vías correspondientes entre el grupo normal, el grupo modelo y el grupo de intervención. La relación entre la farmacología de redes y la metabolómica se construyó aún más para obtener una visión integral del proceso de PF contra la hiperlipidemia. Las proteínas diana clave obtenidas se verificaron mediante acoplamiento molecular. Estos resultados reflejaron que la PF mejoró los niveles plasmáticos de lípidos y la lesión hepática de la hiperlipidemia inducida por una HFD. El ácido gálico, la quercetina y el beta-sitosterol en la PF se demostraron como los compuestos activos clave. Se encontró que un total de 16 y seis metabolitos diferenciales potenciales en plasma e hígado, respectivamente, estaban involucrados en los efectos terapéuticos de la PF contra la hiperlipidemia por metabolómica. Además, el análisis de integración indicó que los efectos de la intervención se asociaron con CYP1A1, AChE y MGAM, así como con el ajuste de L-quinurenina, corticosterona, acetilcolina y rafinosa, involucrando principalmente la vía del metabolismo del triptófano. El acoplamiento molecular aseguró que los ingredientes anteriores que actúan sobre los objetivos proteicos relacionados con la hiperlipidemia desempeñaron un papel clave en la reducción de los lípidos. En resumen, esta investigación proporcionó una nueva posibilidad para prevenir y tratar la hiperlipidemia.
Introducción
La hiperlipidemia es una enfermedad metabólica común con graves impactos en la salud humana, y también es el principal factor de riesgo para enfermedades cardiovasculares1. Recientemente, ha habido una tendencia a la baja relacionada con la edad para esta enfermedad, y las personas más jóvenes se han vuelto más susceptibles debido a estilos de vida irregulares a largo plazo y hábitos alimenticios poco saludables2. En la clínica, se han utilizado varios medicamentos para tratar la hiperlipidemia. Por ejemplo, uno de los medicamentos más utilizados para pacientes con hiperlipidemia y trastornos ateroscleróticos relacionados son las estatinas. Sin embargo, el uso a largo plazo de estatinas tiene efectos secundarios que no pueden ser descuidados, que conducen a un mal pronóstico, como intolerancia, resistencia al tratamiento y eventos adversos 3,4. Estas deficiencias se han convertido en dolores adicionales para los pacientes con hiperlipidemia. Por lo tanto, se deben proponer nuevos tratamientos para una eficacia hipolipemiante estable y menos efectos secundarios.
La Medicina Tradicional China (MTC) ha sido ampliamente utilizada para tratar enfermedades debido a su buena eficacia y pocos efectos secundarios5. Fructus Phyllanthi (FP), el fruto seco de Phyllanthus emblica Linn. (popularmente conocida como amla berry o grosella espinosa india), es una famosa medicina y alimento homólogo material de las medicinas tradicionales chinas e indias 6,7. Este medicamento se ha utilizado para eliminar el calor, enfriar la sangre y promover la digestión, según las teoríasde la MTC 8. Los estudios farmacológicos modernos han demostrado que la PF es rica en compuestos bioactivos como ácidos gálicos, ácidos elágicos y quercetina9, que son responsables de una gama de propiedades biológicas multifacéticas, al actuar como antioxidante, antiinflamatorio, protección hepática, antihipolipídico, etc.10. Investigaciones recientes también han demostrado que la PF podría regular eficazmente los lípidos sanguíneos de pacientes con hiperlipidemia. Por ejemplo, Variya et al.11 han demostrado que el jugo de fruta PF y su principal ingrediente químico del ácido gálico pueden disminuir el colesterol plasmático y reducir la infiltración de aceite en el hígado y la aorta. La eficacia terapéutica se relacionó con la regulación de PF en el aumento de la expresión del receptor alfa activado por proliferadores de peroxisomas y la disminución de la actividad lipogénica hepática. Sin embargo, el mecanismo subyacente de la PF en la mejora de la hiperlipidemia debe investigarse más a fondo, porque sus ingredientes bioactivos son bastante extensos. Se buscó explorar el mecanismo potencial de la eficacia terapéutica de la PF, que puede ser beneficioso para el desarrollo y la utilización posteriores de este medicamento.
Actualmente, la farmacología en red se considera una técnica holística y eficiente para estudiar el mecanismo terapéutico de la MTC. En lugar de buscar genes y fármacos causantes de enfermedades individuales que traten únicamente un objetivo individual, se construye una red completa de medicamentos-ingredientes-genes-enfermedades para encontrar el mecanismo multi-objetivo del fármaco multi-ingrediente con respecto a su tratamiento integral12. Esta técnica es especialmente adecuada para la MTC, ya que sus composiciones químicas son masivas. Desafortunadamente, la farmacología de red solo se puede usar para pronosticar objetivos afectados por ingredientes químicos en teoría. Se deben observar los metabolitos endógenos en el modelo de enfermedad para validar la efectividad de la farmacología de red. El método metabolómico, que surge con el desarrollo de la biología de sistemas, es una herramienta importante para monitorear los cambios en los metabolitos endógenos13. Los cambios en los metabolitos reflejan los cambios en el estado estacionario del huésped, que también es un indicador importante para estudiar el mecanismo interno. Algunos investigadores han integrado con éxito la farmacología y la metabolómica de la red para explorar el mecanismo de interacción entre fármacos y enfermedades14,15.
Este artículo explora las bases mecanicistas de la PF contra la hiperlipidemia mediante la integración de técnicas de farmacología de redes y metabolómica. Se aplicó farmacología en red para analizar la relación entre los principales principios activos de PF y dianas moleculares para la hiperlipidemia. Posteriormente, se realizó metabolómica para observar el cambio de metabolitos endógenos en el modelo animal, lo que puede explicar las acciones del medicamento a nivel metabólico. En comparación con la aplicación de la farmacología de redes o la metabonómica sola, este análisis integrado proporcionó un mecanismo de investigación más específico y completo. Además, se utilizó la estrategia de acoplamiento molecular para analizar la interacción entre los ingredientes activos y las proteínas clave. En general, este enfoque integrado podría compensar la falta de evidencia experimental para la farmacología de redes y la falta de un mecanismo endógeno para el método metabolómico, y puede usarse para el análisis del mecanismo terapéutico de la medicina natural. El diagrama de flujo esquemático principal del protocolo se muestra en la Figura 1.
Protocolo
Todos los procedimientos relacionados con el manejo de animales se llevaron a cabo de acuerdo con la Guía de la Universidad de Medicina Tradicional China de Chengdu para el Cuidado y Uso de Animales de Laboratorio y fueron aprobados por el Comité de Ética Institucional de la Universidad de Medicina Tradicional China de Chengdu (Protocolo número 2020-36). Para el presente estudio se utilizaron ratones machos C57BL/6 (20 ± 2 g). Los ratones se obtuvieron de una fuente comercial (ver Tabla de materiales).
1. Predicción basada en farmacología de redes
NOTA: La farmacología en red se utiliza para predecir los principios activos y sus dianas clave de PF contra la hiperlipidemia.
- Selección de principios activos y objetivos clave
- Busque la palabra clave "Phyllanthi Fructus" en la base de datos de farmacología del sistema de medicina tradicional china (TCMSP; http://tcmspw.com/tcmsp.php) para obtener la lista de los ingredientes activos candidatos y objetivos de PF.
NOTA: Normalmente, solo se incluyen como ingredientes activos los ingredientes con biodisponibilidad oral (OB) ≥30% y valores similares a medicamentos (DL) ≥0.18 en la base de datos. - Busque la palabra clave "hiperlipidemia" en la base de datos GeneCards (https://www.genecards.org/), la base de datos Online Mendelian Inheritance in Man (OMIM; https://omim.org/) y la base de datos de dianas terapéuticas (TTD; http://db.idrblab.net/ttd/) para obtener los respectivos objetivos candidatos de hiperlipidemia. Descargue las hojas de cálculo de los objetivos de la enfermedad. Elimine los objetivos repetidos para obtener la lista de objetivos de hiperlipidemia.
- Copie estas listas de los pasos 1.1.1 y 1.1.2 en una nueva hoja de cálculo. Utilice la función "Datos - Identificar duplicados" en la barra de herramientas para obtener objetivos de intersección. Importe la lista de objetivos de intersección en UniProtKB (http://www.uniprot.org/) para estandarizar los nombres de genes y proteínas.
NOTA: Estos objetivos están relacionados tanto con PF como con hiperlipidemia. Por lo tanto, predecir estos objetivos de intersección como los objetivos de PF contra la hiperlipidemia.
- Busque la palabra clave "Phyllanthi Fructus" en la base de datos de farmacología del sistema de medicina tradicional china (TCMSP; http://tcmspw.com/tcmsp.php) para obtener la lista de los ingredientes activos candidatos y objetivos de PF.
- Construcción de una red de interacción proteína-proteína
- Abra la base de datos STRING (https://string-db.org/) 11.5. Pegue la lista de objetivos de intersección de PF contra la hiperlipidemia en el cuadro de diálogo "Lista de nombres". Seleccione Homo sapiens en "Organismos " y haga clic en el > BUSCAR CONTINUAR.
NOTA: Los seres humanos y los ratones tienen genes muy similares. Por lo tanto, se lleva a cabo una verificación experimental adicional con ratones. - Cuando los resultados estén disponibles, marque ocultar nodos desconectados en la red en "Configuración avanzada". Establezca la confianza más alta (0.900) en "puntuación de interacción mínima requerida", luego haga clic en el botón ACTUALIZAR .
- Haga clic en Exportaciones en la barra de título y descargue el breve texto tabular de la red de interacción proteína-proteína (PPI) en formato PNG y TSV.
- Abra la base de datos STRING (https://string-db.org/) 11.5. Pegue la lista de objetivos de intersección de PF contra la hiperlipidemia en el cuadro de diálogo "Lista de nombres". Seleccione Homo sapiens en "Organismos " y haga clic en el > BUSCAR CONTINUAR.
- Construcción de una red de medicamentos-componentes-enfermedad-diana
- Abra Cytoscape 3.9.1 (ver Tabla de materiales). Importe el archivo de formato TSV del paso 1.2.3. Optimice el color, la fuente y el lado de los nodos de red a través de la barra de estilo en el panel de control.
- Utilice la función "Analizar red" para el análisis de topología de red. Obtener genes hub por CytoHubba en Cytoscape. Establecer la red fármaco-ingrediente-diana-enfermedad.
- Análisis de enriquecimiento GO y KEGG
- Open DAVID Bioinformatics Resources (https://david.ncifcrf.gov/home.jsp). Haga clic en Iniciar análisis y pegue la lista de objetivos en el cuadro de diálogo izquierdo. Seleccione OFFICIAL GENE SYMBOL en "Select Identifier" (Seleccionar identificador). Seleccione Homo sapiens en "Seleccionar especie". Lista de genes de garrapatas en "Tipo de lista". Haga clic en Lista de envíos.
- Cuando los resultados estén disponibles, haga clic en Analizar la lista de genes anterior con una de las herramientas de DAVID. Tick GOTERM_BP_DIRECT, GOTERM_CC_DIRECT, GOTERM_MF_DIRECT en "Gene Ontology" para el análisis de enriquecimiento de funciones GO. Marque KEGG_Pathway en "Vías" para el análisis de enriquecimiento de vías KEGG.
- Haga clic en Gráfico de anotación funcional para mostrar los resultados.
NOTA: Establezca el umbral de significación estadística del análisis de enriquecimiento en p < 0,05.
2. Diseño experimental
- La preparación del extracto acuoso FP
NOTA: La PF se procesa en el laboratorio de la profesora Lina Xia en la Universidad de Chengdu de TCM8.- Remojar el polvo seco de FP (90 g) en 1 L de agua pura en un matraz aforado limpio de 2 L. Use tratamiento ultrasónico (en un baño de agua a 4 ° C, potencia: 250W, frecuencia: 35 kHz) para ayudar a disolver durante 30 min. Filtrar la solución para obtener el extracto con una gasa médica estéril de doble capa, 1 mm x 1 mm. Repita la operación anterior tres veces para garantizar la disolución completa de FP.
- Utilice el método de evaporación rotativa para una mayor concentración. Ajuste la velocidad de rotación a 50 rpm con una temperatura de 60 °C durante 4 h. Concentrar el extracto acuoso a 100 mL.
- Divida el extracto crudo de FP (0,9 g/ml) uniformemente en dos partes (50 ml). Una parte se utiliza como líquido FP de dosis alta (0,9 g/ml). Agregue 50 ml de agua pura en otra parte y considérelo como el líquido FP de dosis baja (0.45 g / ml). Utilice las soluciones acuosas de FP de dosis altas y bajas para la administración. Conservar el líquido a -20 °C hasta su uso.
- Preparación animal
- Aloje a 50 ratones machos C57BL/6 (20 ± 2 g) en una habitación bien ventilada a temperatura ambiente, con un ciclo de luz-oscuridad de 12 h y acceso gratuito a alimentos y agua pura.
- Asigne aleatoriamente a los ratones a dos grupos: alimentar a 10 ratones con una dieta normal y 40 ratones con una dieta alta en grasas (ver Tabla de materiales) para inducir hiperlipidemia.
NOTA: Después de alimentarse durante 8 semanas, los ratones fueron examinados para una mayor intervención farmacológica. - En la 8ª semana, extraer unos 200 μL de sangre de cada órbita del ratón. Centrifugar la sangre durante 10 min a 5.733 x g a 4 °C para obtener muestras de plasma. Determine los niveles de TC y TG con kits de ensayo disponibles comercialmente (consulte la Tabla de materiales).
- Seleccione seis ratones con los niveles de lípidos más normales como el grupo de control sin tratamiento (NC). Seleccione 24 ratones con un nivel de lípidos significativamente más alto como el grupo de dieta alta en grasas, y divídalos aleatoriamente en cuatro grupos: grupo de dieta alta en grasas (HFD), grupo de FP (FP_L) de dosis baja, grupo de FP de dosis alta (FP_H) y grupo de control positivo (PC).
- Administrar irrigación gástrica a los grupos FP_L y FP_H con dos dosis de PF (dosis baja, 4,5 g/kg y dosis alta, 9 g/kg), respectivamente; irrigación gástrica al grupo CP con tabletas de simvastatina (5 mg/kg; ver Tabla de Materiales); e irrigación gástrica a los grupos NC y HFD con el mismo volumen de solución salina fisiológica una vez al día durante 4 semanas.
NOTA: El presente estudio utilizó las soluciones acuosas de PF y simvastatina para el tratamiento. - En la semana 12, después de la anestesia con pentobarbital sódico al 1% (30 mg / kg), sacrificar los ratones de todos los grupos. Recolecte ~400 μL de muestras de sangre de la vena orbitaria de cada ratón.
NOTA: Estimule los dedos de los pies y las plantas de los ratones con pinzas. Si no hay reacción, resulta anestesia adecuada. - Centrifugar la sangre durante 10 min a 5.733 x g a 4 °C para obtener muestras de plasma y determinar los niveles de TC, TG, LDL-C y HDL-C con kits de ensayo disponibles comercialmente (ver Tabla de materiales). Obtener muestras de tejido hepático16 y someterlas a análisis histopatológicos. Utilice las muestras de plasma y hígado restantes para el análisis metabolómico (paso 3).
NOTA: Todas las muestras se almacenan a -80 °C hasta su uso.
- Examen histopatológico hepático
- Fijar los tejidos hepáticos frescos con solución de paraformaldehído al 4% durante más de 24 h. Saque el tejido del fijador y alise los tejidos diana con un bisturí. Coloque el pañuelo y la etiqueta correspondiente en el deshidratador.
- Deshidratar en un gradiente de etanol: alcohol al 75% durante 4 h, alcohol al 85% durante 2 h, alcohol al 90% durante 2 h, alcohol al 95% durante 1 h, etanol absoluto durante 1 h, xileno durante 30 min. Coloque el cassette de tejido en un molde de pañuelo en cera de parafina durante tres lavados, 30 minutos cada16.
- Coloque los pañuelos empapados en cera en la incrustadora de tejido (consulte la Tabla de materiales). Antes de que la cera se solidifique, retire los tejidos del deshidratador, colóquelos en la caja incrustada y coloque la etiqueta correspondiente.
- Enfríe los bloques de cera en una mesa de congelación a -20 °C, retírelos del marco incrustado y recorte el bloque de cera.
- Corte los bloques de cera recortados en secciones de 3 μm de espesor con un micrótomo (consulte la Tabla de materiales). Flote las secciones en agua a 40 °C, retírelas de los toboganes y hornee en un horno a 60 °C. Después de hornear con agua y cera seca, sáquelo y manténgalo a temperatura ambiente.
- Coloque sucesivamente las secciones en xileno I durante 10 min, xileno II durante 10 min, xileno III durante 10 min, etanol absoluto I durante 5 min, etanol absoluto II durante 5 min, alcohol al 75% durante 5 min y lavar en agua16.
- Tiñe las secciones con solución de tinción de hematoxilina durante 4 minutos, solución de alcohol de ácido clorhídrico al 1% (alcohol al 75%) para diferenciación, solución de agua de amoníaco al 1% de azul y lávelas con agua.
- Manche las secciones con solución de tinción de eosina durante 2 minutos y lávelas con agua.
- Observe las secciones utilizando un microscopio óptico con un aumento de 200x y 400x.
- Análisis de cromatografía líquida-espectrometría de masas (LC-MS)
- Identificación de ingredientes de PF
NOTA: El análisis se realiza utilizando cromatografía líquida de ultra alta resolución junto con espectrometría de masas híbrida cuadrupolo-órbita rap de alta resolución (UPLC-Q-Orbirap HRMS, LC-MS; ver Tabla de materiales).- Medir con precisión 1 g de polvo seco de PF y ponerlo en un matraz aforado limpio de 50 ml.
- Añadir 25 ml de metanol al 70% en el matraz aforado y pesar con precisión. Use tratamiento ultrasónico (en un baño de agua a 4 ° C, potencia: 250 W, frecuencia: 35 kHz) durante 30 minutos para ayudar a la disolución. Pesa con precisión de nuevo para determinar con precisión la pérdida después de la disolución, y utiliza metanol al 70% para compensar la pérdida.
NOTA: No mida el volumen, ya que la escala del matraz aforado no es exacta, especialmente después del baño maría a 4 °C. - Agitar para mezclar completamente. Utilice una membrana microporosa de 0,22 μm para filtrar.
- Preparación de muestras de plasma
- Añadir con precisión 100 μL de plasma (paso 2.2.7) en un volumen doble (200 μL) de acetonitrilo en un tubo de centrífuga de 1,5 ml, y vórtice con un vibrador de vórtice durante al menos 30 s. Siga este procedimiento para todas las muestras.
- Centrifugar todas las muestras a 17.200 x g durante 10 min a 4 °C. Transfiera los sobrenadantes después de la centrifugación a un nuevo tubo de centrífuga de 1,5 ml. Secar los sobrenadantes bajo nitrógeno. Reconstituir con 200 μL de disolvente de extracción (acetonitrilo:agua = 4:1 [v/v]).
- Vortex la solución reconstituida durante al menos 30 s y utilizar tratamiento ultrasónico durante 10 min (en un baño de agua a 4 °C, potencia: 250 W, frecuencia: 35 kHz). Centrifugadora a 17.200 x g durante 10 min a 4 °C.
- Filtrar los sobrenadantes con membranas filtrantes de 0,22 μm y mantenerlos a 4 °C para su análisis.
- Preparación de la muestra de hígado
- Homogeneizar 90 mg de tejido hepático (paso 2.2.7) durante 1 minuto en agua helada de metanol (1:1, v/v, 1 ml) y centrifugarlos a 21.500 x g durante 10 min a 4 °C. Transfiera el sobrenadante a tubos de centrífuga de 1,5 ml. Siga este procedimiento para todas las muestras.
- Extraiga los precipitados de nuevo siguiendo el mismo procedimiento y agrupe los sobrenadantes en nuevos tubos de centrífuga de 1,5 ml. Secar los sobrenadantes bajo nitrógeno. Reconstituir con 300 μL del disolvente de extracción (metanol:agua = 4:1 [v/v]).
- Vortex la solución reconstituida durante al menos 30 s y utilizar tratamiento ultrasónico durante 10 min (en un baño de agua a 4 °C, potencia: 250 W, frecuencia: 35 kHz). Centrifugadora a 17.200 x g durante 15 min a 4 °C.
- Filtrar los sobrenadantes con membranas filtrantes de 0,22 μm y mantenerlos a 4 °C para su análisis.
NOTA: Las muestras agrupadas de control de calidad (QC) se prepararon mezclando 10 μL de alícuotas de cada muestra de plasma y hígado (una por cada seis muestras).
- Parámetros de análisis de LC-MS
NOTA: La fase móvil consiste en 0,1% de ácido fórmico (disolvente A) y acetonitrilo (disolvente B). Transfiera estos disolventes a una botella de vidrio limpia y conéctelos con el sistema LC-MS.- Establezca los programas de gradiente de muestras de plasma en el "archivo de entrada" del sistema LC-MS de la siguiente manera: 1% B (0-1.5 min), 1% -60% B (1.5-13.0 min), 60% -99% B (13.0-20.0 min), mantener en 99% B (20.0-25.0 min), 99% -1% B (25.0-25.1 min) y mantener en 1% B hasta 27 min.
- Defina las condiciones del muestreador automático de las muestras de plasma en el "archivo de entrada" del sistema LC-MS de la siguiente manera: el volumen de inyección, 2 μL; y el caudal, 0,3 mL/min, para cada análisis.
- Establezca el programa de gradiente de muestras de hígado en el "archivo de entrada" del sistema LC-MS de la siguiente manera: 1% B (0-1 min), 1% -53% B (1-15 min), 53% -70% B (15-30 min), 70% -90% B (30-32 min), 90% -95% B (32-40 min), 95% -1% B (40-42 min), y mantener en 1% B hasta 45 min.
- Establezca las condiciones del muestreador automático de las muestras hepáticas en el "archivo de entrada" del sistema LC-MS de la siguiente manera: volumen de inyección, 5 μL; y el caudal, 0,3 mL/min, para cada análisis.
- Establezca las condiciones de detección de MS de las muestras de plasma y hígado en el "archivo de ajuste de MS" del sistema LC-MS. Realice la adquisición de MS utilizando los modos de ionización positiva y negativa.
NOTA: Los parámetros de ionización por electrospray calentado son los siguientes: voltaje de pulverización: 3.5 kV para ionización positiva y 3.8 kV para ionización negativa; Flujo de gas de vaina: 55 ARB; Flujo de gas auxiliar: 15 ARB; temperatura del calentador de sonda: 300 °C; y temperatura capilar: 350 °C. - Importe los datos sin procesar recopilados en el software Compound Discoverer y establezca la plantilla de método siguiendo las instrucciones del fabricante (consulte la Tabla de materiales).
- Identificación de ingredientes de PF
3. Validación metabolómica
NOTA: Los datos de perfil metabolómico de metabolitos plasmáticos y hepáticos se importan al software Compound Discoverer para realizar la extracción de características metabólicas mediante la adopción de un algoritmo de extracción de características moleculares. Establezca los parámetros de la siguiente manera: desviación de masa, 5 x 10-6; rango de masa, 100-1.500; umbral de relación señal/ruido (SNR), 3; y desviación del tiempo de retención, 0,05. Evaluar la estabilidad y repetibilidad de la metabolómica por la desviación estándar relativa (RSD) de las áreas pico de control de calidad.
- Utilice el software SIMCA-P (ver Tabla de materiales) para el análisis estadístico multivariado de los valores integrales obtenidos de los hallazgos de LC-MS. Utilice el análisis discriminante ortogonal parcial de mínimos cuadrados (OPLS-DA) para los datos centrados en la media y el modelado de clases de muestra.
- Después de la prueba OPLS-DA, considerar los metabolitos, con integral con importancia variable en los valores de proyección (VIP) de >1 y un valor p de <0.05 de la prueba t de Student como los metabolitos diferenciales potenciales.
- Identificar los metabolitos alterados y las vías metabólicas mediante fuentes de bases de datos abiertas, incluyendo Human Metabolome (HMDB; http://www.hmdb.ca/), Kyoto Encyclopedia of Genes and Genomes (KEGG; https://www.kegg.jp/) y MetaboAnalyst5.0 (https://www.metaboanalyst.ca/).
- Visualice las vistas de resultados de MetaboAnalyst5.0 y la plataforma 'Wu Kong' (https://www.omicsolution.com/wkomics/main/).
4. Acoplamiento molecular
- Descargue la estructura 3D de los ingredientes PF seleccionados de la base de datos TCMSP, respectivamente. Busque los nombres de los ingredientes en el cuadro de búsqueda 'Nombre químico' y descargue los archivos de estructura 3D correspondientes en formato mol2.
- Descargue las estructuras cristalinas de los objetivos clave de la base de datos de estructura de proteínas AlphaFold (Alphafold DB;, https://alphafold.ebi.ac.uk/). Busque los nombres de destino en el cuadro de búsqueda y descargue los archivos de estructuras cristalinas correspondientes en formato pdb.
- Importe ingredientes y archivos de estructuras de destino en el software AutoDockTools. Haga clic en Editar > Eliminar agua para eliminar moléculas de agua. Haga clic en Editar > hidrógenos > Agregar para agregar hidrógenos . Establezca los ingredientes como el "ligando" y realice el acoplamiento ciego seleccionando todos los objetivos como el "receptor"17.
- Ingrese un valor en el cuadro detrás de "centro" y "tamaño" para ajustar el espacio recién desarrollado, lo que permite abarcar completamente el ligando y el receptor. Guarde los archivos de ligando y receptor en formato pdbqt.
- Utilice AutoDock Vina para realizar el acoplamiento molecular. Establezca la barra "Receptor" en el nombre de 'receptor.pdbqt' y la barra "Ligando" en el nombre del 'ligando.pdbqt'. Obtener la ubicación óptima para la unión del ligando al receptor. Registre el valor de energía de enlace en la posición óptima.
NOTA: El proceso de acoplamiento fue calculado por el algoritmo genético14. Todas las opciones de ejecución de acoplamiento eran valores predeterminados. Los marcos de acoplamiento se clasificarán automáticamente de la energía de enlace más alta a la más baja. - Importe los archivos de acoplamiento en PILP (Protein-ligand Interaction Profiler' https://plip-tool.biotec.tu-dresden.de/plip-web/plip/index) para obtener el modelo visual del sistema. Descargue los archivos del modelo en formato pse e impórtelos al software PyMOL (consulte Tabla de materiales) para construir una visualización adicional.
5. Análisis estadístico
NOTA: Utilice el software estadístico SPSS (véase el cuadro de materiales) para el análisis de datos. Considere el valor de p < 0,05 como estadísticamente significativo.
- Exprese los valores como medias ± desviación estándar (DE).
- Realizar un ANOVA unidireccional seguido de diferencia menos significativa post hoc (LSD), Dunnett (en caso de varianza igual) o T3 de Dunnett (en caso de varianza desigual) para probar la significación estadística entre los grupos.
Resultados
Farmacología de redes
Un total de 18 ingredientes potenciales en PF se examinaron de acuerdo con sus propiedades farmacocinéticas y farmacodinámicas de la base de datos y el análisis LC-MS (los cromatogramas iónicos totales se muestran en la Figura Suplementaria 1). A través de la literatura relevante, el contenido de ácido gálico es mucho mayor que otros ingredientes y es eficaz en la reducción de lípidos 9,11. Por lo tanto, este ingrediente también se consideró un ingrediente potencial. En total, se han encontrado 19 ingredientes y 134 objetivos relacionados con ingredientes de PF. Los 19 ingredientes se muestran en la Tabla 1. Para seleccionar los ingredientes más representativos para su posterior análisis, estos ingredientes se importaron a la base de datos Bioinformatics Analysis Tool for Molecular mechANism of Traditional Chinese Medicine (BATMAN-TCM; http://bionet.ncpsb.org/batman-tcm/). De acuerdo con la red ingrediente-diana-vía-enfermedad, algunos ingredientes bioactivos, como el ácido gálico, la quercetina y el beta-sitosterol, fueron identificados como los ingredientes más importantes de la PF relacionados con la hipercolesterolemia y la aterosclerosis coronaria (Figura complementaria 2). Entre estos, el ácido gálico es uno de los ácidos fenólicos más estudiados; es el principal ingrediente bioactivo presentado en el18PM. Mientras tanto, el ácido gálico es también el ingrediente de mayor contenido en PF; Su concentración suele ser del 1% al 3%. El-Hussainy et al.19 han revelado que el ácido gálico puede limitar la lesión cardíaca, mejorar el perfil lipídico y regular negativamente los marcadores inflamatorios cardíacos. Los contenidos de quercetina y beta-sitosterol son más bajos, pero algunos estudios han demostrado su efecto en la reducción de los lípidos. La quercetina, como flavonoide importante que existe ampliamente en las plantas, tiene diversas propiedades, como efectos antioxidantes, antiinflamatorios y de protección cardiovascular20. Lu et al.21 han estudiado que el jugo enriquecido con quercetina puede atenuar los niveles de TC, LDL-C y HDL-C en individuos sanos con hipercolesterolemia leve. En cuanto al beta-sitosterol, estudios clínicos han demostrado que el esterol vegetal puede prevenir significativamente la hipercolesterolemia y las enfermedades cardiovasculares22,23. Althwab et al.24demostraron que el beta-sitosterol podría mejorar el perfil lipídico y el índice aterogénico en ratas HFD. Se puede ver que el efecto hipolipemiante de la PF puede estar relacionado con estos tres ingredientes.
Además, se recopilaron 1.552 objetivos relacionados con la hiperlipidemia de las bases de datos Genecards, OMIM y TTD. Después de hacer coincidir los 134 objetivos relacionados con PF con los objetivos relacionados con la hiperlipidemia, se identificaron 62 objetivos como objetivos potenciales para PF contra la hiperlipidemia (Figura 2A). Todos los objetivos intersectados se normalizaron a sus símbolos oficiales, según la base de datos UniProt. Posteriormente, la red PPI fue construida por STRING (Figura 2B) y Cytoscape (Figura 2C). Combinando las puntuaciones de los métodos computacionales, los 10 objetivos principales fueron ESR1, RELA, FOS, EGFR, HIF1A, AR, CCND1, IL6, MAPK8 y MYC. Los detalles se presentan en la Figura Suplementaria 3. Todos estos 62 objetivos son la base de un análisis adicional, que se integra con los resultados de la metabonómica.
Las vías GO y KEGG se realizaron mediante análisis de enriquecimiento. Las 15 vías principales, según el número de objetivos, se seleccionaron para el análisis de acuerdo con el valor p. Los resultados del enriquecimiento de GO sugirieron que los procesos biológicos y la función molecular de la PF contra la hiperlipidemia estaban relacionados principalmente con la expresión génica y la unión a proteínas (Figura 2D). El enriquecimiento KEGG demostró que la PF podía intervenir en el proceso del metabolismo lipídico y la aterosclerosis (Figura 2E), lo que significa que la PF alivia la hiperlipidemia al afectar el metabolismo lipídico.
El efecto de la PF sobre los niveles de lípidos plasmáticos y el índice hepático
Para probar el efecto mejorado de la PF sobre la hiperlipidemia, primero se midieron los cambios en TC, TG, LDL-C, HDL-C y el índice hepático (la relación entre el peso del hígado y el peso corporal). En comparación con el grupo NC, los ratones en el grupo HFD mostraron un aumento significativo en los niveles plasmáticos de CT (p < 0,001), LDL-C (p < 0,001) y TG (p < 0,05), lo que indica que la intervención a largo plazo de HFD puede aumentar los niveles de lípidos e inducir hiperlipidemia (Figura 3).
Después de administrar el extracto acuoso de PF, los niveles de CT en los grupos FP_L y FP_H se redujeron significativamente (p < 0,05) en un 18,8% y 12,4%, respectivamente (Figura 3A). Los niveles de LDL-C en los grupos FP_L y FP_H se redujeron significativamente (p < 0,05) en un 13,7% y 21,8%, respectivamente (Figura 3B). En cuanto al nivel de HDL-C, el grupo FP_H aumentó significativamente (p < 0,01) de 1,81 ± 0,08 mmol/L a 2,65 ± 0,16 mmol/L, en comparación con el grupo HFD (Figura 3C). Aunque el nivel de TG permaneció insignificante después de la intervención de PF, se redujo en comparación con el grupo de HFD (Figura 3D). Estudios recientes han indicado que el índice de la relación LDL-C/HDL-C es un índice mejor que el LDL-C o el HDL-C solos para predecir la enfermedad cardiovascular25,26. En comparación con el grupo HFD, la relación LDL-C/HDL-C se redujo significativamente (p < 0,01) en un 46,3% en el grupo FP_H (Figura 3E), lo que significa que la intervención de PF redujo el colesterol malo y aumentó los niveles de colesterol bueno. Como principal órgano metabólico de la grasa, el peso del hígado refleja el almacenamiento de grasa en ratones hasta cierto punto27. Después de 12 semanas, los índices hepáticos en el grupo FP_L y FP_H grupo se redujeron significativamente (p < 0,01) en comparación con el grupo HFD (Figura 3F). El grupo de PC también mostró diferentes grados de reducción en estos indicadores anteriores, lo que demuestra que la PF tuvo efectos similares a las estatinas, y el efecto protector mostró una relación dosis-respuesta.
Varios estudios clínicos revelaron que, después de tomar extracto o FP completa por un tiempo, los niveles de CT y LDL-C disminuyeron significativamente. Mientras tanto, el nivel de HDL-C se elevó notablemente tras la administración a largo plazo de FP28,29. Nambiar y Shetty30 encontraron que el jugo de FP podría reducir las lipoproteínas oxidadas de baja densidad, reduciendo así en gran medida el riesgo de aterosclerosis. Gopa et al.31 evaluaron el efecto hipolipidémico de la PF en pacientes con hiperlipidemia y la compararon con simvastatina. El tratamiento con PF resultó en una reducción considerable en TC, LDL-C y TG, y un aumento significativo en los niveles de HDL-C, similar al de simvastatina. En esta investigación, la PF y la simvastatina también tuvieron efectos terapéuticos similares, y el efecto reductor del LDL-C y la acción reparadora hepática de la PF fueron superiores a la simvastatina.
Observación histopatológica hepática
El efecto de la PF sobre la esteatosis hepática en ratones HFD se muestra en la Figura 4. Las secciones patológicas hepáticas en el grupo NC expresaron morfología hepatocitos regular, bordes celulares claramente definidos y sin vacuolas grasas obvias (Figura 4A, B). Comparativamente, el grupo HFD tenía vacuolas grasas de diferentes tamaños alrededor de los vasos sanguíneos y mostró daño hepático obvio, caracterizado por hinchazón celular, degeneración grasa, pérdida de límites celulares, contracción celular y necrosis de hepatocitos (Figura 4C, D). Como se muestra en la Figura 4E,F, la intervención con PF podría mejorar la esteatosis hepática, especialmente en el grupo FP_L. En comparación con el grupo HFD, el grupo FP_H (Figura 4G, H) y PC (Figura 4I, J) tuvieron un cierto grado de recuperación de la estructura de las células hepáticas, degeneración de la grasa y reducción de la vacuola grasa. Esto significa que la intervención con PF puede proteger el tejido hepático de la lesión hepática inducida por HFD.
Perfiles metabolómicos
De acuerdo con el nivel de lípidos plasmáticos y la observación histopatológica hepática, la PF de dosis alta tuvo un mejor efecto sobre la hiperlipidemia que la PF de dosis baja. Por lo tanto, se eligieron grupos NC, HFD y FP_H para analizar su cambio en el nivel de metabolismo. Los cromatogramas iónicos totales de las muestras de control de calidad se mostraron en la Figura suplementaria 4. Para garantizar la precisión de los datos, las características con valores RSD >30% se eliminaron de todas las muestras de control de calidad. Los cromatogramas de PCA e iones reflejaron que las muestras de control de calidad fueron estables durante el proceso (Figura complementaria 5). Un total de 626 y 562 características en el plasma y el hígado se determinaron después del preprocesamiento de datos. Entre ellos, se identificaron 120 y 124 metabolitos en el plasma y el hígado, respectivamente, en base a la base de datos KEGG. Se utilizó el análisis OPLS-DA para explorar la separación entre los grupos NC, HFD y FP_H. OPLS-DA mostró que las mismas muestras grupales se agruparon y diferentes muestras grupales se distinguieron bien (Figura 5A, B). Estos resultados indicaron que las intervenciones HFD y PF causaron variaciones metabólicas obvias.
Para identificar los posibles metabolitos diferenciales que contribuyeron a la distinción metabólica, se realizaron análisis adicionales de OPLS-DA y t-test de NC versus HFD y HFD versus FP_H, respectivamente. Los resultados de OPLS-DA distinguieron bien y mostraron diferencias significativas entre los diferentes grupos de modelos14 (Figura complementaria 6). Con base en VIP (Variable importante en proyección) >1 y p < 0,05, 32 metabolitos en plasma mostraron diferenciación entre el grupo NC y HFD, y 72 metabolitos mostraron diferenciación entre el grupo HFD y FP_H. En el hígado, 38 metabolitos mostraron diferenciación entre el grupo NC y HFD, y 17 metabolitos mostraron diferenciación entre el grupo HFD y FP_H. Finalmente, se identificaron un total de 16 y 6 metabolitos como metabolitos diferenciales en ratones HFD que afectan a FP en el plasma y el hígado, respectivamente (Figura suplementaria 7). La información sobre estos metabolitos se muestra en la Tabla 2.
Para visualizar la variación en los metabolitos entre los tres grupos, MetaboAnalyst 5.0 trazó mapas de calor. Todos los metabolitos diferenciales en el plasma y el hígado se cambiaron en el grupo de HFD y la mayoría de ellos se invirtieron en el grupo de PF, lo que indica que la intervención de PF puede mejorar el trastorno metabólico (Figura 5C, D). Además, los metabolitos diferenciales se importaron a MetaboAnalyst 5.0 para explorar las vías metabólicas de FP en ratones HFD. Con base en p < 0,05 y un impacto de vía >0,10, el metabolismo del triptófano se vio afectado significativamente en el plasma, y los metabolitos relacionados con esta vía fueron D-triptófano y L-quinurenina (Figura 5E). Jung et al.32 estudiaron que la hiperlipidemia prolongada puede disminuir los niveles séricos de quinurenina. El metabolismo de la taurina y la hipotaurina se vio afectado significativamente en el hígado, y el metabolito relacionado fue la taurina (Figura 5F). La taurina es un aminoácido importante y necesario en el cuerpo animal; Dong et al.33 estudiaron que la taurina podría reducir levemente el daño de los lípidos sanguíneos y disminuir el riesgo de aterosclerosis causado por la HFD. En esta investigación, la intervención de PF aumentó el contenido de L-quinurenina y taurina, lo que se relaciona positivamente con la reducción de los niveles de lípidos, apoyando la efectividad de la PF contra la hiperlipidemia.
Análisis integrado de farmacología y metabolómica de redes
Una estrategia integrada de farmacología en red combinada con metabolómica se ha vuelto cada vez más indispensable para estudiar los mecanismos de la enfermedad y las estrategias de intervención. Se estableció la relevancia entre la farmacología de red y la metabolómica con evidencia limitada. Para obtener una visión integral del mecanismo de PF frente a la hiperlipidemia, se construyeron las redes de interacción basadas en farmacología de redes y metabolómica. Los metabolitos diferenciales se importaron al complemento MetScape en Cytoscape y coincidieron con los genes centrales identificados en la farmacología de la red para recolectar las redes compuestas-reacción-enzima-gen (Figura 6). Como se muestra en la Tabla 3, en los metabolitos plasmáticos, la L-quinurenina y la corticosterona se relacionaron con el CYP1A1, que puede catalizar la peroxidación lipídica e inducir la enfermedad del hígado graso no alcohólico34,35; Las vías afectadas fueron el metabolismo del triptófano y la biosíntesis de hormonas esteroides, respectivamente. La acetilcolina se relacionó con AChE y afectó el metabolismo de los glicerofosfolípidos. En los metabolitos hepáticos, MGAM y rafinosa se relacionaron con el metabolismo de la galactosa. Varios estudios han demostrado que la ingesta de oligosacáridos de la familia de las rafinosas podría mejorar los trastornos metabólicos en ratones HFD36.
Además, se ha construido la red ingredientes-dianas-metabolitos-vías (Figura 7). En los ingredientes, la quercetina conectó la mayoría de los bordes, lo que indica que la quercetina de FP juega el papel más importante en la reducción de los lípidos. El análisis integrado anterior reveló los objetivos, metabolitos y vías clave de PF contra la hiperlipidemia, lo que podría ser la base de un mayor estudio del mecanismo terapéutico y la aplicación clínica de este medicamento.
Acoplamiento molecular
Para investigar más a fondo la posibilidad de interacción entre los ingredientes seleccionados y los objetivos clave, se utilizó el acoplamiento molecular para analizar sus interacciones ligando-sitio activo. El software AutoDock Vina (ver Tabla de materiales) se utilizó para realizar el acoplamiento molecular, y la primera pose de acoplamiento se generó de acuerdo con el rango de la función de puntuación. Los resultados del acoplamiento se muestran en la figura 8.
En el análisis integrado, CYP1A1, AChE y MGAM se relacionaron con metabolitos diferenciales; Construyeron puentes entre objetivos y metabolitos. Se realizó un acoplamiento molecular adicional para verificar la relación entre el objetivo y los ingredientes. Los resultados del acoplamiento de ingredientes con CYP1A1 fueron los siguientes: el ácido gálico formó cuatro enlaces de hidrógeno a través de los residuos de aminoácidos Asn-185, Tyr-187, Asn-219 e His-500, y formó una interacción de apilamiento de π-π a través del residuo de aminoácido Tyr-187 (Figura 8A); la quercetina formó tres enlaces de hidrógeno a través de Asn-185, Asn-219 y His-500, interacción hidrofóbica e interacción de apilamiento de π-π a través de Tyr-187 (Figura 8B); beta-sitosterol formó cuatro enlaces de hidrógeno a través de Arg-362, Ser-363, Leu-365 y Arg-464, y la interacción hidrofóbica a través de Glu-369 e Ile-439 (Figura 8C). Las energías de enlace fueron 5.3, 7.0 y 7.3 kcal/-mol, respectivamente. En la interacción con AChE, el ácido gálico fue estabilizado por enlaces de hidrógeno con Arg-237, Arg-238 y Arg-480 (Figura 8D); la quercetina se estabilizó mediante enlaces de hidrógeno con Arg-237 y Phe-474, por interacción hidrofóbica con Phe-157 y por interacción de apilamiento de π-π con Tyr-478 (Figura 8E); el beta-sitosterol se estabilizó mediante interacción hidrofóbica con Phe-157, Val-244, Ile-248, Phe-474, Ala477 y TYR478 (Figura 8F). Las energías de enlace fueron 5.0, 6.5 y 8.0 kcal/- mol, respectivamente. En la interacción con MGAM, el ácido gálico se estabilizó por enlaces de hidrógeno con Ile-1716, Gly-1747 y Trp-1749, y por interacción hidrofóbica con Tyr-1715 y Trp-1749 (Figura 8G); la quercetina se estabilizó mediante enlaces de hidrógeno con Arg-1311, Thr-1726, Gln-1731 y Trp-1752, mediante enlaces de hidrógeno con Arg-1730 y mediante apilamiento de π-π con His-1727 (Figura 8H); beta-sitosterol se estabilizó por interacción hidrofóbica con Pro-1159, Trp-1355, Phe-1427 y Phe-1560, Las energías de enlace fueron 5.9, 8.1 y 6.9 kcal / mol, respectivamente. La información detallada sobre las interacciones y afinidades de unión se muestra en la Tabla 4. Múltiples sitios de unión y altas energías de unión explican las altas afinidades entre los ingredientes y las dianas proteicas, verificando que estos ingredientes desempeñan el papel de reducir los lípidos al actuar sobre dianas relacionadas con la hiperlipidemia.
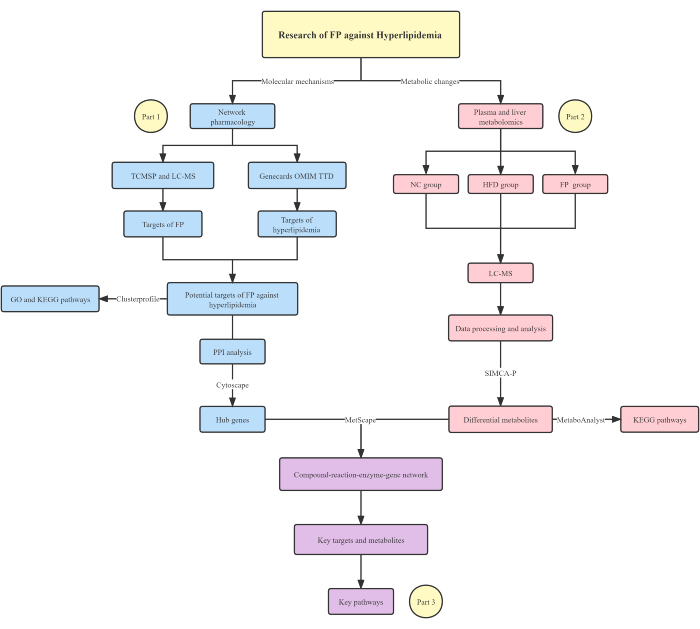
Figura 1: Diagrama de flujo esquemático de la estrategia integrada. Los ingredientes y genes del centro se extrajeron mediante farmacología de red (Parte 1). Los metabolitos diferenciales de PF contra la hiperlipidemia se analizaron mediante metabolómica plasmática y hepática (Parte 2). Los objetivos, metabolitos y vías clave se identificaron y vincularon en base a un análisis integrado de la Parte 1 y la Parte 2 (Parte 3). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cribado objetivo, construcción de redes y análisis de enriquecimiento del efecto de la PF contra la hiperlipidemia . (A) Diagrama de Venn de los objetivos de hiperlipidemia FP. (B) Red potencial de fármacos-ingredientes-dianas-enfermedad: diferentes símbolos de color como se menciona aquí: enfermedad (rojo), fármaco (azul), ingredientes (verde) y objetivos (amarillo). (C) Red PPI por STRING. (D) Análisis de enriquecimiento de la vía GO. (E) Análisis de enriquecimiento de la vía KEGG. Haga clic aquí para ver una versión más grande de esta figura.
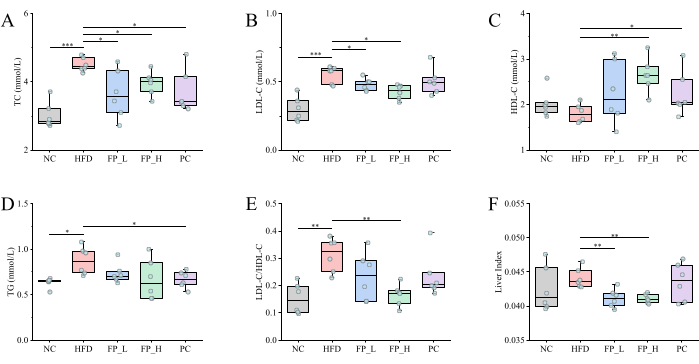
Figura 3: El efecto de la PF sobre los niveles plasmáticos de lípidos y el índice hepático en ratones con hiperlipidemia inducida por HFD (n = 6). a) Niveles de CT. b) Niveles de LDL-C. (C) Nivel de HDL-C. D) Nivel TG. (E) La relación LDL-C/HDL-C. (F) Índices hepáticos.*p < 0,05, **p < 0,01, ***p < 0,001. Las diferencias estadísticamente significativas se evaluaron mediante un ANOVA unidireccional seguido de la prueba de comparaciones múltiples de Dunnett o un análisis post hoc. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: El efecto de la PF en el tejido hepático en ratones con hiperlipidemia inducida por HFD (tinción H&E). (A,B) grupo NC, (C,D) grupo HDD, (E,F) grupo FP_L, grupo (G,H) FP_H, grupo (I,J) PC (n = 6). Barra de escala: (A,C,E = 200 μm; B,D,F = 50 μm). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Los gráficos de puntuación OPLS-DA, mapas de calor y vías metabólicas de metabolitos diferenciales. La puntuación OPLS-DA representa la PF en ratones HFD en plasma (A) e hígado (B). Los mapas de calor de metabolitos diferenciales en el plasma (C) y el hígado (D). Las vías metabólicas de los metabolitos diferenciales en el plasma (E) y el hígado (F). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Las redes compuesto-reacción-enzima-gen de los metabolitos y dianas clave. Se han eliminado los ganglios de bajo grado. Los hexágonos rojos, los círculos azules, los rectángulos verdes redondos y los diamantes grises representan los compuestos activos, genes, proteínas y reacciones, respectivamente. Los objetivos clave y los metabolitos se magnificaron. Las vías con el fondo blanco están significativamente reguladas en el plasma. La vía con el fondo gris está significativamente regulada en el hígado. Haga clic aquí para ver una versión más grande de esta figura.
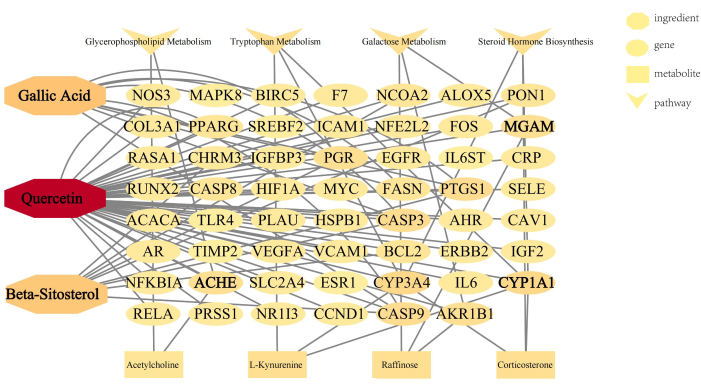
Figura 7: La red ingredientes-dianas-metabolitos-vías. Cuanto más oscuro es el color, más bordes conectados, lo que significa que el nodo es más importante en esta red. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Los diagramas de interacción de los ingredientes de PF y los objetivos clave . (A) Ácido gálico que actúa sobre CYP1A1. (B) Quercetina que actúa sobre CYP1A1. (C) Beta-sitosterol que actúa sobre CYP1A1. (D) Ácido gálico que actúa sobre AChE. (E) Quercetina que actúa sobre AChE. (F) Beta-sitosteroling actúa sobre AChE. (G) Ácido gálico que actúa sobre MGAM. (H) Quercetina actuando sobre MGAM. (I) Beta-sitosterol que actúa sobre MGAM. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Resumen de la PF frente al resultado de hiperlipidemia. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Los ingredientes seleccionados del extracto acuoso de FP. Haga clic aquí para descargar esta tabla.
Tabla 2: Los metabolitos diferenciales entre los tres grupos. Haga clic aquí para descargar esta tabla.
Tabla 3: La información sobre objetivos clave, metabolitos y vías. Haga clic aquí para descargar esta tabla.
Tabla 4: Sitios de unión y fuerzas de acción entre los ingredientes de PF y las proteínas diana. Haga clic aquí para descargar esta tabla.
Figura complementaria 1: Cromatogramas iónicos positivos y negativos del extracto acuoso FP. Haga clic aquí para descargar este archivo.
Figura complementaria 2: La red de ingredientes-diana-vía-enfermedad de PF por BATMAN-TCM. Haga clic aquí para descargar este archivo.
Figura complementaria 3: Análisis de frecuencia de genes hub en farmacología de redes. Haga clic aquí para descargar este archivo.
Figura complementaria 4: Cromatogramas iónicos de muestras de QC de plasma y hígado. Los cromatogramas iónicos representativos positivos (A) y negativos (B) de muestras plasmáticas de control de calidad. Los cromatogramas iónicos representativos positivos (C) y negativos (D) de muestras de control de calidad hepático. Haga clic aquí para descargar este archivo.
Figura complementaria 5: Los gráficos de puntuación PCA de muestras de QC de plasma (A) y hígado (B). Haga clic aquí para descargar este archivo.
Figura complementaria 6: Los gráficos de puntuación OPLS-DA de muestras de plasma (A y B) e hígado (C y D). Haga clic aquí para descargar este archivo.
Figura complementaria 7: Diagramas de Venn de los metabolitos diferenciales en muestras plasmáticas (A) e hepáticas (B). Haga clic aquí para descargar este archivo.
Discusión
En los últimos años, la tasa de incidencia de hiperlipidemia ha ido en aumento, principalmente debido a los hábitos alimenticios poco saludables a largo plazo. La MTC y sus ingredientes químicos tienen diversas actividades farmacológicas, que han sido ampliamente estudiadas en los últimos años37,38. La PF es un tipo de recurso frutícola, utilizado tanto como medicina como alimento, y tiene un potencial importante para tratar la hiperlipidemia. Sin embargo, el mecanismo terapéutico potencial de la PF contra la hiperlipidemia necesita más estudio.
La farmacología de redes evalúa los efectos polifarmacológicos de los fármacos a nivel molecular y predice la interacción de productos naturales y proteínas para determinar el mecanismo principal39. El primer paso es seleccionar los ingredientes activos y los objetivos clave del medicamento. En esta investigación, se encontraron nueve ingredientes activos y 62 genes centrales. Para comprender mejor el mecanismo molecular de la PF en la hiperlipidemia, se establecieron redes de IBP e ingredientes-diana basadas en el análisis de farmacología de redes. Para reducir el alcance de los ingredientes y objetivos clave, BATMAN-TCM ha encontrado tres ingredientes clave (ácido gálico, quercetina y beta-sitosterol) relacionados con la hipercolesterolemia y la aterosclerosis coronaria. Todos estos ingredientes podrían reducir los niveles de LDL-C o aumentar los niveles de HDL-C, validando los efectos específicos de la PF sobre la hiperlipidemia. Además, según el análisis de enriquecimiento de KEGG, la función de la PF en la hiperlipidemia está relacionada con la actividad de la vía lipídica y aterosclerosis. Aunque este método depende demasiado de la base de datos y carece de verificación experimental, tiene valor teórico y proporciona ideas para la posterior investigación de verificación experimental.
Para una validación experimental adicional, los ratones fueron alimentados con una dieta suplementada con grasa durante 8 semanas para inducir hiperlipidemia. Los resultados mostraron que los niveles plasmáticos de TC, LDL-C y TG aumentaron significativamente. Aunque el nivel de HDL-C disminuyó significativamente, la proporción de LDL-C a HDL-C aumentó significativamente. Las observaciones histopatológicas mostraron que el tejido hepático de los ratones HFD estaba severamente dañado, pero no hubo un aumento significativo en el índice hepático; Puede ser que los cambios en el peso corporal y el peso visceral tomen más tiempo. Los lípidos y los cambios hepáticos mostraron adecuadamente el efecto de intervención de la PF sobre la hiperlipidemia. Sin embargo, el mecanismo interno del efecto de la intervención aún necesita más exploración.
La metabolómica proporciona una lista de metabolitos potenciales y vías relacionadas, que tienen como objetivo explorar el mecanismo de las enfermedades metabólicas y la acción de los fármacos terapéuticos40. El resultado de la metabolómica puede verse afectado por el tipo de muestra. Teniendo en cuenta las características patogénicas de la hiperlipidemia, se eligieron muestras de plasma y hígado para el análisis metabonómico en esta investigación. De acuerdo con los resultados de OPLS-DA, los metabolitos de los grupos NC, HFD y FP_H fueron bien discriminados. Se encontraron un total de 16 metabolitos diferenciales en el plasma, y 6 metabolitos diferenciales en el hígado. Hubo más metabolitos afectados en el plasma que en el hígado, lo que demuestra que la sangre es el principal lugar de alteración metabólica inducida por la hiperlipidemia. La intervención de PF puede revertir el cambio de estos metabolitos bajo la influencia de HFD. Además, estos metabolitos diferenciales se importaron a la base de datos KEGG. Las vías metabólicas significativas de los metabolitos diferenciales en el plasma fueron el metabolismo del triptófano, y en el hígado fueron el metabolismo de la taurina y la hipotaurina. En esta investigación, la intervención de PF aumentó el contenido de L-quinurenina del metabolismo del triptófano y el contenido de taurina del metabolismo de la taurina y la hipotaurina, lo que significa que la PF podría ser efectiva para ajustar favorablemente los trastornos metabólicos y la hiperlipidemia. El análisis metabolómico reveló qué metabolitos estaban relacionados con la hiperlipidemia o la intervención de PF, y determinó el mecanismo posterior del efecto FP.
Al combinar el resultado de la farmacología de red con la metabolómica, se identificaron tres objetivos clave (CYP1A1, AChE y MGAM) en las redes compuesto-reacción-enzima-gen. Según el análisis de acoplamiento molecular, estos objetivos mostraron altas afinidades con los ingredientes de PF (ácido gálico, quercetina y beta-sitosterol). Cuatro metabolitos (L-quinurenina, corticosterona, acetilcolina y rafinosa) y cuatro vías relacionadas (metabolismo del triptófano, biosíntesis de hormonas esteroides, metabolismo de glicerofosfolípidos y metabolismo de la galactosa) se identificaron como los metabolitos clave y las vías metabólicas. Entre estos, la quercetina se asoció con la mayoría de los objetivos, y el metabolismo del triptófano apareció tanto en la metabonómica como en los resultados integrados. Desempeñan el papel más esencial en el efecto terapéutico de la PF contra la hiperlipidemia. El resultado del acoplamiento molecular mostró que CYP1A1, AChE y MGAM tienen altas afinidades con los ingredientes. Los resultados anteriores demuestran que estos objetivos seleccionados están estrechamente relacionados con el efecto terapéutico de la PF.
En la presente investigación, el ácido gálico, la quercetina y el beta-sitosterol se identificaron como ingredientes activos de PF hacia la antihiperlipidemia, y el metabolismo del triptófano es la principal vía metabólica de la terapia con PF en ratones HFD. La descripción general del resultado se muestra en la Figura 9. Esta investigación ofreció datos y apoyo teórico para estudios adicionales de los mecanismos y proporcionó una base para la aplicación clínica de la medicina PF. También demostró que los alimentos naturales podrían ser una opción prometedora con grandes perspectivas en la práctica clínica. Sin embargo, todavía hay algunas deficiencias en esta investigación. No se ha verificado el efecto terapéutico del ingrediente activo solo sobre la hiperlipidemia. Además, no se ha estudiado la vía de los objetivos clave; También necesita más experimentos sistemáticos de biología molecular para verificar el mecanismo preciso.
Divulgaciones
Todos los autores declaran que no tienen ningún conflicto de intereses.
Agradecimientos
Esta investigación fue apoyada por el Equipo de Desarrollo e Innovación de Productos de TCM Health Preservation and Rehabilitation (2022C005) y la Investigación sobre la Integración Transfronteriza de Nuevos Negocios de "Preservación y Rehabilitación de la Salud +".
Materiales
| Name | Company | Catalog Number | Comments |
| 101-3B Oven | Luyue Instrument and Equipment Factory | \ | |
| 80312/80302 Glass Slide | Jiangsu Sitai Experimental Equipment Co., LTD | \ | |
| 80340-1630 Cover Slip | Jiangsu Sitai Experimental Equipment Co., LTD | \ | |
| AccucoreTM C18 (3 mm × 100 mm, 2. 6 μm) | Thermo Fisher Scientific | \ | |
| Acetonitrile | Fisher Chemical | A998 | Version 1.5.6 |
| ACQUITY UPLC HSS T3 Column (2.1 mm × 100 mm, 1.8 μm) | Thermo Fisher Scientific | \ | |
| Aethanol | Fisher Chemical | A995 | Version 3.0 |
| Ammonia Solution | Chengdu Cologne Chemicals Co., LTD | 1336-21-6 | Version 3.9.1 |
| AutoDockTools | Scripps Institution of Oceanography | \ | |
| BS-240VT Full-automatic Animal Biochemical Detection System | Shenzhen Mindray Bio-Medical Electronics Co., Ltd. | \ | |
| Compound Discoverer | Thermo Fisher Scientific | \ | |
| Cytoscape | Cytoscape Consortium | \ | |
| DM500 Optical Microscope | Leica | \ | |
| DV215CD Electronic Balance | Ohaus Corporation ., Ltd | T15A63 | |
| Ethyl Alcohol | Chengdu Cologne Chemicals Co., LTD | 64-17-5 | |
| Formic Acid | Fisher Chemical | A118 | |
| HDL-C Assay Kit | Nanjing Jiancheng Bioengineering Institute | A112-1-1 | |
| Hematoxylin Staining Solution | Biosharp | BL700B | |
| High Fat Diet | ENSIWEIER | 202211091031 | |
| Hitachi CT15E/CT15RE Centrifuge | Hitachi., Ltd. | \ | |
| Homogenizer | Oulaibo Technology Co., Ltd | \ | |
| Hydrochloric Acid | Chengdu Cologne Chemicals Co., LTD | 7647-01-0 | |
| Image-forming System | LIOO | \ | |
| JB-L5 Freezer | Wuhan Junjie Electronics Co., Ltd | \ | |
| JB-L5 Tissue Embedder | Wuhan Junjie Electronics Co., Ltd | \ | |
| JK-5/6 Microtome | Wuhan Junjie Electronics Co., Ltd | \ | |
| JT-12S Hydroextractor | Wuhan Junjie Electronics Co., Ltd | \ | |
| KQ3200E Ultrasonic Cleaner | Kun Shan Ultrasonic Instruments Co., Ltd | \ | |
| LDL-C Assay Kit | Nanjing Jiancheng Bioengineering Institute | A113-1-1 | |
| Male C57BL/6 Mice | SBF Biotechnology Co., Ltd. | \ | Version 2.3.2 |
| Neutral Balsam | Shanghai Yiyang Instrument Co., Ltd | 10021190865934 | |
| Pure Water | Guangzhou Watson's Food & Beverage Co., Ltd | GB19298 | |
| PyMOL | DeLano Scientific LLC | \ | Version 14.1 |
| RE-3000 Rotary Evaporator | Yarong Biochemical Instrument Factory ., Ltd | \ | |
| RM2016 Pathological Microtome | Shanghai Leica Instruments Co., Ltd | \ | Version 26.0 |
| SIMCA-P | Umetrics AB | \ | |
| Simvastatin | Merck Sharp & Dohme., Ltd | 14202220051 | |
| SPSS | International Business Machines Corporation | \ | |
| TC Assay Kit | Nanjing Jiancheng Bioengineering Institute | A111-1-1 | |
| TG Assay Kit | Nanjing Jiancheng Bioengineering Institute | A110-1-1 | |
| UPLC-Q-Exactive Quadrupole Electrostatic Field Orbital Hydrazine High Resolution Mass Spectrometry | Thermo Fisher Scientific | \ | |
| Vortex Vibrator | Beijing PowerStar Technology Co., Ltd. | LC-Vortex-P1 | |
| Xylene | Chengdu Cologne Chemicals Co., LTD | 1330-20-7 |
Referencias
- Nelson, R. H. Hyperlipidemia as a risk factor for cardiovascular disease. Primary Care: Clinics in Office Practice. 40 (1), 195-211 (2013).
- Mach, F., et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). European Heart Journal. 41 (1), 111-188 (2020).
- Oesterle, A., Laufs, U., Liao, J. K. Pleiotropic effects of statins on the cardiovascular system. Circulation Research. 120 (1), 229-243 (2017).
- Last, A. R., Ference, J. D., Menzel, E. R. Hyperlipidemia: drugs for cardiovascular risk reduction in adults. American Family Physician. 95 (2), 78-87 (2017).
- Wu, S., et al. Recent advances of tanshinone in regulating autophagy for medicinal research. Front Pharmacol. 13, 1059360(2022).
- Mirunalini, S., Krishnaveni, M. Therapeutic potential of Phyllanthus emblica (amla): the ayurvedic wonder. Journal of Basic and Clinical Physiology and Pharmacology. 21 (1), 93-105 (2010).
- Zhao, H. J., et al. Fructus phyllanthi tannin fraction induces apoptosis and inhibits migration and invasion of human lung squamous carcinoma cells in vitro via MAPK/MMP pathways. Acta Pharmacologica Sinica. 36 (6), 758-768 (2015).
- Yan, X., et al. Current advances on the phytochemical composition, pharmacologic effects, toxicology, and product development of Phyllanthi Fructus. Frontiers in Pharmacology. 13, 1017628(2022).
- Yang, F., et al. Chemical constituents from the fruits of Phyllanthus emblica L. Biochemical Systematics and Ecology. 92, 104122(2020).
- Wu, L., et al. Phytochemical analysis using UPLC-MSn combined with network pharmacology approaches to explore the biomarkers for the quality control of the anticancer tannin fraction of Phyllanthus emblica L. habitat in Nepal. Evidence-Based Complementary and Alternative Medicine. 2021, 6623791(2021).
- Variya, B. C., Bakrania, A. K., Chen, Y., Han, J., Patel, S. S. Suppression of abdominal fat and anti-hyperlipidemic potential of Emblica officinalis: Upregulation of PPARs and identification of active moiety. Biomedicine & Pharmacotherapy. 108, 1274-1281 (2018).
- Gertsch, J. Botanical drugs, synergy, and network pharmacology: forth and back to intelligent mixtures. Planta Medica. 77 (11), 1086-1098 (2011).
- Nicholson, J. K., Wilson, I. D. Understanding 'global' systems biology: metabonomics and the continuum of metabolism. Nature Reviews Drug Discovery. 2 (8), 668-676 (2003).
- Li, T., et al. Integrated metabolomics and network pharmacology to reveal the mechanisms of hydroxysafflor yellow A against acute traumatic brain injury. Computational and Structural Biotechnology Journal. 19, 1002-1013 (2021).
- Wang, F., et al. Network pharmacology combined with metabolomics to investigate the anti-hyperlipidemia mechanism of a novel combination. Journal of Functional Foods. 87, 104848(2021).
- Adams, J. M., Jafar-Nejad, H. Determining bile duct density in the mouse liver. Journal of Visualized Experiments. (146), e59587(2019).
- Wang, J. Y., et al. Use of viral entry assays and molecular docking analysis for the identification of antiviral candidates against coxsackievirus A16. Journal of Visualized Experiments. (149), e59920(2019).
- Wu, L. F., Liang, W. Y., Zhang, L. Z. Determination of main components of Tibetan medicine Phyllanthus emblica L. World Science and Technology-Modernization of Traditional Chinese Medicine and Materia Medica. 22 (8), 2857-2863 (2022).
- El-Hussainy, E. H. M., Hussein, A. M., Abdel-Aziz, A., El-Mehasseb, I. Effects of aluminum oxide (Al2O3) nanoparticles on ECG, myocardial inflammatory cytokines, redox state, and connexin 43 and lipid profile in rats: possible cardioprotective effect of gallic acid. Canadian Journal of Physiology and Pharmacology. 94 (8), 868-878 (2016).
- Huang, W. Y., et al. Quercetin, hyper, and chlorogenic acid improve endothelial function by antioxidant, antiinflammatory, and ACE inhibitory effects. Journal of Food Science. 82 (5), 1239-1246 (2017).
- Lu, T. M., et al. Hypocholesterolemic efficacy of quercetin rich onion juice in healthy mild hypercholesterolemic adults: a pilot study. Plant Foods for Human Nutrition. 70 (4), 395-400 (2015).
- Witkowska, A. M., et al. Dietary plant sterols and phytosterol-enriched margarines and their relationship with cardiovascular disease among polish men and women: The WOBASZ II cross-sectional study. Nutrients. 14 (13), 2665(2022).
- Turini, E., et al. Efficacy of plant sterol-enriched food for primary prevention and treatment of hypercholesterolemia: a systematic literature review. Foods. 11 (6), 839(2022).
- Alamro, S. A., et al. Fermented camel milk enriched with plant sterols improves lipid profile and atherogenic index in rats fed high-fat and-cholesterol diets. Heliyon. , e10871(2022).
- Gao, P., Wen, X., Ou, Q., Zhang, J. Which one of LDL-C/HDL-C ratio and non-HDL-C can better predict the severity of coronary artery disease in STEMI patients. BMC Cardiovascular Disorders. 22 (1), 318(2022).
- Sun, T., et al. Predictive value of LDL/HDL ratio in coronary atherosclerotic heart disease. BMC Cardiovascular Disorders. 22 (1), 273(2022).
- Maegawa, K., et al. Dietary raffinose ameliorates hepatic lipid accumulation induced by cholic acid via modulation of enterohepatic bile acid circulation in rats. British Journal of Nutrition. 127 (11), 1621-1630 (2022).
- Antony, B., Merina, B., Sheeba, V. AmlamaxTM in the management of dyslipidemia in humans. Indian Journal of Pharmaceutical Sciences. 70 (4), 504(2008).
- Antony, B., Benny, M., Kaimal, T. N. B. A pilot clinical study to evaluate the effect of Emblica officinalis extract (Amlamax™) on markers of systemic inflammation and dyslipidemia. Indian Journal of Clinical Biochemistry. 23 (4), 378-381 (2008).
- Nambiar, S. S., Shetty, N. P. Phytochemical profiling and assessment of low-density lipoprotein oxidation, foam cell-preventing ability and antioxidant activity of commercial products of Emblica officinalis fruit. Journal of Food Biochemistry. 39 (3), 218-229 (2015).
- Gopa, B., Bhatt, J., Hemavathi, K. G. A comparative clinical study of hypolipidemic efficacy of Amla (Emblica officinalis) with 3-hydroxy-3-methylglutaryl-coenzyme-A reductase inhibitor simvastatin. Indian Journal of Pharmacology. 44 (2), 238(2012).
- Jung, T. W., et al. Administration of kynurenic acid reduces hyperlipidemia-induced inflammation and insulin resistance in skeletal muscle and adipocytes. Molecular and Cellular Endocrinology. , 518(2020).
- Dong, Y., Li, X., Liu, Y., Gao, J., Tao, J. The molecular targets of taurine confer anti-hyperlipidemic effects. Life Sciences. 278, 119579(2021).
- Huang, B., Bao, J., Cao, Y. R., Gao, H. F., Jin, Y. Cytochrome P450 1A1 (CYP1A1) catalyzes lipid peroxidation of oleic acid-induced HepG2 cells. Biochemistry. 83 (5), 595-602 (2018).
- Xia, H., et al. Alpha-naphthoflavone attenuates non-alcoholic fatty liver disease in oleic acid-treated HepG2 hepatocytes and in high fat diet-fed mice. Biomedicine & Pharmacotherapy. 118, 109287(2019).
- Dai, Z., et al. Protective effects of α-galacto-oligosaccharides against a high-fat/western-style diet-induced metabolic abnormalities in mice. Food & Function. 10 (6), 3660-3670 (2019).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278(2022).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl(2)-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568(2023).
- Noor, F., et al. Network pharmacology approach for medicinal plants: review and assessment. Pharmaceuticals. 15 (5), 572(2022).
- Li, X., et al. Role of potential bioactive metabolites from traditional Chinese medicine for type 2 diabetes mellitus: An overview. Front Pharmacol. 13, 1023713(2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados