Method Article
Un método biológico semiautomatizado y reproducible para cuantificar la deposición de calcio in vitro
* Estos autores han contribuido por igual
En este artículo
Resumen
Las enfermedades cardiovasculares son la principal causa de muerte en todo el mundo. La calcificación vascular contribuye sustancialmente a la carga de morbilidad y mortalidad cardiovascular. Este protocolo describe un método simple para cuantificar la precipitación de calcio mediada por células del músculo liso vascular in vitro mediante imágenes fluorescentes.
Resumen
La calcificación vascular implica una serie de patologías degenerativas, que incluyen inflamación, cambios en el fenotipo celular, muerte celular y ausencia de inhibidores de la calcificación, que concomitantemente conducen a una pérdida de elasticidad y función de los vasos. La calcificación vascular es un importante contribuyente a la morbilidad y mortalidad en muchas patologías, incluida la enfermedad renal crónica, la diabetes mellitus y la aterosclerosis. Los modelos de investigación actuales para estudiar la calcificación vascular son limitados y solo son viables en las últimas etapas del desarrollo de la calcificación in vivo. Las herramientas in vitro para estudiar la calcificación vascular utilizan mediciones de punto final, lo que aumenta las demandas de material biológico y corre el riesgo de introducir variabilidad en los estudios de investigación. Demostramos la aplicación de una nueva sonda marcada con fluorescencia que se une al desarrollo de calcificación in vitro en células del músculo liso vascular humano y determina el desarrollo en tiempo real de la calcificación in vitro . En este protocolo, describimos la aplicación de nuestro ensayo de calcificación recientemente desarrollado, una herramienta novedosa en el modelado de enfermedades que tiene posibles aplicaciones traslacionales. Prevemos que este ensayo es relevante en un espectro más amplio de investigación de deposición mineral, incluidas las aplicaciones en la investigación ósea, cartílago o dental.
Introducción
La calcificación vascular (VC) es un factor de riesgo independiente para la morbimortalidad cardiovascular 1,2,3. Considerado durante mucho tiempo un proceso químico pasivo de deposición mineral ectópica, ahora aparece una respuesta de curación tisular modificable que involucra la contribución activa de varias células, incluidas las células activadas del músculo liso vascular (hVSMC) como impulsor de la enfermedad 4,5. In vivo La VC puede ser medida por tomografía computarizada multicorte como una evaluación de la carga aterosclerótica 6,7,8. Actualmente, se está produciendo un cambio de paradigma, en el que la gravedad de la VC se está reconociendo como un factor de riesgo en la enfermedad cardiovascular, la diabetes tipo II, la enfermedad renal crónica y el envejecimiento 9,10,11,12,13,14,15.
Los hVSMC son el tipo de célula más abundante en el sistema cardiovascular y un actor principal en el desarrollo de VC. La calcificación inducida por hVSMC in vitro es un modelo de enfermedad ampliamente utilizado para estudiar la enfermedad cardiovascular16,17. Sin embargo, la mayoría de los protocolos para la detección de calcificación in vitro utilizan mediciones de punto final que pueden limitar la adquisición de datos, requieren un mayor uso de material celular y pueden retrasar la investigación. Los métodos comunes para la detección de calcificación in vitro de hVSMC incluyen el ensayo de o-cresolftaleína, que mide la deposición de calcio solubilizado contra la proteína total y requiere lisis celular18. Además, se utiliza la tinción Alizarin Red, que se une directamente a los depósitos de calcio en células o tejidos fijos19. Para estudiar la calcificación de hVSMC a lo largo del tiempo con o-cresolftaleína o rojo de alizarina se requieren lotes de réplicas por punto de tiempo, lo que aumenta la demanda de material biológico y, a su vez, aumenta la posibilidad de variabilidad.
En este documento, detallamos el método para la aplicación de un nuevo ensayo que utiliza hVSMC con una sonda de imagen fluorescente para determinar la progresión in vitro de VC, así como la función como un ensayo de calcificación de etapa terminal singular. Anteriormente demostramos que este ensayo es directamente comparable a los métodos de o-cresolftaleína y rojo de alizarina y puede usarse para distinguir entre condiciones de cultivo variables20. Además de las mediciones en tiempo real, este ensayo puede ser utilizado para determinar la propensión de las muestras de suero o plasma como marcador sustituto para el desarrollo clínico de VC20. Esto ayudará en la aplicación de estrategias biológicas de ciencias cardiovasculares y modelado de enfermedades. Una aplicación adicional del ensayo puede ser como un sistema BioHybrid traslacional para evaluar la gravedad o progresión de VC a partir de componentes sanguíneos como suero o plasma.
Protocolo
1. Siembra celular, mantenimiento e inducción de calcificación
- Para cultivar células primarias, use un gabinete de flujo de aire laminar, guantes y equipo estéril. Desinfecte las manos y el espacio de trabajo antes y después de realizar cualquier trabajo. Trate todas las células primarias y medios de cultivo como un riesgo biológico potencial, a menos que se demuestre lo contrario. Preferiblemente células y medios excedentes de autoclave antes de su eliminación. No inactivar químicamente y autoclave, ya que esto liberará humos tóxicos.
- Cultivo de hVSMC en placas de cultivo celular no recubiertas.
- Mantener rutinariamente hVSMC en medio de crecimiento que consiste en medio M199 suplementado con 10% -20% FBS y 1% Pen/Strep e incubar a 37 °C y 5% CO2.
- Dividir las células en una confluencia del 70% -90%.
- Para dividir, lave los hVSMC 2x con PBS. Añadir tripsina e incubar durante 2-5 min a 37 °C. Compruebe si hay desprendimiento de células bajo el microscopio.
- Inhibir la reacción de tripsina añadiendo medio que contenga suero. Centrifugar las células a 350 x g durante 4 min y resuspender el pellet en medio de mantenimiento. Los hVSMC siguen un esquema de división 1:2.
- Para iniciar el experimento de calcificación, prepare las células siguiendo las instrucciones para una división (Paso 1.4.1). Tras la resuspensión, contar las células y la semilla en una placa de 48 pocillos a una densidad de 10-15 x 103 células/cm2. Siembre las células evitando el uso de los pocillos externos, como se recomienda en la Figura suplementaria 1.
- Deje que las células se adhieran y se recuperen durante 24 h (durante la noche) mientras se incuban a 37 °C y 5% deCO2.
- Lave suavemente las células 2x con PBS, aspirando cuidadosamente todo el PBS restante después del2º lavado.
- Añadir suavemente el medio de calcificación e incubar a 37 °C y 5% deCO2. El medio de calcificación debe contener un estímulo de calcificación, fetuina-A marcada fluorescentemente (por ejemplo, con proteína fluorescente roja [RFP]) (1 μg / ml) y tinción nuclear HOECHST 33342 (0.1 μg / ml) o tinción nuclear fluorescente viva similar. No use DAPI, ya que no es permeable.
- Verifique diariamente con un microscopio óptico hasta que se produzca la calcificación.
NOTA: Para obtener notas sobre el cultivo celular y el mantenimiento de hVMSC, consulte el Archivo complementario 1.
2. Detección de calcificación mediante imágenes
NOTA: El siguiente protocolo proporciona los pasos generales que se deben seguir en la preparación, la creación de imágenes y el análisis de datos. Las capturas de pantalla que respaldan las instrucciones para cada paso utilizando una plataforma automatizada de imágenes y el software de análisis de imágenes correspondiente (consulte la Tabla de materiales para obtener más detalles) se proporcionan en el Archivo complementario 2 y el Archivo complementario 3. Se pueden utilizar otros instrumentos de imagen y herramientas de procesamiento de imágenes para aplicar este protocolo. Sin embargo, las imágenes repetidas en la misma ubicación en cada pozo son cruciales para la adquisición de datos significativos. La creación de un protocolo para la calcificación y reutilización de imágenes en cada paso de la imagen es necesaria para obtener resultados reproducibles. La primera vez que aplique el método, siga los pasos a continuación para prepararse antes de la toma de imágenes.
- Configuración del protocolo
- Abra el software y, a continuación, seleccione Protocolos y Crear nuevo.
- Seleccione Procedimiento y haga clic en Establecer temperatura. En la ventana emergente, ajuste la temperatura a 37 °C y el degradado a 1 °C y haga clic en Aceptar. Seleccione el tipo de placa de su elección en el menú desplegable. Agregue el paso de imagen haciendo clic en Imagen. Seleccione el generador de imágenes invertido y haga clic en Aceptar.
- Agregue tres canales de imágenes y configúrelos en DAPI (377, 447 nm), RFP (531, 593 nm) y campo claro. Marque la casilla Montaje y establezca el número y la ubicación deseados de las imágenes. 2 x 2 para una placa de 48 pocillos es una opción común. Cambie la superposición para representar una mejor cobertura de cada pozo. Seleccione qué pozos se van a fotografiar. Se abrirá una nueva ventana donde se pueden seleccionar los pozos de interés.
- Haga clic en Opciones de enfoque para establecer el modo de enfoque . Se abrirá una nueva ventana. Establezca cada canal individualmente. Comúnmente, los pozos se enfocan automáticamente en el canal "DAPI". Establezca todos los demás canales en Altura focal fija desde el primer canal y configúrelos haciendo clic en Aceptar. Cierre la ventana.
- Inicie los pasos de reducción de datos preestablecidos haciendo clic en Reducción de datos y seleccione Preprocesamiento de imágenes. La configuración de este paso reduce el fondo de fluorescencia. Acepte la configuración predeterminada seleccionando Aceptar. Se creará un nuevo conjunto de imágenes con el prefijo "TSF". Las imágenes originales serán preservadas.
- Configure un paso para contar las celdas seleccionando Análisis celular. Seleccione imágenes TSF DAPI en el menú desplegable Canal . Establezca más detalles después de que se hayan realizado las imágenes. Este paso también puede considerarse reducción de datos; Siempre asegúrese de mantener las imágenes originales.
- Prepare el análisis de la señal RFP (calcificación) seleccionando Estadísticas. En la ventana emergente, etiquete Paso y seleccione TSF RFP como canal de entrada. Marque las casillas Valor superior y Valor inferior. Marque la casilla Área total en la lista inferior. Seleccione Ninguno en la columna Efecto de color. En la ventana emergente, haga clic en Personalizado y marque la casilla Fondo. Esto codificará por colores los resultados de bajo-alto para facilitar la evaluación. Pulse OK.
- Para una lectura justa, normalice la señal RFP por celda. Al hacerlo, se divide un área total por celda. Para configurar este paso, presione Ratio en el lado izquierdo. En la ventana emergente, seleccione para la entrada de datos 1 Cuantificación de RFP: Área total en el menú desplegable. Además, seleccione Recuento de celdas como entrada de datos 2.
- Finalmente, seleccione un nuevo nombre de conjunto de datos y presione OK y OK nuevamente. Seleccione Efecto de color como se describió anteriormente. En la esquina superior izquierda, seleccione Archivo y guárdelo como protocolo (tipo de archivo .prt).
- Diariamente después de que se produce la primera calcificación
- Para cada punto de tiempo, repita estos pasos. En el software de inicio, pulse Leer ahora y Protocolo existente.... Seleccione el protocolo que se ha creado en el paso anterior. El programa le pedirá que guarde el experimento. Esto se puede hacer en este paso, pero también en cualquier paso posterior manualmente haciendo clic en el botón Guardar en la parte superior izquierda.
- Una ventana emergente le pedirá que espere a que el sistema se caliente. Encienda el controlador de gas CO2 y configúrelo al 5%.
- Una vez que el sistema haya alcanzado la temperatura establecida, aparecerá un mensaje para insertar una placa y leerla. Presione Cancelar. Esto se debe a que, para cada punto de tiempo, la exposición de cada fluorocromo debe ajustarse individualmente.
- Transporte la placa desde la incubadora hasta el generador de imágenes en una caja segura que resista la rotura y el derrame y que cumpla con las normas locales de bioseguridad para el transporte de células vivas, en caso de accidente. Coloque la placa en el lector de placas.
- Después de cancelar, haga clic en Procedimiento. En la ventana emergente, seleccione Paso de imagen preestablecido. Ajuste primero el enfoque y la exposición en el canal DAPI . Desmarque la casilla Exposición automática en todos los canales. Luego, haga clic en el icono Microscopio junto al canal DAPI . Se abrirá una nueva ventana.
- Seleccione el pozo en el que desea centrarse. Use un pocillo con calcificación media a alta para este paso. Si una señal ya está visible, primero haga clic en Enfoque automático y, a continuación, en Exposición automática. Si no es así, primero aumente la exposición y repita el enfoque automático y la exposición automática. Si lo desea, la exposición se puede ajustar manualmente seleccionando el menú desplegable de exposición. Verifique la configuración en varios pozos. Una vez satisfecho, guarde la configuración.
- Ajuste la exposición de la misma manera para todos los canales.
PRECAUCIÓN: No se centre en otros canales; Solo ajuste la exposición. El plano de enfoque debe ser el mismo para todos los canales. - Cierre la ventana del procedimiento. Seleccione el botón verde Leer ahora en la barra de tareas superior. Guarde el experimento como indica el software.
NOTA: El software ahora leerá automáticamente todos los pozos seleccionados en la configuración seleccionada.
3. Análisis de datos
NOTA: Para obtener capturas de pantalla detalladas sobre cómo realizar el análisis de datos utilizando una plataforma automatizada de imágenes y el software de análisis de imágenes correspondiente (consulte la Tabla de materiales para obtener más detalles), consulte el Archivo complementario 4. Si se utilizan instrumentos de imagen alternativos o software de análisis, las imágenes deben exportarse y procesarse por lotes, asegurando que la exposición, el umbral de fluorescencia o la intensidad se ajusten por igual para todas las imágenes en un conjunto de datos comparativos.
- Mientras el sistema lee la placa, todas las imágenes se procesan automáticamente en segundo plano. Ajuste la configuración del recuento de celdas seleccionando las imágenes TSF DAPI que desea mostrar. Seleccione el pozo de su elección haciendo doble clic. Aparecerá una nueva ventana. Seleccione una de las imágenes.
- Seleccione la pestaña Análisis . En la ventana emergente, seleccione Análisis celular: recuento de células. Haga clic en Aceptar. Anule la selección de los canales RFP y brightfield. Marque la casilla Resaltar objetos .
- Haga clic en Opciones para abrir el menú. Ajuste el umbral de tamaño e intensidad para incluir todos los núcleos pero excluir los desechos. Haga clic en Aceptar. Haga clic en Aplicar cambios en la parte inferior izquierda para transferir también la configuración a todas las demás imágenes.
- De manera similar a como antes, seleccione un pocillo y una imagen con una cantidad media a alta de calcificación para ajustar mejor la relación señal-ruido; haga clic en la ficha Análisis del menú de tareas.
- Esta vez seleccione Estadísticas de imagen. Anule la selección del canal DAPI y brightfield. Haga clic en Opciones para abrir el menú. Marque la casilla Valores atípicos de umbral. Ajuste los valores superior e inferior del umbral. Solo cuente la señal si está por encima del fondo y excluya si hay escombros / artefactos.
- Para establecer un valor de umbral no subjetivo para la señal sobre el fondo, seleccione la herramienta de línea en la barra de tareas. Aparecerá una ventana. Dibuja una línea a través de un parche de señal, pero asegúrate de incluir también un área de fondo.
NOTA: Aparecerá un gráfico en la ventana emergente, que muestra un pico que representa la señal sobre la línea de fondo. El valor de altura máxima del 25% representa el umbral recomendado. También se recomienda medir múltiples parches de señal para garantizar la selección del umbral correcto. Al seleccionar parches de señal, la selección de regiones con una intensidad de señal muy alta puede dar como resultado un umbral que descuida las señales medias o bajas. Por lo tanto, se recomienda seleccionar parches de señal media a baja por encima del fondo. Ejemplos de umbrales demasiado altos, demasiado bajos y precisos se muestran en el archivo complementario 4. - Una vez satisfecho, haga clic en Aceptar y Aplicar cambios para transferir la configuración a todos los demás pozos. Compruebe si el umbral está seleccionado con precisión en los otros pozos.
- Una vez establecidos los umbrales de recuento de celdas y RFP, exporte los datos. Seleccione la placa de interés. En el menú desplegable, se pueden seleccionar varios parámetros para exportar. De relevancia podría ser el recuento de células, el área de RFP y "área / celda", que es la métrica utilizada para la comparación entre grupos. Haga clic en el botón Excel junto al menú desplegable para exportar los datos directamente a una hoja de cálculo.
NOTA: En el menú desplegable, los valores calculados para el recuento de celdas, el área total de la señal RFP (que refleja el área de calcificación), así como la relación normalizada del área total de la señal RFP por celda ahora se pueden seleccionar individualmente y exportar a una hoja de cálculo. Muestre los resultados como la proporción del área total de la señal RFP por celda y visualice (por ejemplo, gráficos de barras). Aplique una prueba t de Student no pareada para comparar dos grupos o un ANOVA no pareado para comparar diferentes grupos en el mismo punto de tiempo. La comparación del mismo grupo en diferentes puntos de tiempo puede requerir un análisis estadístico pareado.
Resultados
El resultado incluye imágenes originales de núcleos teñidos con HOECHST, calcificación marcada con RFP e imágenes de campo claro. Se pueden detectar y analizar diferentes etapas de calcificación que van desde baja (Figura 2) a alta (Figura 3). La calcificación generalmente se puede detectar como manchas negras utilizando microscopía óptica (Figura 2D y Figura 3B, las flechas indican calcificación), que son útiles para la evaluación primaria y para determinar cuándo comenzar la obtención de imágenes. Para mejorar la relación señal-ruido, las imágenes RFP procesadas deben analizarse para cuantificar la calcificación (Figura 2F y Figura 3D, las flechas indican calcificación). Finalmente, los datos pueden presentarse como un gráfico de barras que compara dos o más condiciones en un punto de tiempo, acompañado de imágenes representativas (Figura 4A, B, C). Los datos deben mostrarse normalizados al recuento de células (por ejemplo, como área de calcificación por célula). Los datos también pueden mostrarse como datos de series temporales que muestran la misma condición en varios puntos temporales (Figura 4D).
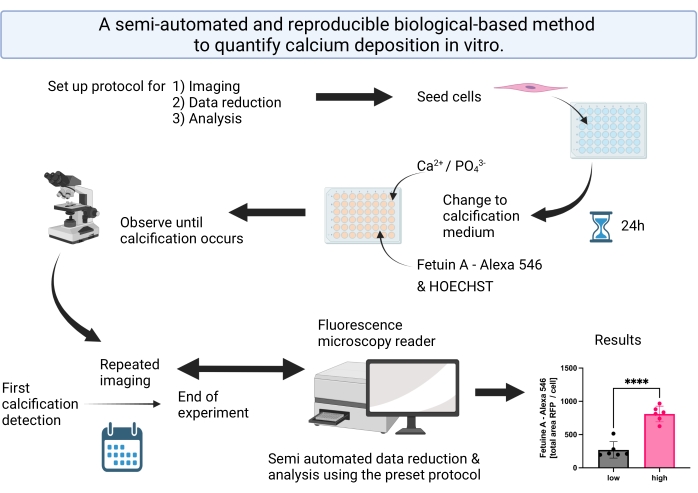
Figura 1: Resumen visual que resume los pasos para la detección y análisis de calcificación semiautomatizada. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Ejemplo de calcificación en etapa temprana. (A) La imagen superpuesta se puede mostrar y analizar como (B) DAPI (núcleos) separados, (C) RFP (calcificación) y (D) imágenes de campo claro. (E) Los núcleos son identificados por el software y se pueden resaltar como círculos amarillos para ajustar la configuración. (F) Para el análisis de la señal RFP, las imágenes se procesan previamente para reducir la señal de fondo y, (G) posteriormente, se puede establecer un umbral para medir la señal. Las flechas indican calcificación en las imágenes RFP transformadas (D) de campo claro y (F y G). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ejemplo de calcificación en etapa posterior. (A) La imagen superpuesta se puede mostrar y analizar como imágenes separadas (B) de campo claro, (C) RFP (calcificación) y (E) DAPI (núcleos). (D) Para el análisis de la señal RFP, las imágenes se procesan previamente para reducir la señal de fondo. Las flechas indican calcificación en las imágenes RFP transformadas (B) y (D) transformadas. Haga clic aquí para ver una versión más grande de esta figura.
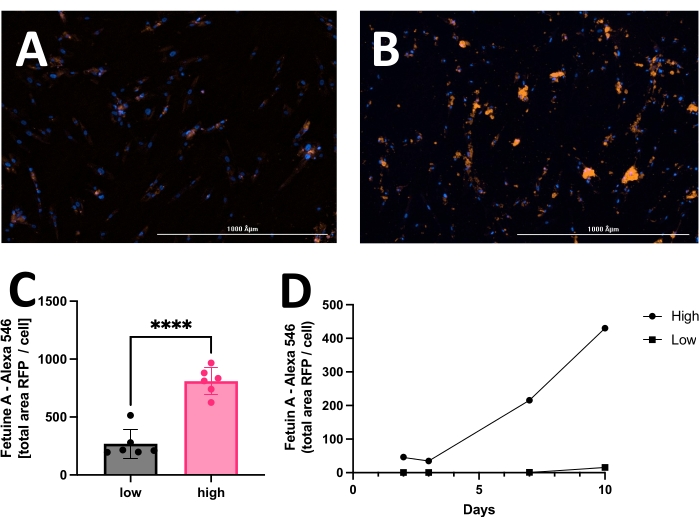
Figura 4: Comparación representativa entre calcificación baja y alta de hVSMC después de 14 días en cultivo con medio de calcificación. Comúnmente, los datos pueden mostrarse como un gráfico de barras y analizarse empleando la prueba t de Student no emparejada. Imágenes representativas de (A) baja calcificación y (B) alta calcificación. La señal roja (RFP) refleja la calcificación, y la señal azul (HOECHST) muestra los núcleos. (C) Calcificación presentada como señal positiva Fetuína A-RFP (área total) por célula. (D) Ejemplo de un ensayo de calcificación medido a lo largo del tiempo. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Ejemplo de una gama de pozos utilizados para un experimento de calcificación con hVSMCs. El anillo exterior de los pozos no se utiliza para el experimento de calcificación, sino que se llena de líquido. Haga clic aquí para descargar este archivo.
Archivo complementario 1: Notas sobre el cultivo celular y el mantenimiento de hVMSC. Haga clic aquí para descargar este archivo.
Archivo complementario 2: Protocolo automatizado de imágenes. Haga clic aquí para descargar este archivo.
Archivo complementario 3: Protocolo de análisis de imágenes. Haga clic aquí para descargar este archivo.
Archivo complementario 4: Protocolo de análisis de datos. Haga clic aquí para descargar este archivo.
Discusión
En este manuscrito, describimos un método semiautomatizado para la determinación de calcificación in vitro . Para este método, se deben optimizar tres pasos críticos de calcificación de hVSMC. En primer lugar, la densidad celular es crítica para el desarrollo de la calcificación de hVSMC. Las bajas densidades de hVSMCs resultarán en calcificación lenta o nula y muerte celular debido a la falta de contacto célula a célula y al estrés inducido en condiciones calcificantes21. Las altas densidades celulares dan como resultado una confluencia excesiva, después de lo cual las células se vuelven senescentes22 y el desarrollo de la calcificación se detiene. Es fundamental sembrar aproximadamente el 70% de confluencia en la placa del pozo que se utilizará para el desarrollo posterior de la calcificación, asegurando la capacidad proliferativa y las conexiones celulares de los hVSMC.
En segundo lugar, los medios de cultivo celular que se utilizarán para la inducción de calcificación requieren optimización. Dentro de la investigación de calcificación vascular, se ha informado que una variedad de condiciones y composiciones de medios calcifican hVSMCs23,24. Creemos que el método es adecuado para detectar todo tipo de calcificación mediada in vitro, y se ha utilizado para detectar depósitos estimulados por calcio, fosfato o calcio-fosfato. Independientemente del modo de inducción de calcificación, la optimización de los medios calcificantes es fundamental. En el protocolo presentado, optimizamos la inducción de calcificación mediante el uso de M199 con una concentración total de calcio de 4.5 mMCa2+ con 2.5% FBS.
Por último, se han observado diferencias locales en las placas durante la calcificación. Es fundamental aplicar una carga aleatoria de réplicas técnicas para evitar el sesgo de la muestra. Además, se debe evitar la carga de los carriles exteriores del pozo, ya que estos pozos siempre se calcifican más rápidamente en la configuración de 48 pozos. Esto es potencialmente causado por la desregulación de la humedad intraplaca, en la que no usar los pozos más externos y cargar estos pozos con grandes volúmenes de líquido ayuda a controlar esto.
Si bien el ensayo de calcificación en sí puede requerir múltiples pasos de optimización para garantizar la reproducibilidad con una configuración particular, una vez en funcionamiento, esto se vuelve sencillo. Los ensayos de calcificación se pueden ejecutar simultáneamente y repetidamente en condiciones establecidas sin necesidad de una mayor optimización. La calcificación mediada por hVSMC puede ser un desafío y requerir experimentación antes de que se haya logrado la robustez de los ensayos. Un investigador debe ser capaz de determinar el momento óptimo antes de comenzar las imágenes regulares, que pueden tomar hasta 1 semana. Se puede establecer un programa de imágenes fijo desde el inicio del experimento, aunque esto puede producir muchas imágenes sin lecturas diferenciales, utilizar una cantidad relativamente grande de almacenamiento de datos para las imágenes y llevar mucho tiempo en el análisis.
El procedimiento descrito en este protocolo es una forma de realizar el análisis del ensayo de calcificación. A otros efectos, el procedimiento debe ajustarse en consecuencia. Nuestro análisis utilizando la plataforma de imágenes automatizada de referencia garantiza la reproducibilidad, aunque el análisis se puede realizar utilizando cualquier célula viva y dispositivo de imagen controlado por temperatura y CO2. Además, los paquetes de software comercial correspondientes están optimizados para la detección y el análisis celular de alto contenido, ideales para medir la propensión a la calcificación a lo largo del tiempo. Otras soluciones de software, como el software gratuito ImageJ, pueden proporcionar análisis de imágenes y cuantificar el desarrollo de la calcificación también.
La obtención de imágenes de las placas de calcificación en etapa tardía puede ser difícil debido a problemas con el enfoque automático en caso de que el cultivo encuentre desechos flotantes, lo que resulta en un número reducido de imágenes nítidas y réplicas. El análisis de imágenes debe ajustarse en consecuencia, y se han desarrollado algunas soluciones en el software empleado en este protocolo para mejorar y simplificar el análisis.
La heterogeneidad celular juega un papel crucial en la cuantificación de la calcificación in vitro. En esta plataforma, utilizamos hVSMCs como biosensores para el desarrollo de la calcificación. Los hVSMC primarios se derivan de varios donantes con diferentes patologías vasculares subyacentes; por lo tanto, este ensayo todavía está sujeto a una alta variabilidad debido a la heterogeneidad de los lotes de VSMC. Una posible solución es el uso de líneas celulares inmortalizadas o el uso de hVSMCs derivadas de células madre pluripotentes.
Otra limitación es que el método de cuantificación sigue siendo sensible a la subjetividad. La subjetividad en los ensayos de calcificación surge debido a los ensayos de punto final, que solo estaban disponibles hasta hace poco. Los investigadores deben decidir cuándo detener el experimento y medir la calcificación, aumentando la subjetividad del ensayo. Creemos que el método introducido en este manuscrito es superior ya que medimos a lo largo del tiempo y podemos comparar el desarrollo de la calcificación en un período determinado. Vinculado a esto, la configuración de iluminación debe ajustarse para cada punto de tiempo por separado debido a la disminución de la señal con el tiempo. Debido a esto, la cantidad de señal representada en una imagen todavía está influenciada por la opinión de un individuo. Es crucial que la iluminación se realice con las más altas relaciones señal-ruido para que el análisis posterior a la imagen se pueda realizar de la manera más objetiva posible.
Aunque vemos la subjetividad de este ensayo como una limitación, creemos que es superior a otros métodos de calcificación in vitro . A diferencia de los métodos existentes, nuestro ensayo de calcificación semiautomatizado tiene la ventaja de que las imágenes se pueden analizar de forma anónima, proporcionando así una opinión ciega independiente. Además, las imágenes se pueden analizar en una etapa posterior con la misma configuración definida en un conjunto de datos, lo que reduce la subjetividad.
Los métodos actuales de determinación de calcificación se basan en mediciones de punto final o carecen del componente vascular25,26,27. Dentro de la clínica, herramientas como la tomografía computarizada, el ultrasonido intravascular y la resonancia magnética son costosas y una carga para los pacientes. La investigación de biomarcadores ha demostrado su uso, pero no refleja la carga de calcificación de los pacientes. Creemos que este ensayo semiautomatizado utiliza no solo un biomarcador único, sino una colección de componentes circulantes, que reflejan el estado cardiovascular de un paciente. Esto se puede utilizar para medir una respuesta de calcificación como un biosensor. Otras aplicaciones potenciales del método descrito incluyen el cribado sérico de los pacientes para el desarrollo de calcificación in vitro como marcador sustituto para el desarrollo personalizado de la calcificación vascular. La plataforma ha demostrado su sensibilidad hacia la diálisis y el tratamiento con vitamina K, además de enfermedades metabólicas y no metabólicas que están relacionadas con pacientes con mal estado cardiovascular y pronóstico20. Dado que el principio del ensayo se basa en la detección de cristales de calcio, planteamos la hipótesis de que también podría ser relevante en otras áreas de investigación donde la mineralización puede ser relevante, como la osteoartritis, la osteoporosis, la medicina regenerativa ósea o la investigación dental.
Divulgaciones
Leon Schurgers ha recibido subvenciones institucionales de Bayer, Boehringer Ingelheim, NattoPharma e IDS. Leon Schurgers posee acciones en Coagulation Profile. Willi Jahnen-Dechent es cofundador y accionista de CALCISCON AG.
Agradecimientos
Esta investigación fue financiada por los programas de investigación e innovación Horizonte 2020 de la Unión Europea bajo el acuerdo de subvención Marie Sklodowska-Curie No 722609 and 764474, NWO ZonMw (MKMD 40-42600-98-13007). Esta investigación fue apoyada por BioSPX. WJ-D recibió fondos de la Deutsche Forschungsgemeinschaft (DFG, Fundación Alemana de Investigación) TRR219-ID de proyecto 322900939 e ID de proyecto 403041552
Materiales
| Name | Company | Catalog Number | Comments |
| Calcium chloride, 93%, anhydrous | Thermo Fisher Scientific | 349615000 | |
| Costar 6-well Clear TC-treated well plates | Corning | 3516 | |
| Cytation 3 System | BioTek, Abcoude, The Netherlands | ||
| Fetal Bovine Serum | Merck | F7524-100ML | |
| Fetuin-A-Alexa Fluor-546 | Prepared in-house | ||
| Gen5 Software v3.10 | BioTek | ||
| Gibco Medium 199 | Thermo Fisher Scientific | 11150059 | |
| Hoechst 33342, Trihydrochloride | Thermo Fisher Scientific | H3570 | |
| PBS (10X), pH 7.4 | Thermo Fisher Scientific | 70011044 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300062 |
Referencias
- Taylor, A. J., Bindeman, J., Feuerstein, I., Cao, F., Brazaitis, M., O'Malley, P. G. Coronary calcium independently predicts incident premature coronary heart disease over measured cardiovascular risk factors: mean three-year outcomes in the Prospective Army Coronary Calcium (PACC) project. Journal of the American College of Cardiology. 46 (5), 807-814 (2005).
- Arad, Y., Goodman, K. J., Roth, M., Newstein, D., Guerci, A. D. Coronary calcification, coronary disease risk factors, C-reactive protein, and atherosclerotic cardiovascular disease events the St. Francis Heart Study. Journal of the American College of Cardiology. 46 (1), 158-165 (2005).
- Detrano, R., et al. Coronary calcium as a predictor of coronary events in four racial or ethnic groups. New England Journal of Medicine. 358 (13), 1336-1345 (2008).
- Schurgers, L. J., Akbulut, A. C., Kaczor, D. M., Halder, M., Koenen, R. R., Kramann, R. Initiation and propagation of vascular calcification is regulated by a concert of platelet- and smooth muscle cell-derived extracellular vesicles. Frontiers in Cardiovascular Medicine. 5, 36 (2018).
- Jaminon, A., Reesink, K., Kroon, A., Schurgers, L. The role of vascular smooth muscle cells in arterial remodeling: focus on calcification-related processes. International Journal of Molecular Sciences. 20 (22), 5694 (2019).
- Mollet, N., et al. Coronary plaque burden in patients with stable and unstable coronary artery disease using multislice CT coronary angiography. La Radiologia Medica. 116 (8), 1174-1187 (2011).
- Galal, H., Rashid, T., Alghonaimy, W., Kamal, D. Detection of positively remodeled coronary artery lesions by multislice CT and its impact on cardiovascular future events. The Egyptian Heart Journal. 71 (1), 26 (2019).
- Benedek, T., Gyöngyösi, M., Benedek, I. Multislice computed tomographic coronary angiography for quantitative assessment of culprit lesions in acute coronary syndromes. The Canadian Journal of Cardiology. 29 (3), 364-371 (2013).
- Raggi, P. Cardiovascular calcification in end stage renal disease. Cardiovascular Disorders in Hemodialysis. 149, 272-278 (2005).
- Raggi, P. Coronary artery calcification predicts risk of CVD in patients with CKD. Nature Reviews Nephrology. 13 (6), 324-326 (2017).
- Durham, A. L., Speer, M. Y., Scatena, M., Giachelli, C. M., Shanahan, C. M. Role of smooth muscle cells in vascular calcification: implications in atherosclerosis and arterial stiffness. Cardiovascular Research. 114 (4), 590-600 (2018).
- Yahagi, K., et al. Pathology of human coronary and carotid artery atherosclerosis and vascular calcification in diabetes mellitus. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (2), 191-204 (2017).
- Harper, E., Forde, H., Davenport, C., Rochfort, K. D., Smith, D., Cummins, P. M. Vascular calcification in type-2 diabetes and cardiovascular disease: Integrative roles for OPG, RANKL and TRAIL. Vascular Pharmacology. 82, 30-40 (2016).
- Lacolley, P., Regnault, V., Segers, P., Laurent, S. Vascular smooth muscle cells and arterial stiffening: relevance in development, aging, and disease. Physiological Reviews. 97 (4), 1555-1617 (2017).
- Pescatore, L. A., Gamarra, L. F., Liberman, M. Multifaceted mechanisms of vascular calcification in aging. Arteriosclerosis, Thrombosis, and Vascular Biology. 39 (7), 1307-1316 (2019).
- Herrmann, J., Babic, M., Tölle, M., vander Giet, M., Schuchardt, M. Research models for studying vascular calcification. International Journal of Molecular Sciences. 21 (6), 2204 (2020).
- Bowler, M. A., Merryman, W. D. In vitro models of aortic valve calcification: solidifying a system. Cardiovascular Pathology: The Official Journal of the Society for Cardiovascular Pathology. 24 (1), 1-10 (2015).
- Gitelman, H. J. An improved automated procedure for the determination of calcium in biological specimens. Analytical Biochemistry. 18 (3), 521-531 (1967).
- Furmanik, M., et al. Endoplasmic reticulum stress mediates vascular smooth muscle cell calcification via increased release of Grp78 (glucose-regulated protein, 78 kDa)-loaded extracellular vesicles. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (2), 898-914 (2021).
- Jaminon, A. M. G., et al. Development of the BioHybrid assay: combining primary human vascular smooth muscle cells and blood to measure vascular calcification propensity. Cells. 10 (8), 2097 (2021).
- Reynolds, J. L., et al. Human vascular smooth muscle cells undergo vesicle-mediated calcification in response to changes in extracellular calcium and phosphate concentrations: a potential mechanism for accelerated vascular calcification in ESRD. Journal of the American Society of Nephrology: JASN. 15 (11), 2857-2867 (2004).
- Wang, X. -. R., Zhang, J. -. J., Xu, X. -. X., Wu, Y. -. G. Prevalence of coronary artery calcification and its association with mortality, cardiovascular events in patients with chronic kidney disease: a systematic review and meta-analysis. Renal Failure. 41 (1), 244-256 (2019).
- Willems, B. A., et al. Ucma/GRP inhibits phosphate-induced vascular smooth muscle cell calcification via SMAD-dependent BMP signalling. Scientific Reports. 8 (1), 4961 (2018).
- Furmanik, M., et al. Reactive oxygen-forming Nox5 links vascular smooth muscle cell phenotypic switching and extracellular vesicle-mediated vascular calcification. Circulation Research. 127 (7), 911-927 (2020).
- Virtanen, P., Isotupa, K. Staining properties of alizarin red S for growing bone in vitro. Acta Anatomica. 108 (2), 202-207 (1980).
- Yang, H., Curinga, G., Giachelli, C. M. Elevated extracellular calcium levels induce smooth muscle cell matrix mineralization in vitro. Kidney International. 66 (6), 2293-2299 (2004).
- Pasch, A., et al. Nanoparticle-based test measures overall propensity for calcification in serum. Journal of the American Society of Nephrology: JASN. 23 (10), 1744-1752 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados