Method Article
一种半自动且可重现的基于生物学的体外定量钙沉积的方法
* 这些作者具有相同的贡献
摘要
心血管疾病是全世界死亡的主要原因。血管钙化大大加重了心血管发病率和死亡率的负担。该协议描述了一种通过荧光成像在 体外 量化血管平滑肌细胞介导的钙沉淀的简单方法。
摘要
血管钙化涉及一系列退行性病变,包括炎症、细胞表型改变、细胞死亡和钙化抑制剂的缺乏,伴随导致血管弹性和功能丧失。血管钙化是许多疾病(包括慢性肾脏病、糖尿病和动脉粥样硬化)发病率和死亡率的重要因素。目前研究血管钙化的研究模型是有限的,仅在体内钙化发展的后期才可行。用于研究血管钙化的体外工具使用终点测量,增加了对生物材料的需求,并有可能将变异性引入研究。我们展示了一种新型荧光标记探针的应用,该探针与人体血管平滑肌细胞的体外钙化发展结合,并确定体外钙化的实时发展。在该协议中,我们描述了我们新开发的钙化测定的应用,这是一种具有潜在转化应用的疾病建模新工具。我们设想该测定法与更广泛的矿物沉积研究相关,包括骨骼、软骨或牙科研究的应用。
引言
血管钙化 (VC) 是心血管疾病发病率和死亡率的独立危险因素1,2,3。长期以来被认为是异位矿物沉积的被动化学过程,现在它似乎是一种可改变的组织愈合反应,涉及各种细胞的积极贡献,包括活化的血管平滑肌细胞(hVSMC)作为疾病的驱动因素4,5。体内VC可以通过多层CT扫描来测量,作为动脉粥样硬化负荷的评估6,7,8。目前,范式转变正在进行中,其中VC严重程度被认为是心血管疾病,II型糖尿病,慢性肾病和衰老的危险因素9,10,11,12,13,14,15。
hVSMC是心血管系统中最丰富的细胞类型,也是VC发展的主要参与者。 体外 hVSMC诱导的钙化是研究心血管疾病的广泛使用的疾病模型16,17。然而,大多数用于体 外 钙化检测的方案使用终点测量,这可能会限制数据采集,需要更多地使用细胞材料,并且可能会减慢研究速度。检测 体外 hVSMC钙化的常用方法包括邻甲酚酞测定法,该测定法测量溶解钙沉积与总蛋白的关系,需要细胞裂解18。此外,使用茜素红染色,其直接与固定细胞或组织上的钙沉积物结合19。要研究邻甲酚酞或茜素红随时间推移的hVSMC钙化,每个时间点需要多次重复,这增加了对生物材料的需求,进而增加了变异性的机会。
在本文中,我们详细介绍了一种新型测定的应用方法,该测定利用hVSMC和荧光成像探针来确定 体外 VC进展,并用作单一终末期钙化测定。我们之前证明,该测定可与邻甲酚酞和茜素红方法直接相媲美,可用于区分不同的培养条件20。除了实时测量外,该测定还可用于确定血清或血浆样品作为临床VC开发的替代标志物的倾向20。这将有助于应用心血管科学和疾病建模的生物学策略。该测定的进一步应用可能是作为转化生物混合系统来评估VC的严重程度或血液成分(如血清或血浆)的进展。
研究方案
1. 细胞接种、维持和钙化诱导
- 要培养原代细胞,请使用层流气流柜、手套和无菌设备。在进行任何工作之前和之后对手和工作区进行消毒。将所有原代细胞和培养基视为潜在的生物危害,除非另有证明。优选在处置前高压灭菌剩余细胞和培养基。不要化学灭活和高压灭菌,因为这会释放有毒烟雾。
- 在未包被的细胞培养板上培养hVSMC。
- 在补充有10%-20%FBS和1%Pen / Strep的M199培养基组成的生长培养基中常规维持hVSMC,并在37°C和5%CO2下孵育。
- 在70%-90%汇合时分裂细胞。
- 要拆分,请用PBS清洗hVSMC2倍。加入胰蛋白酶并在37°C孵育2-5分钟。 在显微镜下检查细胞的分离。
- 通过添加含血清培养基来抑制胰蛋白酶反应。将细胞以350× g 离心4分钟,并将沉淀重悬于维持培养基中。hVSMC遵循1:2的拆分方案。
- 要开始钙化实验,请按照分裂说明准备细胞(步骤1.4.1)。重悬后,将细胞和种子计数到48孔板中,密度为10-15 x 103 细胞/ cm2。接种细胞,避免使用外孔,如 补充图1所示。
- 让细胞粘附并恢复24小时(过夜),同时在37°C和5%CO2下孵育。
- 用PBS轻轻洗涤细胞2次,在第二次洗涤后 小心地吸出所有剩余的PBS。
- 轻轻加入钙化培养基,并在37°C和5%CO2下进一步孵育。钙化培养基必须含有钙化刺激物、荧光标记的胎儿-A(例如,使用红色荧光蛋白 [RFP])(1 μg/mL)和 HOECHST 33342 (0.1 μg/mL) 核染色剂或类似的活荧光核染色剂。不要使用 DAPI,因为这是不可渗透的。
- 每天用光学显微镜检查,直到钙化发生。
注意:有关hVMSC的细胞培养和维护的说明,请参阅 补充文件1。
2. 通过成像检测钙化
注意:以下协议提供了在准备、成像和数据分析中要采取的一般步骤。补充文件2和补充文件3中提供了支持使用自动成像平台和相应图像分析软件的每个步骤说明的屏幕截图(有关详细信息,请参阅材料表)。其他成像仪器和图像处理工具可用于应用该协议。然而,在每个孔的同一位置重复成像对于有意义的数据采集至关重要。创建在每个成像步骤中成像钙化和重复使用的协议对于获得可重复的结果是必要的。首次应用该方法时,请按照以下步骤在成像前进行准备。
- 协议设置
- 打开软件,然后选择" 协议 "和 "新建"。
- 选择 程序 ,然后单击 设置温度。在弹窗中,将温度设置为37°C,梯度设置为1°C,然后单击 确定。从下拉菜单中选择所需的板类型。通过 单击图像添加映像步骤。选择反转成像器,然后单击" 确定"。
- 添加三个成像通道,并将其设置为 DAPI(377、447 nm)、RFP(531、593 nm)和明场。勾选蒙 太奇 框并设置所需的图像数量和位置。48孔板的2 x 2是常见的选择。更改重叠以表示每个井的更好覆盖范围。选择要成像的孔。将打开一个新窗口,可以在其中选择感兴趣的井。
- 单击 对焦选项 以设置对焦模式。将打开一个新窗口。单独设置每个通道。通常,孔自动聚焦在"DAPI"通道上。将所有其他通道设置为 从第一个通道开始的固定焦距 ,然后单击 "确定"进行设置。关闭窗口。
- 通过单击数据缩减并选择图像预处理来开始预设数据缩减步骤。设置此步骤可减少荧光背景。通过选择"确定"接受默认设置。将创建一组前缀为"TSF"的新映像。原始图像将被保留。
- 通过选择细胞分析设置计数细胞的步骤。从通道下拉菜单中选择 TSF DAPI 图像。在执行成像后设置更多详细信息。此步骤也可以被视为数据缩减;始终确保保留原始图像。
- 通过选择统计来准备 RFP(钙化)信号的分析。在弹出窗口中,标记步骤并选择 TSF RFP 作为输入通道。勾选上限值和下限值框。勾选下方列表中的总面积框。在"颜色效果"列中选择"无"。在弹出窗口中,单击 定制 并勾选 背景 框。这将对结果进行从低到高的颜色编码,以便于评估。按确定。
- 为了获得公平的读数,请对每个单元格的 RFP 信号进行归一化。在此过程中,将按单元格划分总面积。要设置此步骤,请按左侧的 比率 。在弹出窗口中,从下拉菜单中选择 1 RFP 量化:总面积 进行数据输入。进一步选择 单元格计数 作为数据输入 2.
- 最后,选择 一个新的数据集名称 ,然后按 确定 ,然后再次按 确定 。如前所述选择 颜色效果 。在左上角,选择"文件"并将 文件 另存为协议(.prt 文件类型)。
- 第一次钙化发生后每天
- 对于每个时间点,重复这些步骤。在启动软件中,按 立即读取 和 现有协议...。选择在上一步中创建的协议。程序将要求保存实验。这可以在此步骤中完成,也可以在以后的任何步骤中通过单击左上角的" 保存 "按钮手动完成。
- 弹出窗口将要求等待系统加热。打开 CO2 气体控制器并将其设置为 5%。
- 系统达到设定温度后,将出现插入板并读取的提示。按 取消。这是因为,对于每个时间点,必须单独调整每种荧光染料的曝光。
- 将板从培养箱运输到成像仪,放在一个安全的盒子中,该盒子可以防止破裂和溢出,并符合当地运输活细胞的生物安全法规,以防发生事故。将板放入读板器中。
- 取消后,单击程序。在弹出窗口中,选择预设成像步骤。首先调整 DAPI 通道上的焦点和曝光。取消选中所有渠道的自动曝光框。然后,单击 显微镜 DAPI 通道旁边的图标。将打开一个新窗口。
- 选择要关注的井。在此步骤中使用中到高钙化的孔。如果信号已经可见,请先点按"自动 对焦 ",然后点按 "自动曝光"。如果没有,请先增加曝光并重复自动 对焦 和 自动曝光。如果需要,可以通过选择曝光下拉菜单手动调整曝光。检查多个孔的设置。满意后,保存设置。
- 以相同的方式调整所有通道的曝光。
注意:不要关注其他渠道;仅调整曝光。所有通道的焦点平原应相同。 - 关闭过程窗口。选择顶部任务栏中的绿色" 立即阅读 "按钮。按照软件指示保存实验。
注意:软件现在将自动读取所选设置中的所有选定孔。
3. 数据分析
注意:有关如何使用自动成像平台和相应的图像分析软件进行数据分析的详细屏幕截图(有关详细信息,请参阅 材料表 ),请参阅 补充文件 4。如果使用其他成像仪器或分析软件,则应导出图像并进行批量处理,确保对比较数据集中的所有图像进行均匀调整曝光、荧光阈值或强度。
- 当系统读取印版时,所有图像都在后台自动处理。通过选择要显示的 TSF DAPI 图像来调整细胞计数设置。双击选择所选井。将弹出一个新窗口。选择其中一个图像。
- 选择 "分析 "选项卡。在弹出窗口中,选择细胞 分析:细胞计数。单击" 确定"。取消选择 RFP 和明场通道。勾选 突出显示对象 框。
- 单击 选项 以打开菜单。调整大小和强度阈值以包括所有细胞核,但不包括碎片。单击" 确定"。单击左下角的应用 更改 ,将设置也传输到所有其他图像。
- 以与以前类似的方式,选择具有中到高钙化的孔和图像,以最好地调整信噪比;单击任务菜单中 的分析 选项卡。
- 这次选择 图像统计。取消选择 DAPI 和明场通道。单击 选项 以打开菜单。勾选 阈值异常值框。调整阈值的上限和下限值。仅当信号高于背景时,才对信号进行计数,如果有碎屑/伪影,则排除信号。
- 要为背景上方的信号设置非主观阈值,请从任务栏中选择线条工具。将弹出一个窗口。在信号块上画一条线,但要确保还包括一个背景区域。
注意:弹出窗口中将出现一个图表,显示代表背景线上方信号的峰值。25%峰高值代表推荐的阈值。还建议测量多个信号斑块,以确保选择正确的阈值。在选择信号块时,选择信号强度非常高的区域可能会导致忽略中等和/或更低信号的阈值。因此,建议选择背景上方的中低信号斑块。过高、过低和准确的阈值示例显示在 补充文件 4 中。 - 满意后,单击 "确定 "和 "应用更改 "以将设置传输到所有其他孔。检查在其他孔中是否准确选择了阈值。
- 设置单元格计数和 RFP 阈值后,导出数据。选择感兴趣的板。在下拉菜单中,可以选择多个参数进行导出。相关性可能是细胞计数、RFP 区域和"区域/单元格",这是用于组间比较的指标。单击下拉菜单旁边的 Excel 按钮,将数据直接导出到电子表格中。
注意:在下拉菜单中,现在可以单独选择细胞计数的计算值,RFP信号的总面积(反映钙化面积)以及每个细胞RFP信号总面积的归一化比率并导出到电子表格。将结果显示为每个单元格RFP信号总面积的比率并可视化(例如,条形图)。应用未配对的学生 t 检验来比较两组,或应用未配对方差分析来比较同一时间点的不同组。在不同时间点比较同一组可能需要配对统计分析。
结果
结果包括HOECHST染色细胞核的原始图像,RFP标记的钙化和明场图像。可以检测和分析从低(图2)到高(图3)的不同钙化阶段。钙化通常可以使用光学显微镜发现为黑色斑点(图 2D 和图 3B,箭头表示钙化),这对于初步评估和确定何时开始影像学检查很有用。为了提高信噪比,应分析处理后的RFP图像以量化钙化(图2F和图3D,箭头表示钙化)。最后,数据可以表示为一个时间点比较两个或多个条件的条形图,并附有代表性图像(图4A,B,C)。数据应按细胞计数标准化显示(例如,作为每个细胞的钙化面积)。数据也可以显示为时间序列数据,显示不同时间点的相同条件(图4D)。
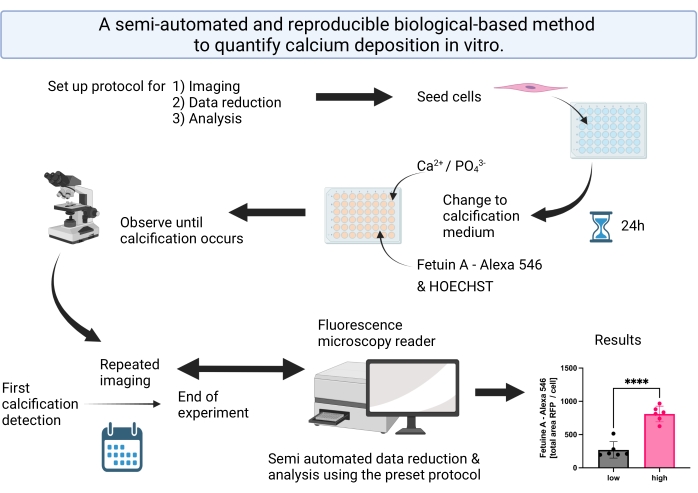
图 1:可视化摘要,总结了半自动钙化检测和分析的步骤。 请点击此处查看此图的大图。

图2:早期钙化的例子 。 (A)叠加图像可以显示为(B)单独的DAPI(细胞核),(C)RFP(钙化)和(D)明场图像。(E)细胞核由软件识别,可以突出显示为黄色圆圈以调整设置。(F)为了分析RFP信号,对图像进行预处理以减少背景信号,(G)随后,可以设置阈值来测量信号。箭头表示(D)明场和(F &G)变换RFP图像中的钙化。 请点击此处查看此图的大图。

图3:晚期钙化的例子 。 (A)叠加图像可以作为单独的(B)明场,(C)RFP(钙化)和(E)DAPI(细胞核)图像显示和分析。(D)为了分析RFP信号,对图像进行预处理以减少背景信号。箭头表示 (B) 明场和 (D) 转换后的 RFP 图像中的钙化。 请点击此处查看此图的大图。
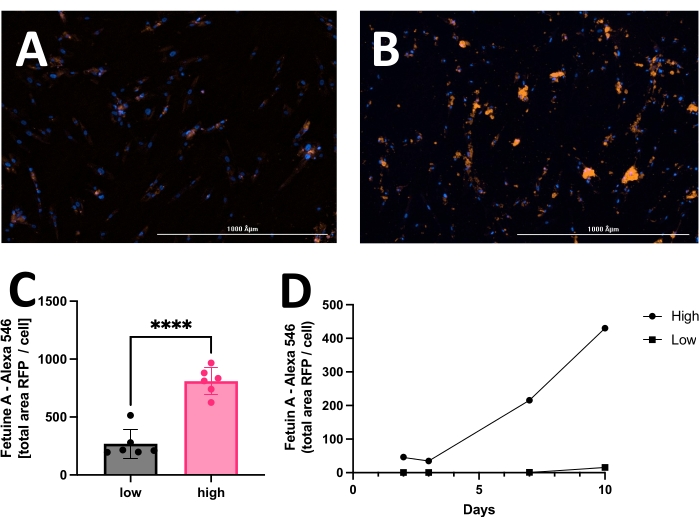
图4:用钙化培养基培养14天后hVSMC低钙化和高钙化的代表性比较。 通常,数据可以显示为条形图,并使用未配对的学生 t 检验进行分析。(A)低钙化和(B)高钙化的代表性图像。红色信号(RFP)反映钙化,蓝色信号(HOECHST)显示细胞核。(C)钙化表现为每个细胞的胎儿A-RFP阳性信号(总面积)。(D)随时间测量的钙化测定示例。 请点击此处查看此图的大图。
补充图1:用于hVSMC钙化实验的一系列孔的示例。孔的外环不用于钙化实验,而是充满液体。请点击此处下载此文件。
补充文件1:关于hVMSC细胞培养和维护的说明。请点击此处下载此文件。
补充文件2:自动成像协议。请点击此处下载此文件。
补充文件3:图像分析协议。请点击此处下载此文件。
补充文件4:数据分析协议。请点击此处下载此文件。
讨论
在本手稿中,我们描述了一种用于 体外 钙化测定的半自动方法。对于这种方法,应优化hVSMC钙化的三个关键步骤。首先,细胞密度对于hVSMC钙化的发展至关重要。由于缺乏细胞间接触以及在钙化条件下诱导的应激,hVSMC的低密度将导致缓慢或无钙化和细胞死亡21。高细胞密度导致过度融合,之后细胞衰老22 ,钙化发育停止。在孔板中播种大约70%的汇合度至关重要,这些汇合度将用于随后的钙化发展,确保hVSMC的增殖能力和细胞连接。
其次,用于钙化诱导的细胞培养基需要优化。在血管钙化研究中,已经报道了多种条件和培养基组成来钙化hVSMCs23,24。我们认为该方法适用于检测各种体外介导的钙化,并且已被用于检测钙,磷酸盐或钙磷酸盐刺激的沉积物。无论钙化诱导的模式如何,钙化介质的优化都是关键。在提出的方案中,我们使用总钙浓度为4.5 mM Ca2+和2.5%FBS的M199优化钙化诱导。
最后,观察到钙化过程中板的局部差异。应用技术重复的随机加载以防止样品偏差至关重要。此外,应避免外井通道的负载,因为这些井在48孔设置中总是更快地钙化。这可能是由板内湿度失调引起的,其中不使用最外层的井并在这些孔中装载大量液体有助于控制这一点。
虽然钙化测定本身可能需要多个优化步骤以确保特定设置的可重复性,但一旦启动并运行,这变得简单明了。钙化测定可以在既定条件下同时和重复运行,无需进一步优化。hVSMC介导的钙化可能具有挑战性,需要在实现测定的稳健性之前进行实验。研究人员应该能够在开始常规成像之前确定最佳时间,这可能需要长达 1 周的时间。从实验开始就可以建立固定的成像时间表,尽管这可能会产生许多没有差异读数的图像,对图像使用相对大量的数据存储,并且分析非常耗时。
本协议中描述的程序是执行钙化测定分析的一种方法。对于其他目的,应相应调整程序。我们使用参考的自动成像平台进行分析可确保可重复性,尽管可以使用任何活细胞以及温度和CO2控制的成像设备进行分析。此外,相应的商业软件包针对高内涵细胞筛选和分析进行了优化,非常适合测量钙化倾向随时间的变化。其他软件解决方案,如免费软件ImageJ,也可以提供图像分析和量化钙化发展。
如果培养物遇到漂浮碎片,由于自动聚焦问题,后期钙化板的成像可能很困难,从而导致锐利图像和复制的数量减少。应相应地调整图像分析,并且已在本协议中使用的软件中开发了一些解决方案以改进和简化分析。
细胞异质性在 体外钙化的定量中起着至关重要的作用。在这个平台上,我们使用hVSMC作为钙化发展的生物传感器。原发性 hVSMC 来源于具有不同潜在血管病变的各种供体;因此,由于VSMC批次的异质性,该测定仍具有很高的变异性。一种可能的解决方案是使用永生化细胞系或使用源自多能干细胞的hVSMC。
另一个限制是量化方法仍然对主观性敏感。钙化测定的主观性是由于终点测定而出现的,直到最近才可用。研究人员必须决定何时停止实验并测量钙化,从而增加测定的主观性。我们相信本手稿中介绍的方法在一段时间内进行测量时是优越的,并且可以比较一定时期内的钙化发展。与此相关,由于信号随时间推移而减少,需要为每个时间点分别调整照明设置。因此,图片中表示的信号量仍然受到个人意见的影响。以最高的信噪比进行照明至关重要,这样才能尽可能客观地进行图像后分析。
尽管我们认为该测定的主观性是一种局限性,但我们认为它优于其他 体外 钙化方法。与现有方法不同,我们的半自动钙化测定具有可以匿名分析图像的优点,从而提供独立的盲法意见。此外,可以在稍后阶段使用数据集中相同定义的设置分析图像,从而降低主观性。
目前的钙化测定方法依赖于终点测量或缺乏血管成分25,26,27。在临床内,计算机断层扫描、血管内超声和磁共振成像等工具价格昂贵,对患者来说是一种负担。生物标志物研究已经证明了它的用途,但不能反映患者的钙化负担。我们相信,这种半自动检测不仅使用一种生物标志物,还使用一系列循环成分,反映患者的心血管状况。这可用于测量钙化反应作为生物传感器。所述方法的潜在进一步应用包括患者血清筛查体外钙化发展作为血管钙化个性化发展的替代标志物。该平台已经证明了其对透析和维生素K治疗的敏感性,以及与心血管状态和预后不良的患者相关的代谢和非代谢性疾病20。由于该测定的原理是基于钙晶体的检测,我们假设它也可能与矿化可能相关的其他研究领域相关,例如骨关节炎,骨质疏松症,骨再生医学或牙科研究。
披露声明
Leon Schurgers获得了拜耳,勃林格殷格翰,纳豆制药和IDS的机构资助。Leon Schurgers拥有Coagulation Profile的股份。Willi Jahnen-Dechent是CALCISCON AG的联合创始人和股东。
致谢
这项研究由欧盟的地平线2020研究和创新计划资助,根据玛丽·斯克洛多夫斯卡-居里赠款协议第722609和764474,NWO ZonMw(MKMD 40-42600-98-13007)。这项研究得到了BioSPX的支持。WJ-D获得德国研究基金会TRR219项目ID 322900939和项目ID 403041552的资助
材料
| Name | Company | Catalog Number | Comments |
| Calcium chloride, 93%, anhydrous | Thermo Fisher Scientific | 349615000 | |
| Costar 6-well Clear TC-treated well plates | Corning | 3516 | |
| Cytation 3 System | BioTek, Abcoude, The Netherlands | ||
| Fetal Bovine Serum | Merck | F7524-100ML | |
| Fetuin-A-Alexa Fluor-546 | Prepared in-house | ||
| Gen5 Software v3.10 | BioTek | ||
| Gibco Medium 199 | Thermo Fisher Scientific | 11150059 | |
| Hoechst 33342, Trihydrochloride | Thermo Fisher Scientific | H3570 | |
| PBS (10X), pH 7.4 | Thermo Fisher Scientific | 70011044 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300062 |
参考文献
- Taylor, A. J., Bindeman, J., Feuerstein, I., Cao, F., Brazaitis, M., O'Malley, P. G. Coronary calcium independently predicts incident premature coronary heart disease over measured cardiovascular risk factors: mean three-year outcomes in the Prospective Army Coronary Calcium (PACC) project. Journal of the American College of Cardiology. 46 (5), 807-814 (2005).
- Arad, Y., Goodman, K. J., Roth, M., Newstein, D., Guerci, A. D. Coronary calcification, coronary disease risk factors, C-reactive protein, and atherosclerotic cardiovascular disease events the St. Francis Heart Study. Journal of the American College of Cardiology. 46 (1), 158-165 (2005).
- Detrano, R., et al. Coronary calcium as a predictor of coronary events in four racial or ethnic groups. New England Journal of Medicine. 358 (13), 1336-1345 (2008).
- Schurgers, L. J., Akbulut, A. C., Kaczor, D. M., Halder, M., Koenen, R. R., Kramann, R. Initiation and propagation of vascular calcification is regulated by a concert of platelet- and smooth muscle cell-derived extracellular vesicles. Frontiers in Cardiovascular Medicine. 5, 36 (2018).
- Jaminon, A., Reesink, K., Kroon, A., Schurgers, L. The role of vascular smooth muscle cells in arterial remodeling: focus on calcification-related processes. International Journal of Molecular Sciences. 20 (22), 5694 (2019).
- Mollet, N., et al. Coronary plaque burden in patients with stable and unstable coronary artery disease using multislice CT coronary angiography. La Radiologia Medica. 116 (8), 1174-1187 (2011).
- Galal, H., Rashid, T., Alghonaimy, W., Kamal, D. Detection of positively remodeled coronary artery lesions by multislice CT and its impact on cardiovascular future events. The Egyptian Heart Journal. 71 (1), 26 (2019).
- Benedek, T., Gyöngyösi, M., Benedek, I. Multislice computed tomographic coronary angiography for quantitative assessment of culprit lesions in acute coronary syndromes. The Canadian Journal of Cardiology. 29 (3), 364-371 (2013).
- Raggi, P. Cardiovascular calcification in end stage renal disease. Cardiovascular Disorders in Hemodialysis. 149, 272-278 (2005).
- Raggi, P. Coronary artery calcification predicts risk of CVD in patients with CKD. Nature Reviews Nephrology. 13 (6), 324-326 (2017).
- Durham, A. L., Speer, M. Y., Scatena, M., Giachelli, C. M., Shanahan, C. M. Role of smooth muscle cells in vascular calcification: implications in atherosclerosis and arterial stiffness. Cardiovascular Research. 114 (4), 590-600 (2018).
- Yahagi, K., et al. Pathology of human coronary and carotid artery atherosclerosis and vascular calcification in diabetes mellitus. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (2), 191-204 (2017).
- Harper, E., Forde, H., Davenport, C., Rochfort, K. D., Smith, D., Cummins, P. M. Vascular calcification in type-2 diabetes and cardiovascular disease: Integrative roles for OPG, RANKL and TRAIL. Vascular Pharmacology. 82, 30-40 (2016).
- Lacolley, P., Regnault, V., Segers, P., Laurent, S. Vascular smooth muscle cells and arterial stiffening: relevance in development, aging, and disease. Physiological Reviews. 97 (4), 1555-1617 (2017).
- Pescatore, L. A., Gamarra, L. F., Liberman, M. Multifaceted mechanisms of vascular calcification in aging. Arteriosclerosis, Thrombosis, and Vascular Biology. 39 (7), 1307-1316 (2019).
- Herrmann, J., Babic, M., Tölle, M., vander Giet, M., Schuchardt, M. Research models for studying vascular calcification. International Journal of Molecular Sciences. 21 (6), 2204 (2020).
- Bowler, M. A., Merryman, W. D. In vitro models of aortic valve calcification: solidifying a system. Cardiovascular Pathology: The Official Journal of the Society for Cardiovascular Pathology. 24 (1), 1-10 (2015).
- Gitelman, H. J. An improved automated procedure for the determination of calcium in biological specimens. Analytical Biochemistry. 18 (3), 521-531 (1967).
- Furmanik, M., et al. Endoplasmic reticulum stress mediates vascular smooth muscle cell calcification via increased release of Grp78 (glucose-regulated protein, 78 kDa)-loaded extracellular vesicles. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (2), 898-914 (2021).
- Jaminon, A. M. G., et al. Development of the BioHybrid assay: combining primary human vascular smooth muscle cells and blood to measure vascular calcification propensity. Cells. 10 (8), 2097 (2021).
- Reynolds, J. L., et al. Human vascular smooth muscle cells undergo vesicle-mediated calcification in response to changes in extracellular calcium and phosphate concentrations: a potential mechanism for accelerated vascular calcification in ESRD. Journal of the American Society of Nephrology: JASN. 15 (11), 2857-2867 (2004).
- Wang, X. -. R., Zhang, J. -. J., Xu, X. -. X., Wu, Y. -. G. Prevalence of coronary artery calcification and its association with mortality, cardiovascular events in patients with chronic kidney disease: a systematic review and meta-analysis. Renal Failure. 41 (1), 244-256 (2019).
- Willems, B. A., et al. Ucma/GRP inhibits phosphate-induced vascular smooth muscle cell calcification via SMAD-dependent BMP signalling. Scientific Reports. 8 (1), 4961 (2018).
- Furmanik, M., et al. Reactive oxygen-forming Nox5 links vascular smooth muscle cell phenotypic switching and extracellular vesicle-mediated vascular calcification. Circulation Research. 127 (7), 911-927 (2020).
- Virtanen, P., Isotupa, K. Staining properties of alizarin red S for growing bone in vitro. Acta Anatomica. 108 (2), 202-207 (1980).
- Yang, H., Curinga, G., Giachelli, C. M. Elevated extracellular calcium levels induce smooth muscle cell matrix mineralization in vitro. Kidney International. 66 (6), 2293-2299 (2004).
- Pasch, A., et al. Nanoparticle-based test measures overall propensity for calcification in serum. Journal of the American Society of Nephrology: JASN. 23 (10), 1744-1752 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。