Method Article
Combinación de organoides humanos y tecnología organ-on-a-chip para modelar la funcionalidad específica de la región intestinal
En este artículo
Resumen
Los organoides intestinales derivados de biopsias y las tecnologías de organ-on-a-chips se combinan en una plataforma microfisiológica para recapitular la funcionalidad intestinal específica de la región.
Resumen
La mucosa intestinal es una barrera física y bioquímica compleja que cumple una miríada de funciones importantes. Permite el transporte, la absorción y el metabolismo de nutrientes y xenobióticos, al tiempo que facilita una relación simbiótica con la microbiota y restringe la invasión de microorganismos. La interacción funcional entre varios tipos de células y su entorno físico y bioquímico es vital para establecer y mantener la homeostasis del tejido intestinal. Modelar estas interacciones complejas y la fisiología intestinal integrada in vitro es un objetivo formidable con el potencial de transformar la forma en que se descubren y desarrollan nuevas dianas terapéuticas y candidatos a fármacos.
Los organoides y las tecnologías Organ-on-a-Chip se han combinado recientemente para generar chips intestinales relevantes para el ser humano adecuados para estudiar los aspectos funcionales de la fisiología intestinal y la fisiopatología in vitro. Los organoides derivados de las biopsias del intestino delgado (duodeno) y grueso se siembran en el compartimento superior de un chip de órgano y luego se expanden con éxito como monocapas mientras preservan las características celulares, moleculares y funcionales distintivas de cada región intestinal. Las células endoteliales microvasculares específicas del tejido del intestino humano se incorporan en el compartimento inferior del chip del órgano para recrear la interfaz epitelial-endotelial. Esta novedosa plataforma facilita la exposición luminal a nutrientes, fármacos y microorganismos, lo que permite estudios de transporte intestinal, permeabilidad e interacciones huésped-microbio.
Aquí, se proporciona un protocolo detallado para el establecimiento de chips intestinales que representan el duodeno humano (chip de duodeno) y el colon (chip de colon), y su posterior cultivo bajo flujo continuo y deformaciones similares a la peristalsis. Demostramos métodos para evaluar el metabolismo de fármacos y la inducción de CYP3A4 en chip duodeno utilizando inductores y sustratos prototípicos. Por último, proporcionamos un procedimiento paso a paso para el modelado in vitro de la interrupción de la barrera mediada por interferón gamma (IFNγ) (síndrome del intestino permeable) en un chip de colon, incluidos los métodos para evaluar la alteración de la permeabilidad paracelular, los cambios en la secreción de citoquinas y el perfil transcriptómico de las células dentro del chip.
Introducción
El intestino humano es un órgano complejo y multitarea capaz de autorregenerarse. Se divide en el intestino delgado y grueso. La función principal del intestino delgado es digerir aún más los alimentos que provienen del estómago, absorber todos los nutrientes y pasar el residuo al intestino grueso, que recupera el agua y los electrolitos. El intestino delgado se divide en múltiples regiones anatómicamente distintas: el duodeno, el yeyuno y el íleon, cada uno de los cuales está adaptado para realizar funciones específicas. Por ejemplo, el duodeno ayuda a descomponer el quimo (contenido del estómago) para permitir la absorción adecuada de nutrientes que involucran proteínas, carbohidratos, vitaminas y minerales en el yeyuno. Esta parte proximal del intestino delgado es también el sitio principal de absorción y metabolismo intestinal de fármacos, y se caracteriza por la mayor expresión de enzimas metabolizadoras de fármacos (por ejemplo, CYP3A4) en comparación con su expresión en el íleon y el colon1. Además de su papel principal en la digestión y absorción de nutrientes, el intestino también es una barrera eficaz contra los contenidos luminales potencialmente dañinos, como microorganismos patógenos, metabolitos microbianos, antígenos dietéticos y toxinas 2,3. Cabe destacar que el colon humano está habitado por una gran cantidad de microorganismos, muy superiores a los del total de células en el cuerpo humano, que proporcionan muchos beneficios a la nutrición, el metabolismo y la inmunidad. Por lo tanto, el mantenimiento de la integridad de la barrera mucosa formada por las células epiteliales intestinales es fundamental para permitir la relación simbiótica entre la microbiota intestinal y las células huésped separándolas físicamente para evitar la activación innecesaria de las células inmunes2. Además, la muerte celular intestinal programada juega un papel esencial como mecanismo de autoprotección que evita que las células infectadas persistan o proliferen, diseminando así patógenos potenciales3, mientras que la autorrenovación continua del epitelio intestinal cada cuatro a siete días compensa la pérdida celular asegurando la integridad de la barrera y la homeostasis tisular. Las alteraciones de las funciones intestinales descritas, incluida la absorción de nutrientes, la integridad de la barrera o el desequilibrio en la muerte celular intestinal y la autorrenovación, pueden dar lugar al desarrollo de una variedad de trastornos gastrointestinales, incluida la desnutrición y la enfermedad inflamatoria intestinal (EII)2,3.
Anteriormente, se han utilizado modelos animales y líneas celulares intestinales transformadas derivadas del cáncer para estudiar las funciones fisiológicas y fisiopatológicas del tejido intestinal humano. Sin embargo, las preocupaciones cada vez más prominentes sobre la traducibilidad de la investigación con animales a los seres humanos, causadas por la presencia de disparidades significativas entre las dos especies, destacaron la necesidad de métodos alternativos relevantes para los humanos4. Las líneas celulares intestinales in vitro comúnmente utilizadas incluyen células T84, Caco-2 y HT29. Si bien imitan ciertos aspectos de la función de barrera intestinal y el transporte de membrana, se caracterizan por una expresión alterada de las enzimas metabolizadoras de fármacos5, receptores de superficie y transportadores4. Además, carecen de especificidad del segmento intestinal y no logran recapitular la complejidad del epitelio intestinal, ya que cada modelo contiene solo uno de los cinco tipos de células epiteliales presentes en el intestino6.
Recientemente, los cultivos de organoides intestinales humanos establecidos a partir de biopsias frescas del intestino delgado y el colon 7,8 o células madre pluripotentes inducidas (iPSC)9 se introdujeron como modelos experimentales alternativos con potencial para complementar, reducir y tal vez reemplazar la experimentación con animales en el futuro. Si bien las iPSC se pueden obtener de manera no invasiva, el establecimiento de organoides a partir de iPSC requiere el uso de protocolos complejos y largos (con varios pasos experimentales) y genera cultivos que se asemejan al tejido fetal humano. Por el contrario, los organoides derivados de biopsias son altamente escalables, ya que pueden aprovechar la capacidad de renovación inherente del tejido intestinal y pueden pasarse y propagarse indefinidamente in vitro. Es importante destacar que los organoides derivados de biopsias mantienen las características específicas de la enfermedad y la región intestinal del tejido primario a partir del cual se desarrollaron y emulan la diversidad celular del epitelio intestinal. Los organoides se pueden utilizar como avatares específicos del paciente in vitro para desentrañar la biología y la patogénesis de diversos trastornos gastrointestinales y mejorar su manejo terapéutico. Aunque los organoides intestinales han alcanzado un grado impresionante de funcionalidad fisiológica, todavía no logran reproducir la complejidad de los órganos nativos debido a su falta de componentes estromales críticos, incluidos los vasos sanguíneos, el tejido conectivo, los nervios periféricos y las células inmunes, así como la estimulación mecánica. Se sabe que los parámetros mecánicos, como el flujo, la tensión cortante, el estiramiento y la presión, influyen en la morfogénesis tisular y la homeostasis in vivo y anteriormente se demostró que mejoran la maduración de las células in vitro 10,11,12,13. Un inconveniente importante adicional de los sistemas organoides es la inaccesibilidad de la luz y, por lo tanto, del lado apical del epitelio. Esto presenta un desafío para investigar varios mecanismos asociados con la expresión polarizada de los transportadores de iones y medicamentos, las interacciones huésped-microbioma y las pruebas de toxicidad farmacéutica. Por último, los cultivos de organoides sufren de una variabilidad considerable en tamaño, morfología y función, debido a la naturaleza estocástica del proceso de autoorganización in vitro y las elecciones de destino celular. Por lo tanto, para aprovechar todo el potencial de los organoides intestinales en el modelado de enfermedades, la detección de medicamentos y la medicina regenerativa, es necesario explorar nuevas estrategias que reduzcan la variabilidad en el desarrollo de organoides, mejoren el acceso al compartimiento luminal e incorporen las interacciones célula-célula faltantes.
La tecnología Organ-on-a-Chip ha introducido muchas técnicas para la incorporación de fuerzas mecánicas y flujo de fluidos a cultivos celulares intestinales in vitro. Sin embargo, dado que la mayoría de los estudios iniciales de prueba de concepto han utilizado líneas celulares derivadas del cáncer que no exhibieron suficiente diversidad celular, la relevancia de estos sistemas ha sido cuestionada. Recientemente, hemos combinado sinérgicamente organoides intestinales y tecnología organ-on-a-chip para incorporar las mejores características de cada enfoque en un sistema in vitro 14,15,16. El chip intestinal resultante recapitula la arquitectura multicelular del epitelio intestinal, la presencia de la interfaz del tejido epitelial-endotelial y las fuerzas mecánicas del flujo y estiramiento del fluido, lo que permite la emulación de las funciones a nivel de órganos in vitro. Además, el uso de organoides derivados de tejidos primarios (que se pueden muestrear de diferentes regiones del intestino humano) como material de partida aumenta la versatilidad de este modelo, ya que se pueden establecer chips que representan duodeno humano, yeyuno, íleon y colon siguiendo procedimientos similares de siembra y cultivo. Es importante destacar que los Chips Intestinales permiten la evaluación en tiempo real de: la integridad de la barrera intestinal; actividad del borde del cepillo y las enzimas del metabolismo de los medicamentos; producción de mucinas; secreción de citoquinas; e interacción de las células intestinales con microorganismos patógenos y comensales, como se demuestra en los informes publicados anteriormente. En particular, cuando se establecieron chips intestinales utilizando organoides generados a partir de tejido de diferentes individuos, estos modelos capturaron la variabilidad esperada entre donantes en las respuestas funcionales a diversos medicamentos y tratamientos. En conjunto, la fusión de organoides con la tecnología Organ-on-a-Chip abre la puerta a modelos más avanzados, personalizados e in vivo relevantes que podrían mejorar la relevancia fisiológica y la precisión de los hallazgos in vitro, así como su extrapolación a los humanos. Aquí, se presenta un protocolo detallado para establecer el chip intestinal y su aplicación en los estudios de funciones fisiológicas de los dos segmentos intestinales: duodeno y colon. En primer lugar, se describen los métodos para evaluar la actividad de la enzima metabolizadora de fármacos CYP3A4 en el chip duodeno, así como su inducción por compuestos prototípicos como la rifampicina y la vitamina D3. En segundo lugar, los pasos necesarios para modelar el "intestino permeable" en el chip de colon se describen en el protocolo, con la interrupción de la barrera epitelial que se realiza utilizando citoquinas distintivas implicadas en la patogénesis de la EII. Brevemente, los organoides derivados de biopsias humanas se propagan in vitro, se someten a digestión enzimática y se introducen en el canal superior del chip. En presencia de perfusión continua con medios enriquecidos con factor de crecimiento, se convierten en una monocapa epitelial confluente con arquitectura 3D y una superficie celular apical de fácil acceso. El compartimento inferior del chip "vascular" está sembrado con células endoteliales microvasculares aisladas del intestino delgado o grueso. El epitelio y el endotelio están separados por una membrana estirable porosa, que facilita las interacciones paracrinas entre los dos tejidos y, cuando se somete a deformaciones cíclicas, emula los movimientos similares a la peristalsis del intestino humano. El cocultivo se mantiene bajo las condiciones de flujo dinámico generado por la perfusión luminal y vascular con medios de cultivo celular apropiados. Finalmente, describimos numerosos tipos de ensayos y análisis de punto final que se pueden realizar directamente en chip o a partir de efluentes de cultivo celular muestreados.
Protocolo
NOTA: Todos los cultivos celulares deben manejarse utilizando una técnica aséptica adecuada.
Los organoides intestinales humanos empleados en este estudio se obtuvieron de la Universidad Johns Hopkins y todos los métodos se llevaron a cabo de acuerdo con las pautas y regulaciones aprobadas. Todos los protocolos experimentales fueron aprobados por la Junta de Revisión Institucional de la Universidad Johns Hopkins (IRB #NA 00038329).
1. Preparación de los reactivos de cultivo celular
- Prepare el medio de crecimiento de organoides humanos siguiendo las instrucciones del fabricante (Tabla de materiales) y suplementarlo con 100 μg / ml de primocina.
- Preparar el medio de crecimiento de células endoteliales microvasculares humanas siguiendo las instrucciones del fabricante (Tabla de materiales) y complementar con 1:20 vol/vol FBS y 50 μg/ml en lugar de 100 μg/ml de primocina.
- Resuspend Y-27632 (Rho-kinase Inhibitor) en BSA estéril al 0,1% en DPBS para preparar una solución madre de 10 mM. Alícuota en microtubos estériles y guárdela a -20 °C durante un máximo de 6 meses.
- Resuspend CHIR99021 (inhibidor de GSK-3) en dimetilsulfóxido estéril (DMSO) para preparar una solución madre de 5 mM. Alícuota en microtubos estériles y guárdela a -20 °C durante un máximo de 6 meses.
- Prepare la solución de digestión organoide humana mezclando una solución de disociación de organoides 1:1 vol/vol (Tabla de Materiales) con solución DPBS (Tabla de Materiales) y complementándola con una solución madre de 10 μM de Y-27632. Este reactivo debe hacerse fresco para cada uso.
2. Cultivo de células endoteliales microvasculares intestinales humanas (HIMEC)
- Iniciar el cultivo HIMEC (Tabla de Materiales) 7 días antes de sembrarlo en el chip. Solo los HIMEC en el pasaje 1-6 se pueden usar para la siembra de chips.
- Añadir 5 ml de la solución de factor de fijación (tabla de materiales) a un matraz T150; incubar a 37 °C durante 1 min y desechar la solución.
- Añadir al matraz 19 ml de medio de crecimiento de células endoteliales precalentado a temperatura ambiente (ver paso 1.2).
- Descongele un vial congelado de HIMEC (2 millones de células/vial) en un baño de agua a 37 °C.
- Transfiera el contenido del vial al matraz y meca suavemente el matraz para distribuir las células de manera uniforme. Coloque el matraz en una incubadora de 37 °C durante la noche para permitir que las células endoteliales se adhieran.
- Reemplace el medio con 20 ml de medio de crecimiento de células endoteliales precalentado a temperatura ambiente al día siguiente y cada 3 días a partir de entonces. Los cultivos deben alcanzar el 90% de la confluencia el día de la cosecha celular para los experimentos con chips.
3. Microfabricación y preparación del chip
- Obtener chips de un proveedor comercial (Tabla de Materiales). Desembala las virutas y colócalas en la cuna de las virutas colocada en una placa de Petri cuadrada (Tabla de Materiales). Etiquete la parte frontal de cada portador de chip con las condiciones experimentales (Figura 1A).
NOTA: Si bien el protocolo presentado se basa en el uso de un chip e instrumentación específicos disponibles comercialmente, hay varios dispositivos microfluídicos ofrecidos a través de diferentes proveedores, que pueden ofrecer ventajas alternativas pero carecen de la capacidad de incorporar estiramiento. Además, la microfabricación de los Órganos-en-Chips se puede realizar "in house" siguiendo los procedimientos descritos en Huh et al.21.
4. Activación y recubrimiento ECM de la membrana
- Preparación de la solución de activación
- Lleve los reactivos ER-1 y ER-2 (Tabla de Materiales) a temperatura ambiente para equilibrarlos antes de su uso. ER-1 es sensible a la luz y debe manejarse en la oscuridad.
- Reconstituir ER-1 en 10 ml de reactivo ER-2 para hacer una concentración final de 0,5 mg/ml y confirmar que el ER-1 está completamente disuelto.
- Activación de la superficie
- Empuje suavemente 50 μL de la solución ER-1 a través de ambos canales del chip (Figura 1A).
- Retire cualquier exceso de solución ER-1 de la superficie del chip con un aspirador.
- Inspeccione los chips para asegurarse de que todos los chips hayan recibido la solución ER-1. En caso de burbujas de aire, introduzca más solución ER-1 hasta que las burbujas se eliminen por completo.
- Incubar los chips dentro de la cámara de la lámpara UV (Tabla de Materiales) durante 15 min. Confirme que la lámpara UV está configurada en el ajuste Consistente.
- Lleve los chips activados por ER-1 de vuelta al gabinete de bioseguridad (BSC). Aspire la solución ER-1 desde ambos canales. Lavar cualquier residuo de la solución ER-1 con 200 μL de ER-2.
- Empuje 200 μL de solución salina tamponada con fosfato (DBPS) estéril de Dulbecco a través de los canales (Tabla de Materiales) y deje DBPS en los canales hasta el siguiente paso.
- Preparación de matriz extracelular (ECM) y recubrimiento de membrana
- Preparación de soluciones de stock de componentes ECM
- Reconstituir colágeno IV (Tabla de Materiales) y fibronectina (Tabla de Materiales) utilizando agua estéril de grado de cultivo celular (Tabla de Materiales) a una concentración final de 1 mg/ml. Preparar alícuotas y conservarlas a -20°C hasta su uso.
- Preparación de la solución de trabajo ECM para el recubrimiento de membranas
- Prepare 1,5 ml de cada solución de ECM para el canal superior e inferior por cada 12 chips que se recubrirán. La solución ECM siempre debe prepararse justo antes de su uso.
- Para el canal superior, mezcle colágeno IV y matriz de membrana basal solubilizada (BMM) (Tabla de Materiales) en DBPS frío estéril a 200 μg / ml y 100 μg / ml, respectivamente. Para el canal inferior, mezcle colágeno IV y fibronectina en DPBS frío estéril a 200 μg/mL y 30 μg/mL, respectivamente.
- Recubrimiento ECM de los chips
- Aspire el DBPS de ambos canales de los chips y reemplácelo con la solución de trabajo ECM adecuada para cada canal (Figura 1A).
- Inspeccione cada chip para asegurarse de que ha recibido la solución de recubrimiento. En caso de burbujas de aire, empuje a través de más solución de recubrimiento hasta que todas las burbujas se eliminen por completo.
- Agregue DPBS estériles a la base de virutas y coloque la placa de Petri que contiene las virutas en una incubadora de 37 °C. Incubar durante la noche para permitir que las proteínas ECM formen enlaces iónicos con la membrana PDMS activada. Si se desea, las células se pueden sembrar en cualquier momento entre 2 h y 1 día después del recubrimiento de las virutas. Alternativamente, los chips recubiertos se pueden almacenar a 4 ° C durante la noche, seguidos de la incubación durante la noche a 37 ° C y la siembra de chips.
- Preparación de soluciones de stock de componentes ECM
5. Siembra de células endoteliales microvasculares intestinales (HIMEC) en el canal inferior del chip
NOTA: Los HIMEC del intestino delgado y el colon se siembran en el canal inferior del duodeno y el chip de colon, respectivamente.
- Preparar fichas
- Transfiera los chips recubiertos de ECM al BSC. Aspire suavemente el recubrimiento ECM de ambos canales de los chips, y luego lave ambos canales con 200 μL de medio de crecimiento organoide y medio de crecimiento de células endoteliales, respectivamente.
- Guarde las virutas lavadas en una incubadora de 37 ° C hasta proceder con la siembra de células endoteliales.
- Cosechar las células endoteliales
- Lleve el matraz de cultivo HIMEC al BSC y lávelo con DPBS estéril.
- Agregue 3 ml de solución de disociación al matraz y colóquelo en la incubadora de 37 ° C durante 2 minutos para permitir el desprendimiento completo de la célula.
- Recolecte las células en un tubo cónico de 15 ml y agregue medios de crecimiento de células endoteliales hasta que alcance los 10 ml. Muestra 15-20 μL de la suspensión celular para el conteo celular. Centrifugadora a 150 x g durante 5 min.
- Aspire cuidadosamente el sobrenadante y vuelva a suspender los HIMEC a una densidad de 8-10 x 106 células / ml en medios de crecimiento de células endoteliales.
- Sembrar células endoteliales en el canal inferior del chip
- Lleve la placa de Petri que contiene los chips al BSC y retire suavemente todos los medios del canal inferior con una pipeta de 1.000 μL.
- Introducir 10-15 μL de la suspensión HIMEC en el canal inferior del chip. Inspeccione el chip inmediatamente después de la siembra para garantizar una densidad de siembra óptima (80% -90% de cobertura) y una distribución celular homogénea dentro del canal (Figura 1D). Si la densidad de siembra es mayor o menor de lo esperado o desigual, lave el canal 2x con 200 μL de medios de crecimiento de células endoteliales y repita el procedimiento de siembra.
- Invierta la placa de Petri inmediatamente después de sembrar cada lote de seis chips para permitir la unión de células endoteliales a la parte inferior de la membrana PDMS. Coloque las placas de Petri en la incubadora de 37 °C durante 30 minutos a 1 h, o hasta que los HIMEC en el canal inferior se hayan unido a la membrana (Figura 1D).
- Lavar las patatas fritas
- Empuje suavemente 200 μL de medios de crecimiento de células endoteliales a través de la entrada del canal inferior para eliminar las células no unidas y reponer los nutrientes en los medios.
- Lave las células que no se unieron en el canal superior con 200 μL de medio de crecimiento organoide suplementado con 5 μM CHIR99021 y 10 μM Y-27632.
- Coloque las virutas en la incubadora de 37 ° C hasta proceder a la siembra de células epiteliales.
6. Siembra de fragmentos organoides en el canal superior del chip
NOTA: Los organoides aislados de biopsias de varias regiones intestinales se pueden cultivar en el chip intestinal7. Seguir los procedimientos descritos en Fujii et al. para el aislamiento de criptas intestinales humanas y el establecimiento de cultivos de organoides22. Aquí, los organoides duodenales y colónicos se utilizan para generar los chips de duodeno y colon, respectivamente. Dada la alta variabilidad de lote a lote y de donante a donante en la formación y el crecimiento de organoides, se sugiere realizar una evaluación piloto de la densidad celular en el cultivo de suspensión de organoides (formato de placa de 24 pocillos) para lograr la densidad de siembra óptima de 8 millones de células / ml.
- Evaluación piloto del número de células/pozo del cultivo de organoides estáticos.
NOTA: El siguiente procedimiento es únicamente para determinar el número de pocillos de cultivo de suspensión de organoides requeridos para la siembra de virutas. Las células individuales resultantes no deben usarse para la siembra de chips.- Aspire cuidadosamente el sobrenadante de tres pocillos de la placa de cultivo de organoides. Agregue 500 μL de solución de disociación de BMM helada (Tabla de materiales) a cada pozo y use un raspador de plástico para separar el BMM solubilizado del plástico.
- Recoger la suspensión organoide en un tubo cónico estéril de baja unión a proteínas utilizando una pipeta helada de 1.000 μL. Incubar en hielo durante 60 min, mezclando cada 15 min agitando suavemente el tubo. Centrifugar a 300 x g durante 5 min a 4°C.
- Aspire el sobrenadante y agregue 2 ml de tripsina. Incubar a 37°C durante 30 min para digerir los organoides al nivel unicelular y añadir 10 mL de medio de crecimiento organoide completo para detener la reacción enzimática. Centrifugar a 300 x g durante 5 min a 4°C.
- Resuspender el pellet celular en 1 ml de medio de crecimiento organoide completo y contar el número total de células utilizando un hematocitómetro de acuerdo con los métodos estándar.
- Preparación de fragmentos organoides y su siembra en el chip
NOTA: Los siguientes procedimientos se pueden utilizar para sembrar organoides duodenales o colónicos en el canal superior del chip. El establecimiento de una monocapa epitelial con una citoarquitectura 3D relevante in vivo está supeditado a la presencia de flujo15,23 y a la siembra exitosa de fragmentos organoides.- Aspire cuidadosamente el medio a partir del número de pocillos del cultivo de organoides estáticos, que es suficiente, según lo determinado en el paso 6.1, para lograr una densidad de siembra final de 8 millones de células / ml. Agregue 500 μL de solución de disociación BMM helada a cada pozo.
- Separe el BMM solubilizado de la superficie de los pozos utilizando un raspador de plástico o una pipeta de 1.000 μL. Recoja la suspensión en un tubo cónico de baja unión a proteínas de 15 ml.
- Guarde la suspensión en hielo durante 60 minutos, mezclando cada 15 minutos agitando suavemente el tubo. Proceder a la centrifugación a 300 x g durante 5 min a 4°C. Un gránulo organoide bien definido debe ser visible después de la centrifugación. Si se observa una capa de gel transparente por encima del gránulo celular (residuos de BMM solubilizado) (Figura 1B), continúe con los siguientes pasos.
- Mezcle el sobrenadante y el gránulo celular y agregue un volumen igual de solución de disociación BMM en el tubo. Mezcle suavemente y almacene en hielo durante 10 minutos adicionales, y proceda a la centrifugación a 300 x g durante 5 minutos a 4 ° C.
- Si es necesario, repita el paso 6.2.3.1 hasta que no haya residuos de BMM solubilizados.
- Deseche el sobrenadante y vuelva a suspender el gránulo organoide con una solución de digestión organoide (ver paso 1.5). Utilice un volumen suficiente de solución de digestión organoide para asegurar la inmersión completa del pellet. 2 ml de solución es apropiado para aproximadamente 2.400-12.000 organoides de tamaño mediano (Figura 1D, Post-Siembra). Incubar a 37°C durante 1-3 min.
- Agregue DMEM/F-12 avanzado al tubo para detener la reacción enzimática. Use cuatro veces el volumen de la solución de digestión utilizada. Centrifugar a 300 x g durante 5 min a 4°C.
- Aspirar el sobrenadante y resuspendir los fragmentos organoides en un medio de crecimiento organoide completo suplementado con 5 μM CHIR99021 y 10 μM Y-27632 para lograr 8 millones de células/ml. Preparar alícuotas de 360 μL de la suspensión en tubos estériles de baja unión a proteínas de 1,5 ml para evitar la reducción de la densidad celular debido a la unión en las paredes.
- Retire el medio del canal superior de las virutas recubiertas. Añadir 30 μL de suspensión celular en el canal superior de cada chip. Incubar los chips durante la noche en una incubadora de 37 ° C para permitir que los fragmentos organoides se adhieran a la membrana recubierta de ECM (Figura 1D).
7. Cultivo dinámico de chip intestinal - iniciación y mantenimiento del flujo y movimientos similares a la peristalsis
- Preparación de medios y desgasificación
- Para mantener un flujo laminar constante a través del chip, permita que la temperatura del medio se equilibre a temperatura ambiente y luego sumérjala a filtración impulsada por vacío durante 10 minutos utilizando una bomba de vacío y tubos cónicos de filtro de PVDF (desgasificación de medios).
- Cebado de módulos portátiles
NOTA: Los módulos portátiles son reservorios que actúan como una interfaz entre los chips y el módulo de cultivo que permite repetir el muestreo y la dosificación de los medios.- Abra los módulos portátiles, en el BSC, y colóquelos en las bandejas de módulos de cultivo, que son contenedores especializados para la alineación de los módulos portátiles.
- Agregue 3 ml de medio de crecimiento organoide completo preequilibrado complementado con 5 μM CHIR99021 y 10 μM Y-27632 al reservorio de entrada superior y 3 ml de medio de crecimiento de células endoteliales preequilibrado en el reservorio de entrada inferior (Figura 1C). Añadir 300 μL del mismo medio en los respectivos depósitos de salida.
- Lleve las bandejas a la incubadora de 37°C y deslícelas en el módulo de cultivo (Figura 1C). Utilice los controles en la pantalla del módulo de cultivo para ejecutar el "Prime Cycle" (1 minuto de duración). Cuando la barra de estado indica "Listo", se completa el ciclo Prime. Repita el ciclo Prime para asegurarse de que se hayan formado suficientes gotas para conectar con éxito los chips.
- Asegúrese de que todos los módulos portátiles estén cebados y tengan gotas de medios visibles.
- Introducción del flujo
NOTA: El flujo generalmente se inicia 24 h después de sembrar fragmentos organoides para permitir que las células epiteliales intestinales se adhieran firmemente a la membrana.- Lave ambos canales de las virutas sembradas con 200 μL de los medios respectivos para eliminar cualquier burbuja o residuo celular. Deje pequeñas gotas de medios en los puertos después del lavado. Deslice el portador del chip en el módulo portátil (Figura 1C).
- Coloque los módulos portátiles en las bandejas y, a continuación, en el módulo de cultivo. Utilice los controles en la pantalla del módulo de cultivo para programar las condiciones de cultivo de chip de órganos apropiadas (caudal y estiramiento).
NOTA: Para condiciones estándar de cultivo de chip de duodeno y colon, establezca el caudal en 30 μL/h15 y 60 μL/h16 respectivamente, tanto para los canales superior como inferior. Sin embargo, los caudales de cada canal se controlan de forma independiente y se pueden ajustar entre 0-1.000 μL/h. Se pueden utilizar jeringas o bombas peristálticas, en lugar de los módulos de cultivo presentados aquí, para introducir el flujo laminar a los chips microfluídicos. Sin embargo, el establecimiento de conexiones fluidas confiables entre chips y bombas utilizando tubos y conectores puede ser técnicamente un desafío cuando se requiere la perfusión simultánea de múltiples chips. - Inicie el "Ciclo de Regulación" (2 h de duración) que presuriza los medios de cultivo en módulo portátil y chip para evitar la nucleación de las burbujas de aire. Las condiciones programadas se reanudarán después de la finalización del Ciclo de Regulación.
- Cambio de medios
- Prepare medios frescos para ambos canales y reponga cada 48 h agregando 2 ml de medio fresco a los depósitos de entrada (Figura 1C).
- Pausar los módulos de cultivo y llevar las bandejas a BSC. Aspirar medios en todos los reservorios y reponer con medios frescos. Vuelva a traer las bandejas y reinicie el flujo.
- Introducción del estiramiento
NOTA: Permita que las células crezcan hasta el 100% de confluencia antes de la aplicación de la cepa cíclica. El estiramiento se introduce típicamente 3 días después de la siembra o 48 h después del inicio del cultivo fluídico. La tensión cíclica al 2% a la frecuencia de 0.2 o 0.15 Hz, para el chip intestinal duodeno11 y colon24 , respectivamente, se aplica durante las 24 h iniciales. Luego se aumenta aún más al 10% durante la duración restante del cultivo de chips intestinales para parecerse mucho a la cepa cíclica experimentada por las células epiteliales intestinales in vivo (Figura 1D)25. El módulo de cultivo puede admitir la aplicación de una cepa cíclica del 2% al 12% y una frecuencia de hasta 0,4 Hz.- Para introducir el estiramiento en el cultivo fluídico en curso, detenga el módulo de cultivo. Con los controles de la pantalla, cambie la configuración de estiramiento al 2% de estiramiento, frecuencia de 0,2 o 0,15 Hz y reinicie el módulo de referencia cultural.
- Después de 24 h, repita el paso 7.5.1 para aplicar un estiramiento del 10%, 0.2 o 0.15 Hz de frecuencia.
8. Inducción de CYP450 utilizando inductores prototípicos de CYP en el chip de duodeno
NOTA: El ensayo de inducción del citocromo P450 (CYP450) permite evaluar si el compuesto de prueba aumenta los niveles de ARNm y/o la actividad catalítica de enzimas específicas del CYP450. Aquí, describimos el protocolo para la evaluación de la inducción de CYP3A4 por el estándar de la industria y el regulador recomendado in vitro inductores de CYP, rifampicina (RIF) y 1,2-dihidroxi vitamina D3 (VD3). El método presentado se puede utilizar para identificar el potencial de varios compuestos de prueba para inducir diferentes isoformas de CYP450 en el tejido intestinal humano. Se deberán seleccionar conjuntos específicos de cebadores y sustrato de sonda para cada isoforma enzimática que se evaluará.
- Exposición a inductores de CYP
- Prepare soluciones de stock de 20 mM RIF, 100 mM VD3 y 200 mM de testosterona (Tabla de materiales) utilizando DMSO estéril.
PRECAUCIÓN: La testosterona es una sustancia controlada de la Lista III. Siga los procedimientos reglamentarios durante el manejo. - Preparar medios dosificadores con inductores de CYP diluyendo las soluciones madre en medio de crecimiento organoide completo y medio de crecimiento de células endoteliales para lograr 20 μM RIF, 100 nmol/L de VD3. Preparar el control del vehículo diluyendo DMSO en los medios respectivos para lograr el 0.1% de DMSO.
- Pausa el módulo de cultivo y lleva las bandejas al BSC. Reemplace el medio en todos los depósitos de entrada con 2 ml de medios de dosificación con inductores o control del vehículo. Devuelva los módulos portátiles al módulo de cultivo y reinicie el flujo a 30 μL/h.
- Después de 24 h, reemplace el medio con solución inductora y repita los pasos 8.1.2-8.1.3. Las soluciones inductoras deben prepararse frescas diariamente y reponerse cada 24 h en el transcurso del experimento, que generalmente dura 48-72 h.
- Prepare soluciones de stock de 20 mM RIF, 100 mM VD3 y 200 mM de testosterona (Tabla de materiales) utilizando DMSO estéril.
- Incubación con un sustrato prototípico (testosterona)
- El día de la cosecha, prepare la solución de sustrato de sonda de testosterona junto con los inductores correspondientes en ADVANCED DMEM / F12 para obtener una concentración final de 200 μM. Omita la adición del suero al medio, ya que esto puede interferir con el análisis LCMS.
- Lleve las bandejas al BSC y aspire el medio de dosificación de todos los depósitos. Lave y reemplace los depósitos de entrada superior e inferior con medio avanzado AVANZADO /F12 caliente y medio de crecimiento de células endoteliales, respectivamente.
- Retire el medio de lavado de los depósitos y reemplácelo con 1 ml de solución de sustrato de sonda, preparada en la etapa 8.2.1. Perfundir las virutas a un alto caudal de 1.000 μL/h durante 5 min y aspirar los depósitos de salida superior e inferior. Devolver las virutas al módulo de cultivo e incubar durante 1 h bajo el flujo constante de 300 μL/h.
- Análisis de datos
- Recogida de muestras para análisis LCMS
- Alícuota 200 μL de solución de parada que contenga acetonitrilo con ácido fórmico al 0,1% en tubos de 1,5 ml premarcados y colóquelos sobre hielo. La composición de la solución de parada de LCMS puede variar según el sustrato que deba analizarse.
- Después de completar 1 h de tratamiento, detenga el flujo y lleve las bandejas de vuelta a BSC. Recoger 100 μL de efluente del depósito de salida superior y añadirlo al tubo correspondiente que contiene la solución de parada (Figura 2A). Coloque los tubos inmediatamente sobre hielo seco. Almacene las muestras a -80 °C antes de proceder al análisis.
- Extraiga y analice muestras mediante el uso de técnicas HPLC o LC-MS / MS, monitoreando la formación del metabolito-6β-hidroxitestosterona (6β-OH-T). La actividad de la enzima CYP se puede expresar como proteína pmol/min/mg donde pmol se refiere a la cantidad de metabolito (6β-OH-T) formado durante la reacción. El contenido total de proteína por chip (proteína; mg) se determina mediante la realización de un ensayo de Bradford descrito en el paso 8.3.2.

La actividad de plegado-inducción se calcula por: actividad CYP (inducida) / actividad CYP (vehículo). - Si se recogen muestras para el análisis de ARNm, consulte el paso 8.3.3.
- Lisis de las células para el análisis de la expresión de proteínas
NOTA: La extracción de proteínas de las células en chip se realiza utilizando un tampón de lisis de proteínas, complementado con inhibidores de proteasa y fosfatasa (Tabla de Materiales). La proteína extraída se cuantifica utilizando el ensayo de Bradford y se utiliza en el análisis aguas abajo.- Separe los chips de los módulos portátiles y colóquelos en una placa de Petri. Lave ambos canales con 200 μL de DPBS estéril.
- Bloquee la salida del canal inferior con una punta de pipeta de filtro de 200 μL. Perfundir 50 μL de la solución de disociación a través del canal inferior e incubar durante 2 min a temperatura ambiente.
- Inspeccione para confirmar el desprendimiento completo de las células endoteliales. Pipetear hacia arriba y hacia abajo 1-2 veces y retire la solución de disociación del canal. Repetir el lavado.
- Bloquee la salida del canal superior con una punta de pipeta de filtro de 200 μL. Perfuse 75 μL de tampón de lisis proteica a través del canal superior. Deje la punta de la pipeta insertada, para bloquear la entrada del canal superior e incubar durante 5 minutos a temperatura ambiente. Pipetee hacia arriba y hacia abajo 5-10 veces y recoja los lisados celulares en un tubo de 1.5 ml preetiquetado.
- Repita el paso 8.3.2.4. hasta que se observe el desprendimiento completo de las células. Recoger los lisados celulares en el mismo tubo de 1,5 ml y almacenarlos a -80 °C hasta su análisis.
- Extraiga la fracción de proteína de acuerdo con los métodos estándar y cuantifique la proteína total utilizando el ensayo bradford (Tabla de materiales).
- Lisis de las células para el análisis de expresión génica
NOTA: La lisis celular en chip para la extracción de ARN se puede lograr utilizando un tampón de lisis de ARN, complementado con 0.1% de 2-mercaptoetanol (Tabla de Materiales). Alternativamente, se puede utilizar un tampón de lisis de ARN a base de fenol si se requieren altos rendimientos de ARN de alta calidad adecuados para el análisis de NGS y microarrays.- Siga los pasos 8.3.2.1 a 8.3.2.2 para preparar el chip intestinal para la lisis.
- Bloquee la salida del canal superior con una punta de pipeta de filtro de 200 μL. Perfusa 150 μL de tampón de lisis de ARN a través del canal superior. Deje la punta de la pipeta insertada para bloquear la entrada del canal superior. Incubar durante 2 min a temperatura ambiente. Para la lisis utilizando un tampón de lisis de ARN basado en fenol, use 350 μL del reactivo.
- Pipete hacia arriba y hacia abajo 5-10 veces y recoja los lisados celulares en un tubo preetiquetado de 1.5 ml. Repita el paso con otros 150 μL de tampón de lisis de ARN y recoja. Conservar los lisados celulares a -80 °C hasta su análisis. En caso de análisis posterior de secuenciación de ARN, proceda con el análisis dentro de 1 mes después del lisado.
- Extraiga el ARN total de los lisados celulares utilizando un kit de purificación de ARN.
- Transcribir inversamente en ADNc utilizando un kit de transcriptasa inversa y realizar PCR en tiempo real utilizando un ciclador de PCR en tiempo real y los cebadores y búfer adecuados. Cuantificar los resultados utilizando el método 2-ΔΔCt .
- Recogida de muestras para análisis LCMS
9. Interrupción de la barrera epitelial usando citoquinas proinflamatorias en chip de colon
NOTA: Este protocolo describe la alteración de la barrera epitelial intestinal por la citoquina interferón gamma (IFNγ)26,27,28,29. La citoquina se dosifica en el canal inferior del chip de colon dada la expresión basolateral del receptor IFNγ en las células epiteliales intestinales. El estímulo proinflamatorio se introduce en el chip el día 5 del cultivo, tan pronto como laaplicación P se ha estabilizado por debajo de 0,5 x 10-6 cm / s. Se puede usar un régimen de dosificación similar para otras citoquinas proinflamatorias y agentes disruptivos de barrera.
- Estimulación con IFNγ
- Preparar una solución madre de 100 μg/ml de IFNγ (Tabla de Materiales) en agua de cultivo celular estéril. Almacene la solución madre a -80 °C en el transcurso del experimento. Para cada experimento, utilice siempre un caldo fresco de IFNγ y evite más de tres ciclos de congelación y descongelación.
- Preparar la solución dosificadora de IFNγ diluyendo la solución madre en medio de crecimiento de células endoteliales desgasificadas para lograr una concentración final de 10-100 ng/mL.
- Lleve las bandejas al BSC y retire el medio de los depósitos de entrada del canal inferior y reemplácelo con 3 ml del medio que contiene IFNγ. Actualice el medio de dosificación ifnγ diariamente.
- Coloque las bandejas en el módulo de cultivo y perfunda las virutas a un alto caudal de 1.000 μL/h durante 5 min para iniciar el tratamiento con IFNγ. Vuelva a cambiar el caudal a 60 μL/h y continúe con el cultivo fluídico.
- Análisis de datos
- Evaluación de la función de barrera epitelial. La permeabilidad aparente epitelial (Papp), o función de barrera, se puede medir en varios puntos temporales del cultivo después del tratamiento con IFNγ, en los medios de efluentes de los depósitos de entrada y salida de ambos canales. El trazador fluorescente debe agregarse al medio de crecimiento organoide del canal superior 4 h antes de la evaluación de laaplicación P. Por lo general, 3 kDa Dextran Cascade Blue se utiliza como trazador fluorescente y se agrega en el medio 24 h antes.
- Pausa el módulo de cultivo y lleva las bandejas al BSC.
- Etiquete y prepare una placa de paredes negras de 96 pocillos con 100 μL de DPBS por pozo. Utilizando una pipeta multicanal de 200 μL, recoger y añadir 50 μL de efluente de todos los embalses a los pozos respectivos (Figura 2B).
- Para preparar la curva estándar, diluya el medio que contiene 100 μg/mL de dextrano Cascade Blue 1:3 de 3 kDa en DPBS. Posteriormente realizar diluciones seriadas utilizando una dilución triple del medio de crecimiento de células endoteliales en DPBS.
- Lea la fluorescencia a 375 nm de excitación y 420 nm de emisión utilizando un lector de placas. Utilice los valores de OD medidos para calcular la permeabilidad aparente (aplicación P) de la siguiente manera:
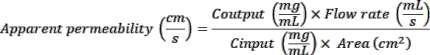
- Tinción de inmunofluorescencia de células en chip
- Lavar con 200 μL de DPBS para cada canal, tres veces.
- Perfundir 200 μL de la solución fijadora (4% PFA en DPBS) en cada canal. Incubar durante 15 min a temperatura ambiente.
- Repita el paso de lavado 9.2.2.1. En esta etapa, las virutas lavadas se pueden almacenar hasta por 7 días a 4 ° C.
- Permeabilizar las células utilizando 200 μL de solución de permeabilización (0,1% Triton-X 100 en suero de burro normal al 10% en DPBS) para cada canal. Incubar durante 30 min a temperatura ambiente. Repita el paso de lavado 9.2.2.1.
- Bloquee las células en el chip utilizando 200 μL de solución de bloqueo (10% NDS en DPBS) para cada canal. Incubar durante 1 h a temperatura ambiente.
- Diluir los anticuerpos primarios en solución de anticuerpos (5% NDS en DPBS) de la siguiente manera: anti-Zonula Occludens 1 (ZO-1) (1:100, marcador de unión estrecha epitelial), anti-Ocludina (1:100, marcador de unión estrecha epitelial), anti-Claudina 4 (1:100, marcador de unión estrecha epitelial), anti-E-cadherina (1:100, marcador de uniones adherentes epiteliales (Tabla de Materiales). Perfundir 200 μL de la solución primaria de anticuerpos a través de cada canal e incubar durante la noche a 4 °C. Repita el paso de lavado 9.2.2.1.
- Diluir los anticuerpos secundarios en solución de anticuerpos (1:300, NDS al 5% en DPBS). Perfundir 200 μL de esta solución a través de cada canal e incubar durante 2 h a temperatura ambiente. Repita el paso de lavado 9.2.2.1. Si se desea, se puede agregar faloidina, un marcador citoesquelético, a la solución secundaria de anticuerpos.
- Preparar una solución de 50 μg/ml de 4′,6-diamidino-2-fenilindol (DAPI) en DPBS y utilizarla para perfundir 200 μL a través de cada canal. Incubar a temperatura ambiente durante 15 min. Repita el paso de lavado. En este punto, las virutas teñidas se pueden almacenar hasta 14 días a 4 ° C.
- Evaluación de la escisión de Caspasa 3
- Aislar y cuantificar la cantidad total de proteína de las células epiteliales como se describe en el paso 8.3.2. Omita el paso de lavado 8.3.2.1. Diluir las muestras con DPBS a una concentración final de 400 μg/ml.
- Cuantificar los niveles de caspasa 3 total y escindida utilizando el kit de detección de caspasa 3 siguiendo el protocolo del fabricante.
- Evaluación de la secreción de citoquinas proinflamatorias
- Utilice los efluentes recogidos de la salida de ambos canales del chip de colon para cuantificar las citoquinas proinflamatorias de fase aguda secretadas, siguiendo los protocolos proporcionados por el fabricante. Realice una dilución de 5 veces para V-PLEX Vascular Injury Panel 2 Human Kit y una dilución doble para V-PLEX Human Proinflammatory Panel II.
- Evaluación de la función de barrera epitelial. La permeabilidad aparente epitelial (Papp), o función de barrera, se puede medir en varios puntos temporales del cultivo después del tratamiento con IFNγ, en los medios de efluentes de los depósitos de entrada y salida de ambos canales. El trazador fluorescente debe agregarse al medio de crecimiento organoide del canal superior 4 h antes de la evaluación de laaplicación P. Por lo general, 3 kDa Dextran Cascade Blue se utiliza como trazador fluorescente y se agrega en el medio 24 h antes.
Resultados
La Figura 1D resume la línea de tiempo del cultivo de chips intestinales e ilustra las células endoteliales intestinales y los organoides antes y después de la siembra en el chip. Además, demuestra las diferencias morfológicas distintivas entre las virutas de duodeno y colon, destacadas por la presencia de formaciones similares a vellosidades en la vilipruta de duodeno y representativas de la arquitectura del intestino delgado.
La Figura 3A, B demuestra las respuestas de inducción de CYP3A4 en el chip de duodeno de tres donantes de organoides diferentes. Los chips se expusieron a 20 μM RIF o 100 nM VD3 durante 48 h y se utilizaron para evaluar los niveles de ARNm (A) y/o la actividad catalítica del pliegue (B) de la enzima CYP450. Se observó un aumento de los niveles de metabolito de testosterona, 6β-hidroxitestosterona (6β-OH-T), consistente con la expresión elevada del gen CYP3A4 mRNA en el chip duodeno expuesto a RIF y VD3, lo que indica respuestas de inducción apropiadas en los tres donantes probados. Se muestran las medias ± SEM de n = 3 chips biológicamente independientes.
La Figura 4 muestra los resultados representativos para el modelado del síndrome del intestino permeable en el chip de colon, incluidos (A, C) cambios en la morfología de las células epiteliales y la integridad de la unión estrecha, (B) disminución de la función de barrera, (D) inducción de apoptosis y (E) aumento de la secreción de citoquinas en respuesta al tratamiento con IFNγ.
La Figura 4A muestra imágenes representativas de campo brillante de la monocapa epitelial controlada y tratada con IFNγ (50 ng/mL, 48 h) de la viruta de colon. Las virutas se retiraron del módulo de cultivo y la morfología epitelial se evaluó diariamente bajo el microscopio. Las imágenes se adquirieron utilizando un microscopio de campo brillante y un objetivo 10x. Las astillas de colon tratadas con IFNγ muestran una morfología celular comprometida y pérdida del epitelio columnar.
La Figura 4B demuestra un resultado representativo del ensayo de permeabilidad aparente realizado en chips de colon cultivados en condiciones basales o tras la estimulación con IFNγ. Se agregó un trazador Dextran Cascade Blue de 3 kDa al depósito del canal superior a una concentración final de 100 μg / ml. El IFNγ a una concentración final de 50 ng/ml se dosificó en el canal inferior el día 5 del cultivo. Las virutas se perfundieron a 60 ml/h. A continuación, los medios se recogieron diariamente (hasta el día 72 h después de la exposición) de los depósitos de entrada y salida de los canales superior e inferior. Se recogieron 50 μL de cada muestra, se procesaron como se describe en la etapa 9.2.1 del protocolo y se examinaron para detectar fluorescencia a 375-420 nm utilizando un lector de placas. Se observó un aumento significativo de la permeabilidad paracelular epitelial después de 48 h de estimulación con IFNγ.
La Figura 4C muestra imágenes inmunofluorescentes representativas de las uniones epiteliales estrechas (Zonula Occludens 1 - ZO-1, Occludin, Claudin-4) y adherens (E-cadherin) en control y chip de colon tratado con IFNγ (50 ng/ mL, 48 h). Los chips se fijaron con paraformaldehído al 4% (PFA) durante 15 minutos a temperatura ambiente y se procesaron posteriormente como se describe en el paso 9.2.2 del protocolo. Las imágenes se adquirieron utilizando un microscopio confocal y un objetivo de larga distancia 20x y se procesaron utilizando la versión 2.0 de Fiji de acuerdo con los protocolos estándar. El tratamiento con IFNγ desencadena el desplazamiento de ZO-1 y Claudina-4 y la internalización de Ocludina y E-cadherina, como lo demuestra el aumento de la señal citoplasmática.
La Figura 4D representa el curso temporal de la escisión de Caspasa 3 en el chip de colon en respuesta a 50 ng/mL de IFNγ indicativo de activación de la apoptosis. Las células epiteliales se lisaron en los chips y las muestras de proteínas se purificaron de acuerdo con los métodos estándar. El contenido intracelular de la Caspasa 3 total y escindida se midió como se describe en el paso 9.2.3 del protocolo. IFNγ induce la activación de la apoptosis, como se describió anteriormente29, en las células epiteliales colónicas cultivadas en el chip, después de 48 h de estimulación.
La Figura 4E muestra el curso temporal de la secreción de la citoquina del chip de colon tras la estimulación con 50 ng/mL IFNγ. Se recogieron diariamente 200 μL de medios de efluentes de los depósitos de salida de los canales superior e inferior. Las muestras de efluentes se almacenaron a -80 °C y 24 h antes de que el análisis se descongelara durante la noche a 4 °C. Los niveles de citoquinas en los medios de cultivo del chip se evaluaron utilizando la tecnología Meso Scale Discovery como se describe en el paso 9.2.4 del protocolo. El IFNγ indujo una secreción polarizada de moléculas proinflamatorias en el chip de colon, como lo demuestra la secreción basolateral de la Proteína de Adhesión Celular Vascular 1 (VCAM-1) y la Interleucina 6 (IL-6) y la secreción apical de la Molécula de Adhesión Intercelular 1 (ICAM-1) y la Proteína Amiloide Sérica (SAA). Los niveles séricos de las formas solubles de VCAM-1, ICAM-1, IL-6 y SAA se utilizan en laboratorios clínicos como indicador de inflamación30,31.
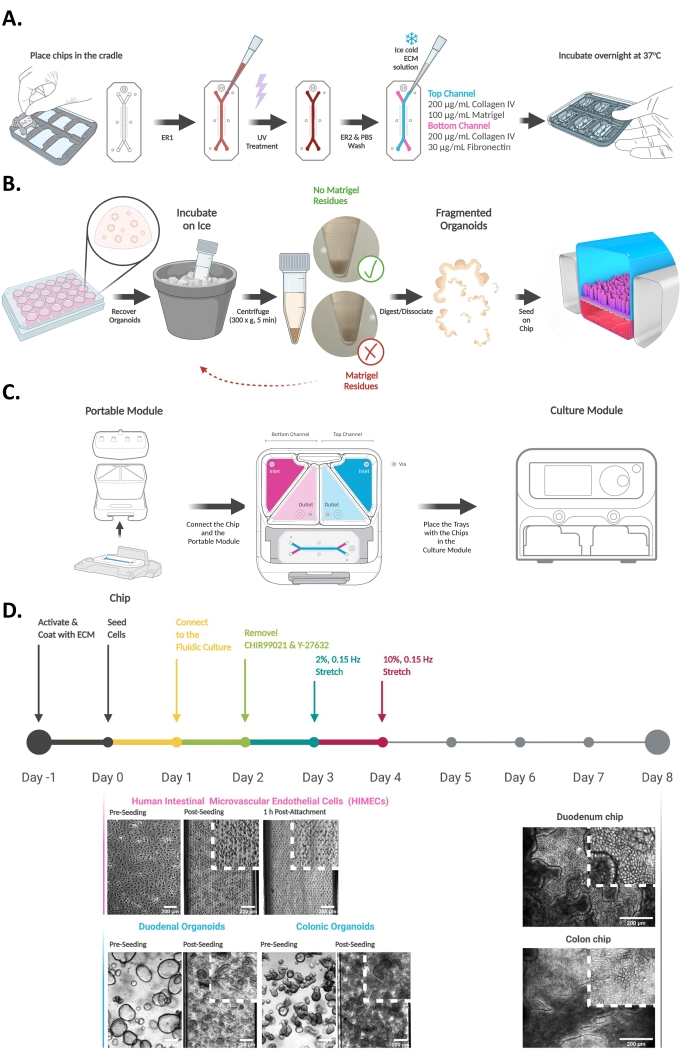
Figura 1: Establecimiento del chip intestinal15,16. (A) Esquema de la activación y recubrimiento del chip. Brevemente, los chips se colocan en una base de chip, perfundidos con solución ER1 y activados bajo luz UV. A continuación, los chips se lavan con ER2 y DPBS. Finalmente, las virutas se recubren con una solución de ECM helada, específica para cada tipo de célula, y se incuban durante la noche a 37 ° C. (B) Esquema que representa el proceso de introducción de organoides en el chip. Los organoides se transfieren de la placa de 24 pocillos a un tubo cónico y se incuban en hielo en presencia de la solución de disociación BMM para recuperar organoides del BMM solubilizado. La suspensión organoide se centrifuga y se evalúa la presencia de residuos de BMM solubilizados. Si una capa transparente de BMM todavía es visible sobre el pellet celular, el proceso debe repetirse. Si se observa un pellet bien definido sin residuos de gel visibles, los organoides se disocian enzimáticamente y se introducen en el canal superior (azul) del chip. El canal inferior (magenta) del chip se siembra con células endoteliales microvasculares específicas del tejido. (C) Esquema que muestra la conexión de los chips al módulo de cultivo, que admite el flujo de medios y el estiramiento similar a la peristalsis cíclica. El ciclo de cebado permite la generación de gotas del medio de cultivo celular sobre los puertos del chip y al final de las resistencias del módulo portátil. Esto asegura la creación de la interfaz líquido-líquido entre el chip y el módulo portátil, facilitando el deslizamiento del chip en el módulo y su conexión segura. Por último, los módulos portátiles se colocan en bandejas y las bandejas se insertan en el módulo de cultivo. (D) Cronología experimental que destaca los principales pasos para el establecimiento de la plataforma de chips intestinales derivados de biopsias, incluidos el duodeno y el chip de colon. Las imágenes de campo brillante ilustran las células endoteliales y derivadas de organoides en el día 0, antes y después de la siembra en el chip, así como la formación de tejido epitelial confluente y 3D en el día 8 del cultivo con chip. Haga clic aquí para ver una versión más grande de esta figura.
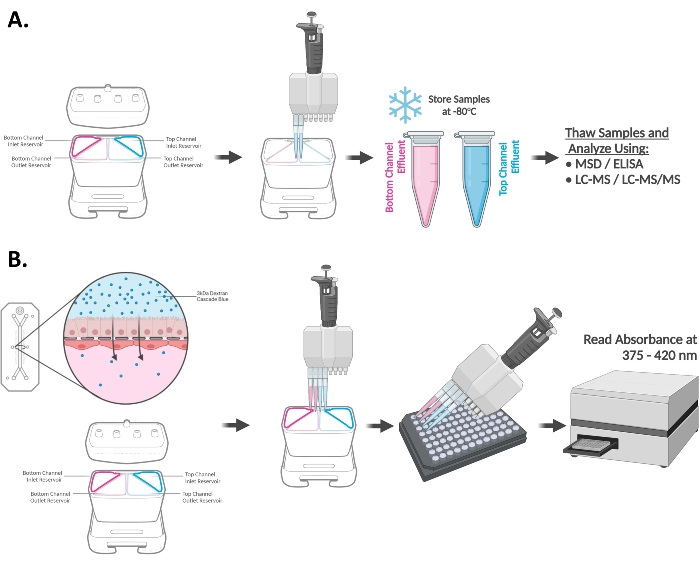
Figura 2: Colección de medios de efluentes del chip intestinal. (A) Esquema que representa la recolección de efluentes de medios del módulo portátil. Los medios se recogen de los depósitos de salida del canal superior e inferior y se almacenan a -80 °C hasta un nuevo análisis ELISA o LC-MS / LC-MS / MS. (B) Esquema que muestra la recolección de muestras de efluentes utilizando una pipeta multicanal y su transferencia a una placa de paredes negras de 96 pocillos para la evaluación aguas abajo de la permeabilidad aparente epitelial (P app). Haga clic aquí para ver una versión más grande de esta figura.
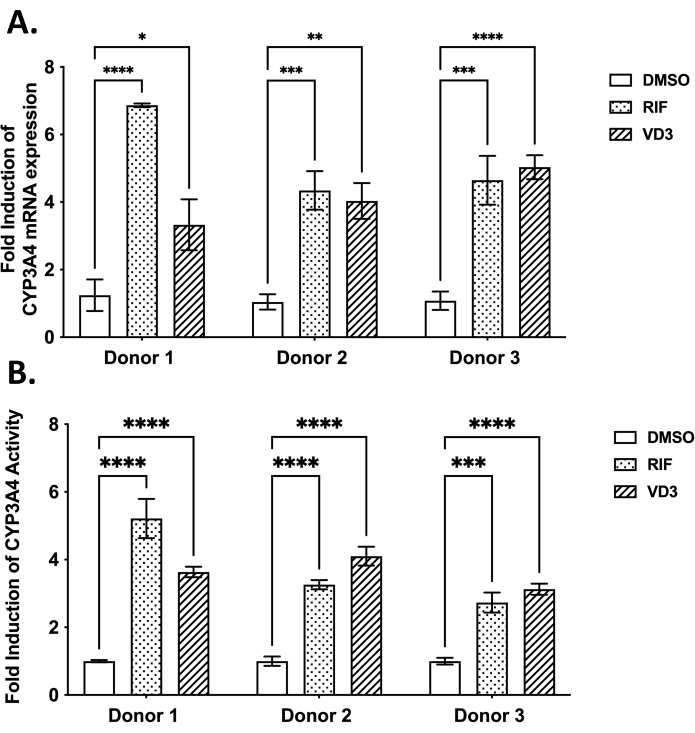
Figura 3: Inducción de CYP3A4 en el chip de duodeno15. (A) Inducción de los niveles de ARNm de CYP3A4 en chip de duodeno por exposición de 48 h a 20 μM de RIF y 100 nM VD3. Media ± SEM, N = 3 chips/condición/donante, ANOVA bidireccional, prueba post hoc de Tukey, ****p < 0,0001 (comparado entre los controles DMSO). (B) Inducción de la actividad del CYP3A4 en el chip duodeno expuesto a inductores prototípicos evaluados por la cuantificación LC-MS/MS del metabolito del sustrato de la sonda: 6β-hidroxitestosterona. Se observó un aumento significativo en la actividad del CYP3A4 en el chip duodeno tratado con 20 μM RIF o 100 nM VD3 durante 48 h. Media ± SEM, N = 3 chips/condición/donante, ANOVA bidireccional, prueba post hoc de Tukey, ****p < 0.0001. Haga clic aquí para ver una versión más grande de esta figura.
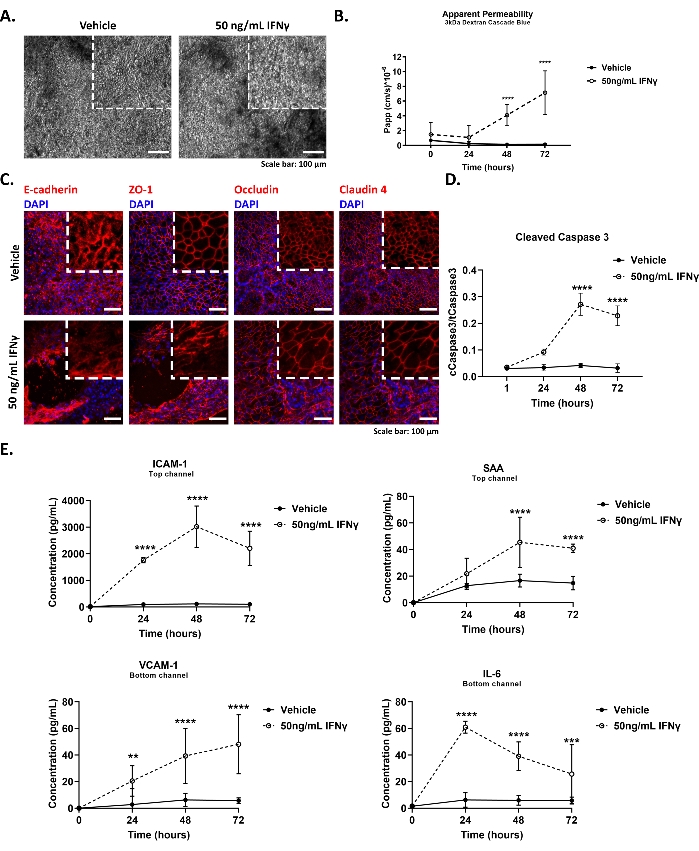
Figura 4: Interrupción de la barrera epitelial en el chip de colon utilizando IFNγ16. (A) Imágenes de campo brillante que muestran la morfología de las células epiteliales en condiciones basales y tras la estimulación con 50 ng/mL IFNγ durante 48 h. Barra de escala: 100 μm. (B) Permeabilidad aparente de la barrera epitelial a 3 kDa Dextrano en el transcurso de una estimulación de 72 h con 50 ng/mL de IFNγ. Promedio ± IC del 95%, N = 5-9 chips/condición, ANOVA bidireccional, prueba post hoc de Tukey, ****p < 0.0001. (C) Imágenes de inmunofluorescencia que representan la interrupción de las uniones epiteliales estrechas y adheridas tras la estimulación con 50 ng/ ml de IFNγ durante 48 h. Zonula Occludens 1 (ZO-1) (rojo) uniones estrechas, E-cadherina (rojo) se adhiere a las uniones, ocludina (rojo) uniones estrechas, claudin-4 (rojo) uniones estrechas, núcleos 4′,6-diamidino-2-fenilindole (DAPI) (azul). Barra de escala: 50 μm. (D) Inducción de la escisión de caspasa 3 en chip de colon mediante el tratamiento con 50 ng/mL de IFNγ. Se evaluaron cuatro puntos de tiempo diferentes a lo largo de 72 h de exposición. Promedio ± IC del 95%, N = 3-6 chips / condición, ANOVA bidireccional, prueba post hoc de Tukey, ****p < 0.0001. (E) Aumento de la secreción de citoquinas: Proteína 1 de Adhesión Celular Vascular (VCAM-1) e Interleucina 6 (IL-6), en el canal inferior, y Molécula de Adhesión Intercelular 1 (ICAM-1) y Proteína Amiloide Sérica A (SAA) en el medio efluente del canal superior, en el transcurso de una estimulación de 72 h del chip de colon con 50 ng/ mL de IFNγ. Promedio ± IC del 95%, N = 3 chips/condición, ANOVA bidireccional, prueba post hoc de Tukey, *: p < 0,05, **: p < 0,01, ***: p < 0,001, ****p < 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La combinación de la tecnología de órganos en un chip y los organoides intestinales es prometedora para el modelado preciso de la fisiología intestinal humana y la fisiopatología. Aquí, proporcionamos un protocolo paso a paso simple y robusto (descrito en la Figura 1) para el establecimiento del chip intestinal que contiene epitelio intestinal delgado o colónico derivado de la biopsia y células endoteliales microvasculares intestinales cocultivadas en un dispositivo microfluídico. Esta simulación basada en chips del intestino humano incorpora flujo fisiológico, luminal y vascular y movimientos similares a la peristalsis. Además, describimos procedimientos para la evaluación de funciones intestinales críticas, como el metabolismo de los fármacos en el chip de duodeno y la función de barrera en el chip de colon.
Para recapitular las interacciones celulares epiteliales-endoteliales, que son esenciales para el mantenimiento de la homeostasis intestinal y, por lo tanto, el modelado preciso del tejido intestinal en chip, es fundamental establecer monocapas celulares funcionales e intactas a ambos lados de la membrana PDMS. El primer paso hacia la siembra exitosa del chip es la activación química de la superficie PDMS que permite el desarrollo de un enlace estable entre la superficie PDMS y las proteínas ECM. La activación inadecuada puede dificultar la unión de las células y dar lugar a la formación de monocapas celulares incompletas. La solución de activación debe prepararse fresca, ya que es sensible a la luz y propensa a la degradación. Durante la activación UV y el posterior recubrimiento ECM, es importante garantizar una distribución uniforme de los reactivos dentro de cada canal. La composición específica y la concentración de las soluciones utilizadas para recubrir los canales superior e inferior se han optimizado para adaptarse a las necesidades de las células epiteliales y endoteliales, respectivamente. Si se requieren cambios en la composición celular del chip intestinal, es posible que las condiciones de ECM deban volver a optimizarse para lograr resultados óptimos.
Después del recubrimiento ECM, es importante sembrar HIMEC a alta densidad de siembra celular (8 x 106 células/ml) para obtener una monocapa completa y homogénea en la parte inferior de la membrana PDMS. Si no se está logrando la confluencia celular completa, la confluencia, se recomienda aumentar aún más la densidad de la suspensión de células endoteliales durante la siembra o retrasar la siembra de fragmentos organoides en el canal superior del chip hasta que los HIMEC se vuelvan completamente confluentes. El uso de organoides fragmentados, en lugar de la suspensión de células individuales obtenidas a través de la digestión enzimática de organoides, se demostró previamente para mejorar el éxito y la reproducibilidad de la formación de monocapa intestinal dentro del chip intestinal14. Por lo tanto, se recomienda encarecidamente monitorear de cerca el proceso de digestión de organoides para garantizar el momento óptimo de incubación con la enzima, lo que resulta en fragmentos de organoides compuestos de alrededor de 10-30 células (40-100 μm de tamaño). La disociación inadecuada puede resultar en la reforma de la estructura organoide quística en los chips microfluídicos en lugar de la monocapa deseada. Además, es fundamental evitar la disociación excesiva de organoides en células individuales que podría conducir a una disminución de la supervivencia celular, la recuperación y la falta de formación de monocapa confluente dentro del chip.
Se ha demostrado que la incorporación de flujo fluido (esfuerzo cortante) y tensión cíclica en el cultivo de virutas intestinales, apoyada mediante el módulo de cultivo, mejora la formación de la barrera intestinal funcional y promueve el desarrollo espontáneo de la arquitectura 3D del tejido epitelial13. Sin embargo, al realizar experimentos microfluídicos con el uso de Organs-on-Chips, es fundamental precalentar y desgasificar los medios de cultivo celular antes de su uso para evitar la formación de microburbujas en los canales que podrían provocar estrés celular o incluso el desprendimiento de la membrana.
Además de las aplicaciones específicas que se muestran aquí, el modelo de chip intestinal se puede utilizar para abordar una variedad de preguntas científicas, desde la ciencia básica hasta el descubrimiento y la prueba de nuevos medicamentos o tecnologías de administración de medicamentos. Puede facilitar los estudios del desarrollo intestinal humano, la maduración de las células madre y la función de las células epiteliales; particularmente en el contexto de la evaluación del papel de la mecánica en el crecimiento y la homeostasis del tejido intestinal. Descubrimientos recientes revelaron que el equilibrio dinámico del epitelio intestinal sano se basa en su capacidad para coordinar con precisión varias fuerzas que definen la arquitectura cripta-vellosidad, compartimentar los tipos de células, dirigir la migración celular y regular la identidad celular, la proliferación y la muerte en el espacio y el tiempo32. El chip intestinal brinda la oportunidad de dilucidar mejor la interacción entre las fuerzas mecánicas (por ejemplo, tensión o tensión cortante), el destino celular y la función para responder algunas de las muchas preguntas fascinantes que permanecen en el campo emergente de la mecanobiología intestinal. Además, puede permitir estudios de procesos de detección y transporte intestinal, gracias a la presencia de células enteroendocrinas secretoras de hormonas y a la correcta localización de diversos transportadores de nutrientes15,16. El modelo de chip intestinal también se puede modificar para incorporar células inmunes, así como microorganismos comensales o patógenos para estudios sobre trastornos inflamatorios intestinales, interacciones huésped-patógeno y huésped-microbioma, así como para predecir con precisión las toxicidades fuera del objetivo de los productos inmuno-oncológicos, como se mostró anteriormente 17,20,33,34,35.
Además, el uso de muestras de biopsia clínica de individuos con características genotípicas y fenotípicas específicas puede permitir el análisis de los mecanismos de la enfermedad específica del paciente, así como la respuesta a las terapias, lo que ayuda a avanzar en la medicina personalizada en el futuro.
La principal limitación de este método es que se requieren fragmentos de un gran número de organoides (~ 60-80) para formar un epitelio intestinal confluente en cada chip. Esto se debe a que los fragmentos organoides requieren una siembra de alta densidad para garantizar que un número adecuado de células madre intestinales estén presentes para apoyar la expansión proliferativa de la monocapa y el establecimiento de una arquitectura de tejido 3D. Un epitelio intestinal completamente diferenciado en un chip posee todos los principales tipos de células epiteliales intestinales (enterocitos absorbentes, células de Paneth, células caliciformes y células enteroendocrinas) y un perfil transcripcional muy parecido al de la contraparte in vivo . Sin embargo, el modelo actual todavía carece de otros componentes importantes del intestino vivo, incluidos los fibroblastos intestinales, las células inmunes residentes (por ejemplo, macrófagos, linfocitos intraepiteliales y células dendríticas) y el sistema nervioso entérico.
Si bien estos son inconvenientes potenciales, estudios anteriores han demostrado que el poder del enfoque de la tecnología Organ-on-a-Chip radica en su capacidad para emular la complejidad estructural y funcional de los órganos humanos mediante la integración progresiva de varios componentes de los tejidos in vivo y su microambiente uno por uno36,37. Este enfoque de biología sintética para la ingeniería de tejidos in vitro proporciona una forma de estudiar la contribución de los componentes celulares y moleculares individuales a las respuestas fisiológicas y fisiopatológicas a nivel de órganos en diferentes niveles de complejidad del sistema. Además, permite que el análisis bioquímico, genético y microscópico de los tejidos que interactúan se realice individualmente y en tiempo real, obteniendo información sobre cómo las señales intercelulares y las interacciones tejido-tejido contribuyen a comportamientos específicos a nivel de órganos. Otra característica notable de la tecnología de chips intestinales es la versatilidad. El control preciso sobre los elementos microambientales permite ajustar los caudales de los medios y los parámetros de deformación para reproducir las fuerzas naturales experimentadas por las células del cuerpo humano, como el esfuerzo cortante detectado por las células endoteliales expuestas al flujo sanguíneo y los movimientos peristálticos cíclicos del tejido intestinal. Además, la ingeniería sinérgica de organoides y órganos en chips permite la creación de órganos vascularizados en chips que representan varias regiones de tejidos intestinales que podrían estar fluidamente vinculadas entre sí para estudiar las interacciones fisiológicas entre los intestinos delgado y grueso. Por lo tanto, creemos que el chip intestinal representa un modelo superior del epitelio intestinal y podría ayudar a implementar el principio 3R (Reducción, Refinamiento y Reemplazo) en la ciencia básica, así como en la configuración preclínica y regulatoria.
Divulgaciones
Gauri Kulkarni, Athanasia Apostolou, Lorna Ewart, Carolina Lucchesi y Magdalena Kasendra son empleadas actuales o anteriores de Emulate Inc. y pueden tener acciones. Emulate Inc. es la compañía que fabrica los dispositivos de chips de órganos y ha publicado patentes relevantes para el trabajo establecido en este artículo.
Agradecimientos
Agradecemos al profesor Mark Donowitz por proporcionar los organoides derivados de la biopsia intestinal y a Brett Clair por diseñar las ilustraciones científicas del chip, el módulo portátil y de cultivo. Todo el resto de las ilustraciones científicas se generaron utilizando el BioRender.
Materiales
| Name | Company | Catalog Number | Comments |
| small intestine Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE15 | 0.5 cells M/ml ; cryopreserved |
| colon Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE16 | 0.5 cells M/ml ; cryopreserved |
| Biopsy-derived Human Duodenal Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Biopsy-derived Human Colonic Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Zoë CM-1™ Culture Module | Emulate Inc. | - | Culture module |
| Orb-HM1™ Hub Module | Emulate Inc. | - | 5% CO2, vacuum stretch, and power supply |
| Chip-S1™ Stretchable Chip | Emulate Inc. | - | Organ-Chip |
| Pod™ Portable Modules | Emulate Inc. | - | Portable module |
| UV Light Box | Emulate Inc. | - | - |
| Chip Cradle | Emulate Inc. | - | 1 per square culture dish |
| Steriflip®-HV Filters | EMD Millipore | SE1M003M00 | 0.45 μm PVDF filter |
| Square Cell Culture Dish (120 x 120 mm) | VWR | 82051-068 | - |
| Handheld vacuum aspirator | Corning | 4930 | - |
| Aspirating pipettes | Corning / Falcon | 357558 | 2 mL, polystyrene, individually wrapped |
| Aspirating tips | - | Sterile (autoclaved) | |
| Serological pipettes | - | 2 mL, 5 mL, 10 mL, and 25 mL low endotoxin, sterile | |
| Pipette | P20, P200, P1000 and standard multichannel | ||
| Pipette tips | P20, P200, and P1000. | ||
| Conical tubes (Protein LoBind® Tubes) | Eppendorf | 0030122216; 0030122240 | 15 mL, 50 mL tubes |
| Eppendorf Tubes® lo-bind | Eppendorf | 022431081 | 1.5 mL tubes |
| 96 wells black walled plate | - | - | for epithelial permeability analysis |
| Microscope (with camera) | - | - | For bright-field imaging |
| Water bath (or beads) | - | - | Set to 37°C |
| Vacuum set-up | - | - | Minimum pressure: -70 kPa |
| Cell scrapers | Biotium | 220033 | |
| T75 flasks | BD Falcon | 353136 | Cell culture flask |
| Emulate Reagent-1 (ER-1) | Emulate Inc. | - | Chip coating solution |
| Emulate Reagent-2 (ER-2) | Emulate Inc. | - | Chip coating solution |
| Dulbecco’s PBS (DPBS) | Corning | 21-031-CV | 1X |
| Cell Culture Grade Water | Corning | MT25055CV | |
| Trypan blue | Sigma | 93595 | For cell counting |
| TryplE Express | ThermoFisher Scientific | 12604013 | Organoids dissociation and endothelium cells detachment solution |
| Advanced DMEM/F12 | ThermoFisher Scientific | 12634028 | Medium |
| IntestiCult™ Organoid Growth Medium (Human) | Stem Cell technologies | 06010 | Organoid Growth Medium |
| Endothelial Cell Growth Medium MV 2 | Promocell | C-22121 | Endothelial medium |
| Fetal bovine serum (FBS) | Sigma | F4135 | Serum |
| Primocin™ | InvivoGen | ANT-PM-1 | antimicrobial agent |
| Attachment Factor™ | Cell Systems | 4Z0-210 | coating solution for flask |
| Matrigel - Growth Factor Reduced | Corning | 356231 | Solubilized basement membrane matrix |
| Collagen IV | Sigma | C5533 | ECM component |
| Fibronectin | Corning | 356008 | ECM component |
| Y-27632 | Stem Cell technologies | 72304 | organoid media supplement |
| CHIR99021 | Reprocell | 04-0004-10 | organoid media supplement |
| Cell Recovery Solution | Corning | 354253 | Basement mebrane matrix dissociationsolution |
| Bovine Serum Albumin (BSA) | Sigma | A9576 | 30%, Sterile |
| Cell Culture Grade Water | Corning | MT25055CV | Sterile, Water |
| DMSO | Sigma | D2650 | solvent |
| 3KDa Dextran Cascade Blue | Invitrogen | D7132 | 10 mg powder |
| Rifampicin (RIF) | Sigma | Cat# R3501 | CYP inducer |
| Testosterone hydrate | Sigma | T1500 | CYP substrate |
| 1,25-dihyroxy Vitamin D3 (VD3) | Sigma | Cat# D1530 | CYP inducer |
| Acetonitrile with 0.1% (v/v) Formic acid | Sigma | 159002 | LCMS stop solution |
| IFNγ | Peprotech | 300-02 | |
| 4% Paraformaldehyde (PFA) | EMS | 157-4 | Fixative |
| Triton-X 100 | Sigma | T8787 | |
| Normal Donkey Serum (NDS) | Sigma | 566460 | |
| anti-Occludin | ThermoFisher Scientific | 33-1500 | tight junctions marker |
| anti-Claudin 4 | ThermoFisher Scientific | 36-4800 | tight junctions marker |
| anti-E-cadherin | Abcam | ab1416 | epithelial adherens junctions marker |
| anti-VE-cadherin | Abcam | ab33168 | endothelial adherent junctions marker |
| anti- Zonula Occludens 1 (ZO-1) | Thermo Fischer | 339194 | tight junctions marker |
| DAPI | ThermoFisher Scientific | 62248 | nuclear stain |
| 2-mercaptoethanol | Sigma | M6250 | |
| PureLink RNA Mini Kit | Invitrogen | 12183020 | RNA lysis, isolation and purification kit |
| SuperScript™ IV VILO™ Master Mix | Invitrogen | 11756050 | reverse transcriptase kit |
| TaqMan™ Fast Advanced Master Mix | Applied Biosystems | 4444557 | qPCR reagent |
| QuantStudio™ 5 Real-Time PCR System | Applied Biosystems | A28573 | Real-time PCR cycler |
| 18S primer | ThermoFisher Scientific | Hs99999901_s1 | Eukaryotic 18S rRNA |
| CYP3A4 primer | ThermoFisher Scientific | Hs00604506_m1 | Cytochrome family 3 subfamily A member 4 |
| Pierce™ Coomassie Plus (Bradford) Assay Kit | ThermoFisher Scientific | 23236 | Protein quantification kit |
| MSD Tris lysis buffer | Meso Scale Diagnostics | R60TX-3 | Protein lysis buffer |
| Cleaved/Total Caspase-3 Whole Cell Lysate Kit | Meso Scale Diagnostics | K15140D | Caspase 3 detection kit |
| V-PLEX Vascular Injury Panel 2 Human Kit | Meso Scale Diagnostics | K15198D | |
| V-PLEX Human Proinflammatory Panel II (4-Plex) | Meso Scale Diagnostics | K15053D | |
| Zeiss LSM 880 | Zeiss | - | Confocal microscope |
| Zeiss LD plan-Neofluar 20x/0.40 Korr M27 | Zeiss | - | 20X long-distance objective lenses |
| Zeiss AXIOvert.A1 | Zeiss | - | Brightfield microscope |
| Zeiss LD A-Plan 10X/0.25 Ph1 | Zeiss | - | 10X objective lenses |
Referencias
- Fritz, A., et al. Expression of clinically relevant drug-metabolizing enzymes along the human intestine and their correlation to drug transporters and nuclear receptors: An intra-subject analysis. Basic and Clinical Pharmacology and Toxicology. 124 (3), 245-255 (2019).
- Okumura, R., Takeda, K. Maintenance of intestinal homeostasis by mucosal barriers. Inflammation and Regeneration. 38 (1), 1-8 (2018).
- Delgado, M. E., Grabinger, T., Brunner, T. Cell death at the intestinal epithelial front line. FEBS Journal. 283 (14), 2701-2719 (2016).
- Mestas, J., Hughes, C. C. W. Of mice and not men: Differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Yu, H., et al. The contributions of human mini-intestines to the study of intestinal physiology and pathophysiology. Annual Review of Physiology. 79, 291-312 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Durel, J. F., Nerurkar, N. L. Mechanobiology of vertebrate gut morphogenesis. Current Opinion in Genetics and Development. 63, 45-52 (2020).
- Gayer, C. P., Basson, M. D. The effects of mechanical forces on intestinal physiology and pathology. Cellular Signalling. 21 (8), 1237-1244 (2009).
- Xu, Y., et al. Mechanical stimulation activates Piezo1 to promote mucin2 expression in goblet cells. Journal of Gastroenterology and Hepatology (Australia). 36 (11), 3127-3139 (2021).
- Navabi, N., McGuckin, M. A., Lindén, S. K. Gastrointestinal cell lines form polarized epithelia with an adherent mucus layer when cultured in semi-wet interfaces with mechanical stimulation. PLoS One. 8 (7), 68761(2013).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Kasendra, M., et al. Duodenum intestine-chip for preclinical drug assessment in a human relevant model. eLife. 9, 50135(2020).
- Apostolou, A., et al. A novel microphysiological colon platform to decipher mechanisms driving human intestinal permeability. Cellular and Molecular Gastroenterology and Hepatology. 12 (5), 1719-1741 (2021).
- Jalili-Firoozinezhad, S., et al. Author correction: A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 583(2019).
- Yin, J., et al. Fluid shear stress enhances differentiation of jejunal human enteroids in Intestine-Chip. American Journal of Physiology-Gastrointestinal and Liver Physiology. 320 (3), 258-271 (2021).
- Sontheimer-Phelps, A., et al. Human colon-on-a-chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43(2019).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Sarna, S. K. Colonic motility: From bench side to bedside. Morgan & Claypool Life Sciences. , San Rafael (CA). (2010).
- Basson, M. D. Paradigms for mechanical signal transduction in the intestinal epithelium - category: Molecular, cell, and developmental biology. Digestion. 68 (4), 217-225 (2003).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. The American Journal of Pathology. 166 (2), 409-419 (2005).
- Nava, P., et al. Interferon-γ regulates intestinal epithelial homeostasis through converging β-Catenin signaling pathways. Immunity. 32 (3), 392-402 (2010).
- Madara, J. L., Stafford, J. Interferon-γ directly affects barrier function of cultured intestinal epithelial monolayers. Journal of Clinical Investigation. 83 (2), 724-727 (1989).
- Bruewer, M., et al. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms. The Journal of Immunology. 171 (11), 6164-6172 (2003).
- Jones, S. C., et al. Adhesion molecules in inflammatory bowel disease. Gut. 36 (5), 724-730 (1995).
- Uhlar, C. M., Whitehead, A. S. Serum amyloid A, the major vertebrate acute-phase reactant. European Journal of Biochemistry. 265 (2), 501-523 (1999).
- Pérez-González, C., Ceada, G., Matejčić, M., Trepat, X. Digesting the mechanobiology of the intestinal epithelium. Current Opinion in Genetics & Development. 72, 82-90 (2022).
- In, J., et al. Enterohemorrhagic escherichia coli reduces mucus and intermicrovillar bridges in human stem cell-derived colonoids. Cellular and Molecular Gastroenterology and Hepatology. 2 (1), 48-62 (2016).
- Grassart, A., et al. Bioengineered human organ-on-chip reveals intestinal microenvironment and mechanical forces impacting shigella infection. Cell Host and Microbe. 26 (3), 435-444 (2019).
- Kerns, S. J., et al. Human immunocompetent organ-on-chip platforms allow safety profiling of tumor-targeted t-cell bispecific antibodies. eLife. 10, 67106(2021).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Ingber, D. E. Reverse engineering human pathophysiology with organs-on-chips. Cell. 164 (6), 1105-1109 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados