Method Article
结合人体类器官和芯片器官技术,对肠道区域特异性功能进行建模
摘要
活检衍生的肠道类器官和芯片上的器官技术被组合成一个微生理平台,以概括区域特异性肠道功能。
摘要
肠粘膜是一个复杂的物理和生化屏障,具有无数重要功能。它能够促进营养物质和异种生物的运输,吸收和代谢,同时促进与微生物群的共生关系并限制微生物的入侵。各种细胞类型及其物理和生化环境之间的功能相互作用对于建立和维持肠组织稳态至关重要。在 体外 模拟这些复杂的相互作用和集成的肠道生理学是一个艰巨的目标,有可能改变新的治疗靶点和候选药物的发现和开发方式。
类器官和器官芯片技术最近被结合起来,产生了适合研究体 外肠道生理学和病理生理学的功能方面的人类相关肠道芯片。来自小肠(十二指肠)和大肠活检的类器官被植入器官芯片的顶部隔室,然后成功地作为单层扩张,同时保留每个肠道区域独特的细胞,分子和功能特征。将人肠组织特异性微血管内皮细胞并入器官芯片的底部隔室中,以重建上皮 - 内皮界面。这个新颖的平台有助于腔内暴露于营养物质,药物和微生物,从而能够研究肠道运输,渗透性和宿主 - 微生物相互作用。
这里提供了代表人十二指肠(十二指肠芯片)和结肠(结肠芯片)的肠芯片及其在连续流动和蠕动样变形下的后续培养的详细方案。我们展示了使用原型诱导剂和底物评估十二指肠芯片中药物代谢和CYP3A4诱导的方法。最后,我们为结肠芯片中干扰素γ(IFNγ)介导的屏障破坏(肠漏综合征)的 体外 建模提供了分步程序,包括评估细胞旁通透性改变,细胞因子分泌变化以及芯片内细胞转录组分析的方法。
引言
人体肠道是一个复杂的多任务器官,能够自我再生。它分为小肠和大肠。小肠的主要功能是进一步消化来自胃的食物,吸收所有营养物质,并将残留物传递给大肠,从而回收水和电解质。小肠进一步分为多个解剖学上不同的区域:十二指肠,空肠和回肠,每个区域都适应于执行特定功能。例如,十二指肠有助于分解食糜(胃内容物),使空肠中涉及蛋白质,碳水化合物,维生素和矿物质的营养素得到适当的吸收。小肠的近端部分也是肠道药物吸收和代谢的主要部位,其特征是药物代谢酶(例如CYP3A4)的表达高于它们在回肠和结肠1中的表达。肠道除了在消化和吸收营养物质方面的主要作用外,还是抵御潜在有害腔内物质的有效屏障,如病原、微生物代谢物、膳食抗原和毒素2,3。值得注意的是,人体结肠中栖息着大量的微生物,远远超过人体总细胞的微生物,这些微生物为营养、新陈代谢和免疫力提供了许多益处。因此,维持由肠上皮细胞形成的粘膜屏障的完整性对于通过物理分离来允许肠道微生物群与宿主细胞之间的共生关系至关重要,以避免不必要的免疫细胞活化2。此外,程序性肠细胞死亡作为一种自我保护机制起着至关重要的作用,可防止受感染细胞持续存在或增殖 - 从而传播潜在的病原体3 - 而肠道上皮每四到七天持续自我更新一次,以补偿细胞损失,确保屏障完整性和组织稳态。所述肠道功能的损害,包括营养吸收、屏障完整性或肠细胞死亡和自我更新的不平衡,可能导致一系列胃肠道疾病的发展,包括营养不良和炎症性肠病(IBD)2,3。
此前,动物模型和转化的癌症衍生肠细胞系已被用于研究人体肠道组织的生理和病理生理功能。然而,由于两个物种之间存在显着差异,对动物研究对人类的可转化性的日益突出的担忧凸显了对人类相关替代方法的需求4.常用 的体外 肠细胞系包括T84、Caco-2和HT29细胞。虽然它们模仿肠道屏障功能和膜转运的某些方面,但它们的特征在于药物代谢酶5,表面受体和转运蛋白4的表达改变。此外,它们缺乏肠段特异性,无法概括肠上皮的复杂性,每个模型仅包含肠道中存在的五种上皮细胞类型中的一种6。
最近,通过小肠和结肠7,8或诱导多能干细胞(iPSC)9的新鲜活检建立的人肠类器官培养物被引入作为替代实验模型,具有补充,减少和可能取代未来动物实验的潜力。虽然iPSCs可以以非侵入性方式获得,但从iPSCs建立类器官需要使用复杂而漫长的方案(具有几个实验步骤),并产生类似于人类胎儿组织的培养物。相比之下,活检衍生的类器官具有高度可扩展性,因为它们可以利用肠道组织固有的更新能力,并且可以在体外无限期地传代和繁殖。重要的是,活检衍生的类器官维持其发育的原发组织的疾病和肠道区域特异性特征,并模拟肠上皮的细胞多样性。类器官可以在体外用作患者特异性化身,以揭示各种胃肠道疾病的生物学和发病机制,并改善其治疗管理。虽然肠道类器官已经取得了令人印象深刻的生理功能,但它们仍然无法重现天然器官的复杂性,因为它们缺乏关键的基质成分 - 包括血管,结缔组织,周围神经和免疫细胞 - 以及机械刺激。已知机械参数,如流动,剪切应力,拉伸和压力会影响体内的组织形态发生和稳态,并且先前已被证明可以改善细胞在体外的成熟10,11,12,13。类器官系统的另一个重要缺点是内腔难以接近,因此无法进入上皮的顶端。这对于研究与离子和药物转运蛋白的极化表达、宿主-微生物组相互作用和药物毒性测试相关的各种机制提出了挑战。最后,由于体外自组织过程和细胞命运选择的随机性,类器官培养物在大小,形态和功能方面存在相当大的差异。因此,为了实现肠道类器官在疾病建模、药物筛选和再生医学中的全部潜力,有必要探索新的策略,以减少类器官发育的变异性,改善对腔室的准入,并结合缺失的细胞 - 细胞相互作用。
器官芯片技术引入了许多技术,用于将机械力和流体流动结合到体外的肠道细胞培养 物中。然而,由于大多数最初的概念验证研究都使用了癌症衍生的细胞系,这些细胞系没有表现出足够的细胞多样性,因此这些系统的相关性受到了质疑。最近,我们协同结合肠道类器官和器官芯片技术,将每种方法的最佳功能整合到一个 体外 系统14,15,16中。由此产生的肠芯片概括了肠上皮的多细胞结构,上皮 - 内皮组织界面的存在以及液体流动和拉伸的机械力,从而能够在 体外模拟器官水平功能。此外,使用原代组织衍生的类器官(可以从人类肠道的不同区域取样)作为起始材料,增加了该模型的多功能性,因为代表人类十二指肠,空肠,回肠和结肠的芯片可以按照类似的播种和培养程序建立。重要的是,肠道芯片可以实时评估:肠道屏障完整性;刷子边界和药物代谢酶的活性;粘蛋白的生产;细胞因子的分泌;以及肠细胞与致病微生物和共生微生物的相互作用,如先前发表的报告所示。值得注意的是,当使用来自不同个体组织产生的类器官建立肠芯片时,这些模型捕获了对各种药物和治疗的功能反应中预期的供体间变异性。总而言之,将类器官与器官芯片技术相结合,为更先进、个性化、 体内相关模型打开了大门,这些模型可以提高 体外 发现的生理相关性和准确性,以及它们对人类的外推。在这里,提出了用于建立肠芯片及其在两个肠段的生理功能研究中的应用的详细方案:十二指肠和结肠。首先,描述了评估药物代谢酶CYP3A4在十二指肠芯片中的活性的方法,以及通过利福平和维生素D3等原型化合物诱导的方法。其次,在实验方案中概述了在结肠芯片中模拟"漏肠"所需的步骤,使用与IBD发病机制相关的标志性细胞因子对上皮屏障的破坏进行。简而言之,来自人类活检的类器官 在体外繁殖,进行酶消化,并引入芯片的顶部通道。在连续灌注富含生长因子的培养基的情况下,它们发育成具有3D结构和易于接近的顶端细胞表面的融合上皮单层。底部的"血管"芯片室接种着从小肠或大肠中分离的微血管内皮细胞。上皮和内皮由多孔可拉伸膜隔开,这有利于两个组织之间的旁分泌相互作用,并且在发生循环变形时,模拟人体肠道的蠕动样运动。在腔内和血管灌注与适当的细胞培养基产生的动态流动条件下维持共培养物。最后,我们描述了多种类型的测定和终点分析,这些分析可以直接在芯片上进行,也可以从取样的细胞培养流出物中进行。
研究方案
注意:所有细胞培养物都应使用适当的无菌技术进行处理。
本研究中使用的人类肠道类器官是从约翰霍普金斯大学获得的,所有方法均按照批准的指南和规定进行。所有实验方案均由约翰霍普金斯大学机构审查委员会(IRB #NA 00038329)批准。
1. 细胞培养试剂的制备
- 按照制造商的说明(材料表)准备人类器官生长培养基,并补充100μg/ mL的原基蛋白。
- 按照制造商的说明(材料表)制备人微血管内皮细胞生长培养基,并补充1:20 vol / volFBS和50μg/ ml代替100μg/ ml的Primocin。
- 将Y-27632(罗激酶抑制剂)重悬于DPBS中无菌的0.1%BSA中,以制备10mM储备溶液。等分试样到无菌微管中,并在-20°C下储存长达6个月。
- 将CHIR99021(GSK-3抑制剂)重悬于无菌二甲基亚砜(DMSO)中,以制备5mM储备溶液。等分试样到无菌微管中,并在-20°C下储存长达6个月。
- 通过将1:1体积/体积的类器官解离溶液(材料表)与DPBS溶液(材料表)混合并补充10μM储备溶液Y-27632来制备人类器官消化溶液。每次使用时,该试剂必须新鲜。
2. 人肠道微血管内皮细胞(HIMEC)的培养
- 在将HIMEC培养物接种到芯片上之前7天启动其培养物(材料表)。只有通道1-6处的海梅克才能用于芯片播种。
- 将5mL附着因子溶液(材料表)加入T150烧瓶中;在37°C孵育1分钟并丢弃溶液。
- 向烧瓶中加入在室温下预热的19mL内皮细胞生长培养基(参见步骤1.2)。
- 在37°C水浴中解冻冷冻的HIMEC小瓶(200万个细胞/小瓶)。
- 将小瓶的内容物转移到烧瓶中,轻轻摇动烧瓶以均匀分布细胞。将烧瓶置于37°C培养箱中过夜,以使内皮细胞粘附。
- 将培养基替换为20 mL内皮细胞生长培养基,第二天在室温下预热,此后每3天一次。培养物应在细胞收获当天达到90%的汇合度,以进行芯片实验。
3. 微细加工和芯片的制备
- 从商业供应商处获取芯片(材料表)。打开芯片的包装,将它们放在放置在方形培养皿(材料表)中的芯片支架中。用实验条件标记每个芯片载体的正面(图1A)。
注意:虽然所提出的协议依赖于使用特定的商用芯片和仪器,但通过不同的供应商提供了几种微流体设备,这些设备可能提供替代优势,但缺乏整合拉伸的能力。此外,芯片上器官的微加工可以按照Huh等人21中描述的程序"内部"进行。
4. 膜的活化和ECM涂层
- 活化溶液的制备
- 使用前将ER-1和ER-2试剂(材料表)置于室温以平衡。ER-1对光敏感,必须在黑暗中处理。
- 在10 mL ER-2试剂中重构ER-1,使终浓度为0.5mg / mL并确认ER-1完全溶解。
- 表面活化
- 轻轻地将50μLER-1溶液推入芯片的两个通道(图1A)。
- 使用吸气器从芯片表面除去任何多余的ER-1溶液。
- 检查芯片以确保所有芯片都已收到 ER-1 解决方案。如果出现气泡,引入更多的ER-1溶液,直到气泡完全去除。
- 将芯片在紫外灯室(材料表)内孵育15分钟。确认 UV 灯已设置为"一致"设置。
- 将ER-1激活芯片带回生物安全柜(BSC)。从两个通道吸入 ER-1 溶液。用200μLER-2洗涤ER-1溶液的任何残留物。
- 将200μL无菌杜贝克科的磷酸盐缓冲盐水(DBPS)推入通道(材料表),并将DBPS留在通道中直到下一步。
- 制备细胞外基质(ECM)和膜包衣
- ECM 组件的储备溶液的制备
- 使用无菌细胞培养级水(材料表)将胶原蛋白IV(材料表)和纤连蛋白(材料表)重构至最终浓度为1mg / mL。准备等分试样并将其储存在-20°C直至使用。
- 膜包衣ECM工作液的制备
- 为每12个要涂覆的芯片的顶部和底部通道准备1.5 mL每个ECM溶液。ECM 解决方案应始终在使用前做好准备。
- 对于顶部通道,将胶原IV和溶解基底膜基质(BMM)(材料表)分别以200μg/ mL和100μg/ mL的无菌冷DBPS混合。对于底部通道,将胶原IV和纤连蛋白分别以200μg/ mL和30μg/ mL混合在无菌冷DPBS中。
- 芯片的 ECM 涂层
- 从芯片的两个通道吸入DBPS,并为每个通道更换适当的ECM工作解决方案(图1A)。
- 检查每个芯片以确保其已收到涂层溶液。如果出现气泡,请推入更多的涂层溶液,直到所有气泡完全去除。
- 将无菌DPBS加入芯片底座,并将含有芯片的培养皿置于37°C培养箱中。孵育过夜,使ECM蛋白与活化的PDMS膜形成离子键。如果需要,可以在涂覆芯片后2小时至1天之间的任何时间接种细胞。或者,涂覆的芯片可以在4°C下储存过夜,然后在37°C下孵育过夜并进行芯片接种。
- ECM 组件的储备溶液的制备
5. 在芯片底部通道中接种肠道微血管内皮细胞(HIMEC)
注意:小肠和结肠HIMEC分别播种在十二指肠和结肠芯片的底部通道中。
- 准备薯片
- 将 ECM 涂层芯片转移到平衡计分卡。从芯片的两个通道中轻轻吸出ECM涂层,然后分别用200μL类器官生长培养基和内皮细胞生长培养基洗涤两个通道。
- 将洗过的芯片储存在37°C培养箱中,直到进行内皮细胞接种。
- 收获内皮细胞
- 将海美耐克培养瓶带到平衡计分卡,并使用无菌DPBS清洗。
- 向烧瓶中加入3mL解离溶液,并将其置于37°C培养箱中2分钟,以允许完全细胞分离。
- 将细胞收集在15 mL锥形管中,并加入内皮细胞生长培养基,直到达到10 mL。样品15-20μL细胞悬浮液用于细胞计数。以150× g 离心5分钟。
- 小心地吸出上清液,并在内皮细胞生长培养基中将HMECs重新悬浮至8-10×106 个细胞/ mL的密度。
- 将内皮细胞接种到芯片的底部通道中
- 将含有芯片的培养皿带到BSC,并使用1,000μL移液管从底部通道轻轻地除去所有培养基。
- 将10-15μL的HIMEC悬浮液引入芯片的底部通道。接种后立即检查芯片,以确保最佳的接种密度(覆盖率的80%-90%)和通道内的均匀细胞分布(图1D)。如果接种密度高于或低于预期或不均匀,请用200μL内皮细胞生长培养基洗涤通道2x并重复接种程序。
- 接种每批六个芯片后立即倒置培养皿,以允许内皮细胞附着在PDMS膜的底部。将培养皿放入37°C培养箱中30分钟至1小时,或直到底部通道中的HMEC连接到膜上(图1D)。
- 清洗薯片
- 轻轻推200μL内皮细胞生长培养基通过底部通道入口,以除去任何未连接的细胞并补充培养基中的营养物质。
- 用200μL补充有5μM CHIR99021和10μM Y-27632的类器官生长培养基洗去未附着在顶部通道中的细胞。
- 将芯片置于37°C培养箱中,直到进行上皮细胞接种。
6. 在芯片的顶部通道中播种类器官片段
注意:从各种肠道区域的活检中分离出的类器官可以在肠道芯片7中培养。按照藤井等人中描述的程序分离人肠隐窝和建立类器官培养物22。在这里,十二指肠和结肠类器官分别用于产生十二指肠和结肠碎片。鉴于类器官形成和生长的批次间和供体间差异性很高,建议对类器官悬浮培养物(24孔板形式)中的细胞密度进行试验性评估,以实现800万个细胞/mL的最佳接种密度。
- 对静态类器官培养物的细胞数量/孔进行试点评估。
注意:以下程序仅用于确定芯片接种所需的类器官悬浮培养孔数。由此产生的单个细胞不应用于芯片接种。- 小心地从类器官培养板的三个孔中吸出上清液。向每个孔中加入500μL冰冷的BMM解离溶液(材料表),并使用塑料刮刀将溶解的BMM从塑料中分离出来。
- 使用冰冷的1,000μL移液管将类器官悬浮液收集到无菌的低蛋白结合锥形管中。在冰上孵育60分钟,轻轻摇动管子,每15分钟混合一次。在4°C下以300× g 离心5分钟。
- 吸出上清液并加入2 mL胰蛋白酶。在37°C下孵育30分钟以将类器官消化至单细胞水平,并加入10mL完全类器官生长培养基以停止酶促反应。在4°C下以300× g 离心5分钟。
- 将细胞沉淀重悬于1mL完全类器官生长培养基中,并根据标准方法使用血细胞计数器计数细胞总数。
- 类器官片段的制备及其在芯片中的播种
注意:以下程序可用于在芯片的顶部通道中播种十二指肠或结肠类器官。具有体内相关3D细胞结构的 上 皮单层的建立取决于流动15,23 的存在和类器官片段的成功播种。- 小心地从静态类器官培养物的孔数中吸出培养基,这足以达到步骤6.1中确定的最终接种密度为800万个细胞/ mL。向每个孔中加入500μL冰冷的BMM解离溶液。
- 使用塑料刮刀或1,000μL移液器将溶解的BMM从孔表面分离。将悬浮液收集到15 mL低蛋白结合锥形管中。
- 将悬浮液储存在冰上60分钟,通过轻轻摇动管子每15分钟混合一次。在4°C下以300× g 离心5分钟。 离心后应能看到定义明确的类器官沉淀。如果在细胞沉淀上方观察到透明凝胶层(溶解的BMM的残留物)(图1B),请继续执行以下步骤。
- 混合上清液和细胞沉淀,并在管中加入等体积的BMM解离溶液。轻轻混合并在冰上再储存10分钟,然后在4°C下以300× g 离心5分钟。
- 如果需要,重复步骤6.2.3.1,直到不存在溶解的BMM残留物。
- 弃去上清液并用类器官消化溶液重悬类器官沉淀(见步骤1.5)。使用足够体积的类器官消解溶液,以确保颗粒完全浸没。2 mL溶液适用于约2,400-12,000个中型类器官(图1D,播种后)。在37°C下孵育1-3分钟。
- 将高级DMEM / F-12加入管中以停止酶促反应。使用所用消解溶液体积的四倍。在4°C下以300× g 离心5分钟。
- 吸出上清液并将类器官片段沉淀重悬于补充有5μM CHIR99021和10μM Y-27632的完整类器官生长培养基中,以达到800万个细胞/ mL。在无菌的1.5mL低蛋白结合管中制备360μL等分试样的悬浮液,以防止由于附着在壁上而降低细胞密度。
- 从涂层芯片的顶部通道中取出介质。在每个芯片的顶部通道中加入30μL细胞悬浮液。将芯片在37°C培养箱中孵育过夜,以使类器官片段粘附在ECM包被的膜上(图1D)。
7. 肠芯片的动态培养 - 启动,以及流动和蠕动样运动的维持
- 培养基制备和脱气
- 为了保持通过芯片的恒定层流,使介质温度平衡至室温,然后使用真空泵和PVDF过滤锥形管(介质脱气)对其进行真空驱动过滤10分钟。
- 便携式模块的启动
注:便携式模块是储液槽,充当芯片和培养模块之间的接口,允许对培养基进行重复采样和加样。- 打开平衡计分卡中的便携式模块,并将它们放在培养模块托盘上,培养模块托盘是用于对准便携式模块的专用容器。
- 向顶部入口储液器中加入3mL预平衡的完全类器官生长培养基,其中补充有5μM CHIR99021和10μM Y-27632,并在底部入口储液器中加入3mL预平衡的内皮细胞生长培养基(图1C)。在相应的出口储液槽中加入300μL相同的培养基。
- 将托盘放入37°C培养箱,然后将其滑入培养模块(图1C)。使用培养模块屏幕上的控件运行"质数周期"(1 分钟长)。当状态栏指示"就绪"时,则表示质数周期已完成。重复素数循环,以确保形成足够的液滴以成功连接芯片。
- 确保所有笔记本电脑模块都已装上底漆,并且有可见的介质液滴。
- 流量介绍
注意:通常在接种类器官片段后24小时开始流动,以使肠上皮细胞牢固地附着在膜上。- 用200μL各自的培养基洗涤接种芯片的两个通道,以除去任何气泡或细胞碎片。清洗后在端口上留下小的介质液滴。将芯片托架滑入笔记本电脑模块(图1C)。
- 将笔记本电脑模块放在托盘上,然后放入培养模块中。使用培养模块屏幕上的控件对适当的器官芯片培养条件(流速和拉伸)进行编程。
注意:对于标准十二指肠和结肠芯片培养条件,对于顶部和底部通道,将流速分别设置为30 μL / h15 和60μL / h16 。但是,每个通道的流速都是独立控制的,并且可以设置为0-1,000 μL / h之间。可以使用注射器或蠕动泵代替此处介绍的培养模块,将层流引入微流体芯片。然而,当需要同时灌注多个芯片时,使用管道和连接器在芯片和泵之间建立可靠的流体连接在技术上可能具有挑战性。 - 启动"调节周期"(2小时长),对便携式模块和芯片中的培养基加压,以防止气泡成核。编程条件将在监管周期完成后恢复。
- 媒体变更
- 为两个通道准备新鲜培养基,并通过向入口储液器中加入2mL新鲜培养基来每48小时补充一次(图1C)。
- 暂停培养模块并将托盘带到平衡计分卡。在所有储液罐中吸出培养基,并补充新鲜培养基。将托盘带回去,然后重新开始流动。
- 拉伸的介绍
注意:在施用循环菌株之前,让细胞生长到100%汇合。通常在播种后 3 天或开始流式培养后 48 小时引入拉伸。在0.2或0.15 Hz的频率下,分别对十二指肠11 和结肠24 肠芯片施加2%的循环应变,用于初始24小时。然后,在肠芯片培养的剩余持续时间内,它进一步增加到10%,以与 体内 肠上皮细胞经历的周期性菌株非常相似(图1D)25。培养模块可以支持2%-12%循环菌株的应用和高达0.4 Hz的频率。- 要将拉伸引入正在进行的流体培养,请暂停培养模块。使用屏幕上的控件,将拉伸设置更改为 2% 拉伸、0.2 或 0.15 Hz 频率,然后重新启动区域性模块。
- 24小时后,重复步骤7.5.1以施加10%的拉伸,0.2或0.15 Hz频率。
8. CYP450感应在十二指肠芯片中使用原型CYP诱导器
注意:细胞色素P450(CYP450)诱导测定可以评估测试化合物是否增加特定CYP450酶的mRNA水平和/或催化活性。在这里,我们描述了通过行业标准和调节剂推荐的 体外 CYP诱导剂利福平(RIF)和1,2-二羟基维生素D3(VD3)评估CYP3A4诱导的方案。所提出的方法可用于鉴定各种测试化合物在人肠道组织中诱导CYP450不同亚型的潜力。需要为要评估的每种酶亚型选择特定的引物集和探针底物。
- 接触CYP诱导剂
- 使用无菌DMSO制备20 mM RIF,100 mM VD3和200mM睾酮(材料表)的储备溶液。
注意:睾酮是附表III受控物质。在处理过程中遵循监管程序。 - 通过在完整的类器官生长培养基和内皮细胞生长培养基中稀释储备溶液来制备具有CYP诱导剂的给药培养基,以达到20μM RIF,100 nmol / L的VD3。通过在相应的培养基中稀释DMSO来制备车辆控制,以达到0.1%的DMSO。
- 暂停培养模块,将托盘带到平衡计分卡。用 2 mL 带诱导剂或载体控制的加药介质替换所有入口储液槽中的培养基。将便携式模块放回培养模块,并以30μL/h的速度重新开始流动。
- 24小时后,用诱导溶液替换培养基,并重复步骤8.1.2-8.1.3。诱导溶液应每天新鲜制备,并在实验过程中每24小时补充一次,通常为48-72小时长。
- 使用无菌DMSO制备20 mM RIF,100 mM VD3和200mM睾酮(材料表)的储备溶液。
- 与原型底物(睾酮)孵育
- 在收获当天,在高级DMEM / F12中制备睾酮的探针底物溶液以及相应的诱导剂,以产生200μM的最终浓度。
- 将托盘带到平衡计分卡,并从所有储液槽中吸出计量介质。分别用温热的高级DMEM / F12培养基和内皮细胞生长培养基清洗并更换顶部和底部入口储液器。
- 从储液槽中取出洗涤介质,并用步骤8.2.1制备的1 mL探针基质溶液代替。以1,000μL / h的高流速灌注芯片5分钟,并吸出顶部和底部出口储液槽。将芯片返回到培养模块,并在300μL / h的恒定流量下孵育1小时。
- 数据分析
- 用于液相色谱分析的样品采集
- 在预先标记的1.5mL管中等分200μL含有乙腈的塞溶液和0.1%甲酸,并将其放在冰上。LCMS停止溶液的组成可能因需要分析的基质而异。
- 1小时处理完成后,停止流动并将托盘带回平衡计分泌素电池。从顶部出口储液器收集100μL流出物,并将其加入含有停止溶液的相应管中(图2A)。立即将管子放在干冰上。将样品储存在-80°C,然后进行分析。
- 通过使用HPLC或LC-MS / MS技术提取和分析样品,监测代谢物-6β-羟基睾酮(6β-OH-T)的形成。CYP酶活性可以表示为pmol / min / mg蛋白,其中popol是指反应过程中形成的代谢物(6β-OH-T)的量。每个芯片的总蛋白质含量(蛋白质; mg)通过执行步骤8.3.2中描述的布拉德福德测定来确定。

折叠诱导活性的计算方式为:CYP活性(诱导)/CYP活性(车辆)。 - 如果收集样品进行mRNA分析,请参见步骤8.3.3。
- 裂解细胞进行蛋白表达分析
注意:从芯片上的细胞中提取蛋白质是使用蛋白质裂解缓冲液进行的,并辅以蛋白酶和磷酸酶抑制剂(材料表)。然后使用布拉德福德测定法对提取的蛋白质进行定量,并用于下游分析。- 从便携式模块中取出芯片,并将其放入培养皿中。用200μL无菌DPBS洗涤两个通道。
- 用200 μL过滤器移液器吸头堵塞底部通道出口。通过底部通道灌注50μL解离溶液,并在室温下孵育2分钟。
- 检查以确认内皮细胞完全脱离。上下移液1-2次,并从通道中取出解离溶液。重复洗涤。
- 用200 μL过滤器移液器吸头阻挡顶部通道出口。通过顶部通道灌注75μL蛋白质裂解缓冲液。保持插入移液器尖端,以阻塞顶部通道入口并在室温下孵育5分钟。上下移液5-10次,并将细胞裂解物收集在预先标记的1.5mL管中。
- 重复步骤 8.3.2.4。直到观察到细胞完全分离。将细胞裂解物收集在同一个1.5 mL管中,并将其储存在-80°C直至分析。
- 根据标准方法提取蛋白质级分,并使用Bradford测定法(材料表)定量总蛋白质。
- 裂解细胞以进行基因表达分析
注意:使用补充0.1%2-巯基乙醇的RNA裂解缓冲液(材料表)可以实现用于RNA提取的片上细胞裂解。或者,如果需要适合NGS和微阵列分析的高产量高质量RNA,则可以使用基于苯酚的RNA裂解缓冲液。- 按照步骤8.3.2.1至8.3.2.2制备用于裂解的肠芯片。
- 使用200 μL过滤器移液器吸头阻挡顶部通道的出口。通过顶部通道灌注150μLRNA裂解缓冲液。保持插入的移液器吸头以阻塞顶部通道的入口。在室温下孵育2分钟。对于使用基于苯酚的RNA裂解缓冲液进行裂解,请使用350μL试剂。
- 上下移液5-10次,并将细胞裂解物收集在预先标记的1.5mL管中。用另一个150μLRNA裂解缓冲液重复该步骤并收集。将细胞裂解物储存在-80°C直至分析。在随后的RNA测序分析中,在裂解后1个月内进行分析。
- 使用RNA纯化试剂盒从细胞裂解物中提取总RNA。
- 使用逆转录酶试剂盒逆转录成cDNA,并使用实时荧光定量PCR循环仪和适当的引物和缓冲液进行实时PCR。使用2-ΔΔCt 方法量化结果。
- 用于液相色谱分析的样品采集
9. 使用结肠芯片中的促炎细胞因子破坏上皮屏障
注意:该协议描述了细胞因子干扰素γ(IFNγ)26,27,28,29对肠上皮屏障的破坏。细胞因子在结肠芯片的底部通道中给药,给定IVNγ受体在肠上皮细胞上的基底外侧表达。 一旦Papp稳定在0.5 x 10-6 cm / s以下,就会在培养的第5天在芯片中引入促炎刺激。类似的给药方案可用于其他促炎细胞因子和屏障破坏剂。
- 用异丙氨酸刺激
- 在无菌细胞培养水中制备100μg/ mL的IFNγ储备溶液(材料表)。在实验过程中将储备溶液储存在-80°C。对于每个实验,始终使用新鲜的IFNγ储备,并避免三个以上的冻融循环。
- 通过在脱气内皮细胞生长培养基中稀释储备溶液来制备IFNγ加药溶液,以达到10-100ng / mL的最终浓度。
- 将托盘带到平衡计分卡,从底部通道入口储液槽中取出培养基,并用3 mL含有IFNγ的培养基代替。每天刷新IFNγ给药介质。
- 将托盘放入培养模块中,并以1,000μL / h的高流速灌注芯片5分钟以启动IFNγ处理。将流速切换回60μL / h并继续流体培养。
- 数据分析
- 评估上皮屏障功能。上皮表观渗透率(Papp)或屏障函数可以在IFNγ培养后处理的不同时间点,在两个通道的入口和出口储液池的出水介质中测量。荧光示踪剂应在评估Papp之前4小时添加到顶部通道类器官生长培养基中。通常,3 kDa葡聚糖级联蓝用作荧光示踪剂,并在24小时前加入培养基中。
- 暂停培养模块并将托盘带到平衡计分卡。
- 标记并制备96孔黑壁板,每孔100μLDPBS。使用200μL多通道移液器,收集50μL来自所有储层的流出物并将其加入各自的孔中(图2B)。
- 为了制备标准曲线,在DPBS中以1:3稀释含有100μg/ mL 3的3 kDa葡聚糖级联蓝的培养基。随后使用DPBS中内皮细胞生长培养基的三倍稀释进行连续稀释。
- 使用读板器读取375 nm激发和420 nm发射处的荧光。使用测量的 OD 值计算表观渗透率 (Papp),如下所示:
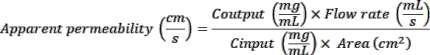
- 片上细胞的免疫荧光染色
- 每个通道使用200μLDPBS洗涤三次。
- 在每个通道中灌注200μL固定剂溶液(DPBS中4%PFA)。在室温下孵育15分钟。
- 重复洗涤步骤9.2.2.1。在这个阶段,洗过的薯片可以在4°C下储存长达7天。
- 对于每个通道,使用200μL透化溶液(DPBS中10%正常驴血清(NDS)中的0.1%Triton-X 100)透化细胞。在室温下孵育30分钟。重复洗涤步骤9.2.2.1。
- 通过对每个通道使用200μL封闭溶液(DPBS中10%NDS)来阻断芯片上的细胞。在室温下孵育1小时。
- 稀释抗体溶液中的一抗(DPBS中为5%NDS),如下所示:抗Zonula闭塞1(ZO-1)(1:100,上皮紧密连接标志物),抗闭塞素(1:100,上皮紧密连接标记),抗克劳丁4(1:100,上皮紧密连接标记),抗E-钙粘蛋白(1:100,上皮贴壁连接标记物)(材料表)。通过每个通道灌注200μL一抗溶液,并在4°C下孵育过夜。 重复洗涤步骤9.2.2.1。
- 稀释抗体溶液中的二抗(1:300,DPBS中5%NDS)。通过每个通道灌注200μL该溶液,并在室温下孵育2小时。重复洗涤步骤9.2.2.1。如果需要,可以将细胞骨架标志物鬼笔环蛋白添加到二抗溶液中。
- 在DPBS中制备50μg/ mL的4',6-二氨基-2-苯基吲哚(DAPI)溶液,并用它来通过每个通道灌注200μL。在室温下孵育15分钟。重复洗涤步骤。此时,染色的芯片可以在4°C下储存长达14天。
- 半胱天冬酶 3 裂解的评估
- 分离和量化上皮细胞的蛋白质总量,如步骤8.3.2所述。省略洗涤步骤 8.3.2.1。用DPBS将样品稀释至终浓度为400μg/mL。
- 根据制造商的方案,使用半胱天冬酶 3 检测试剂盒量化总半胱天冬酶 3 和裂解半胱天冬酶 3 的水平。
- 促炎细胞因子分泌的评估
- 按照制造商提供的方案,使用从结肠芯片两个通道的出口收集的流出物来量化分泌的急性期促炎细胞因子。对 V-PLEX 血管损伤小组 2 人试剂盒进行 5 倍稀释,对 V-PLEX 人促炎小组 II 进行两倍稀释。
- 评估上皮屏障功能。上皮表观渗透率(Papp)或屏障函数可以在IFNγ培养后处理的不同时间点,在两个通道的入口和出口储液池的出水介质中测量。荧光示踪剂应在评估Papp之前4小时添加到顶部通道类器官生长培养基中。通常,3 kDa葡聚糖级联蓝用作荧光示踪剂,并在24小时前加入培养基中。
结果
图1D 总结了肠芯片培养的时间线,并说明了在芯片上播种之前和之后的肠内皮细胞和类器官。此外,它证明了十二指肠和结肠芯片之间的明显形态差异,突出的是十二指肠芯片中存在绒毛样形成,并且代表了小肠结构。
图3A,B 显示了来自三个不同类器官供体的十二指肠芯片中的折叠CYP3A4诱导反应。将芯片暴露于20μM RIF或100 nM VD3中48小时,并用于评估CYP450酶的mRNA水平(A)和/或折叠催化活性(B)。在暴露于RIF和VD3的十二指肠芯片中观察到睾酮代谢物,6β-羟基睾酮(6β-OH-T)水平升高,与CYP3A4 mRNA基因表达升高一致,表明所有三个供体都具有适当的诱导反应。图中显示了 n = 3 个生物独立芯片的均值± SEM。
图4描绘了结肠芯片中肠漏综合征建模的代表性结果,包括(A,C)上皮细胞形态和紧密连接完整性的变化,(B)屏障功能的降低,(D)细胞凋亡的诱导和(E)响应IFNγ治疗增加的细胞因子分泌。
图4A 显示了对照组和IFNγ处理的结肠芯片上皮单层(50ng/mL,48小时)的代表性明场图像。从培养模块中取出芯片,每天在显微镜下评估上皮形态。使用明场显微镜和10倍物镜获取图像。用IFNγ处理的结肠芯片显示细胞形态受损和柱状上皮丢失。
图4B 显示了在基线条件下或用IFNγ刺激时对结肠芯片进行的表观渗透率测定的代表性结果。将3 kDa葡聚糖级联蓝示踪剂加入到顶部通道储液槽中,最终浓度为100μg/mL。在培养的第5天将终浓度为50ng / mL的IFNγ加入到底部通道中。将薯片以60 mL / h灌注。接下来,每天(暴露后最多72小时)从顶部和底部通道的入口和出口储液罐中收集培养基。收集50μL每个样品,按照方案的步骤9.2.1所述进行处理,并使用读板器检查375-420nm处的荧光。在IFNγ刺激48小时后观察到上皮细胞旁通透性的显着增加。
图4C 显示了上皮紧密(闭塞区1 - ZO-1,闭塞物,克洛丁,克朗丁-4)和粘附(E-钙粘蛋白)连接处的代表性免疫荧光图像,并且IFNγ处理(50ng / mL,48小时)结肠芯片。将芯片在室温下用4%多聚甲醛(PFA)固定15分钟,并按照方案的步骤9.2.2中所述进一步处理。使用共聚焦显微镜和20x长距离物镜获取图像,并根据标准协议使用斐济2.0版本进行处理。用IFNγ治疗触发ZO-1和克劳丁-4的位移以及闭塞素和E-钙粘蛋白的内化,如细胞质信号增加所示。
图4D 表示结肠芯片中半胱天冬酶3裂解的时间过程,以响应于50 ng / mL的IFNγ,指示细胞凋亡激活。将上皮细胞裂解在芯片上,并按照标准方法纯化蛋白质样品。按照方案的步骤9.2.3中所述测量总和切割的半胱天冬酶3的细胞内含量。IFNγ在刺激48小时后,在芯片上培养的结肠上皮细胞中诱导细胞凋亡的活化,如前所述29。
图4E 显示了在用50 ng / mL IFNγ刺激时细胞因子从结肠芯片分泌的时间过程。每天从顶部和底部通道的出口储液器中收集200μL出水培养基。将出水样品储存在-80°C和24小时,然后在4°C下解冻分析过夜。 使用中观规模发现技术评估芯片培养基中的细胞因子水平,如方案的步骤9.2.4中所述。IFNγ诱导结肠芯片中促炎分子的极化分泌,如血管细胞粘附蛋白1(VCAM-1)和白细胞介素6(IL-6)的基底分泌以及细胞间粘附分子1(ICAM-1)和血清淀粉样蛋白A(SAA)的顶端分泌所示。血清可溶性VCAM-1,ICAM-1,IL-6和SAA水平在临床实验室中用作炎症的指标30,31。
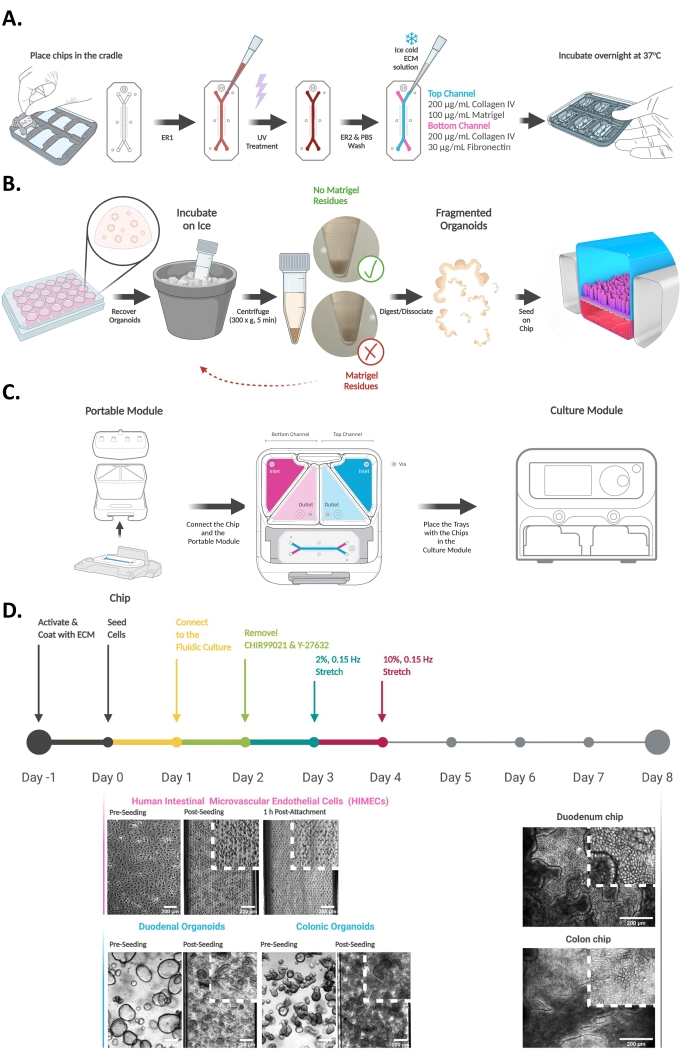
图1:建立肠芯片15,16. (A)芯片活化和涂层的示意图。简而言之,将芯片放置在芯片底座中,注入ER1溶液并在紫外光下激活。接下来,用ER2和DPBS清洗芯片。最后,将芯片涂有冰冷的ECM溶液,特定于每种细胞类型,并在37°C下孵育过夜。将类器官从24孔板转移到锥形管中,并在BMM解离溶液存在的情况下在冰上孵育,以从溶解的BMM中回收类器官。然后离心类器官悬浮液并评估是否存在溶解的BMM残留物。如果细胞沉淀上方仍然可见透明BMM层,则应重复该过程。如果观察到没有可见凝胶残留物的明确定义的沉淀,则酶解离类器官并将其引入芯片的顶部通道(蓝色)中。芯片的底部通道(洋红色)接种有组织特异性微血管内皮细胞。(C)显示芯片与培养模块的连接示意图,该模块支持培养基流动和循环蠕动样拉伸。启动周期使得细胞培养基液滴在芯片端口和便携式模块电阻末端产生。这确保了芯片和便携式模块之间液-液界面的产生,便于芯片滑入模块并安全连接。最后,将便携式模块放置在托盘中,并将托盘插入培养模块中。(D)实验时间表,重点介绍建立活检衍生肠芯片平台(包括十二指肠和结肠芯片)的主要步骤。明场图像说明了芯片接种前后第0天的内皮细胞和类器官来源的细胞,以及在芯片培养的第8天形成汇合物和3D上皮组织。请点击此处查看此图的大图。
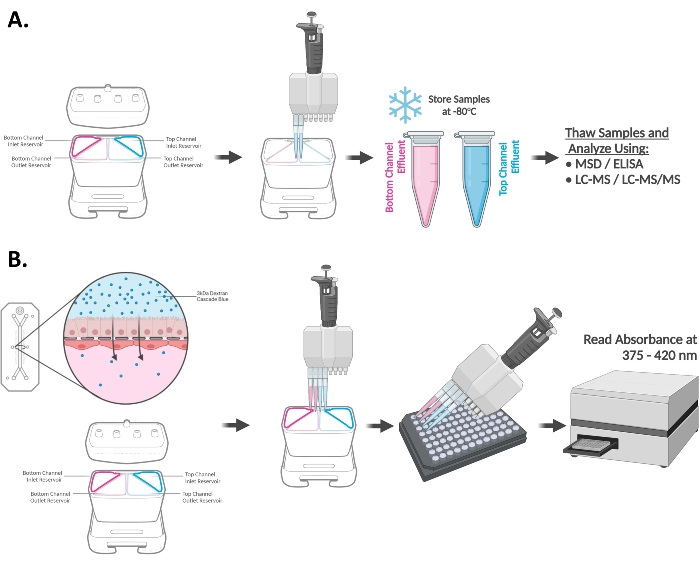
图 2:从肠芯片收集流出介质 (A) 描述便携式模块中收集介质流出物的示意图。从顶部和底部通道的出口储液槽收集培养基,并储存在-80°C,直到进一步的ELISA或LC-MS / LC-MS / MS分析。(B)使用多通道移液器收集出水样品并将其转移到96孔黑壁板中以下游评估上皮表观渗透率的示意图(Papp)。 请点击此处查看此图的大图。
图 3:十二指肠芯片中的 CYP3A4 诱导15. (A) 通过暴露于 20 μM RIF 和 100 nM VD3 进行 48 小时,在十二指肠芯片中诱导 CYP3A4 mRNA 水平。平均±SEM,N = 3个芯片/条件/供体,双向方差分析,Tukey的事后测试,****p<0.0001(与DMSO对照组相比)。(B)通过探针底物代谢物的LC-MS / MS定量评估暴露于原型诱导剂的十二指肠芯片中诱导CYP3A4活性:6β-羟基睾酮。在用20μM RIF或100 nM VD3处理48小时的十二指肠芯片中观察到CYP3A4活性显着增加。均值±SEM,N = 3个芯片/条件/供体,双向方差分析,图基事后测试,****p<0.0001。 请点击此处查看此图的大图。
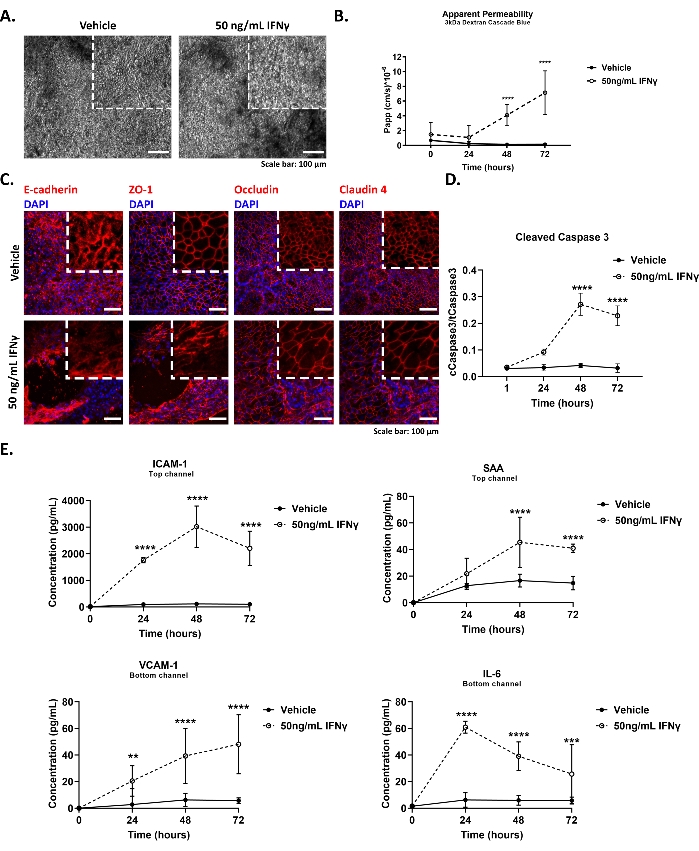
图4:使用IFNγ16破坏结肠芯片中的上皮屏障. (A)明场图像显示基线条件下和用50 ng / mL IFNγ刺激48小时后上皮细胞的形态。鳞条:100μm.(B)在用50 ng / mL IFNγ刺激72小时的过程中,上皮屏障对3 kDa葡聚糖的明显渗透性。均值± 95% 置信区间,N = 5-9 个芯片/条件,双向方差分析,Tukey 的事后检验,****p < 0.0001。(C)免疫荧光图像,描绘用50 ng / mL IFNγ刺激48小时时上皮紧密和粘附连接处的破坏。比例尺:50μm.(D)通过用50ng / mL IFNγ处理在结肠芯片中诱导半胱天冬酶3裂解。在暴露72小时内评估了四个不同的时间点。均值± 95% 置信区间,N = 3-6 个芯片/条件,双向方差分析,Tukey 的事后检验,****p < 0.0001。(E)增加细胞因子的分泌:血管细胞粘附蛋白1(VCAM-1)和白细胞介素6(IL-6),在底部通道中,细胞间粘附分子1(ICAM-1)和血清淀粉样蛋白A(SAA)在顶部通道流出介质中,在用50 ng / mL的IFNγ刺激结肠芯片72小时的过程中。均值± 95% 置信区间,N = 3 个芯片/条件,双向方差分析,Tukey 事后检验,*: p < 0.05, **: p < 0.01, ***: p < 0.001, ****p < 0.0001。 请点击此处查看此图的大图。
讨论
芯片器官技术和肠道类器官的结合有望准确模拟人体肠道生理学和病理生理学。在这里,我们提供了一个简单而稳健的分步方案( 如图1所示),用于建立含有活检衍生的小肠或结肠上皮和在微流体装置中共培养的肠微血管内皮细胞的肠芯片。这种基于芯片的人体肠道模拟结合了生理、腔内和血管流动以及蠕动样运动。此外,我们还描述了评估关键肠道功能的程序,例如十二指肠芯片中的药物代谢和结肠芯片中的屏障功能。
为了概括上皮 - 内皮细胞相互作用,这对于维持肠道稳态至关重要,因此在芯片上准确建模肠道组织至关重要,因此在PDMS膜的两侧建立功能性和完整的细胞单层至关重要。成功芯片接种的第一步是PDMS表面的化学活化,从而在PDMS表面和ECM蛋白之间建立稳定的连锁反应。不正确的激活可能会阻碍细胞的附着,并导致形成不完整的细胞单层。活化溶液必须新鲜制备,因为它对光敏感且容易降解。在紫外线活化和随后的ECM包衣过程中,确保试剂在每个通道内的均匀分布非常重要。用于涂覆顶部和底部通道的溶液的特定成分和浓度已经过优化,分别适合上皮细胞和内皮细胞的需求。如果需要改变肠芯片的细胞组成,可能需要重新优化ECM条件以获得最佳结果。
在ECM包衣之后,重要的是在高细胞接种密度(8 x 106 个细胞/ mL)下接种HIMEC,以获得PDMS膜底侧的完整且均匀的单层。如果未实现完全细胞汇合,则建议在接种过程中进一步增加内皮细胞悬浮液的密度,或延迟芯片顶部通道中类器官片段的接种,直到HIMEC完全汇合。使用碎片状类器官,而不是通过酶消化类器官获得的单个细胞的悬浮液,先前已被证明可以提高肠芯片14内肠道单层形成的成功和再现性。因此,强烈建议密切监测类器官消化过程,以确保与酶孵育的最佳时间,从而产生由约10-30个细胞(大小为40-100μm)组成的类器官片段。解离不充分可导致微流体芯片中囊性类器官结构的重整,而不是所需的单层。此外,避免过多的类器官解离成单细胞至关重要,这可能导致细胞存活、恢复减少,并且无法在芯片内形成融合的单层。
使用培养模块支持将流体流动(剪切应力)和循环应变掺入肠芯片培养物中,已被证明可以增强功能性肠屏障的形成并促进上皮组织13的3D结构的自发发育。然而,当使用Files-on-Chips进行微流体实验时,在使用前对细胞培养基进行预热和脱气至关重要,以避免在通道中形成微气泡,从而导致细胞应激甚至从膜上脱落。
除了这里显示的具体应用外,肠芯片模型还可用于解决各种科学问题,从基础科学到发现和测试新药或药物输送技术。它可以促进对人体肠道发育,干细胞成熟和上皮细胞功能的研究;特别是在评估力学在肠道组织生长和稳态中的作用的背景下。最近的发现表明,健康肠上皮的动态平衡依赖于其精确协调各种力量的能力,这些力量定义了隐窝绒毛结构,划分细胞类型,直接细胞迁移,并调节细胞在空间和时间中的特性,增殖和死亡32.肠道芯片提供了一个机会,可以更好地阐明机械力(例如,张力或剪切应力),细胞命运和功能之间的相互作用,以回答新兴的肠道机械生物学领域仍然存在的许多迷人问题。此外,由于存在分泌激素的肠内分泌细胞和各种营养转运蛋白的正确定位,它可以允许研究传感和肠道转运过程15,16。肠道芯片模型也可以修改为结合免疫细胞以及共生或病原微生物,用于研究肠道炎症性疾病,宿主 - 病原体和宿主 - 微生物组相互作用,以及精确预测免疫肿瘤学产品的脱靶毒性,如先前所示17,20,33,34,35。
此外,使用来自具有特定基因型和表型特征的个体的临床活检标本可以分析患者特异性疾病机制以及对治疗的反应,从而有助于在未来推进个性化医疗。
这种方法的主要局限性是需要来自大量类器官(~60-80)的片段才能在每个芯片上形成融合的肠上皮。这是因为类器官片段需要高密度接种,以确保存在足够数量的肠道干细胞,以支持单层的增殖扩张和3D组织结构的建立。芯片上完全分化的肠上皮具有所有主要的肠上皮细胞类型(吸收性肠细胞,Paneth细胞,杯状细胞和肠内分泌细胞)和与 体内 对应物非常相似的转录谱。然而,目前的模型仍然缺乏活肠的其他重要成分,包括肠成纤维细胞、常驻免疫细胞(例如巨噬细胞、上皮内淋巴细胞和树突状细胞)和肠神经系统。
虽然这些都是潜在的缺点,但以前的研究表明,器官芯片技术方法的力量在于它能够通过逐步整合 体内 组织的各种成分及其微环境来模拟人体器官的结构和功能复杂性36,37。这种 用于体外 组织工程的合成生物学方法提供了一种方法,用于研究不同系统复杂性水平下单个细胞和分子组分对器官水平生理和病理生理学反应的贡献。此外,它允许单独和实时地对相互作用的组织进行生化,遗传和微观分析,从而深入了解细胞间信号和组织 - 组织相互作用如何促进特定的器官水平行为。肠芯片技术的另一个显着特征是多功能性。对微环境元素的精确控制可以微调介质流速和应变参数,以再现人体细胞所经历的自然力,例如暴露于血流的内皮细胞感测到的剪切应力和肠道组织的周期性蠕动。此外,类器官和芯片器官的协同工程能够创建血管化的芯片器官,代表肠道组织的各个区域,这些区域可以相互流体连接,以研究小肠和大肠之间的生理相互作用。因此,我们认为肠芯片代表了肠上皮的优越模型,可能有助于在基础科学以及临床前和监管设置中实施3R(还原,精炼和替代)原则。
披露声明
高里·库尔卡尼、阿萨纳西亚·阿波斯托洛、洛娜·埃瓦尔特、卡罗琳娜·卢切西和马格达莱娜·卡森德拉是埃穆拉特公司的现任或前任雇员,并可能持有股权。Emulate Inc.是制造器官芯片设备的公司,并已发表与本文所述工作相关的专利。
致谢
我们感谢马克·多诺维茨教授提供肠道活检衍生的类器官,并感谢Brett Clair设计芯片、便携式和培养模块的科学插图。所有其他科学插图都是使用生物渲染器生成的。
材料
| Name | Company | Catalog Number | Comments |
| small intestine Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE15 | 0.5 cells M/ml ; cryopreserved |
| colon Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE16 | 0.5 cells M/ml ; cryopreserved |
| Biopsy-derived Human Duodenal Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Biopsy-derived Human Colonic Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Zoë CM-1™ Culture Module | Emulate Inc. | - | Culture module |
| Orb-HM1™ Hub Module | Emulate Inc. | - | 5% CO2, vacuum stretch, and power supply |
| Chip-S1™ Stretchable Chip | Emulate Inc. | - | Organ-Chip |
| Pod™ Portable Modules | Emulate Inc. | - | Portable module |
| UV Light Box | Emulate Inc. | - | - |
| Chip Cradle | Emulate Inc. | - | 1 per square culture dish |
| Steriflip®-HV Filters | EMD Millipore | SE1M003M00 | 0.45 μm PVDF filter |
| Square Cell Culture Dish (120 x 120 mm) | VWR | 82051-068 | - |
| Handheld vacuum aspirator | Corning | 4930 | - |
| Aspirating pipettes | Corning / Falcon | 357558 | 2 mL, polystyrene, individually wrapped |
| Aspirating tips | - | Sterile (autoclaved) | |
| Serological pipettes | - | 2 mL, 5 mL, 10 mL, and 25 mL low endotoxin, sterile | |
| Pipette | P20, P200, P1000 and standard multichannel | ||
| Pipette tips | P20, P200, and P1000. | ||
| Conical tubes (Protein LoBind® Tubes) | Eppendorf | 0030122216; 0030122240 | 15 mL, 50 mL tubes |
| Eppendorf Tubes® lo-bind | Eppendorf | 022431081 | 1.5 mL tubes |
| 96 wells black walled plate | - | - | for epithelial permeability analysis |
| Microscope (with camera) | - | - | For bright-field imaging |
| Water bath (or beads) | - | - | Set to 37°C |
| Vacuum set-up | - | - | Minimum pressure: -70 kPa |
| Cell scrapers | Biotium | 220033 | |
| T75 flasks | BD Falcon | 353136 | Cell culture flask |
| Emulate Reagent-1 (ER-1) | Emulate Inc. | - | Chip coating solution |
| Emulate Reagent-2 (ER-2) | Emulate Inc. | - | Chip coating solution |
| Dulbecco’s PBS (DPBS) | Corning | 21-031-CV | 1X |
| Cell Culture Grade Water | Corning | MT25055CV | |
| Trypan blue | Sigma | 93595 | For cell counting |
| TryplE Express | ThermoFisher Scientific | 12604013 | Organoids dissociation and endothelium cells detachment solution |
| Advanced DMEM/F12 | ThermoFisher Scientific | 12634028 | Medium |
| IntestiCult™ Organoid Growth Medium (Human) | Stem Cell technologies | 06010 | Organoid Growth Medium |
| Endothelial Cell Growth Medium MV 2 | Promocell | C-22121 | Endothelial medium |
| Fetal bovine serum (FBS) | Sigma | F4135 | Serum |
| Primocin™ | InvivoGen | ANT-PM-1 | antimicrobial agent |
| Attachment Factor™ | Cell Systems | 4Z0-210 | coating solution for flask |
| Matrigel - Growth Factor Reduced | Corning | 356231 | Solubilized basement membrane matrix |
| Collagen IV | Sigma | C5533 | ECM component |
| Fibronectin | Corning | 356008 | ECM component |
| Y-27632 | Stem Cell technologies | 72304 | organoid media supplement |
| CHIR99021 | Reprocell | 04-0004-10 | organoid media supplement |
| Cell Recovery Solution | Corning | 354253 | Basement mebrane matrix dissociationsolution |
| Bovine Serum Albumin (BSA) | Sigma | A9576 | 30%, Sterile |
| Cell Culture Grade Water | Corning | MT25055CV | Sterile, Water |
| DMSO | Sigma | D2650 | solvent |
| 3KDa Dextran Cascade Blue | Invitrogen | D7132 | 10 mg powder |
| Rifampicin (RIF) | Sigma | Cat# R3501 | CYP inducer |
| Testosterone hydrate | Sigma | T1500 | CYP substrate |
| 1,25-dihyroxy Vitamin D3 (VD3) | Sigma | Cat# D1530 | CYP inducer |
| Acetonitrile with 0.1% (v/v) Formic acid | Sigma | 159002 | LCMS stop solution |
| IFNγ | Peprotech | 300-02 | |
| 4% Paraformaldehyde (PFA) | EMS | 157-4 | Fixative |
| Triton-X 100 | Sigma | T8787 | |
| Normal Donkey Serum (NDS) | Sigma | 566460 | |
| anti-Occludin | ThermoFisher Scientific | 33-1500 | tight junctions marker |
| anti-Claudin 4 | ThermoFisher Scientific | 36-4800 | tight junctions marker |
| anti-E-cadherin | Abcam | ab1416 | epithelial adherens junctions marker |
| anti-VE-cadherin | Abcam | ab33168 | endothelial adherent junctions marker |
| anti- Zonula Occludens 1 (ZO-1) | Thermo Fischer | 339194 | tight junctions marker |
| DAPI | ThermoFisher Scientific | 62248 | nuclear stain |
| 2-mercaptoethanol | Sigma | M6250 | |
| PureLink RNA Mini Kit | Invitrogen | 12183020 | RNA lysis, isolation and purification kit |
| SuperScript™ IV VILO™ Master Mix | Invitrogen | 11756050 | reverse transcriptase kit |
| TaqMan™ Fast Advanced Master Mix | Applied Biosystems | 4444557 | qPCR reagent |
| QuantStudio™ 5 Real-Time PCR System | Applied Biosystems | A28573 | Real-time PCR cycler |
| 18S primer | ThermoFisher Scientific | Hs99999901_s1 | Eukaryotic 18S rRNA |
| CYP3A4 primer | ThermoFisher Scientific | Hs00604506_m1 | Cytochrome family 3 subfamily A member 4 |
| Pierce™ Coomassie Plus (Bradford) Assay Kit | ThermoFisher Scientific | 23236 | Protein quantification kit |
| MSD Tris lysis buffer | Meso Scale Diagnostics | R60TX-3 | Protein lysis buffer |
| Cleaved/Total Caspase-3 Whole Cell Lysate Kit | Meso Scale Diagnostics | K15140D | Caspase 3 detection kit |
| V-PLEX Vascular Injury Panel 2 Human Kit | Meso Scale Diagnostics | K15198D | |
| V-PLEX Human Proinflammatory Panel II (4-Plex) | Meso Scale Diagnostics | K15053D | |
| Zeiss LSM 880 | Zeiss | - | Confocal microscope |
| Zeiss LD plan-Neofluar 20x/0.40 Korr M27 | Zeiss | - | 20X long-distance objective lenses |
| Zeiss AXIOvert.A1 | Zeiss | - | Brightfield microscope |
| Zeiss LD A-Plan 10X/0.25 Ph1 | Zeiss | - | 10X objective lenses |
参考文献
- Fritz, A., et al. Expression of clinically relevant drug-metabolizing enzymes along the human intestine and their correlation to drug transporters and nuclear receptors: An intra-subject analysis. Basic and Clinical Pharmacology and Toxicology. 124 (3), 245-255 (2019).
- Okumura, R., Takeda, K. Maintenance of intestinal homeostasis by mucosal barriers. Inflammation and Regeneration. 38 (1), 1-8 (2018).
- Delgado, M. E., Grabinger, T., Brunner, T. Cell death at the intestinal epithelial front line. FEBS Journal. 283 (14), 2701-2719 (2016).
- Mestas, J., Hughes, C. C. W. Of mice and not men: Differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Yu, H., et al. The contributions of human mini-intestines to the study of intestinal physiology and pathophysiology. Annual Review of Physiology. 79, 291-312 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Durel, J. F., Nerurkar, N. L. Mechanobiology of vertebrate gut morphogenesis. Current Opinion in Genetics and Development. 63, 45-52 (2020).
- Gayer, C. P., Basson, M. D. The effects of mechanical forces on intestinal physiology and pathology. Cellular Signalling. 21 (8), 1237-1244 (2009).
- Xu, Y., et al. Mechanical stimulation activates Piezo1 to promote mucin2 expression in goblet cells. Journal of Gastroenterology and Hepatology (Australia). 36 (11), 3127-3139 (2021).
- Navabi, N., McGuckin, M. A., Lindén, S. K. Gastrointestinal cell lines form polarized epithelia with an adherent mucus layer when cultured in semi-wet interfaces with mechanical stimulation. PLoS One. 8 (7), 68761(2013).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Kasendra, M., et al. Duodenum intestine-chip for preclinical drug assessment in a human relevant model. eLife. 9, 50135(2020).
- Apostolou, A., et al. A novel microphysiological colon platform to decipher mechanisms driving human intestinal permeability. Cellular and Molecular Gastroenterology and Hepatology. 12 (5), 1719-1741 (2021).
- Jalili-Firoozinezhad, S., et al. Author correction: A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 583(2019).
- Yin, J., et al. Fluid shear stress enhances differentiation of jejunal human enteroids in Intestine-Chip. American Journal of Physiology-Gastrointestinal and Liver Physiology. 320 (3), 258-271 (2021).
- Sontheimer-Phelps, A., et al. Human colon-on-a-chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43(2019).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Sarna, S. K. Colonic motility: From bench side to bedside. Morgan & Claypool Life Sciences. , San Rafael (CA). (2010).
- Basson, M. D. Paradigms for mechanical signal transduction in the intestinal epithelium - category: Molecular, cell, and developmental biology. Digestion. 68 (4), 217-225 (2003).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. The American Journal of Pathology. 166 (2), 409-419 (2005).
- Nava, P., et al. Interferon-γ regulates intestinal epithelial homeostasis through converging β-Catenin signaling pathways. Immunity. 32 (3), 392-402 (2010).
- Madara, J. L., Stafford, J. Interferon-γ directly affects barrier function of cultured intestinal epithelial monolayers. Journal of Clinical Investigation. 83 (2), 724-727 (1989).
- Bruewer, M., et al. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms. The Journal of Immunology. 171 (11), 6164-6172 (2003).
- Jones, S. C., et al. Adhesion molecules in inflammatory bowel disease. Gut. 36 (5), 724-730 (1995).
- Uhlar, C. M., Whitehead, A. S. Serum amyloid A, the major vertebrate acute-phase reactant. European Journal of Biochemistry. 265 (2), 501-523 (1999).
- Pérez-González, C., Ceada, G., Matejčić, M., Trepat, X. Digesting the mechanobiology of the intestinal epithelium. Current Opinion in Genetics & Development. 72, 82-90 (2022).
- In, J., et al. Enterohemorrhagic escherichia coli reduces mucus and intermicrovillar bridges in human stem cell-derived colonoids. Cellular and Molecular Gastroenterology and Hepatology. 2 (1), 48-62 (2016).
- Grassart, A., et al. Bioengineered human organ-on-chip reveals intestinal microenvironment and mechanical forces impacting shigella infection. Cell Host and Microbe. 26 (3), 435-444 (2019).
- Kerns, S. J., et al. Human immunocompetent organ-on-chip platforms allow safety profiling of tumor-targeted t-cell bispecific antibodies. eLife. 10, 67106(2021).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Ingber, D. E. Reverse engineering human pathophysiology with organs-on-chips. Cell. 164 (6), 1105-1109 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。