Method Article
Preparación biológica y técnica mecánica para determinar las propiedades viscoelásticas de las fibras zonulares
En este artículo
Resumen
El protocolo describe un método para el estudio de la viscoelasticidad de la matriz extracelular y su dependencia de la composición proteica o de factores ambientales. El sistema matricial objetivo es la zónula del ratón. El rendimiento del método se demuestra comparando el comportamiento viscoelástico de las fibras zonulares de tipo salvaje con las que carecen de glicoproteína-1 asociada a microfibrillas.
Resumen
La elasticidad es esencial para la función de tejidos como los vasos sanguíneos, los músculos y los pulmones. Esta propiedad se deriva principalmente de la matriz extracelular (ECM), la malla de proteínas que une células y tejidos. Cómo las propiedades elásticas de una red ecm se relacionan con su composición, y si las propiedades de relajación de la ECM juegan un papel fisiológico, son preguntas que aún no se han abordado por completo. Parte del desafío radica en la compleja arquitectura de la mayoría de los sistemas ECM y la dificultad para aislar los componentes ECM sin comprometer su estructura. Una excepción es la zónula, un sistema ecm que se encuentra en el ojo de los vertebrados. La zónula comprende fibras de cientos a miles de micrómetros de longitud que abarcan el espacio libre de células entre el cristalino y la pared del ojo. En este informe, describimos una técnica mecánica que aprovecha la estructura altamente organizada de la zónula para cuantificar sus propiedades viscoelásticas y determinar la contribución de los componentes proteicos individuales. El método consiste en la disección de un ojo fijo para exponer el cristalino y la zónula y emplea una técnica de pull-up que estira las fibras zonulares por igual mientras se controla su tensión. La técnica es relativamente barata pero lo suficientemente sensible como para detectar alteraciones en las propiedades viscoelásticas de las fibras zonulares en ratones que carecen de proteínas zonulares específicas o con el envejecimiento. Aunque el método presentado aquí está diseñado principalmente para estudiar el desarrollo ocular y la enfermedad, también podría servir como un modelo experimental para explorar preguntas más amplias sobre las propiedades viscoelásticas de las ECM elásticas y el papel de factores externos como la concentración iónica, la temperatura y las interacciones con las moléculas de señalización.
Introducción
El ojo de un vertebrado contiene una lente óptica viva que ayuda a enfocar las imágenes en la retina1. La lente está suspendida en el eje óptico por un sistema de delicadas fibras orientadas radialmente, como se ilustra en la Figura 1A. En un extremo, las fibras se adhieren al ecuador del cristalino y, en el otro, a la superficie del cuerpo ciliar. Sus longitudes abarcan distancias que van desde 150 μm en ratones hasta 1 mm en humanos. Colectivamente, estas fibras se conocen como la zónula de Zinn2, la zónula ciliar, o simplemente la zónula. El trauma ocular, la enfermedad y ciertos trastornos genéticos pueden afectar la integridad de las fibras zonulares3, lo que resulta en su eventual falla y la consiguiente pérdida de la visión. En ratones, las fibras tienen un núcleo compuesto principalmente por la proteína fibrilina-2, rodeada por un manto rico en fibrilina-14. Aunque las fibras zonulares son exclusivas del ojo, tienen muchas similitudes con las fibras ECM a base de elastina que se encuentran en otras partes del cuerpo. Estos últimos están cubiertos por un manto de fibrilina-15 y tienen dimensiones similares a las fibras zonulares6. Otras proteínas, como las proteínas de unión al factor de crecimiento β transformante latente (LTBP) y la glicoproteína-1 asociada a microfibrillas (MAGP-1), se encuentran en asociación con ambos tipos de fibras7,8,9,10,11. El módulo elástico de las fibras zonulares está en el rango de 0.18-1.50 MPa12,13,14,15,16, comparable al de las fibras a base de elastina (0.3-1.2 MPa)17. Estas similitudes arquitectónicas y mecánicas nos llevan a creer que cualquier conocimiento de los roles de las proteínas asociadas a las zónulas puede ayudar a dilucidar sus roles en otras fibras elásticas de ECM.
El objetivo principal del desarrollo del método descrito aquí es obtener información sobre el papel de las proteínas zonulares específicas en la progresión de la enfermedad ocular hereditaria. El enfoque general es comparar las propiedades viscoelásticas de las fibras zonulares en ratones de tipo salvaje con las de ratones portadores de mutaciones dirigidas en genes que codifican proteínas zonulares. Si bien anteriormente se han utilizado varios métodos para medir las propiedades elastomecánicas de las fibras zonulares, todos fueron diseñados para los ojos de animales mucho más grandes12,13,14,15,16. Como tales modelos no son genéticamente tratables; buscamos desarrollar un método experimental que se adaptara mejor a los ojos pequeños y delicados de los ratones.
El método que desarrollamos para evaluar la viscoelasticidad de las fibras zonulares de ratón es una técnica a la que nos referimos como el ensayo pull-up4,18, que se resume visualmente en la Figura 1. A continuación se proporciona una descripción detallada del método pull-up y el análisis de los resultados. Comenzamos describiendo la construcción del aparato, incluidas las piezas impresas en tres dimensiones (3D) utilizadas en el proyecto. A continuación, detallamos el protocolo utilizado para obtener y preparar los ojos para el experimento. Por último, proporcionamos instrucciones paso a paso sobre cómo obtener datos para la determinación de las propiedades viscoelásticas de las fibras zonulares. En la sección resultados representativos, compartimos datos no publicados obtenidos con nuestro método sobre las propiedades viscoelásticas de las fibras zonulares de ratones que carecen de MAGP-119, así como un conjunto de control obtenido de animales de tipo salvaje de la misma edad. Finalmente, concluimos con observaciones generales sobre las ventajas y limitaciones del método, y sugerencias para posibles experimentos que pueden dilucidar cómo los factores ambientales y bioquímicos afectan las propiedades viscoelásticas de las fibras ECM.
Protocolo
Todos los experimentos con animales fueron aprobados por el Comité de Estudios Animales de la Universidad de Washington y se adhirieron a la Declaración ARVO para el Uso de Animales en la Investigación Oftálmica y de la Visión.
1. Fabricación de piezas especializadas y construcción de aparatos
- Fabricación de piezas especializadas
- Fabricación de sondas. Sostenga un capilar de vidrio en ángulo como se muestra en el panel izquierdo de la Figura 2A. Coloque una llama de un encendedor de cigarrillos a unos 2 cm de un extremo y manténgala allí hasta que el extremo se doble 90 °, como se muestra en el panel derecho de la Figura 2A.
- Fabricación de plataformas de muestra. Utilizando software de dibujo 3D, diseñe una plataforma que mida 30 x 30 x 5 mm y que contenga hedentaciones hemisféricas de 2.0, 2.5 y 3.0 mm de diámetro, como se muestra en la Figura 2B.
- Fabricación del soporte de la sonda. Utilizando el software de dibujo 3D, diseñe un soporte que sostenga la sonda capilar y conéctelo a un micromanipulador (consulte la Figura 2C).
NOTA: Un archivo 3D de muestra para la fabricación de plataformas y la fabricación de soportes de sonda en formato STL está disponible a petición del autor correspondiente. - Montaje negativo de la lente. Coloque una lente cilíndrica negativa (-75 mm en distancia focal y aproximadamente 50 mm en altura y longitud) como se muestra en la Figura 1C y la Figura 1D para corregir la distorsión causada por la adición de líquido a la placa de Petri (la adición de líquido distorsiona la vista del ojo diseccionado cuando se toma una imagen desde un lado).
- Pegue la lente negativa a una de las bases de 2 ranuras (consulte la Figura 2D para el posicionamiento de la lente en la base).
- Ensamble las piezas restantes como se muestra en la Figura 2D.
- Ajuste la altura del poste para que la lente apenas se cierne sobre la báscula y apriete el tornillo en el soporte del poste.
- Construcción de aparatos
- Instale en una computadora el programa de registro suministrado con la báscula, el software de la cámara del microscopio y la aplicación del controlador de micrómetro motorizado.
- Conecte el micrómetro motorizado al controlador del servomotor y este último a la computadora. Inicie la aplicación del controlador del motor y edite la configuración del motor.
NOTA: Los ajustes del motor, que se enumeran a continuación, se eligieron después de experimentos preliminares que revelaron que las tensiones se relajaron en una escala de tiempo de 10-20 s. En base a esta determinación, seleccionamos una velocidad y aceleración que permitiera al motor completar un desplazamiento de 50 μm en un tiempo menor que el tiempo de relajación, pero no demasiado corto para evitar sacudir la muestra. Aquí elegimos un tiempo de desplazamiento de unos 5-10 s. - Establezca la velocidad máxima en 0,01 mm/s y la aceleración en 0,005 mm/s2.
- Instale la cámara en el microscopio de inspección y pruebe el software de imágenes de la cámara.
- Coloque la báscula en el espacio del banco dedicado al aparato.
- Pegue una plataforma impresa en 3D (del paso 1.1.2) a una placa de Petri y agregue una cuenta de vidrio de 2-3 mm a uno de los pozos. Coloque la placa de Petri en la báscula para que la cuenta se encuentre cerca del centro de la sartén.
- Reemplace el micrómetro manual del micromanipulador por el motorizado.
- Atornille los dos tornillos 4-40 en el soporte de la sonda. Conecte el soporte de la sonda al manipulador como se muestra en la Figura 1C.
- Prepare una sonda como se ilustra en la Figura 2A, colóquela dentro del soporte de la sonda con la parte doblada hacia abajo y apriete los tornillos.
- Coloque el micromanipulador sobre la mesa de modo que la punta de la sonda esté sobre la cuenta en la plataforma. Coloque el micromanipulador en la mesa para evitar movimientos accidentales durante el experimento.
- Coloque el microscopio lateral sobre la mesa de modo que la cuenta esté en el centro de su campo de visión y enfocada.
2. Preparación de muestras y adquisición de datos
- Fijación y disección ocular
- Mantenga ratones de tipo salvaje y animales nulos Magp1 en un fondo C57 / BL6J idéntico. Sacrificar ratones de 1 mes o 1 año de edad por inhalación de CO2 .
- Retire los ojos con fórceps finos y fije los globos enucleados a 4 °C durante la noche en solución salina tamponada con paraformaldehído/fosfato al 4% (PBS, pH 7.4). Mantener una presión positiva de 15-20 mmHg en el ojo durante el proceso de fijación, como se describe6.
NOTA: Los experimentos se llevan a cabo en ratones machos, para controlar las posibles diferencias relacionadas con el sexo en el tamaño del globo ocular. La presión positiva asegura que el globo permanezca inflado, preservando el espacio entre la lente y la pared del ojo atravesada por las fibras zonulares. - Lavar los ojos durante 10 min en PBS. Usando tijeras quirúrgicas oftálmicas y trabajando bajo un estereomicroscopio, haga una incisión de espesor completo en la pared del ojo cerca de la cabeza del nervio óptico.
- Extienda el corte hacia adelante hasta el ecuador y luego alrededor de la circunferencia ecuatorial del ojo. Tenga cuidado de evitar los delicados procesos ciliares y las fibras zonulares asociadas.
- Retire la parte posterior del globo terráqueo, exponiendo la superficie posterior de la lente.
- Use los fórceps para extraer un ojo disecado de la solución tampón y colóquelo en una toallita seca con la córnea hacia abajo. Arrastre suavemente la córnea sobre la superficie de la toallita para secarla.
- Agregue 3 μL de pegamento instantáneo a los pocillos de la plataforma que acomodarán el ojo en la placa de Petri.
- Coloque el plato en la placa del escenario del estereomicroscopio para que el pozo con el pegamento esté a la vista.
- Transfiera el ojo de la toallita al borde del pozo que contiene pegamento. Luego, arrastre cuidadosamente el ojo hacia el pozo y ajuste rápidamente su orientación para que la parte posterior de la lente esté más arriba.
- Seque el lado expuesto de la lente secándola suavemente con la esquina de una toallita seca.
- Aplique un poco de pegamento instantáneo en la parte inferior de una placa de Petri de 50 mm y cemente la plataforma.
- Medición de la respuesta viscoelástica zonular
- Encienda la báscula, inicie el programa de registro de incrustaciones y el software de la cámara. Asegúrese de que el programa de registro pueda adquirir datos durante 30 minutos, ya que algunos ensayos pueden durar tanto tiempo.
- Encienda el controlador del servomotor e inicie la aplicación del controlador en la computadora. Asegúrese de que el controlador esté configurado para moverse en incrementos de 50 μm utilizando parámetros de movimiento similares a los descritos en la NOTA en el paso 1.2.2.
- Cree una curvatura de 90° en una varilla capilar como se describe en el paso 1.1.1.
- Deslice el capilar doblado en el soporte de la sonda capilar y apriete los tornillos de sujeción.
NOTA: Para minimizar la deshidratación de la muestra, recomendamos que los pasos 1-4 se completen antes o durante la disección ocular. - Agregue una pequeña cuenta (~ 1 mm) de pegamento de curado UV a la punta del capilar.
- Usando los ajustes manuales en el manipulador, mueva la punta de la sonda capilar para que esté directamente sobre el centro de la lente. Compruebe si la parte inferior del pegamento UV aparece centrada sobre la parte superior de la lente cuando se ve desde el frente (mediante inspección visual) y el lateral (a través de la cámara del microscopio).
- Mientras mira a través de la cámara, baje la punta de la sonda hasta que el pegamento UV haga contacto con la lente y cubra de un tercio a la mitad de su superficie superior.
- Use una fuente de luz UV (380-400 nm) de baja intensidad (~ 1 mW), direccional y casi visible para curar el pegamento.
NOTA: Estas especificaciones son suficientes para curar el pegamento en unos pocos segundos al tiempo que minimizan el potencial de inducir la reticulación de proteínas. Las fuentes de luz UV suministradas con plumas de pegamento UV comerciales cumplen con estas especificaciones. - Agregue la solución de PBS al plato hasta que el ojo esté cubierto por líquido a una profundidad de al menos 2 mm.
- Coloque la lente cilíndrica frente al microscopio de inspección y lo más cerca posible de la placa de Petri sin tocarla.
- Inicie simultáneamente el programa de registro y un programa de temporizador. Tome una foto del ojo/sonda con la cámara.
- Después de 60 s, inicie otro desplazamiento de 50 μm, y a partir de entonces cada 60 s hasta que se complete el experimento, es decir, hasta que se hayan roto todas las fibras. Tenga en cuenta que la señal no volverá a los niveles basales debido a la evaporación del búfer durante el experimento. Corrija la deriva resultante en las lecturas durante el análisis de datos, como se ejemplifica en el paso 2.2.14.
- Al finalizar una ejecución, guarde los datos de registro de escala y expórtelos a un formato compatible con la hoja de cálculo, por ejemplo, un formato de .csv. Guarde las imágenes de la lente que se recopilaron durante la carrera.
- Importar datos a una hoja de cálculo. Utilice la primera y la última lectura de escala para interpolar la deriva en la lectura de fondo a lo largo del tiempo debido a la evaporación (ver Figura 3). Reste la lectura interpolada de la lectura en cada punto de tiempo.
NOTA: Si se utiliza una hoja de cálculo, la interpolación se puede realizar automáticamente introduciendo la fórmula = B2 - $B$2 + ($B$2 - @INDIRECT("B"&COUNTA(B:B)))/(COUNTA(B:B)-2) * A2 en la celda a la derecha de la primera lectura de escala, luego moviendo el cursor a la esquina inferior derecha de la celda y arrastrándolo hacia abajo hasta el último valor de datos. La fórmula supone que los datos están organizados en una columna con el primer punto de datos que aparece en la celda B2. Si se desea, los datos procesados en el paso 2.2.14 pueden analizarse con el modelo viscoelástico cuasi elástico desarrollado por uno de los coautores, el Dr. Matthew Riley4.
Resultados
La técnica pull-up descrita aquí proporciona un enfoque sencillo para determinar las propiedades viscoelásticas de las fibras zonulares en ratones. En resumen, el ojo de ratón se conserva primero mediante la inyección de un fijador a presión intraocular fisiológica. Este enfoque mantiene la inflación natural del ojo y mantiene las fibras adecuadamente pretensadas (la fijación se consideró aceptable después de que los experimentos preliminares demostraron que no alteraba significativamente la elasticidad o la resistencia de las fibras). La parte posterior del ojo del ratón se extrae mediante disección para exponer el cristalino y las fibras zonulares que lo suspenden. La parte frontal del ojo se fija a una plataforma y se coloca dentro de una placa de Petri que descansa en una escala digital. A continuación, un capilar de vidrio unido a un micromanipulador se cementa a la superficie posterior de la lente. La lente se eleva en incrementos de 50 μm mientras se registra la fuerza en la escala. Una reducción en el peso aparente de la preparación proporciona información sobre las fuerzas que estiran las fibras. Cada desplazamiento es seguido por un período de equilibrio que dura aproximadamente 1 minuto para observar cualquier relajación del estrés inducido por el desplazamiento. Finalmente, los resultados se analizan utilizando un modelo viscoelástico cuasi lineal diseñado específicamente para la geometría de las fibras zonulares del ratón y la dirección del tirón para el ensayo4.
Los datos viscoelásticos típicos obtenidos con nuestro método se muestran en la Figura 3. La curva aparece invertida (negativa) ya que la fuerza de elevación en la lente reduce el peso del conjunto plato/plataforma/ojo en la báscula en una cantidad equivalente. La respuesta incluye picos de fuerza instantáneos durante cada uno de los desplazamientos verticales de 50 μm de la lente, seguidos de una fase de relajación con una vida útil del orden de 10 s. Se ha observado una relajación del estrés similar para las fibras zonulares bovinas12. La magnitud de las fuerzas instantáneas y relajadas aumenta con cada paso hasta aproximadamente 1000 s (~ 800 μm de desplazamiento total) y luego comienza a disminuir a medida que las fibras comienzan a fallar. La falla de Zonule se completa en el punto de tiempo de 1,500 s (~ 1.25 mm de desplazamiento total). Tenga en cuenta que debido a la evaporación del búfer en el curso del experimento, la curva no vuelve a la lectura inicial después de que la lente se libera del ojo.
La Figura 4 contrasta las respuestas obtenidas para un ratón knockout Magp-1 (curva roja) y un animal de tipo salvaje de la misma edad (curva azul). Estas curvas se han corregido para la evaporación, invertidas, y las mediciones brutas de masa (ver Figura 3) ahora se expresan como fuerza (con unidades de mN). La respuesta viscoelástica inicial de la zónula agotada de Magp-1 (tiempo 0-600 s) se parece mucho a la del tipo salvaje, lo que sugiere que las propiedades viscoelásticas de la zónula no se vieron alteradas significativamente por la ausencia de Magp-1. Sin embargo, las fibras parecen romperse a una tensión mucho menor en comparación con sus contrapartes de tipo salvaje.
Para ilustrar la confiabilidad del método, recopilamos datos de múltiples animales sobre la fuerza instantánea máxima aplicada a los ojos antes de que sus fibras se rompieran. Los resultados se muestran en la Figura 5. Los datos de ratones de 1 mes de edad presentan valores muy pequeños para el error estándar de la media (SEM) a pesar del número relativamente bajo de muestras utilizadas (n = 5 o 6), lo que sugiere una alta reproducibilidad. Los resultados indican que la resistencia de las fibras difiere significativamente entre los dos genotipos (valor p = 2,4 x 10-6). Los resultados no mostrados en las figuras también sugieren que hay un aumento sutil pero estadísticamente significativo en la fuerza de ruptura con la edad para los animales de tipo salvaje (valor p = 0,024).
El método pull-up también puede generar estimaciones cuantitativas de los parámetros viscoelásticos que dan cuenta de las variaciones observadas en las respuestas temporales. La Tabla 1 resume los parámetros de mejor ajuste a nuestros datos del MAGP-1, obtenidos con un modelo viscoelástico cuasi lineal descrito anteriormente4. Los resultados muestran que tanto la eliminación de MAGP-1 como el envejecimiento pueden tener impactos muy significativos en algunas de las propiedades mecánicas de las fibras zonulares.

Figura 1: Un resumen visual del método pull-up. (A) Vista transversal de un ojo vertebrado que muestra el cristalino y las fibras zonulares que lo suspenden. (B) Un enfoque general para determinar el comportamiento viscoelástico en las fibras zonulares desplazando el cristalino hacia arriba (lejos de la córnea). (C) Vista real de un ojo diseccionado pegado a una plataforma con su lente siendo tirada hacia arriba por una sonda de vidrio conectada a un micromanipulador. (D) Esquema de todo el aparato. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Fabricación de varias piezas. (A) Fabricación de la sonda de vidrio. Un capilar de vidrio se mantiene en ángulo y se aplica una llama en un punto de aproximadamente 2 cm de un extremo. En unos segundos, el extremo del capilar comienza a caer. La llama se elimina cuando el extremo del capilar se dobla a unos 90°. (B) Fabricación de la plataforma ocular. La pieza se fabrica con una impresora de estereolitografía 3D (SLA). Mide 30 x 30 x 5 mm y contiene tres hemisféricas con diámetros de 2,0, 2,5 y 3,0 mm en las que se pegan ojos disecados de varios tamaños. (C) Fabricación del soporte de la sonda. Esta pieza también se fabricó con una impresora 3D SLA. Consta de dos varillas ortogonales de 7,3 mm de diámetro. La varilla inferior contiene un orificio de 1,5 mm y dos orificios pasantes de 2,5 mm en la superficie exterior para acomodar tornillos metálicos que aseguran la sonda capilar en su lugar. (D) Conjunto de lente negativa. Las imágenes capturadas por el microscopio lateral contienen una distorsión astigmática debido a la curvatura de la placa de Petri y la solución tampón. El conjunto de la lente está diseñado para compensar la distorsión, lo que permite que el microscopio lateral capture imágenes con un enfoque nítido. Haga clic aquí para ver una versión más grande de esta figura.
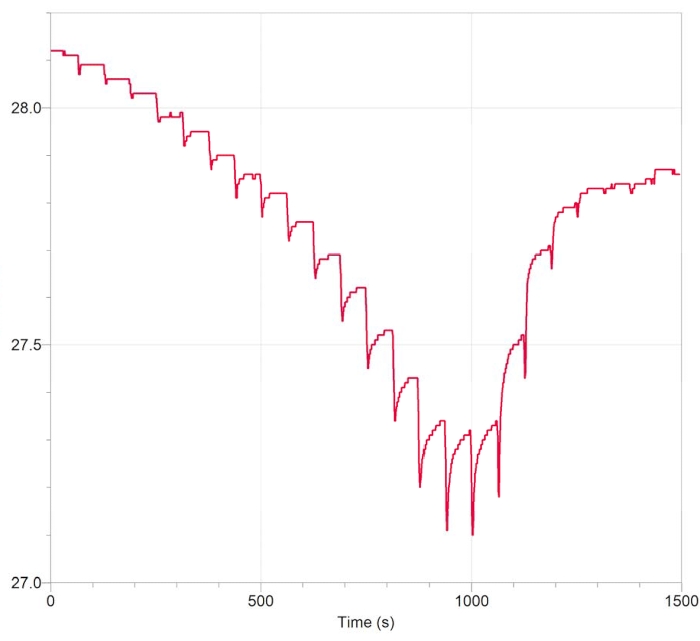
Figura 3: Datos brutos típicos obtenidos con el ensayo. El gráfico mostrado se registró con un software de registro que registra datos de una escala digital con una precisión de 0,01 g. El borde izquierdo del gráfico (tiempo 0) refleja el peso de la muestra sin una fuerza de elevación. El eje y representa la masa en g. La lente se levanta en pasos de 50 μm hasta que todas las fibras zonulares se rompen y la placa de Petri vuelve a descansar completamente en la escala. Tenga en cuenta que la lectura final está desplazada de la lectura inicial. El desplazamiento se debe a la evaporación gradual de la solución tampón durante el curso del experimento y se puede tener en cuenta durante el análisis de datos, como se describe en el paso 2.2.14. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Curvas representativas de fuerza-desplazamiento zonular para ratones de tipo salvaje y deficientes en MAGP-1. El gráfico compara la respuesta viscoelástica obtenida después de desplazamientos discretos de la lente lejos de su posición de equilibrio. La respuesta de un ojo de un ratón knockout MAGP-1 (KO) rastrea la de un animal salvaje de la misma edad hasta el punto en que las fibras en el ratón knockout se rompen prematuramente. Haga clic aquí para ver una versión más grande de esta figura.
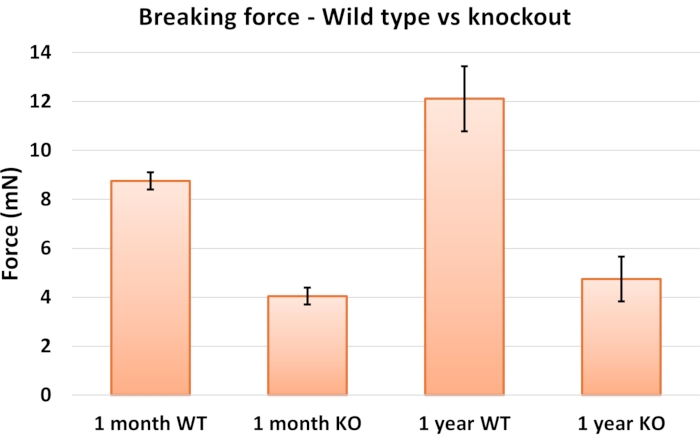
Figura 5: Fuerzas de rotura de fibras zonulares obtenidas con el método pull-up para MAGP-1 KO versus ratones de tipo salvaje y a las dos edades. Todas las mediciones mostradas se basan en n = 5 o 6 ojos, con barras de error que representan el error estándar de la media (SEM). Abreviaturas: WT = tipo salvaje; KO = NOCAUT MAGP-1 . Haga clic aquí para ver una versión más grande de esta figura.
| Genotipo/edad | G0 (Pa) | G∞ (Pa) | Ʈ (seg.) | σ f (Pa) | |
| WT 1 mes | SIGNIFICAR | 2.34E+05 | 9.33E+04 | 16.3 | 9.61E+05 |
| SD | 2.83E+04 | 2.94E+04 | 3.4 | 1.25E+05 | |
| 95% Cl | 5.55E+04 | 5.76E+04 | 6.7 | 2.45E+05 | |
| KO 1 mes | SIGNIFICAR | 2.73E+05 | 6.74E+04 | 17.6 | 4.44E+05 |
| SD | 6.30E+04 | 2.06E+04 | 3.8 | 7,85E+04 | |
| 95% Cl | 1.23E+05 | 4.03E+04 | 7.5 | 1.54E+05 | |
| valores de p | 0.25 | 0.12 | 0.58 | 0.000022 | |
| WT 1 año | SIGNIFICAR | 1.98E+05 | 7.42E+04 | 17 | 1.41E+06 |
| SD | 1.17E+05 | 2.39E+04 | 9.1 | 2.44E+05 | |
| 95% Cl | 2.29E+05 | 4.69E+04 | 17.9 | 4.79E+05 | |
| KO 1 año | SIGNIFICAR | 1.70E+04 | 2.46E+04 | 12.9 | 5.05E+05 |
| SD | 9.06E+03 | 8.04E+03 | 7.4 | 1.48E+05 | |
| 95% Cl | 1.78E+04 | 1.58E+04 | 14.4 | 2.91E+05 | |
| valores de p | 0.0063 | 0.001 | 0.41 | 0.000014 | |
| valores de p, edad | WT | 0.46 | 0.23 | 0.85 | 0.002 |
| KO | 0.0007 | 0.0068 | 0.26 | 0.44 | |
Tabla 1: Propiedades viscoelásticas obtenidas con un modelo viscoelástico cuasi lineal (QLV). Los escaneos de datos como los que se muestran en la Figura 4 se analizaron con un modelo QLV desarrollado específicamente para el ensayo pull-up y la zónula del ratón. Se muestran los mejores parámetros de ajuste para las rigideces instantáneas (G0) y de equilibrio (G∞), la constante de tiempo de relajación (τ) y la resistencia a la tracción final (σ f). Abreviaturas: SD = desviación estándar; IC = intervalo de confianza.
Discusión
La zónula es un sistema ECM inusual donde las fibras están dispuestas simétricamente y pueden manipularse de manera idéntica desplazando la lente del ojo a lo largo del eje óptico. También se puede acceder fácilmente al espacio sin interrupción celular, lo que permite estudiar las fibras en un entorno cercano a su estado nativo. La técnica pull-up aprovecha esta presentación ECM para manipular las delicadas fibras de ratones, un sistema genéticamente tratable, y cuantificar con precisión sus propiedades mecánicas. Esto nos ha permitido examinar la contribución de las proteínas ECM clave (fibrilina-118, LTBP-24 y MAGP-1 reportadas aquí) a las propiedades biomecánicas de las fibras zonulares. Nuestro análisis de ratones deficientes en fibrilina-1 reveló que las fibras zonulares que carecen de fibrilina-1 se debilitan con la edad y eventualmente se rompen, lo que lleva al desplazamiento de la lente dentro del ojo (en humanos, una condición conocida como ectopia lentis). Significativamente, la luxación del cristalino también es una ocurrencia común en pacientes con síndrome de Marfan, una enfermedad causada por mutaciones en el gen FBN120. Por lo tanto, el ensayo pull-up ofrece una oportunidad para modelar aspectos de la enfermedad del tejido conectivo humano en ratones. En ratones que carecían de LTPB-2 (una proteína que se cree que está involucrada en la génesis de las microfibrillas), pudimos demostrar que las fibras zonulares se produjeron en ausencia de esa proteína, pero se rompieron a tensiones significativamente más bajas y finalmente se desintegraron con la edad4. Estos resultados sugieren que LTBP-2 contribuye a la longevidad de las fibras en lugar de su síntesis. En el estudio actual, determinamos que las fibras deficientes en MAGP-1 tenían propiedades viscoelásticas similares a las fibras de tipo salvaje, pero se rompían a tensiones más bajas, sin signos de una mayor degradación relacionada con la edad. Esto sería consistente con un modelo en el que las fibras que carecen de MAGP-1 son intrínsecamente más débiles tan pronto como se desarrollan.
Observamos que las resistencias a la tracción final enumeradas en la Tabla 1 se estiman bajo el supuesto de que las fibras se rompen en algún lugar a mitad de tramo. Sin embargo, no podemos descartar la posibilidad de que la falla de la fibra se deba al desprendimiento de los puntos de anclaje en la superficie de la lente o el cuerpo ciliar. Si este fuera el caso, la resistencia a la tracción a la fractura de la fibra podría ser mayor que los valores enumerados en la Tabla 1. Se requerirá un análisis microscópico para diferenciar entre estas posibilidades. Tal análisis está lejos de ser trivial ya que las fibras involucradas son muy delgadas (~ 0.5-0.6 μm de ancho) y casi indexadas al agua, lo que las hace esencialmente invisibles. En ausencia de esta información adicional, sólo podemos afirmar que las resistencias a la tracción final enumeradas en la Tabla 1 representan sus límites inferiores. También sería interesante, en principio, comprobar si las mediciones de fuerza difieren en función de la dirección en la que se tire de la lente. En la práctica, sin embargo, tirar de la lente desde el lado anterior requeriría eliminar el iris sin dañar las fibras zonulares que se encuentran inmediatamente debajo. Tal disección precisa está más allá de lo que podemos lograr actualmente con el ojo del ratón.
La relativa simplicidad del método y la alta reproducibilidad de sus resultados son cualidades deseables para los estudios comparativos de las propiedades mecánicas de ECM. Además, como se ha demostrado aquí, también es posible utilizar el ensayo pull-up para obtener valores absolutos de parámetros viscoelásticos asumiendo un modelo viscoelástico y ajustando las curvas de tiempo a él. Por ejemplo, utilizando un modelo viscoelástico cuasilineal estándar (QLV), pudimos extraer valores para las rigideces instantáneas (G0) y de equilibrio (G∞), la constante de tiempo de relajación (τ) y la resistencia a la tracción final (σ f) de las fibras zonulares de ratones de tipo salvaje, así como aquellos que carecen de LTBP-24 o MAGP-1. Los valores de G0 y G∞ obtenidos para animales de tipo salvaje en ambos estudios varían de 6,7 x 104 Pa a 2,3 x 105 Pa, un rango ampliamente comparable a los encontrados en fibras mucho más grandes derivadas dezonulas humanas, bovinas y porcinas (1,8 x 105-1,5 x 106 Pa)12,13, 14,15,16. Este acuerdo entre especies sugiere que estas son características universales de estas fibras, y nos da la confianza de que se pueden extraer parámetros viscoelásticos significativos con nuestro método.
Un paso crítico para obtener respuestas viscoelásticas de calidad es la orientación del ojo disecado pegado a la plataforma (paso 2.1.9). La inclinación menor (menos de 10 °) no parece afectar significativamente los resultados. Los experimentos realizados fuera de este límite pueden generar curvas con formas que se desvían de las que se muestran en la Figura 4. Por ejemplo, algunas de esas curvas pueden poseer dos picos anchos en lugar de uno.
Idealmente, el procedimiento descrito en este artículo se habría realizado sin fijación de los ojos, lo que limita nuestra capacidad para evaluar los verdaderos parámetros viscoelásticos de las fibras zonulares frescas. Sin embargo, después de que nuestros experimentos preliminares no mostraron diferencias significativas entre las muestras fijas de paraformaldehído y las frescas, decidimos adoptar la fijación, ya que ofrecía varias ventajas. Como se menciona en el Protocolo, el uso de tejidos fijos ayuda a preservar el estiramiento nativo de las fibras para los experimentos de pull-up. Además, encontramos que la fijación promovió una mayor adhesión del pegamento UV a la cápsula del ojo, reduciendo así las posibilidades de que la sonda se desprendiera de la lente durante la acción de pull-up, como se experimenta comúnmente con muestras frescas (el desprendimiento de la sonda se puede reconocer fácilmente como un retorno repentino de la fuerza a un nivel basal). La fijación también evitó el pandeo de la pared del ojo en la dirección del tirón. A pesar de esta limitación, nuestro método proporciona un enfoque robusto para determinar la contribución relativa de los componentes proteicos a las propiedades viscoelásticas de las fibras zonulares.
Aunque nuestro trabajo hasta la fecha se ha centrado en la contribución de proteínas específicas, el método podría adaptarse fácilmente para estudiar el efecto de factores externos a las fibras sobre sus propiedades mecánicas. Tales factores incluyen la temperatura, el pH, la concentración de calcio y la presencia o ausencia de enzimas de reticulación. Las mediciones de alta precisión podrían lograrse utilizando nuestro método en modo diferencial, es decir, pretensando las fibras zonulares con una tensión / tensión inicial, y luego leyendo la diferencia de tensión que se produce cuando se alteran las condiciones externas. Algunas de estas intervenciones pueden posiblemente afectar la elasticidad de los tejidos que rodean la zónula y, por lo tanto, producir cambios en la tensión que compiten con los generados en la zónula. Se necesitarían mediciones de control con tejidos aislados para evaluar su relevancia para los experimentos propuestos. Esperamos que tales efectos puedan ser insignificantes, según las observaciones con la cámara lateral que muestran que los tejidos contiguos se comportan como materiales altamente rígidos que esencialmente no sufren deformación, incluso cuando las fibras zonulares están completamente estiradas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por NIH R01 EY029130 (S.B.) y P30 EY002687 (S.B.), R01 HL53325 y la Fundación de Investigación Ines Mandl (R.P.M.), la Fundación Marfan, y una subvención sin restricciones al Departamento de Oftalmología y Ciencias Visuales de la Universidad de Washington de Investigación para Prevenir la Ceguera. J.R. también recibió una subvención de la Universidad de Ciencias de la Salud y Farmacia en apoyo de este proyecto.
Materiales
| Name | Company | Catalog Number | Comments |
| 1/4-20 hex screws 3/4 inch long | Thorlabs | SH25S075 | |
| 1/4-20 nut | Hardware store | ||
| 3D SLA printer | Anycubic | Photon | |
| 4-40 screws 3/8 inch long, 2 | Hardware store | ||
| Capillaries, OD 1.2 mm and 3 inches long, no filament | WPI | 1B120-3 | |
| Cyanoacrylate (super) glue | Loctite | ||
| Digital Scale accurate to 0.01 g | Vernier | OHAUS Scout 220 | |
| Excel | Microsoft | Spreadsheet | |
| Gas cigarette lighter | |||
| Inspection/dissection microscope | Amscope | SKU: SM-4NTP | Working distance ~ 15 cm |
| Micromanipulator, Economy 4-axis | WPI | Kite-L | |
| Motorized micrometer | Thorlabs | Z812B | |
| Negative cylindrical lens | Thorlabs | LK1431L1 | -75 mm focal length |
| Petri dishes, 50 mm | |||
| Post holder, 3 inches | Thorlabs | PH3 | |
| Post, 4 inches | Thorlabs | TR4 | |
| Scale logging software | Vernier | LoggePro | |
| Servo motor controller | Thorlabs | KDC101 | |
| Servo motor controller software | Thorlabs | APT | |
| Slotted base, 1 | Thorlabs | BA1S | |
| Slotted bases, 2 | Thorlabs | BA2 | |
| Stand for micromanipular | WPI | M-10 | |
| USB-camera for microscope | Amscope | SKU: MD500 | |
| UV activated glue with UV source | Amazon |
Referencias
- Bassnett, S., Shi, Y., Vrensen, G. F. Biological glass: structural determinants of eye lens transparency. Philosophical Transactions of the Royal Society B Biological Sciences. 366 (1568), 1250-1264 (2011).
- Bassnett, S. Zinn's zonule. Progress in Retinal and Eye Research. 82, 100902(2021).
- Dureau, P. Pathophysiology of zonular diseases. Current Opinion in Ophthalmology. 19 (1), 27-30 (2008).
- Shi, Y., et al. Latent-transforming growth factor beta-binding protein-2 (LTBP-2) is required for longevity but not for development of zonular fibers. Matrix Biology. 95, 15-31 (2021).
- Ushiki, T. Collagen fibers, reticular fibers and elastic fibers. A comprehensive understanding from a morphological viewpoint. Archives of Histology and Cytology. 65 (2), 109-126 (2002).
- Bassnett, S. A method for preserving and visualizing the three-dimensional structure of the mouse zonule. Experimental Eye Research. 185, 107685(2019).
- Todorovic, V., Rifkin, D. B. LTBPs, more than just an escort service. Journal of Cellular Biochemistry. 113 (2), 410-418 (2012).
- Mecham, R. P., Gibson, M. A. The microfibril-associated glycoproteins (MAGPs) and the microfibrillar niche. Matrix Biology. 47, 13-33 (2015).
- Hubmacher, D., Reinhardt, D. P., Plesec, T., Schenke-Layland, K., Apte, S. S. Human eye development is characterized by coordinated expression of fibrillin isoforms. Investigative Ophthalmology & Visual Science. 55 (12), 7934-7944 (2014).
- Inoue, T., et al. Latent TGF-β binding protein-2 is essential for the development of ciliary zonule microfibrils. Human Molecular Genetics. 23 (21), 5672-5682 (2014).
- De Maria, A., Wilmarth, P. A., David, L. L., Bassnett, S. Proteomic analysis of the bovine and human ciliary zonule. Investigative Ophthalmology & Visual Science. 58 (1), 573-585 (2017).
- Wright, D. M., Duance, V. C., Wess, T. J., Kielty, C. M., Purslow, P. P. The supramolecular organization of fibrillin-rich microfibrils determines the mechanical properties of bovine zonular filaments. Journal of Experimental Biology. 202 (21), 3011-3020 (1999).
- Bocskai, Z. I., Sandor, G. L., Kiss, Z., Bojtar, I., Nagy, Z. Z. Evaluation of the mechanical behaviour and estimation of the elastic properties of porcine zonular fibres. Journal of Biomechanics. 47 (13), 3264-3271 (2014).
- Fisher, R. F. The ciliary body in accommodation. Transactions of the Ophthalmological Societies of the United Kingdom. 105, Pt 2 208-219 (1986).
- Michael, R., et al. Elastic properties of human lens zonules as a function of age in presbyopes. Investigative Ophthalmology & Visual Science. 53 (10), 6109-6114 (2012).
- van Alphen, G. W., Graebel, W. P. Elasticity of tissues involved in accommodation. Vision Research. 31 (7-8), 1417-1438 (1991).
- Green, E. M., Mansfield, J. C., Bell, J. S., Winlove, C. P. The structure and micromechanics of elastic tissue. Interface Focus. 4 (2), 20130058(2014).
- Jones, W., Rodriguez, J., Bassnett, S. Targeted deletion of fibrillin-1 in the mouse eye results in ectopia lentis and other ocular phenotypes associated with Marfan syndrome. Disease Models & Mechanisms. 12 (1), 037283(2019).
- Weinbaum, J. S., et al. Deficiency in microfibril-associated glycoprotein-1 leads to complex phenotypes in multiple organ systems. Journal of Biological Chemistry. 283 (37), 25533-25543 (2008).
- Comeglio, P., Evans, A. L., Brice, G., Cooling, R. J., Child, A. H. Identification of FBN1 gene mutations in patients with ectopia lentis and marfanoid habitus. British Journal of Ophthalmology. 86 (12), 1359-1362 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.