Method Article
Un nuevo modelo de insuficiencia cardíaca post-infarto de miocardio en la rata
En este artículo
Resumen
Desarrollamos con éxito un modelo fiable y reproducible de insuficiencia cardíaca post-infarto de miocardio en rata sin ventilación ni exteriorización del corazón. Esto simplifica el procedimiento y beneficia a los estudios posteriores sobre los posibles mecanismos detrás de la insuficiencia cardíaca.
Resumen
La ligadura de la arteria coronaria descendente anterior izquierda (DA) ha sido ampliamente utilizada para establecer el modelo de rata de insuficiencia cardíaca (IC) después de un infarto de miocardio (IM). Sin embargo, las desventajas de este modelo incluyen una alta tasa de mortalidad después de la ligadura y mayores variaciones tanto en el tamaño del infarto como en el grado de deterioro de la función cardíaca. Además, para los modelos anteriores es indispensable un ventilador o exteriorización del corazón, lo que complica el procedimiento durante la ligadura. En este estudio, desarrollamos un modelo fiable y reproducible sin el ventilador ni la exteriorización del corazón mediante la ligadura de la arteria coronaria LAD. Cuatro semanas después del procedimiento, encontramos que las concentraciones séricas de CK-MB, NT-proBNP y renina, que se utilizaron para ayudar en el diagnóstico de IM e IC, fueron significativamente más altas en el grupo de IM en comparación con el grupo simulado. Por el contrario, el valor de la fracción de eyección del ventrículo izquierdo (FEVI) en el grupo de IM fue obviamente menor que en el grupo simulado. Además, el tamaño del infarto y el área de fibrosis cardíaca se confirmaron individualmente y se analizaron cuantitativamente mediante tinción TTC y tinción tricrómica de Masson. Se encontraron variaciones más pequeñas en el tamaño del infarto o en el área de fibrosis en el grupo de IM, lo que ayudó a desarrollar un modelo confiable y reproducible de IC post-IM. Este nuevo modelo de HF post-IM en rata es vital para estudiar los posibles mecanismos de IM y HF. Este nuevo método se puede utilizar para desarrollar el nuevo fármaco para el tratamiento de la IM y la IC en ratas mediante el uso de estrategias farmacológicas.
Introducción
La insuficiencia cardíaca (IC) se considera un problema de salud pública mundial que afecta a más de 26 millones de pacientes y su prevalencia sigue aumentando1. La IC se define como cuando el corazón no bombea sangre tan bien como debería. Existen muchos factores de riesgo para la IC, incluyendo cardiopatía isquémica, diabetes, hipertensión, hipertrofia del VI, obesidad, tabaquismo, etc.2,3,4. El infarto de miocardio (IM) es una de las causas más comunes de IC5. Durante casi 50 años, la IC después del infarto de miocardio ha sido el principal impulsor de la morbilidad tardía, la mortalidad y el coste sanitario6. Para una mejor comprensión del mecanismo fisiopatológico de la IC y para prevenir y tratar la IC de manera más efectiva, se han desarrollado un gran número de modelos animales de IC post-IM para su estudio preclínico. Las ratas se utilizan típicamente debido a su fácil mantenimiento, menores costos, capacidad de controles y alta homología con los humanos7,8,9. La ligadura de la arteria coronaria izquierda (LCA), especialmente la ligadura de la rama descendente anterior izquierda (LAD), es ampliamente utilizada para desarrollar el modelo de IC post-IM en la rata8.
Sin embargo, las cirugías que inducen infarto de miocardio en ratas suelen ser técnicamente difíciles de realizar debido a la alta variación, la operación complicada y la alta mortalidad10,11. A pesar de que se han reportado bastantes procedimientos, la gran mayoría de las cirugías requirieron ventilación después de la intubación traqueal o exteriorización del corazón. Esos métodos aumentaron el costo de la cirugía, dificultaron la operación y redujeron la seguridad del animal. Además, el grado de IC depende del sitio de ligadura de la LCA. La diversidad anatómica del ACV en ratas conduce a inconsistencias en el tamaño del infarto y los parámetros funcionales en el modelo de rata. Los diferentes sitios de ligadura de LCA causan un tamaño especial del infarto, que determina el grado de IC y la tasa de supervivencia.
En este estudio, nuestro objetivo fue crear un modelo post-IM de HF confiable y reproducible. Nuestros hallazgos permitieron cirugías de ratas sin un ventilador o exteriorización del corazón, lo que resultó en una alta tasa de supervivencia. Además, el sitio relativamente fijo de la ligadura de la DA condujo a menos variaciones de la IC 4 semanas después de la cirugía. Además, hemos evaluado los efectos del modelo de IC mediante el uso de tinción histopatológica, detección bioquímica y medición de la función cardíaca, lo que ha ayudado a estudiar los posibles mecanismos detrás de la enfermedad y desarrollar nuevos fármacos para tratar la IC.
Protocolo
El protocolo fue aprobado por el Comité de Investigación de Ética Animal de la Universidad de Medicina Tradicional China de Shandong.
NOTA: Las ratas Sprague-Dawley macho adultas, de 10 semanas de edad y con un peso de 180-220 g, se dividieron aleatoriamente en 2 grupos, simulado (n = 25) y MI (n = 35). Los animales se mantuvieron en un ciclo de luz/oscuridad de 12/12 h y recibieron agua y alimento ad libitum.
1. Anestesia y suministro continuo de oxígeno
- Colocar las ratas en una cámara de inducción y anestesiar con isoflurano al 3%.
- Para confirmar si la anestesia estaba lista, observe el reflejo de pellizco del dedo del pie. La anestesia es suficiente cuando desaparece el reflejo de pinzamiento del dedo del pie.
- Mueva individualmente a las ratas a una pequeña tabla de cirugía con temperatura controlada. Pega las patas de la rata a la tabla.
- Coloque una máscara en la cara de la rata que proporcione un suministro constante de 3% de isoflurano y 1% de oxígeno.
2. Inducción de infarto de miocardio sin ventilación ni exteriorización del corazón
- Use cremas depilatorias para eliminar los pelos del tórax para la esterilización.
- Use un paño estéril con un orificio de 1 cm x 3 cm en el campo quirúrgico de la rata.
- Confirme la profundidad suficiente de la anestesia con un pellizco en el dedo del pie antes de operar.
- Abrir el tórax con una incisión transversal de 2,5 cm entre el tercer y cuarto espacio intercostal en el borde izquierdo del esternón sin cortar las costillas.
- Separe los músculos pectoral mayor y pectoral menor mediante el uso de dos pinzas vasculares sin cortar el tejido ni los vasos sanguíneos pequeños. Coloque el retractor autorretenedor Weitlaner en el tórax para separar la tercera y la cuarta costilla para obtener suficiente exposición del corazón mientras se mantiene la integridad de las costillas.
- Diseccionar delicadamente el pericardio con dos pinzas.
- Utilice una sutura de nailon 6/0 con una aguja curva para ligar permanentemente el DAA 2,0-2,5 mm por debajo del punto medio del cono arterioso y la conexión de la orejuela auricular izquierda. La LAD se puede reconocer fácilmente y se encuentra en algunas ratas.
- Confirmar la ligadura apropiada de la DA después de que la pared anterior del ventrículo izquierdo se volviera pálida.
- En el grupo simulado, pase solo la sutura por debajo de la DA, pero no se agare.
- Retire el retractor y exprima el aire del tórax antes de suturar el músculo y la piel capa por capa.
- Después de la cirugía, coloque a las ratas en una almohadilla térmica a 37 °C para su recuperación. Monitoree a todos los animales y proporcione ketoprofeno (5 mg/kg SC) para la analgesia cada 24 horas hasta 72 horas.
NOTA: Por razones técnicas, se prefieren ratas con pesos corporales más pequeños (menos de 250 g) para esta operación. El tiempo de mantener el pecho abierto, desde el paso 2.4 hasta el 2.8, se limitó a 5 minutos.
3. Evaluación de la función cardíaca
NOTA: Para confirmar si la IC se desarrolló con éxito, se midió la función cardíaca 4 semanas después del procedimiento utilizando un sistema de ultrasonido TE7 equipado con un transductor electrónico de 13 MHz. Durante la prueba de ecocardiografía, las ratas fueron sometidas al mismo protocolo de anestesia utilizado para el procedimiento inicial.
- Después de afeitar el vello anterior del pecho, coloque las ratas en el tablero utilizado para la operación anterior.
- Coloque la sonda en la pared torácica anterior y obtenga imágenes de las vistas del eje largo paraesternal izquierdo (PLAX) del ventrículo izquierdo (VI) (a nivel de los músculos papilares).
- Mida las dimensiones internas del ventrículo izquierdo al final de la diástole (LVIDd) y al final de la sístole (LVID) en modo M a partir de tres ciclos cardíacos consecutivos.
- Calcule la fracción de eyección de BT (FEVI) y el acortamiento fraccional de VI (LVFS) mediante el software de la máquina.
4. Análisis adicional del modelo de IC 4 semanas después de la ligadura de la DA
- Sacraficar a las ratas 4 semanas después de la ligadura de la DA administrando una sobredosis de isoflurano. Mida las concentraciones séricas de CK-MB, péptido natriurético procerebral N-terminal (NT-proBNP), renina, angiotensina (AngII), aldosterona (ALD), TNF-α, VEGF, IL-6 y HIF-1α utilizando los kits ELISA de acuerdo con el protocolo del fabricante.
- Para recolectar los corazones para el análisis histopatológico, perfundir los corazones de rata con solución salina fisiológica a 4 °C antes de retirarlos.
- Coloque los corazones en formol al 10% durante 24 horas, insértelos en parafina y corte transversalmente en secciones de 5,0 μm de grosor a lo largo del eje ventricular izquierdo.
- Monte todas las secciones del corazón en portaobjetos de vidrio y tiña individualmente con hematoxilina y eosina (HE) y tricrómico de Masson.
- Con el fin de medir el tamaño del infarto, tiña los corazones con cloruro de 2,3,5-trifenil tetrazolio (TTC).
- Cortar los corazones transversalmente a 3 mm de grosor desde el ápice hasta la base en estado semicongelado e incubar en una solución de TTC al 2% durante 20 minutos a 37 °C.
- Cuando se haya establecido el color, fije las rodajas en una solución de paraformaldehído al 4% durante 15 minutos y tome fotografías.
- Marque el tamaño del infarto y calcule mediante ImageJ. Exprese el tamaño del infarto como un porcentaje del área del infarto en comparación con el área total del VI.
- Para analizar cuantitativamente el contenido de colágeno en el centro de la zona infartada de LV, tiñe las secciones de tejido del corazón de rata con tricrómico de Masson.
- Después de la tinción, escanee las imágenes y analícelas. Evaluar el grado de fibrosis por la fracción de volumen de colágeno (CVF) que se expresó como porcentaje del área fibrótica versus el área total del VI.
Resultados
El procedimiento se realizó con una baja tasa de mortalidad. Los instrumentos clave utilizados para este experimento son el retractor autorretenedor Weitlaner (13,5 cm) y el vaporizador de isoflurano que se muestran en la Figura 1. El modelo de infarto de miocardio se desarrolló sin ventilación ni exteriorización del corazón como se describe en el protocolo. Durante todo el procedimiento, todas las costillas se mantuvieron en integridad y todo el procedimiento duró unos 10 minutos. El diagrama esquemático del sitio de ligadura quirúrgica se muestra en la Figura 2. En este estudio, 2 ratas murieron de fibrilación ventricular durante el procedimiento de ligadura en el grupo de infarto de miocardio, y 1 rata murió debido a una hemorragia después de que el corazón fuera perforado accidentalmente por la aguja curva en el grupo simulado. La tasa de mortalidad fue de alrededor del 5% durante todo el experimento.
La función cardíaca de las ratas se redujo significativamente en el grupo IM y se desarrolló con éxito la IC. Se obtuvieron mediciones ecocardiográficas en ratas 4 semanas después del procedimiento para evaluar los efectos de los modelos de IC (Figura 3). Con base en las guías de la ESC de 2016 para el diagnóstico y tratamiento de la insuficiencia cardíaca aguda y crónica12, las ratas con FEVI inferior al 50% se consideran modelos exitosos de IC. Los principales parámetros relacionados con la insuficiencia cardíaca se resumieron en la Tabla 1. Al comparar el grupo de IM con el grupo simulado, la FEVI en el grupo de IM se redujo significativamente (32,7% ± 8,0 VS 75,3% ± 4,9, P<0,001). Estas disminuciones significativas de FS y aumentos de LVIDd y LVIDs en el grupo de IM fueron buenos signos de IC. Además, los cambios en la estructura ventricular se observaron en las imágenes ecográficas (Figura 3). La cámara del VI se hizo más grande, y la pared del VI se hizo más delgada y rígida en el grupo IM en comparación con la simulación.
Evaluación de biomarcadores de IM e IC post-IM mediante ELISA
Como se muestra en la Figura 4 y la Figura 5, las concentraciones séricas del marcador cardíaco CK-MB utilizado para ayudar en el diagnóstico de IM aumentaron significativamente más de 3 veces en el grupo de IM. Mientras tanto, algunos parámetros relacionados con la insuficiencia cardíaca, como la renina, la AngII y las concentraciones séricas de ALD, fueron más altos en comparación con el grupo simulado 4 semanas después del procedimiento. Las concentraciones de NT-proBNP en el grupo de IM fueron 13 veces mayores que en el grupo simulado. Además, las concentraciones de citocinas proinflamatorias en el grupo de IM, incluidos el TNF-α y la IL-6, aumentaron en un 400% y un 300% en comparación con el grupo simulado. Mientras tanto, los factores representativos relacionados con la angiogénesis como el VEGF y el HIF-1α también fueron significativamente más altos en 2 y 5 veces en el grupo de IM en comparación con el grupo simulado.
Alteraciones morfológicas y análisis histopatológicos
En el grupo IM, el análisis morfológico de los corazones reveló una pared VI delgada y pálida, así como formación de cicatrices fibrosas (Figura 6). Además, también se verificó el infarto de miocardio mediante tinción TTC y se analizó el tamaño del infarto (Figura 6). El tamaño del infarto fue de 40,7±4,4% a las 4 semanas del procedimiento en el grupo IM, lo que demostró la fiabilidad y estabilidad del nuevo método de IC post-IM. Para la tinción de HE, la evaluación microscópica mostró una disposición ordenada de las fibras miocárdicas sin cambios inflamatorios en el grupo simulado. Sin embargo, las fibras miocárdicas se convirtieron en una disposición laxa e irregular con infiltrados celulares inflamatorios en el grupo IM (Figura 7a). Además, la tinción tricrómica de Masson reveló que las áreas de fibrosis cardíaca estaban aumentadas en el grupo de IM (Figura 7a), y la fracción de volumen de colágeno (FVC) fue del 39,2±6,9% en el grupo de IM. Los resultados de la tinción tricrómica de Masson fueron consistentes con la tinción TTC, lo que confirmó aún más el desarrollo exitoso de los modelos MI y HF (Figura 7b, 7c).

Figura 1. Se utilizaron instrumentos clave para establecer el modelo de IM. a) El retractor autorretenedor Weitlaner (13,5 cm) (tercero desde la izquierda); b) El equipo de suministro de oxígeno; c) El vaporizador de isoflurano. Haga clic aquí para ver una versión más grande de esta figura.
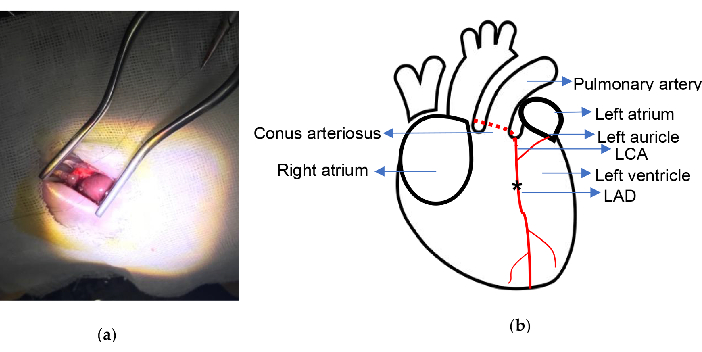
Figura 2. Esquema experimental. (a) Exposición del corazón con el retractor autorretenedor Weitlaner; (b) Se indica el lugar de ligadura. El asterisco ilustra la posición de ligadura. LCA: arteria coronaria izquierda; DA: descendente anterior izquierda. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Mediciones ecocardiográficas. (a) Las imágenes representativas de las estructuras del ventrículo izquierdo del grupo simulado y del IM probadas por M-Mode durante 3 ciclos cardíacos después de 4 semanas del procedimiento; (b) FEVI de ratas después de 4 semanas del procedimiento del grupo simulado (n= 24) e IM (n=33). IM: infarto de miocardio. FEVI: fracción de eyección del ventrículo izquierdo. P < 0,001 en comparación con el grupo simulado. Haga clic aquí para ver una versión más grande de esta figura.
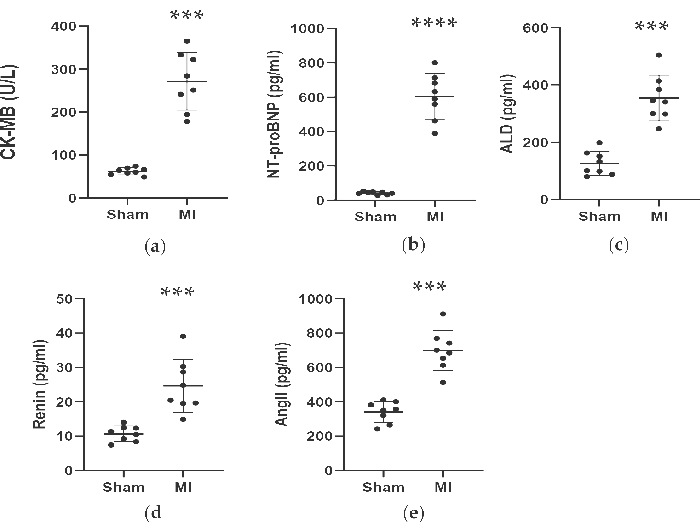
Figura 4. Las concentraciones de CK-MB, NT-proBNP, ALD, Renina y AngII se incrementaron 4 semanas después de la ligadura de LAD. Los datos se expresaron como media ± DE (n = 8 animales en cada grupo). IM: infarto de miocardio; DA: descendente anterior izquierda. P < 0,001 en comparación con el grupo simulado. P < 0,0001 en comparación con el grupo simulado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Las concentraciones de TNF-α, IL-6, VEGF y HIF-α aumentaron 4 semanas después de la ligadura de LAD. (a, b) Las concentraciones de TNF-α e IL-6 asociadas con la respuesta inflamatoria aumentaron 4 semanas después de la ligadura de LAD; c, d) Las concentraciones de VEGF y HIF-α asociadas con la angiogénesis aumentaron 4 semanas después de la ligadura de LAD. Los datos se expresan como media ± DE (n = 8 animales en cada grupo). DA: descendente anterior izquierda; IM: infarto de miocardio. **P < 0,01 en comparación con el grupo simulado. P < 0,001 en comparación con el grupo simulado. Haga clic aquí para ver una versión más grande de esta figura.
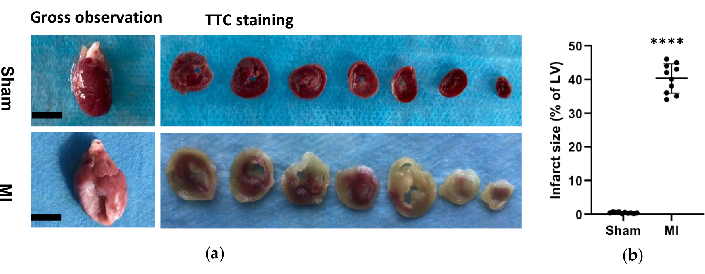
Figura 6. Análisis morfológico de los corazones. (a) Observación macroscópica e histología de corazones de rata de grupos simulados y MI 4 semanas después del procedimiento. El corazón del infarto de miocardio mostraba una pared del ventrículo izquierdo más delgada y grande en comparación con la simulación; Para los corazones teñidos con TTC del grupo simulado y MI, el tejido viable se tiñó de rojo y el área del infarto estaba pálida y sin teñir. (b) El tamaño del infarto de miocardio se expresó como el porcentaje del área del infarto en relación con el VI completo. Los datos se expresan como media ± DE (n = 10 animales en cada grupo).IM: infarto de miocardio; TTC: cloruro de trifenil tetrazolio; VI: ventrículo izquierdo. Barra de escala = 5 mm. ****P < 0,0001 en comparación con el grupo simulado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7. Tinción tricrómica de HE y Masson en el tejido del corazón de rata 4 semanas después del procedimiento. (a) La pared del VI del corazón del IM se volvió más delgada que el grupo simulado (HE×10, barra de escala = 2 mm). La evaluación microscópica mostró una disposición ordenada de las fibras miocárdicas sin cambios inflamatorios en el grupo simulado y mostró una disposición laxa e irregular con infiltrados celulares inflamatorios en el grupo IM (HE×200, barra de escala = 100 μm); (b) La tinción tricrómica de Masson del tejido cardíaco muestra la fibrosis miocárdica como azul en el grupo IM (barra de escala = 2 mm). (c) Fracción de volumen de colágeno para la tinción tricrómica de Masson en cortes de tejido ventricular izquierdo de los grupos simulado y MI. Los datos se expresan como media ± DE (n = 6 animales en el grupo IM). HE, hematoxilina y eosina; IM: infarto de miocardio; VI: ventrículo izquierdo. P < 0,0001 en comparación con el grupo simulado. Haga clic aquí para ver una versión más grande de esta figura.
| Parámetros | Grupo simulado (n=24) | Grupo MI (n=33) |
| VIDd (mm) | 8.3±1.3 | 10,1±2,9* |
| VID (mm) | 4.1±0.9 | 7,7±1,5*** |
| FS (%) | 42,5±7,8 | 22.2±4.4*** |
Tabla 1: Datos ecocardiográficos de ratas en el grupo simulado e IM 4 semanas después de la ligadura de LAD. Los datos se expresaron como media ± DE. IM, infarto de miocardio; LVIDd: dimensiones internas del ventrículo izquierdo al final de la diástole al final de la diástole; VIVI: dimensiones internas del ventrículo izquierdo al final de la sístole; FS%, porcentaje de manteca fraccional. *P < 0,05, en comparación con el grupo simulado. P < 0,001 en comparación con el grupo simulado.
Discusión
A pesar de que existen muchos modelos de IM o IC en roedores 13,14,15, este estudio ha desarrollado un procedimiento novedoso y eficiente de ligadura de DA para inducir IC post-IM en ratas. Sin embargo, en este nuevo modelo de HF en ratas, se eliminaron las necesidades de intubación y ventilación o exteriorización del corazón, lo que aumentó significativamente la tasa de supervivencia de las ratas. Para desarrollar este nuevo modelo de HF en ratas, la inducción de IM es un paso crucial. En comparación con los protocolos convencionales que solían implicar intubación y ventilación o exteriorización del corazón durante la ligadura 9,16,17, desarrollamos un abordaje mejorado, sin ventilación ni exteriorización del corazón por primera vez, lo que permitió una mayor tasa de supervivencia. Vale la pena señalar que el procedimiento mejorado conduce a menos daño tisular. Por lo tanto, las ratas tienen una recuperación postoperatoria mucho más rápida y una tasa de supervivencia más alta. Los siguientes dos puntos nos permitieron alcanzar estos resultados: En primer lugar, la inhalación continua de oxígeno durante todo el procedimiento permitió una oxigenación y ligadura suficientes sin ventilación. En segundo lugar, se utilizó el retractor autorretenedor Weitlaner, un instrumento quirúrgico clave, para obtener suficiente exposición al corazón mientras se mantenía la integridad de las costillas, lo que ayudó a evitar la exteriorización del corazón.
Es bien sabido que el desarrollo exitoso de la IC post-IM en ratas depende en gran medida del tamaño del infarto, que está relacionado con el sitio de ligadura del LCA. Ya en 1979, Marc A. Pfeefer y sus colegas informaron que la oclusión de LCA en ratas podía proporcionar fácilmente infartos de pared libre del ventrículo izquierdo de diferentes tamaños18. Para reducir la variación del tamaño de los infartos y desarrollar un modelo de IC más estable después del infarto de miocardio, la ligadura de la DA se ha utilizado comúnmente en ratas para inducir el infarto ventricular izquierdo con fines de investigación19. La principal ventaja de la oclusión de la DA es que permite una ligadura precisa de esta arteria para inducir un infarto de miocardio estable que puede causar IC mientras se mantiene una tasa de supervivencia mucho más alta. En nuestro procedimiento, elegimos la posición de ligadura 2,0-2,5 mm por debajo del punto medio de la conexión entre el cono arterioso y la orejuela auricular izquierda, que resultó exitosa y estable, con menos variaciones en la FEVI entre todas las ratas del grupo IM. Además, determinamos individualmente el tamaño del infarto mediante tinción TTC y el grado de fibrosis mediante tinción de Masson, las cuales han sido ampliamente utilizadas para evaluar este tipo de modelo 20,21,22. Por su parte, las menores variaciones de este modelo también se ilustraron a través de alteraciones morfológicas y análisis histopatológicos.
También estudiamos algunos parámetros relacionados con el IM y la IC después de 4 semanas de la ligadura de la DA para ayudar a confirmar el desarrollo de IC después del IM. La ecocardiografía tiene la capacidad de medir de manera precisa y no invasiva la función ventricular y evaluar las causas de la cardiopatía estructural23. Las FEVI de los ratones del grupo de IM estaban todas por debajo del 50%, lo que podría considerarse como HF12. De acuerdo con estos resultados, la concentración de NT-proBNP aumentó en consecuencia, lo que también fue un indicador importante de deterioro de la función cardíaca. Existe una amplia evidencia de inflamación y apoptosis en el corazón isquémico24, 25. La inflamación y la insuficiencia cardíaca están fuertemente interconectadas y se refuerzan mutuamente26. En nuestro estudio, evaluamos el aumento significativo de los factores inflamatorios, IL-6 y TNF-a. El sistema renina-angiotensina-aldosterona (SRAA) activado por hipoperfusión renal y activación simpática es una característica central en la fisiopatología de la insuficiencia cardíaca27. Evaluamos los parámetros implicados en el SRAA y encontramos que el nivel sérico de renina fue significativamente mayor en el grupo IM en comparación con el grupo simulado, lo que verificó aún más el desarrollo de IC.
Hay dos puntos principales de énfasis durante el procedimiento de ligadura de LAD. En primer lugar, durante todo el procedimiento y hasta que se recuperen de la anestesia, proporcionar un suministro continuo de oxígeno a los animales y al mismo tiempo mantenerlos calientes. En segundo lugar, la posición de la ligadura en la DA tiene un papel clave en el tamaño del infarto y en el grado de IC. El sitio 2,0-2,5 mm por debajo del punto medio de la conexión entre el cono arterioso y la orejuela auricular izquierda es apropiado para un modelo de IC estable y exitoso con menor tasa de mortalidad. Sin embargo, la limitación del nuevo modelo de IC en ratas es que el procedimiento quirúrgico para desarrollar IM sin ventilación es técnicamente exigente y desafiante. El paso clave para lograr este modelo es obtener suficiente exposición del corazón para visualizar completamente el corazón dentro del tórax y limitar el tiempo que el tórax está abierto a 5 minutos, lo que requiere más práctica antes del experimento formal.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este modelo fue desarrollado con el apoyo del Centro de Co-Innovación de Shandong de Fórmula TCM Clásica, Departamento de Educación Provincial de Shandong. Nos gustaría agradecer al Dr. Lianfeng Wu por realizar la ecocardiografía en este estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| 2% TTC solution | Solarbio | T8170-1 | |
| ELISA kits | Shanghai BlueGene Biotech CO., LTD | ||
| Forceps | shinva | ||
| H&E Staining Kit | abcam | ab245880 | |
| Isoflurane | RWD | 100 mL | |
| Kotoprofen | Zoetis | KETOFEN | |
| nylon suture 6-0 | AD surgical | #S-N618R13 | with needle |
| Scalpel blades | shinva | s2646 | |
| Scalpel Handles | shinva | ||
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15-1KT | |
| Ultrasound | Mindray | TE7 | |
| Veterinary Vaporizer | Matrix | vip-3000 | |
| Weitlaner Self-Retaining Retractor | shinva | ZV077RN |
Referencias
- Savarese, G., Lund, L. H. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 3 (1), 7-11 (2017).
- Ziaeian, B., Fonarow, G. C. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 13 (6), 368-378 (2016).
- Meijers, W. C., de Boer, R. A. Common risk factors for heart failure and cancer. Cardiovascular Research. 115 (5), 844-853 (2019).
- Triposkiadis, F., Xanthopoulos, A., Butler, J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. Journal of the American College of Cardiology. 74 (6), 804-813 (2019).
- Tanai, E., Frantz, S. Pathophysiology of Heart Failure. Comprehensive Physiology. 6 (1), 187-214 (2015).
- Cahill, T. J., Kharbanda, R. K. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk. World Journal Of Cardiology. 9 (5), 407-415 (2017).
- Houser, S. R., et al. Animal models of heart failure: a scientific statement from the American Heart Association. Circulation Research. 111 (1), 131-150 (2012).
- Patten, R. D., Hall-Porter, M. R. Small animal models of heart failure: development of novel therapies, past and present. Circulation Heart Failure. 2 (2), 138-144 (2009).
- Chen, J., et al. Ischemic Model of Heart Failure in Rats and Mice. Methods in Molecular Biology. 1816, Clifton, NJ. 175-182 (2018).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Goldman, S., Raya, T. E. Rat infarct model of myocardial infarction and heart failure. Journal of Cardiac Failure. 1 (2), 169-177 (1995).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure. 18 (8), 891-975 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Henri, O., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 133 (15), 1484-1497 (2016).
- Fu, Y. H., et al. A novel rat model of chronic heart failure following myocardial infarction. Methods and Findings in Experimental and Clinical Pharmacology. 31 (6), 367-373 (2009).
- Pfeffer, M. A., et al. Myocardial infarct size and ventricular function in rats. Circulation Research. 44 (4), 503-512 (1979).
- Samsamshariat, S. A., Samsamshariat, Z. A., Movahed, M. R. A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats. Cardiovascular Revascularization Medicine: Including Molecular Interventions. 6 (3), 121-123 (2005).
- Redfors, B., Shao, Y., Omerovic, E. Myocardial infarct size and area at risk assessment in mice. Experimental and Clinical Cardiology. 17 (4), 268-272 (2012).
- Rüder, C., et al. Combinatorial G-CSF/AMD3100 treatment in cardiac repair after myocardial infarction. PloS One. 9 (8), 104644(2014).
- Valentin, J., Frobert, A., Ajalbert, G., Cook, S., Giraud, M. N. Histological Quantification of Chronic Myocardial Infarct in Rats. Journal of Visualized Experiments. (118), (2016).
- Kirkpatrick, J. N., Vannan, M. A., Narula, J., Lang, R. M. Echocardiography in heart failure: applications, utility, and new horizons. Journal of the American College of Cardiology. 50 (5), 381-396 (2007).
- Teringova, E., Tousek, P. Apoptosis in ischemic heart disease. Journal of Translational Medicine. 15 (1), 87(2017).
- Wang, X., Guo, Z., Ding, Z., Mehta, J. L. Inflammation, Autophagy, and Apoptosis After Myocardial Infarction. Journal of the American Heart Association. 7 (9), (2018).
- Van Linthout, S., Tschöpe, C. Inflammation - Cause or Consequence of Heart Failure or Both. Current Heart Failure Reports. 14 (4), 251-265 (2017).
- Orsborne, C., Chaggar, P. S., Shaw, S. M., Williams, S. G. The renin-angiotensin-aldosterone system in heart failure for the non-specialist: the past, the present and the future. Postgraduate Medical Journal. 93 (1095), 29-37 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados