Method Article
大鼠心肌梗死后心力衰竭的新模型
摘要
我们成功开发了一种可靠且可重复的大鼠心肌梗死后心力衰竭模型,无需心脏通气或体外化。这简化了程序,并有利于进一步研究心力衰竭背后的潜在机制。
摘要
左前降支 (LAD) 冠状动脉结扎已被广泛用于建立心肌梗死 (MI) 后心力衰竭 (HF) 的大鼠模型。然而,该模型的缺点包括结扎后死亡率高,以及梗死面积和心脏功能受损程度的变化较大。此外,以前的型号必不可少地使用呼吸机或心脏外化,这使得结扎过程中的过程复杂化。在这项研究中,我们开发了一种可靠且可重复的模型,无需呼吸机或通过结扎 LAD 冠状动脉进行心脏外化。手术后 4 周,我们发现用于辅助诊断 MI 和 HF 的 CK-MB 、 NT-proBNP 和肾素的血清浓度与假手术组相比,MI 组显着升高。相比之下,MI 组左心室射血分数 (LVEF) 值明显小于假手术组。此外,通过 TTC 染色和 Masson 三色染色分别确认和定量分析梗死面积和心脏纤维化面积。在 MI 组中,在梗死面积或纤维化区域方面发现较小的变化,这有助于开发可靠且可重复的 MI 后 HF 模型。大鼠 MI 后 HF 的这种新模型对于研究 MI 和 HF 的潜在机制至关重要。这种新方法可用于通过使用药理学策略开发治疗大鼠 MI 和 HF 的新药。
引言
心力衰竭 (HF) 被认为是一个全球性的公共卫生问题,影响着超过 2600 万患者,而且患病率仍在增加1。HF 被定义为心脏不能正常泵血。HF 的危险因素很多,包括缺血性心脏病、糖尿病、高血压、LV 肥大、肥胖、吸烟等2,3,4。心肌梗塞 (MI) 是 HF5 的最常见原因之一。近 50 年来,心肌梗死后 HF 一直是晚期发病率、死亡率和医疗保健成本的主要驱动因素6。为了更好地了解 HF 的病理生理机制并更有效地预防和治疗 HF,已经开发了大量 MI 后动物 HF 模型用于临床前研究。通常使用大鼠是因为易于维护、成本较低、能够控制以及与人类高度同源性 7,8,9。左冠状动脉 (LCA) 结扎术,尤其是左前降支 (LAD) 结扎术,被广泛用于开发大鼠 MI 后 HF 模型8。
然而,由于变异性高、手术复杂和高死亡率,在大鼠中诱导 MI 的手术通常在技术上具有挑战性10,11。尽管已经报道了相当多的手术,但绝大多数手术需要在气管插管后进行通气或心脏外化。这些方法增加了手术成本,使手术更加困难,并降低了动物的安全性。此外,HF 的程度取决于 LCA 结扎的部位。大鼠 LCA 的解剖多样性导致大鼠模型中梗死面积和功能参数的不一致。LCA 的不同连接部位导致特殊的梗死面积,这决定了 HF 的程度和存活率。
在这项研究中,我们旨在创建一个可靠且可重复的 HF 后 MI 模型。我们的研究结果允许在没有呼吸机或心脏外置术的情况下对大鼠进行手术,这导致了高存活率。此外,LAD 结扎部位相对固定导致术后 4 周 HF 的变化较少。此外,我们通过使用组织病理学染色、生化检测和心脏功能测量评估了 HF 模型的效果,这有助于研究疾病背后的潜在机制并开发治疗 HF 的新药。
研究方案
该方案得到了山东中医药大学动物伦理学研究委员会的批准。
注:将 10 周龄、体重 180-220 g 的成年雄性 Sprague-Dawley 大鼠随机分为 2 组,假手术 (n = 25) 和 MI (n = 35)。将动物保持在 12/12 小时的光照/黑暗循环中,并随意接受水和食物。
1. 麻醉和持续供氧
- 将大鼠放入诱导室中,用 3% 异氟醚麻醉。
- 要确认麻醉是否准备好,请观察脚趾捏反射。当脚趾捏反射消失时,麻醉就足够了。
- 将大鼠单独移至小型温控手术板上。将老鼠的爪子粘在板上。
- 在大鼠脸上戴上面罩,提供 3% 异氟醚和 1% 氧气的恒定供应。
2. 在没有通气或心脏外化的情况下诱导心肌梗死
- 使用脱毛膏去除胸毛进行消毒。
- 在大鼠的手术区域使用带有 1 cm x 3 cm 孔的无菌窗帘。
- 手术前用脚趾捏确认足够的麻醉深度。
- 在胸骨左缘的第三和第四肋间隙之间用一个 2.5 cm 的横向切口打开胸部,不要切开肋骨。
- 使用两个血管镊子将胸大肌和胸小肌分开,而不切割组织或小血管。将 Weitlaner 自保持牵开器放入胸部,以分离第三和第四肋骨,从而在保持肋骨完整性的同时获得足够的心脏暴露。
- 用两个镊子仔细解剖心包。
- 使用带有弯曲针的 6/0 尼龙缝合线在动脉圆锥和左心耳连接中点下方 2.0-2.5 毫米处永久结扎 LAD。LAD 很容易识别,并在一些大鼠中被发现。
- 在左心室前壁变白后,确认 LAD 的适当结扎。
- 在假手术组中,仅在 LAD 下通过缝合线,但不进行结扎。
- 取下牵开器,将胸部中的空气挤出,然后逐层缝合肌肉和皮肤。
- 手术后,将大鼠放在 37 °C 加热垫上进行恢复。监测所有动物,并每 24 小时提供酮洛芬 (5 mg/kg SC) 用于镇痛,直至 72 小时。
注意:由于技术原因,体重较小(小于 250 克)的大鼠是此作的首选。从第 2.4 步到 2.8 步,保持胸部打开的时间限制为 5 分钟。
3. 心脏功能评估
注意:为了确认 HF 是否成功发展,在手术后 4 周使用配备 7 MHz 电子换能器的 TE13 超声系统测量了心脏功能。在超声心动图测试期间,大鼠接受与初始手术相同的麻醉方案。
- 剃掉前胸毛后,将大鼠放在用于先前手术的板上。
- 将探头放在前胸壁上,并从左心室 (LV) 的左胸骨旁长轴 (PLAX) 视图(在肌水平)获取图像。
- 通过连续三个心动周期的 M 模式测量舒张末期 (LVIDd) 和收缩末期 (LVID) 的左心室内部尺寸。
- 通过机器的软件计算 LV 射血分数 (LVEF) 和 LV 缩短分数 (LVFS)。
4. LAD 结扎后 4 周 HF 模型的进一步分析
- LAD 结扎后 4 周通过施用过量的异氟醚对大鼠进行骶洗。根据制造商的方案,使用 ELISA 试剂盒测量 CK-MB、N 末端脑钠肽前体 (NT-proBNP)、肾素、血管紧张素 (AngII)、醛固酮 (ALD)、TNF-α、VEGF、IL-6 和 HIF-1α 的血清浓度。
- 为了收获心脏进行组织病理学分析,在取出大鼠心脏之前,用4°C生理盐水灌注大鼠心脏。
- 将心脏放入 10% 福尔马林中 24 小时,包埋在石蜡中,并沿左心室轴横向切成 5.0 μm 厚的切片。
- 将心脏的所有部分安装在载玻片上,并用苏木精和伊红 (HE) 以及 Masson 三色单独染色。
- 为了测量梗死面积,用 2,3,5-三苯基四唑氯化物 (TTC) 染色心脏。
- 在半冷冻状态下,将心从顶端到基部横向切成 3 mm 厚的切片,并在 37 °C 下在 2% TTC 溶液中孵育 20 分钟。
- 确定颜色后,将切片在 4% 多聚甲醛溶液中固定 15 分钟并拍照。
- 标记梗塞大小并使用 ImageJ 进行计算。将梗死面积表示为梗死面积与总 LV 面积的百分比。
- 为了定量分析 LV 梗塞区域中间的胶原蛋白含量,用 Masson 三色染色大鼠心脏组织切片。
- 染色后,扫描图像并进行分析。通过胶原蛋白体积分数 (CVF) 评估纤维化程度,该分数表示为纤维化面积与总 LV 面积的百分比。
结果
该手术的死亡率较低。本实验使用的关键仪器是 Weitlaner 自保持式牵开器 (13.5 cm) 和异氟醚蒸发器,如图 1 所示。MI 模型是在协议中描述的没有心脏通气或体外化的情况下开发的。在整个过程中,所有肋骨都保持完整,整个过程大约需要 10 分钟。手术结扎部位的示意图如图 2 所示。本研究中,MI 组 2 只大鼠在结扎过程中死于心室颤动,假手术组 1 只大鼠在心脏被弯针意外刺穿后因出血而死亡。整个实验的死亡率约为 5%。
MI 组大鼠心功能显著降低,HF 开发成功。手术后 4 周对大鼠进行超声心动图测量,以评估 HF 模型的效果(图3)。根据 2016 年 ESC 急性和慢性心力衰竭诊断和治疗指南12,LVEF 低于 50% 的大鼠被认为是成功的 HF 模型。与心力衰竭相关的主要参数总结于 表 1 中。当 MI 组与假手术组相比时,MI 组的 LVEF 显著降低 (32.7% ± 8.0 vs 75.3% ± 4.9,P<0.001)。MI 组 FS 的这些显着降低以及 LVIDd 和 LVID 的增加是 HF 的良好迹象。此外,从超声图像中可以看到心室结构的变化(图3)。与假手术相比,MI 组的 LV 腔室变得更大,而 LV 壁变得更薄、更硬。
通过 ELISA 评估 MI 和 MI 后 HF 的生物标志物
如图 4 和 图 5 所示,MI 组用于辅助诊断 MI 的心脏标志物 CK-MB 血清浓度显著升高了 3 倍以上。同时,与假手术组相比,术后 4 周与心力衰竭相关的一些参数如肾素、 AngII 和 ALD 血清浓度更高。MI 组 NT-proBNP 浓度比假手术组高 13 倍。此外,与假手术组相比,MI 组促炎细胞因子(包括 TNF-α 和 IL-6)的浓度分别增加了 400% 和 300%。同时,作为代表性的血管生成相关因子,如 VEGF 和 HIF-1α,MI 组也显著高于假手术组 2 倍和 5 倍。
形态学改变和组织病理学分析
在 MI 组中,心脏的形态学分析显示 LV 壁薄而苍白,并形成纤维状疤痕(图 6)。此外,还使用 TTC 染色验证了 MI 并测试了梗塞大小(图 6)。MI 组术后 4 周梗死面积为 40.7±4.4%,显示 MI 后 HF 新方法的可靠性和稳定性。对于 HE 染色,显微镜评估显示假手术组心肌纤维排列整齐,无炎症变化。然而,心肌纤维在 MI 组中变得松散和不规则,伴有炎性细胞浸润(图 7a)。此外,Masson 的三色染色显示 MI 组心脏纤维化面积增加 (图 7a),MI 组的胶原蛋白体积分数 (CVF) 为 39.2±6.9%。Masson 的三色染色结果与 TTC 染色一致,这进一步证实了 MI 和 HF 模型的成功开发(图 7b、7c)。

图 1.使用关键工具建立 MI 模型。 (a) Weitlaner 自保持牵开器 (13.5 cm)(左起第三);(b) 供氧设备;(c) 异氟醚蒸发器。 请单击此处查看此图的较大版本。
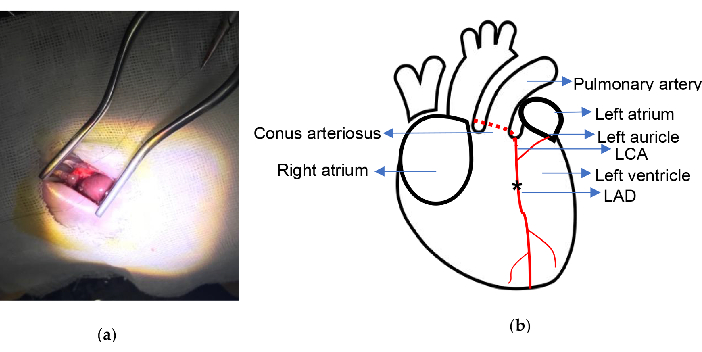
图 2.实验原理图。 (a) 使用 Weitlaner 自保持牵开器暴露心脏;(b) 标明连接位置。星号表示连接位置。LCA,左冠状动脉;LAD,左前下降。 请单击此处查看此图的较大版本。

图 3.超声心动图测量。 (a) 手术 4 周后 3 个心动周期内通过 M-Mode 测试的假组和 MI 组左心室结构的代表性图像;(b) 假手术 (n= 24) 和 MI (n=33) 组大鼠术后 4 周的 LVEF。MI,心肌梗塞。LVEF,左心室射血分数。P < 0.001 与假手术组相比。 请单击此处查看此图的较大版本。
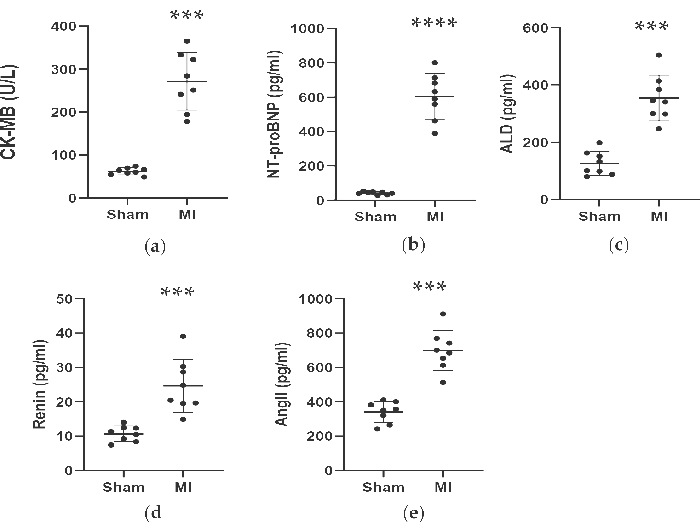
图 4.LAD 连接后 4 周 CK-MB 、 NT-proBNP 、 ALD 、 肾素 和 AngII 浓度升高。 数据表示为 SD ± 平均值 (每组 n = 8 只动物)。MI,心肌梗死;LAD,左前下降。P < 0.001 与假手术组相比。P < 0.0001 与假手术组相比。 请单击此处查看此图的较大版本。

图 5.LAD 连接后 4 周 TNF-α 、 IL-6 、 VEGF 和 HIF-α 浓度增加。 (a、b) LAD 连接后 4 周与炎症反应相关的 TNF-α 和 IL-6 浓度增加;(c, d)LAD 连接后 4 周,与血管生成相关的 VEGF 和 HIF-α 浓度增加。数据表示为 SD ±平均值 (每组 n = 8 只动物)。LAD,左前降;MI,心肌梗塞。**与假手术组相比,P < 0.01。P < 0.001 与假手术组相比。 请单击此处查看此图的较大版本。
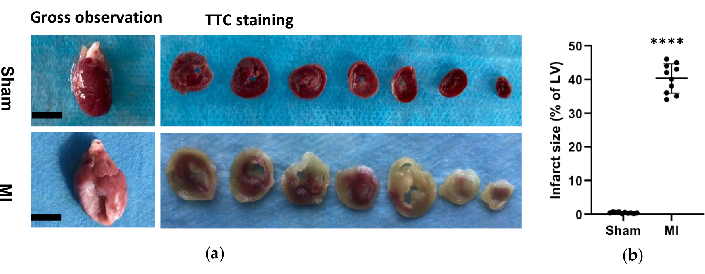
图 6.心脏的形态学分析。 (a) 手术后 4 周假手术组和 MI 组大鼠心脏的大体观察和组织学检查。与假手术相比,MI 心脏的左心室壁更薄、更大;对于 scase 和 MI 组的 TTC 染色心脏,活组织染成红色,梗死区域苍白且未染色。(b) MI 梗死面积表示为梗死面积相对于整个 LV 的百分比。数据表示为 SD ±平均值(每组 n = 10 只动物).MI,心肌梗死;TTC,三苯基四唑氯化物;LV,左心室。比例尺 = 5 毫米。****P < 0.0001 与假手术组相比。 请单击此处查看此图的较大版本。

图 7.手术后 4 周大鼠心脏组织的 HE 和 Masson 三色染色。 (a) MI 心脏 LV 壁变得比假手术组薄 (HE×10,比例尺 = 2 mm)。显微镜评估显示假手术组心肌纤维排列整齐,无炎症改变,MI 组显示松散且不规则排列,伴有炎症细胞浸润 (HE×200,比例尺 = 100 μm);(b) 心脏组织的 Masson 三色染色显示心肌纤维化在 MI 组中为蓝色(比例尺 = 2 mm)。(c) 假手术组和 MI 组左心室组织切片中 Masson 三色染色的胶原蛋白体积分数。数据表示为 SD ±平均值 (MI 组中 n = 6 只动物)。HE、苏木精和伊红;MI,心肌梗死;LV,左心室。P < 0.0001 与假手术组相比。 请单击此处查看此图的较大版本。
| 参数 | 假组 (n=24) | MI 组 (n=33) |
| LVIDd (毫米) | 8.3±1.3 | 10.1±2.9* |
| LVID (毫米) | 4.1±0.9 | 7.7±1.5*** |
| 满量程 (%) | 42.5±7.8 | 22.2±4.4*** |
表 1:LAD 结扎后 4 周假手术组和 MI 组大鼠的超声心动图数据。 数据表示为 SD ±平均值。心肌梗死、心肌梗死;LVIDd,舒张末期舒张末期左心室内部尺寸;LVIDs,收缩末期的左心室内部尺寸;FS%,分数起酥油百分比。*与假手术组相比,P < 0.05。P < 0.001 与假手术组相比。
讨论
尽管啮齿动物中有许多现有的 MI 或 HF 模型 13,14,15,但本研究开发了一种新颖有效的 LAD 连接程序,用于诱导大鼠 MI 后 HF。然而,在这种新的大鼠 HF 模型中,消除了插管和通气或心脏外化的需要,这显着提高了大鼠的存活率。为了开发这种新的大鼠 HF 模型,MI 的诱导是关键的一步。与通常涉及插管和通气或在结扎过程中心脏外化的传统方案相比 9,16,17,我们首次开发了一种改进的方法,既不通气也不体外化,从而获得更高的存活率。值得注意的是,改进的程序导致更少的组织损伤。因此,大鼠术后恢复更快,存活率更高。以下两点使我们能够取得这些结果:首先,在整个过程中持续吸入氧气,无需通气即可获得足够的氧合和结扎。其次,Weitlaner 自保持牵开器是一种关键的手术器械,用于在保持肋骨完整性的同时获得足够的心脏暴露,这有助于避免心脏外化。
众所周知,大鼠 MI 后 HF 的成功发展在很大程度上取决于梗死面积,这与 LCA 的连接部位有关。早在 1979 年,Marc A. Pfeefer 和他的同事就报告说,大鼠的 LCA 闭塞可以很容易地提供不同大小的左心室游离壁梗死18。为了减少梗死大小的变化并在 MI 后开发更稳定的 HF 模型,LAD 结扎已常用于大鼠以诱导左心室梗死用于研究目的19。LAD 闭塞的主要优点是允许准确结扎该动脉以诱导稳定的 MI,这会导致 HF,同时保持更高的存活率。在我们的手术中,我们选择了动脉圆锥和左心耳连接中点下方 2.0-2.5 mm 的结扎位置,这被证明是成功且稳定的,并且在 MI 组的所有大鼠中 LVEF 的变化较小。此外,我们通过 TTC 染色单独测定梗死面积,通过 Masson 染色单独测定纤维化程度,这两者都已广泛用于评估此类模型 20,21,22。同时,该模型的较少变化也通过形态学改变和组织病理学分析来说明。
我们还研究了 LAD 结扎 4 周后与 MI 和 HF 相关的一些参数,以帮助确认 MI 后 HF 的发展。超声心动图能够准确无创地测量心室功能并评估结构性心脏病的原因23。MI 组小鼠 LVEF 均低于 50%,可视为 HF12。与这些结果一致,NT-proBNP 的浓度相应增加,这也是心脏功能受损的重要指标。缺血性心脏存在炎症和细胞凋亡的充分证据24, 25。炎症和心力衰竭密切相关,相互促进26.在我们的研究中,我们评估了炎症因子 IL-6 和 TNF-a 的显着增加。肾灌注不足和交感神经激活激活的肾素-血管紧张素-醛固酮系统 (RAAS) 是心力衰竭病理生理学的核心特征27。我们评估了 RAAS 所涉及的参数,发现 MI 组血清肾素水平明显高于假手术组,进一步验证了 HF 的发展。
在 LAD 结扎过程中有两个主要重点。首先,在整个过程中,直到它们从麻醉中恢复过来,为动物提供持续的氧气供应,同时保持它们的温暖。其次,LAD 上的结扎位置对梗死面积和 HF 的程度起关键作用。动脉圆锥和左心耳之间连接中点下方 2.0-2.5 mm 的部位适用于稳定和成功的 HF 模型,死亡率较低。然而,大鼠新 HF 模型的局限性在于,在没有通气的情况下发展 MI 的外科手术在技术上要求很高且具有挑战性。实现此模型的关键步骤是获得足够的心脏暴露,以完全可视化胸腔内的心脏,并将胸部打开的时间限制为 5 分钟,这需要在正式实验之前进行更多练习。
披露声明
作者没有什么可披露的。
致谢
该模型是在山东省教育厅山东省经典中医方剂协同创新中心的支持下开发的。我们要感谢 Lianfeng Wu 博士在本研究中进行超声心动图检查。
材料
| Name | Company | Catalog Number | Comments |
| 2% TTC solution | Solarbio | T8170-1 | |
| ELISA kits | Shanghai BlueGene Biotech CO., LTD | ||
| Forceps | shinva | ||
| H&E Staining Kit | abcam | ab245880 | |
| Isoflurane | RWD | 100 mL | |
| Kotoprofen | Zoetis | KETOFEN | |
| nylon suture 6-0 | AD surgical | #S-N618R13 | with needle |
| Scalpel blades | shinva | s2646 | |
| Scalpel Handles | shinva | ||
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15-1KT | |
| Ultrasound | Mindray | TE7 | |
| Veterinary Vaporizer | Matrix | vip-3000 | |
| Weitlaner Self-Retaining Retractor | shinva | ZV077RN |
参考文献
- Savarese, G., Lund, L. H. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 3 (1), 7-11 (2017).
- Ziaeian, B., Fonarow, G. C. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 13 (6), 368-378 (2016).
- Meijers, W. C., de Boer, R. A. Common risk factors for heart failure and cancer. Cardiovascular Research. 115 (5), 844-853 (2019).
- Triposkiadis, F., Xanthopoulos, A., Butler, J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. Journal of the American College of Cardiology. 74 (6), 804-813 (2019).
- Tanai, E., Frantz, S. Pathophysiology of Heart Failure. Comprehensive Physiology. 6 (1), 187-214 (2015).
- Cahill, T. J., Kharbanda, R. K. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk. World Journal Of Cardiology. 9 (5), 407-415 (2017).
- Houser, S. R., et al. Animal models of heart failure: a scientific statement from the American Heart Association. Circulation Research. 111 (1), 131-150 (2012).
- Patten, R. D., Hall-Porter, M. R. Small animal models of heart failure: development of novel therapies, past and present. Circulation Heart Failure. 2 (2), 138-144 (2009).
- Chen, J., et al. Ischemic Model of Heart Failure in Rats and Mice. Methods in Molecular Biology. 1816, Clifton, NJ. 175-182 (2018).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Goldman, S., Raya, T. E. Rat infarct model of myocardial infarction and heart failure. Journal of Cardiac Failure. 1 (2), 169-177 (1995).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure. 18 (8), 891-975 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Henri, O., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 133 (15), 1484-1497 (2016).
- Fu, Y. H., et al. A novel rat model of chronic heart failure following myocardial infarction. Methods and Findings in Experimental and Clinical Pharmacology. 31 (6), 367-373 (2009).
- Pfeffer, M. A., et al. Myocardial infarct size and ventricular function in rats. Circulation Research. 44 (4), 503-512 (1979).
- Samsamshariat, S. A., Samsamshariat, Z. A., Movahed, M. R. A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats. Cardiovascular Revascularization Medicine: Including Molecular Interventions. 6 (3), 121-123 (2005).
- Redfors, B., Shao, Y., Omerovic, E. Myocardial infarct size and area at risk assessment in mice. Experimental and Clinical Cardiology. 17 (4), 268-272 (2012).
- Rüder, C., et al. Combinatorial G-CSF/AMD3100 treatment in cardiac repair after myocardial infarction. PloS One. 9 (8), 104644(2014).
- Valentin, J., Frobert, A., Ajalbert, G., Cook, S., Giraud, M. N. Histological Quantification of Chronic Myocardial Infarct in Rats. Journal of Visualized Experiments. (118), (2016).
- Kirkpatrick, J. N., Vannan, M. A., Narula, J., Lang, R. M. Echocardiography in heart failure: applications, utility, and new horizons. Journal of the American College of Cardiology. 50 (5), 381-396 (2007).
- Teringova, E., Tousek, P. Apoptosis in ischemic heart disease. Journal of Translational Medicine. 15 (1), 87(2017).
- Wang, X., Guo, Z., Ding, Z., Mehta, J. L. Inflammation, Autophagy, and Apoptosis After Myocardial Infarction. Journal of the American Heart Association. 7 (9), (2018).
- Van Linthout, S., Tschöpe, C. Inflammation - Cause or Consequence of Heart Failure or Both. Current Heart Failure Reports. 14 (4), 251-265 (2017).
- Orsborne, C., Chaggar, P. S., Shaw, S. M., Williams, S. G. The renin-angiotensin-aldosterone system in heart failure for the non-specialist: the past, the present and the future. Postgraduate Medical Journal. 93 (1095), 29-37 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。