Method Article
Emisión de Fluorescencia Inducida por Láser (L.I.F.E.) como Novedosa Herramienta No Invasiva para Mediciones In-Situ de Biomarcadores en Hábitats Criosféricos
En este artículo
Resumen
Los flujos de carbono en la criosfera apenas se evalúan, pero son cruciales con respecto al cambio climático. Aquí mostramos un nuevo prototipo de dispositivo que captura el potencial fototrófico en entornos supraglaciales basados en la tecnología de emisión de fluorescencia inducida por láser (L.I.F.E.) que ofrece datos de alta resolución espectral y espacial en condiciones in situ.
Resumen
El calentamiento global afecta a las comunidades microbianas en una variedad de ecosistemas, especialmente hábitats criosféricos. Sin embargo, se sabe poco sobre los flujos de carbono mediados por microbianos en ambientes extremos. Por lo tanto, la metodología de adquisición de muestras descrita en los muy pocos estudios disponibles implica dos problemas principales: A) los datos de alta resolución requieren un gran número de muestras, que es difícil de obtener en áreas remotas; B) manipulación inevitable de muestras como corte, aserrado y derretimiento de núcleos de hielo que conduce a un malentendido de las condiciones in situ. En este estudio, se presenta un prototipo de dispositivo que no requiere preparación de muestras ni destrucción de muestras. El dispositivo se puede utilizar para mediciones in situ con una alta resolución espectral y espacial en ecosistemas terrestres y de hielo y se basa en la técnica Laser-Induced Fluorescence E(L.I.F.E.) . Las comunidades supraglaciales fotoautotróficas pueden ser identificadas por la detección de firmas L.I.F.E. en fotopigmentos. Se demuestra la calibración del instrumento L.I.F.E. para los derivados de porfirina clorofilaa (chla) (excitación láser de 405 nm) y B-ficoeritrina (B-PE) (excitación láser de 532 nm). Para la validación de esta metodología, los datos de L.I.F.E. fueron ratificados por un método convencional para chluna cuantificación que implicaba la extracción de pigmentos y la posterior espectroscopia de absorción. La aplicabilidad del prototipo en el campo fue probada en entornos polares extremos. Otras pruebas sobre hábitats terrestres tuvieron lugar durante las simulaciones analógicas de Marte en el postre marroquí y en un glaciar de roca austriaco. El instrumento L.I.F.E. permite escaneos de alta resolución de grandes áreas con logística de operación aceptable y contribuye a una mejor comprensión del potencial ecológico de las comunidades supraglaciales en el contexto del cambio global.
Introducción
La criosfera alberga hielo marino, glaciares, lagos de alta montaña, áreas de nieve, hielo del lago, corrientes de agua derretida y permafrost. Estas áreas cubren aproximadamente el 11% de las masas de tierra de la tierra1,2 y son abarrotadas por la atmósfera como un ambiente criosférico reconocido. Estudios recientes muestran que áreas masivas de la criosfera se están retirando rápidamente3,4. Los5antárticos,6,los Alpes7,el ártico8y otras regiones muestran equilibrios negativos de masa de hielo. La retirada de casquetes de hielo y glaciares conduce al agotamiento de nuestro mayor depósito de agua dulce en la Tierra. En algunas zonas, el retiro del glaciar es imparable5.
Durante mucho tiempo, los ecosistemas de hielo se consideraron ambientes estériles. Sin embargo, a pesar de las duras condiciones, la presencia de vida activa en la criosfera de la tierra es evidente9,10,11,12,13,14,15 . Debido a la tendencia hacia pérdidas masivas de hielo por el derretimiento, la criosfera está pasando por un cambio en la actividad biológica, que afecta a los hábitats adyacentes. Para entender esos cambios parcialmente irreversibles requerimos métodos para investigar la actividad biológica en el hielo en condiciones in situ con alta resolución espacial y temporal.
En ambientes supraglaciales, la vida se puede encontrar en agujeros de crioconita, cubiertas de nieve, agua derretida, arroyos y en superficies de hielo desnudas. Sin embargo, los hábitats supraglaciales más obvios son los agujeros de crioconita. Aparecen a nivel mundial en ambientes glaciares y fueron descritos por primera vez por el explorador sueco Adolf Erik Nordenskjold durante una expedición a Groenlandia en losaños 16,17. El nombre proviene de las palabras griegas "kryos" (frío) y "konia" (polvo). Los desechos orgánicos e inorgánicos oscuros derivados de Eolia se unen en la superficie del hielo y reducen el albedo localmente. La radiación solar promueve el derretimiento de los escombros en capas de hielo más profundas, formando cuencas cilíndricas con sedimentos (crioconita) en la parte inferior9. Los orificios de crioconita cubren 0,1–10% de las zonas de ablación glaciar11.
Las comunidades crioconitas consisten en virus, hongos, bacterias, cianobacterias, microalgas y protozoos. Dependiendo de la región, también se pueden encontrar organismos metazoanos como rotíferos, nematodos, copépodos, tardígrados y larvas de insectos. Edwards y otros18 describen los agujeros de crioconita como "puntos críticos de hielo frío". También trazaron genes funcionales en agujeros de crioconita que son responsables del ciclismo N, Fe, S y P. Los ecosistemas de mini lagos respiren y fotosintetizan a tasas que se encuentran en hábitats mucho más cálidos y ricos en nutrientes11. Estos hallazgos enfatizan el importante papel del secuestro microbiano en entornos supraglaciales. Además de las comunidades vivas en agujeros de crioconita, las superficies de hielo desnudas están habitadas por algas de hielo. Su fisiología está bien estudiada19 pero su distribución espacial no ha sido evaluada20. Su presencia en ambientes supraglaciales disminuye el albedo y por lo tanto promueve el derretimiento que conduce a un lavado de nutrientes y el aporte de nutrientes en hábitats aguas abajo9. El aumento de las temperaturas y, por lo tanto, una mayor disponibilidad de agua líquida, afecta a la productividad neta del ecosistema en estos ecosistemas helados.
En entornos supraglaciales, los organismos fotosintéticamente activos transforman el carbono inorgánico y el nitrógeno en fuentes orgánicas disponibles para la red de alimentos microbianos21,22. Hasta ahora hay pocos estudios que estiman los flujos de carbono supraglacial11,20,23. La discrepancia en las tasas propuestas de flujo de carbono resulta de una baja resolución de datos espaciales y temporales. Además, apenas se evalúa la distribución espacial de las comunidades supraglaciales fuera de los agujeros de crioconita. Cook y otros20 predijeron en sus modelos que las comunidades supraglaciales de algas fijan hasta 11 veces más carbono que los agujeros contemporáneos de crioconita debido a su gran cobertura superficial. La detección de comunidades supraglaciales de algas que aseguran la integridad de la muestra todavía se ve obstaculizada debido a la falta de herramientas para la detección y cuantificación in situ.
En respuesta a las dificultades en la logística, los ecosistemas de hielo se estudian con menos frecuencia que los hábitats en áreas templadas. La resolución de datos depende del número de muestras evaluadas y depende de la accesibilidad de los sitios de estudio. Los métodos de muestreo estándar, como el aserrado, el coring y la posterior fusión, implican la manipulación de la comunidad microbiana. Por ejemplo, la evaluación declorofila a (chla) en muestras de hielo sólido es imposible con métodos estándar sin interferencias sustanciales. Por lo tanto, los cambios de temperatura inducidos por el derretimiento dentro de las comunidades microbianas investigadas son inevitables. En respuesta a la termolabilidad del fotosistema II y otras estructuras celulares en los psiquiatrios22,los análisis de laboratorio de muestras de hielo derretido siempre conducirán a una falsificación de las condiciones in situ.
Las mediciones in situ no destructivas son la única manera razonable de obtener datos fiables. Este objetivo se puede lograr utilizando métodos basados en fluorescencia. Debido a su función de recolección ligera,chl a y B-ficoerythrina (B-PE) están presentes en organismos que contribuyen al ciclo del carbono en ambientes supraglaciales, como ha demostrado Anesio y otros11. Por lo tanto, estas moléculas fluorescentes son biomarcadores adecuados para la cuantificación de flujos de carbono mediados microbianos en ecosistemas de hielo.
En este estudio, presentamos el desarrollo, calibración y aplicabilidad de una novedosa herramienta no invasiva para la cuantificación in situ de moléculas chla y B-PE en ecosistemas terrestres y de hielo. El prototipo de dispositivo se basa en la emisión fluorescente inducida por láser, también conocida como L.I.F.E. El instrumento óptico(Figura 1) captura las firmas de biomarcadores fluorescentes después de la excitación de fluorescencia inducida por láser. El procedimiento no es destructivo y se puede realizar en el lugar de estudio o en un laboratorio.
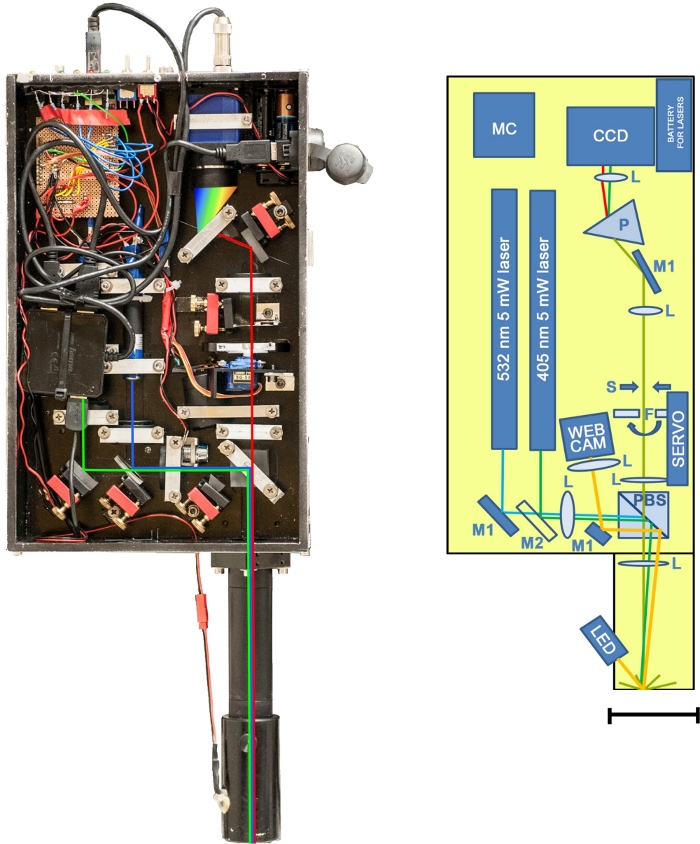
Figura 1: El prototipo L.I.F.E. Izquierda: Foto del instrumento sin tapa protectora. Derecha: Ilustración esquemática del instrumento. Masa total a 5,4 kg (láser y óptica a 4,025 kg, portátil a 1,37 kg). Estructura de aluminio de 32,5 cm x 20,3 cm x 6,5 cm. Tubo óptico: 18,4 cm x 4 cm (diámetro). CCD: sensor bluefox mv220g; F: filtros de paso largo servodirigidos (450 nm y 550 nm); L: lentes ópticas; M1: espejos; M2: espejo dicroico; MC: microcontrolador; P: prisma; PBS: divisor de haz polarizador; S: abertura de hendidura hecha de cuchillas de afeitar ajustables. Barra de escala de 70 mm. Haga clic aquí para ver una versión más grande de esta figura.
El kit portátil de doble longitud de onda pesa 4,5 kg y se utiliza en un trípode en combinación con un ordenador externo. La configuración de campo es rápida y fácil. El instrumento está conectado al trípode, y el tubo de la lente está conectado al dispositivo junto con un cable USB y el cable de la cámara. El ordenador externo está conectado al instrumento mediante un cable USB. Las patas del trípode se ajustan de tal manera que el tubo de la lente se dirige hacia y cubre la muestra. A continuación, un láser verde de 5 mW golpea la muestra después de pasar un divisor de haz polarizador que redirige la luz polarizada hacia el eje óptico del espectrómetro. El espécimen exhibe una luz fluorescente, ilustrada en rojo en la Figura 1. La mitad de la luz colimada pasa por el divisor del haz polarizador y se enfoca a través de un filtro de paso largo servodirigido que elimina las señales láser. A continuación, la señal golpea una abertura de apertura que consta de dos cuchillas de afeitar ajustables. Un prisma separa espectralmente la línea fina de luz ortogonal a la abertura de la hendidura antes de que la señal sea capturada por el sensor. El procedimiento se repite con un láser azul. Los datos sin procesar se transfieren automáticamente a un equipo portátil que también se utiliza para el funcionamiento del software.
El instrumento es controlado por un ordenador externo utilizando un entorno LabVIEW que sincroniza la toma de imágenes con la cámara CCD, encendiendo/apagando láseres y girando la rueda de filtro de paso largo. La interfaz gráfica de usuario (GUI) se divide en tres secciones principales. El ajuste de la exposición se realiza manualmente. Aunque la corrección entre el tiempo de exposición y la intensidad de la señal es lineal(Figura 2B),el tiempo máximo de exposición se limita a 10 s porque los tiempos de integración más largos conducen a una disminución significativa en la relación señal-ruido. El campo de comentario se utiliza para la descripción del ejemplo(Figura 2A). En la sección derecha, las imágenes sin procesar se muestran tan pronto como las mediciones están terminadas. Esta característica es crucial para la evaluación inmediata de datos en el campo(Figura 2C–E). Las áreas rojas indican píxeles sobreexpuestos, que se pueden evitar reduciendo el tiempo de exposición.
El proceso de reducción de datos sin procesar posterior se desacopla del procedimiento de adquisición de imágenes y se puede realizar en cualquier momento después de la adquisición de la imagen.

Figura 2: Interfaz gráfica de usuario L.I.F.E. para la adquisición de datos y la evaluación de datos sin procesar. (A) El software habilita la entrada manual de texto para descripciones de muestra. ( B ) El tiempodeexposición se puede ajustar antes de la medición. (C-E) Las imágenes sin procesar se muestran en el lado derecho de la interfaz. (E) Los colores rojos indican una saturación del sensor. (F) La activación del botón RUN MEASUREMENT activa el proceso de adquisición de datos. En la matriz (G), se muestran todos los comandos ejecutados automáticamente durante la adquisición de datos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ejemplo de una imagen sin procesar. Izquierda: Datos sin procesar de chlun estándar en solución de acetona, grabado con el instrumento L.I.F.E. Debido a las propiedades ópticas del dispositivo, la señal se muestra como una línea deformada. Derecha: Interpretación de la imagen sin procesar por píxel (px). El eje espectral (resolución de 5 nm/px) se traza contra el eje espacial (resolución de 30 m/px). Haga clic aquí para ver una versión más grande de esta figura.
Las imágenes raw en escala de grises de 12 bits muestran un componente espacial debido a la abertura unidimensional y un componente espectral debido al prisma delante del CCD(Figura 3). En respuesta a las restricciones ópticas, las imágenes sin procesar se distorsionan. Por lo tanto, deben recortarse y deformarse aplicando un código que reconozca el grado de distorsión. Esto se hace con un asistente de software(figura 4). A continuación, la calibración de la longitud de onda se realiza con el láser de 532 nm. La luz verde se produce por duplicación de frecuencia de un láser infrarrojo de 1.064 nm. Ambas longitudes de onda pueden ser detectadas por el CCD y, por lo tanto, la posición espectral de cada píxel se puede calcular en imágenes deformadas automáticamente(Figura 4).
La imagen se reduce a un rango de longitud de onda dado (550–1,000 nm para mediciones de láser verde y 400–1,000 para mediciones de láser azul). Los valores grises de cada píxel de una línea de píxel seleccionada se cuentan y se suman. Un valor gris puede oscilar entre 0 y 255. Después de eso, cada línea de píxeles representa un número. Otras instrucciones de software en pantalla conducen a la generación de un trazado que muestra los recuentos de valores grises de cada línea de píxeles trazada contra las coordenadas espaciales. Esto permite una discriminación espacial cuantitativa de chla y B-PE simultáneamente en la muestra. Además, las propiedades espectrales de una muestra se pueden trazar automáticamente a partir de líneas de píxeles seleccionadas.

Figura 4: Deformación de imágenes en bruto. Izquierda: Imagen cruda capturada con un láser verde. No se utilizó ningún filtro. Las señales se muestran a 532 nm y 1.064 nm. Tiempo de exposición a 0,015 s. Centro: La señal recortada de 532 nm se utiliza como línea de referencia para deformar un conjunto de imágenes. Derecha: La imagen deformada de la fuente de imagen sin procesar. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Calibración y validación
NOTA: Para la calibración del pigmento, prepare las filas de dilución a partir de soluciones de stock de chla y B-PE. El chluna solución en stock se diluye con acetona y B-PE se diluye con agua estéril destilada. Más tarde, se necesitarán 15 ml de cada paso de dilución. Proteja los pigmentos de la luz envolviéndolos con papel de aluminio. Conservar el chla en un congelador y el B-PE en un refrigerador hasta que se lo use más. Un protocolo detallado para la fila de dilución sigue en las secciones 1.1 para chla y 1.2 para B-PE. A continuación se describe tanto la calibración del laboratorio Chla como la B-PE para la detección y cuantificación de pigmentos con el instrumento L.I.F.E. Una calibración anterior24 se hizo con los mismos pigmentos que en este estudio.
-
Clorofilauna fila de dilución
- Disolver 1 mg de chla (purificado a partir de algas A. nidulans) con acetona en un tubo de muestra de 50 ml y diluir este chluna solución en stock con acetona a las siguientes concentraciones finales: 1.000; 800; 640; 320; 160; 80; 40; 20; 10; 5; 1; y 0,5 ng/mL.
- Transfiera 15 ml de cada dilución en tubos de muestra de 50 ml y cúbralos en papel de aluminio debido a la sensibilidad a la luz. Almacene los tubos en un congelador de -20 oC hasta que se tomen las medidas de calibración.
NOTA: El protocolo se puede interrumpir aquí. - Mida el chluna característica de absorción de cada dilución en un espectrofotómetro de doble haz como triplicados y calcule el contenido dechl como se describe en Lorenzen25,que se describirá en detalle en la sección 2.2.2.
-
Fila de dilución PE
- Diluir una solución de 4 mg/ml de B-PE con agua filtrada estéril (pH a 7) a las siguientes concentraciones finales: 1.000; 800; 640; 320; 160; 80; 40; 20; 10; y 5 ng/mL B-PE. Transfiera 15 ml de cada dilución en un tubo de muestra de 50 ml y cúbralo con papel de aluminio. Conservar a 4oC hasta su uso posterior.
NOTA: El protocolo se puede interrumpir aquí.
- Diluir una solución de 4 mg/ml de B-PE con agua filtrada estéril (pH a 7) a las siguientes concentraciones finales: 1.000; 800; 640; 320; 160; 80; 40; 20; 10; y 5 ng/mL B-PE. Transfiera 15 ml de cada dilución en un tubo de muestra de 50 ml y cúbralo con papel de aluminio. Conservar a 4oC hasta su uso posterior.
-
Configuración para la calibración
- Cree un bastidor como se muestra en la Figura 5 para establecer tres plataformas de medición, cada una 1,5 cm más alta que la siguiente.
NOTA: La altura del bastidor y de la columna juega un papel importante para las mediciones, ya que la superficie de los líquidos debe permanecer en el punto focal del instrumento L.I.F.E. como se indica en la Figura 5. - Añadir 5 ml de la dilución más alta concentrada en un vial de plástico de poliscintillación y ponerlo en el punto más alto del bastidor. Mida la intensidad de la fluorescencia.
- Coloque el vial en la posición media del bastidor y añada otros 5 ml (10 ml de volumen total). Mida la intensidad de la fluorescencia. Repita el procedimiento en la posición más baja del bastidor con otros 5 ml (15 ml de volumen total; total de 45 mm de altura de columna).
NOTA: Adapte el tiempo de exposición para cada paso de dilución para evitar la saturación del detector (valores grises sobre 255 en imágenes de 12 bits) y para una relación señal-ruido suficiente de las señales de fluorescencia débiles. - Repita los pasos 1.3.2 y 1.3.3 con todas las diluciones (pasos 1.1.1 y 1.2.1) de chla y B-PE.
- Cargue los archivos de datos generados en el asistente de reducción de datos para contar y resumir automáticamente los valores grises de cada línea de píxel a lo largo del eje Y (distribución espacial).
NOTA: Los diferentes tiempos de exposición se compensan automáticamente normalizando la intensidad de la fluorescencia a un tiempo de integración de 1 s. - Calcule la densidad del área del pigmento con un análisis de regresión de Poisson utilizando las concentraciones conocidas de la serie de dilución y las intensidades de fluorescencia normalizadas que se calcularon. A continuación, normalice los recuentos de fluorescencia de las tres alturas de columna diferentes a 1,5 cm (5 ml) multiplicando los recuentos de cada altura de columna con un factor (factores 1, 0,5 y 0,33, para las soluciones de concentración de 5 ml, 10 ml y 15 ml, respectivamente).
- Cree un bastidor como se muestra en la Figura 5 para establecer tres plataformas de medición, cada una 1,5 cm más alta que la siguiente.
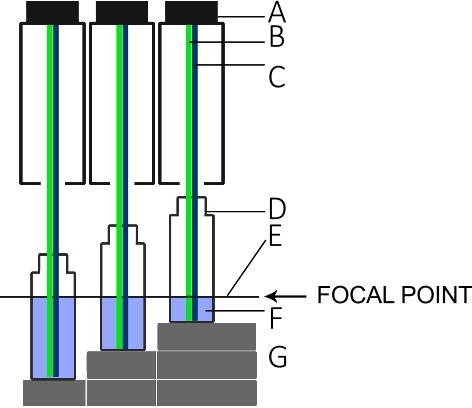
Figura 5: Configuración para la calibración L.I.F.E. con chla y B-PE en condiciones de laboratorio.
(A) Tubo de lente del instrumento. (B) Láser verde para excitación B-PE. (C) Láser azul para chluna excitación. (D) Vial de centelleo. (E) Punto focal del instrumento L.I.F.E. (F) B-PE/agua o chlunasolución /acetona con 5 mL, 10 mL y 15 mL. (G) Espaciadores que mantienen la superficie de cada solución en el plano focal para tres volúmenes diferentes. Haga clic aquí para ver una versión más grande de esta figura.
2. Muestreo y procesamiento de muestras
- Colección de nieve y hielo
- Recoger la nieve y el hielo supraglacial de un glaciar en bolsas estériles de polietileno y almacenarlos congelados hasta su posterior procesamiento.
NOTA: Para este estudio, las muestras fueron recogidas en Midtre Lovenbreen (MLB), un glaciar politérmico cerca de la aldea de investigación Ny-Élesund en el alto archipiélago ártico de Svalbard (78-53' N, 12-03' E). - Muestre esteras bacterianas del campo de cultivo del glaciar en bolsas de polietileno estériles y transporte todas las muestras a un laboratorio para su posterior procesamiento.
- Derretir el material congelado lentamente en la oscuridad a 4 oC. Filtre las muestras líquidas en filtros GF/F (47 mm de diámetro) y observe el volumen filtrado. Mantenga los filtros congelados hasta su posterior procesamiento.
- Recoger la nieve y el hielo supraglacial de un glaciar en bolsas estériles de polietileno y almacenarlos congelados hasta su posterior procesamiento.
- Clorofilauna medida
- Usando el instrumento L.I.F.E., mida el filtro en cuatro áreas aleatorias, cada una en triplicados usando el láser verde y azul. Calcule la concentración global de pigmento multiplicando la densidad de área con el área filtrada y el volumen filtrado. Normalizar la concentración de pigmento (g/L) a un volumen de 1 L.
- Evaluar el contenido delos filtros GF/F con un estándar de laboratorio según el protocolo de Lorenzen25. Para ello, poner cada uno de los filtros en un vial con 13 ml de acetona y guardarlos en la oscuridad a 4oC durante la noche. A continuación, tome un vial y colóquelo en hielo antes de la sonicación durante 2 minutos a 50% de potencia en modo continuo. Apriete y retire el filtro del vial.
- Fije el tubo de tygon a una jeringa y retire el chluna mezcla de extracción y acetona del vial. Sustituya el tubo tygon por un soporte de filtro GF-5. Transfiera la solución a una cubeta de cuarzo.
- Después de calibrar el espectrómetro de absorbancia para la acetona, coloque la muestra en la cubeta en el espectrómetro y mida las características de absorción entre 400-750 nm. A continuación, retire la cubeta del espectrómetro y agregue 200 ml de 2 M HCl a la muestra. A continuación, repita la medición de absorbancia para medir el contenido de faeofitina en la muestra.
- Medición de la actividad microbiana a través de marcadores radiomarcados e impacto de la intensidad del láser y el tiempo de exposición en las tasas de productividad
ADVERTENCIA: Tenga cuidado con la radiactividad del marcador (radiación). Use un abrigo de laboratorio, guantes y gafas, y trabaje bajo una campana de humos en un laboratorio de isótopos con licencia.- Para la producción bacteriana transferir cinco alícuotas de esteras bacterianas en bolsas de polietileno estériles. Inactivar los controles con formaldehído a una concentración final del 4%.
NOTA: Se utilizan tres alícuotas para la ingesta de leucina con etiqueta 3H y dos alícuotas como controles. - Exponer las esteras con un láser azul (405 nm, 5 mW) y con un láser verde (532 nm, 5 mW) para 10 s y 30 s cada una. Repita el procedimiento con láseres de 50 mW. A continuación, desactive las muestras que no fueron tratadas con formaldehído.
NOTA: Se utiliza una estera para una sola exposición láser. Utilice esteras microbianas no expuestas como controles. - Después del tratamiento con láser, estime la producción bacteriana y primaria incorporando 3H-leucina y NaH14CO3, respectivamente. Para las mediciones de producción bacteriana, utilizar cinco alícuotas por muestra (20 ml) y añadir formalina (4% concentración final) a dos de los paralelos, que sirven como controles para la incorporación abiótica del marcador. Añadir 3H-leucina (40 nM) a todas las muestras de los diversos tratamientos e incubarlas durante 4 h en condiciones in situ (0,1oC). Termine la reacción añadiendo formalina a las muestras en vivo restantes.
- Para la producción bacteriana de esteras bacterianas, transfiera muestras etiquetadas a crioviales. Extraer células con ácido tricloroacético al 5% y centrífuga a 10.000 x g durante 5 min según los protocolos de Kirchman26 y Bell27. Añadir líquido de centelleo y poner el criovial en un vial de poliscintillación. Analice las muestras con un contador de centelleo líquido y calcule las tasas de admisión.
NOTA: Se utilizan tres alícuotas para la ingesta de leucina con etiqueta 3H, se utilizan dos alícuotas como controles. - Para la producción primaria, preparar cinco réplicas de diversos tratamientos (100 ml), envolver dos de ellos en papel de aluminio para imitar las muestras oscuras, y añadir NaH14CO3 (1 éCi) a todos. Incubar durante 4 h en la luz ambiental y en la temperatura in situ (0,1oC). Terminar la reacción oscureciendo las tres réplicas restantes y filtrar la muestra en filtros GF/F (25 mm de diámetro).
- Añadir 100 s l de 2 N HCl a los filtros para eliminar todo el exceso de carbono y dejar que se airee bajo la campana de humos. Secar las muestras en una placa de calentamiento a 80 oC y colocar las muestras en viales de poliscintillación.
- Para medir las desintegraciones radiactivas por minuto (dpm) de todos los tratamientos de producción primaria y bacteriana, coloque los crioviales en viales de poliscintillación y añada 5 ml de cóctel de centelleo. Mida el dpm con un contador de centelleo líquido y calcule las tasas de admisión.
- Para la producción bacteriana transferir cinco alícuotas de esteras bacterianas en bolsas de polietileno estériles. Inactivar los controles con formaldehído a una concentración final del 4%.
Resultados
Calibración de laboratorio para B-PE
Las señales de respuesta de la fila de dilución B-PE se midieron con el instrumento L.I.F.E. en una sala oscura a 20 oC(figura 6). La tasa de recuento dependía tanto de la concentración como de la altura de la columna de la muestra medida. Muestra de b-PE de baja concentración y baja altura de columna fluorescado más fuerte en comparación con muestras de la misma concentración y mayor altura de columna.
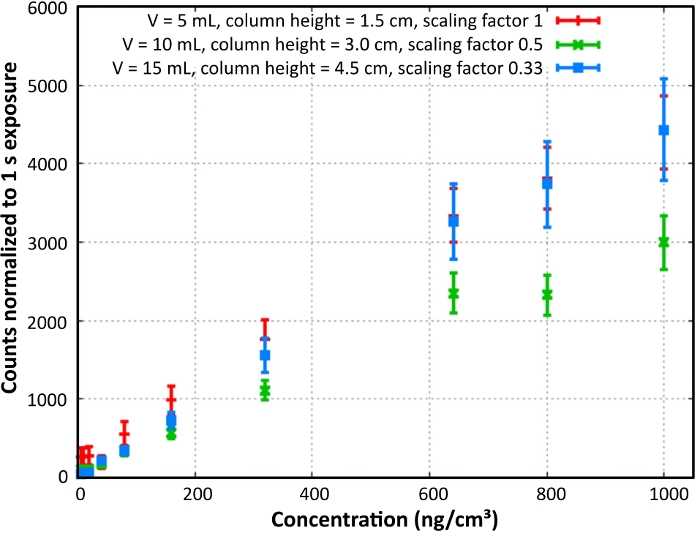
Figura 6: Calibración del laboratorio B-PE. Se muestra el contenido B-PE y la calibración de la densidad de columna. Las tasas de recuento normalizadas se calcularon para una altura de columna de 1,5 cm. Reimprimir con permiso28. Haga clic aquí para ver una versión más grande de esta figura.
Se utilizó una regresión de Poisson para el ajuste final de la línea de calibración. Había una correlación lineal entre las densidades de área y los recuentos de valores grises de píxeles. La función de la curva era y a 81,04x(Figura 7), lo que significa que una tasa de recuento de valores grises de 8.104 en una muestra expuesta de 1 s equivalía a una densidad de área de 100 ng/cm2 B-PE. La calibración deuna calibración se configura de forma analógica. La función era y a 8,94x.

Figura 7: Curva de calibración final para B-PE. Los recuentos de valores grises se normalizaron a un tiempo de exposición de 1 s y se trazaron contra la densidad de área. Reimprimir con permiso28. Haga clic aquí para ver una versión más grande de esta figura.
Aplicación en muestras de crioconita de Svalbard y validación de datos en laboratorio
Los valores medios de las mediciones L.I.F.E. y las mediciones individuales de las mismas muestras derivadas de la extracción convencional mediante acetona y posterior análisis con un espectrofotómetro se ilustran en la Figura 8.

Figura 8: Validación de datos con muestras naturales. Las muestras (MLB) se clasifican por chlun contenido, basado en los resultados de un espectrofotómetro de laboratorio (valores únicos) y en comparación con el chlun datos de fluorescencia medido en cuatro áreas aleatorias por filtro. Las barras de error representan la desviación estándar de las mediciones L.I.F.E. Haga clic aquí para ver una versión más grande de esta figura.
Se subestimóun contenido que oscilaba entre 48 g/L-67 g/L, y el prototipo L.I.F.E. sobrestimóun contenido que oscilaba entre 0,7 g/L y un prototype L.I.F.E. Las desviaciones estándar de las mediciones de L.I.F.E. fueron bajas.
Comparación de datos espectrales de mediciones in situ con estándares de laboratorio
Chla spectra eran comparables entre las muestras de crioconita y las de purificadas a partir de algas A. nidulans. Los picos de fluorescencia en todas las muestras se ubicaron en 700 nm–710 nm. Sin embargo, los espectros derivados de muestras de crioconita mostraron señales de ruido más altas entre 400 nm–650 nm y de 800 nm–1.000 nm en comparación con los espectros de la chlun estándar de pigmento(Figura 9).
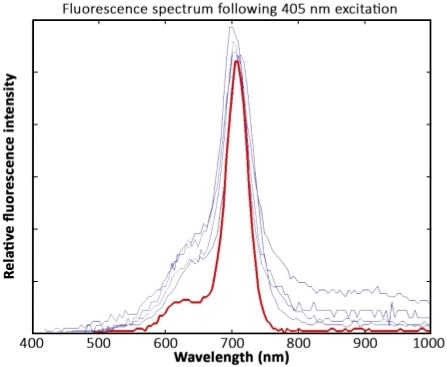
Figura 9: Interpretación de datos espectrales. Mediciones de cuatro gránulos de crioconita (azul) y un chluna solución pigmentada estándar (rojo) después de la excitación con láseres de 405 nm. Los espectros se registraron 1 año después de la recolección de muestras. Las muestras se mantuvieron congeladas y no fueron expuestas a la luz antes de la medición. En respuesta a problemas de calibración de longitud de onda, el pico de fluorescencia se encuentra en 700 nm–710 nm en lugar de 680 nm. Haga clic aquí para ver una versión más grande de esta figura.
Análisis automatizado del grano de crioconita
En un ejemplo de un análisis automatizado de un agujero de crioconita(Figura 10), se observaron las densidades de área de pigmento más altas en la línea de píxeles 50. El espectro de muestra después de la excitación con un láser de 532 nm mostró un pico con un corte a un valor gris de 255 en respuesta a la sobresaturación del sensor. Este pico deriva del láser verde y no de la señal fluorescente.

Figura 10: Análisis automatizado de datos de un solo gránulo de crioconita con un diámetro de 1 mm. La muestra fue recogida en Vestre Br-ggerbreen (VBB) y se midió dentro de 4 h después de tomar muestras en una oscura sala de laboratorio en las instalaciones de la Estación Ártica (GB) en Ny-Élesund. La columna izquierda muestra las mediciones B-PE y la columna derecha representachl un dato. Las imágenes sin procesar se muestran en la parte superior. Las respuestas de fluorescencia inducidas por láser se muestran en gris. Las áreas rojas indican la respuesta de los pigmentos estándar. La sección central ilustra la distribución espacial de los pigmentos objetivo. Las propiedades espectrales de la señal de fluorescencia se muestran en las imágenes inferiores. Haga clic aquí para ver una versión más grande de esta figura.
Impacto de la excitación láser en la productividad en esteras bacterianas
Ni la productividad primaria ni bacteriana se vieron afectadas al aumentar la potencia del láser y/o el tiempo de exposición(Figura 11). No se detectaron diferencias significativas en tratamientos con láser con mayor potencia.
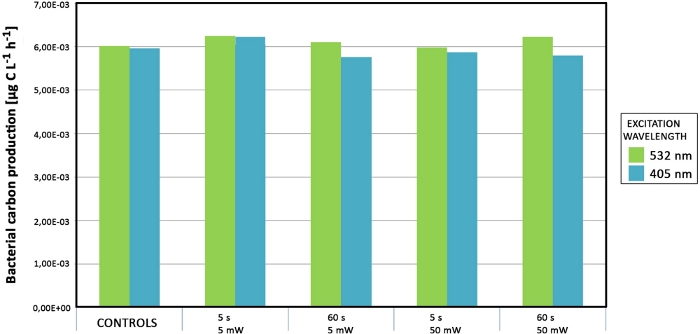
Figura 11: Mediciones de productividad de muestras de Svalbard. Las esteras bacterianas fueron expuestas con láseres verdes y azules de diferentes intensidades de láser y tiempos de exposición. Los datos se colorean según la fuente de longitud de onda láser (verde y azul). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Calibración
Hubo una correlación lineal entre la concentración de pigmento y la intensidad de la fluorescencia después de normalizar los recuentos de fotones a un tiempo de exposición de 1 s. Las muestras con baja altura de columna y bajas concentraciones de pigmento sin salida condujeron a una sobreestimación de los pigmentos objetivo, en comparación con las alturas más altas de la columna con la misma concentración de pigmento. Además, las señales de fluorescencia débiles requerían largos tiempos de exposición para contar suficientes fotones en el sensor. Sin embargo, los largos tiempos de integración también aumentaron la cantidad de luz perdida en el sensor, lo que resultó en una disminución de la relación señal-ruido. En su versión actual, el software no puede distinguir entre ruido y señal durante el proceso de reducción de datos. Por lo tanto, las mediciones de baja intensidad de fluorescencia llevaron a una sobreestimación del pigmento porque el ruido se contó como una señal que se deriva de los pigmentos objetivo. Además, las intensidades de fluorescencia de soluciones de pigmentos más concentradas mostraron una mayor variabilidad que las soluciones de baja concentración. Este efecto podría explicarse por los procesos de absorción dentro de las soluciones de pigmento que se utilizaron para la curva de calibración.
Validación de datos para clorofilauna cuantificación
Después de filtrar muestras de hielo y nieve, las muestras tridimensionales casi aparecían como una muestra bidimensional en el filtro. Esto justificó una comparación directa entre L.I.F.E (densidad de área) y datos espectrofotométricos (medida volumétrica).
El conjunto de datos(Figura 8) indica que una alta concentración de pigmentos conduce a una subestimación, mientras que la baja concentración de pigmentos conduce a una sobreestimación del valor real. Este efecto se puede explicar por el grosor de la torta de filtro y, por lo tanto, el carácter volumétrico de la muestra. La profundidad de penetración del láser dependía de la densidad óptica y el grosor de la muestra. Se subestimó un alto contenido de pigmentos porque el láser no podía inducir fluorescencia del pigmento en capas más profundas. Sin embargo, en las tortas de filtro delgado, se capturaron señales de baja fluorescencia debido a las bajas densidades de área de pigmentos. Aparentemente, el filtro en sí mostró señales inducidas por láser después de pasar el filtro de paso largo de 450 nm(Figura 12). Esta señal fue contada engañosamente como señal de fluorescencia derivada de chla. Por lo tanto, las tortas de filtro delgadas y demasiado gruesas son difíciles de medir con el instrumento L.I.F.E.
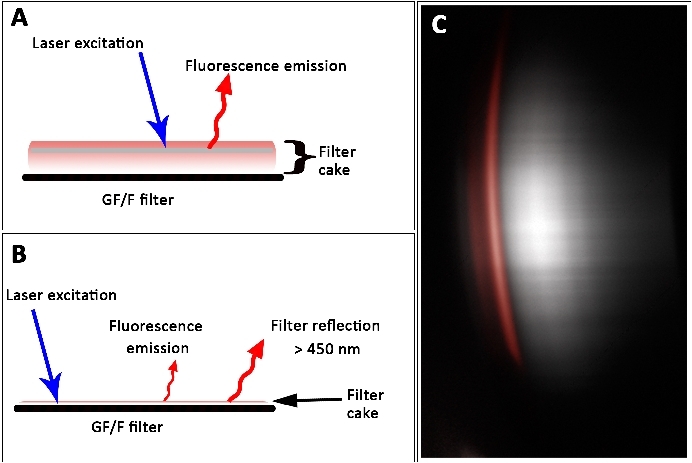
Figura 12: Señales de fluorescencia de tortas de filtro gruesas (A) y delgadas (B) en un filtro GF/F. (A) El autosombreado evita la fluorescencia inducida por láser de capas más profundas, lo que resulta en una subestimación de la concentración real del pigmento. (B) Emisión de fluorescencia de la torta de filtro con superposición por reflejos de filtro. (C) Los datos sin procesar muestran la reflexión del filtro (gris). La propiedad espectral de un laboratorio derivado chlun patrón de fluorescencia se ilustra en rojo. Barra de escala de 45 mm. Haga clic aquí para ver una versión más grande de esta figura.
Limitaciones del prototipo L.I.F.E.
Durante la reducción de datos, el software codificado de MATLAB interpretó las imágenes sin procesar sumando líneas de píxeles dentro de un rango de longitud de onda determinado. La versión actual del software no distinguió entre señales derivadas orgánicas e inorgánicas. La presencia de múltiples señales podría conducir a una sobreestimación del contenido real del pigmento. Los largos tiempos de exposición debido a las bajas intensidades de fluorescencia dieron lugar a una disminución de la relación señal-ruido, promoviendo el efecto descrito anteriormente (ver Figura 8 y Figura 12).
Una roca geoda que se muestra en la Figura 13 exhibió luz fluorescente roja cuando se expone con luz verde y azul. Actualmente, no está claro si la fluorescencia fue el resultado de minerales o de moléculas basadas en porfirina. Por lo tanto, una superposición de señales biológicas y no biológicas puede limitar la aplicación de este método y requerir el establecimiento de una base de datos de fluorescencia específicamente hecha para el prototipo L.I.F.E.

Figura 13: Fluorescencia mineral de una roca geoda, encontrada en Ny-Elesund. La roca se emocionó con un láser de 532 nm 50 mW (A) y un láser de 405 nm 50 mW (B). Ambas imágenes fueron capturadas con un filtro de polarización unido en la lente, lo que llevó a una falsificación de los colores reales de fluorescencia. (C) Imagen de color verdadero sin el uso de un filtro de polarización en condiciones de luz diurna. Barra de escala de 40 mm. Haga clic aquí para ver una versión más grande de esta figura.
Beutler y otros29 concluyeron que los espectros de emisión característicos de cianobacterias en los ecosistemas marinos dependen de las condiciones ambientales. Además, el estado metabólico tiene un impacto en las propiedades de fluorescencia en los organismos fototróficos30. El instrumento L.I.F.E puede distinguir entre el patrón de fluorescencia de algas y cianobacteriana mediante el uso de bibliotecas de huellas biológicas que contienen información espectral de la muestra correlacionada con las condiciones ambientales.
En las moléculas de chla adaptadas a la oscuridad, todos los centros de reacción están completamente oxidados y disponibles para la fotoquímica y no hay rendimiento de fluorescencia se aplaca31. Usando el procedimiento L.I.F.E., un espécimen es excitado primero por un láser de 532 nm (verde) y luego con un láser de 405 nm (azul). Durante la segunda excitación por el láser azul, chla podría mostrar una disminución de la respuesta de fluorescencia debido a la excitación previa por el láser verde. Chla absorbe energía a 532 nm de longitud de onda, a pesar de su distancia desde su longitud de onda máxima de absorción32. Antes de la clo realuna medida a 405 nm, el láser verde puede causar reacciones fotoquímicas, activando mecanismos de enfriamiento en los pigmentos objetivo. Además, la preiluminación de los organismos fototróficos marinos no condujo a un cambio en las curvas de las normas espectrales entre 450 nm–600 nm, mientras que la desviación estándar en las intensidades de fluorescencia aumentó en un 25%29. Dependiendo de la especie, las intensidades de fluorescencia incluso aumentaron en respuesta a la excitación previa. Este tema requiere más investigación.
Aplicabilidad
Probamos el instrumento L.I.F.E. en varios hábitats con énfasis en agujeros de crioconita. El láser se aplicó con éxito en hábitats de suelo y biopelícula debido a la ausencia de luz ambiental durante la medición. Los gránulos de crioconita se pueden medir cuando las capas de sedimentos bloquean la luz desde debajo del agujero(Figura 14A,C). Los agujeros finos de crioconita de sedimento eran permeables para la luz perdida desde abajo(Figura 14B). La luz desviada interfiere con la medición. Por lo tanto, la concentración de pigmentos en superficies de hielo desnudas aún no se puede medir en condiciones de luz diurna. Actualmente se están realizando esfuerzos de procesamiento de señales para permitir el funcionamiento del sistema en condiciones de luz ambiental elevada.

Figura 14: Agujero de crioconita con agua líquida en la parte superior. (A) Crioconita en el glaciar con tubo de lente L.I.F.E. Barra de escala de 70 mm. (B) La capa de sedimento (roja) es muy delgada. La luz desviada sangra a través de la capa de crioconita. (C) La capa de sedimentos es lo suficientemente gruesa como para bloquear la luz perdida desde abajo. Este tipo de agujero de crioconita se puede medir con el instrumento L.I.F.E. Haga clic aquí para ver una versión más grande de esta figura.
En conclusión, nuestro instrumento L.I.F.E. detectó organismos fotoautotróficos en hábitats terrestres como suelos, esteras bacterianas, biopelículas y en agujeros de crioconita en superficies glaciares. Las moléculas diana eran chla y B-PE. La resolución espacial fue de 30 m/px. El límite de detección de chla fue de 250 pg/mL y 2 ng/mL para B-PE. Después de una calibración de laboratorio pudimos cuantificar el contenido de pigmentos en muestras que fueron recogidas en nuestro sitio de estudio en el ártico. Aplicamos software autoprogramado para un proceso automatizado de reducción de datos. Los efectos de la presencia de minerales y las condiciones de luz cambiantes durante las mediciones requieren una investigación adicional.
Con el calentamiento climático, el aumento de las temperaturas conduce a una mayor disponibilidad de agua líquida, lo que resulta en una mayor actividad biológica en superficies heladas de naturaleza autotrófica y heterotrófica. Se deben hacer esfuerzos vigorosos para detectar organismos heterotróficos in situ para dar una imagen completa de la vida activa en la criosfera. Esto podría ser probado con otros pigmentos diana y longitudes de onda de excitación láser apropiadas. Por lo tanto, L.I.F.E. proporciona un sistema de monitoreo adecuado que proporciona una alta resolución temporal y espacial para condiciones supraglaciales en contexto con el cambio global, así como posibles aplicaciones astrobiológicas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen con gratitud al Coronel (IL) J.N. Pritzker, la Fundación Tawani, EE.UU., el Ministerio Federal de Ciencia, Investigación y Economía de Austria (Sparkling Science SPA04_149 y SPA05_201), Alpine Forschungsstelle Obergurgl (AFO), El Foro Espacial Austriaco ( Erler, Roman Erler del Hintertuxer Natur Eis Palast, el federal forestal austriaco y gerente de base Nick Cox de la estación ártica en Ny Alesund (Svalbard). También estamos en deuda con Sabrina Obwegeser, Carina Rofner y Fabian Drewes por su ayuda durante el rodaje. Por último, queremos dar las gracias a James Bradley por dar la voz por el video concomitante.
Materiales
| Name | Company | Catalog Number | Comments |
| aceton | Merck | 67-64-1 | |
| B-Phycoerythrin | Invirtrogen | P6305 | |
| Chlorophyll a standard | Sigma-Aldrich | C6144-1MG | |
| formaline | Merck | HT501128 | 36% |
| GF/C filters | Whatman | WHA1822025 | 25mm diameter |
| HCl | Merck | H1758 | 36,5-38% |
| L.I.F.E. Prototype | University of Innsbruck | built on demand | |
| LabView | National Instruments | Software, Laboratory Virtual Instrumentation Engineering Workbench | |
| Leucine, L-[4,5-3H], 1 mCi | Perkin Elmer | NET1166001MC | radioactive |
| Liquid scintillation cocktail Beckman Ready Use | Beckman | not more available, can be compensated by Ultra Gold, Packard | |
| liquid scintillation counter | Beckman | out of stock | LSC 6000 IC |
| NaH14CO3 (4 µCi/ml) | DHI Denmark | 4 μCi/ml, 1 ml | radioactive |
| Osmonics polycarbonate filters | DHI Denmark | PCTE | 25mm diameter, 0,2µm pore size |
| Polyscintillation vials | Perkin Elmer | WHA1825047 | 20ml |
| sample tubes | Sigma Aldrich | T2318-500EA | Greiner centrifuge tubes, 50ml |
| Spectrophotometer | Hitachi | NA | Model U2001, any photometer for absorption spectroscopy measuring at 664nm and 750nm would be appropriate |
| trichloric acetic acid (TCA) | Merck | T6399 | 100% |
| ultrasonic probe | nano lab | QS1T-2 |
Referencias
- Boyd, E. S., Skidmore, M., Mitchell, A. C., Bakermans, C., Peters, J. W. Methanogenesis in subglacial sediments. Environmental Microbiology Reports. 2, 685-692 (2010).
- Sattler, B., Puxbaum, H., Psenner, R. Bacterial growth in supercooled cloud droplets. Geophysical Research Letters. 28, 239-242 (2001).
- Good, P., et al. A review of recent developments in climate change science. Part I: Understanding of future change in the large-scale climate system. Progress in Physical Geography. 35, 281-296 (2011).
- Fountain, A. G., et al. The Disappearing Cryosphere: Impacts and Ecosystem Responses to Rapid Cryosphere Loss. BioScience. 62, 405-415 (2012).
- Rignot, E., Mouginot, J., Morlighem, M., Seroussi, H., Scheuchl, B. Widespread, rapid grounding line retreat of Pine Island, Thwaites, Smith, and Kohler glaciers, West Antarctica, from 1992 to 2011. Geophysical Research Letters. 41, 3502-3509 (2014).
- McMillan, M., et al. Increased ice losses from Antarctica detected by CryoSat-2. Geophysical Research Letters. 41, 3899-3905 (2014).
- Barletta, V. R., et al. Glacier shrinkage and modeled uplift of the Alps. Geophysical Research Letters. 33, 14307 (2006).
- Nuth, C., et al. Decadal changes from a multi-temporal glacier inventory of Svalbard. The Cryosphere. 7, 1603-1621 (2013).
- Takeuchi, N., Kohshima, S., Seko, K. Structure, formation, and darkening process of albedo-reducing material (cryoconite) on a Himalayan glacier: A granular algal mat growing on the glacier. Arctic Antarctic and Alpine Research. 33, 115-122 (2001).
- Takeuchi, N. Optical characteristics of cryoconite (surface dust) on glaciers: the relationship between light absorbency and the property of organic matter contained in the cryoconite. Annals of Glaciology. 34, 409-414 (2002).
- Anesio, A. M., Hodson, A. J., Fritz, A., Psenner, R., Sattler, B. High microbial activity on glaciers: importance to the global carbon cycle. Global Change Biology. 15, 955-960 (2009).
- Anesio, A. M., et al. Carbon fluxes through bacterial communities on glacier surfaces. Annals of Glaciology. 51, 32-40 (2010).
- Storrie-Lombardi, M. C., Sattler, B. Laser-Induced Fluorescence Emission (L.I.F.E): In Situ Nondestructive Detection of Microbial Life in the Ice Covers of Antarctic Lakes. Astrobiology. 9, 659-672 (2009).
- Murray, A. E., et al. Microbial life at -13 °C in the brine of an ice-sealed Antarctic lake. Proceedings of the National Academy of Sciences of the United States of America. 109, 20626-20631 (2012).
- Edwards, A., et al. A distinctive fungal community inhabiting cryoconite holes on glaciers in Svalbard. Fungal Ecology. 6, 168-176 (2013).
- Miteva, V., Margesin, R., Schinner, F., Marx, J. C., Gerday, C. Bacteria in Snow and Glacier Ice. Psychrophiles: from Biodiversity to Biotechnology. , 31-50 (2008).
- Yallop, M. L., et al. Photophysiology and albedo-changing potential of the ice algal community on the surface of the Greenland ice sheet. The ISME Journal. 6, 2302-2313 (2012).
- Edwards, A., et al. A metagenomic snapshot of taxonomic and functional diversity in an alpine glacier cryoconite ecosystem. Environmental Research Letters. 8, 035003 (2013).
- Remias, D., et al. Characterization of an UV-and VIS-absorbing, purpurogallin-derived secondary pigment new to algae and highly abundant in Mesotaenium berggrenii (Zygnematophyceae, Chlorophyta), an extremophyte living on glaciers. FEMS Microbiology Ecology. 79, 638-648 (2012).
- Cook, J., et al. An improved estimate of microbially mediated carbon fluxes from the Greenland ice sheet. Journal of Glaciology. 58, 1098-1108 (2012).
- Mueller, D. R., Vincent, W. F., Pollard, W. H., Fritsen, C. H. Glacial cryoconite ecosystems: a bipolar comparison of algal communities and habitats. Nova Hedwigia Beiheft. 123, 173-198 (2001).
- Morgan-Kiss, R. M., Priscu, J. C., Pocock, T., Gudynaite-Savitch, L., Huner, N. P. A. Adaptation and Acclimation of Photosynthetic Microorganisms to Permanently Cold Environments. Microbiology and Molecular Biology Reviews. 70, 222-252 (2006).
- Hodson, A., et al. The cryoconite ecosystem on the Greenland ice sheet. Annals of Glaciology. 51, 123-129 (2010).
- Tilg, M., et al. L.I.F.E.: laser induced fluorescence emission, a non-invasive tool to detect photosynthetic pigments in glacial ecosystems. Proceedings SPIE. 8152, Instruments, Methods, and Missions for Astrobiology XIV, 81520I. , (2011).
- Lorenzen, C. J. Determination of chlorophyll and pheo-pigments: spectrophotometric equations. Limnology & Oceanography. 12, 343-346 (1967).
- Kirchman, D. Measuring bacterial biomass production and growth rates from leucine incorporation in natural aquatic environments. Methods in Microbiology. , 227-238 (2001).
- Bell, R. T., Kemp, P. F., Cole, J. J., Sherr, B. F., Sherr, E. B. Estimating production of heterotrophic bacterioplankton via incorporation of tritiated thymidine. Handbook of methods in aquatic microbial ecology. Edited by. , 495-503 (1993).
- Groemer, G., et al. Field trial of a dual-wavelength fluorescent emission (L.I.F.E.) instrument and the Magma White rover during the MARS2013 Mars analog mission. Astrobiology. 14, 391-405 (2014).
- Beutler, M. . Spectral fluorescence of chlorophyll and phycobilins as an in situ tool of phytoplankton analysis-models, algorithms and instruments. , (2003).
- Krogmann, K. D. Discoveries in Oxygenic Photosynthesis (1727-2003): A Perspective. Photosynthesis Research. 80, 15-57 (2004).
- Corrêa, D. S., et al. Reverse saturable absorption in chlorophyll A solutions. Journal of Applied Physics B. 74, 559-561 (2002).
- Kaňa, R., et al. The slow S to M fluorescence rise in cyanobacteria is due to a state 2 to state 1 transition. Biochimica et Biophysica Acta. 1817, 1237-1247 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados