Method Article
A11-positivo β-amiloide oligómero preparación y evaluación mediante Dot blot análisis
En este artículo
Resumen
Este protocolo describe cómo preparar oligómeros de Aß de un péptido sintético en vitro y evaluar cantidades relativas de oligómero Aβ mediante un punto de análisis el borrar.
Resumen
Β-amiloide (Aβ) es un péptido hidrofóbico con una tendencia intrínseca a la uno mismo-montar en agregados. Entre los diversos agregados, oligómero Aβ es ampliamente aceptado como la neurotoxina líder en el progreso de la enfermedad de Alzheimer (EA) y es considerado como el evento crucial en la patogenia de la EA. Por lo tanto, inhibidores de oligómero Aβ podrían prevenir la neurodegeneración y tienen el potencial para desarrollarse como modificadores de la enfermedad tratamientos de AD. Sin embargo, protocolos de formación diferentes de oligómero Aβ pueden dar oligómeros con diferentes características. Por otra parte, no hay muchos métodos con eficacia pantalla Aβ1-42 oligómero inhibidores de. Un anticuerpo A11 puede reaccionar con un subconjunto de tóxicos oligómero Aβ1-42 con estructuras de β-hoja de la URL. En este protocolo, se describe cómo preparar una muestra de ricos oligómero A11 positivo Aβ1-42 de un sintético Aβ1-42 péptido en vitro y para evaluar las cantidades relativas de oligómero de A11 positivo Aβ1-42 en muestras frotando un punto Análisis usando A11 y Aβ1-42-6E10 específico anticuerpos. Mediante este protocolo, inhibidores de oligómero de A11 positivo Aβ1-42 pueden también proyectará a partir de resultados experimentales semi-cuantitativo.
Introducción
Enfermedad de Alzheimer (EA) es una de las más importantes enfermedades neurodegenerativas que afectan a personas mayores en todo el mundo1. Es ampliamente aceptado que la agregación anormal de β-amiloide (Aβ) puede ser el factor patológico principal del anuncio. Agregados de Aß son los principales componentes de las placas seniles, uno de los marcadores biológicos en el cerebro de pacientes con EA. Por otra parte, agregados de Aß, oligómeros en particular producen neurotoxicidad potente, que pudo ser la causa de la muerte neuronal como progresa AD. Por lo tanto, la inhibición de la formación de Aß oligómero puede prevenir la neurodegeneración, e inhibidores del oligómero de Aß podrían desarrollarse como modificadores de la enfermedad tratamientos de AD. Muchos estudios han utilizado un péptido Aß sintético para formar oligómeros en vitro, explorar morfologías y estructuras de oligómeros de Aß artificiales e investigar los inhibidores de oligómero Aβ usando in vitro modelos2,3 , 4. sin embargo, diferentes en vitro protocolos de formación de oligómero Aβ podrían conducir a oligómero con características morfológicas diferentes, que pueden causar los resultados incomparables entre diferentes grupos de investigación. Por lo tanto, un protocolo de formación estándar de oligómero Aβ es urgente.
Hasta ahora, no muchos métodos se han divulgado para detectar directamente los oligómeros de Aß. Microscopía electrónica de transmisión (TEM), no desnaturalizando electroforesis del gel, análisis enzima-ligado del inmunosorbente (ELISA) y dot blotting análisis pueden usarse para examinar la cantidad y morfología de Aβ oligómero en vitro5, 6. por ejemplo, la morfología y estructura del oligómero Aβ pueden observarse en TEM. Las cantidades relativas y tamaño de agregados de Aβ podrían medirse por electroforesis en geles no desnaturalizantes. ELISA puede utilizarse para determinar oligómero Aβ en suero, plasma y extractos de tejido cerebral. Por último, dot Blot análisis, una técnica usada para la detección, análisis y la identificación de proteínas, podría utilizarse para evaluar la concentración relativa de oligómero Aβ en diferentes muestras con la ayuda de anticuerpos específicos de Aß y oligómero. Por otra parte, un dot Blot ensayo ofrece ahorro de tiempo significativo, como electroforesis en gel y los Blot procedimientos para los geles no son necesarios. Por lo tanto, este ensayo se usa normalmente para los inhibidores potenciales de oligómero la Aß pantalla. El objetivo general de este protocolo es describir un método relativamente simple, confiable y reproducible para preparar una muestra Aβ1-42 oligómero-ricos, para analizar las cantidades de oligómero Aβ1-42 por dot Blot análisis y oligómero de Aß de pantalla inhibidores mediante resultados experimentales semi-cuantitativos.
Protocolo
1. preparación de la solución
Nota: Ver Tabla de materiales para fuentes de reactivo.
- Preparar una solución 5% albúmina de suero bovino (BSA) mediante la adición de 5 g de BSA 100 ml de agua destilada doble. Mezclar completamente por Vortex ellos. Almacenar la solución a 4 ° C durante 1 mes.
- Preparar una solución anticuerpo anti-oligómero de A11 (1:1, 000) agregando 10 μl de la solución madre de anticuerpo a 10 mL de la solución de BSA de 5%. Mezclar completamente por Vortex ellos. Almacenar la solución a 4 ° C durante 1 mes.
- Preparar una solución de 6E10 del anticuerpo de anti-Aß (1:1, 000) agregando 10 μl de la solución madre de anticuerpo a 10 mL de solución de BSA de 5%. Mezclar completamente por Vortex. Almacenar la solución a 4 ° C durante 1 mes.
- Preparar una solución OC de anticuerpo anti-fibrilar oligómero (1:1, 000) agregando 10 μl de la solución madre de anticuerpo a 10 mL de solución de BSA de 5%. Mezclar completamente por Vortex. Almacenar la solución a 4 ° C durante 1 mes.
- Preparar una Tris-buffer salino (TBS) solución mediante la adición de 24 g de Tris base y 88 g de NaCl en 1000 mL de agua destilada doble. Ajustar el pH a 7.4. Almacenar la solución a 4 ° C hasta por 3 meses.
- Preparar una solución de Tween-20 (TBST) y solución salina con tampón Tris añadiendo 1 mL de Tween-20 a 100 mL de TBS común solución y 900 mL doble y agua destilada.
- Preparar una solución de anticuerpo secundario agregar 10 μl de rábano con peroxidasa (HRP) cabra anti-IgG de conejo (H + L) a 10 mL de solución TBST. Mezclar completamente por Vortex ellos. Almacenar la solución a 4 ° C durante 1 mes.
- Disolver 3,68 g de cúrcuma en 1 mL de dimetilsulfóxido (DMSO) para formar una solución stock de 10 mM la curcumina.
- Disolver 5 mg de sintético Aβ1-42 en 2 mL de 1,1,1,3,3,3-hexafluoro-2-propanol (HFIP) para formar una solución de monómero de Aß de 2.5 mg/mL. Lugar a temperatura ambiente (25 ° C) para alícuotas de 20 min hacer 100 μl y almacenar a-20 ° C hasta por 6 meses.
Nota: Este procedimiento se debe correr tan rápido como sea posible. Deben cortarse las puntas de pipetas para pipeteo exacto. - Preparar electrochemiluminescence (ECL) líquido mezclando ECL líquido A y B con una relación de volumen de 1:1. Esta solución debe ser preparada inmediatamente antes de uso.
2. preparación de la muestra
Nota: Realizar la preparación de la muestra 2 días antes de la dot blotting análisis.
- Agregar 900 μl de agua doble destilada a un tubo de solución de monómero Aβ1-42 ; la concentración de Aβ1-42 será 0.25 mg/mL. Coloque la mezcla a temperatura ambiente durante 20 minutos.
- Evaporar la solución con gas nitrógeno de alta pureza hasta que su volumen es cerca de 850 μl. La concentración de la solución Aβ1-42 será de 0,29 mg/mL.
Nota: La solución debe agitarse de vez en cuando para asegurar que el HFIP se evapora completamente. Normalmente, después de 30 min de la evaporación, el volumen de la solución residual es cerca de 850 μl. - Diluir la solución madre de curcumina a una solución de trabajo de la curcumina (0,2 y 2 μm) con agua destilada doble. Mezclar la Aβ1-42solución y solución con una relación de volumen de 1:1 la curcumina. Las concentraciones finales de curcumina será 0,1 y 1 μm.
Nota: Potenciales inhibidores de oligómero se pueden mezclar con la solución Aβ1-42 en cualquier relación si es necesario. - Agite continuamente la solución en un agitador magnético (véase Tabla de materiales).
- Arreglar una caja de plástico separador para el agitador magnético. 2 lugar magnético remover barras en 2 esquinas de la caja y colocar los tubos de muestras en el centro de la caja.
- Agitar la caja a temperatura ambiente (25 ° C) durante 48 h.
Nota: La velocidad del agitador magnético es alrededor de 60 rpm.
- Centrifugar los tubos durante 15 min a 4 ° C y 18.000 x g. recoger el sobrenadante.
3. dot Blotting análisis
Nota: Todas las incubaciones se realizan en un agitador horizontal.
- Cortar la membrana de nitrocelulosa en tiras ancho 1 cm.
Nota: El ancho de la membrana de nitrocelulosa se puede ajustar según necesidades experimentales. - Coloque las muestras 2 μl uniformemente en 2 tiras (tira 1 y 2) con cada intervalo punto a 0,5 cm.
- Coloque las tiras a temperatura ambiente durante 5 minutos hasta que se seque la gota en la banda.
- Incube las tiras con una solución de BSA de 5% durante 30 min a temperatura ambiente.
- Enjuague las tiras con una solución TBST por 5 min a temperatura ambiente.
- Aspirar la solución TBST. Por 1 h a temperatura ambiente, incubar 1 tira con un anticuerpo anti-oligómero solución A11 y pele 2 con una solución de 6E10 del anticuerpo de anti-Aß.
- Enjuague las tiras con una solución TBST tres veces, cada vez durante 5 minutos a temperatura ambiente.
- Aspirar la solución TBST. Incube las tiras con una solución de anticuerpo secundario durante 40 min a temperatura ambiente.
- Enjuague las tiras con una solución TBST tres veces, cada vez durante 5 minutos a temperatura ambiente.
- Aplique uniformemente el líquido mezclado de ECL para la superficie de las tiras. Exponga las tiras en una quimioluminiscencia automático sistema de imagen (véase Tabla de materiales).
Nota: Normalmente, 300 μL de líquido ECL es suficiente para una membrana. La membrana debe mantenerse húmeda durante la exposición. El tiempo de exposición se calcula automáticamente por el sistema de proyección de imagen. - Hacer un análisis de escala de grises con ImageJ (institutos nacionales de salud) u otro software de procesamiento de imágenes para obtener resultados semi-cuantitativos.
Resultados
Para investigar si un monómero Aβ1-42 puede formar un oligómero Aβ1-42 después de la preparación, se usó análisis TEM. No agregados visibles fueron observados en la muestra de monómero disuelto HFIP Aβ1-42 (figura 1A). Por otra parte, agregados globulares principalmente con un diámetro de alrededor de 10-80 nm fueron observados en la muestra Aβ1-42 después de 48 h de agitación, lo que sugiere que Aβ1-42 forma oligómeros después de la preparación (figura 1B).

Figura 1 . Análisis TEM de Aβ1-42 oligómero ricas muestras y monómero Aβ1-42 . La muestra de monómero disuelto HFIP Aβ1-42 (10 μm) y de la Aβ1-42 oligómero ricos muestra (10 μm) preparados de acuerdo a este protocolo fueron examinados por TEM. La barra de escala = 200 nm. Haga clic aquí para ver una versión más grande de esta figura.
Además, el dot blotting análisis fue utilizado para evaluar las cantidades relativas de oligómero Aβ1-42 en las muestras. Un anticuerpo A11 podría reaccionar con un subconjunto de oligómero Aβ tóxicos con estructuras de β-hoja de la URL. Un anticuerpo OC reacciona con los agregados fibrilares con estructuras paralelas de β-hoja de registro. Mediante el uso de estos anticuerpos, demostramos que A11 positivo Aβ1-42 oligómeros, pero no OC-positivo1-42 fibrilares agregados de Aß, aparecieron principalmente en las muestras de oligómero-ricos Aβ1-42 que se prepararon según el protocolo ( Figura 2). Usando el 6E10 del anticuerpo anti-Aß, observamos que el número de péptidos Aβ1-42 era similar en la muestra de monómero disuelto HFIP Aβ1-42 y la muestra de oligómero ricos Aβ1-42 (figura 2).

Figura 2 . Dot blot análisis de Aβ1-42 monómero y Aβ1-42 muestras de oligómero rico. Muestra de monómero (A) disolvió el HFIP Aβ1-42 (10 μm) y de la Aβ1-42 oligómero ricos muestra (10 μm) preparados de acuerdo a este protocolo fueron examinados por dot Blot análisis con el anticuerpo anti-oligómero A11, anti-fibrilar oligómero 6E10 del anticuerpo anti-Aß y el anticuerpo OC. (B - D) se realizó el análisis semi-cuantitativo de escala de grises de ImageJ. Los datos, expresados como un porcentaje de control, fueron la media ± SEM de 3 experimentos independientes; *** p < 0,001 vs el grupo de monómero Aβ1-42 (ANOVA y t-test). Haga clic aquí para ver una versión más grande de esta figura.
Para investigar si este protocolo podría ser utilizado para los inhibidores de la pantalla de oligómeros Aβ1-42 , la curcumina, un conocido inhibidor de oligómero Aβ, fue utilizado. Encontramos que una incubación conjunta con curcumina (0.1 - 1 μm) redujo significativamente las cantidades relativas de oligómero de A11 positivo Aβ1-42 , como lo demuestra la tinción disminuida de A11 en la curcumina Co incubados Aβ1-42 oligómero muestra que en el se incubó Aβ1-42 oligómero ricos muestra normal (figura 3). En la misma condición, la curcumina (0.1 - 1 μm) no alteró el número de péptidos Aβ1-42 como la tinción de 6E10 era uniforme en todas las muestras (figura 3).

Figura 3 . Dot blot análisis de curcumina Co incubados Aβ1-42 muestras de oligómero rico. Monómeros (A) disuelto HFIP Aβ1-42 (10 μm) fueron preparados de acuerdo a este protocolo y se incubaron con o sin curcumina (0, 0,1, 1 μm) bajo agitación durante 48 h. Las muestras fueron examinadas por un dot Blot usando A11 y 6E10 del análisis. (B) el análisis semi-cuantitativo en escala de grises fue realizado por ImageJ. Los datos, expresados como un porcentaje de control, fueron la media ± SEM de 3 experimentos independientes; *** p < 0,001 vs el grupo solo de Aβ1-42 (prueba de ANOVA y de Tukey). Haga clic aquí para ver una versión más grande de esta figura.
Para verificar formación de oligómero, también hemos usado un gel no desnaturalizantes. Encontramos que oligómero (> 4 KD) estuvo presente en la muestra Aβ1-42 oligómero-ricos, mientras más monómero (4 KD) fue encontrado en la muestra de monómero Aβ1-42 (Figura S1).
Hemos investigado agregados de Aß en el sobrenadante y el pellet de la muestra Aβ1-42 . Después de 48 h de incubación, oligómero Aβ1-42 pero no agregados fibrilares de Aβ1-42 fueron encontrados en el sobrenadante de la muestra según lo determinado por A11, OC y 6E10 anticuerpos (Figura S2). En la misma condición, agregados fibrilares de Aβ1-42 pero no oligómeros de1-42 de Aβ fueron encontrados en el sedimento de la muestra (Figura S2).
También hemos examinado la morfología de la muestra tratada con curcumina Aβ1-42 usando TEM. La muestra tratada con curcumina contiene unos puntos esféricos, sugiriendo que la curcumina podría reducir la cantidad de oligómero Aβ1-42 (S3 de la figura).

Figura S1 . Análisis de electroforesis de gel no desnaturalizantes de monómero Aβ1-42 y muestras de oligómero ricos Aβ1-42. La muestra de monómero disuelto HFIP Aβ1-42 (10 μm) y la muestra de oligómero ricos Aβ1-42 (5 μm, bajo; 10 μm, alta) preparados de acuerdo a este protocolo fueron examinados por electroforesis en geles no desnaturalizantes usando el 6E10 del anticuerpo anti-Aß. Haga clic aquí para ver una versión más grande de esta figura.
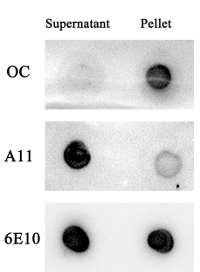
Figura S2 . El sobrenadante de solución Aβ1-42 contiene principalmente oligómero, pero agregados fibrilares no. Una solución de Aβ1-42 (50 μL), después de agitar durante 48 h, se centrifugó a 18.000 x g por 10 min. Se recolectó el sobrenadante y el pellet fue nuevamente disuelto en 850 μl de agua destilada doble. El sobrenadante y el pellet más fueron examinados por un análisis de dot blot utilizando anticuerpos OC, A11 y 6E10. Haga clic aquí para ver una versión más grande de esta figura.

Figura S3 . Análisis TEM de la curcumina Co incubaron muestras de oligómero ricos Aβ1-42. Disuelto HFIP Aβ1-42 monómeros (10 μm) fueron preparados de acuerdo a este protocolo y se incubaron con 1 μm la curcumina bajo agitación durante 48 h. Las muestras fueron examinadas por TEM. Barra de escala = 100 nm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este protocolo hemos reportado un método para preparar las muestras que contienen oligómero Aβ1-42 y analizar las cantidades de oligómero de A11 positivo Aβ1-42 , un punto de análisis el borrar. Aunque nuestros métodos para la preparación de Aβ1-42 oligómero ricas muestras son bastante simples, fiables y reproducibles, todavía hay algunos puntos a ser notado. En primer lugar, HFIP se utiliza para disolver el péptido sintético de1-42 de Aβ. Un péptido de42 1 agregado de Aβ puede desmontar en monómero en la solución HFIP. Sin embargo, HFIP es fácil volatilizar y el HFIP es muy baja. Por lo tanto, el péptido Aβ1-42 debe ser disuelto en HFIP y la solución HFIP debe alícuotas tan rápido como sea posible para reducir la pérdida potencial de HFIP durante la operación. Por otra parte, se deben cortar las puntas de pipetas para pipeteo exacto en este procedimiento. En segundo lugar, se utiliza gas nitrógeno de alta pureza que se evapore el HFIP de la solución. Durante este procedimiento, la solución Aβ1-42 debe agitarse de vez en cuando para asegurarse de que el HFIP se puede evaporar completamente. Al final de este procedimiento, el olor de HPIF no debe detectarse en la solución. Normalmente, 30 min de la evaporación reduce la concentración de HFIP a menos del 0,1%. En esta concentración, HFIP se divulga no para modificar la transición de la conformación de Aβ1-427. En tercer lugar, durante la preparación de las muestras que contienen oligómero Aβ1-42 , el volumen mínimo de líquido debe ser mayor a 50 μl. de lo contrario, las muestras suelen esparcir en gotas pequeñas, colocar en la pared de los tubos. También, monómero Aβ1-42 no puede formar oligómero sin una mezcla completa.
El protocolo para preparar una muestra de ricos oligómero Aβ1-42 como se describe aquí es ligeramente diferente de algunos de los protocolos utilizados en otros grupos. Por ejemplo, en algunos estudios, HFIP se evaporó antes de agregar agua destilada doble en la solución de8,9. Sin embargo, en tales condiciones, el péptido Aβ1-42 puede formar hojas pequeñas, que son difíciles de disolver en la solución. Por lo tanto, elegimos agregar agua destilada doble primero y luego evaporar el HFIP por gas nitrógeno. Lo más importante, formas oligoméricas de agregados preparados por este protocolo son confirmadas por el TEM. Por otra parte, oligómero de1-42 de Aß formado por este protocolo podría inducir neurotoxicidad en células SH-SY5Y y primarias neuronas hippocampal y reducir rendimiento cognitivo después de la inyección en la región del hipocampo de los ratones, sugiriendo que la Aβ1-42 oligómero preparado es muy tóxico5,10. Estos resultados son consistentes con estudios anteriores11.
Este protocolo para evaluar oligómero de A11 positivo Aβ1-42 por un análisis de dot Blot todavía tiene algunas carencias. En primer lugar, mediante el uso de muestreo manual, no es fácil mantener las gotas de tamaño uniforme. En segundo lugar, un punto de análisis el borrar es semi cuantitativo pero método no cuantitativo para medir las cantidades de oligómero de A11 positivo Aβ1-42 , lo que sugiere que otros métodos, como ELISA, son necesarias la evaluación exacta de cantidades de Aβ 1-42 de oligómero es necesario. En tercer lugar, algunos medicamentos pueden reaccionar a los anticuerpos, conduciendo a resultados falsos positivos.
En general, hemos incluido un protocolo confiable para preparar las muestras que contienen oligómero de A11 positivo Aβ1-42 y a analizar las cantidades de oligómero de A11 positivo Aβ1-42 mediante un punto de análisis el borrar. Mediante el uso de este protocolo, oligómero de1-42 de Aβ potenciales inhibidores con el potencial para el tratamiento de AD podrían proyectará eficazmente.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de la nacional Ciencias naturales Fundación de China (U1503223, 81673407, 21475131), el proyecto de investigación aplicada en tecnología sin fines de lucro de la provincia de Zhejiang (2016C 37110), Ningbo internacional Ciencia y tecnología Proyecto de cooperación 2014D 10019, el equipo de innovación Municipal de Ningbo del Ciencias de la vida y salud (2015C 110026), Ningbo Sci & Tech proyecto de riqueza común (2017C 50042), el Li Dak suma Yip Yio Chin Kenneth Li Marine biofarmacéutica fondo de desarrollo, y el fondo K. C. Wong Magna en la Universidad de Ningbo.
Materiales
| Name | Company | Catalog Number | Comments |
| A11 (ab126892 Rb pAb to Amyloid Oligomers) | Abcam | GR91739-58 | |
| 6E10 (beta-Amyloid Rabbit Ab) | Cell Signalling Technology | 2454S | |
| OC (Anti-Amyloid Fibrils OC Antibody) | Millipore | AB2286 | |
| Horseradish Peroxidase (HRP) Marker Goat anti rabbit IgG (H+L) | Beyotime | A0208 | |
| Aβ1-42 | GL Biochem | 52487 | |
| 1,1,1,3,3,3-Hexafiuoro-2-propanol | Aladdin | I1523078 | |
| Curcumin | Sigma | C1386 | |
| Albumin Bovine V | Solarbio | A8020 | |
| Sodium chloride | Sangon Biotech | D920BA0003 | |
| Sodium dodecyl sulfate | SCR | 30166428 | |
| TRIS | Solarbio | T8060 | |
| Glycine | Solarbio | G8200 | |
| Dimethyl sulfoxide | Solarbio | D8370 | |
| 5×nondenaturing gel PAGE Protein Marker | Beyotime | P0016 | |
| Genshare CFAS anyKD PAGE | Genshare | JC-PE022 | |
| Pure Nitrocellulose Blotting Membrane | Pall Corporation | T50189 | |
| Methanol | SCR | 10014118 | |
| Ethanol | SCR | 10009218 | |
| Super low range protein Marker | Solarbio | PR1300 | |
| Transfer Membranes | Immobilon-PSQ | ISEQ00010 | |
| BeyoECL Star | Beyotime | P0018A | |
| Commassie Blue Fast staining solution | Beyotime | P0017 | |
| All - automatic chemiluminescence imaging system | Tanon | Tanon 5200 | |
| Image J | National Institutes of Health | ||
| Image processing software | Adobe | Photoshop CS6 | |
| Magnetic agitator | Shanghai Huxi |
Referencias
- Lauren, J. Cellular prion protein as a therapeutic target in Alzheimer's disease. Journal of Alzheimer's Disease. 38 (2), 227-244 (2014).
- De Maio, A., Rivera, I., Cauvi, D. M., Arispe, N. Modulation of amyloid peptide oligomerization and toxicity by extracellular Hsp70. Biophysical Journal. 112 (3), 444 (2017).
- Di Scala, C., Chahinian, H., Yahi, N., Garmy, N., Fantini, J. Interaction of Alzheimer's beta-amyloid peptides with cholesterol: mechanistic insights into amyloid pore formation. Biochemistry. 53 (28), 4489-4502 (2014).
- Xiang, S. Y., et al. Fucoxanthin inhibits beta-amyloid assembly and attenuates beta-amyloid oligomer-induced cognitive impairments. Journal of Agricultural and Food Chemistry. 65 (20), 4092-4102 (2017).
- Chang, L., et al. Protection against beta-amyloid-induced synaptic and memory impairments via altering beta-amyloid assembly by bis(heptyl)-cognitin. Scientific Reports. 5, 10256 (2015).
- Yam, G. H. F., et al. In vitro amyloid aggregate forming ability of TGFBI mutants that cause corneal dystrophies. Investigative Ophthalmology & Visual Science. 53 (9), 5890-5898 (2012).
- Tomaselli, S., et al. The alpha-to-beta conformational transition of Alzheimer's A beta-(1-42) peptide in aqueous media is reversible: A step by step conformational analysis suggests the location of beta conformation seeding. ChemBioChem. 7 (2), 257-267 (2006).
- Shigemitsu, Y., et al. Nuclear magnetic resonance evidence for the dimer formation of beta amyloid peptide 1-42 in 1,1,1,3,3,3-hexafluoro-2-propanol. Analytical Biochemistry. 498, 59-67 (2016).
- Khan, M. V., Rabbani, G., Ahmad, E., Khan, R. H. Fluoroalcohols-induced modulation and amyloid formation in conalbumin. International Journal of Biological Macromolecules. 70, 606-614 (2014).
- Fang, F., et al. 5-hydroxycyclopenicillone, a new beta-amyloid fibrillization inhibitor from a sponge-derived fungus trichoderma sp HPQJ-34. Marine Drugs. 15 (8), 260 (2017).
- Shiao, Y. J., Su, M. H., Lin, H. C., Wu, C. R. Echinacoside ameliorates the memory impairment and cholinergic deficit induced by amyloid beta peptides via the inhibition of amyloid deposition and toxicology. Food & Function. 8 (6), 2283-2294 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados