Method Article
Un modelo de lesión de Drosophila en Vivo para el estudio de Neurorregeneración en el periférico y sistema nervioso Central
En este artículo
Resumen
Aquí, presentamos un protocolo usando Drosophila neurona sensorial - modelo de lesión de neurona arborización dendrítica (da), que combina en vivo en vivo la proyección de imagen, dos fotones láser axotomía/dendriotomy y potentes herramientas genéticas mosca, como una plataforma para la detección de potenciales promotores e inhibidores de Neurorregeneración.
Resumen
La capacidad de regeneración de neuronas dañadas gobierna Neurorregeneración y recuperación funcional después del trauma del sistema nervioso. En las últimas décadas, se han identificado varios intrínsecos y extrínsecos inhibidoras factores implicados en la restricción de la regeneración del axón. Sin embargo, simplemente quitando estas señales inhibidoras es insuficiente para la exitosa regeneración, indicando la existencia de maquinaria reguladora adicional. Drosophila melanogaster, la mosca de la fruta, comparte genes evolutionarily conservados y vías de señalización con vertebrados, incluyendo a seres humanos. Combinando la potente caja de herramientas genética de moscas con dos fotones láser axotomía/dendriotomy, Describimos aquí la neurona sensorial de la Drosophila – modelo de lesión de la neurona arborización dendrítica (da) como una plataforma para la detección sistemática de novela reguladores de la regeneración. Brevemente, este paradigma incluye a) la preparación de las larvas, la inducción b) lesión a dendrite(s) o axon(s) usando un láser de dos fotones, c) vivo confocal imagen después de la lesión y d) análisis de datos. Nuestro modelo permite lesiones altamente reproducible de solo etiquetadas neuronas, axones y dendritas de subtipos neuronales bien definidos, en el sistema nervioso central y periférico.
Introducción
La incapacidad de los axones para regenerar después de una lesión al sistema nervioso central (SNC), puede llevar a incapacidades permanentes en los pacientes y también desempeña un papel en el déficit neurológico irreversible en enfermedades neurodegenerativas1,2 ,3,4,5. El entorno de la CNS, así como la capacidad de crecimiento intrínseco de las neuronas, determina si los axones son capaces de regenerar después de trauma. Factores extracelulares de oligodendrocyte astroglial y fibroblásticas fuentes ha demostrado que impiden el crecimiento neuronal4,6,7,8, pero la eliminación de estas moléculas sólo permite limitado brote5. Las señales de regeneración intrínseca pueden influir en éxito regenerativa5,9 y representan potenciales dianas terapéuticas, pero estos procesos son todavía no bien definidos a nivel molecular. Aumento de factor trófico señalización o eliminación de frenos endógenos, tales como la fosfatasa Pten10, puede resultar en la regeneración axonal en determinadas circunstancias. Combinaciones de diferentes métodos individualmente efectivo también sólo proporcionan recuperación global limitada hasta la fecha11,12,13,14. Por lo tanto, hay una necesidad desesperada para identificar vías adicionales de terapia dirigida. Además de la apertura del nuevo crecimiento del axon, si y cómo los axones Re-cablea el objetivo correcto, especificidad de la sinapsis de la reforma y lograr la recuperación funcional son importantes preguntas sin respuesta.
En Resumen, la comprensión actual de la maquinaria que dictan la regeneración del axón es todavía muy fragmentaria. Parte del problema es la dificultad técnica de estudiar axon regeneración en los mamíferos en tiempo real, un enfoque que es costoso, desperdiciador de tiempo y desafiante para la realización de pantallas genéticas a gran escala. Drosophila melanogaster, por el contrario, ha demostrado para ser un sistema excepcionalmente poderoso para el estudio de cuestiones biológicas complejas. La mosca de la fruta ha sido fundamental en la definición de genes y vías que sorprendentemente se conservan en los seres humanos de señalización y ha sido un modelo exitoso para el estudio de las condiciones humanas, tales como las enfermedades neurodegenerativas, a través de las herramientas de genética molecular amplia disponible para manipular genes función15. En particular, moscas de la fruta se consideran una herramienta ideal para el descubrimiento de genes implicados en lesiones neurales y rebrote15,16. Se han desarrollado varios modelos de mosca lesiones neurales, incluyendo cabeza de adulto o larvario ventral nervio cuerda (VNC) punzante con agujas, VNC larval o aplastamiento del nervio con fórceps, neurona larvas láser axotomía, eliminación de neuronas receptoras olfatorias, explantes craneoencefálico, y lesión del nervio periférico por ala indemnización por15,17,18,19,20,21,22,23. Emocionante, trabajo utilizando Drosophila lesiones modelos recientes han avanzado nuestra comprensión de las vías celulares y genéticas utilizados por el sistema nervioso para responder a lesiones neuronales, algunos de los cuales se han demostrado para ser conservado en mamíferos24 ,25. Una vez más, esto pone de relieve la utilidad de este organismo modelo para identificables nuevos mecanismos de reparación neuronal.
Descrito aquí es un modelo de lesión larvas neurona sensorial de dos fotones láser Drosophila . Un láser de dos fotones primero fue utilizado para cortar axones en el pez cebra en vivo en 200326. En el mismo año, el primer dendriotomy de láser fue realizada en Drosophila utilizando un láser de nitrógeno pulsado27. Poco después, varios laboratorios de C. elegans utilizan láseres de femtosegundo para establecer modelos de axón regeneración28. En 2007, Wu y sus colegas compararon e informaron las diferencias entre lesiones del laser en C. elegans inducida por varios tipos de láseres29. En 2010, regeneración del axón tras axotomía láser era primer demostrada en Drosophila30. Basándose en esta literatura de lesión extensa láser, hemos desarrollado un modelo de mosca lesiones neurales utilizando el láser de dos fotones, que permite la inducción precisa de la lesión a sitios específicos con mínima perturbación de los vecinos de los tejidos, proporcionando un relativamente limpio sistema para el estudio de las propiedades intrínsecas y extrínsecas de Neurorregeneración con resolución unicelular. En concreto, hemos establecido un conjunto de métodos de lesión de las neuronas sensoriales de la arborización dendrítica (da) en tanto el sistema nervioso periférico (PNS) y CNS. Da las neuronas pueden agruparse en cuatro clases distintas que se distingue principalmente por su complejidad de dendrita ramificación: clase I a IV31. Nuestro trabajo publicado muestra que la regeneración de neuronas da se asemeja a modelos de lesión mamíferos a nivel fenotípico y molecular: las neuronas da mostrar las propiedades de regeneración específica de clase, con clase IV pero no clase I o III da neuronas exhibiendo la regeneración en el PNS; axones de neuronas de clase IV da regeneración robusta en la periferia, pero su potencial regenerativo se reduce drásticamente en el SNC, así asemejándose a las neuronas de ganglio (DRG) de la raíz dorsal en mamíferos; mejorar la actividad de mTOR través de Pten eliminación o sobreexpresión de Akt mejora la regeneración del axón en la mosca del CNS19. Utilizando este modelo de la lesión, han estado llevando a cabo pantallas genéticas y han identificado la enzima del procesamiento del RNA Rtca como factor inhibitorio evolutivamente conservado para la regeneración del axón, a lesión del axón al estrés celular y modificación de RNA20 .
En el paradigma actual, la lesión es inducida por láser axotomía/dendriotomy de larvas clase IV o III da neuronas, etiquetadas por ppk-CD4-tdGFP o 19-12-Gal4, UAS-CD4-tdGFP, repo-Gal80, respectivamente. La lesión se realiza en 2nd a 3 larvas de estadio derd en alrededor de 48-72 h después de la postura (h AEL). Para PNS axotomía la lesión está dirigida a la sección del axón ~ 20-50 μm lejos del cuerpo celular, axotomía CNS a un área de ~ 20 μm de diámetro en el cruce de la comisura en el VNC y para dendriotomy a los puntos de ramificación dendrítica primaria. La misma neurona está reflejada en el 8-24 h después de la lesión (AI) para confirmar el transection completo y a las 48-72 h AI evaluar la regeneración. A través de la proyección de imagen confocal de lapso de tiempo, la degeneración y la regeneración de axones individuales/dendritas que han sido heridos en vivo pueden ser monitoreados en el tiempo.
Protocolo
1. preparación de placas y botellas
- Preparación de las placas de agar jugo de uva
- Añadir 10 g de polvo de agar, zumo de uva 200 mL y mL 192 Dec2O en un vaso y microondas por unos 4-5 min, revolviendo intermitentemente hasta que se disuelva completamente el agar.
- En una campana de humos, enfriar la solución a aproximadamente 60 ° C. Añadir etanol al de 95% mL 4,2 y 4,0 mL de ácido acético glacial. Ajustar el volumen total de la solución de 400 mL con ddH2O. mezcla bien.
- Para cada placa de 35 mm, añadir unos 2-3 mL de la solución. Hacer aproximadamente 120-150 placas para un total de 400 mL de zumo de uva agar de solución.
- Espere 10 minutos enfriar las planchas y solidifique la solución de agar. El jugo de uva las placas de agar en bolsas ziplock auto sellado y almacenar a 4 ° C para su uso futuro.
- Preparación de frascos de cultivo de Drosophila
- Utilice una hoja para hacer un agujero triangular longitud del lado de 1,5 cm en una pared de la botella de cultivo de Drosophila y llenar el agujero con una bola de diámetro de 2-2.5 cm de algodón para la ventilación.
- Tape la botella con una placa de agar mosto suplementada con 0,5 cm3 de pasta de levadura.
2. colección de larvas de Drosophila
- Establecer cruces de moscas adultas
- Lugar 10 hembras vírgenes y 5 adulto macho vuela juntos en un frasco tapado con una placa de agar jugo de uva.
- Coloque los fondos de botella arriba a 25° C, para que las moscas ponen huevos en la placa de agar jugo de uva. Cambie la placa con pasta de levadura por lo menos una vez al día. Durante un período de colección 2-h, que permite la recolección de larvas de una etapa de desarrollo homogénea, comience con más de 20 Virgen hembras y 10 machos en el paso 2.1.1.
- Cultura la placa a 25° C en un plato de Petri de 60 mm con un tejido húmedo, por ejemplo, empapada en solución al 0.5% ácido propiónico. Colocar el tejido para que no obstruya el flujo de oxígeno.
Nota: La solución de ácido propiónico se utiliza para mantener la humedad en el plato y evitar el crecimiento de moho.
- Cosecha de las larvas de una edad específica
- Utilizar un par de pinzas para transferir las larvas de la etapa deseada, por ejemplo, 2nd a 3rd instar las larvas a las 48-72 h después de la postura (AEL), a una nueva placa de agar jugo de uva sin pasta de levadura.
- Retire la levadura la piel de las larvas permitiéndoles arrastrarse alrededor en la placa nueva, para evitar la interferencia potencial de levadura con láser axotomía y proyección de imagen. Por otra parte, limpie completamente las larvas lavarlas en un plato de PBS y secar brevemente en un pedazo de papel de seda.
3. dos fotones lesiones y proyección de imagen Confocal
- Configuración del microscopio
Nota: Se utilizó un láser confocal de barrido microscopio con un láser de dos fotones para este experimento, pero también bastará con otros sistemas con una configuración equivalente. El láser de dos fotones (930 nm) fue utilizado para la entrega de lesiones y un láser de argón (488 nm) fue utilizado para la proyección de imagen confocal de GFP.- Al principio de cada sesión, activar el láser de dos fotones u oambos confocal y el microscopio. Abra el software de imágenes.
- Por lesión de dos fotones, configurar los siguientes parámetros para la proyección de imagen GFP con el láser de dos fotones en 930 nm (1.950 mW).
- Seleccione el modo barrido de línea. Abrir el poro todo el camino. Aumentar la intensidad del láser a ~ 20% (390 mW).
- Seleccione 512 x 512 como la exploración del marco. Utilizar la máxima velocidad de exploración (normalmente con el tiempo de permanencia de pixel en 0,77 μs). Asegúrese de que el promedio es 1 y profundidad de bits de 8 bits.
- Ajuste ganancia ~ 750, y el offset a 0.
- Guarde este protocolo experimental previamente establecido como 2 P GFP 930 ablación, permitir a los experimentos de fácil reutilización en el futuro.
- Para la proyección de imagen confocal, configurar los siguientes parámetros para imágenes GFP con el láser de argón 488 nm:
- Seleccione la ficha de adquisición y Z-stack.
- Bajo "láser", conecte la alimentación para el láser de argón de 488 nm.
- Ir a canales, seleccione el láser de 488 mm y aumentar la potencia del láser para 5-10%. Para el agujero de alfiler, utilizar el aparato luminoso 1-2 (AU). Ajustar la ganancia a 650.
- En el Modo de adquisición, seleccionar 1024 x 1024 como la exploración del marco, use la velocidad máximo de análisis, un promedio de 2 y profundidad de bits de 8 bits.
- Guarde este protocolo experimental previamente establecido como Proyección de imagen de GFP.
- Anestesia de larvas con éter dietílico y montaje
- En una campana de humos, colocar un plato de vidrio de 60 mm en un plato de Petri de plástico de 15 cm. Doble y ponga un pedazo de papel de tejido en la parte inferior del plato de vidrio, luego coloque una placa de agar jugo de uva en el tejido. Añadir éter dietílico en el plato de vidrio, hasta el punto donde el papel se haya empapado y hay una capa de éter líquido restante en el plato. Mantenga la tapa en todo el tiempo.
- Preparar un portaobjetos de vidrio con una gota de halocarburos 27 aceite en el centro. Añadir 4 manchas de grasa de vacío en las cuatro esquinas de la diapositiva, para después apoyar el cubreobjetos.
- Utilice pinzas para recoger una larva limpia y colóquela sobre la placa de agar en el plato de vidrio de 60 mm. Cubrir el plato de vidrio con su tapa y espere hasta que la larva deja de moverse. Para lesiones PNS/proyección de imagen, sacar la larva tan pronto como su cola deja de crispar. Para el SNC, espere hasta que la larva entera llega a ser inmóvil, especialmente los segmentos de la cabeza.
Nota: El tiempo de exposición de éter es crítico. Vea la discusión. - Cuidadosamente levante la larva anestesia y colocarlo verticalmente la cabeza sobre la gota de aceite de halocarbonos en la diapositiva. Añadir un cubreobjetos sobre el portaobjetos. Use una presión suave para empujar hacia abajo sobre el cubreobjetos, hasta que toque la larva (figura 1A).
- Ajustar la posición de la larva empujando suavemente el cubreobjetos hacia la izquierda o la derecha para rodar la larva, por lo que la neurona/axón/dendrita de interés está en la parte superior y más cercano a la lente del microscopio.
- Para lesiones PNS, Monte el lado dorsal de la larva, para que tanto el traquear es visibles. Luego rodar la larva ~ 30 grados a la izquierda para herir a los axones del neurona de la da de la III clase (figura 1B y 1C) y 90 grados para herir a los axones del neurona de la da de la IV clase (figura 1B y 1E) ~ 30 grados para lesiones clase IV da la neurona las dendritas ( Figura 2A).
- Para lesión del CNS, coloque la larva para ser perfectamente ventral hacia arriba (Figura 3A), de modo que la región de interés es más cercana a la lente del microscopio en el plano z.
- Lesiones por dos fotones láser
- Coloque el portaobjetos con la larva en el microscopio y fijarla con el soporte de diapositivas en el escenario. Objetivo de usar la 10 X (0.3 NA) para encontrar la larva.
- Añadir 1 gota de aceite objetiva sobre el cubreobjetos, cambiar a 40 X (NA 1.3) objetivo y ajuste el enfoque.
- Cambiar al modo de exploración y vuelva a usar el protocolo experimental 2 P GFP 930 ablación. Asegúrese de que el poro se abre completamente.
Nota: La configuración debe ser optimizado basado en sistemas individuales. - Iniciar el modo de vivir para localizar la región de interés (ROI) y ajuste la configuración para lograr buena calidad de imagen con el zoom adecuado.
Nota: El propósito de este paso es encontrar la neurona/axón/dendrita a lesionar, en lugar de tomar la mejor imagen de calidad. Por lo tanto, use la configuración mínima suficiente para visualizar el área de la blanco, para evitar la sobreexposición o fotoblanqueo. - Detener análisis de Live , por lo que estará disponible el botón recortar . Deje que la imagen sirva de la hoja de ruta. Seleccionar la función de cultivos y ajustar la ventana de exploración para centrarse en el objetivo de ser heridos.
- Reducir el retorno de la inversión para ser del tamaño del posible sitio de la lesión. Por ejemplo, sólo cubren el ancho de un axón o una dendrita, para asegurar la precisión de las lesiones y reducir el daño a los tejidos vecinos. Si lo desea, acercarse al retorno de la inversión antes de recortar, lo que permite mayor precisión lesiones.
- Abrir una nueva ventana de imagen. Reducir la velocidad de exploración y aumentar la intensidad del láser. Determinar el aumento en la intensidad de láser basado en la señal de fluorescencia del tejido analizada en modo Live .
- Normalmente, ajuste la intensidad de laser de dos fotones a partir de 25% para lesiones PNS y 50-100% para lesiones VNC. Para lesión del axon PNS, asegúrese de que la intensidad del láser es ~ 480 mW y pixel tiempo de permanencia es de 8,19 μs. Para la lesión del axón VNC, asegúrese de que el tiempo de permanencia de píxeles y la intensidad de láser suelen 965-1930 mW y 8.19-32.77 μs, respectivamente.
- Iniciar el análisis continuo . Deja el cursor sobre el botón continua . Mantener una estrecha vigilancia sobre la imagen y detener el análisis tan pronto como se observa un incremento en fluorescencia.
Nota: La aparición de la espiga de la fluorescencia es debido a la auto-fluorescencia en el sitio de la lesión. - Cambiar al modo directo mediante la reutilización de la configuración. Encontrar la región de interés que sólo se ajuste el enfoque.
Nota: Una buena indicación de lesión exitosa es la aparición de un pequeño cráter, anillo-como la estructura o escombros localizados en el sitio de la lesión. - Pasar a la siguiente neurona y repita desde el paso 3.3.5, lesionar las neuronas múltiples en un solo animal. O repita el paso 3.3.5 mientras poco a poco aumentando la potencia y reducir la velocidad de exploración si la lesión inicial fue insuficiente.
Nota: En caso de que la potencia del láser es demasiado alta, una gran área dañada será visible en la imagen de escaneado de la lesión. Demasiado herida puede causar la muerte de la larva. - Recuperar la larva con cuidado retirar el cubreobjetos y transferencia de la larva de heridos en un nuevo plato con pasta de levadura. Zanja de varias cuevas en la placa de agar con fórceps; por otra parte, hacer una isla de agar en la placa en lugar de utilizar la placa entera, para reducir la posibilidad de la larva arrastrándose fuera de la placa.
- Poner la placa en caja Petri de 60 mm con tejido húmedo (embebido en solución al 0.5% ácido propiónico) y cultivo a temperatura ambiente o 25° C.
Nota: La larva permanecerá en la etapa larvaria durante aproximadamente un día extra a temperatura ambiente (22° C) comparado a 25° C.
- La proyección de imagen confocal después de la lesión
- Imagen la larva lesionada en puntos de tiempo deseado mediante la preparación de la larva con el mismo procedimiento de la anestesia y montaje como en el paso 3.2, entonces la proyección de imagen con el láser confocal.
Nota: La larva a las 24 h después de la lesión (AI) para confirmar la lesión axonal y en AI (las neuronas da de clase IV) de 48 h o 72 h AI (clase III da las neuronas) para evaluar la regeneración de la imagen. - Localice la larva con el objetivo de X 10, luego cambiar a una de 25 X (0.8 NA) objetivo. Volver a utilizar el protocolo experimental Imagen de GFP.
- Haga clic en el botón de Live y encontrar la misma neurona herida previamente.
- Fijar las posiciones Z primeras y últimas en la ventana de escaneado. Pulse stop y haga clic en Inicio experimento para adquirir una imagen Z-stack.
Nota: Asegúrese de que un punto de normalización (el punto de convergencia de axón) está incluido en la captura de imágenes para que sea posible la cuantificación de la regeneración (figura 1, 1F): esto se discute más adelante en la sección de análisis de datos. - Conmutador para Procesamiento de imágenes, seleccione la imagen que acaba de tomar y generar una proyección de intensidad máxima. Guardar el z-stack y la intensidad máxima proyección imágenes.
- Imagen la larva lesionada en puntos de tiempo deseado mediante la preparación de la larva con el mismo procedimiento de la anestesia y montaje como en el paso 3.2, entonces la proyección de imagen con el láser confocal.
4. Análisis de datos
- Procesar y cuantificar imágenes usando la proyección de imagen software o ImageJ.
- Cuantificación de la regeneración del axón en el PNS
- Calcular el porcentaje de regeneración, que se refiere al porcentaje de regeneración de axones entre todos los axones que estaban lesionados. Puntuación de un axón como regenerador como regrows más allá del sitio de lesión.
- Medida longitud de regeneración, que es el aumento en la longitud del axón. Si cuantificar con ImageJ, utilice la herramienta Línea segmentada para rastrear el axón regenerado y utilizar medida en el menú Analyze para obtener la longitud de la línea que representa el axón regenerado.
- Calcular el Índice de regeneración, que es el aumento de longitud de axón normalizado.
Nota: La longitud del axón es normalizado por la distancia entre el cuerpo de la célula y el axon convergente punto (DCAC) – longitud del axon/DCAC (figura 1 y 1F). Este valor ayuda a explicar cualquier crecimiento axonal debido a escala larvas. Un valor positivo representa la regeneración, un valor de 0 significa que no hay regeneración y un valor negativo significa contracción.
- Cuantificación de la regeneración de la dendrita
- Calcular el porcentaje de regeneración, que es el porcentaje de neuronas da entre todos los roto que muestran rebrote evidente dendrita.
Nota: Nuevo crecimiento de la dendrita se anotó como positivas si nuevas dendritas crecer fuera del tallo dendrítico retraído y más allá del sitio de lesión. El sitio de la lesión está decidido por puntos de referencia y en algunos casos, es fácilmente visible por el autofluorescence inducida por la lesión residual. - Calcular el aumento de puntos de ramificación, que cuenta con la adición de nuevos puntos de ramificación dendrítica después de lesión.
- Calcular el aumento de la longitud total de la dendrita, que es la longitud acumulada de todas las dendritas nuevo añadido después de la lesión.
- Calcular el porcentaje de regeneración, que es el porcentaje de neuronas da entre todos los roto que muestran rebrote evidente dendrita.
- Cuantificación de la regeneración de axones en el SNC
Nota: Si un sitio de la lesión muestra degeneración del primer punto de la hora reflejada (figura 3B), se incluirá en el análisis de longitud de regeneración y ritmo.- Medida longitud de regeneración, que es la longitud de los axones regenerados.
Nota: El axón rebrote de un sitio de la lesión solo se identifica como origina la ruta axón original antes de la lesión. - Calcular la longitud de regeneración normalizado, que normaliza la longitud de la regeneración a la longitud del segmento comisura - distancia longitudinal entre las comisuras ("Y" en la Figura 3A y 3B).
Nota: Este valor ayuda a corregir el efecto de las diferencias de tamaño de larvas. - Calcular tasa de regeneración, que es el porcentaje de regeneración de segmentos de entre todos los segmentos que estaban lesionados, para reflejar la capacidad de regeneración de un genotipo particular.
- Medida longitud de regeneración, que es la longitud de los axones regenerados.
Resultados
Las neuronas da muestran regeneración diferencial potencial entre el periférico y sistema nervioso central, así como especificidad de clase. Esto proporciona oportunidades únicas para detectar nuevos factores que se requieren para la regeneración del axón (utilizando la clase lesión IV ENP), así como aquellos que son inhibitorios para la regeneración (con lesiones de clase IV CNS y clase lesión III PNS).
Regeneración del Axon en el PNS
Por ejemplo, se describe la caracterización de la regeneración de las neuronas da de clase III y clase IV. Estas neuronas están ubicadas bilateralmente en cada segmento del cuerpo. Múltiples neuronas pueden lesionarse en la misma larva; por lo general, 3-4 neuronas en el lado derecho de segmentos abdominales A7-A2. Clase III y clase IV da neuronas pueden visualizarse por 19-12-Gal4, UAS-CD4tdGFP, repo-Gal80 y ppk-CD4tdGFP, respectivamente. Anestesiar y larvas AEL de 48-72 h de montaje como se describe, ajustar la posición de las larvas para que las neuronas da de interés son hacia arriba (figura 1A y 1B). Nos suele lesionar el ddaF de clase III y clase IV v'ada neuronas (figura 1 y 1E). Realizar axotomía y recuperar larvas como se describe. Poco después de la lesión (AI), las larvas habrán recuperado de locomoción normal cirugía y exposición. La tasa de supervivencia suele ser sobre 80%. Deseche las larvas que están muertos o enfermos. Vuelva a montar el resto como se describe y evaluar la degeneración. A las 24 h AI, los axones distales deben haber completado la degeneración en este tiempo punto19, y el tronco del axón será fácilmente visible (figura 1 y 1F). Crear una nueva imagen de las mismas larvas en 48 h AI de neuronas de da clase IV o 72 h AI de neuronas de clase III da para evaluar la regeneración. Generalmente pretendemos evaluar neuronas al menos 20 lesionadas por condición experimental. En (tipo salvaje) WT animales, mientras que típicamente ~ 70% da superficie clase IV neuronas habrán regenerado más allá del sitio de la lesión (Figura 1F), neuronas de clase III da dejar de crecer, evidencian por el cono de crecimiento estancamiento (figura 1).
Regeneración de la dendrita
Generalmente realizamos dendriotomy en clase IV da neuronas ddaC (figura 2A). Como se muestra en el diagrama esquemático, la lesión está dirigida al punto rama dendríticas primario. Basado en la experiencia, cuando lesiona a las 48 h AEL, ~ 50% de las neuronas ddaC regenerar sus dendritas (figura 2B). En el 50% restante, las dendritas vecinas invaden y cubren el espacio vacante. Además, el potencial de regeneración de estas neuronas se reduce si se lesionan en una etapa de desarrollo más adelante.
Regeneración de axones en el SNC
Para lesión del axon VNC, la tasa de supervivencia de las larvas varía considerablemente y depende de la edad en que es inducida por lesión. Basado en la experiencia, las larvas de 48-72 h AEL tienen la mayor tasa de supervivencia (> 60%) entre las diferentes etapas de la prueba. Larvas de menos de 48 h AEL mal sobrevivieron después de la lesión, mientras que en mayores de 72 h AEL es difícil de presentar lesiones en el VNC. Por otra parte, es más fácil de inducir lesiones en los segmentos de la comisura posterior que la anterior, ya que estos segmentos posteriores de la VNC son más cercano a la superficie ventral y así más accesible por láser (Figura 3A).
Para herir a axones de neuronas de da clase IV en el SNC, Monte las larvas como se describió anteriormente (Figura 3A). Bajo el microscopio, ubicar la escalera-como la estructura de paquetes de axones que forman parte de la VNC (Figura 3A) y realizar axotomía como se indica. La degeneración se confirma a las 8 h AI y regeneración son evaluados a las 24 y 72 h AI. Como se muestra en la figura 3B, axones a las 8 h AI ya han comenzado a degenerar, y a las 24 h AI, regeneración del axón se observa mientras que restos del axón pueden todavía ser encontrado alrededor de los sitios de lesión. Axones WT muestran crecimiento limitado en el VNC y no vuelva a conectar las brechas generadas por la lesión (figura 3B). Para cuantificar la capacidad de regeneración de axones lesionados, la longitud de rebrote después de lesiones se miden y la longitud de la comisura (Y en la Figura 3A) se utiliza para la normalización (figura 3).
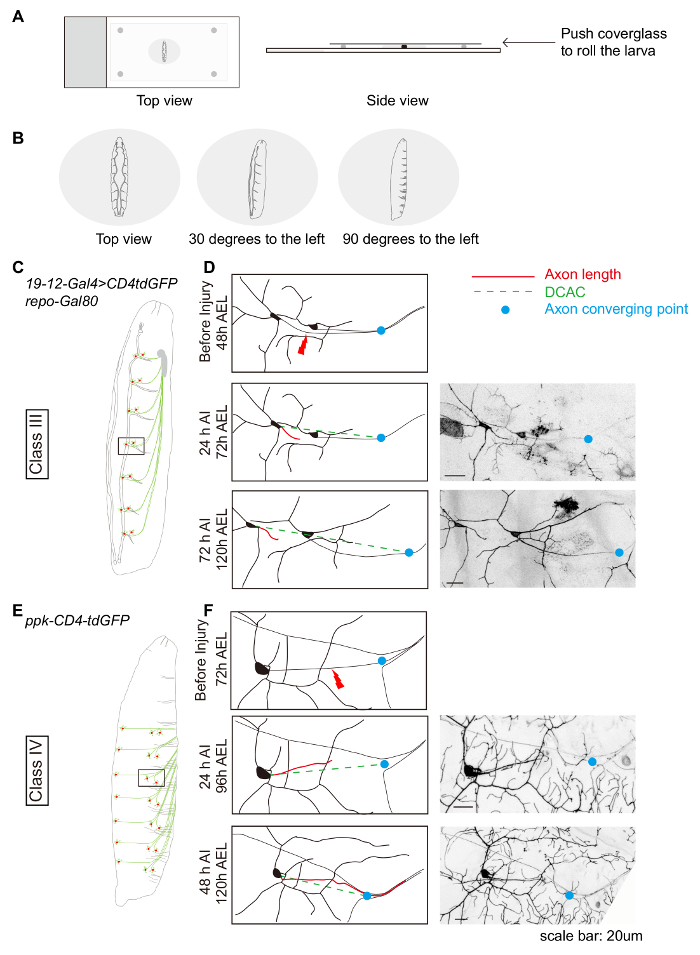
Figura 1: Da regeneración de axones de neuronas en la periferia muestra especificidad de clase. (A y B) Dibujo mostrando la posición de las larvas de esquemático. (C) dibujo esquemático del neuronas de clase III da. (D) axones de la clase III da neuronas ddaF, con 19-12-Gal4, UAS-CD4-tdGFP, repo-Gal80 / +, no vuelva a crecer. (E) dibujo esquemático de las neuronas da de clase IV. Axones (F) de la v'ada de las neuronas da clase IV, con ppk-CD4-tdGFP / +, crecer más allá del sitio de la lesión. (D y F) Línea roja indica longitud de axón, mientras que línea verde discontinua marca la distancia entre el cuerpo de la célula y el axon convergente punto (DCAC). El punto azul marca el punto de convergencia de axón. Barra de escala = 20 μm. haga clic aquí para ver una versión más grande de esta figura.
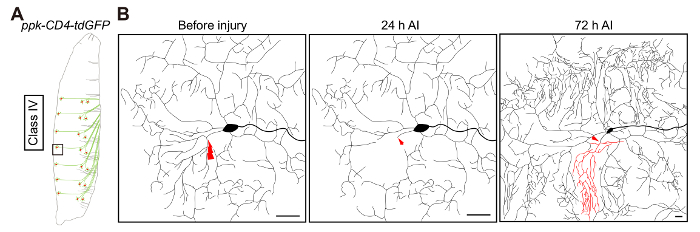
Figura 2: Da regeneración de dendrita de la neurona. (A) representación ilustrativa de las neuronas da de clase IV. (B) representación ilustrativa de la regeneración de la dendrita en clase IV da neurona ddaC, por ppk-CD4-tdGFP / +. Ablación láser es dirigida al punto de rama primaria y se lleva a cabo a las 48 h AEL. Lesión de 24 h AI transection de la neurita es confirmado, y a las 72 h AI se cuantifica la regeneración. Las dendritas de las neuronas ddaC demuestran crecimiento substancial, con nuevas ramas dendríticas brotando del tallo cortado al espacio vacante. Cabe señalar que nuevas ramas terminales se agregan continuamente a las dendritas ileso en esta etapa del desarrollo. Barra de escala = 20 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Da regeneración de axon de la neurona en el VNC. (A) dibujo esquemático de una larva de Drosophila montado en un portaobjetos y reflejada bajo el microscopio. Axones de neuronas de da IV en el VNC visualizado en la clase un ppk-CD4tdGFP / + larva. En la imagen ampliada y el dibujo esquemático se muestran dos segmentos de comisura de candidato. Cada uno de ellos tiene dos sitios de la lesión (círculos rojos). (B) imágenes confocales de un segmento lesionado, reflejada en el 8, 24 y 72 h después de la lesión (AI). Líneas rojas representan los axones regenerados. (C) medición y normalización de regrowing axones. Barra de escala = 20 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Cuando cruza la configuración de vuelo, el número de hembras y machos utilizados puede variar dependiendo de los genotipos y el número de larvas para experimentos específicos. Para moscas de la WT, Cruz típico utiliza 10 hembras y 5 machos. La ventana colección puede ser reducida, dependiendo de la exactitud de la edad de las larvas requerida. Por ejemplo, un período de 2-h colección darán larvas de una población más homogénea. En este caso, utilizando 20 o más vírgenes hembras para configurar las cruces le ayudará a producir suficientes huevos. El rendimiento desde el primer día es generalmente escaso, así que recoger el plato con los huevos dos o más días después de configurar la cámara. Cuando más cultivo de la placa con los huevos, se recomienda en remojo el tejido en el plato de Petri de 60 mm en solución al 0.5% ácido propiónico en lugar de agua, que no sólo ayudan a mantener la humedad en el plato pero también evitar el crecimiento de moho.
Al configurar los dispositivos para anestesia de larvas y el montaje, asegúrese de utilizar un plato de cristal porque el éter se funde a través de plásticos. El plato de vidrio se encuentra en una placa de Petri en caso de una fuga de plástico 15 cm. El papel de tejido ayuda a preservar el éter en el plato para que la larva se puede golpear con eficacia hacia fuera por el vapor de éter. Es recomendable utilizar soltando botellas para almacenar alícuotas de éter y adición de éter en gotas con el gotero de vidrio ámbar. Reponer el éter y mantenga una capa de éter líquido en el fondo del plato para un efecto óptimo.
El momento de la exposición de éter es crítico: bajo anestesia conducirá a la recuperación de la larva en el medio de la sesión de imágenes e imágenes temblorosas; una sobredosis de anestesia, o contacto directo con el líquido éter, hará que la mortalidad. Para maximizar la supervivencia y la tasa de éxito, nuestra regla general es la siguiente: para lesiones PNS/proyección de imagen, extraer la larva tan pronto como su cola deja de crispar; para el SNC, espere hasta que la larva entera llega a ser inmóvil, especialmente los segmentos de la cabeza. Incluso un ligero movimiento interferirá con la lesión y la proyección de imagen de axones VNC. Larvas más viejas tienden a tomar más tiempo para noquear a. Generalmente toma menos de 2 min para larvas menores de 72 h AEL y 2-5 min para larvas de más de 72 h AEL.
Cuando ajuste la intensidad del láser de dos fotones para la lesión, el valor es determinado por la señal de fluorescencia de tejidos obtenida de la exploración "En vivo". La lesión se introduce por la exploración del "Continuo" como en el paso 3.3. El aumento de fluorescencia inducida por la lesión es por autofluorescencia en el sitio de lesión y sirve como un buen indicador de la ruptura de la neurita. Por lo general, tarda 1-10 s para ver el pico de fluorescencia. Es fundamental para controlar el tiempo de exploración una vez que la fluorescencia es elevada. Para lesiones PNS, es esencial para detener la exploración inmediatamente. La exposición prolongada a ampliar el sitio de la lesión y dañar los tejidos vecinos. Sin embargo, esto proporciona la oportunidad de ajustar el tiempo de la exploración y manipular la gravedad de la lesión. Una lesión en la exitosa debe tener un diámetro de tamaño de la lesión menor de 3-4 μm. Para lesión del axon VNC, los axones VNC se encajan mucho más profundo en comparación con las neuronas de PNS axones/las dendritas, que son justo debajo de la piel y por lo tanto requieren mayor intensidad del laser. Generalmente dejamos el análisis en unos segundos más. Esto es para asegurar que el paquete entero del axón es cortado. Si el radio de los sitios de lesión es más de la mitad del ancho del haz de la comisura, los sitios de lesión se cuentan como fracasados. Estas larvas tienen una baja tasa de supervivencia y no se incluirán en el análisis.
Para la regeneración del axón, la capacidad de regeneración es similar a través de estadios larvarios. Pero para la regeneración de la dendrita después de un corte sola dendrita, se reduce el potencial de la regeneración después de 72 h AEL19. Así, la lesión del axón se realiza típicamente en 48 h - 72 h AEL y dendrita lesiones a las 48h AEL, con la evaluación de la regeneración a las 120h AEL. También se pueden utilizar larvas de 24h AEL, pero requieren el tratamiento más cuidadoso, dado su menor tamaño. Las larvas forman pupas después de 120 h AEL, haciendo más difícil la proyección de imagen. Por lo tanto, nuestro objetivo es generalmente 120 h AEL.
¿Cuál es la relación entre degeneración y regeneración? Para lesión del PNS, en 24 h AI, normalmente el axon distal/dendrita en WT ha completado la degeneración Wallerian mientras que regeneración no ha comenzado en este momento. Por lo tanto, creemos que en las larvas de la WT, degeneración de neurites cortadas sólo tiene un impacto muy limitado en la regeneración, si en todos. Para lesiones VNC, axones a las 8 h AI ya han empezado a degenerar, y a las 24 h AI, regeneración del axón se observa mientras escombros axon todavía se encuentran alrededor de los sitios de lesión. Los escombros no parecen bloquear la regeneración. Sin embargo, es posible que bajo ciertas circunstancias, puede haber un traslapo o incluso una interferencia entre la degeneración y regeneración. De hecho, se ha informado que en los ratones envejecidos, remoción de escombros después de daño a los nervios periféricos es más lenta que en los animales jóvenes. Concomitante, fue observado reinervación más lento de la placa neuromuscular, que puede atribuirse a la mayor cantidad de obstrucciones regenerar axones encuentro en los animales viejos. Sorprendentemente, sin embargo, axones de animales de regeneran rápidamente y reinnervate sitios de unión neuromuscular eficiente cuando no se enfrenta con residuos32. Esto sugiere que facilitando la remoción de escombros podría ser una estrategia potencial para promover la regeneración.
En comparación con otros modelos de Neurorregeneración, el modelo de lesión de neurona sensorial mosca tiene ventajas únicas. Modelos de ratón suele tardar semanas a meses para llevar a cabo y no son adecuados para la realización de pantallas genéticas a gran escala; C. elegans tiene solamente un sistema de nervioso central primitivo que de cerca no puede recapitular las barreras de la regeneración en el SNC mamífero; a diferencia de los mamíferos, axones de CNS de pez cebra regeneran robusta. El rápido ciclo de vida de las moscas, la versatilidad de la mosca genética, accesibilidad y patrones estereotipados de axones/dendritas de neuronas sensoriales mosca y las propiedades de la característica de la regeneración de neuronas sensoriales mosca – subtipo específica regeneración en el PNS y limitada regeneración en el SNC – hacen las neuronas da de Drosophila un modelo atractivo para el estudio de Neurorregeneración. Por otra parte, estudios recientes de las células ganglionares de la retina de ratón aplastado (RGCs) también sugieren que subtipos neuronales son competencia de distintas regeneración; algunos subtipos de leve pueden regenerarse, mientras que otros en el paquete del nervio aparentemente homogénea no vuelva a crecer33. Este importante hallazgo sugiere que las estrategias específicas del tipo neuronales deben explotarse para promover la regeneración y recuperación funcional y sostiene firmemente que la inducción de la lesión del axón y el análisis de la regeneración posterior debe realizarse en un manera de subtipo específico neuronal. Además, los determinantes celulares y moleculares de este tipo de regeneración-especificidad permanecen en gran parte desconocido19,33. Por lo tanto, el modelo de lesión de neurona da ofrece el paradigma ideal para abordar estas cuestiones.
Respecto a la regeneración del axón, estudios centrados en la regeneración de la dendrita son mucho más escasos. Dendrita lastimarse, tales como lesión cerebral traumática, accidente cerebrovascular y muchas formas de neurodegeneración, pero casi nada se sabe sobre la capacidad de las dendritas para reparar y reformar las conexiones neuronales. El modelo de lesión de la neurona da nuevo proporciona un sistema muy accesible que muestra patrones estereotipados, especificidad de clase y regulación temporal19, para explorar este sentido.
También cabe destacar que mientras que es posible dañar un axón único etiquetado en el PNS, la lesión de forma se lleva a cabo en los resultados del CNS en la lesión de un haz de axones. Si lo desea, MARCM34 o el enfoque de35 clon FLP-out puede utilizarse para etiquetar solo axones en el SNC. Además, cuando las células gliales están marcadas simultáneamente con mRFP (Repo-Gal4, UAS-mRFP), la acumulación de los procesos de la glia se observa específicamente en el sitio de la lesión. Además, la expresión de Ptp99A, la mosca homólogo de condroitina sulfato proteoglicanos (CSPG) phosphacan PTPRZ1, es regulado hacia arriba en el sitio de la lesión. Ptp99A Co se localiza con las células gliales y rodea el sitio de la lesión, formando una estructura de anillo similar a lo que se ha divulgado para las cicatrices astroglial en mamíferos19,36,37. En conclusión, el modelo da la neurona lesiones, cuando se combina con los marcadores de otros tipos celulares como células gliales o células inmunes, permitirá en vivo vigilancia en tiempo real de las interacciones multicelulares entre una neurona lesionada y sus alrededores medio ambiente.
Mientras que este modelo de lesión de neurona sensorial de larvas de la mosca nos proporciona oportunidades de encontrar potenciales reguladores de Neurorregeneración en el PNS y CNS, todavía tiene varias limitaciones. En primer lugar, no es de alto rendimiento en la etapa actual. Por lo general, 5-6 genotipos podrían proyectará por una persona en una semana. Debe ser optimizado para una pantalla de imparcial. En segundo lugar, como la anestesia del éter en las larvas puede durar desde varios minutos a no más de veinte minutos, no es óptimo para la proyección de imagen a largo plazo. Así, se eligen momentos específicos que son representante de regeneración y degeneración del axon, respectivamente para la proyección de imagen. En tercer lugar, a pesar de que este protocolo está introduciendo una manera de herir a axones precisamente, la posibilidad de daño a los tejidos circundantes no se pueden excluir totalmente. En el VNC, estos tejidos pueden ser células gliales, axones y las dendritas de otras neuronas. Para minimizar esta advertencia posibles, reducir al mínimo los sitios de lesión, la más baja posible de la energía láser se aplica y realizar los mismos procedimientos en paralelo tanto controlar y experimentar grupos. En cuarto lugar, en el proceso de establecer el paradigma de lesión del CNS, probaron a los sitios de lesión diferentes, incluyendo los sitios cerca del termini de axón que elegimos usar y la entrada punto de axones en el VNC. Los puntos de entrada fueron encontrados para ser más difícil de lesionar debido a son más profundas en el tejido y más propensos a moverse. Así, por estas razones prácticas, optamos por el método actual, que es más consistente, mejor controlados y buena para los experimentos de mayor escala. Una preocupación potencial, como se indicó anteriormente, es la posibilidad de lesionar a los tejidos vecinos, como los componentes postsinápticos y las células gliales. Por otra parte, es una excelente pregunta cómo influyen los tejidos circundantes dañados en la degeneración y la regeneración de axones. Por ejemplo, cómo la cicatriz glial afecta la regeneración del axón. Esto presenta otra razón por qué nuestro modelo de lesión cerca puede asemejarse a modelos de lesión en los mamíferos, en el que axones y los tejidos alrededor de los sitios de lesión son generalmente heridos al mismo tiempo.
Lesión de láser seguida por microscopía de Time-lapse es un ensayo sensible para estudiar la regeneración del axón/dendrita. Sin embargo, una preocupación principal de este ensayo es el costo percibido, que va desde <$ 10K para láseres de pulso estado sólido low-end, $25-100K para láseres de femtosegundos para >$ 100K para los lasers de dos fotones. Hay varias buenas discusiones sobre sistemas láser diferentes axotomía29,38,39,40,41,42,43, 44 , 45. para resumir, láseres convencionales son óptimos para axones de corte dentro de 30-50 μm de la superficie. Habrá más daños colaterales con los lasers segunda nano y pico en comparación con el láser de femtosegundo, especialmente cuando aumenta la profundidad de la zona de destino45. Para herir a axones en el VNC, la profundidad de la que suele ser unos 50-100 μm, es esencial para minimizar el daño tisular. En este caso, el láser de dos fotones es ideal, que centra la energía del laser para el plano focal, reducción del daño colateral del tejido sin comprometer penetración del tejido. En conclusión, el sistema de dos fotones es costoso pero ofrece la mejor preservación de tejido y precisión. Sin embargo, si sólo los axones del SNP están el objetivo de la axotomía, láseres de pulso convencional pueden ser una alternativa más asequible.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Jessica Goldshteyn para soporte técnico. Trabajo en el laboratorio de la canción es financiado por la subvención del NIH R00NS088211 y el intelectual y el centro de investigación de discapacidades del desarrollo (IDDRC) nuevo programa desarrollo premio.
Materiales
| Name | Company | Catalog Number | Comments |
| Diethyl ether, ACS reagent, anhydrous | Acros Organics | AC615080010 | |
| Halocarbon 27 Oil | Genesee Scientific | 59-133 | |
| Phosphate buffered saline (PBS), 20x Concentrate, pH 7.5, supplier # E703-1L | VWR | 97062-948 | |
| Agar powder, Alfa Aesar, 500GM | VWR | AAA10752-36 | |
| Grape juice | Welch’s | ||
| Ethanol 95% (Reagent Alcohol 95%) | VWR | 64-17-5 | |
| Acetic acid | Sigma-Aldrich | A6283 | |
| Propionic Acid | J.T.Baker | U33007 | |
| Cover Glasses: Rectangles | Fisher Scientific | 12-544-D | 50 mm X 22 mm |
| Zeiss LSM 880 laser scanning microscope | Zeiss | ||
| Zen software | Zeiss | ||
| Chameleon Ultra II | Coherent |
Referencias
- Yakura, J. S. Recovery following spinal cord injury. , (1996).
- Harel, N. Y., Strittmatter, S. M. Can regenerating axons recapitulate developmental guidance during recovery from spinal cord injury? Nature reviews. Neuroscience. 7, 603-616 (2006).
- Jurewicz, A., Matysiak, M., Raine, C. S., Selmaj, K. Soluble Nogo-A, an inhibitor of axonal regeneration, as a biomarker for multiple sclerosis. Neurology. 68, 283-287 (2007).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat Rev Neurosci. 7, 617-627 (2006).
- Sun, F., He, Z. Neuronal intrinsic barriers for axon regeneration in the adult CNS. Curr Opin Neurobiol. , (2010).
- Liu, B. P., Cafferty, W. B., Budel, S. O., Strittmatter, S. M. Extracellular regulators of axonal growth in the adult central nervous system. Philos Trans R Soc Lond B Biol Sci. 361, 1593-1610 (2006).
- Liu, K., Tedeschi, A., Park, K. K., He, Z. Neuronal intrinsic mechanisms of axon regeneration. Annu Rev Neurosci. 34, 131-152 (2011).
- Schwab, M. E., Strittmatter, S. M. Nogo limits neural plasticity and recovery from injury. Curr Opin Neurobiol. 27, 53-60 (2014).
- He, Z., Jin, Y. Intrinsic Control of Axon Regeneration. Neuron. 90, 437-451 (2016).
- Park, K. K., et al. Promoting axon regeneration in the adult CNS by modulation of the PTEN/mTOR pathway. Science. 322, 963-966 (2008).
- Geoffroy, C. G., Hilton, B. J., Tetzlaff, W., Zheng, B. Evidence for an Age-Dependent Decline in Axon Regeneration in the Adult Mammalian Central Nervous System. Cell Rep. 15, 238-246 (2016).
- Geoffroy, C. G., et al. Effects of PTEN and Nogo Codeletion on Corticospinal Axon Sprouting and Regeneration in Mice. J Neurosci. 35, 6413-6428 (2015).
- Jin, D., et al. Restoration of skilled locomotion by sprouting corticospinal axons induced by co-deletion of PTEN and SOCS3. Nat Commun. 6, 8074(2015).
- Wang, X., et al. Axonal regeneration induced by blockade of glial inhibitors coupled with activation of intrinsic neuronal growth pathways. Exp Neurol. 237, 55-69 (2012).
- Fang, Y., Bonini, N. M. Axon degeneration and regeneration: insights from Drosophila models of nerve injury. Annual review of cell and developmental biology. 28, 575-597 (2012).
- Venken, K. J., Simpson, J. H., Bellen, H. J. Genetic manipulation of genes and cells in the nervous system of the fruit fly. Neuron. 72, 202-230 (2011).
- Leyssen, M., et al. Amyloid precursor protein promotes post-developmental neurite arborization in the Drosophila brain. The EMBO journal. 24, 2944-2955 (2005).
- MacDonald, J. M., et al. The Drosophila cell corpse engulfment receptor Draper mediates glial clearance of severed axons. Neuron. 50, 869-881 (2006).
- Song, Y., et al. Regeneration of Drosophila sensory neuron axons and dendrites is regulated by the Akt pathway involving Pten and microRNA bantam. Genes Dev. 26, 1612-1625 (2012).
- Song, Y., et al. Regulation of axon regeneration by the RNA repair and splicing pathway. Nat Neurosci. 18, 817-825 (2015).
- Kato, K., Forero, M. G., Fenton, J. C., Hidalgo, A. The glial regenerative response to central nervous system injury is enabled by pros-notch and pros-NFkappaB feedback. PLoS Biol. 9, e1001133(2011).
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Curr Biol. 22, 590-595 (2012).
- Xiong, X., et al. Protein turnover of the Wallenda/DLK kinase regulates a retrograde response to axonal injury. J Cell Biol. 191, 211-223 (2010).
- Brace, E. J., DiAntonio, A. Models of axon regeneration in Drosophila. Exp Neurol. 287, 310-317 (2017).
- Hao, Y., Collins, C. Intrinsic mechanisms for axon regeneration: insights from injured axons in Drosophila. Curr Opin Genet Dev. 44, 84-91 (2017).
- Galbraith, J. A., Terasaki, M. Controlled damage in thick specimens by multiphoton excitation. Mol Biol Cell. 14, 1808-1817 (2003).
- Sugimura, K., et al. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J Neurosci. 23, 3752-3760 (2003).
- Yanik, M. F., et al. Neurosurgery: functional regeneration after laser axotomy. Nature. 432, 822(2004).
- Wu, Z., et al. Caenorhabditis elegans neuronal regeneration is influenced by life stage, ephrin signaling, and synaptic branching. Proc Natl Acad Sci U S A. 104, 15132-15137 (2007).
- Stone, M. C., Nguyen, M. M., Tao, J., Allender, D. L., Rolls, M. M. Global up-regulation of microtubule dynamics and polarity reversal during regeneration of an axon from a dendrite. Mol Biol Cell. 21, 767-777 (2010).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Kang, H., Lichtman, J. W. Motor axon regeneration and muscle reinnervation in young adult and aged animals. J Neurosci. 33, 19480-19491 (2013).
- Duan, X., et al. Subtype-specific regeneration of retinal ganglion cells following axotomy: effects of osteopontin and mTOR signaling. Neuron. 85, 1244-1256 (2015).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22, 451-461 (1999).
- Grueber, W. B., et al. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Buss, A., et al. NG2 and phosphacan are present in the astroglial scar after human traumatic spinal cord injury. BMC Neurol. 9, 32(2009).
- McKeon, R. J., Jurynec, M. J., Buck, C. R. The chondroitin sulfate proteoglycans neurocan and phosphacan are expressed by reactive astrocytes in the chronic CNS glial scar. J Neurosci. 19, 10778-10788 (1999).
- Raabe, I., Vogel, S. K., Peychl, J., Tolic-Norrelykke, I. M. Intracellular nanosurgery and cell enucleation using a picosecond laser. J Microsc. 234, 1-8 (2009).
- Hutson, M. S., Ma, X. Plasma and cavitation dynamics during pulsed laser microsurgery in vivo. Phys Rev Lett. 99, 158104(2007).
- Venugopalan, V., Guerra, A. 3rd, Nahen, K., Vogel, A. Role of laser-induced plasma formation in pulsed cellular microsurgery and micromanipulation. Phys Rev Lett. 88, 078103(2002).
- Bourgeois, F., Ben-Yakar, A. Femtosecond laser nanoaxotomy properties and their effect on axonal recovery in C. elegans. Opt Express. 16, 5963(2008).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. , (2009).
- Tsai, P. S., et al. Plasma-mediated ablation: an optical tool for submicrometer surgery on neuronal and vascular systems. Curr Opin Biotechnol. 20, 90-99 (2009).
- Chung, S. H., Clark, D. A., Gabel, C. V., Mazur, E., Samuel, A. D. The role of the AFD neuron in C. elegans thermotaxis analyzed using femtosecond laser ablation. BMC Neurosci. 7, 30(2006).
- Williams, W., Nix, P., Bastiani, M. Constructing a low-budget laser axotomy system to study axon regeneration in C. elegans. J Vis Exp. , (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados