Method Article
Disección del páncreas de ratón para análisis histológico y perfiles metabólicos
En este artículo
Resumen
Este artículo de video ofrece una demostración detallada de los procedimientos necesarios para eliminar con éxito el páncreas de un ratón por disección para análisis histológico y perfiles metabólicos.
Resumen
Hemos estado investigando el factor de transcripción específico de páncreas, 1a cre-recombinase; sarcoma de rata LOX-parada-lox-Kristen, glicina, ácido aspártico en el codón 12 (Ptf1acre / +; LSL-KrasG12D / +) tensión del ratón como un modelo humano de cáncer de páncreas. El objetivo de nuestros estudios actuales es identificar nuevos biomarcadores metabólicos de la progresión del cáncer de páncreas. Hemos realizado perfilado metabólico de orina, heces, sangre y extractos de tejido de páncreas, así como el análisis histológicos del páncreas a la progresión del cáncer de la etapa. El páncreas de ratón no es un órgano sólido bien definido como en los seres humanos, sino que es un tejido blando difusamente distribuido que no se identifica fácilmente por individuos familiarizados con la anatomía interna del ratón o por personas que tienen poca o ninguna experiencia realizando disecciones de órganos de ratón. El propósito de este artículo es proporcionar una step-wise manifestación visual para orientar a los novatos en la extirpación del páncreas de ratón por disección. Este artículo debe ser especialmente valioso para los estudiantes y los investigadores nuevos a la investigación que requiere la recolección del páncreas de ratón por disección de perfiles metabólicos o análisis histológicos.
Introducción
El ratón se ha convertido en un importante modelo animal de cáncer de páncreas humano1,2. En el Ptf1acre / +; LSL-KrasG12D / + modelo de ratón, Kristen oncogene de rata sarcoma (K-Ras) se activa exclusivamente en el páncreas, dando lugar a la iniciación de las lesiones precancerosas en el páncreas, conocidas como neoplasias intraepiteliales pancreáticas (PanINs), que el progreso para adenocarcinomas ductales pancreáticas, comúnmente contempladas como PDACs3. Este sistema de modelo de ratón ofrece uno de los modelos animales mejor disponibles para cáncer pancreático humano4,5, con la ventaja adicional que el PanINs surgen dentro de los primeros cinco meses de vida y con frecuencia el progreso PDAC dentro de un solo año4,5, mientras que el cáncer de páncreas ocurre más frecuentemente en los seres humanos 60-70 años de edad.
Extracción de páncreas por la disección de la Ptf1acre / +; LSL-KrasG12D / + ratones en diferentes edades permite el examen histológico longitudinal detallado de desarrollo del cáncer en el páncreas, que van desde las primeras etapas de PanIN a través de la progresión de la PDAC3,4 , 5. recolección del páncreas en edades que van de cinco a quince meses puede usarse para preparar tejido extractos para caracterizar los cambios globales en el metabolismo del páncreas4 que ocurren durante la transición de sano a enfermo del tejido 6,7.
Este artículo presenta a una completa guía visual de los pasos necesarios para realizar una extracción de páncreas de ratón y proporciona directrices para el almacenamiento de un páncreas para su posterior análisis. Esta guía será igualmente valiosa para personas que realizan investigación sobre otras enfermedades pancreáticas, incluyendo diabetes tipo y deben ser especialmente útiles para estudiantes e investigadores nuevos a la investigación que implica la cosecha de los páncreas de ratón utilizando disección de perfiles metabólicos o análisis histológicos.
Protocolo
los procedimientos realizados en el video y se describen a continuación han sido aprobados por el cuidado institucional del Animal y el Comité uso (IACUC) en la Universidad de Miami.
1. preparación y estímulo de prueba
- establecer dos zonas diferenciadas para el procedimiento quirúrgico, la mesa de operaciones y la mesa después de la operación. Etapa de ambas áreas con todos los materiales y utensilios necesarios.
Tabla de
- el funcionamiento de la etapa bajo una campana de ventilación. Arreglar la mesa con el equipo de una manera que permite el funcionamiento continuo y sin trabas de procedimiento.
- Establecer un cuadro postoperatorio en la misma habitación y cerca de la mesa principal de la operación. Mantener ambas tablas como ambientes estériles durante el procedimiento.
- Lugar las siguientes fuentes en la mesa de operaciones: un tarro con tapa, un tubo de 15 mL, un par de tijeras quirúrgicas, una apretar botella de etanol al 70%, dos placas de espuma, dos pinzas, dos jeringas de 1 mL 21 calibre, dos tubos de 50 mL, tubo de uno centrífuga , un frasco criogénico, cuatro cojines quirúrgicos, diez pernos, un dispensador de toallitas de esterilización y un contenedor.
- Coloque los siguientes suministros en la mesa después de la operación: una balanza analítica, una 4 L dewar de nitrógeno líquido, un ancho superficial de la boca dewar, un flotante estante microtubo, un par de tijeras quirúrgicas, pinzas de dos, cuatro frascos criogénicos y un dispensador de toallitas o pañitos estériles.
- Llenan un 50 mL y un tubo de 15 mL a 75% volumen de formalina.
- Usando un perno en cada esquina, colocar un cojín quirúrgico a un tablero de la espuma de aproximado 30 cm x 30 cm para servir como la Junta de la disección. Utilice las cuatro clavijas restantes durante la operación. Preparar un pequeño tablero de la espuma con un paño quirúrgico para transferir a los órganos a la mesa después de la operación.
PRECAUCIÓN: Isoflurano (99.9%) es un producto químico tóxico y debe utilizarse en una campana de ventilación para garantizar el máximo nivel de seguridad de la depuración de gases anestésicos residuales 8. Información adicional sobre los riesgos a los investigadores asociados con el uso del método de caída libre con isoflurano puede encontrarse en un artículo por Taylor y Mook 8. - Coloque un cojín quirúrgico en el tarro de cristal y remojo con unas gotas de isoflurano (99,9%) y coloque una toalla de papel sobre la parte superior para evitar el contacto directo del ratón con el isoflurano. Del mismo modo, utilice una almohadilla de quirúrgica línea tubo restante y poner en remojo con unas gotas de isoflurano y coloque una almohadilla adicional sobre la parte superior para evitar el contacto directo entre el ratón y el isoflurane.
- Nitrógeno líquido vertido en la boca ancha baja dewar hasta línea de llenado máximo se alcanza. Compartimiento de
- lugar el ratón seleccionado para la disección en la anestesia, es decir, el tarro de cristal con un paño empapado con unas cuantas gotas de isoflurano (99,9%) cubierto con la tapa, para ~ 1 min
Nota: Este tiempo varía de ratón a ratón. Una vez que el ratón está inconsciente, retire de la cámara y colocarlo sobre el tablero operativo. - Oriente el ratón de manera que esté acostada lateral ventral y con su cabeza apuntado lejos del científico. Coloque el cabezal dentro del tubo con un cojín quirúrgico impregnado con unas gotas de isoflurano (99,9%) y realizar una prueba de estímulo una pizca de pie para asegurarse de que el ratón no responde a estímulos.
- Si esta prueba falla y el ratón responde a la prueba del pellizco de pie, repita el paso 1.8.
2. Inicial de incisión, punción del corazón y la eutanasia
- Pin las extremidades del ratón para el tablero de la espuma quirúrgica y mojado el lado ventral del ratón con etanol al 70%.
- Pellizcar la piel/piel cerca de la abertura uretral con pinzas y tire ligeramente hacia arriba. Hacer una incisión con las tijeras quirúrgicas a través de la cavidad abdominal a partir de la apertura uretral, la línea media y terminando en la barbilla.
- Cerca del punto de partida de la incisión inicial, agarra un lado de la piel/piel con las pinzas y hacer otra incisión con las tijeras hacia abajo y en diagonal hacia la pata trasera.
- Repetirlo de la misma manera en el lado opuesto.
Nota: La piel, la piel puede ser inmovilizada para crear una abertura más amplia, pero no es necesaria.
- Localizar el corazón y quitar el pericardio, que es el saco alrededor del corazón, para evitar la obstrucción de la aguja de la jeringa.
- Agarre el pericardio con el fórceps y cortar con las tijeras. Realizar la punción del corazón introduciendo con cuidado la aguja de la jeringa en el corazón y poco a poco empieza a retraer el émbolo.
- Para recolección de sangre óptimo, utilice el émbolo de la aguja para imitar la acción de bombeo del corazón y evitar demasiado rápido.
Nota: Por lo general alrededor de 1 mL de sangre se puede recoger. - Después de completar la colección de sangre, disipar la sangre en el tubo de centrífuga y deseche la jeringa en el contenedor.
- Después de realiza la punción del corazón, realizar eutanasia quitando los accesorios conectando el corazón.
Nota: Heparina, un anticoagulante, no fue añadida a la jeringa en este procedimiento antes de la punción del corazón para permitir que la sangre a coagular para la colección de suero en este estudio específico. Sin embargo, si el investigador desea prevenir la coagulación de la sangre para recoger el plasma, la heparina podría añadirse a la jeringa antes de la punción del corazón.
- Si el estudio implica el genotipado del ratón, cortar una porción de la oreja con las tijeras y coloque en un tubo de centrífuga para una verificación de genotipos.
3. extracción de páncreas
- localización del estómago en el lado izquierdo del ratón. Comenzar suavemente (para evitar el rasgado) separa el páncreas estómago y el duodeno mediante el uso de dos pinzas.
Nota: Al extraer el páncreas desde el estómago y los intestinos, es muy importante que las pinzas se utilizan suavemente para guiar el tejido del páncreas de los órganos y para no aplastar o romper el páncreas con el fórceps.- Continuar separar el páncreas de las secciones de yeyuno e íleon del intestino delgado y por último de intestino ciego del intestino grande.
- En el intestino ciego, vuelva a colocar las pinzas y continuar la separación del páncreas a lo largo de los dos puntos restantes hacia el recto.
Nota: En este punto, es conveniente cortar y quitar la porción del estómago a la región de los dos puntos inmediatamente anterior del recto. - Localizar el páncreas y Unido del bazo. Deslice el páncreas hacia el lado derecho del ratón. Separar las conexiones restantes entre el páncreas y la cavidad torácica con el fórceps para separar totalmente el páncreas y el bazo contiguas.
- Quitar el páncreas y extienda para el examen. Deje el bazo, atado páncreas para propósitos de identificación.
- Quitar todos del tejido conectivo, grasa y mesentérico del tejido del páncreas.
Nota: Este tejido es más blanco en color y así puede ser fácilmente distinguido del tejido del páncreas es más rosado en color. Esto es particularmente importante si el páncreas entero debe ser extirpado. Por ejemplo, si el páncreas tiene que ser pesado y en comparación con el peso corporal o entre grupos de animales. En el Ptf1a cre / +; LSL-Kras G12D / + modelo con ratones, específicamente en los meses más viejo, duro fibroso tejido pancreático puede estar presente. En este caso, deberá realizarse remoción cuidadosa del páncreas como los intestinos podrían ser entrelazados en tejido tumoral. En casos avanzados, bazo anormal y el tejido del hígado pueden también estar presentes.
- Quitar todos del tejido conectivo, grasa y mesentérico del tejido del páncreas.
- Si lo desea, eliminar otros órganos en este momento.
4. recopilación de datos y almacenamiento
- después de la extracción de los órganos, mover las muestras al área de postoperatorio para la preservación de.
- Pesan cada órgano y colocarlos en su respectivo frasco criogénico.
Nota: a lo largo de ingenioh la masa de cada muestra, se deben registrar las irregularidades para futura referencia. - Una vez que los órganos son pesados, colocarlos en el nitrógeno líquido para congelar rápido.
- Después de snap congelar, almacenar los órganos a-80 ° C para almacenamiento a largo plazo.
- Colocar las muestras de formol almacenada en la mesa durante la noche y la mañana siguiente cambiar su solución de formalina a etanol al 70%.
Nota: Estas muestras deben almacenarse a 4 ° C para almacenamiento a largo plazo. - Para almacenamiento a largo plazo, congelación de la sangre y oído ponche a-80 ° C.. Para la recolección de suero de la sangre, que la sangre coagular durante 30 minutos y luego centrifugarlo. Eliminar la porción de suero con una pipeta y luego conservarlo a -80 ° C.
5. Limpiar
herramientas- desinfección la disección con los trapos de esterilización. Tapa el tubo con el isoflurano empapado cojín quirúrgico. Reemplace la almohadilla quirúrgica en el tablero de la espuma con una esponja quirúrgica fresca. Disponer las porciones del ratón que no fueron recogidas por el centro de ' política de eliminación de animales de s.
Resultados
La figura 1 muestra un resumen del funcionamiento área de medio ambiente y la figura 2 muestra el área de operación post. Aunque esta configuración proporciona la cantidad mínima de equipo y escenificando, individuos puede modificar esto para que mejor se adapte a las necesidades individuales. El protocolo debe ser optimizado según las necesidades específicas del experimento. Este procedimiento se lleva a cabo de forma que termina la vida de un ratón, que requieren adecuado euthanization9. Cuando el investigador está preparado, el ratón se coloca en la cámara de anestesia con las almohadillas empapadas de isoflurano (figura 3).
Una vez que el ratón está inconsciente, quite el ratón y coloque el lado dorsal en el tablero. Un pellizco del dedo del pie debe realizarse para que el ratón sea insensible al dolor (figura 4). Aplicar etanol al 70% para esterilizar el área de la incisión inicial. El sorteo de sangre terminal se realizarán en primer lugar, antes de la extirpación del páncreas, para asegurar la recuperación adecuada de la sangre. Antes de quitar la sangre, el pericardio debe eliminarse para evitar la obstrucción de la aguja de 21 G de apertura. Después de completar la terminal sangre dibujar, el corazón se extrae como un método secundario de la eutanasia y luego se extirpa el páncreas.
Comienza ubicando el estómago, que proporciona un buen punto de partida para la extracción del páncreas (figura 5). Nota: Debe tener mucho cuidado durante la extracción del páncreas, que es un tejido delicado y frágil, y por lo tanto todas las operaciones deben realizarse con la fuerza suave. Con unas pinzas, comenzar la disección comenzando a tirar suavemente del páncreas, del estómago y continuar separar el tejido pancreático de la funda externa del tracto gastrointestinal (GI) trabajando desde el estómago hasta el duodeno, el yeyuno y el íleon ( Figura 6). Una vez alcanzado el intestino ciego, más fácil extracción del páncreas se logra reposicionar el fórceps para que un fórceps sostiene el intestino ciego y los otros fórceps se utilizan para continuar separar el páncreas al intestino (figura 7). Después de la eliminación desde el intestino, el páncreas se coloca en el lado derecho del ratón y los restantes datos adjuntos son cortadas()figura 8).
El páncreas debe aventó hacia fuera para la inspección y cualquier anormalidad debe ser registrado (figura 9). En el Ptf1acre / +; LSL-KrasG12D / + ratón cepa, páncreas potencialmente podría contener un tumor endurecido (figura 10). Otros órganos también deben examinarse para la metástasis potencial. Una vez que el páncreas se ha eliminado, debe ser pesado y el peso registrado. Una porción del páncreas debe ser complemento congelado en nitrógeno líquido para futuros análisis de perfiles metabólicos u otras pruebas y una porción de páncreas deben colocarse en formalina para futuros análisis histológico. La figura 11 muestra el almacenamiento inicial de los diferentes órganos de la disección para uso en análisis posterior. Los órganos recogidos por disección y almacenado para estudio adicional dependerá de los objetivos del investigador individual.
Muestras de tejido y sangre pueden utilizarse para análisis histológicos y perfiles metabólicos. En la figura 12se muestra un ejemplo del análisis histológico de los tejidos del páncreas. Perfiles metabólicos pueden realizarse en las muestras de tejido congelado rápido y la muestra de sangre. Espectros de representante de resonancia magnética nuclear espectroscopia (NMR) de los componentes hidrofílicos e hidrofóbicos de los extractos de tejido del páncreas se muestran en la Figura 13A y 13B, respectivamente. Un espectro de RMN representativo recogido en una muestra de suero preparada de sangre recogida en el momento de un procedimiento de drenaje de sangre terminal se muestra en la figura 14.

Figura 1 : Puesta en escena del área de trabajo. Disposición general de herramientas adecuadas y condiciones de funcionamiento para la disección. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Puesta en escena de después de la operación zona. Disposición general de herramientas adecuadas y condiciones de funcionamiento de los procedimientos postoperatorios. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Anestesia cámara. Ambiente adecuado para la anestesia por isoflurano. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Estímulo examen. La prueba de estímulo llevó a cabo en el ratón antes de la incisión inicial para cualquier dolor o malestar no es ser soportada. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5 : Extirpación del páncreas a partir. La orientación del ratón indica la extracción inicial del páncreas, lugar indicado por el fórceps. Haga clic aquí para ver una versión más grande de esta figura.
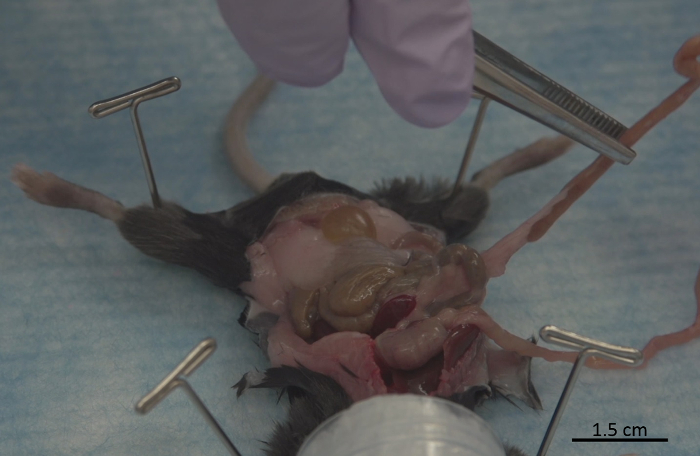
Figura 6 : Extracción de páncreas a lo largo de los intestinos. Proceso de aislar del páncreas desde el tracto gastrointestinal. Haga clic aquí para ver una versión más grande de esta figura.
Figura 7 : Extirpación del páncreas en el intestino ciego. Reposicionamiento de las pinzas una vez que el ciego se alcanza. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8 : Extirpación del páncreas. Lugar del páncreas a la derecha del ratón. Los restantes datos adjuntos deben cortarse para quitar totalmente el páncreas. Haga clic aquí para ver una versión más grande de esta figura.
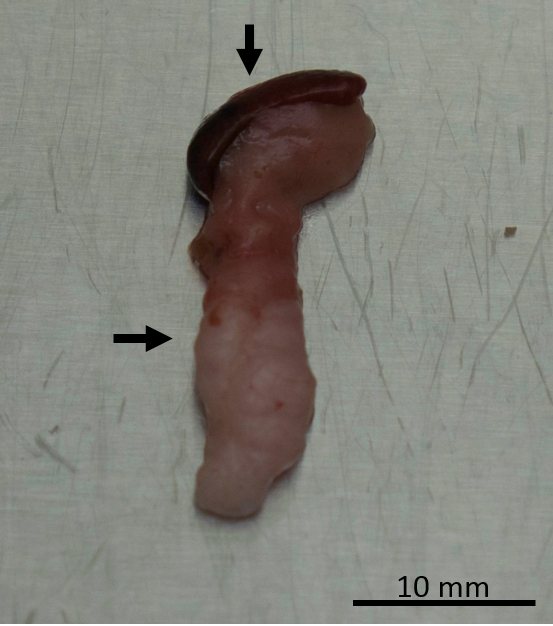
Figura 9 : Examen del páncreas. El páncreas con el bazo adjunto examinarse después del retiro del ratón. Bazo es indicado por la flecha vertical, y el páncreas está indicado por la flecha horizontal. Haga clic aquí para ver una versión más grande de esta figura.
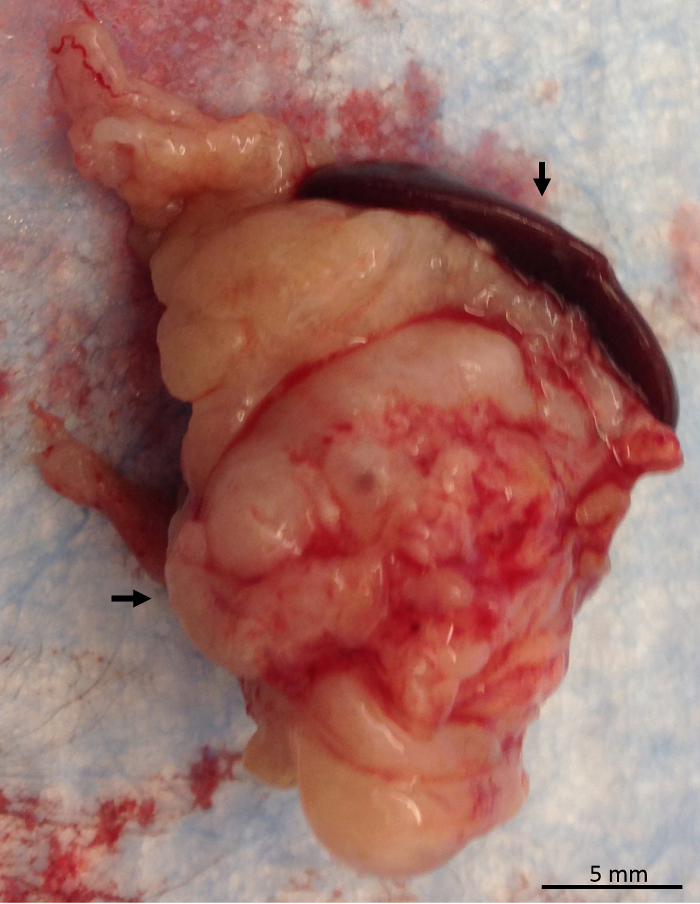
Figura 10 : Examen del páncreas. Páncreas con el bazo adjunto mostrando un tumor pancreático siendo examinado después del retiro del ratón. Bazo es indicado por la flecha vertical, y el páncreas está indicado por la flecha horizontal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 11 : Almacenamiento de información de los órganos quitados. Almacenamiento apropiado de los órganos y las muestras recogidas, preparado para almacenamiento a largo plazo y análisis futuros. Haga clic aquí para ver una versión más grande de esta figura.

Figura 12 : Análisis histológico del páncreas tejido. Hematoxilina y eosina teñidos imágenes de tejidos del páncreas. A) tejido de páncreas normal de un Ptf1acre /-; LSL-KrasG12D /- control del ratón. B) PanIN tejido del páncreas de un Ptf1acre / +; LSL-KrasG12D / + estudio de ratón. Haga clic aquí para ver una versión más grande de esta figura.

Figura 13 : Análisis de perfiles metabólicos. Espectros de los componentes de fase A) hidrofílico y B) hidrofóbica de extractos de tejido de páncreas después de homogeneización de tejidos y extracción de Cloroformo/metanol en protón unidimensional resonancia magnética nuclear espectroscopia (NMR). Los espectros de RMN fueron adquiridos en 850 MHz y son convenientes para el uso en análisis de perfiles metabólicos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 14 : Representante NMR espectro de suero. La sangre recogida por el procedimiento de sorteo de sangre terminal puede utilizarse para el análisis de perfiles metabólicos. Este espectro muestra un típico espectro de 850 MHz NMR unidimensional protón recogidos en el suero obtenido de una muestra de sangre terminal sorteo. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Importancia con respecto a los métodos existentes
Mientras que existen otros videos informales de disecciones de ratón, este artículo de vídeo ofrece primera calidad profesional, con revisión por pares, demostración de todos los pasos detallados necesarios para la extracción y recolección de lo páncreas de ratón por disección10 . Con el páncreas es un órgano principal de la actividad metabólica y de la insulina producción, disección y extracción del páncreas permite la preservación de las características fisiológicas11. Aislando el páncreas, futuros análisis pueden realizarse en la muestra. Este procedimiento permite la comparación y estudio de las interacciones de otros tejidos en el mismo organismo dentro del mismo plazo.
Limitaciones de la técnica
La mayor limitación de este procedimiento es la terminación de la vida del ratón, evitando colección longitudinal y muestreo de múltiples muestras de tejido desde el mismo ratón. Para analizar las tendencias relacionadas con la edad, sexo u otros cuantificadores, debe implementarse una población transversal, como lo hemos hecho para el estudio de biomarcadores metabólicos del cáncer pancreático. Otra limitación de este protocolo es la incapacidad para detener el procedimiento. Una vez iniciada la euthanization, el procedimiento debe llevarse a cabo en su totalidad.
Pasos críticos en el protocolo
Ejecución de la prueba de estímulo pellizcando la pata trasera del ratón es fundamental para que el ratón recibe un trato humano. Si el ratón no reacciona a este estímulo, entonces el procedimiento puede llevarse a cabo como estaba previsto. Sin embargo, debe mostrar el ratón una respuesta dificultad como resultado de la prueba de estímulo, el ratón debe devolverse a la cámara de anestesia por un período adicional de tiempo y la prueba que se repite hasta que una reacción a la prueba de estímulo no se observa12.
Del mismo modo, la punción del corazón terminal seguida por el retiro de las conexiones al corazón inmediatamente después de la muestra de sangre terminal se recoge como un método secundario de la eutanasia asegura que el sacrificio humano del ratón. Para asegurar un drenaje de sangre, el científico debe usar un movimiento de bombeo con la jeringa que es similar a los latidos del corazón del ratón, permitiendo máxima colección de sangre para análisis.
Modificaciones y la resolución de problemas
Cambio de los órganos de formalina para soluciones de etanol 70% prepara los órganos para el proceso de inclusión para el análisis histológico. Soluciones de almacenamiento diferentes pueden ser necesarias si el científico elige realizar otros experimentos con los órganos. Antes del análisis, es importante limitar cualquier deshielo potencial de los órganos almacenados en el congelador de-80 ° C para preservar la integridad del órgano.
Uso de la Ptf1acre / +; LSL-KrasG12D / + modelo de ratón minimiza la ocurrencia de no pancreático primario tumores y enfermedades13. Por lo tanto, es importante tener en cuenta las irregularidades que son evidentes para el páncreas u otros órganos durante la disección y la recolección de las muestras de tejido para análisis.
Futuras aplicaciones
Cosecha del páncreas de ratón por disección permite múltiples tipos de análisis a realizarse en la misma muestra. Las más populares incluyen, pero no se limitan a, microscopía de fluorescencia, hematoxilina e histología de eosina, inmunohistoquímica, espectrometría de masas y resonancia magnética nuclear espectroscopia6,7, 14 , 15. enfermedades como la diabetes, pancreatitis y cáncer de páncreas pueden ser estudiadas mediante las técnicas antes mencionadas16.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
MAK reconoce apoyo a esta labor de los institutos nacionales de salud / número - 1R15CA152985-01A1 de la concesión del Instituto Nacional del cáncer. Este proyecto ha sido apoyado también por el Miami Universidad pregrado Premio programa de investigación, las oportunidades de doctorado licenciatura Universidad de Miami para el programa de becas y el programa de eruditos de verano de la Universidad de Miami.
Materiales
| Name | Company | Catalog Number | Comments |
| Glass Jar | Corning | 3140-150 | The glass jar used in the video has been discontinued. This is its replacement. |
| Lid of Glass Jar | Corning | 9985-150 | The glass jar lid used in the video has been discontinued. This is its replacement. |
| 15 mL Falcon Tubes | Fisher Scientific | 339650 | |
| Surgical Scissors | Fisher Scientific | 9201 | |
| Squeeze bottle | Fisher Scientific | 03-409-10DD | |
| 100% Ethanol | Fisher Scientific | 22-032-103 | |
| Formalin | Fisher Scientific | 245-684 | |
| Foam Boards | Therapak | 562908 | |
| Forceps | Fisher Scientific | 200205SHN | |
| 1 mL 21G Syringes | BD Biosciences | 309624 | |
| 50 mL Falcon Tubes | Fisher Scientific | 339652 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 02-681-258 | |
| Surgical Pads | Fisher Scientific | S67011 | |
| T-Pins Length: 2" | Advance Store Products | X32T-05 | |
| Sterilizing Wipes | Professional Disposables International Inc. | Q85084 | |
| Sharps Container | Fisher Scientific | 14-827-122 | |
| Analytical Balance | Marshall Scientific | ME-AE200 | |
| 4L Dewar | Taylor-Wharton | 4LD | |
| Shallow Wide Mouth Dewar | Fisher Scientific | F3087-V | |
| Floating Microtube Rack | VWR | 60986-100 | |
| Cryogenic Vial 1.2 mL, Sterile | Fisher Scientific | 10-500-25 | |
| Isothesia (Isoflurane) | Henry Schein Animal Health | 050033 | |
| Liquid Nitrogen | Wright Brothers | NIT-60-XX | |
| Mouse Kras Strain | The Jackson Laboratory | OO8179 | |
| Mouse Cre Strain | MMRRC | OOO435-UNC |
Referencias
- Fesinmeyer, M. D., Austin, M. A., Li, C. I., De Roos, A. J., Bowen, D. J. Differences in Survival by Histologic Type of Pancreatic Cancer. Cancer Epidemiol Biomarkers Prev. 14 (7), 1766-1773 (2005).
- Jackson-Grusby, L. Modeling cancer in mice. Oncogene. 21 (35), 5504-5514 (2002).
- Heid, I., et al. Early requirement of Rac1 in a mouse model of pancreatic cancer. Gastroenterology. 141 (2), 719-730 (2011).
- Hingorani, S. R., et al. Preinvasive and invasive ductal pancreatic cancer and its early detection in the mouse. Cancer cell. 4 (6), 437-450 (2003).
- Shi, C., et al. KRAS2 Mutations in Human Pancreatic Acinar-Ductal Metaplastic Lesions Are Limited to Those with PanIN Implications for the Human Pancreatic Cancer Cell of Origin. Mol Cancer Res. 7 (2), 230-236 (2009).
- LaConti, J. J., et al. Distinct serum metabolomics profiles associated with malignant progression in the KrasG12D mouse model of pancreatic ductal adenocarcinoma. BMC Genomics. 16 (1), 1-10 (2015).
- Ludwig, M. R., et al. Surveying the serologic proteome in a tissue-specific kras(G12D) knockin mouse model of pancreatic cancer. Proteomics. 16 (3), 516-531 (2016).
- Taylor, D. K., Mook, D. M. Isoflurane Waste Anesthetic Gas Concentrations Associated with the Open-Drop Method. J Am Assoc Lab Anim Sci. 48 (1), 61-64 (2009).
- Parasuraman, S., Raveendran, R., Kesavan, R. Blood sample collection in small laboratory animals. J Pharmacol Pharmacother. 1 (2), 87-93 (2010).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nature Protocols. 4 (11), 1649-1652 (2009).
- Auer, H., et al. The effects of frozen tissue storage conditions on the integrity of RNA and protein. Biotech Histochem. 89 (7), 518-528 (2014).
- Ma, J., Leung, L. S. Limbic System Participates in Mediating the Effects of General Anesthetics. Neuropsychopharmacology. 31, 1177-1192 (2006).
- Ijichi, H., et al. Aggressive pancreatic ductal adenocarcinoma in mice caused by pancreas-specific blockade of transforming growth factor-β signaling in cooperation with active Kras expression. Genes Dev. 20 (22), 3147-3160 (2006).
- Abiatari, I., et al. Moesin-dependent cytoskeleton remodelling is associated with an anaplastic phenotype of pancreatic cancer. J Cell Mol Med. 14 (5), 1166-1179 (2010).
- Goodpaster, A. M., Romick-Rosendale, L. E., Kennedy, M. A. a Statistical significance analysis of nuclear magnetic resonance-based metabonomics data. Analytical biochemistry. 401, 134-143 (2010).
- Yadav, D., et al. Idiopathic Tumefactive Chronic Pancreatitis: Clinical Profile, Histology, and Natural History After Resection. Clin Gastroenterol Hepatol. 1 (2), 129-135 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados