Method Article
Automatizado de montaje robotizada manipulación líquido de dispositivos modulares de la DNA
En este artículo
Resumen
Aquí, se presenta un flujo de trabajo automatizado para modular montaje de "dispositivo" de ADN usando un método de montaje modular de clonación ADN sobre robots de manipulación de líquidos. El protocolo utiliza una herramienta de software intuitivo para la generación de listas de líquido controlador para combinatoria ADN dispositivo biblioteca generación, demostramos con dos plataformas de manejo de líquidos.
Resumen
Los avances recientes en técnicas de montaje de ADN modulares han permitido biólogos sintéticos probar más de las disponibles "diseño del espacio" representado por "dispositivos" creados como combinaciones de componentes genéticos individuales. Sin embargo, manual de armado de tal cantidad de dispositivos es mucho tiempo, errores y costoso. La creciente sofisticación y escala de la investigación de la biología sintética requiere un modo eficaz y reproducible para construcción de dispositivo a gran escala, complejas y de alto rendimiento.
Aquí, un protocolo de la Asamblea de ADN mediante la técnica de clonación Modular (MoClo) tipo IIS endonuclease de la restricción basada está automatizado en dos plataformas robóticas de manejo de líquido. Robots automatizados de manejo de líquido requieren cuidado, muchas veces tedioso optimización de parámetros de pipeteo para líquidos de distintas viscosidades (por ejemplo, enzimas, ADN, agua, amortiguadores), así como programación explícita para asegurar la correcta aspiración y dispensación de piezas de ADN y reactivos. Esto hace escritura manual complejos montajes sólo tan problemático como manual conjunto de ADN y requiere una herramienta de software que puede automatizar la generación de secuencia de comandos. Para ello, hemos desarrollado una herramienta de software basada en web, http://mocloassembly.com, para generar librerías combinatorias de dispositivo de ADN de partes básicas del ADN subidas como archivos de Genbank. Ofrecemos el acceso a la herramienta, y un archivo de exportación de nuestro software de controlador líquido que incluye optimizado clases líquidas, parámetros de laboratorio y diseño de la cubierta. Todas las piezas de ADN utilizadas están disponibles a través de Addgene, y los mapas digitales se pueden acceder mediante el registro de hielo de BDC de Universidad de Boston. Juntos, estos elementos constituyen una base para otras organizaciones automatizar experimentos de clonación modulares y protocolos similares.
El automatizado DNA Asamblea y flujo de trabajo presentada aquí permite la producción repetible, automatizada y de alto rendimiento de dispositivos de ADN, reduce el riesgo de errores humanos derivados de pipeteo manual repetitiva. Secuenciación de datos muestran las reacciones de Asamblea automatizadas de ADN generadas por este flujo de trabajo ~ 95 son correcto y requieren como poco 4% como práctica mucho tiempo, en comparación con preparación manual de la reacción.
Introducción
Los dispositivos genéticos biológicos sintéticos más tempranos como el Collins interruptor1 y el repressilator de Elowitz2 demostraron que sistemas biológicos podrían diseñarse hacia adelante para tener funciones específicas, deterministas. Desde entonces, los biólogos sintéticos se han esforzado para ingeniero de sistemas vivos para llevar a cabo funciones progresivamente más complejas en el servicio de biomateriales3,5,de4,6de biotherapeutics, biocombustibles 7,8y biosensores aplicaciones9,10,11. Lograr estas aplicaciones a través de la combinación de ADN modular "piezas" en "dispositivos" con funcionalidad específica ha sido uno de los principales objetivos de la biología sintética. Para que este proceso a escala, debe ser una técnica que permite la creación de dispositivos complejos de grandes bibliotecas de piezas en un tiempo eficiente, rentable y lo más importante, forma reproducible.
Un proceso de Asamblea expansiva está garantizado porque actualmente el campo carece de una comprensión completa de las reglas guía sistema biológico acertado diseño y composición. Esto se ve exacerbado por insuficientemente caracterizado ADN piezas12, falta de compatibilidad y dimensionabilidad de piezas13e inesperadas, indeseables interacciones entre componentes genéticos dentro de dispositivos sintéticos14, 15. en la ausencia de modelado predictivo fiable, funcionales sintético dispositivos genéticos se llegaron por ensayo y error, que exige decenas o incluso cientos, de la fuerza de la señal de entrada-salida variantes de un dispositivo previsto se defienden y lo "mejor" se selecciona para la composición con elementos posteriores16. Mientras que moderno había estandarizado métodos de montaje de ADN como Golden Gate17y clonación Modular18,19,20 facilitan este proceso, un experto experimental sigue siendo necesario para llevar a cabo cada protocolo. Como dispositivos sintéticos crecen en tamaño y complejidad, el espacio total disponible diseño llega a ser demasiado grande construir y probar manualmente21y el proceso será demasiado artesanal para cualquier progreso significativo que sea replicable en el campo.
Hasta el advenimiento de la biología sintética y repositorios de la parte biológica como iGEM piezas de registro (http://partsregistry.org), las partes genéticas JBEI inventario de los elementos componentes22y23de la SynBioHub, no fueron almacenadas en cualquier formato estandarizado de la Asamblea. Sólo un puñado de piezas necesarias para ser clonados por proyecto y así, el volumen de la clonación hace era pequeño y fue posible la realización de un dispositivo montado y trivial en comparación con los objetivos de la investigación actual. Clonación molecular era a menudo ad hoc y realizó con resúmenes de la restricción basadas en la disponibilidad de sitio y endonucleasa de restricción, y no después de cualquier proceso estandarizado. La falta de estandarización hace impráctico para automatizar cualquier protocolo de clonación ya que era poco probable que la reacción de clonación siguiente seguiría un protocolo idéntico. Además, automatización de la Asamblea de ADN requiere una importante inversión monetaria en equipos (robots y su infraestructura asociada de software y equipo de laboratorio para manejo de líquidos) así como la inversión de tiempo para la generación de instrucciones para desarrollar precisa parámetros para el manejo de las diversas clases de líquidos se procesan y la serie precisa de instrucciones a ejecutar estos protocolos. Pequeña escala clonación esfuerzos no justificaba esos gastos. La combinación de diseños de dispositivos genéticos más grandes, más complejas juntada con montaje estandarizadas protocolos24,25 crea un entorno donde la automatización de estos procesos es muy práctica. Robótica de bajo costo como la Opentrons OT-One26 también están emergiendo que permite incluso modestamente financiadas labs para acceder a esta tecnología. Además, "la nube" laboratorios27 como Transcriptic y Esmeralda nube laboratorio académico "biofoundries" tales como la fundición de genoma de Edimburgo, el iBioFab UIUC, y la fundición de MIT-amplio, robótica de arnés para montar diversos conjuntos de diseños una variedad de clientes rápida y repetidamente manteniendo un repositorio común de primitivas básicas de ADN y Asamblea tecnologías para futuros pedidos.
Uno de los mayores desafíos en la automatización del proceso de ensamblaje de ADN es la generación de los comandos de pipeteo para el controlador del líquido. Mientras que las interfaces de software para estos dispositivos son por lo general fácil de usar, compleja pipeteo instrucciones como las necesarias para el ensamblaje combinatorio de ADN requieren el científico explícitamente especificar cada aspirar y dispensar comando manualmente. Esto crea un cuello de botella importante en el flujo de trabajo y deja vulnerables a los errores de pipeteo mismo el proceso de generación de secuencia de comandos como si el montaje se realiza manualmente. Esto requiere una herramienta de software que puede automatizar todas las partes de este proceso, desde el diseño de la biblioteca de dispositivos, para generar las instrucciones de pipeteo y proveer al investigador con las configuraciones de la placa/reactivo necesarias para montarlos. En este trabajo, aprovechamos nuestra herramienta de software para automatizar el diseño de una pequeña biblioteca combinatoria de dispositivo de ADN, así como la mezcla de reactivos (almacenador intermediario, agua, enzimas) y partes del ADN (Figura 1b) en 96 uno pote modular ADN Asamblea reacciones. Uso de la herramienta no requiere ninguna experiencia previa en programación, es escalable y de alto rendimiento y combinatoria de forma predeterminada. Nos muestran que clonación reacciones preparados en dos plataformas de manejo de líquidos automática en diferentes clones de secuencia verificado correcto rendimiento con frecuencia comparable a las reacciones preparado manualmente (95%) y con mucho menos tiempo de práctica.
Protocolo
1. especificar las piezas a utilizar en la biblioteca de dispositivos de ADN y generar usuario/líquido controlador instrucciones [15 min]
- Usando cualquier navegador web, vaya a mocloassembly.com y cargar archivos de Genbank para todas las partes de ADN que se incluirán en el diseño de dispositivo combinatorio de ADN.
- Una vez que se han subido todos los archivos, selecciona partes de ADN deseadas y arrastre sobre el lienzo en blanco, colocando parte de tipos en el orden previsto final de piezas de ADN.
Nota: Colecciones de piezas, así como piezas individuales, pueden ser seleccionados y colocados sobre el lienzo. También, solicitar piezas de ADN que sobresale por la 5' y 3' para cada parte de fósforo. - Haga clic en 'Montar' en la parte inferior derecha de la página.
Nota: La herramienta generará sólo válidos, para armar conjuntos basados en los voladizos de cuatro pares que flanquean cada parte sobre la digestión con la enzima BsaI. Si no para armar dispositivos de ADN existe basado en las partes cargadas por el científico, la herramienta indicará que no hay asambleas fueron encontrados. -
Vaya a la pestaña de 'Planes' y descargar archivos generados por la herramienta. Estos archivos se incluyen:
- Mapas de placa legible para que el científico preparar muestras de ADN, así como los reactivos necesarios para las reacciones
- Una 'lista' para el controlador del líquido
- Completamente anotados archivos de Genbank para todos los dispositivos de ADN ser ensamblado
Nota: Se deben probar el brazo de posicionamiento cuando se accede a cualquier equipo de laboratorio nuevo para manejo de líquidos. Consulte el manual del fabricante para obtener instrucciones detalladas sobre cómo ajustar el brazo de pipeteo posicionamiento en la X, Y y Z ejes según sea necesario.
2. prepare el DNA plasmídico y reactivos para Asamblea [3 días]
- [Día 1] Utilizando un asa de inoculación estéril y trabajando cerca de una llama abierta o en campana de flujo laminar, raya a las poblaciones bacterianas glicerol en placas de LB-agar suplidas con el antibiótico apropiado. Hacer esto para todas las partes ADN necesarias, asegurándose de esterilizar el lazo entre cada muestra. Incube las placas a 37 ° C durante la noche.
Nota: Congelados glicerol bacteriana las acciones deben conservarse en hielo tanto como sea posibles. Ciclos de congelación y descongelación repetida reducir la viabilidad de la acción y deben evitarse. - [Día 2] Usando una pipeta estéril, un palillo o asa de inoculación y trabajando cerca de una llama abierta o en campana de flujo laminar, inoculan 3 mL de caldo LB (suplementado con antibiótico apropiado) con una sola Colonia de las placas de agar LB preparado en 2.1. Incubar los cultivos durante la noche a 37 º C agitando a 300 RPM.
- [Día 3] Purificar el DNA plasmídico de los cultivos bacterianos con cualquier kit de purificación de plásmidos disponibles en el mercado mini-prep.
- Utilizando el archivo MoClo_Setup.xlsx suministrado, diluir cada muestra de ADN de plásmido a una concentración de 20 fmol/μL en agua o en buffer TE.
- Siguiendo el mapa de la placa del archivo PDF generado por la herramienta de montaje, coloque el volumen indicado de cada pieza de ADN diluido al pozo apropiado en una placa de PCR de 96 pocillos bordeado por completo. Mantener este SetupPlate en el hielo hasta que se necesite, o sellar con un sello adhesivo de papel de aluminio y almacenar a-20 ° C.
-
En el hielo, preparar el mastermix de reacción con los componentes siguientes: por cada 20 μl de reacción añadir 2 μl de 10 x buffer ligasa de T4 DNA, 0.5 μl de T4 ADN ligasa (HC) y 1 μl de enzima BsaI. Una hoja calculadora está incluida en el archivo MoClo_Setup.xlsx para ayudar con esto.
- Distribuir el mastermix de enzima en los pocillos adecuados de un nuevo lleno-bordeó PCR placa de 96 pocillos, siguiendo el mapa de la placa de la ReagentPlate en el PDF generado. Mantener este ReagentPlate en hielo o en un frío-bloque de 96 pocillos.
Nota: El ReagentPlate sólo debe estar preparada cuando esté listo para ejecutar la Asamblea en el controlador de líquido.
- Distribuir el mastermix de enzima en los pocillos adecuados de un nuevo lleno-bordeó PCR placa de 96 pocillos, siguiendo el mapa de la placa de la ReagentPlate en el PDF generado. Mantener este ReagentPlate en hielo o en un frío-bloque de 96 pocillos.
3. ejecutar el Script de montaje en el controlador de líquido [Variable]
- Coloque el SetupPlate(s), el ReagentPlate(s) (en un frío-bloque de 96 pocillos) y el número necesario de placas de PCR de 96 pocillos lleno-bordeó los vacíos en la cubierta del controlador del líquido. La placa vacía será la OutputPlate(s) donde se ensamblan las reacciones.
- Preparar el líquido controlador software de control mediante la creación de instancias de cada placa muestra y reactivo preparado, asegurándose de nombre exactamente como aparecen en los mapas de placa generados por mocloassembly.com, incluyendo un canal de limpia, agua desionizada con la etiqueta ' Depósito '.
- El comando 'Lista de tareas' en el software de control, carga el archivo .gwl generado por nuestra herramienta de software, seguido por otro comando de 'Lista de tareas' que se ejecuta el archivo .gwl en el primer comando.
- Ejecutar el script usando el comando 'Ejecutar' del software controlador.
Nota: Siempre deje que el controlador robótico de líquido completar la ejecución de un script antes de intentar acceder al espacio de cubierta. - Quite todas las placas de la cubierta de líquido controlador. Restantes de la DNA pueden guardarse sellando el SetupPlate(s) con película de aluminio y almacenar a-20 ° C. La OutputPlate(s) con la película adhesiva del sello, coloque en un termociclador o bloque de calor y funcionar con los siguientes parámetros de ciclo:
37 ° C durante 2 h, 50 ° C por 5 min, 80 ° C durante 10 min, mantener a 4 ° C
Nota: Una vez completado el termociclaje de reacción rápido, OutputPlate(s) pueden almacenarse a-20 ° C hasta que estén listas ser transformado.
4. transformar las reacciones [día 1]
-
Descongelar el número de competentes de e. coli célula alícuotas necesitadas (10 μl por reacción) sobre el hielo.
Nota: Para mantener la esterilidad, los pasos siguientes deben realizarse cerca de una llama abierta, o dentro de una campana de flujo laminar.- Mientras que las células son descongelar, preparar placas de LB-agar (que contienen antibiótico apropiado) Pipetear 50 μl de 0,1 M IPTG y 50 μl de 20 mg/mL X-GAL en la superficie. Hacer una mezcla principal si un gran número de reacciones de la galjanoplastia. Las placas con una varilla de vidrio estéril o perlas de vidrio de la capa y permita que las placas descansar a 37 ° C durante al menos 15 minutos antes de las bacterias de la galjanoplastia.
Nota: Alternativamente, agregar IPTG y X-Gal en agar líquido antes de que las placas se vierten, en 2 mM IPTG y concentración final de 40 μg/mL X-Gal. Almacenar estas placas fuera de luz directa como X-Gal es sensible a la luz.
- Mientras que las células son descongelar, preparar placas de LB-agar (que contienen antibiótico apropiado) Pipetear 50 μl de 0,1 M IPTG y 50 μl de 20 mg/mL X-GAL en la superficie. Hacer una mezcla principal si un gran número de reacciones de la galjanoplastia. Las placas con una varilla de vidrio estéril o perlas de vidrio de la capa y permita que las placas descansar a 37 ° C durante al menos 15 minutos antes de las bacterias de la galjanoplastia.
- En el hielo, alícuotas de 10 μl de células competentes para cada reacción en una nueva placa de PCR de 96 pocillos. Se trata de la placa de transformación.
- Añadir 1-3 μl de cada reacción de la OutputPlate(s) a la correspondiente en la placa de transformación e incubar en hielo durante 5 minutos.
- Sellar la placa de transformación con adhesivo descarga película y calor en un termociclador a 42 ° C para 30 s. Luego, colocar inmediatamente la placa de hielo por 2 min.
- Los mismos pozos de la placa de transformación, añadir 150 μL de medio SOC, sellado con un sello adhesivo de aluminio e incubar a 37 ° C y agitación a 900 RPM durante 1 hora.
- Todo el contenido de cada pocillo de la placa de transformación en las placas de agar LB preparadas en 4.1.1 usando una varilla de vidrio estéril o perlas de vidrio para cubrir uniformemente la superficie de la placa de la placa. Incube las placas a 37 ° C durante la noche.
5. copia de verificación [2 días]
-
Preparar uno o varios bloques de cultivo de 96 pozos pozos profundos con 1,5 mL de LB caldo (que contienen antibiótico apropiado).
- Similar al paso 2.2, inocular los bloques de cultura de pozo profundo con solo colonias blancas de cada placa de LB-agar de reacciones transformadas.
- Sello de los bloques de cultura con un sello de gas permeable e incubar durante una noche a 37 ° C y agitación a 900 RPM.
Nota: El modular técnica de clonación utiliza detección de color blanco, así que positivo UFC aparece blanco en la placa de LB-agar, mientras que vectores de destino vacía aparecerá azul.
- Aislar ADN plasmídico de cultivos bacterianos (como en 2.3) y el de Sanger secuenciación para verificar clones.
Resultados
Aquí demostramos la Asamblea modular automatizada de 96 equipos de ADN de distintas partes básicas del DNA (Figura 1b) utilizando dos plataformas de manejo de líquidos en robótica automatizada. Cada unidad transcripcional es un arreglo lineal de promotor, sitio de Unión ribosomal, gene y terminador transcripcional, clonado en un vector de destino específico. TUs son un componente clave en muchos circuitos genéticos jerárquica diseños28,29,30 y por lo tanto una prueba natural de concepto para este enfoque. Clones de secuencia verificada se logra en días ~ 5 de principio a fin, y se presenta un resumen del flujo de trabajo presentado en la Figura 1a.
Utilizando la herramienta descrita y Protocolo, capturamos varios indicadores útiles en la determinación de la plataforma de montaje óptimas dada un número definido de clonación reacciones para ser generadas por el científico. Figura 2a ilustra una comparación entre los tiempos de montaje de reacción a través de todas las tres modalidades. Tiempo de ejecución es el tiempo total para completar todos los pasos de pipeteo debían montar 96 reacciones, que incluye suministro de todas las partes del ADN y reactivos. Tiempo de práctica se refiere al tiempo total de que un ser humano participó manualmente en la preparación de las reacciones de la clonación, o configuración de software que se ejecuta el controlador de líquido. Figura 2b compara entre los diferentes métodos. Los costos presentados son para una sola reacción preparada por cada método e incluye el precio de las enzimas y las puntas de pipeta desechables, dadas el volumen de la reacción más típica (20 μl de líquido controlador, 10 μl 250 manual, nL distribuidor de acústica). Solo clones de todas las 96 reacciones para sistemas preparados por el controlador manual y líquidos fueron ordenados, con un subconjunto de 12 ordenados para las reacciones de la acústica del dispensador (figura 2C). 95% de los sistemas de controlador manual y líquido 96 se obtuvieron secuencias correctas. 83% del subconjunto de muestras acústicas dispensador estaban correctos, sin embargo el finales dos reacciones no cualquier colonias blancas, probablemente debido a una mezcla de gotitas después de la dosificación de la DNA y reactivos fue completa. Figura 2d ilustra clonación eficiencia de reacción, según lo medido por la proporción de colonias blanco al número total de colonias, que son comparables entre manualmente (94%) y líquido controlador montado (84%) reacciones. Curiosamente, cuando escala por el volumen de reacción final con el dispensador de acústico, nos dimos cuenta de una marcada baja en la eficiencia de la reacción cuando las reacciones se prepararon en volúmenes más pequeños que 1 μl (suplementario Figura 1 y tabla 2 suplementaria). Esto es probablemente debido a la evaporación durante el termociclaje rápido de reacción, que puede causar un aumento en concentraciones de sal en la reacción.
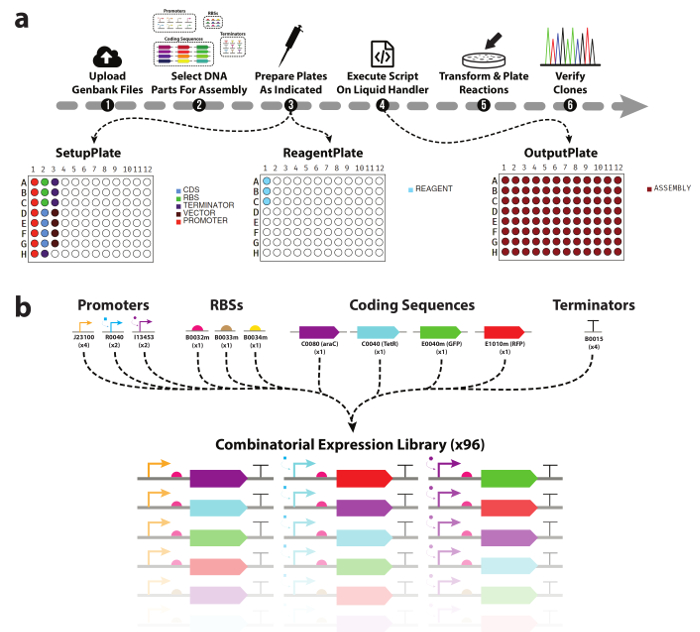
Figura 1. Automatizado DNA dispositivo biblioteca Asamblea flujo de trabajo.
(a) un resumen del flujo de trabajo experimental presentado en este trabajo. (1) investigadores primero subir archivos de Genbank para todas las partes del ADN y vectores de destino que desean utilizar. (2) a continuación, se seleccionan piezas de ADN a ser incluido en la Asamblea. (3) la herramienta entonces generará a una lista desplegable para un controlador automático de líquido, así como mapas de placa ayudar a población manual con partes de DNA y la enzima mastermix. (4) usando ADN y placas de reactivos, así como la lista generada, los investigadores ejecutan el conjunto de las reacciones de la clonación en el controlador de líquido. (5) una vez finalizada, las reacciones son transformadas y plateadas para análisis posteriores. (b) piezas lista de ADN utilizadas en este trabajo. Un total de tres promotores, tres ribosomal secuencias de sitios, cuatro codificación de Unión, y se utiliza un terminador transcripcional generan la biblioteca combinatoria de 96 TUs. Haga clic aquí para ver una versión más grande de esta figura.
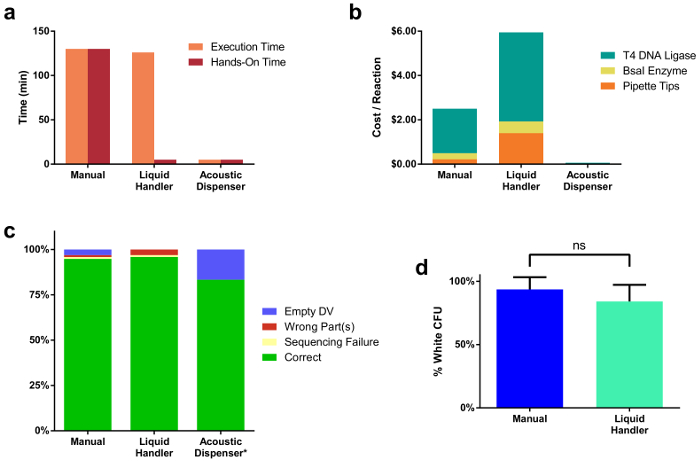
Figura 2. Comparaciones a través de tres modalidades de montaje de reacción diferente.
(a) tiempo de instalación de reacción de 96 reacciones montado manualmente, a través de un controlador de líquido y un dispensador de acústico. Manual de armado tomó 2 h 10 min, que era tiempo de práctica. El controlador líquido tomó una cantidad similar de tiempo (2 h 6min) para ejecutar los comandos de pipeteo, sin embargo sólo una fracción de ese tiempo (5 min) era práctica. El dispensador de acústico tuvo significativamente menos tiempo para ejecutar las transferencias de líquido (5 minutos) y tomó el tiempo práctico mínimo (5 min). (b) precio por reacción clonación única para cada método de montaje. Este precio incluye el costo de las enzimas que utiliza, así como las puntas de pipeta. (c) secuenciación resultados de colonias individuales de 96 todo había montado TUs. El porcentaje de clones correcto fue comparable en todos los métodos de montaje. Tenga en cuenta que sólo un subconjunto (12) de las Asambleas completo 96 fueron transformados desde el dispensador acústico preparado muestras. Dos reacciones no cualquier colonias blancas, probablemente debido a una mezcla de gotas de mastermix de DNA y la enzima en el OutputPlate. (d) comparación de eficiencias de reacción entre reacciones manual y líquidas preparado por el controlador de la clonación. Haga clic aquí para ver una versión más grande de esta figura.
Figura 1 complementaria. Eficiencia de reacción disminuye con la reducción de volumen de reacción.
Eficiencia de reacción caer marcadamente cuando escala por volúmenes de reacción por debajo de 1 μl. Esta tendencia se ve con dos concentraciones de ADN de finales diferentes; sin embargo, los científicos pueden optar por utilizar volúmenes más pequeños para ahorrar en costos de reactivos si pueden tolerarse rendimientos más bajos. Haga clic aquí para descargar este archivo.
Suplemento tabla 1.
Tabla de parámetros de DNA y la enzima clase líquido para diferentes volúmenes. Haga clic aquí para descargar este archivo.
Tabla 2 suplementaria.
Cálculos de eficiencia de la reacción. Números crudos de UFC se dan para 12 de las 96 reacciones transformadas preparadas manualmente y mediante el controlador de líquido. Para prueba de volúmenes más pequeños de la reacción final en el dispensador acústico, dispones de número de UFC. Haga clic aquí para descargar este archivo.
Discusión
En conclusión, la automatización del proceso completo de ADN dispositivo creación, desde el in-silico de diseño para manejo de líquidos, es una meta viable actualmente existentes tecnología. Software y robótica modernos permiten la creación de flujos de trabajo rentable, eficiente y escalable, al tiempo que se produce más resultados consistentemente reproducibles que los métodos manuales. Mientras que la automatización no puede ser siempre la opción más rentable para la ejecución de un protocolo, mejorar la reproducibilidad experimental y libera tiempo valioso investigador. Sin embargo, dependiendo del hardware utilizado, el uso de la automatización puede conducir a veces costo y tiempo de ejecución muy por debajo de lo que puede lograrse a través de métodos manuales convencionales. Además, automatización de captura protocolos explícitamente en una manera formalizada prevención especial, artesanal, y anecdótica mejor práctica basado en la experimentación. Aquí se demuestra el montaje automático de dispositivos modulares de ADN, y el protocolo de archivos electrónicos y recursos físicos de ADN necesarios para el lector para llevar a cabo estas y similares, experimentos por cuenta propia reciben. Esperamos que la disponibilidad de nuestra herramienta, y la publicación de este protocolo servirá como un recurso y mueve el campo hacia un futuro más transparente y comunal en el área de procesos de ensamblaje de ADN y robótica para manejo de líquidos.
La utilidad de hardware de automatización depende en gran medida la configuración y capacidades de ese hardware. Por ejemplo, nuestro handler líquido utiliza desplazamiento de líquido del sistema para accionar aspirar y dispensar los comandos. Los pistones que disco el fluido del sistema son relativamente grande 1 mL jeringas que, aunque útil para una amplia gama de volúmenes, impone un límite inferior de 2 μL para la dosificación exacta de los reactivos. Como consecuencia, ampliar el volumen total de la clonación reacciones configuradas en el controlador de líquido a 20 μl, ya que cada comando debe ser ≥ 2 μl de dispensar. Este duplicado el costo por reacción para reacciones de controlador preparado líquidas, sin embargo se redujo significativamente la cantidad de tiempo práctica necesario para ejecutar esas reacciones. En un esfuerzo por abordar este tema, repetimos el programa de instalación de reacción para todas las 96 reacciones en un dispensador de líquidos acústico. Este dispositivo utiliza energía sana para dispensar el líquido directamente de una placa a otra y puede alcanzar dispensar volúmenes muy por debajo (2,5 nL) lo que es posible con desplazamiento de aire estándar basado en pipetas manual. Utilización de este producto, hemos sido capaces de reducir el volumen total de nuestras reacciones, a 250 nL, una reducción de 40-fold respecto a reacciones manualmente preparadas de 10 μl. Debido a los pequeños volúmenes dispensados y la falta de cambio de puntas entre pasos pipeteo, el dispensador de acústico fue capaz de generar las mismas 96 reacciones en una fracción del tiempo (< 5 min). Los volúmenes más pequeños de la reacción también guardar reactivos perdidos, ya que por lo general sólo transformar 1-3 μl de la reacción. Dicho esto, el uso de hardware de automatización, en conjunto con un software intuitivo, puede que la generación de un gran número de reacciones de ensamblaje de ADN accesible a un público académico mucho más amplio.
Aquí, demostramos la utilidad de nuestra herramienta de software, sin embargo hay una serie de características que le ayudan a ampliar su utilidad. En primer lugar, cada vez que la herramienta se utiliza para generar un ensamblado de combinatorio, placas nuevas de parte de ADN deben generarse, requiriendo el científico rellenar manualmente estas placas para cada conjunto de funcionamiento. Sería útil, en cambio, si el científico puede especificar la ubicación de las piezas en una placa de ADN que se utilizará en la Asamblea. Esto permitiría el uso de plásmidos de alto rendimiento kits de purificación de ADN ya que los investigadores podrían inocular culturas de un kit como la biblioteca de MoClo de CIDAR y purificar todas las muestras juntas manteniendo la ubicación bien cada parte especificado en el kit. En segundo lugar, la herramienta actualmente sólo soporta el uso de placas de 96 pocillos. Para proyectos más grandes, donde varios cientos dispositivos de ADN necesitan ser construido, la cantidad de ADN, reactivos y placas de destino puede exceder la capacidad de la cubierta del controlador del líquido. Este problema podría ser, al menos en parte, aliviado por soporte para formatos de placa de mayor densidad (384 o 1536-bien). Por último, la herramienta actualmente sólo admite un único tipo de controlador de líquido y estrategia de la Asamblea de ADN. Si bien es relativamente fácil de convertir las instrucciones controlador líquido producido por la herramienta a un formato acústico dispensador utilizando el software de hoja de cálculo, esperamos ampliar el soporte nativo para muchos manipuladores de líquidos diferentes que ampliarían considerablemente su aplicabilidad, como compatibilidad con otras técnicas de ensamblaje de ADN común como conjunto de Gibson31.
Una parte crucial de este ecosistema Asamblea automatizada es un conjunto de herramientas de software que traduce planes de montaje alto nivel protocolos ambiente automatización que explícitamente están programados para ejecutarse en robots para manejo de líquidos. Aunque existe un número de herramientas de software que permiten a los investigadores diseñar ensamblados en silico incluyendo Benchling, planificador de MoClo y Cuervo32, pocos tienen la habilidad de traducir los diseños en instrucciones ejecutables para ejecutar en un líquido controlador. Al terminar, trabaja como titiritera y automatización PR-PR33,34,35 han empezado a poner estas herramientas a disposición. Además, las entidades comerciales que trabajan en esta área buscan formas para introducir "cloud labs" que ofrecen servicios de experimentales a grupos grandes de usuarios finales mediante la automatización. El protocolo descrito en este documento podría servir como una pieza de cualquiera de estos esfuerzos siempre se presentan como un servicio.
Asamblea automatizada de dispositivos de ADN es de valor inmediato y obvio a la biología sintética, nuestro protocolo es útil para la comunidad de biólogos moleculares así. Automatizar conjunto de DNA permite a gran número de conocidos y dispositivos similares, genéticos en paralelo y puede permitan la rápida síntesis de bibliotecas de expresión para la investigación y realizar pruebas en estudios de desarrollo de medicamentos. Esperamos que nuestra herramienta de software que esfuerzos de ensamblaje de ADN basados en combinatoria más grandes sea más accesible y servir como un recurso útil tanto la biología sintética, como comunidad académica.
Divulgaciones
Densmore es el Presidente y cofundador de enrejado Automation, Inc. Timmons y McCarthy son empleados de enrejado. Enrejado hace software y servicios para la automatización de muchos de lo proceso que se describe.
Agradecimientos
Agradecemos Swapnil Bhatia, Alejandro Pelaez y Johnson Lam para el trabajo en el proyecto del titiritero, así como Swati Carr Rachael Smith y Thomas Costa para ayuda con este manuscrito. Este trabajo fue financiado por NSF carrera Premio #1253856. También es financiado por la NSF expediciones en computación Premio #1522074.
Materiales
| Name | Company | Catalog Number | Comments |
| Hardware / Software | |||
| Freedom EVO 150 Liquid Handling Robot | Tecan | Custom liquid handler fitted with an 8-channel pipetting arm http://lifesciences.tecan.com/products/liquid_handling_and_robotics/freedom_evo | |
| Freedom EVOware Standard (Version 2.4 Service Pack 2) | Tecan | Software used to control the Freedom EVO 150 liquid handler http://lifesciences.tecan.com/products/software/freedom_evoware | |
| Echo 550 | Labcyte | Acoustic Liquid Dispenser http://www.labcyte.com/products/liquidhandling/echo-550-liquid-handler | |
| Sorvall Legend RT | Sorvall | Large benchtop swing-bucket sentrifuge | |
| MasterCycler Pro | Eppendorf | 950040015 | Thermocycler with 96-well heat block https://online-shop.eppendorf.us/US-en/PCR-44553/Cyclers-44554/Mastercycler-pro-PF-5193.html |
| ECHOTHERM Chilling/Heating Dry Bath | Torrey Pines Scientific | Heating/Chilling block for EVO 150 deck https://www.torreypinesscientific.com/products/chilling-and-heating-dry-baths/echotherm-ric20-series-remote-controlled-chillingheating-dr | |
| Tabletop Microcentrifuge 5418 | Eppendorf | 5418000017 | Stardard 18-well microcentrifuge https://online-shop.eppendorf.com/OC-en/Centrifugation-44533/Centrifuges-44534/Centrifuges-5418--5418R-PF-9257.html |
| Name | Company | Catalog Number | Comments |
| Resources | |||
| mocloassembly.com | Lattice Automation | Web-tool for combinatorial DNA assembly mocloassembly.com | |
| CIDAR MoClo Parts Kit | AddGene | 1000000059 | Kit of bacterial glycerol stocks for all DNA parts used in this study https://www.addgene.org/cloning/moclo/densmore/ |
| CIDAR ICE Registry | CIDAR Lab | Registry of plasmid DNA maps https://ice.cidarlab.org/folders/8 https://synbiohub.programmingbiology.org/public/bubdc_ice/bubdc_ice_folder_8/current | |
| Name | Company | Catalog Number | Comments |
| Labware | |||
| 50 μL Conductive Tips | Tecan | 30 057 818 | Sterile 50 μL conductive tips for Tecan liquid handler http://lifesciences.tecan.com/products/consumables/disposable_tips/liquid_handling_disposable_tips |
| 2 mL Deep 96-well Culture Plates | USA Scinetific | 5678-0285 | Bacterial culture plates used for culturing of large numbers of samples http://www.thermoscientific.com/en/product/nunc-1-3-2-0ml-deepwell-plates-shared-wall-technology.html |
| 1.5 mL Microcentrifuge Tubes | USA Scinetific | 1615-5599 | Disposable microcentrifuge tubes http://www.usascientific.com/Seal-Rite-1.5-ml-tube-colors.aspx |
| Breathe Easier sealing membrane | Sigma-Aldrich | Z763624-100EA | Breathable sealing membrane for bacterial culture plates http://www.sigmaaldrich.com/catalog/product/sigma/z763624?lang=en®ion=US |
| Full-Skirted, Low-Profile, 96-Well PCR Plates | GeneMate | T-3183-2 | PCR plates used for all steps https://www.bioexpress.com/store/catalog/product.jsp?catalog_number=T-3183-R |
| Alluminum Sealing Foil for PCR Plates | GeneMate | T-2451-1 | Alluminum seals for PCR plate storage https://www.bioexpress.com/store/catalog/product.jsp?catalog_number=T-2451-1 |
| Polyolefin Sealing Film for PCR Plates | GeneMate | T-2450-1 | Plastic seals for PCR plates during cycling https://www.bioexpress.com/store/catalog/product.jsp?catalog_number=T-2450-1 |
| PCR Cooler | Eppendorf | 22510525 | 96-well cold block https://online-shop.eppendorf.us/US-en/Temperature-Control-and-Mixing-44518/Accessories-44520/PCR-Cooler-PF-55940.html |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| GenCatch Plasmid DNA Mini-Prep Kit | Epoch Life Sciences | 2160250 | Plasmid DNA purification kit http://www.epochlifescience.com/Product/PurificationKit/dna_mini.aspx |
| T4 DNA Ligase (HC) | Promega | M1794 | High concentration T4 DNA Ligase https://www.promega.com/products/cloning-and-dna-markers/molecular-biology-enzymes-and-reagents/t4-dna-ligase/?catNum=M1794 |
| BbsI Restriction Enzyme | New England Biolabs | R0539L | BbsI enzyme at 10,000 units/ml https://www.neb.com/products/r0539-bbsi |
| BsaI Restriction Enzyme | New England Biolabs | R0535L | BsaI enzyme at 10,000 units/ml https://www.neb.com/products/r3535-bsai-hf |
| T4 DNA Ligase Buffer Pack | Promega | C1263 | 10x T4 DNA ligase buffer https://www.promega.com/products/cloning-and-dna-markers/cloning-tools-and-competent-cells/t4-dna-ligase/ |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Zymo Research | I1001-25 | 0.5M IPTG Solution http://www.zymoresearch.com/buffers-solutions/chemicals/isopropyl-ss-d-thiogalactopyranoside-iptg |
| 5-bromo-4-chloro-3-indolyl ß-D-galactopyranoside (X-GAL) | Zymo Research | X1001-25 | 20 mg/ml X-GAL solution http://www.zymoresearch.com/buffers-solutions/chemicals/5-bromo-4-chloro-3-indolyl-ss-d-galactopyranoside-x-gal |
| Kanamycin Sulfate | Zymo Research | A1003-25 | 35 mg/ml Kanamycin solution http://www.zymoresearch.com/buffers-solutions/antibiotics/kanamycin-sulfate |
| Carbenicillin (Disodium Salt) | Fisher | BP26481 | 1 g Carbenicillin (Ampicillin analog) https://www.fishersci.com/shop/products/carbenicillin-disodium-salt-fisher-bioreagents-3/p-25005#?keyword=carbenicillin |
| SOC Broth Media | Teknova | S0225 | Powder media used to make SOC broth http://www.teknova.com/SOC-BROTH-MEDIA-p/s0225.htm |
| LB Broth (Lennox) Media | Sigma-Aldrich | L3022-1KG | Powder media used to make LB broth http://www.sigmaaldrich.com/catalog/product/sigma/l3022?lang=en®ion=US |
| LB Broth with agar (Lennox) Media | Sigma-Aldrich | L2897-1KG | LB with agar mix used for making solid media plates http://www.sigmaaldrich.com/catalog/product/sigma/l2897?lang=en®ion=US |
| Alpha-Select Gold Efficiency Competent Cells | Bioline | BIO-85027 | High efficiency chemically competent E. coli cells http://www.bioline.com/us/alpha-select-gold-efficiency.html |
| Name | Company | Catalog Number | Comments |
| Primers | |||
| Primer VF | 5'-TGCCACCTGACGTCTAAGAA-3' Primers used for Sanger sequencing and colony PCRs | ||
| Primer VR | 5'-ATTACCGCCTTTGAGTGAGC-3' Primers used for Sanger sequencing and colony PCRs |
Referencias
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403 (6767), 339-342 (2000).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403 (6767), 335-338 (2000).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat Biotechnol. 23 (1), 47-55 (2005).
- Anderson, J. C., Clarke, E. J., Arkin, A. P., Voigt, C. A. Environmentally controlled invasion of cancer cells by engineered bacteria. J Mol Biol. 355 (4), 619-627 (2006).
- Xie, Z., Wroblewska, L., Prochazka, L., Weiss, R., Benenson, Y. Multi-input RNAi-based logic circuit for identification of specific cancer cells. Science. 333 (6047), 1307-1311 (2011).
- Ro, D. K., et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature. 440 (7086), 940-943 (2006).
- Georgianna, D. R., Mayfield, S. P. Exploiting diversity and synthetic biology for the production of algal biofuels. Nature. 488 (7411), 329-335 (2012).
- Savage, D. F., Way, J., Silver, P. A. Defossiling fuel: how synthetic biology can transform biofuel production. ACS Chem Biol. 3 (1), 13-16 (2008).
- Fussenegger, M., et al. Streptogramin-based gene regulation systems for mammalian cells. Nat Biotechnol. 18 (11), 1203-1208 (2000).
- Boorsma, M., et al. A temperature-regulated replicon-based DNA expression system. Nat Biotechnol. 18 (4), 429-432 (2000).
- Malphettes, L., et al. A novel mammalian expression system derived from components coordinating nicotine degradation in arthrobacter nicotinovorans pAO1. Nucleic Acids Res. 33 (12), e107(2005).
- Brophy, J. A., Voigt, C. A. Principles of genetic circuit design. Nat Methods. 11 (5), 508-520 (2014).
- Lou, C., Stanton, B., Chen, Y. J., Munsky, B., Voigt, C. A. Ribozyme-based insulator parts buffer synthetic circuits from genetic context. Nat Biotechnol. , (2012).
- Cardinale, S., Arkin, A. P. Contextualizing context for synthetic biology--identifying causes of failure of synthetic biological systems. Biotechnol J. 7 (7), 856-866 (2012).
- Carr, S. B., Beal, J., Densmore, D. M. Reducing DNA context dependence in bacterial promoters. PLoS One. 12 (4), e0176013(2017).
- Yeung, E., Ng, A., Kim, J., Sun, Z. Z., Murray, R. M. Decision and Control (CDC), 2014 IEEE 53rd Annual Conference on. , 5405-5412 (2014).
- Engler, C., Gruetzner, R., Kandzia, R., Marillonnet, S. Golden gate shuffling: a one-pot DNA shuffling method based on type IIs restriction enzymes. PLoS One. 4 (5), e5553(2009).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A modular cloning system for standardized assembly of multigene constructs. PLoS One. 6 (2), e16765(2011).
- Iverson, S. V., Haddock, T. L., Beal, J., Densmore, D. M. CIDAR MoClo: Improved MoClo Assembly Standard and New E. coli Part Library Enable Rapid Combinatorial Design for Synthetic and Traditional Biology. ACS Synth Biol. 5 (1), 99-103 (2016).
- Casini, A., Storch, M., Baldwin, G. S., Ellis, T. Bricks and blueprints: methods and standards for DNA assembly. Nat Rev Mol Cell Biol. 16 (9), 568-576 (2015).
- Bhatia, S. P., Smanski, M., Voigt, C. A., Densmore, D. M. Genetic design via combinatorial constraint specification. ACS Synth Biol. , (2017).
- Ham, T. S., et al. Design, implementation and practice of JBEI-ICE: an open source biological part registry platform and tools. Nucleic Acids Res. 40 (18), e141(2012).
- Madsen, C., et al. The SBOL Stack: A Platform for Storing, Publishing, and Sharing Synthetic Biology Designs. ACS Synth Biol. 5 (6), 487-497 (2016).
- Knight, T. Draft standard for BioBrick biological parts. , (2007).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods. 6 (5), 343-345 (2009).
- Ma, A. C., et al. FusX: A Rapid One-Step Transcription Activator-Like Effector Assembly System for Genome Science. Hum Gene Ther. 27 (6), 451-463 (2016).
- Check Hayden, E. The automated lab. Nature. 516 (7529), 131-132 (2014).
- Nielsen, A. A., et al. Genetic circuit design automation. Science. 352 (6281), aac7341(2016).
- Woodruff, L. B. A., et al. Registry in a tube: multiplexed pools of retrievable parts for genetic design space exploration. Nucleic Acids Res. 45 (3), 1553-1565 (2017).
- Hasty, J., McMillen, D., Collins, J. J. Engineered gene circuits. Nature. 420 (6912), 224-230 (2002).
- Gibson, D. G. Enzymatic assembly of overlapping DNA fragments. Methods Enzymol. 498, 349-361 (2011).
- Appleton, E., Tao, J., Haddock, T., Densmore, D. Interactive assembly algorithms for molecular cloning. Nat Methods. 11 (6), 657-662 (2014).
- Vasilev, V., Liu, C., Haddock, T., Bhatia, S., Adler, A., Yaman, F., Beal, J., Babb, J., Weiss, R., Densmore, D. A Software Stack for Specification and Robotic Execution of Protocols for Synthetic Biological Engineering. SynBERC Fall Retreat, Harvard University. , (2011).
- Beal, J., et al. An end-to-end workflow for engineering of biological networks from high-level specifications. ACS Synth Biol. 1 (8), 317-331 (2012).
- Bhatia, S., Densmore, D. Pigeon: a design visualizer for synthetic biology. ACS Synth Biol. 2 (6), 348-350 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados