Method Article
Conversión epigenética como un método seguro y simple para obtener células secretoras de insulina a partir de fibroblastos de la piel de adultos
En este artículo
Resumen
Here, a new method that allows the conversion of adult skin fibroblasts into insulin-secreting cells is presented. This technique is based on epigenetic conversion, does not involve the use of retroviral vectors nor the acquisition of a stable pluripotent state. It is therefore highly promising for translational medicine applications.
Resumen
Regenerative medicine requires new, fully functional cells that are delivered to patients in order to repair degenerated or damaged tissues. When such cells are not readily available, they can be obtained using different approaches that include, among the many, reprogramming and trans-differentiation, with advantages and limitations that are specific of the different techniques. Here a new strategy for the conversion of an adult mature fibroblast into an insulin-secreting cell, arbitrarily designated as epigenetic converted cells (EpiCC), is described. The method has been developed, based on the increasing understanding of the mechanisms controlling epigenetic regulation of cell fate and differentiation. In particular, the first step uses an epigenetic modifier, namely 5-aza-cytidine, to drive adult cells into a "highly permissive" state. It then takes advantage of this brief and reversible window of epigenetic plasticity, to re-address cells toward a different lineage. The approach is designated "epigenetic cell conversion". It is a simple and robust way to obtain an efficient, controlled and stable cellular inter-lineage switch. Since the protocol does not involve the use of any gene transfection, it is free of viral vectors and does not involve a stable pluripotent state, it is highly promising for translational medicine applications.
Introducción
Un objetivo fundamental de la medicina regenerativa es la generación de células nuevas y funcionales que se pueden utilizar para reparar o reemplazar dañado, degenerado tejidos. Rehacer células adultas fácilmente disponibles en otros nuevos, mediante la conversión de un tipo de célula a otra, es un enfoque particularmente atractivo, especialmente cuando la población de células requerido no es abundante o de difícil acceso. Sin embargo, las células adultas son extraordinariamente estables. Adquieren su estado diferenciado a través de una restricción gradual en sus opciones y, una vez que lleguen a la terminal de especialización madura, que se retengan de manera estable 1.
En los últimos años se han desarrollado una serie de protocolos, que permitan la reasignación a la pluripotencia de una célula somática (iPS) logrado a través de la expresión forzada de un conjunto de factores de transcripción 2,3. Alternativamente, la conversión de células puede obtenerse por transdiferenciación linaje directo, la introducción de un solo 4 o una combinación de factores de transcripción 5-7. Esta estrategia no implica la transición a través de un estado de-diferenciado, pero sí requiere una alta expresión de los factores de la transcripción específica 8.
Hemos desarrollado recientemente un protocolo de conversión basado en la breve exposición de las células adultas a las propiedades de desmetilación del análogo de citidina 5-azacitidina (5-aza-CR), un inhibidor de la metiltransferasa de ADN bien caracterizado. La etapa de desmetilación es seguido inmediatamente por un protocolo de diferenciación específica 9-11 que permite obtener el fenotipo de terminal requerida. Este método es capaz de convertir células maduras, diferenciadas en células de un linaje diferente y tiene la ventaja sustancial para evitar tanto el uso de vectores virales y la transfección de los factores de transcripción exógenas. La adquisición de un estado pluripotente estable, y el aumento de la susceptibilidad relacionada con la inestabilidad celular también se evita.
El protocolo detallado que permite la conversión de fibroblastos de piel humana adultas en células completamente funcionales secretoras de insulina se presenta aquí. Sin embargo, vale la pena señalar que la técnica se ha aplicado a diferentes tipos de células y ha generado resultados positivos, al dirigirse a células hacia diferentes vías de diferenciación. Además, la conversión epigenética se ha utilizado con éxito en la especie humana y porcina 9-13, así como en el perro (manuscrito presentado) lo que sugiere una amplia eficacia y la robustez de la aproximación.
Protocolo
Nota: Todos los procedimientos descritos a continuación deben realizarse bajo campana de flujo laminar en condiciones estériles. Asegúrese de que todos los procedimientos de cultivo se llevan a cabo en etapas termostáticas y las células se mantienen a 37 ° C en toda su manejo.
1. Aislamiento de fibroblastos de la piel
- Preparar Cultura Solución de revestimiento del plato
- Disolver 0,1 g de gelatina porcina en 100 ml de agua (concentración final 0,1%). Esterilizar la solución con autoclave.
- Añadir 1,5 ml de gelatina porcina estéril 0,1% a 35 mm placas de Petri. Esperar 2 horas para revestir, manteniéndolas a temperatura ambiente.
Nota: las biopsias de piel humana son recogidos por escisión bajo anestesia local de una zona avascular de la cara anterior del antebrazo y se almacenaron en solución salina tamponada con fosfato de Dulbecco (PBS) suplementado con solución antimicótica antibiótica 2% a 4 ° C antes de su uso.
- Lavar las biopsias con nueva PBS suplementado con 2% de antibisolución antimicótica ótica.
- Biopsias lugar en un plato de Petri de 100 mm y cortar en aproximadamente 2 mm 3 fragmentos con bisturís estériles.
- Eliminar el exceso de solución de revestimiento inmediatamente antes de chapado fragmentos.
- Coloque 5-6 fragmentos de piel en la placa de Petri pre-revestido 35 mm.
- Preparar medio de cultivo de fibroblastos: 77% de Eagle modificado por Dulbecco (DMEM) alto nivel de glucosa, 20% suero bovino fetal (FBS), 1% de solución de L-glutamina y 2% de solución antimicótica antibiótica.
- Añadir una gota de medio de fibroblastos sobre cada fragmento (por lo general 100 l por fragmento) y la cultura de ellos a 37 ° C en 5% de CO 2.
- Después de 24 horas, añadir 500 l de medio de cultivo de fibroblastos en los fragmentos para mantenerlos húmedos a 37 ° C en 5% de CO 2.
- Cambiar el medio con una pipeta al menos una vez cada 48 horas.
- Después de 6 días de incubación, retirar cuidadosamente los fragmentos de tejido y desecharlos.
Nota: Después de 6 días, fibroblastoss comienzan a crecer fuera de los fragmentos de tejido y comienzan a formar una monocapa de células. - Refrescar medio, agregar 2 ml de medio de cultivo de fibroblastos y continuar el cultivo en monocapa de células a 37 ° C en 5% de CO2.
2. cultivo de fibroblastos
- Fibroblastos de cultivo a 37 ° C en CO2 al 5% hasta 80% de confluencia
- Para los pases, medio de cultivo de fibroblastos de aspirado de placas de cultivo de tejidos. Lavar las células tres veces con 4 ml de PBS suplementado con solución antimicótica antibiótica 1%.
- Añadir una capa fina (10% del volumen de medio de cultivo) de solución de tripsina-EDTA (0,5 g de tripsina / L porcina y 0,2 g / L de EDTA) y se incuba a 37 ° C hasta que monocapa de células comienza a desprenderse de la parte inferior del tejido placa de cultivo y las células se disocian.
- Diluir la suspensión de células con 9 partes de medio de cultivo de fibroblastos para neutralizar la acción de la tripsina. La centrifugación no es necesario.
- células de la placa en nuevas placas de cultivo (confuera de gelatina) y el cultivo a 37 ° C en 5% de CO2. Mantener la relación de paso entre 1: 2 y 1: 4, dependiendo de la tasa de crecimiento.
- Cuando las células alcanzan aproximadamente el 80% de confluencia, el paso de ellos (por lo general dos veces por semana).
3. fibroblastos Chapado de epigenética Conversión
- Añadir 0,26 ml / cm 2 de 0,1% de gelatina porcina (preparar como se describe en 1.1) a placas de cultivo celular. Esperar 2 horas para cubrir.
- Retire el exceso de solución de revestimiento min 10-30 antes de chapado fibroblastos.
- Retire el medio de cultivo de fibroblastos de placas de cultivo. Lavar las células tres veces con PBS suplementado con solución antimicótica antibiótica 1%.
- Añadir una capa fina (10% del volumen de medio de cultivo) de solución de tripsina-EDTA (0,5 g de tripsina / L porcina y 0,2 g / L de EDTA) y se incuba a 37 ° C hasta que monocapa de células comienza a desprenderse de la parte inferior del tejido placa de cultivo y las células se disocian.
- Diluir la suspensión de células con 9 partes de fibroblmedio de cultivo ast para neutralizar la acción de la tripsina.
- Recuento de células utilizando una cámara de recuento bajo un microscopio a temperatura ambiente. Calcular el volumen requerido de medio de cultivo de fibroblastos para resuspender las células, para obtener una concentración de células de 7,8 x 10 4 fibroblastos / cm 2. Esto dependerá del tipo específico de la cámara utilizada.
Células / l = Promedio del número de células por rejilla (factor de multiplicación) de dilución x 90 x pequeña - suspensión de células Centrifugar a 150 g durante 5 min a temperatura ambiente. Retire las células sobrenadante y resuspender con el volumen calculado previamente de medio de cultivo de fibroblastos.
- Células de la placa en un 0,1% de gelatina platos y cultivarlas durante 24 horas a 37 ° C en 5% de CO2 pre-recubiertos.
4. Aumentar la plasticidad celular utilizando el De-metilación agente 5-aza-CR
- día 0
- Preparar 5 aza-CR-solución madre disolviendo 2,44 mg de 5-aza-CR en 10 ml de DMEM de alta glucosa medium. Esterilizar por filtración. Preparar 5-aza-CR de stock inmediatamente antes de su uso.
- Diluir 1 l de 5-aza-CR solución madre en 1 ml de medio de cultivo de fibroblastos (concentración final 1 mM).
- Para aumentar la plasticidad de las células, 24 horas después de la siembra de células (subpartida 3,8), retire el medio de cultivo de fibroblastos sembrados y añadir 1 M 5-aza-CR solución madre y la cultura durante 18 horas a 37 ° C en 5% de CO2.
- Día 1
- Preparar medio fresco Pluripotentes (HP) tal como se describe en la Tabla 1.
- Después de la incubación con 1 M 5-aza-CR, retire medio y lavar las células tres veces con PBS para garantizar que el 5-aza-CR se enjuaga de distancia.
- Incubar 5-aza-CR fibroblastos tratados con medio de HP durante 3 horas (periodo de recuperación) a 37 ° C en 5% de CO 2.
- Después de que el período de recuperación, eliminar medio, lavar tres veces con PBS.
- Para monitorizar la eficacia del tratamiento 5-aza-CR, comprobar en esta etapa fo la presencia de cambios morfológicos (detalla en la sección Resultados). Las células pierden la típica morfología alargada de fibroblastos y adquieren una forma redonda u ovalada, cada vez más pequeños en tamaño, con núcleos grandes.
- Proceder con la diferenciación de páncreas.
5. protocolo de diferenciación pancreático
- 1-6 días
- Preparar pancreático medio basal tal como se describe en la Tabla 2.
- Preparar una solución madre de activina: disolver 5 g de proteína activina A humana recombinante en 166,6 l de agua estéril.
- Cultura 5-aza-CR fibroblastos tratados de 0,26 ml / cm2 de páncreas medio basal suplementado con 1 l / ml activina una solución de reserva (véase 5.1.2) durante 6 días a 37 ° C en 5% de CO2. Cambiar de un día medio.
- 7-8 días
- Preparar la solución de ácido retinoico de stock mediante la adición de 16,6 ml de sulfóxido de dimetilo (DMSO) a 50 mg de aci retinoicore.
- Células de cultivo de 0,26 ml / cm2 de páncreas medio basal suplementado con 1 l / ml de activina una solución de reserva (véase 5.1.2) y 1 l / solución de ácido retinoico Stock ml (ver 5.2.1) durante 2 días a 37 ° C en 5% de CO 2. Cambiar de un día medio.
- 9-36 días
- Células de cultivo en 0,26 ml / cm 2 de páncreas medio basal suplementado con 1% (v / v) de insulina-transferrina-selenio (ITS), 2% (v / v) B27 y 0,1% (v / v) recombinante FGF humano básico (bFGF) solución de reserva (véase la Tabla 1) a 37 ° C en 5% de CO2. Cambiar el medio al día durante los primeros 15 días.
- De día 16 en adelante, volver a cargar medio cada dos días, con un microscopio, ya que la formación de células de agregado puede separar de la parte inferior de la placa de cultivo.
Resultados
Establecimiento de cultivo primario a partir de biopsias de la piel
Las biopsias de piel se cortaron en fragmentos pequeños y se colocan en platos de gelatina pre-revestidas. Después de 6 días, los fibroblastos empezaron a crecer fuera de los fragmentos de tejido y formaron una monocapa de células (Figura 1A). Las células mostraron una típica forma alargada y, como se esperaba, mostraron una inmune-positividad uniforme para el fibroblasto vimentina marcador específico (Vim, Figura 1B).
Los cambios morfológicos y la metilación del patrón de fibroblastos de la piel después de la exposición de 18 horas a 5-aza-CR
Para obtener una conversión exitosa epigenética de los fibroblastos en células secretoras de insulina, aumentamos su plasticidad utilizando el agente de-metilación, 5-aza-CR. Los fibroblastos humanos se sembraron en 0,1% de gelatina platos pre-revestidos a una concentración de 7,8 x 10 4 fibroblastos / cm 2. Veinticuatro horas después de la siembra, las células wERE se incubaron con 1 micras 5-aza-CR durante 18 h.
Al final de este tratamiento, una extensa cambio de fenotipo de células era visible (POST 5-aza-CR, Figura 2A). La morfología alargada típica de los fibroblastos no tratados (T0, Figura 2A), fue sustituido por una forma redonda u ovalada y tamaño de la celda se hizo considerablemente más pequeño. El citoplasma era granular, aplanado, y las células se adhiere a la superficie de cultivo. Los núcleos apareció más grande y vacuolado, como consecuencia de la estructura de la cromatina relajado. En nuestra experiencia, la presencia de estos cambios morfológicos es esencial y debe ser cuidadosamente monitorizado como un marcador para la eficacia del tratamiento con 5-aza-CR.
Después de 18 h de exposición a 5-aza-CR, una fuerte disminución de la metilación del ADN a nivel mundial también fue evidente y se demostró claramente por la menor intensidad de la inmunotinción 5-metilcitidina ( Figura 2B).
Los cambios morfológicos y funcionales durante la conversión epigenética de fibroblastos de la piel en células secretoras de insulina
Para inducir la diferenciación de páncreas, los fibroblastos tratados 5-aza-CR fueron expuestos a un protocolo de tres etapas para la inducción de páncreas, inmediatamente después del período de recuperación de 3 hr.
Durante la primera etapa, las células se cultivaron durante 7 días en pancreático medio basal suplementado con activina A para promover el compromiso endodermo. En este intervalo, las células más aplanados y poco a poco comenzaron a organizarse en grupos (día 7, Figura 3A). Posteriormente, la diferenciación del linaje pancreático se promovió con la adición de ácido retinoico durante 2 días. En respuesta a este tratamiento, las células reordenan en un patrón reticular y crecieron en los agregados claramente distinguibles de células (Día 10, Figura 3A). La formación agrupación pproceso en que aumentó con el tiempo y fue estimulado por la tercera y última etapa, que consistió en la exposición de células a B27, bFGF e ITS. Esto llevó a la contratación de un número creciente de células que agregarse en grandes colonias 3D (día 20, la Figura 3A). Alrededor del día 36, estas colonias aparecieron como estructuras redondas distintas que recuerdan de islotes pancreáticos típicos in vitro (Día 36, Figura 3A).
La adquisición de la nueva fenotipo EPICC fue acompañado por un aumento gradual de los niveles globales de metilación del ADN que volvieron a los observados en los fibroblastos no tratados (5 mC Día 36 Figura 3B).
Después de 36 días de la inducción de páncreas, la eficiencia de conversión epigenética también se demostró mediante la expresión de marcadores pancreáticos maduras típicas, que eran originalmente indetectable en los fibroblastos no tratados (T0, Figura 3B). La co-localización de C-péptido (C-PEP) con pancreático y duodenal homeobox 1 (PDX1) confirmó la naturaleza de buena fe de EPICC como productoras de insulina los (Día 36, Figura 3B). Por otra parte, convierte fenotipo funcional celular se demuestra por su capacidad para responder a 20 mM de exposición a la glucosa, lo que representa el compuesto de activación fisiológica. Más en detalle, EPICC secretada activamente a la insulina en el medio de cultivo después de 1 h de estimulación D-glucosa. Sin autorización era detectable después de la exposición a una cantidad equimolar de L-glucosa (Figura 3C).

Figura 1: Aislamiento y caracterización de fibroblastos de piel humana (A) imagen representativa de los fibroblastos que crecen fuera de los fragmentos de tejido.. (B) Los fibroblastos muestran una inmune-positividad uniforme para su svimentina marcador ESPECÍFICOS (Vim). Los núcleos se tiñeron con DAPI. (Las barras de escala, 100 m). Haga clic aquí para ver una versión más grande de esta figura.
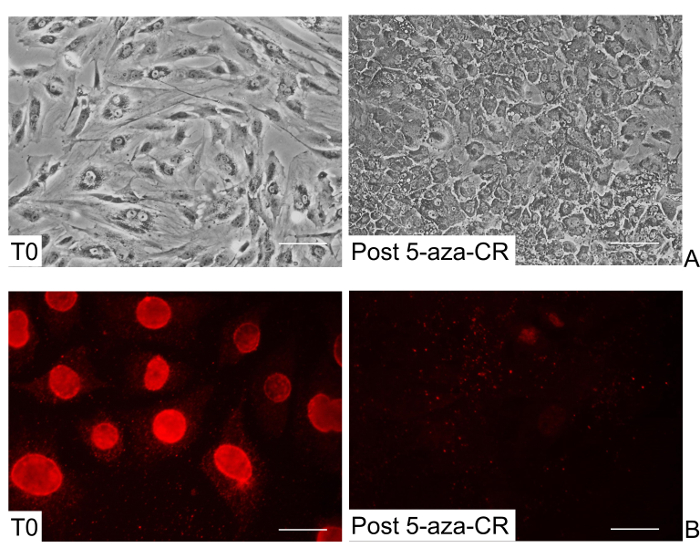
Figura 2: Los cambios morfológicos y de metilación de fibroblastos de piel humana después de 5-aza-CR tratamiento (A) Imágenes representativas de los fibroblastos no tratados que muestran de forma alargada (T0), y 5-aza-CR fibroblastos tratados que muestran una ronda o la morfología ovalada, granulado. citoplasma y núcleos agrandados y vacuolizadas (Mensaje 5-aza-CR). (Las barras de escala, 100 m). (B) Una disminución de la metilación del ADN a nivel mundial es detectable después de tratamiento con 5-aza-CR (Mensaje 5-aza-CR). (Las barras de escala, 50 micras). Por favor, click aquí para ver una versión más grande de esta figura.
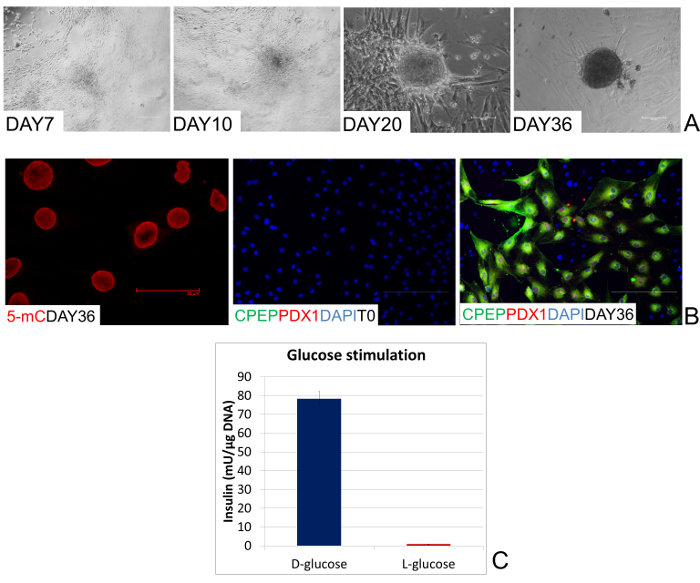
Figura 3:. Los cambios morfológicos y funcionales durante la conversión epigenética (A) imágenes representativas de los cambios morfológicos que tienen lugar durante la diferenciación de páncreas endocrino. Después de 7 días de la inducción, las células humanas organizan gradualmente en grupos (día 7). En respuesta a la adición de ácido retinoico, se reordenan en un patrón reticular y el grupo de los agregados distinguibles (Día 10). Estas formaciones progresan con el tiempo, el reclutamiento de células y agregando en grandes colonias en 3D (día 20). Finalmente, las colonias se convierten en estructuras esféricas que tienden a separar y flotar libremente en el medio de cultivo, que recuerda a los islotes pancreáticos típicos en vitro (día 36). (Las barras de escala, 100 m). (B) Después de 36 días de páncreas enla producción, los niveles globales de metilación del ADN de EPICC retorno humano a los observados en los fibroblastos no tratados (5 Día mC 36). (Barra de escala, 50 micras). Co-localización de PDX1 con C-PEP es detectable al final del período de conversión (Día 36), mientras que estos marcadores pancreáticos endocrinos están completamente ausentes en los fibroblastos no tratados (T0). (Las barras de escala, 100 m). La liberación de insulina (C) EPICC en respuesta a 20 mM de D-glucosa y 20 mM exposición-L glucosa. Las barras representan la media ± desviación estándar de tres repeticiones independientes. Por favor, haga clic aquí para ver una versión más grande de esta figura.
| Nombre del material / Equipo | Cantidad (v / v) | Comentarios / Descripción |
| Mezcla de nutrientes F-10 de Ham | 40% | |
| DMEM bajo en glucosa | 40% | |
| Reemplazo golpe de gracia suero | 10% | |
| FBS | 5% | |
| solución antimicótica antibiótica | 1% | |
| solución de L-glutamina | 1% | |
| Solución de aminoácidos no esenciales MEM | 1% | |
| 2-mercaptoetanol social | 1% | 2-mercaptoetanol preparación de la pasta: diluite 3,5 l de 2-mercaptoetanol en 5 ml de PBS estéril. Conservar en la oscuridad 4 ° C. Nota: Use dentro de 2 semanas |
| mezcla nucleósido de stock | 1% | nucleósidos preparación de la mezcla de almacén: disolver 0,042 g de guanosina, adenosina 0,040 g, 0,036 g citidina, uridina y 0,036 g 0,012 g de timidina en 50 ml de agua estéril. Se funden a 50 ° C para disolver. Esterilizar por filtrationes y se almacena a 4 ° C |
| ESGRO (LIF) | 0,1% | |
| FGF recombinante humano básico (bFGF) stock | 0,1% | bFGF preparación de la pasta: Añadir 5 ml de 0,1% albúmina de suero bovino (BSA) en PBS a 25 g de bFGF |
Tabla 1: Las soluciones de materiales.
| Nombre del material / Equipo | Cantidad (v / v) | Comentarios / Descripción |
| DMEM / F-12 | 93% | |
| B-27 Suplemento de vitamina A Minus | 2% | |
| N-2 Suplemento | 1% | |
| Solución de aminoácidos no esenciales MEM | 1% | |
| Antibióticosolución antimicótica | 1% | |
| 2-mercaptoetanol social | 1% | 2-mercaptoetanol preparación de la pasta: diluite 3,5 l de 2-mercaptoetanol en 5 ml de PBS estéril. Conservar en la oscuridad 4 ° C. Nota: Use dentro de 2 semanas |
| solución de L-glutamina | 1% | |
| BSA social | 1% | Preparación de BSA existencia: se disuelven 250 mg en 50 ml de agua. Esterilizar por filtración y se almacena a 4 ° C. |
Tabla 2: Las soluciones de materiales.
Discusión
El presente manuscrito describe un método que permite la conversión de fibroblastos de piel humana en células productoras de insulina, a través de una exposición transitoria y breve a 5-aza-CR, seguido de un protocolo de inducción específica de tejido. Este enfoque permite un interruptor del mesodermo a las células relacionadas con endodermo, sin la expresión forzada de factores de transcripción o microRNAs ni la adquisición de un estado pluripotente estable, que hace que las células más inestable y propenso a errores 14.
En el primer paso, la plasticidad de células se incrementa gracias a un modificador de la epigenética sintético que induce un estado permisivo transitoria, reversible en las células diferenciadas terminalmente. En particular, 5-aza-CR se utilizó con el fin de causar una disminución en la metilación global del las células de fibroblastos de la piel. 5-aza-CR se sabe que inhibe directamente la actividad de metil transferasa y para evitar que la metilación de novo en el ADN recién sintetizado. Debido a su efecto, esta moléculase ha utilizado previamente para reactivar genes silenciosos, así como para modificar los estados de diferenciación de las células eucariotas 15,16. Consistente con esto, publicar 5-aza-CR fibroblastos de piel mostraron una desmetilación del ADN global (Figura 2A), indicando 5-aza-CR capacidad de aumentar la plasticidad en las células usadas para los presentes experimentos. Esto también está de acuerdo con la observación de que el 5-aza-CR facilita la expresión del marcador relacionado alta plasticidad-Oct-4 en células de neuroesferas (NSC) 17. Sin embargo, es interesante observar que enviar 5-aza-CR fibroblastos de la piel vuelven a su fenotipo original después de la eliminación de 5-aza-CR. De hecho, previamente demostrado que los fibroblastos devueltos a su medio de cultivo original, hasta la expresión regulada de los factores relacionados con la pluripotencia-9,10, lo que indica que el estado adquirió mayor plasticidad, en respuesta al modificador epigenética, es transitoria y reversible y que no implique modificaciones permanentes de tél células.
Marcados cambios en la morfología celular acompañaron a la inducción de un estado superior plasticidad (Figura 2A). Los cuerpos celulares alargado típicos de las células de fibroblastos no tratados fue reemplazado por las células de forma ovalada o redonda que presenta dimensiones más pequeñas y un mayor volumen de núcleos, que apareció más grande que la de las células diferenciadas. Niwa correlaciona esta ampliación nuclear a una estructura de la cromatina relajada descrito como una característica relacionada con la pluripotencia-18. La presencia de núcleos vacuolados y citoplasma granular, así como un aumento de la morfología aplanada, eran evidentes. Todos los cambios morfológicos descritos se pueden utilizar prácticamente como un marcador para la realización exitosa de la primera parte del protocolo de conversión; en nuestra experiencia, cuando los cambios están presentes, 5-aza-CR ha hecho las células para adquirir un estado más permisiva ayudado.
Es posible tomar ventaja de esta transitorios "altos permisventana de tiempo sividad "para conducir las células hacia un fenotipo completamente diferente. El presente protocolo demuestra que los fibroblastos poste 5-aza-CR se pueden volver a dirigirse a las células similares a células beta pancreáticas, en respuesta a un medio de diferenciación específico. El protocolo utilizado permiten a las células para cambiar de un tipo de célula mesodermo derivado a una población celular que pertenece al linaje endodermo.
La insulina, que originalmente era indetectable en fibroblastos de la piel sin tratar, fue positivo al final del protocolo de diferenciación (Figura 3B). Esto fue acompañado por la expresión simultánea de otros factores, tales como PDX1, que participan en la diferenciación de la totalidad del páncreas exocrino - su, endocrino, y las poblaciones de células ductal, al lado del linaje de las células beta específico. Esto es consistente con el trabajo previo sobre las células madre embrionarias de ratón (CES) que indica que una adecuada diferenciación en las células beta se logró sólo cuando fueron capas de células inmaduras con other células endocrinas 19, lo que sugiere que el microambiente local proporcionado por el islotes pancreáticos de Langerhans de la arquitectura tiene un papel funcional fuerte.
De hecho, EPICC logró un fenotipo diferenciado maduro y mostró la capacidad de responder a 20 mM exposición a la glucosa (Figura 3). La insulina se secreta activamente en el medio de cultivo después de 1 h de estimulación D-glucosa, lo que confirma la naturaleza de buena fe de EPICC como las productoras de insulina (Figura 3C).
Un requisito distinto para un procedimiento exitoso es el mantenimiento riguroso de las células a 37 ° C, en todas las etapas, incluyendo su manejo bajo el flujo laminar estéril y el microscopio. En nuestra experiencia, es también muy recomendable para preparar reactivos recién, antes de su uso en el cultivo y para refrescar medio estrictamente de acuerdo con el protocolo. Esta operación debe llevarse a cabo bajo un microscopio ya que las células que forman agregadospuede desprenderse de la parte inferior de la placa de cultivo y se pierde durante cambios de medio.
El protocolo de conversión epigenética también se ha aplicado con éxito a la especie porcina, así como para el perro (manuscrito presentado), usando el mismo número de células / cm 2 y la concentración de agente metilante des descrito para los seres humanos.
En conclusión, un protocolo que permite la conversión de fibroblastos de la piel en otro tipo de célula se presenta aquí. La estrategia descrita tiene las ventajas de una conversión a base de células epigenetically: a saber, la posibilidad de evitar un estado pluripotente que podría dejar detrás de células capaces de causar cáncer; la eliminación de los factores genéticos exógenos que podrían causar cambios persistentes en las células. Estas ventajas hacen que el presente enfoque muy prometedor para aplicaciones de medicina traslacional y permite la terapia de células específicas del paciente.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Este trabajo fue financiado por la Fundación Carraresi y la Fundación Europea para el Estudio de la Diabetes (EFSD). GP es apoyado por una beca post-doctoral de la Universidad de Milán. Los autores son miembros de la Acción COST FA1201 Epiconcept: Epigenética y periconcepción medio ambiente y la Acción COST avanza en modelos animales grandes BM1308 Sharing (Salaam). TALB de es miembro de la Acción COST CM1406 epigenética Biología Química (EPICHEM).
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco's Phosphate Buffered Saline | Sigma | D5652 | PBS; for cell wash and solution preparation |
| Antibiotic Antimycotic Solution | Sigma | A5955 | Component of Fibroblast, HP and Pancreatic media |
| 100 mm Petri dish | Sarstedt | 83.3902 | For Fibroblast isolation |
| Porcine Gelatin | Sigma | G1890 | For dish coating |
| Water | Sigma | W3500 | For solution preparation |
| 35 mm Petri dishes | Sarstedt | 83.39 | For Fibroblast isolation |
| DMEM, high glucose, pyruvate | Life Technologies | 41966052 | For Fibroblast culture medium |
| Fetal Bovine Serum | Life Technologies | 10500064 | FBS; Component of Fibroblast and HP media |
| L-Glutamine solution | Sigma | G7513 | Component of Fibroblast, HP and Pancreatic media |
| Trypsin-EDTA solution | Sigma | T3924 | For Fibroblast dissociation |
| KOVA GLASSTIC SLIDE 10 WITH GRIDS | Hycor Biomedical | 87144 | Cell counting |
| 5-Azacytidine | Sigma | A2385 | 5-aza-CR, for increrase cell plasticity in fibroblasts |
| Ham's F-10 Nutrient Mix | Life Technologies | 31550031 | For HP medium |
| DMEM, low glucose, pyruvate | Life Technologies | 31885023 | For HP medium |
| KnockOut Serum Replacement | Life Technologies | 10828028 | Component of HP medium |
| MEM Non-Essential Amino Acids Solution | Life Technologies | 11140035 | Component of HP and Pancreatic Basal media |
| 2-Mercaptoethanol | Sigma | M7522 | Component of HP and Pancreatic Basal media |
| Guanosine | Sigma | G6264 | Nucleoside mix stock component of HP medium |
| Adenosine | Sigma | A4036 | Nucleoside mix stock component of HP medium |
| Cytidine | Sigma | C4654 | Nucleoside mix stock component of HP medium |
| Uridine | Sigma | U3003 | Nucleoside mix stock component of HP medium |
| Thymidine | Sigma | T1895 | Nucleoside mix stock component of HP medium |
| Millex-GS 0,22 µm | Millipore | SLGS033SB | For sterilizing of solution |
| FGF-Basic (AA 1-155) Recombinant Human Protein | Life Technologies | PHG0261 | bFGF; Component of HP and Pancreatic Basal medium |
| Bovine Serum Albumin | Sigma | A3311 | BSA; Component of Pancreatic Basal medium |
| DMEM/F-12 | Life Technologies | 11320074 | For Pancreatic Basal medium |
| B-27 Supplement Minus Vitamin A | Life Technologies | 12587010 | Component of Pancreatic medium |
| N-2 Supplement | Life Technologies | 17502048 | Component of Pancreatic Basal medium |
| Activin A Recombinant Human Protein | Life Technologies | PHG9014 | For Pancreatic medium |
| Retinoic Acid | Sigma | R2625 | For Pancreatic medium |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO; for Retinoic Acid stock preparation |
| Insulin-Transferrin-Selenium | Life Technologies | 41400045 | ITS; for Pancreatic Final medium |
| Anti-Vimentin antibody | Abcam | ab8069 | For immunocytochemical analisys. Working dilution 1:100 |
| 4′,6-Diamidino-2-phenylindole dihydrochloride | Sigma | 32670 | DAPI. For immunocytochemical analisys. Working dilution 1 µg/ml |
| 5-Methylcytidine | Eurogentec | MMS-900P-B | For immunocytochemical analisys. Working dilution 1:500 |
| Anti-C Peptide antibody | Abcam | ab14181 | For immunocytochemical analisys. Working dilution 1:100 |
| Anti-PDX1 antibody | Abcam | ab47267 | For immunocytochemical analisys. Working dilution 1:500 |
| Mercodia Insulin ELISA | Mercodia | 10-1113-10 | For insulin release detection |
Referencias
- Zhou, Q., Brown, J., Kanarek, A., Rajagopal, J., Melton, D. A. In vivo reprogramming of adult pancreatic exocrine cells to beta-cells. Nature. 455 (7213), 627-632 (2008).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Davis, R. L., Weintraub, H., Lassar, A. B. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell. 51 (6), 987-1000 (1987).
- Vierbuchen, T., et al. Direct conversion of fibroblasts to functional neurons by defined factors. Nature. 463 (7284), 1035-1041 (2010).
- Caiazzo, M., et al. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 476, 224-227 (2011).
- Huang, P., et al. Induction of functional hepatocyte-like cells from mouse fibroblasts by defined factors. Nature. 475, 386-389 (2011).
- Marro, S., et al. Direct Lineage Conversion of Terminally Differentiated Hepatocytes to Functional Neurons. Cell Stem Cell. 9 (4), 374-382 (2011).
- Pennarossa, G., et al. Brief demethylation step allows the conversion of adult human skin fibroblasts into insulin-secreting cells. Proc Natl Acad Sci U S A. 110 (22), 8948-8953 (2013).
- Pennarossa, G., et al. Reprogramming of Pig Dermal Fibroblast into Insulin Secreting Cells by a Brief Exposure to 5-aza-cytidine. Stem Cell Rev. 10 (1), 31-43 (2014).
- Brevini, T. A., et al. Morphological and Molecular Changes of Human Granulosa Cells Exposed to 5-Azacytidine and Addressed Toward Muscular Differentiation. Stem Cell Rev. 10 (5), 633-642 (2014).
- Thoma, E. C., et al. Chemical conversion of human fibroblasts into functional Schwann cells. Stem Cell Reports. 3 (4), 539-547 (2014).
- Mirakhori, F., Zeynali, B., Kiani, S., Baharvand, H. Brief azacytidine step allows the conversion of suspension human fibroblasts into neural progenitor-like cells. Cell J. 17 (1), 153-158 (2015).
- Plath, K., Lowry, W. E. Progress in understanding reprogramming to the induced pluripotent state. Nat Rev Genet. 12 (4), 253-265 (2011).
- Taylor, S. M., Jones, P. A. Multiple new phenotypes induced in 10T1/2 and 3T3 cells treated with 5-azacytidine. Cell. 17 (4), 771-779 (1979).
- Glover, T. W., Coyle-Morris, J., Pearce-Birge, L., Berger, C., Gemmill, R. M. DNA demethylation induced by 5-azacytidine does not affect fragile X expression. Am J Hum Genet. 38 (3), 309-318 (1986).
- Do, J. T., Scholer, H. R. Nuclei of embryonic stem cells reprogram somatic cells. Stem Cells. 22 (6), 941-949 (2004).
- Niwa, H. How is pluripotency determined and maintained? Development. 134 (4), 635-646 (2007).
- Kahan, B. W., et al. Pancreatic precursors and differentiated islet cell types from murine embryonic stem cells: an in vitro model to study islet differentiation. Diabetes. 52 (8), 2016-2024 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados