Method Article
Un modelo de microfluidos de biomiméticamente respiración pulmonar acinar Airways
En este artículo
Resumen
Soft-lithography was utilized to produce a representative true-scale model of pulmonary alveolated airways that expand and contract periodically, mimicking physiological breathing motion. This platform recreates respiratory acinar flows on a chip, and is anticipated to facilitate experimental investigation of inhaled aerosol dynamics and deposition in the pulmonary acinus.
Resumen
La cuantificación de las características del flujo respiratorio en las profundidades acinares pulmonar y cómo influyen en el transporte aerosol inhalado es crítica con respecto a la optimización de las técnicas de inhalación de drogas, así como la predicción de los patrones de deposición de partículas en el aire potencialmente tóxicos en los alvéolos pulmonares. Aquí, las técnicas de litografía blanda se usan para fabricar estructuras de las vías respiratorias acinares-como complejos en los veraces longitud escalas anatómicas que reproducen fenómenos de flujo acinar fisiológicas en un sistema ópticamente accesible. El dispositivo de microfluidos cuenta con 5 generaciones de bifurcar conductos alveolada con la expansión periódicamente y paredes de contratación. Wall accionamiento se consigue mediante la alteración de la presión dentro de las cámaras llenas de agua de los alrededores de las delgadas paredes del canal acinar PDMS tanto de los lados y la parte superior del dispositivo. En contraste con los dispositivos de microfluidos de capas múltiples comunes, donde se requiere el apilamiento de moldes de varios PDMS, se presenta un método simple para fabricar la parte superiorcámara mediante la incorporación de la sección de barril de una jeringa en el molde de PDMS. Esta novedosa configuración de microfluidos proporciona movimientos respiratorios fisiológicos que a su vez dan lugar a características acinares flujos de aire. En el presente estudio, se utilizó micro partículas velocimetría de imagen (μPIV) con partículas líquidas en suspensión de cuantificar tales flujos de aire a juego basado en la similitud hidrodinámico. La buena concordancia entre los resultados μPIV y fenómenos de flujo acinar esperados sugieren que la plataforma de microfluidos puede servir en un futuro próximo como una herramienta atractiva en vitro para investigar el transporte de partículas en el aire directamente representativa y la deposición en las regiones acinares de los pulmones.
Introducción
Una cuantificación detallada de la dinámica de flujo respiratorio en el distal, regiones alveolada de los pulmones es de suma importancia en la comprensión de la mezcla del flujo de aire en el acino pulmonar y predecir el destino de los aerosoles inhalados en la más profunda de las vías respiratorias 1-3. Este último aspecto es de particular preocupación cuando abordar por una parte los peligros de las partículas contaminantes inhalados o por el contrario en la búsqueda de nuevas estrategias para la administración de fármacos mejorado y selectiva de agentes terapéuticos inhalados a sitios localizados de pulmón 4, 5, así como para la administración sistémica.
Hasta la fecha, los flujos respiratorios en las regiones acinares pulmonares profundas han sido típicamente investigado in silico usando la dinámica de fluidos computacional (CFD) o, alternativamente, in vitro con modelos experimentales ampliados de coincidencia siguientes similitud hidrodinámico. En las últimas décadas, los métodos CFD se han aplicado cada vez más para estudiar fenómenos de flujo acinar, de cabeza del ce modelos alveolares 6, 7 y alveolada conductos 8-12 para más elaborado modelos in silico que capturan anatómicamente realista árbol acinar estructuras con múltiples generaciones de conductos alveolada y hasta varios cientos de alvéolos individuales 13-15.
En conjunto, los esfuerzos numéricos han sido fundamentales en el esclarecimiento de la función y la influencia del movimiento de la pared durante la respiración en los movimientos que siguió los patrones de flujo de aire acinar. En ausencia de movimiento de la respiración, estática de recirculación característica alvéolos fluye dentro de sus cavidades que exhiben ningún intercambio convectivo de aire entre el conducto acinar y el alvéolo 6, 7; en otras palabras, los flujos de alveolares serían totalmente aislados de flujos dentro de los árboles acinares y el intercambio de aire daría lugar únicamente de mecanismos de difusión. Con la existencia de las expansiones cíclicas del dominio alveolar, sin embargo, las topologías de flujo alveolares se modifican drásticamente y la resulting patrones de flujo dentro de los alvéolos están íntimamente ligados a la localización de un alvéolo lo largo del árbol acinares (por ejemplo., vs. proximal distal generaciones).
En particular, se ha planteado la hipótesis en las simulaciones que los patrones de flujo alveolares están fuertemente influenciadas por la relación de alveolar para ductal velocidades de flujo tal que las generaciones proximales del árbol acinar pulmonar, donde esta relación es relativamente grande siguiente conservación de la masa a través de una estructura de árbol, característica recirculación de los complejos flujos dentro de las cavidades alveolares con pathlines fluidos irreversibles. Con cada generación acinar más profunda, la relación de alveolar para velocidades de flujo ductal disminuye gradualmente de tal manera que las generaciones acinares distales presentan líneas de corriente más radiales como que recuerdan a inflaciones y deflaciones de un globo simples. Con los avances en las técnicas de imagen modernas, datos de imagen pulmonar 16, 17 de los roedores, incluyendo rata y ratón, han dado lugar a algunos de los primeros simultánea CFDciones de los flujos acinares reconstruidos anatómicamente en los alvéolos reconstruidas. A pesar de estos progresos prometedores, estos estudios recientes son todavía limitados para hacer frente a los fenómenos de flujo de aire en los sacos alveolares terminales sólo el 18, 19 o unos alvéolos en torno a un solo conducto 20. Como resultado, las investigaciones del estado de la técnica de los fenómenos de flujo respiratorio en los acinos siguen dominadas por los estudios centrados en genéricos geometrías inspiradas anatómicamente del entorno acinar 2.
En el lado experimental, diversas configuraciones que ofrecen una vía aérea con uno o varios alvéolos se han desarrollado a lo largo de los años 21-24. Sin embargo, no existe ningún modelos experimentales de bifurcar las vías respiratorias alveolada que son capaces de imitar la respiración fisiológica mediante la expansión y la contratación de una manera similar a la respiración. Dada la falta de plataformas experimentales atractivos en parte, el estudio de los fenómenos de transporte acinar sigue siendo limitada en lo que respecta a validating estudios computacionales y críticamente, sigue habiendo una escasez de datos experimentales disponibles. . En los últimos años, Ma et al (2009) han construido un modelo de pared rígida a mayor escala de un acino que consta de tres generaciones acinares; Sin embargo, la falta de movimiento de la pared en este modelo limita su capacidad para capturar los patrones de flujo alveolares en condiciones realistas de respiración.
Otros experimentos a escala plano incluyendo un modelo de pared móvil en base a los datos anatómicos de réplica de yeso recientemente se introdujeron 25; Sin embargo, dado que el modelo sólo capturó las dos últimas generaciones acinares (es decir., sacos terminales), que no pudo capturar los flujos de recirculación complejas que caracterizan a las generaciones acinares más proximales. Estos últimos ejemplos de experimentos a escala arriba subrayan aún más las limitaciones en curso con estos planteamientos. Específicamente, ningún experimento existente hasta el momento ha demostrado la transición planteado la hipótesis de recirculación para radial fluye a lo largolos acinos y de ese modo confirman las predicciones numéricas de las topologías de flujo hipótesis de existir en árboles acinares pulmonar reales 7, 15. Tal vez lo más crítico, los experimentos a escala arriba están muy limitados en la investigación de partículas de transporte y deposición dinámica de 26 inhalada debido a las dificultades en la adecuación de todos los no relevantes parámetros dimensionales (por ejemplo., la difusión de partículas, un mecanismo de transporte crítico para las partículas sub-micrométricas, está completamente descuidado).
Con desafíos experimentales en curso, nuevas plataformas experimentales que se puedan investigar las vías respiratorias flujos de aire y dinámica de las partículas en las paredes móviles complejas se buscan redes acinares. Aquí, un anatómicamente inspirado en el modelo in vitro se introduce acinar. Esto imita la plataforma de microfluidos acinares pulmonar fluye directamente en la escala acinar representativa, y amplía la creciente gama de modelos de microfluidos pulmonares 27, que incluye asma bronquial plug-flo líquidaws 28-30 y la barrera alveolocapilar 31.
Es decir, cuenta con el diseño actual de un árbol de la vía aérea alveolada cinco generación simplificada con la expansión y las paredes, en los movimientos cíclicos se consiguen mediante la presión que controla el interior de una cámara de agua que rodea las paredes laterales PDMS delgadas y donde la pared superior es deformada por un agua adicional contraer cíclicamente cámara situada directamente encima de la estructura acinar. A diferencia de los dispositivos de microfluidos de capas múltiples comunes, esta cámara está formado simplemente mediante la incorporación de la sección de barril de una jeringa dentro del dispositivo de PDMS, y no requiere la preparación de un molde de PDMS adicional.
El enfoque que aquí se presenta miniaturizado ofrece un medio simple y versátil para la reproducción de las estructuras acinares complicados con paredes móviles, en comparación con modelos a escala en marcha durante la captura de las características subyacentes del entorno de flujo acinar. Esta plataforma puede ser utilizado para flow visualización mediante partículas de fluido a poner en suspensión dentro de las vías respiratorias (ver resultados representativos de abajo). En un futuro próximo, el modelo se puede utilizar con partículas en el aire para el estudio de la dinámica de partículas inhaladas acinares.
Protocolo
Fabricación 1. Maestro
- Utilizar el grabado profundo de iones reactivos (DRIE) de un silicio sobre aislante de obleas (SOI) para fabricar una oblea de silicio maestro como se describe en trabajos anteriores 32, 33.
NOTA: DRIE se prefiere estándar SU-8 micromecanizado debido a las características de alta relación de aspecto (40 micras de ancho y 90 micras zanjas profundas).
2. Fundición y sellado del dispositivo de microfluidos
- Mezclar PDMS y agente de curado en una relación de 10: 1 peso dentro de un contenedor pequeño limpia tal como un plato de plástico de pesaje.
- Desgasificar la mezcla en un desecador al vacío hasta que se eliminen todas las burbujas de aire.
NOTA: Prepare suficientes PDMS para todos los pasos subsiguientes. A continuación, el acrónimo "PDMS" se refiere siempre a las desgasificados 10: 1 de PDMS: mezcla-agente de curado que se preparó en los pasos 2.1 y 2.2. - Verter la mezcla desgasificada a una altura de aproximadamente 1 mm por encima de la oblea maestro. Degas, una vez más durante al menos40 minutos para eliminar todas las burbujas de aire por encima de la oblea y minimizar las burbujas debajo de la oblea.
NOTA: Asegúrese de que la oblea es lo más cerca posible a la parte inferior de la placa. Si es necesario, pulse la oblea suavemente hacia la parte inferior con 2 barras de agitación y desgasificar una vez más. - Hornear a 65 ° C durante 20 minutos en un horno de convección natural.
NOTA: Después de 20 minutos, el PDMS se endurece y casi completamente curado. Mientras que un tiempo más largo de cocción es posible hornear durante 20 minutos ahorra tiempo y mejora la adherencia de la segunda capa de PDMS (ver más abajo) a la primera. - Presente la sección de cuerpo de una jeringa de plástico de 2 ml utilizando un papel de lija de grano fino para mejorar la adherencia al PDMS. Además, utilizar el papel de lija para aplanar la base del cilindro de la jeringa mediante la colocación de la arena de papel sobre una superficie plana y de deslizamiento de la base del cilindro de la jeringa en la parte superior de la misma. Limpiar la jeringa usando aire a presión.
- Coloque la sección de barril de la jeringa en la parte superior de la primera capa de PDMS con el LAapertura RGE frente a la superficie de los PDMS, y verter una segunda capa de PDMS en la parte superior de la primera uno a una altura de 5 ~ mm, y desgasificar la PDMS una vez más en un desecador.
NOTA: La segunda capa de PDMS se debe verter desde el pequeño recipiente alrededor del cañón, y no debe entrar dentro de él. - Hornear la configuración completa a 65 ° C durante al menos 2 h en un horno de convección natural.
NOTA: No hay necesidad de sostener el cuerpo en su lugar durante los procesos de curado ya que el peso del PDMS presionando contra la amplia base del barril tiene el barril firmemente en su lugar. - Cortar a través del molde de PDMS en torno a la región de modelado de la oblea maestro utilizando un bisturí. Si bien el corte, el bisturí debe débilmente toque la superficie de la oblea. A continuación, inserte suavemente un objeto puntiagudo, como fórceps de la oblea en la ranura creada por el bisturí, y se desprenda el PDMS emitidos por el oblea maestro.
- Colocar el molde en una superficie suave cubierto con papel de aluminio con el lado estampadohacia arriba (es decir., el cañón debe colgar desde el borde de la mesa), y perforar un agujero en el PDMS en la entrada de entrada de la cámara y el canal utilizando un punzón de biopsia de 1 mm.
- Escudo un portaobjetos de vidrio limpio con un (desgasificado) 10: 1 PDMS: mezcla-agente de curado utilizando un aplicador de giro programada a 3.000 rpm durante 30 segundos, y hornear durante> 1 hora a 65 ° C. A continuación, limpiar la diapositiva y PDMS fundido utilizando cinta adhesiva transparente.
- Tratar la superficie del molde y PDMS recubierto portaobjetos de vidrio PDMS con plasma de O2 (por ejemplo, utilizando un tratador corona de mano) durante 1 minuto, y luego presione suavemente las superficies juntas y hornear a 65 ° C durante la noche (O / N) .
3. Relleno de dispositivos y de actuación
- Mezclar agua suspendidas partículas de poliestireno fluorescentes con agua y glicerol en un vial de vidrio para obtener una (v / v) mezcla 64/36 de glicerol / agua con 0,25% (w / w) partículas ..
- Colocar una gota de la solución de glicerol en la parte superior de la entrada del canal y una gota de DI water en la entrada de la cámara, a continuación, colocar el aparato en un desecador y vacío durante ~ 5 min.
NOTA: Antes de liberar la espera de vacío de las burbujas que se forman en las gotas de solución de glicerol y agua DI al pop. Tras la liberación de vacío los líquidos son absorbidos en los espacios vacíos en el interior del dispositivo. Si el aire residual permanece dentro de los canales, eliminarlo mediante la aplicación de presión externa sobre los fluidos (por ejemplo., Usando una jeringa) y permitiendo que el aire se difunda en el PDMS. - Inyectar ~ 2 ml de agua DI en la cámara superior (es decir, el cuerpo de la jeringa, la Fig. 2b) hasta que esté completamente llena de agua. Luego cubra la cámara superior con una punta roma de la jeringa de calibre 19, cortar la punta de la otra punta de la jeringa de calibre 19 roma e insertar este consejo a la entrada de la cámara lateral. Conectar ambas puntas de jeringa a una jeringa de 1 ml mediante un tubo de teflón delgado y un conector en forma de T.
NOTA: Asegúrese de que la jeringa de 1 ml, tubo de teflón, conector en forma de T y la cámara superior (Barr jeringa de 2 mlEL) son todo lleno de agua sin burbujas. Esto se puede lograr mediante la apertura de los puntos de conexión, que empuja el agua a través de secciones vacías de tubo y volver a conectar los puntos de conexión. - Coloque la jeringa de 1 ml con una bomba de jeringa pre-programados para imitar, por ejemplo, un ciclo de respiración corriente tranquila (con un periodo de T = 4 s) construida de rampas lineales, es decir, de cero a 1,8 ml / min en 1 segundo, a partir de 1,8 ml / min a -1.8 ml / min en 2 segundos y desde -1.8 ml / min a cero en 1 seg.
4. Los experimentos de visualización de flujo: micro-partículas de velocimetría de imagen (μPIV)
- Mientras que el dispositivo está siendo accionado, obtener una serie de 9 - 12 imágenes de enganche de fase, de doble marco del flujo de partículas cabeza de serie, utilizando un sistema (μPIV) micro-partículas imagen velocimetría que consiste, por ejemplo de un CCD exposición marco de múltiples dual la cámara (por ejemplo., 1.600 × 1.200 píxeles para lograr una resolución suficiente), un doble láser de Nd-YAG pulsado (longitud de onda: 532 nm, energía de salida: 400 mJ, duración del pulso: 4 nseg), y un microscopio invertido.
NOTA: Tal sistema es capaz de obtener pares de marco con un retraso de tiempo de hasta unos pocos microsegundos entre el primer y segundo bastidores. Para lograr imágenes doble marco de enganche de fase, es útil para adquirir una serie doble marco en por ejemplo., 10 Hz (pares de bastidor están separados por 0,1 segundos una de otra). Entonces, los datos pueden ser reorganizados para que todos los pares de trama que están separados por un tiempo de ciclo completo (aquí T = 4 seg) forman una nueva serie de tiempo. La adquisición de imágenes se debe repetir varias veces mientras la modificación del tiempo de retraso entre el primer y segundo bastidores de cada par de trama (es decir., 100 microsegundos a 0,1 segundos) para la resolución de diferentes regiones de flujo dentro de la cavidad alveolar.
Nota: las configuraciones alternativas con respecto a las mejores combinaciones de sistemas de adquisición de imagen (. Es decir, la cámara) y la iluminación de las fuentes (es decir, láser) a la imagen talesmicroflujos también están disponibles 34, 35. - Utilizar un algoritmo de suma de correlación para calcular mapas de vectores de velocidad de enganche de fase del campo de flujo resultante de la serie de imágenes para cada intervalo de tiempo utilizado. Repita este proceso varias veces con diferentes tiempos de retraso entre el primer y segundo bastidores de cada par de trama para la resolución de diferentes regiones de flujo dentro de la cavidad alveolar. A continuación, utilizar un programa de análisis de datos para coser juntos los mapas de flujo individuales en un mapa completo y de alto detallada de los patrones de flujo promediando la superposición de puntos de datos 33.
Resultados
Diseño asistido por ordenador (CAD) y microscopio imágenes de la plataforma acinar in vitro se presentan en la Fig. 1. El modelo acinar biomimético cuenta con cinco generaciones de ramificación canales rectangulares alineadas con las cavidades cilíndricas alveolares similar (Fig. 1). Aquí, las generaciones de modelos se numeran de generación 1 (para la generación más proximal) para la generación de 5 (para la generación más distal). Tenga en cuenta que sólo la entrada del canal que conduce a la generación 1 está abierto al ambiente exterior por medio de una abertura en el PDMS. Los 16 conductos que conducen lejos de la generación 5 se dejan cerrada al aire (Fig. 1a). Al modular periódicamente la presión del agua dentro de las cámaras, las paredes delgadas que constituyen las cavidades alveolares y conductos están cíclicamente deformados. Al mismo tiempo, el techo de las vías respiratorias se deforma verticalmente por medio de una cámara de agua adicional situado por encima de los conductos; para crear esta cámara superior en unade manera sencilla sin la preparación de una capa de microfluidos adicional del cilindro de una jeringa se sumergió dentro de la PDMS antes de la reticulación. Esto dio lugar a una capa de PDMS de aproximadamente 1 mm de separación de los conductos alveolada y la cámara de agua superior (ver Fig. 2).
Las cámaras de agua están conectados a una bomba de jeringa programado para repetir una serie de velocidades de flujo lineal en rampa para imitar una normal a pesada escenario respiración corriente de un adulto humano promedio con un tiempo de ciclo de 4 segundos (T). Esto se traduce en una disminución periódica y aumento de volumen de las vías respiratorias; ya que las salidas están selladas y sólo la entrada es abierta al entorno, el fluido dentro de los conductos es inhalado y exhalado desde el dispositivo a través de la entrada, de modo similar a un proceso natural de respiración. Aquí, los conductos de las vías respiratorias se llenaron con una solución de glicerol se siembra con partículas fluorescentes (véase el Protocolo) y micro velocimetría de imágenes de partículas (μPIV) fue usado para mapear el resultadoi campos de flujo ng a través del árbol 33 de las vías respiratorias.
La magnitud normalizada de velocidad (u x / u x, max) en el sentido de la corriente (es decir., Axial) dirección a través de la anchura de los canales se muestra en la Fig. 3. Los resultados se presentan en la velocidad de inhalación pico para cada una de las 5 generaciones de dispositivos, y representan la proyección 2D del flujo dentro de una losa delgada cerca del plano medio del conducto. Para la comparación, la solución analítica de la corriente laminar en estado estacionario para un canal infinitamente largo 36 también se presenta en la Fig. 3.
La figura 4 muestra los patrones de racionalizar y magnitudes de velocidad dentro de las cavidades alveolares en el plano medio de las vías respiratorias en el pico de la inhalación. Las figuras 4a, byc representan generaciones acinares 1, 3 y 5, respectivamente.
gura 1 "src =" / files / ftp_upload / 53588 / 53588fig1.jpg "/>
Figura 1: Modelo de microfluidos de la red de árboles acinar (a) dibujo CAD del dispositivo completo.. (B) las instantáneas primer plano de la estructura de árbol que muestra los canales acinar, las cámaras y las delgadas paredes que los separan. Púrpura flechas indican los lugares correspondientes y -INSTRUCCIONES Y positivos de los perfiles de flujo presentados en la Fig. 3. Adaptado con permiso de ref. 33.

Figura 2:. Diseño CAD del dispositivo de microfluidos (a) Las líneas discontinuas indican los tubos que van de las cámaras laterales y superior a la bomba de jeringa a través de un conector en forma de T. (B) lateral, entró por el centro del dispositivo que ilustra la ubicación de la jeringa dentro del molde de PDMS. UNdaptado con permiso de ref. 33.
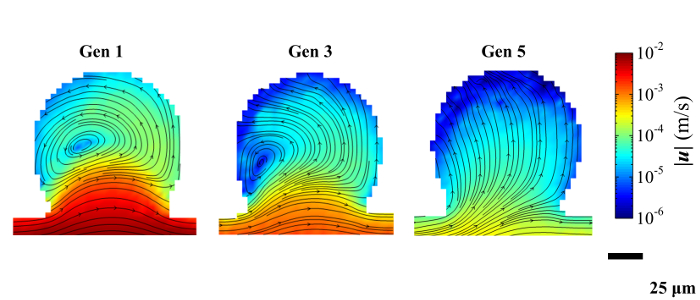
Figura 3: acinares velocidades de flujo perfiles de velocidad ductal normalizado (u x / u x, max) extraídos de PIV lo largo de la anchura del canal para las generaciones 1 a 5 en los lugares ilustrados en la Fig.. 1; y = 0 coincide con la ubicación del punto medio a través del canal y u x, max = 0,0104 m / seg corresponde aquí a la velocidad pico medido en sentido de la corriente del dispositivo de generación de mediciones de PIV 1. Aquí se muestra en el pico de la inhalación (t = 0,6 segundos) y la línea de negro se corresponde con el perfil de velocidad de análisis para creeping flujo dentro de un canal rectangular con W d = 345 micras y h = 92 micras. Adaptado con permiso de ref. 33.

Figura 4: Velocity Magnitudes y modelos correspondientes Streamline. Los datos se obtuvieron a partir de micro-PIV para una proyección de la corriente extraída en el plano medio de un alvéolo situado en generaciones de dispositivos se muestran 1, 3 y 5. Los campos de flujo de inhalación en aproximadamente pico (t = 0,6 segundos). magnitudes de velocidad se muestran en una escala logarítmica. Adaptado con permiso de ref. 33.
Discusión
Una característica crítica de la plataforma acinar de microfluidos que aquí se presenta es su capacidad para reproducir los movimientos de respiración fisiológicamente realistas que dan lugar a perfiles de flujo fisiológicas y velocidades dentro de los conductos acinares y dentro de los alvéolos. Dado que los canales de microfluidos se producen con una relación de aspecto relativamente baja (es decir., W d / h ≈ 3,9, donde w d es la anchura del conducto y h es la altura del conducto), los flujos medidos muestran más características de flujo de tipo tapón en comparación con los perfiles de flujo anticipadas parabólicos que existirían en canales circulares. Sin embargo, las velocidades medidas están bien dentro del rango fisiológico; se encuentra que el número de Reynolds adimensional característica, la comparación de inercia a fuerzas viscosas, se obtiene un máximo de aproximadamente 0,01 que corresponde a mediados y regiones distales, acinares siguientes estimaciones semi-empíricos 2.
contenido "> Aquí, el número de Reynolds se define como Re = u x, solución de h / ν glicerol max D, donde U x, max es la velocidad media sentido de la corriente a través del plano medio del conducto en el instante de la tasa de flujo máximo, D h es la diámetro hidráulico del conducto y ν solución de glicerol es la viscosidad cinemática de la solución de glicerol utilizado para la visualización de flujo que se corresponde con la viscosidad cinemática del aire a ~ 24 ° C (ν aire = 1,55 × 10 -5 m 2 / seg, ν solución de glicerol = 1,51 × 10 -5 m 2 / seg). Además, una disminución de la magnitud de flujo en aproximadamente se observa un factor de dos después de cada bifurcación como se espera delos patrones de ramificación dicotómica del modelo acinar. A saber, esta cascada de las velocidades de flujo es una característica importante de acinar fluye en los árboles de las vías respiratorias.Perfiles de flujo cerca y dentro de las cavidades alveolares (Fig. 4) muestran que las velocidades de los conductos están disminuyendo gradualmente hacia las generaciones más profundas acinares. Además, las magnitudes de flujo caen abruptamente a lo largo de la apertura de los alvéolos que resulta en velocidades de flujo que son de dos a tres órdenes de magnitud más lenta dentro de los alvéolos en comparación con los conductos; tales topologías de flujo se informó anteriormente en varios estudios numéricos 1, 9, 15 Además, los patrones de flujo cambian significativamente de una generación acinares a otro, como se predijo en las simulaciones 7., 15: mientras que la generación 1 cuenta con una zona de recirculación, que coincide aproximadamente con el centro del alveolo (Fig. 4, izquierda), la generación 3 se caracteriza por una zona de recirculación que se desplaza hacia el lado proximal de laalvéolo con un patrón de línea de corriente más abierta (Fig. 4, centro). Por último, las líneas de corriente radiales con ninguna zona de recirculación se observan en la generación dispositivo 5 (Fig. 4, derecha). Para el mejor conocimiento de los autores, esta es la primera vez que la existencia de una amplia gama de patrones de flujo alveolares es capturado experimentalmente.
El éxito del método presentado depende de algunos pasos críticos en el protocolo de microfabricación. En primer lugar, para evitar que las paredes delgadas de PDMS se rompa después de la liberación de la oblea maestro del dibujo grabado en la superficie de la oblea debe tener paredes rectas y no debe adherirse a los PDMS curados. Se aconseja encarecidamente para producir las obleas utilizando DRIE de una oblea SOI como se describe en Fishler et al. (2013). Tal oblea maestro es duradero y se puede recubrir fácilmente con una capa anti-adherencia por cualquiera silanizar la superficie como se describe en Fishler et al. (2013) o asegurando tsombrero el último paso en el proceso DRIE es el de pasivación con CF 4. Otro paso importante es la presentación (paso 2.5) y la incrustación (paso 2.6) del cuerpo de la jeringa para crear la cámara superior. Las burbujas de aire atrapado entre la base de la jeringa y la primera capa de PDMS puede reducir en gran medida la integridad y durabilidad del dispositivo fabricado. Para evitar la formación de burbujas, es crítico que la base del cilindro de jeringa es plana y uniformemente presentada.
Si bien el diseño actual permite la fabricación de una de dos capas del dispositivo utilizando sólo una oblea de maestro, un método modificado puede incluir la creación de una capa de PDMS adicional que contiene una indentación circular para formar la cámara superior. Para esta segunda capa de PDMS una oblea maestro adicional con una cresta circular se puede fabricar utilizando el estándar SU-8 fotolitografía. Una modificación adicional del protocolo puede incluir un método diferente para PDMS unión que no requiere un tratador de corona. Para adherirse al molde de PDMS en el cristaldiapositiva, primera capa de la lámina de vidrio tal como se describe en el paso 2.10 del Protocolo pero el uso de un 5: 1 en lugar de una mezcla 10: 1 de PDMS: relación en peso de agente de curado. Hornear el vidrio revestido durante 15 min a 65 ° C en un horno de convección natural, pulse el molde de PDMS para las PDMS vidrio revestido, y hornear durante una noche a 65 ° C en un horno de convección natural.
Con motivo de líquido que sale de la superficie de unión entre el molde de PDMS y el vidrio se pueden tomar las siguientes medidas: (1) asegurarse de que el tratador corona está produciendo chispas eléctricas durante el tratamiento, si es así, ajuste la tensión de salida, (2) prolonga el tiempo de tratamiento con tratador corona y (3) el uso del método alternativo para unir el molde de PDMS en el cristal (véase el párrafo anterior). A menudo, el agua puede filtrarse a través de la conexión del tubo de Teflon fina sobre la entrada de la cámara. Para eludir tales fugas, asegúrese de que calibre 19 roma punta de la jeringa se utiliza para conectar el tubo de teflón a la entrada. Si hay una fuga de agua entre el molde y TH PDMScima de la cámara e (los 2 ml tubo de la jeringa) asegúrese de que la base del cilindro de la jeringa se presentó correctamente (véase el paso 2.5 en el Protocolo), y que la segunda capa de PDMS se vertió suficientemente alta (~ 5 mm por encima de la primera capa de PDMS ).
Tenga en cuenta que el grado de deformación de la pared depende de las propiedades mecánicas de PDMS altamente. Pequeños cambios en el procedimiento de preparación de los dispositivos pueden resultar en una considerable variabilidad de las velocidades medidas entre diferentes dispositivos. Para asegurar el uso repetibilidad máximas condiciones constantes de preparación (humedad, tiempos de cocción, etc.). Además, el ajuste fino del cambio de volumen durante el accionamiento del dispositivo se puede lograr mediante la visualización de la superficie superior de los canales mediante microscopía de contraste de fase y el ajuste de las rampas de velocidad de la bomba de jeringa de manera que la superficie superior del canal es desviado a la distancia deseada tal como se mide por la z de movimiento de la platina del microscopio.
Un importante LIMITAción de la técnica actual es que las características morfológicas exactas (por ejemplo, la anatomía, la morfometría) de los pulmones no pueden ser reproducidas con exactitud. De hecho, el diseño planar del modelo acinar no captura, por ejemplo, fuera del plano bifurcaciones acinares y la relación de volumen alveolar a ductal es mucho menor que mide in vivo valores 37. Además, la geometría de microfluidos simplificado sólo captura una pequeña porción de un acino completo. A pesar de estas limitaciones, el presente modelo es capaz de reproducir los patrones de flujo esperadas y velocidades directamente en los verdaderos escalas de longitud anatómicas, y por lo tanto representa una plataforma de pruebas valioso para los fenómenos de transporte acinar.
Para concluir, los modelos de microfluidos destacados de los acinos pulmonares muestran una gran promesa como una herramienta in vitro para el estudio cuantitativo de los flujos acinar respiratoria que imitan los patrones de respiración. En este caso, el modelo acinar simple consiste de cinco generations de expansión y contracción de los conductos alveolada, por tanto, la reproducción de algunas de las importantes propiedades de flujo subyacentes previstos para existir dentro de la región acinares de los pulmones. El flujo de visualización, utilizando micro-PIV, dentro de las cavidades alveolares proporciona por primera vez evidencia experimental de la gama de recirculación complejo y flujos alveolares radiales a lo largo del árbol acinar. Este enfoque de microfluidos permite la fabricación de estructuras acinares complejas con paredes móviles después de un procedimiento relativamente simple y ofrece una alternativa atractiva a los modelos acinares ampliados. En particular, con la principal ventaja de la entrega de un modelo en una escala de uno a uno, dinámica de partículas acinar inhalado verdaderas pueden ser investigados sin más necesidad de coincidencia de similitud dinámica.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported in part by the European Commission (FP7 Program) through a Career Integration Grant (PCIG09-GA-2011-293604), the Israel Science Foundation (Grant nr. 990/12) and the Technion Center of Excellence in Environmental Health and Exposure Science (TCEEH). Microfabrication of microfluidic chips was conducted at the Micro-Nano Fabrication Unit (MNFU) of the Technion and supported by a seed grant from the Russel Berrie Institute of Nanotechnology (RBNI) at Technion. The authors thank Avshalom Shai for assistance during deep reactive ion etching (DRIE) and Molly Mulligan and Philipp Hofemeier for helpful discussions.
Materiales
| Name | Company | Catalog Number | Comments |
| Polydimethylsiloxane (PDMS) and curing agent | Dow Corning | (240)4019862 | Sylgard® 184 Silicone Elastomer Kit |
| Plastipak 2 ml syringe | BD | 300185 | |
| Norm-Ject Luer slip 1 ml syringe | Henke Sass Wolf | 4010-200V0 | |
| 1 mm Biopsy punch | Kai Medical | BP-10F | |
| Laboratory Corona Treater | Electro-Technic Products | BD-20AC | |
| PHD Ultra Syringe pump | Harvard apparatus | 703006 | |
| Dyed red rqueous fluorescent particles | Thermo-Scientific | Uncatalloged 0.86 µm beads were used | |
| Glycerin AR | Gadot | 830131320 | |
| FlowMaster MITAS micro-particle image velocimetry (µPIV) system | LaVision | 1108630 |
Referencias
- Kleinstreuer, C., Zhang, Z. Airflow and Particle Transport in the Human Respiratory System. Annu. Rev. Fluid Mech. 42 (1), 301-334 (2010).
- Sznitman, J. Respiratory microflows in the pulmonary acinus. J. Biomech. 46 (2), 284-298 (2013).
- Tsuda, A., Henry, F. S., Butler, J. P. Gas and aerosol mixing in the acinus. Respir. Physiol. Neurobiol. 163 (1-3), 139-149 (2008).
- Kleinstreuer, C., Zhang, Z., Donohue, J. F. Targeted Drug-Aerosol Delivery in the Human Respiratory System. Annu. Rev. Biomed. Eng. 10 (1), 195-220 (2008).
- Semmler-Behnke, M., Kreyling, W. G., Schulz, H., Takenaka, S., Butler, J. P., Henry, F. S., Tsuda, A. Nanoparticle delivery in infant lungs. Proc. Natl. Acad. Sci. 109 (13), 5092-5097 (2012).
- Sznitman, J., Heimsch, F., Heimsch, T., Rusch, D., Rosgen, T. Three-Dimensional Convective Alveolar Flow Induced by Rhythmic Breathing Motion of the Pulmonary Acinus. J. Biomech. Eng. 129 (5), 658-665 (2007).
- Tsuda, A., Henry, F. S., Butler, J. P. Chaotic mixing of alveolated duct flow in rhythmically expanding pulmonary acinus. J. Appl. Physiol. 79 (3), 1055-1063 (1995).
- Henry, F. S., Butler, J. P., Tsuda, A. Kinematically irreversible acinar flow: a departure from classical dispersive aerosol transport theories. J. Appl. Physiol. 92 (2), 835-845 (2002).
- Kumar, H., Tawhai, M. H., Hoffman, E. A., Lin, C. L. The effects of geometry on airflow in the acinar region of the human lung. J. Biomech. 42 (11), 1635-1642 (2009).
- Lee, D. Y., Lee, J. W. Characteristics of particle transport in an expanding or contracting alveolated tube. J. Aerosol Sci. 34 (9), 1193-1215 (2003).
- Tsuda, A., Butler, J. P., Fredberg, J. J. Effects of alveolated duct structure on aerosol kinetics. I. Diffusional deposition in the absence of gravity. J. Appl. Physiol. 76 (6), 2497-2509 (1994).
- Tsuda, A., Butler, J. P., Fredberg, J. J. Effects of alveolated duct structure on aerosol kinetics. II. Gravitational sedimentation and inertial impaction. J. Appl. Physiol. 76 (76), 2510-2516 (1994).
- Ma, B., Darquenne, C. Aerosol bolus dispersion in acinar airways—influence of gravity and airway asymmetry. J. Appl. Physiol. 113 (3), 442-450 (2012).
- Ma, B., Darquenne, C. Aerosol deposition characteristics in distal acinar airways under cyclic breathing conditions. J. Appl. Physiol. 110 (5), 1271-1282 (2011).
- Heimsch, J., Sznitman, T., Wildhaber, J. H., Tsuda, A., Rösgen, T. Respiratory Flow Phenomena and Gravitational Deposition in a Three-Dimensional Space-Filling Model of the Pulmonary Acinar Tree. J. Biomech. Eng. 131 (3), 031010(2009).
- Litzlbauer, H. D., Korbel, K., Kline, T. L., Jorgensen, S. M., Eaker, D. R., Bohle, R. M., Ritman, E. L., Langheinrich, A. C. Synchrotron-Based Micro-CT Imaging of the Human Lung Acinus. Anat. Rec. Adv. Integr. Anat. Evol. Biol. 293 (9), 1607-1614 (2010).
- Tsuda, A., Filipovic, N., Haberthür, D., Dickie, R., Matsui, Y., Stampanoni, M., Schittny, J. C. Finite element 3D reconstruction of the pulmonary acinus imaged by synchrotron X-ray tomography. J. Appl. Physiol. 105 (3), 964-976 (2008).
- Berg, E. J., Weisman, J. L., Oldham, M. J., Robinson, R. J. Flow field analysis in a compliant acinus replica model using particle image velocimetry (PIV). J. Biomech. 43 (6), 1039-1047 (2010).
- Sznitman, J., Sutter, R., Altorfer, D., Stampanoni, M., Rösgen, T., Schittny, J. C. Visualization of respiratory flows from 3D reconstructed alveolar airspaces using X-ray tomographic microscopy. J. Vis. 13 (4), 337-345 (2010).
- Henry, F. S., Haber, S., Haberthür, D., Filipovic, N., Milasinovic, D., Schittny, J. C., Tsuda, A. The Simultaneous Role of an Alveolus as Flow Mixer and Flow Feeder for the Deposition of Inhaled Submicron Particles. J. Biomech. Eng. 134 (12), 121001(2012).
- Chhabra, S., Prasad, A. K. Flow and Particle Dispersion in Lung Acini: Effect of Geometric and Dynamic Parameters During Synchronous Ventilation. J. Fluids Eng. 133 (7), 071001(2011).
- Cinkotai, F. F. Fluid flow in a model alveolar sac. J. Appl. Physiol. 37 (2), 249-251 (1974).
- Karl, A., Henry, F. S., Tsuda, A. Low reynolds number viscous flow in an alveolated duct. J. Biomech. Eng. 126 (4), 420-429 (2004).
- Tippe, A., Tsuda, A. recirculating flow in an expanding alveolar model: experimental evidence of flow-induced mixing of aerosols in the pulmonary acinus. J. Aerosol Sci. 31 (8), 979-986 (2000).
- Berg, E. J., Robinson, R. J. Stereoscopic particle image velocimetry analysis of healthy and emphysemic alveolar sac models. J. Biomech. Eng. 133 (6), 061004(2011).
- Ma, B., Ruwet, V., Corieri, P., Theunissen, R., Riethmuller, M., Darquenne, C. CFD simulation and experimental validation of fluid flow and particle transport in a model of alveolated airways. J. Aerosol Sci. 40 (5), 403-414 (2009).
- Kumar Mahto, S., Tenenbaum-Katan, J., Sznitman, J. Respiratory Physiology on a Chip. Scientifica. 2012, e364054(2012).
- Huh, D., Fujioka, H., Tung, Y. C., Futai, N., Paine, R., Grotberg, J. B., Takayama, S. Acoustically detectable cellular-level lung injury induced by fluid mechanical stresses in microfluidic airway systems. Proc. Natl. Acad. Sci. 104 (48), 18886-18891 (2007).
- Song, Y., Baudoin, M., Manneville, P., Baroud, C. N. The air–liquid flow in a microfluidic airway tree. Med. Eng. Phys. 33 (7), 849-856 (2011).
- Tavana, H., Huh, D., Grotberg, J. B., Takayama, S. Microfluidics, Lung Surfactant, and Respiratory Disorders. Lab Med. 40 (4), 203-209 (2009).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y., Ingber, D. E. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Pihl, J., Sinclair, J., Sahlin, E., Karlsson, M., Petterson, F., J, O. lofsson, Orwar, O. Microfluidic Gradient-Generating Device for Pharmacological Profiling. Anal. Chem. 77 (13), 3897-3903 (2005).
- Fishler, R., Mulligan, M. K., Sznitman, J. Acinus-on-a-chip: A microfluidic platform for pulmonary acinar flows. J. Biomech. 46 (16), 2817-2823 (2013).
- Lindken, R., Rossi, M., Grosse, S., Westerweel, J. Micro-Particle Image Velocimetry (microPIV): recent developments, applications, and guidelines. Lab. Chip. 9 (17), 2551-2567 (2009).
- Wereley, S. T., Meinhart, C. D. Recent Advances in Micro-Particle Image Velocimetry. Annu. Rev. Fluid Mech. 42 (1), 557-576 (2010).
- Bruus, H. Theoretical Microfluidics. Oxford Master Series in Condensed Matter Physics. , (2008).
- Haefeli-Bleuer, B., Weibel, E. R. Morphometry of the human pulmonary acinus. Anat. Rec. 220 (4), 401-414 (1988).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados