Method Article
Un protocolo para la inducción genética y visualización de tumores benignos y invasoras en cefálica Complejos de
En este artículo
Resumen
Cooperación entre un oncogén activado como RAS V12 y las mutaciones en los genes de polaridad celular como garabateado, resultar en el crecimiento tumoral en Drosophila donde las células tumorales también muestran comportamientos invasivos. Aquí se presenta un protocolo sencillo para la inducción y la observación de los tumores benignos y invasivos.
Resumen
Drosophila ha iluminado nuestra comprensión de las bases genéticas del desarrollo normal y la enfermedad de las últimas décadas y hoy en día sigue contribuyendo en gran medida a nuestra comprensión de las enfermedades complejas 1-7. La progresión de los tumores de comportamiento benigno a un estado metastásico es un evento complejo 8 y ha sido el modelo en Drosophila para ayudarnos a entender mejor la base genética de esta enfermedad 9. Aquí presento un protocolo sencillo para inducir genéticamente, observar y luego analizar la progresión de los tumores en las larvas de Drosophila. La técnica de inducción del tumor se basa en el sistema de MARCM 10 y explota la cooperación entre un oncogén activado, Ras V12 y la pérdida de genes de polaridad celular (íntima, discos grande y letal larvas gigante) para generar tumores invasivos 9. Demuestro cómo estos tumores pueden ser visualizados en las larvas intactas yentonces, ¿cómo estos pueden ser disecados para su posterior análisis. El protocolo simplificado presentado aquí debería hacer posible que esta técnica para ser utilizada por los investigadores interesados en la comprensión de la función de un gen en la invasión tumoral.
Introducción
La progresión de los tumores de un benigna a un estado metastásico es un proceso sabia paso que se caracteriza por la evasión de los mecanismos protectores presentes en el cuerpo 8. Por ejemplo células tumorales en el cuerpo ha de ser capaz de evadir la apoptosis y el sistema inmune, avance la matriz extracelular especializada (ECM) denominada membrana basal, y superar los controles sociales impuestas por las células circundantes 8. Es a través de un paso de progresión prudente que las células cancerosas adquieren la capacidad de migrar y colonizar sitios distantes en un proceso denominado metástasis. Nuestra comprensión de cómo la célula tumoral supera las barreras impuestas por el cuerpo está todavía en su infancia, sin embargo, el cuadro que surge de las investigaciones realizadas hasta el momento los puntos a un uso repetido de los procesos normales de desarrollo y vías de señalización de las células de cáncer de 11 a 13.
La mosca de la fruta Drosophila melanogaster, ha contribuido enormemente a nuestro understanding del desarrollo normal y la enfermedad a través del uso de técnicas genéticas sofisticadas desarrolladas a lo largo de las últimas décadas 14-17. El uso de mutagénesis y herramientas sobreexpresión hemos llegado a una mejor comprensión de diversos oncogenes y genes supresores de tumores 18-22. Sin embargo, la metástasis tumoral es el resultado de la cooperación entre varias lesiones genéticas que se ha estudiado principalmente en modelos de cultivo de células 23,24, así como diversos modelos de xenoinjerto 25-27. Estos modelos aunque poderosa tienen sus limitaciones, ya que no reproducir todas las condiciones que se encuentran en un organismo vivo. Además, los modelos transgénicos disponibles en ratones son engorrosos y no es propicio para el análisis genético de la conducta invasiva 28,29. Varios estudios han intentado entender invasión de células tumorales en Drosophila 30,31. Estas técnicas utilizan principalmente el trasplante de tumores primarios a anfitriones y luego se basan en el seguimiento de la transplanted tumores para la invasión de los tejidos vecinos 32,33. Una poderosa técnica llamada MARCM 10 fue adaptada por Pagliarini y Xu para modelar la invasión tumoral en Drosophila 9. Esta elegante modelado genética de la invasión tumoral explotado la cooperación entre un oncogén activado y la pérdida de la polaridad celular. El poder de este modelado se encuentra en el hecho de que los tumores invasivos se crean en un organismo intacto eludiendo así la necesidad de trasplante de tejidos. Para llevar a cabo la cooperación oncogénica, un oncogén activado como Ras V12 se expresa en los clones de células en el disco de ojos antenal de larvas. Como resultado de la técnica de MARCM estos clones también están marcadas con proteína fluorescente verde (GFP) para la visualización fácil y se hacen homocigotos para los mutantes de la polaridad celular como larvas letal gigante, íntima, y discos grandes. El resultado es GFP etiquetada tumores invasivos en el complejo cefálica. En este informe,demostrar cómo inducir, y visualizar estos tumores invasivos tanto en el contexto de una larvas intacto y en diseccionados complejo cefálica. La inducción de tumores que aquí se presenta utiliza reactivos en el segundo cromosoma de Drosophila. En la Tabla 2, proporciono una lista de acciones en X y 3 ª cromosomas que pueden ser utilizados para el mismo fin. Creo que este protocolo simplificado hará que esta técnica de fácil acceso para los investigadores interesados en la comprensión de la base molecular de la progresión del tumor.
Protocolo
1. La inducción de tumores no invasivos benignos
- Utilice las poblaciones enumeradas en la tabla 2 para la inducción de tumores benignos.
- Preparar un cultivo iniciador para el "tester" balance de la siguiente genotipo: y, w, ey-FLP1; Tub-GAL80, FRT40A; Act5C> y +> Gal4, UAS-GFP
- Preparar un cultivo iniciador para la población "prueba" del siguiente genotipo: w; FRT40A, UAS-Ras V12 / CyO
- Recoge diez vírgenes femeninas de la acción "tester" y diez machos de la población "probado".
- Cruce los hombres y mujeres de la "tester" y la acción "probado" colocando a ambos en un vial con comida mosca.
- Coloque la cruz en una incubadora a 25 ° C y deje que los machos y las hembras para aparearse y poner huevos durante 24-48 horas.
- Compruebe los viales para la deposición de huevos y suficiente para la presencia de larvas de primer instar de asegurarse de que la cultura no se está secando.
- Añadir unas gotas de autoclavede agua destilada a la cultura para mantenerlo húmedo (si la cultura se está secando).
- Seguir controlando la cultura y repita el paso 1.7.1, según sea necesario.
- Observe deambular larvas de tercer estadio bajo un microscopio estereoscópico de fluorescencia como se describe en la sección 3.
2. La inducción de tumores invasivos
- Utilice las poblaciones enumeradas en la tabla 2 para la inducción de tumores invasivos.
- Utilice el cultivo iniciador desde el paso 1.2 anterior de la siguiente genotipo: y, w, ey-FLP1; Tub-GAL80, FRT40A; Act5C> y +> Gal4, UAS-GFP
- Preparar un cultivo iniciador para la población "prueba" del siguiente genotipo: w; LGL 4, FRT40A, UAS-Ras V12 / CyO
- Recoge diez vírgenes femeninas de la acción "tester" y diez machos de la población "probado".
- Cruce los hombres y mujeres de la "tester" y la acción "probado" colocando a ambos en un vial con mosca fud.
- Coloque la cruz en una incubadora a 25 ° C y deje que los machos y las hembras para aparearse y poner huevos durante 24-48 horas.
- Compruebe los viales para la deposición de huevos y suficiente para la presencia de larvas de primer instar de asegurarse de que la cultura no se está secando.
- Añadir unas gotas de agua destilada en autoclave a la cultura para mantenerlo húmedo (si la cultura se está secando).
- Seguir controlando la cultura para la sequedad y repita el paso 2.7.1, según sea necesario.
- Observar las larvas de tercer estadio bajo un microscopio estereoscópico de fluorescencia como se describe en la sección 3.
3. La observación de los tumores benignos y invasoras
- Utilice larvas de tercer estadio para el aislamiento tumor benigno y visualización.
- Moje un cepillo de pintura en agua destilada, y utilizar este pincel raspar unas pocas larvas de tercer estadio de la pared del vial de cultivo.
- Coloque las larvas en una diapositiva de la depresión con 1X PBS y luego con un cepillo de pintura húmeda chatarrae de descuento en cualquier producto alimenticio de la epidermis de las larvas.
- Coloque las larvas en una placa de Petri y dejar a -20 ° C congelador durante 30 min para inmovilizar la larva.
- Método alternativo para inmovilizar larvas utilizando FLYNAP.
- Coloque una varita FLYNAP sumergido en FLYNAP al vial de 3.1.3.2 y después de enchufar el let vial vial tapado con larvas reposar durante 30 a 40 min.
- Coloque la larva inmovilizada sobre un portaobjetos de vidrio, agregar una gota de aceite de halocarbonos luz, cubrir con una cubierta de vidrio y observar bajo un microscopio estereoscópico de fluorescencia con la capacidad de visualizar la proteína verde fluorescente (GFP).
- Las larvas que tiene un tumor benigno será fluorescente verde en la región anterior donde el complejo cefálica está presente.
- Seleccione el día 10 larvas (después de la inducción) de la cultura definida en el paso 2 anterior para la observación de los tumores invasivos. Día 10 larvas son seleccionadas porque las larvas portador de un tumor invasivo tiene un l extendidaetapa arval y generalmente no logran pupariate.
- Siga los pasos 3.1.1 al 3.1.4 excepto que en lugar de tercero día de uso en estadio las larvas 10 larvas.
- Las larvas día 10 portador de un tumor invasivo será fluorescente verde en la región anterior donde el complejo cefálica está presente.
- Si el microscopio de fluorescencia está equipado con una cámara digital y luego tomar imágenes de las larvas que tiene un tumor benigno e invasiva fluorescente.
4. La disección de la Observación Complex y más cefálica de tumores benignos y invasoras
La epidermis translúcidas de la larva hace que sea difícil de observar el grado de invasión de los tumores. Así, la extensión de la invasión es mejor visualizado mediante la disección del complejo cefálica de la larva. Los siguientes pasos se deben utilizar para diseccionar el complejo cefálica.
- Usando un pincel mojado seleccionar larvas de tercer estadio (para los tumores benignos) y el día 10 larvas (para los tumores invasivos) fesde los viales de cultivo respectivos.
- Coloque las larvas en un pocillo de una placa que contiene la disección en frío PBS 1X. Utilice el pincel para raspar las partículas de comida de la epidermis de las larvas.
- Traslado larvas limpia para un pozo fresco del plato que contiene la disección en frío PBS 1X.
- Comprobación de la existencia de la fluorescencia de GFP usando un microscopio estereoscópico capaz de detectar la fluorescencia. Deseche las larvas que no devenga GFP.
- Añadir 1,0 ml de 1X PBS frío a un pozo fresco en el plato de disección y el uso de un par de fórceps transferir una larva de cojinete o bien los tumores benignos o invasivos (el protocolo de disección sigue siendo el mismo para estos dos tipos de tumores).
- Sostenga la larva hacia abajo con un par de pinzas alrededor de 2/3rds desde el extremo anterior.
- Utilice el otro par de pinzas y elegantemente separar el 1/3o posterior de la larva y deséchelo.
- Suelte el anterior 2/3rds de la larva. A medida que se libera la presión en el interior de la larva el contenido dellarva rezumar de la cavidad del cuerpo.
- Use un par de pinzas para eliminar el intestino, grasa corporal y otros contenidos interiores de la larva que salir al exterior de la cavidad del cuerpo.
- Use un par de pinzas para sujetar el gancho de la boca de la larva y empujarla hacia la epidermis de larva y usando el otro par de pinzas invertir la larva completamente.
- Utilice las pinzas para quitar suavemente y con cuidado la grasa corporal, las glándulas salivares, el intestino, el complejo ala disco y cualquier tubo traqueal. El complejo cefálico debe ser visible en el gancho de la boca de la larva invertida. Los hemisferios cerebrales y el cordón nervioso ventral (VNC) todavía estaría conectado a la epidermis de larvas a través de los nervios que emanan de la VNC.
- Use un par de pinzas para romper suavemente las conexiones entre los nervios cefálicas y la epidermis de larvas.
- A medida que las conexiones nerviosas entre el VNC y la epidermis de larvas se rompen y el exceso de grasa corporal y otros tejidos removidos, el co cefálicamplex se convertiría claramente visible y se adjunta a la epidermis de larvas sólo en los ganchos de la boca.
- El complejo cefálica puede ser dejada en la epidermis de las larvas si el complejo tiene que ser fijo para aplicaciones posteriores, como la tinción de anticuerpos o para la visualización posterior.
- Si no hay más aplicaciones posteriores se realizaron a continuación, el complejo cefálica se puede extraer de la epidermis de las larvas y se coloca en una gota de un glicerol medios de montaje basado en observación y análisis. Utilice VECTASHIELD como los medios de montaje.
Resultados
Como resultado del protocolo presentado aquí el usuario será capaz de inducir tumores benignos mediante la sobreexpresión de un oncogén activado en el ojo antenal disco imaginal de larvas. El usuario también será capaz de inducir tumores invasivos en el disco antenal ojo mediante la sobreexpresión de un oncogén activado en clones de células también de mutantes en un gen de polaridad de la célula. Los tumores pueden ser fácilmente visualizados con la ayuda de un estereomicroscopio fluorescente como tejido "verde fluorescente" en todo el larvas o en complejos cefálicos que han sido disecados fuera de la cavidad del cuerpo de las larvas (Figura 1). Los tumores benignos se pueden localizar en el ojo complejo disco antenal como clones de células GFP positivos, mientras que los tumores invasivos se traducirá en el crecimiento excesivo masivo de los tumores y la posterior migración de los tumores invasivos GFP positivos para el VNC y otros órganos contiguos. En> 10 días de edad larvas (derivado del genotipo del tumor invasivo) tumores secundarios positivos y las buenas prácticas agrarias independientes floaTing en la cavidad del cuerpo de las larvas también se puede observar. Por otra parte, mientras que las larvas teniendo los tumores benignos pupariate a tiempo, los que llevan los tumores invasivos tienen un período larval prolongado y no logran pupariate. Estas larvas portador de un tumor invasivo se puede observar fácilmente como "larvas gigante" con un fluido llena la cavidad del cuerpo.
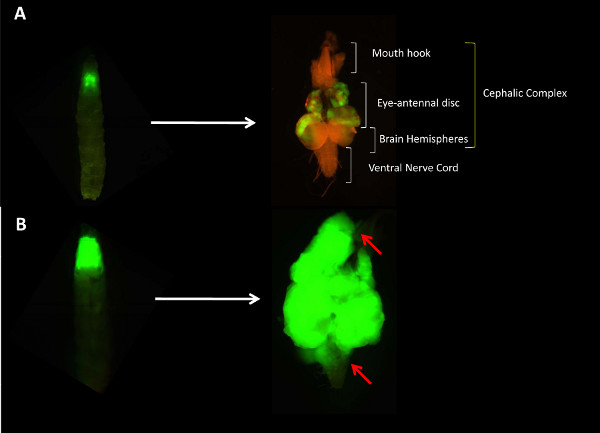
Figura 1. . Los tumores benignos y invasoras en Drosophila AB dejó el panel: Larva verde fluorescente con tumores benignos e invasoras, respectivamente panel derecho AB:. Complejos cefálicas disecados de larvas teniendo bien tumores benignos o invasivos respectivamente A) Los tumores benignos están localizados en el ojo-antenal. disco en el que se inducen. Observe que el tejido de la etiqueta GFP no ha migrado a órganos contiguos comoel cordón nervioso ventral (VNC). Compare esto con B. B) tumores invasivos de rodamientos complejos encefálicos de una larva día 10. Observe el crecimiento excesivo de tejido tumoral (verde) y también la invasión de órganos contiguos como el VNC y ganchos de la boca por el tejido del tumor (indicado por una flecha roja). La invasión de los órganos adyacentes por el tejido del tumor invasivo está indicado con una flecha. Haga clic aquí para ver más grande la figura .
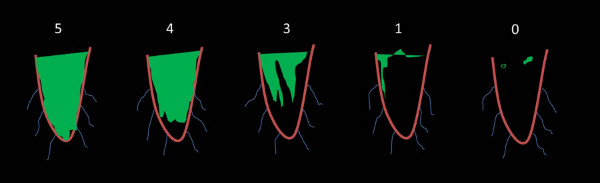
Figura 2. Un esquema de clasificación para los tumores invasivos basados en la medida de la migración sobre el VNC. El esquema de la VNC se muestra con el grado de migración del tumor representado con color de relleno verde. El número asociado con lala gravedad de la migración se da por encima de cada esquema.
| Cromosoma # | Genotipo cepa Tester | Genotipo cepa Probado | Referencia | |
| Los tumores benignos | Los tumores invasivos | |||
| 1 | w, Tub-GAL80, FRT19A; ey-FLP5, Act5C> y +> Gal4, UAS-GFP | w, FRT19A; UAS-Ras V12 | m52 dlg, FRT19A/FM7C; UAS-Ras V12 | Pagliarini y Xu, 2003 |
| 2 | y, w, ey-FLP1; Tub-GAL80, FRT40A; Act5C> y +> Gal4, UAS-GFP | w; FRT40A, UAS-Ras V12 / CyO | w; LGL 4, FRT40A, UAS-Ras V12 / CyO | Pagliarini y Xu, 2003 |
| 3 | y, w, ey-FLP1; Act5C> y +> Gal4, UAS-GFP;FRT82B, Tub-GAL80 | w; UAS-Ras V12; FRT82B | w; UAS-Ras V12; FRT82B, scrib 1 / TM6Tb | Pagliarini y Xu, 2003 |
Tabla 2. El genotipo de las existencias necesarias para inducir los tumores benignos y invasivos. Todos los stocks se han descrito en la referencia indicada. Las acciones deben ser solicitados al laboratorio de Tian Xu.
Discusión
El cáncer es una enfermedad compleja con una comprensión mucho mejor hoy que en el pasado. Sin embargo, todavía queda mucho por aprender y explicado antes de que tengamos una imagen completa de los mecanismos subyacentes. El protocolo simple que aquí se presenta permite inducir genéticamente tumores benignos y invasivos en un organismo completo y, a continuación estudiar la biología asociada con la progresión de los tumores en este modelo. La mayoría de las técnicas existentes en Drosophila y otros organismos o bien utilizan un sistema de cultivo basado en células para entender la tumorigénesis y metástasis o un sistema que emplea el trasplante de tejidos tumorales primarias en huéspedes adultos 23-27. Tanto la célula basada y técnicas de trasplante tiene sus limitaciones. Por ejemplo, la técnica de trasplante es engorroso y consume mucho tiempo y puede resultar en el trasplante de tejidos no tumorales en el huésped. Esto podría resultar en la producción de artefactos experimentales. Además, culto celularsistemas basados ure son sólo aproximaciones del entorno real que existe en un organismo completo. Esta limitación hace que sea difícil de imitar el tumor muy importante y la interacción de micro-entorno que desempeña un papel crítico en la progresión tumoral y la metástasis 34. La técnica que aquí se presenta ha sido empleado con éxito por varios grupos de investigación para investigar las bases genéticas y moleculares de la progresión tumoral en Drosophila. Por ejemplo, la utilización de esta técnica se ha demostrado que la vía de JNK es tanto upregulated en tumores invasivos y también es necesario para la progresión de los tumores 35,36. En otro estudio el papel de la metaloproteasa de matriz en la progresión del tumor se demostró en este modelo 12,37 genética.
Los pasos críticos asociados con el protocolo presentado aquí comienzan con el genotipo correcto de las existencias utilizadas para la inducción de tumores benignos y invasivos. Se debe tener cuidado para asegurarse de que éstospoblaciones no están "desmoronando". Las acciones pueden ser revisados periódicamente para detectar la presencia de color amarillo (y -) vuela lo cual sería indicativo de una crisis de valores. Esto indicaría que el casete FLP-Out en el probador de stock MARCM se ha invertido de forma espontánea y que por lo tanto se expresan Gal4 constitutivamente. Esto se puede evitar mediante el mantenimiento de existencias duplicados en viales y a 18 ° C. También, como los tumores son inducidos, el día en el que las larvas se debe comprobar para tumores benignos y invasivas es también crítico. Aunque las larvas de portador de un tumor benigno seguir una línea de tiempo de desarrollo que es muy similar a su forma natural de larvas, la historia con tumores invasivos de rodamientos larvas es diferente. La pantalla larvas portador de un tumor invasivo extendió etapa larval y algunos no logran pupariate. De hecho esta característica de pupariation frente pupariation no ha sido utilizada como una medida de la supresión del tumor invasivo por Menut et al. 38 Debido a la larvas extendidaetapa de larvas portador de un tumor invasivo es fundamental para observar los tumores invasivos alrededor 8-10 días después de la inducción para obtener mejores resultados. Al día 8-10 migración tumoral suficiente ha sucedido en el VNC para que sea fácilmente observable al microscopio estéreo. Más allá de los 10 días, mientras se observa el tumor, se empieza a hundir por completo el VNC lo que hace difícil orientar el complejo cefálica en especímenes disecados. Otro paso crítico asociado con la visualización de tumores en larvas conjunto es la capacidad de inmovilizar las larvas. Tanto FlyNap y temperaturas reducidas se pueden utilizar para inmovilizar las larvas como se indica en el protocolo detallado. Por último, si los complejos cefálicos disecados necesitan ser teñidas con un anticuerpo continuación, las disecciones deben llevarse a cabo en hielo y complejos deben ser fijados dentro de los treinta minutos.
La técnica presentada aquí puede ser utilizado por investigadores para comprender la contribución de los genes sospechosos de jugar un papel en la progresión tumoral.El uso de este modelo genético regulación hasta de un gen puede ser estudiada in situ por las técnicas de tinción de anticuerpos o mediante el uso de RT-PCR. También se puede tratar de comprender si un gen es necesario para la progresión tumoral mediante la utilización de este modelo en combinación con los mutantes para el gen en cuestión o reactivos de RNAi. Por ejemplo, un reactivo de RNAi para un gen a ser probado para la supresión de tumores podría estar presente en el cromosoma 3 ª. En este caso, el probador y la combinación de la acción Probado para el cromosoma 2 podría ser utilizado (Tabla 2), sólo después de que el RNAi teniendo 3 rd el cromosoma se ha cruzado en la culata probado. Una vez que esto se ha logrado a continuación, el probador y la acción Probado para el cromosoma 2 se pueden cruzar y la supresión de tumores invasivos ensayadas. Una supresión del fenotipo invasivo del tumor sugiere la implicación de un gen en el proceso invasivo. Sin embargo, la supresión del fenotipo invasivo no puede ser completamente penetrante y es por esta razón por la quepresentar un esquema de clasificación para los tumores invasivos basados en la medida de la migración de los tumores sobre el VNC (Figura 2). La utilización de este sistema de clasificación se puede comparar fácilmente los tumores invasivos a los tumores invasivos en un gen sospechoso de estar involucrado en la invasión ha sido derribado. El análisis de varios complejos cefálicas puede dar una mejor idea de la magnitud de la supresión invasivo comportamiento.
Mientras que el protocolo presentado aquí se puede utilizar en combinación con caída de uno o dos genes para estudiar el efecto de los genes en la progresión del tumor, caídas simultánea de más de dos genes serían técnicamente difícil de lograr. Finalmente, una modificación de esta técnica fue utilizada por Wu et al. 39 para entender los efectos de la yuxtaposición de oncogén activado células que expresan contra las células que eran mutantes para genes de polaridad celular. La técnica por Wu et al. Fue una modificación en el nivel de reactivos genéticos hin embargo el experimento utilizado disección de complejos cefálicos para la visualización de tumores. Así, el método para diseccionar complejos cefálicos presentados aquí podría ser útil para los científicos que tratan de utilizar la técnica modificada presentado por Wu y col. También.
Divulgaciones
No tengo nada que revelar.
Agradecimientos
La investigación en mi laboratorio es apoyado por el Departamento de los fondos de inicio Biología WKU, WKU Investigación Fundación RCCA-Concedo # 11-8032 y con una donación KBRIN-AREA financiado mediante una donación de padres, del Instituto Nacional de Ciencias Médicas Generales de los Institutos Nacionales de Salud con el número premio 5P20GM103436-13. También me gustaría agradecer al Dr. Tian Xu, en cuyo laboratorio se me presentaron a esta técnica y el Dr. Raymond Pagliarini que estableció por primera vez esta técnica en el laboratorio de Xu.
Materiales
| Name | Company | Catalog Number | Comments |
| 10X PBS (phosphate buffered saline) pH 7.2 stock solution | Invitrogen, Sigma Aldrich | ||
| Chilled 1X PBS pH7.2 working solution | Invitrogen, Sigma Aldrich | Make fresh and refrigerate, can be used up to a week | |
| Flynap | Carolina Biologicals | Fly anesthesia needed to anesthetize larvae | |
| Fixative | 0.1M PIPES, pH 7.2, 4% Paraformaldehyde | Needed to fix the dissected cephalic complex | |
| Ice Bucket | Several | Maintain solutions on ice. Also, dissect cephalic complex in chilled 1X PBS and then place on ice in an Eppendorf tube | |
| 1.7ml Eppendorf tube | Various | ||
| Glass slides, cover glass | Fisher Scientific | ||
| Vectashield Mounting Media or any other mounting media | Vector Laboratories | ||
| Halocarbon 200 or 700 Oil | Polysciences Inc. or Halocarbon.com | Halocarbon 200 is used to mount the larvae for visualization on a fluorescence stereoscope | |
| Sally Hansen "Hard as Nails" nail polish | Can be found at any general merchandise store | Needed to seal the edges of Coverslip | |
| A Leica MZ16.5 fluorescence stereomicroscope or any other fluorescence stereomicroscope | Leica and others | Needed to observe the GFP fluorescence in larvae | |
| Dumont #5 forceps | Fine Science Tools | ||
| Pyrex 9 well spot plate or any other dissection dish | Sigma Aldrich | ||
| Paint Brush | Can be found at any general merchandise store | ||
| Table 1. Materials needed to perform the experimental protocol presented in this article. | |||
Referencias
- Bale, A. E. Hedgehog signaling and human disease. Annu Rev Genomics Hum Genet. 3, 47-65 (2002).
- Bier, E., Bodmer, R. Drosophila, an emerging model for cardiac disease. Gene. 342, 1-11 (2004).
- Coombs, G. S., Covey, T. M., Virshup, D. M. Wnt signaling in development, disease and translational medicine. Curr Drug Targets. 9, 513-531 (2008).
- Gistelinck, M., Lambert, J. C., Callaerts, P., Dermaut, B., Dourlen, P. Drosophila models of tauopathies: what have we learned. Int J Alzheimers Dis. 2012, 970980(2012).
- Marsh, J. L., Thompson, L. M. Drosophila in the study of neurodegenerative disease. Neuron. 52, 169-178 (2006).
- Reiter, L. T., Bier, E. Using Drosophila melanogaster to uncover human disease gene function and potential drug target proteins. Expert Opin Ther Targets. 6, 387-399 (2002).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Pagliarini, R. A., Xu, T. A genetic screen in Drosophila for metastatic behavior. Science. 302, 1227-1231 (2003).
- Wu, J. S., Luo, L. A protocol for mosaic analysis with a repressible cell marker (MARCM) in Drosophila. Nat Protoc. 1, 2583-2589 (2006).
- Boccaccio, C., Comoglio, P. M. Invasive growth: a MET-driven genetic programme for cancer and stem cells. Nat Rev Cancer. 6, 637-645 (2006).
- Srivastava, A., Pastor-Pareja, J. C., Igaki, T., Pagliarini, R., Xu, T. Basement membrane remodeling is essential for Drosophila disc eversion and tumor invasion. Proc Natl Acad Sci U S A. 104, 2721-2726 (2007).
- Wang, W., Eddy, R., Condeelis, J. The cofilin pathway in breast cancer invasion and metastasis. Nat Rev Cancer. 7, 429-440 (2007).
- Brand, A. GFP as a cell and developmental marker in the Drosophila nervous system. Methods Cell Biol. 58, 165-181 (1999).
- Brand, A. H., Dormand, E. L. The GAL4 system as a tool for unravelling the mysteries of the Drosophila nervous system. Curr Opin Neurobiol. 5, 572-578 (1995).
- Vidal, M., Cagan, R. L. Drosophila models for cancer research. Curr Opin Genet Dev. 16, 10-16 (2006).
- Parks, A. L., et al. Systematic generation of high-resolution deletion coverage of the Drosophila melanogaster genome. Nat Genet. 36, 288-292 (2004).
- Blair, S. S. Genetic mosaic techniques for studying Drosophila development. Development. 130, 5065-5072 (2003).
- Xu, T., Rubin, G. M. Analysis of genetic mosaics in developing and adult Drosophila tissues. Development. 117, 1223-1237 (1993).
- Xu, T., Wang, W., Zhang, S., Stewart, R. A., Yu, W. Identifying tumor suppressors in genetic mosaics: the Drosophila lats gene encodes a putative protein kinase. Development. 121, 1053-1063 (1995).
- Rebay, I., et al. A genetic screen for novel components of the Ras/Mitogen-activated protein kinase signaling pathway that interact with the yan gene of Drosophila identifies split ends, a new RNA recognition motif-containing protein. Genetics. 154, 695-712 (2000).
- Therrien, M., Morrison, D. K., Wong, A. M., Rubin, G. M. A genetic screen for modifiers of a kinase suppressor of Ras-dependent rough eye phenotype in Drosophila. Genetics. 156, 1231-1242 (2000).
- Albini, A., et al. A rapid in vitro assay for quantitating the invasive potential of tumor cells. Cancer Res. 47, 3239-3245 (1987).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. J Cell Sci. 99 (Pt 4), 769-775 (1991).
- Fidler, I. J. New developments in in vivo models of neoplasia. Cancer Metastasis Rev. 10, 191-192 (1991).
- Mueller, B. M., Romerdahl, C. A., Trent, J. M., Reisfeld, R. A. Suppression of spontaneous melanoma metastasis in scid mice with an antibody to the epidermal growth factor receptor. Cancer Res. 51, 2193-2198 (1991).
- Konantz, M., et al. Zebrafish xenografts as a tool for in vivo studies on human cancer. Ann N Y Acad Sci. 1266, 124-137 (2012).
- McIntyre, R. E., vander Weyden, L., Adams, D. J. Cancer gene discovery in the mouse. Curr Opin Genet Dev. 22, 14-20 (2012).
- Mattison, J., vander Weyden, L., Hubbard, T., Adams, D. J. Cancer gene discovery in mouse and man. Biochim Biophys Acta. 1796, 140-161 (2009).
- Miles, W. O., Dyson, N. J., Walker, J. A. Modeling tumor invasion and metastasis in Drosophila. Dis Model Mech. 4, 753-761 (2011).
- Stefanatos, R. K., Vidal, M. Tumor invasion and metastasis in Drosophila: a bold past, a bright future. J Genet Genomics. 38, 431-438 (2011).
- Beaucher, M., et al. Drosophila brain tumor metastases express both neuronal and glial cell type markers. Dev Biol. 301, 287-297 (2007).
- Beaucher, M., Hersperger, E., Page-McCaw, A., Shearn, A. Metastatic ability of Drosophila tumors depends on MMP activity. Dev Biol. 303, 625-634 (2007).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat Rev Cancer. 9, 239-252 (2009).
- Igaki, T., Pagliarini, R. A., Xu, T. Loss of cell polarity drives tumor growth and invasion through JNK activation in Drosophila. Curr Biol. 16, 1139-1146 (2006).
- Uhlirova, M., Jasper, H., Bohmann, D. Non-cell-autonomous induction of tissue overgrowth by JNK/Ras cooperation in a Drosophila tumor model. Proc Natl Acad Sci U S A. 102, 13123-13128 (2005).
- Uhlirova, M., Bohmann, D. JNK- and Fos-regulated Mmp1 expression cooperates with Ras to induce invasive tumors in Drosophila. EMBO J. 25, 5294-5304 (2006).
- Menut, L., et al. A mosaic genetic screen for Drosophila neoplastic tumor suppressor genes based on defective pupation. Genetics. 177, 1667-1677 (2007).
- Wu, M., Pastor-Pareja, J. C., Xu, T. Interaction between Ras(V12) and scribbled clones induces tumour growth and invasion. Nature. 463, 545-548 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados