Method Article
La separación de Ratón Facial ectodermo embrionario y mesénquima
En este artículo
Resumen
Un protocolo para la separación de ectodermo y el mesénquima facial embrión se describe. Utilizamos Dispasa II para el tratamiento de embriones enteros en primer lugar, analizar las prominencias faciales completas, y luego separar el ectodermo facial y mesénquima.
Resumen
Hendiduras orofaciales son los defectos craneofaciales más frecuentes, que afectan a 1,5 de cada 1.000 recién nacidos en todo el mundo 1,2. Hendidura orofacial es causada por el desarrollo facial anormal 3. En, humanos y de ratón de crecimiento inicial y el patrón de la cara se basa en varios brotes pequeños de tejido, las prominencias 4,5 faciales. La cara se deriva de seis pares de prominencias frontales principales: procesos nasales (FNP), prominencias maxilares (MXP) y prominencias mandibulares (MdP). Estas protuberancias consisten en hinchazones de mesénquima que se encajonan en un epitelio suprayacente. Los estudios en múltiples especies han mostrado que la señalización a la diafonía entre el ectodermo y el mesénquima facial es crítica para dar forma a la cara 6. Sin embargo, los detalles mecanicistas sobre los genes implicados en estos relés de señalización son insuficientes. Una forma de obtener una comprensión completa de la expresión génica, factor de transcripción de unión, y las marcas asociadas a la cromatina con el desarrollo de ciertasmesa de ping ectodermo y el mesénquima facial es aislar y caracterizar los compartimentos de tejido separados.
Aquí presentamos un método para separar ectodermo y el mesénquima facial en el día embrionario (E) 10,5, una etapa crítica en el desarrollo en la formación de ratón facial que precede a la fusión de las prominencias. Nuestro método es una adaptación del enfoque que hemos utilizado anteriormente para disecar las prominencias faciales 7. En este estudio anterior que había empleado C57BL consanguínea / 6 ratones como esta variedad se ha convertido en un estándar para la genética, la genómica y la morfología facial 8. Aquí, sin embargo, debido a las cantidades más limitadas de tejido disponible, hemos utilizado el outbred cepa CD-1 que es más barato para comprar, más robusto para la cría, y que tiende a producir más embriones (12-18) por camada que cualquier endogámica ratón cepa 8. Después del aislamiento del embrión, proteasa neutra dispasa II se utiliza para tratar el embrión. Entonces, las prominencias faciales fueron diseccionared a cabo, y el ectodermo facial se separó a partir del mesénquima. Este método evita que tanto el ectodermo y el mesénquima facial intacto. Las muestras obtenidas utilizando esta metodología se puede utilizar para técnicas que incluyen la detección de proteínas, la inmunoprecipitación de cromatina (ChIP) de ensayo, los estudios de microarrays, ARN y ss-.
Protocolo
1. Preparar Dispasa II
- Preparar fresco Hepes-solución salina tamponada (HBS) (50 mM HEPES / KOH pH 7,4, 150 mM NaCl). Añadir 2 ml de 0,5 M Hepes / KOH pH 7,4 y 1,2 ml de NaCl 2,5 M en 16,8 ml ultrapura H 2 O.
- Hacer 10 mg / ml Dispasa II. Pesar 0,2 g Dispase II (Roche, Cat # 4942078001) y disolver en 20 ml de HBS. Preparar alícuotas de 1,0 ml en tubos individuales de Eppendorf y se almacena a -20 ° C para almacenamiento a largo plazo.
- Diluir 10 mg / ml Dispasa II 1:10 en PBS antes de su uso. Ponga el diluido II Dispasa sobre hielo.
2. Disecciona CD-1 a partir de embriones E10.5 Mujer Embarazada
Todos los experimentos con animales se realizaron de acuerdo con los protocolos aprobados por el Cuidado de Animales de la Universidad de Colorado en Denver (UCD) y el Comité de uso. Ratones CD-1 (ICR) se obtuvieron de Harlan Laboratories (Indianapolis, IN).
- Limpiar la zona de disección y herramientas con 70% de etanol.
- Eutanasiar embarazada CD-1 hembra con Aprobacióned protocolos.
- Rocíe el abdomen con un 70% de etanol y luego abrir el abdomen. Use un juego de pinzas para tirar del útero y otro para arrancar el mesometrio del útero. Extirpar el útero del cuerpo. Repita el procedimiento para cuerno uterino en el otro lado del abdomen.
- Brevemente enjuague el útero con PBS enfriado con hielo en un plato de Petri 10-cm para limpiarla de sangre.
- Transferir el útero en una nueva placa de Petri con PBS enfriado con hielo. Separado en fragmentos de embriones de una sola cortando entre sitios de implantación.
- Transferir un embrión en PBS helado bajo un microscopio estereoscópico. Use unas pinzas finas para arrancar la pared muscular del útero a partir de uno de los sitios de corte para exponer el embrión con el saco vitelino. Retire el saco vitelino y el amnios. La transferencia de embriones disecados a un plato de Petri de 6 cm con PBS en hielo. Continúe hasta que todos los embriones han sido recogidos de esta manera.
3. Dispasa II El tratamiento del
- Lavar todos los embriones con PBS en una placa de Petri de 6 cm. ReemplazarPBS con 10 ml diluido en PBS Dispase II. Cubrir la placa de Petri y se incuba a 37 ° C durante 25 minutos - una infección bacteriana incubadora o sala caliente debe ser suficiente - no hemos utilizado un CO 2 incubadora de cultivo de tejidos para este paso.
- Tomar la placa de Petri a cabo y observar el embrión en un estereomicroscopio. El ectodermo se han aflojado, caracterizado por una clara diferencia entre esta capa de tejido y el mesénquima subyacente. Si no, incubar durante 5 min a 37 ° C. A continuación, coloque la placa de Petri en hielo.
4. Diseccionar las prominencias faciales intactas
- Utilice una pipeta de vidrio desechable (VWR, Cat # 14672-380) para transferir un Dispase II tratados embrión en PBS enfriado en hielo en una placa de Petri de 6 cm en un estereomicroscopio.
- Utilice un par de pinzas para sujetar el embrión. El uso de otro par de pinzas finas para cortar cuidadosamente los límites de las prominencias faciales unidos a la cabeza (Figura 1 muestra los límites delas prominencias faciales). Iniciar desde un lado de la MnP, entonces la MxP, y FNP la última. Hacer lo mismo para el otro lado de diseccionar las prominencias faciales fuera intacto (Figura 2A).
5. Ectodermo facial independiente de mesénquima
- Tenga en cuenta las prominencias faciales bajo un microscopio estereoscópico con una distancia de trabajo de 3x. Utilice una pipeta Pasteur de vidrio larga para pipetear suavemente las prominencias faciales arriba y abajo 5 veces. Después de esto, el ectodermo es fácil de pelar.
- Use un par de pinzas para sujetar las prominencias faciales. Utilice el otro par de pinzas para pelar el ectodermo muy lentamente. Figura 2B muestra las hojas separadas del ectodermo facial.
- Utilice una nueva pipeta Pasteur de vidrio larga para transferir el ectodermo facial en un tubo de 1,5 ml Eppendorf con PBS en hielo. Transferir el mesénquima a otro tubo de 1,5 ml Eppendorf con PBS en hielo.
- Utilice el nuevo hielo frío PBS para cada disección. Recoger muestras.
- Lave tél las muestras con PBS. Se centrifuga a 4 ° C, 500 xg durante 3 min.
- Aspirar el PBS utilizando pipetas Pasteur de vidrio largas. Si las muestras se van a utilizar para el chip de ensayo, vaya al paso 6.1. Para la extracción de RNA, vaya al paso 6.2. Para la extracción de proteínas, vaya al paso 6.3.
6. Las muestras de proceso para nuevos experimentos
- Las muestras para ensayo ChIP
- Añadir 1 ml de PBS con 1% de formaldehído para reticular. Homogeneizar las muestras.
- Incubar a temperatura ambiente durante 10 min con rotación.
- Añadir 110 l de 1,25 M de glicina a cada tubo para saciar formaldehído sin reaccionar.
- Mezclar e incubar a temperatura ambiente durante 5 min.
- Spin a 500 xg, a 4 ° C durante 3 min. Eliminar el sobrenadante.
- Añadir 1 ml de PBS frío para lavar los tejidos.
- Spin a 500 xg, a 4 ° C durante 3 min.
- Retire PBS PBS y repetir lavar una vez.
- Remover el sobrenadante, Snap congelar los tejidos en nitrógeno líquido. Guarde la samples a -80 ° C para la puesta en común posterior y el procesamiento.
- Las muestras para la extracción de ARN
- Coloque el ectodermo y el mesénquima facial en tubos que contienen RNAlater (Ambion).
- Se incuban las muestras en solución RNAlater durante la noche a 4 ° C para permitir la penetración profunda del tejido.
- Almacenar a -20 ° C para la puesta en común posterior y procesamiento.
- Las muestras para la extracción de proteínas
Añadir tampón de lisis a la muestra para su posterior procesamiento. O SNAP congelar los tejidos en nitrógeno líquido. Almacenar las muestras a -80 º C para la puesta en común posterior y procesamiento.
Notas
- Las limitaciones de tiempo. Planee en 4-6 horas desde el inicio de la disección hasta el comienzo de la sección 6.
- Cuando competente, toma ~ 10-15 min por embrión para realizar las secciones 4 y 5 (la prominencia disección y separación ectodermo).
- Si las muestras son para el aislamiento de ARN, cada solution debe ser tratada con pirocarbonato de dietilo primero. También limpie las pinzas y el área de trabajo con RNasa Away.
- Mantener las muestras en hielo en todo momento, excepto para el tratamiento Dispasa II y disecciones. Cambie al nuevo PBS enfriado con hielo para cada disección para asegurarse de que el sistema de cartilla utilizada para la disección en frío.
- Pinzas cortantes son críticos para obtener disección precisa. Limpie la pinza completamente para evitar cualquier contaminación.
- Para recoger muestras de diferentes prominencias, diseccionar cada prominencia por separado después de Dispasa tratamiento II. A continuación, separar el ectodermo y el mesénquima.
- Después del tratamiento con Dispasa II, el ectodermo facial es fácil de pelar. Preste especial atención a la contaminación del ectodermo otro. Deseche todos los tejidos potencialmente contaminados.
- Una vez que comience, no te detengas hasta que las muestras alcancen el punto apropiado en la Sección 6. Finalizar separación del ectodermo facial y mesénquima para todos los embriones lo más rápido que puedas.
- El correoactividades nzyme de Dispasa II podría ser diferente entre lotes y marcas. Es necesario ajustar el tiempo de tratamiento para diferentes marcas y los lotes de Dispase II.
Resultados
Después Dispasa tratamiento II, el ectodermo del embrión tiende a ser flojo. Las prominencias faciales deben estar intactos después de la disección (Figura 2A). El ectodermo facial aislada es clara y libre de tejido mesénquima (Figura 2B). Para determinar la eficacia del protocolo y para detectar la contaminación cruzada que ensayaron para prosencéfalo expresó ZIC3 9, ectodérmica específico 5 CDH1 y mesenquimales específico SOX10 10 usando la transcriptasa inversa PCR. Nuestros estudios confirmaron que tanto el ectodermo y el mesénquima facial expresado los genes esperados y estaban libres de contaminación cruzada (Figura 3).
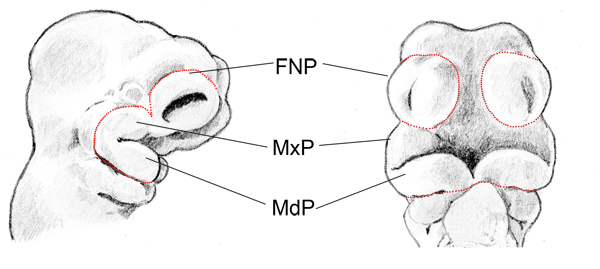
Figura 1. Representación esquemática de ratón E10.5 prominencias faciales. Vista lateral (izquierda) de la cabeza y la vista rostral (derecha) de la cabeza del embrión E10.5. Red Dotted líneas indican el límite de las prominencias faciales. Prominencia frontonasal (FNP), la prominencia maxilar (MXP), prominencia mandibular (MdP).

Figura 2. Aparición de enteros disecados E10.5 prominencias faciales y ectodermo facial. (A) Total prominencias faciales. (B) ectodermo facial. Los paneles A y B son los mismos aumentos. Insertar en B muestra un aumento mayor de una de las ectodermo facial en el panel B. Prominencia frontonasal (FNP), la prominencia maxilar (MXP), prominencia mandibular (MdP).
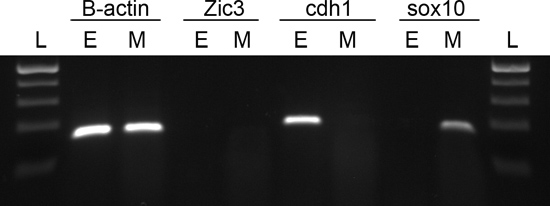
Figura 3. La transcriptasa inversa PCR confirmó que tanto el ectodermo y el mesénquima facial son libres de cruz contamination. ARN total fue extraído a partir de ectodermo facial (E) y el mesénquima (M). El ARN se transcribió de forma inversa en su ADN complementario (ADNc), seguido de PCR con cebadores específicos para detectar la expresión de beta-actina (B-actina), ZIC3, CDH1 y SOX10. Las secuencias de los cebadores de la Tabla 1 se obtuvieron de banco cebador ( http://pga.mgh.harvard.edu/primerbank/ ). Los productos de PCR fueron separados en un gel de agarosa 2%. DNA Ladder (L).
| Gene | Primer nombre | secuencias | Tamaño del producto |
| Beta-actina | mActb-F | 5'-GGCTGTATTCCCCTCCATCG-3 ' | 154 pb |
| mActb-R | 5'-CCAGTTGGTAACAATGCCATGT-3 ' | ||
| ZIC3 | mZic3-F | 5'-TCCCTTCGGGGACTCAACC-3 ' | 138 pb |
| mZic3-R | 5'-GCATTGGCATAACCTGAACCC-3 ' | ||
| CDH1 | mcdh1-F | 5'-CAGGTCTCCTCATGGCTTTGC-3 ' | 175 pb |
| mcdh1-R | 5'-CTTCCGAAAAGAAGGCTGTCC-3 ' | ||
| SOX10 | msox10-F | 5'-ACACCTTGGGACACGGTTTTC-3 ' | 165 pb |
| msox10-R | 5'-TAGGTCTTGTTCCTCGGCCAT-3 ' |
Tabla 1. Las secuencias de cebador.
Discusión
Este protocolo proporciona un método sencillo para separar ectodermo embrionario del ratón facial y el mesénquima basado en una etapa de tratamiento inicial Dispase II. En estudios anteriores, hemos realizado la disección de las prominencias faciales antes del tratamiento Dispasa II, pero hemos encontrado consistentemente que el mesénquima se vuelve "pegajoso" y más difícil de manipular. Nuestro nuevo protocolo evita este problema. Combinación Dispase II tratamiento con la fuerza física suave pipeteando arriba y hacia abajo hace que la separación del ectodermo y el mesénquima más fácil. Además, este protocolo también funciona bien para la separación de otras muestras embrionarias ectodermo y el mesénquima, tales como ectodermo extremidad brote y mesénquima con Dispasa tratamiento más corto II. De manera similar, se puede utilizar en otras etapas de desarrollo - por ejemplo, para separar E11.5 ectodermo y el mesénquima facial con una etapa de tratamiento más largo Dispase II.
El tamaño de la muestra obtenida de un ratón E10.5 facial PROMINcia es muy pequeño y por lo tanto tienden a almacenar los lotes para el tiempo de procesamiento y análisis. A este respecto es necesario piscina muestras ectodérmicas 100 a 150 embriones para obtener 10 mg de tejido. Una mayor cantidad de mesénquima se deriva de cada embrión requiere menos de fondo común. El rendimiento de ADN genómico sonicado para chip de ensayo es de aproximadamente 80 mg de 10 mg ectodermo facial. El rendimiento total de ARN es de aproximadamente 20 mg por cada 10 mg ectodermo facial. A partir de un análisis comparativo de proteínas Bradford, estimamos que podemos obtener hasta 1 mg de proteína por cada 10 mg ectodermo facial. Una vez que el ARN, la cromatina, o muestras de proteína se encuentran en la mano, pueden ser utilizados para los ensayos de numerosas incluyendo la detección de proteínas, chip de ensayo, el análisis de microarrays, ARN y ss-. Por lo tanto, este protocolo permite un análisis profundo de la expresión génica diferencial, modificación epigenética, y la unión de factores de transcripción responsables de la diafonía molecular entre el ectodermo y el mesénquima facial durante el desarrollo embrionario.
Divulgaciones
Los autores no tienen intereses en conflicto o los conflictos asociados con el contenido de este artículo.
Agradecimientos
Los autores desean agradecer a Irene Choi para ilustrar las cabezas de embriones en la figura 1 y los otros miembros del laboratorio en busca de ayuda y discusión. Este trabajo es apoyado por el NIH subvención DE012728 (TW)
Materiales
| Name | Company | Catalog Number | Comments |
| Dispase II (neutral protease, grade II) | Roche | 4942078001 | Make 10 mg/ml Dispase II stock solution in HBS. Aliquot and store at -20 °C . |
| RNAlater | Ambion | AM7021 |
Referencias
- Wilkie, A. O., Morriss-Kay, G. M. Genetics of craniofacial development and malformation. Nat. Rev. Genet. 2, 458-468 (2001).
- Gritli-Linde, A. Chapter 2 - The Etiopathogenesis of cleft lip and cleft palate: usefulness and caveats of mouse models. Current Topics in Developmental Biology. 84, 37-138 (2008).
- Schutte, B. C., Murray, J. C. The many faces and factors of orofacial clefts. Human Molecular Genetics. 8, 1-7 (1999).
- Chai, Y., Maxson, R. E. Recent advances in craniofacial morphogenesis. Dev. Dyn. 235, 2353-2375 (2006).
- Jiang, R., Bush, J. O., Lidral, A. C. Development of the upper lip: Morphogenetic and molecular mechanisms. Dev. Dyn. 235, 1152-1166 (2006).
- Reid, B. S., Yang, H., Melvin, V. S., Taketo, M. M., Williams, T. Ectodermal WNT/β-catenin signaling shapes the mouse face. Developmental Biology. 349, 261-269 (2011).
- Feng, W., et al. Spatial and temporal analysis of gene expression during growth and fusion of the mouse facial prominences. PLoS ONE. 4, e8066(2009).
- Chia, R., Achilli, F., Festing, M. F., Fisher, E. M. The origins and uses of mouse outbred stocks. Nat. Genet. 37 (11), 1181-1186 (2005).
- Nagai, T., Aruga, J., Takada, S., et al. The expression of the mouse Zic1, Zic2, and Zic3 gene suggests an essential role for Zic genes in body pattern formation. Developmental Biology. 182, 299-313 (1997).
- Britsch, S., et al. The transcription factor Sox10 is a key regulator of peripheral glial development. Genes Dev. 15 (1), 66-78 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados