Method Article
Ein Do-it-yourself-System für die planmäßige Fütterung von Labornagetieren in ihrem Heimkäfig
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Papier beschreibt das Design, die Montage und das Protokoll für ein automatisiertes Fütterungssystem zusammen mit einer alternativen Deckel- und Käfigmodifikation, die mit minimalen Modifikationen für angebundene optogenetische oder faserphotometrische Experimente in Standard-Nagetierkäfigen implementiert werden kann. Das Fütterungssystem bietet ein kostengünstiges Werkzeug für die zeitgesteuerte Fütterung und/oder Kalorienrestriktion.
Zusammenfassung
Intermittierendes Fasten und die Erforschung des Einflusses einer zeitgesteuerten Kalorienrestriktion auf die Regulierung des Körpergewichts und das Altern liegen im Trend, sowohl in der Gesellschaft als auch im Labor. Um die zeitlich begrenzte Fütterung und/oder Kalorienrestriktion im Labor zu untersuchen, werden zugeteilte Futtermengen in festgelegten Zeitintervallen verteilt. Die derzeitige Technologie für die planmäßige Fütterung von Nagetieren umfasst entweder spezielle Käfige mit geschlossenen Futtereintrittsöffnungen, zeitlich gesperrte digitale Trichter oder manuelle Futterabgabe. Spezielle Geräte für solche Experimente können kostspielig sein, und die manuelle Fütterung erfordert oft, dass die Forscher spät in der Nacht oder am frühen Morgen kommen, was längere Studien ausschließt. Das hier beschriebene automatisierte Fütterungssystem bietet ein kostengünstiges Werkzeug für die zeitgesteuerte Fütterung und/oder Kalorienrestriktion, das mit minimalen Modifikationen in Standard-Nagetierkäfigen implementiert werden kann. Das Protokoll verwendet einen handelsüblichen Futterautomaten, der mit einem Standard-Mikroisolator-Käfigdeckel (Käfigdeckel für Maus, Hamster, Ratte oder Meerschweinchen) ausgestattet ist und die gewünschten Futterzuteilungen in programmierten Zeitintervallen im Heimkäfig des Tieres verabreichen kann. Unser Design kann modifiziert werden, um verschiedene Futterautomaten oder geringfügige Abweichungen in den Käfigabmessungen zu akzeptieren. Wir liefern das Design, die Montage und das Protokoll für das Fütterungssystem sowie eine alternative Deckel- und Käfigmodifikation für angebundene optogenetische oder faserphotometrische Experimente.
Einleitung
Intermittierendes Fasten ist ein wichtiger Bereich der Stoffwechsel- und Alternsforschung. Die richtige Abstimmung der Fütterung und des zirkadianen Rhythmus kann die Wirkung der Ernährung auf das Körpergewicht verändern 1,2,3,4. Darüber hinaus ist längeres intermittierendes Fasten mit einer erhöhten Langlebigkeit und verbesserten altersbedingten Störungen verbunden 5,6,7,8. Forschungsstudien, die Langzeitfastenprotokolle (>20 Tage) implementieren, erfordern in der Regel spezielle Geräte. Es ist zwar möglich, Futter für geplante Fütterungsprotokolle manuell zu liefern, dies kann jedoch erfordern, dass ein Untersucher über einen längeren Zeitraum zu zahlreichen Zeitpunkten außerhalb der Geschäftszeiten anwesend ist. Zum Beispiel würden drei Fütterungszeiten, die 4 Stunden auseinander liegen, eine manuelle Lieferung um 20:00 Uhr, 12:00 Uhr und 4:00 Uhr erfordern; Wahrscheinlich eine Compliance-Herausforderung, die länger als ein paar Tage anhält.
Alternativen zur manuellen Futterabgabe für Labornagetiere sind 1) spezialisierte Käfige mit automatischem Torzugang zu Lebensmitteln oder 2) digitale Trichtersysteme, die einen automatisierten und programmierten Zugang zu Lebensmitteln ermöglichen, wie z. B. FED39. Käfigsysteme mit bewachtem Zugang zu Futter sind kostspielig und einige bieten keine geeignete Käfigumgebung für Langzeitstudien. Herkömmliche operante Konditionierungsboxen sind beispielsweise in der Lage, die Lebensmittellieferung zu automatisieren, haben aber einen Drahtgitterboden, der für eine langfristige Unterbringung nicht förderlich ist. Das BioDAQ-System von Research Diets liefert Futter und Wasser über geschlossene externe Anschlüsse. Programmierbare automatisierte Gates ermöglichen langfristig geplante Fütterungs- oder Trinkstudien, das System ist jedoch eine kostspielige Investition. Mechanisierte Trichtersysteme sind ein weiteres Werkzeug für automatisierte geplante Fütterungsprotokolle 9,10. Die beiden genannten mechanisierten Trichter haben den Vorbehalt, dass sie den Wohnraum im Käfig reduzieren. Hungrige Tiere mit Nahrungseinschränkung können an den Fütterungsgeräten kauen und/oder Käfigreste können die Mechanik des Trichters für Langzeitstudien beeinträchtigen. Schließlich wurde ein mechanisierter Trichter, der von der Takahashi-Forschungsgruppe zusammen mit der Phenome-Technologie entwickelt wurde, speziell für langfristig geplante Fütterungsstudien entwickelt3. Bei diesem System befindet sich ein mechanisierter Trichter über dem Drahtgestell eines Standardkäfigs mit einer Rutsche, die das Futter liefert. Das Phenome-System bietet jedoch keine Flexibilität für Tiere, die an ein Patchkabel gebunden sind (Optogenetik/Faserphotometrie-Experimente), und es ist im Vergleich zu dem hier beschriebenen Autofeeder-Gerät relativ teuer.
Als Antwort auf die vorherrschenden Herausforderungen bei geplanten Fütterungsprotokollen schlagen wir eine kostengünstige Lösung vor. Unser automatisiertes System ermöglicht eine präzise Lieferung von Lebensmitteln in festgelegten Intervallen. Mit einer Kombination aus 3D-gedruckten Teilen und einem im Handel erhältlichen automatischen Fischfutterautomaten entwickeln wir ein externes Fütterungssystem zum Selbermachen (DIY), das auf eigenständigen Nagetierkäfigen mit Mikroisolatoren ausgestattet werden kann. Das Fütterungssystem und die hier beschriebenen Teile können direkt auf jeden der folgenden Nagetierkäfige angewendet werden: Maus, Ratte, Hamster oder Meerschweinchen, vorausgesetzt, dass die eigenständigen Käfige Mikroisolator-Oberteile verwenden. Da die Käfige unterschiedlich groß sind, können die Platzierungen leicht variieren, aber die 3D-gedruckten Halterungen, das Fütterungssystem und das Design der externen Wasserflasche sind im Allgemeinen auf eigenständige Nagetierkäfige mit Mikroisolatordeckeln anwendbar.
Wir stellen ein Beispiel für einen Autofeeder vor, aber viele andere Standard-Autofeeder sind verfügbar und können mit leichten Änderungen an den 3D-gedruckten Teilen in das modulare System eingebaut werden. Um die Anpassung des 3D-gedruckten Halters an alternative Feeder oder geringfügige Abweichungen in den Käfigabmessungen zu erleichtern, weisen wir eine modifizierbare, 3-dimensionale SolidWorks-Datei mit einer begleitenden STL-Datei nach.
Die externe Platzierung des Futterautomaten bietet vollen Platz im Heimkäfig und ermöglicht das Abnehmen, Sterilisieren und erneute Beladen oder Ersetzen des Futterautomaten ohne Unterbrechung des Tieres. Das automatisierte Fütterungssystem ist effizient für Langzeitaufzeichnungen, erschwinglich und für verschiedene zeitlich begrenzte Fütterungs- und/oder Kalorienrestriktionsprotokolle zugänglich. Wir stellen detaillierte technische Zeichnungen der Käfigbaugruppen, des Designs und des Protokolls für die Implementierung des Fütterungssystems sowie Beispieldaten zur Verfügung. Zweitens stellen wir eine Reihe von Anweisungen zur Verfügung, um die Standardkäfighaltung für die Verwendung des Autofeeders mit Tieren zu modifizieren, die an ein Patchkabel für optogenetische oder faserphotometrische Experimente gebunden sind.
Protokoll
Alle Verfahren wurden vom Amherst Institutional Animal Care and Use Committee der University of Massachusetts genehmigt.
1. Montage des Autofeeders auf einem Standard-Mikroisolator-Käfigdeckel (Abbildung 1)
- Schneiden Sie mit einem rotierenden Werkzeug mit einer 1,5-Zoll-Trennscheibe ein 20 x 25 mm großes Quadrat in einen Käfigdeckel für den Mikroisolator aus. Positionieren Sie die Öffnung 2,75 cm von der Deckelkante entfernt und mittig über dem Gitterrost (Abbildung 1B, links).
- Drucken Sie eine Halterung in 3D, um den Autofeeder mit dem Käfigdeckel zu koppeln (Abbildung 1A und ergänzende Datei 1). Lassen Sie die Halterung auf das Loch des Käfigdeckels einrasten (Schritt 1.1; Abbildung 1B, Mitte) und schieben Sie den Autofeeder auf die Oberseite der gesicherten Halterung (Abbildung 1B [rechts] ,C).

Abbildung 1: Modifikation und Montage der Autofeeder-Halterung und des Käfigdeckels. (A) Technische Zeichnung der Autofeeder-Halterung (siehe SolidWorks/STL-Dateien in der Zusatzdatei 1 für den Maßstab in 3D). (B) Von links nach rechts, Käfigdeckel mit Loch 20 x 25 mm; Die Halterung wird auf der Käfigoberseite montiert und mit dem Petbank-Autofeeder montiert. (C) Zusammengebauter Petbank Autofeeder auf einem Käfig mit Futterpellets, das auf ein Standard-Gitter mit Wasserflasche fallen gelassen wird. Maßstabsbalken = 25 cm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Programmierung und Verwendung des Beispiel-Autofeeders von der Stange
- Stellen Sie bei zeitgesteuerten Experimenten zuerst die Fütterungszeiten und zuletzt die synchronisierte Fütterungsuhr ein, da nachfolgende Anpassungen die Taktzeit verschieben.
- Stellen Sie sicher, dass der Feeder ausreichend geladen ist. Halten Sie die Einstellungstaste gedrückt, bis die Stundeneinstellung auf dem Bildschirm blinkt.
- Fahren Sie mit der Zeiteinstellung fort. Stellen Sie mit den Pfeilen nach oben und unten die Zeit auf die erste gewünschte geplante Fütterungsperiode ein.
- Legen Sie die Anzahl der Zuteilungen für diesen Zeitpunkt fest (gekennzeichnet durch die Anzahl der Punkte neben der Feed-Einstellung). Wiederholen Sie die Schritte 2.2 bis 2.4 für bis zu zwei weitere Zeitpunkte.
- Befüllen Sie die Kammern der automatischen Fütterung mit den gewünschten Futterkontingenten von ≤1,5 g Standard-Nagetierfutter. Wenn mehr Futter benötigt wird, stellen Sie den Futterautomaten so ein, dass er mehrere Zuteilungen zu einem bestimmten Zeitpunkt liefert. Der Beispiel-Feeder verfügt über 16 Kammern.
HINWEIS: Lebensmittel können nach Maß bestellt oder mit einer Schere zugeschnitten werden. - Beschriften Sie eine Kammer mit Klebeband oder Farbe, um die programmierte Kammerdrehung und die Futterausgabe zu bestätigen. Kontrollieren Sie täglich, während Sie die Futterautomaten laufen lassen.
3. Modifiziertes Käfigsystem für angebundene Tiere mit dem Futterautomaten
- Optionaler Ersatzdeckeleinsatz für Tiere, die an ein Patchkabel gebunden sind (Abbildung 2)
- Schneiden Sie ein Stück aus 3 mm dickem, klarem Acryl nach den Vorgaben in Abbildung 2A mit dem Laser (siehe auch Ergänzende Datei 2). Der Acryleinsatz ist mit Laschen versehen, die in die Käfigoberseite eingerastet werden können. Der Mittelschlitz (190 x 5 mm) ermöglicht den Durchgang des Patchkabels. Das quadratische Loch von 20 x 25 mm passt auf die Halterung des automatischen Vorschubs; 20 Belüftungslöcher sorgen für eine Frischluftzirkulation.
- Hebeln Sie mit einem Schlitzschraubendreher oder einem Keilwerkzeug die perforierte obere Abdeckung des Käfigs eines Standard-Mikroisolatordeckels ab. Lösen Sie die Laschen aus den Laschenschlitzen, und entfernen Sie sowohl den perforierten Einsatz als auch das Filterpapier (Abbildung 2C, links und Mitte).
- Unter der perforierten Oberseite und dem Filterpapier befindet sich ein internes geripptes Stützgitter. Verwenden Sie ein rotierendes Werkzeug und ein 1,5-Zoll-Schneidrad, um das Stützgitter zu entfernen. folgen Sie den Pfeilindikatoren, die in der Mitte von Abbildung 2C gezeigt sind. Nach dem Schneiden, um das Stützgitter zu entfernen, feilen Sie, um die Schnittkante zu glätten.
- Lassen Sie die Ersatz-Acrylplatte (Schritt 3.1) in die Käfigoberseite einrasten. Beginnen Sie mit der Installation, indem Sie die Plattenlaschen in die Laschenschlitze entlang einer der kurzen Kanten und dann einer der langen Kanten schieben und vorsichtig drücken, bis die Platte einrastet (Abbildung 2C [rechts] ,D).
- Optionale externe Wasserflaschenhalterung für Tiere, die an ein Patchkabel gebunden sind (Abbildung 3)
- Bohren Sie eine Öffnung für den Trinkflaschen-Sipper: Loch mit 11 mm Durchmesser, 50 mm über dem Boden, zentriert an der kurzen Kante des Käfigs (Abbildung 3B und ergänzende Datei 3).
- Bohren Sie auf beiden Seiten des Mittellochs (± 27,5 mm) zwei Löcher mit einem Durchmesser von 6 mm. Optional können Sie ein 8-mm-Vierkantlochwerkzeug verwenden, um quadratische Löcher zu bohren (siehe Abbildung 3B).
- Drucken Sie eine externe Wasserflaschenhalterung in 3D (Abbildung 3A und ergänzende Datei 4). Montieren Sie die Halterung der Wasserflasche mit Schlossschrauben (2 cm lang, 6 x 1 mm oder 0,75" lang 1/4 x 20; Abbildung 2B,C).
- Für eine Wasserflasche montieren Sie ein konisches Standardröhrchen mit 50 mL und einer Sipper/Stopper-Baugruppe (#7 Stopper mit 3-1/2" gebogenem Sipper, siehe Materialtabelle) an der externen Halterung. Füllen Sie alle 2-3 Tage Wasser nach.
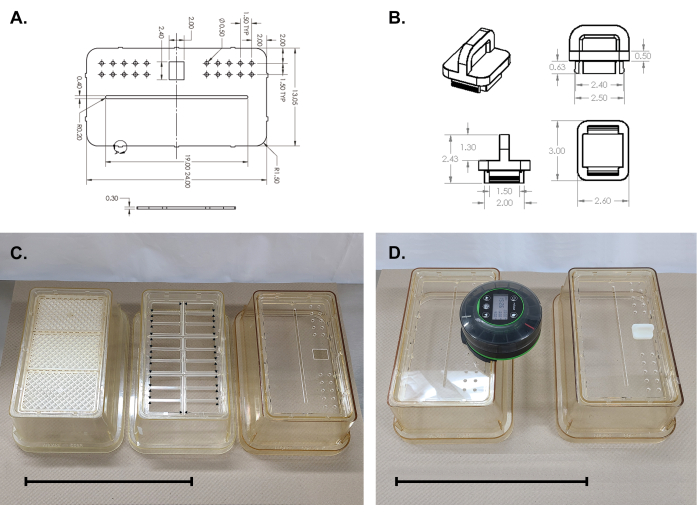
Abbildung 2: Montage der Acrylplatte auf der Käfigoberseite. (A,B) Technische Zeichnungen der Acrylplatte und des Feeder-Port-Steckers. (C) Links, Standard-Käfigoberteil mit perforiertem Einsatz und Filter. Mitte, Entnahme des perforierten Einsatzes und des Filters (das gerippte Gitter muss entlang der mit dem Pfeil gekennzeichneten Linien ausgeschnitten werden). Rechts, die Acrylplatte rastete ein. (D) Komplette Deckelmontage. Maßstabsbalken = 25 cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
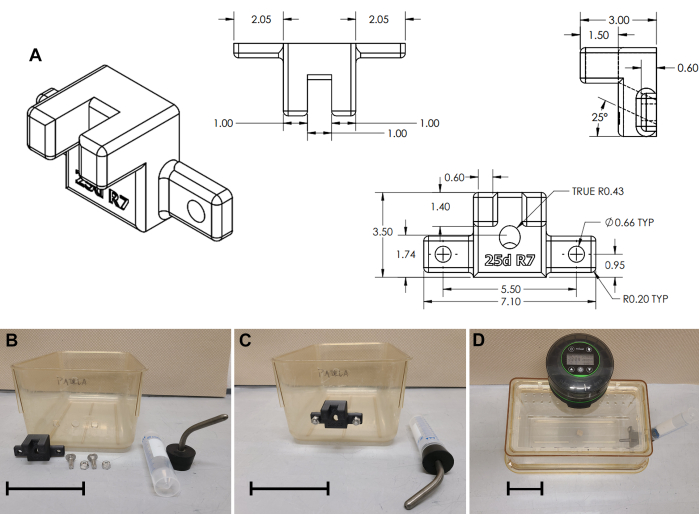
Abbildung 3: Montage der Wasserflaschenhalterung. (A) Technische Zeichnung der 3D-gedruckten Wasserflaschenhalterung. (B) Modifikationen am Käfig und Montage der Wasserflaschenhalterung; (C) Halterung installiert; (D) Komplette Käfigbaugruppe. Maßstabsbalken = 10 cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Zusammenfassung der kompletten Käfigmontage mit dem Futterautomaten. (A) Standardkäfig mit Drahtgestell, (B) modifizierter Käfig für angebundene Tiere. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Eine Studie zur Kalorienrestriktion (21 Tage) zur Induktion von Unfruchtbarkeit bei weiblichen Mäusen (Autofeeder- und Käfigdesign, Abbildung 4A)
Chronischer Energiemangel reicht aus, um die Fruchtbarkeit bei Säugetieren zu hemmen, eine Reaktion, die bei Nagetieren und Menschen gleichermaßen konserviert ist11,12. In dieser Studie verwenden wir die Kalorienrestriktion, um einen langfristigen Körpergewichtsverlust zu induzieren. Erwachsene weibliche C57BL/6-Mäuse, 15-18 Wochen alt, wurden in Einzelhaltung gehalten und in einem 12:12-stündigen Hell-Dunkel-Zyklus gehalten, wobei das Licht zur Zeitgeberzeit 12 (ZT12) ausging. Das Gitter mit dem Futter wurde täglich für jedes Tier über einen Zeitraum von einer Woche gewogen, um die Ausgangsnahrungsaufnahme von 3,80 ± 0,64 g/Tag (Mittelwert ± SE) zu ermitteln. Als nächstes wurde die Nahrung eingeschränkt, um eine Gewichtsabnahme herbeizuführen. Das Futter wurde in drei Portionen rationiert und vom Autofeeder über drei Intervalle verteilt: ZT 12, 16 und 20 (Käfigkonfiguration, Abbildung 4A). In den ersten 48 Stunden waren die Tiere auf 50 % der Ausgangsfutteraufnahme beschränkt. Dann wurden die Tiere in den nächsten 19 Tagen auf ~70 % des Ausgangsfutters beschränkt, mit leichten Anpassungen in der zweiten Hälfte der Beschränkung, um 80-90 % des Ausgangsgewichts zu halten (Abbildung 5A, unten).
Zwischen ZT 0 und ZT 1 wurden die Tiere gewogen und bewertet, um den Ovulationszyklus durch histologische Charakterisierung von Zellen zu inszenieren, die durch eine vaginale Spülung mit 0,1 M phosphatgepufferter Kochsalzlösung gewonnen wurden. Die Zykluslänge wurde mindestens 11 Tage vor und während eines Gewichtsverlusts von 80-90% überwacht. Ein anhaltender Gewichtsverlust von mehr als 10 % reichte aus, um bei weiblichen Mäusen Unfruchtbarkeit zu induzieren, wie bereits veröffentlichtwurde 11.
Die Futterautomaten wurden täglich auf die richtige Rotation und Futterabgabe überprüft (Protokollschritt 3.1). Alle Lebensmittel, die auf dem Boden liegen geblieben waren oder im Gitterrost übrig geblieben waren, wurden weggeworfen. Der hier vorgestellte Beispielanleger hat 16 Kammern und kann so eingestellt werden, dass er in drei Intervallen Futter ausgibt (siehe Materialtabelle). Wir haben festgestellt, dass das maximale Volumen des Chows, das in eine Kammer passt, 2 g beträgt, die zugeschnitten oder bestellt werden kann. Wir haben auch festgestellt, dass die Essenslieferung ~10 s dauert, sobald die programmierte Zeit erreicht ist. Es dauert 7 s, bis sich das Bodentor vollständig öffnet, und dann weitere 3 s, bis sich die Kammer über die Öffnung bewegt und das Futterpellet ausgibt. Es gibt Geräusche, die mit dem Öffnen des Tores und dem Fallendes des Lebensmittelkorn in ein leeres Gitter zusammenfallen (Video 1, mit Tonaufnahme).
Im Laufe von 21 Tagen beobachteten wir eine vollständige Genauigkeit der Rotationen und der Futterausgabe mit diesem speziellen Futterautomat von Petbank (Table of Materials). Zum Zeitpunkt des Tests waren die Feeder zwischen 3 und 6 Monate nach ihrer ersten Verwendung vergangen und die internen wiederaufladbaren Batterien zeigten während der gesamten 21-tägigen Testphase volle Ladeanzeigen an. Da es sich um eine relativ kleine Stichprobe von Futtertieren handelte (n = 4), führten wir anschließend eine weitere 21-tägige Studie mit 10 Selbstfüttern durch, die so eingestellt waren, dass sie das Futter mit einer übereinstimmenden Geschwindigkeit verteilten. Die anschließende Studie wurde 10 Monate nach der ersten Verwendung der Futterautomaten durchgeführt. Während der 21-tägigen Testphase verlor ein Feeder an Tag 15 einen einzelnen Balken Strom (~25 % Leistungsverlust) und ein anderer an Tag 17 einen einzelnen Balken, während die restlichen 8 Feeder während der gesamten 21 Tage volle Ladeanzeigen hatten. Der Leistungspegel des Beispiel-Feeders wird mit vier Balken angegeben. Unsere Quantifizierung geht davon aus, dass jeder Balken 25 % Leistung darstellt. Wie bei unserem ersten Test führten die Futterautomaten auch in der anschließenden Studie für die Dauer der Studie eine fehlerfreie Rotation und Futterabgabe durch.
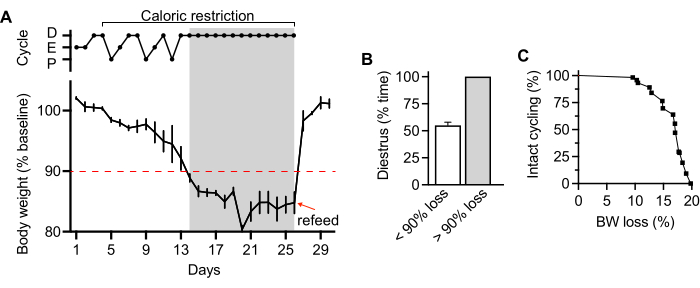
Abbildung 5: Körpergewichtsverlauf mit überlagerten Brunstzyklusdaten bei weiblichen Mäusen während einer Kalorienrestriktion mit dem Autofeeder. (A) Durchschnittlicher Gewichtsverlust (unten) mit dem Autofeeder zur Abgabe von 50-70 % der Ausgangsnahrung über drei Zeitpunkte (im Abstand von 4 Stunden, beginnend bei ausgeschaltetem Licht). Repräsentative Daten zum Östruszyklus, die mit dem Gewichtsverlust übereinstimmen (oben). Eine graue Hervorhebung zeigt einen Gewichtsverlust von mehr als 10 % des Ausgangsgewichts an. Der Pfeil zeigt die Rückkehr zum ad libitum Zugang zu Lebensmitteln an, indem der Rost mit Lebensmitteln gefüllt und die automatische Zuführung entfernt wird. (B) Östruszyklus während der Gewichtsabnahme; Vergleich innerhalb des Probanden von % der Zeit im Distrus, wenn die Tiere zwischen 1 % und 10 % (offener Balken) Gewichtsverlust haben, gegenüber >10 % Gewichtsverlust (grauer Balken; Hinweis: Stillstand im Diestrus ist ein Zeichen von Unfruchtbarkeit) n = 4. (C) Wasserfalldiagramm des Gewichtsverlusts im Vergleich zum Radfahren. Mit einem Gewichtsverlust von bis zu 8 % waren 100 % der Tiere fruchtbar und zyklisch, während bei einem Gewichtsverlust von 20 % 100 % der Tiere azyklisch und unfruchtbar waren. Abkürzungen: P = proöstrus; E = Brunst; D = Diöstrus. Die Fehlerbalken stellen den Standardfehler des Mittelwerts dar Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1: Geräusche, die darauf hinweisen, dass sich das Tor öffnet und das Pellet mit Lebensmitteln in ein leeres Gitter fällt. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzende Datei 1: Zip-Datei mit der technischen Zeichnung und SolidWorks + STL-Dateien für die Halterung für den automatischen Einzug. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2: Technische Zeichnung der Acrylplatte. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 3: Zip-Datei mit der technischen Zeichnung und SolidWorks + STL-Dateien für den Anschlussstecker. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 4: Zip-Datei mit der technischen Zeichnung, SolidWorks + STL-Dateien für die Wasserflaschenhalterung und den Flaschenhalter. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In präklinischen Tiermodellen ist die Kalorienrestriktion ein leistungsfähiges experimentelles Werkzeug, um den Stoffwechsel präzise zu manipulieren und zu untersuchen. Nachhaltiger Gewichtsverlust hat Auswirkungen auf Fettleibigkeit, Diabetes, Alterung, Fruchtbarkeit und Menopause (eine Art des reproduktiven Alterns), die allesamt wichtige translationale Endpunkte sind. Es kann jedoch schwierig sein, kalorische Restriktionsparadigmen über einen längeren Zeitraum aufrechtzuerhalten. In diesem Manuskript bieten wir eine kostengünstige Lösung an, um eine langfristige Kalorienrestriktion in einer Laborumgebung zu erreichen. Im Lieferumfang enthalten sind Anweisungen zum Koppeln eines handelsüblichen Futterautomaten an einen Nagetierkäfig mit einem Standard-Mikroisolatordeckel. Der Futterautomat wird auf dem Heimkäfig des Tieres montiert und ist so programmiert, dass er das Futter zu festgelegten Zeiten liefert. Die geplante Essenslieferung steuert die Menge und den Zeitpunkt des Zugriffs auf Lebensmittel und ist kostenlos, wenn ein Bediener den Raum betritt. Darüber hinaus kann das kostengünstige System über einen längeren Zeitraum (Monate) laufen, was die Fähigkeit verbessert, eine langfristige Kalorienrestriktion in einer Laborumgebung zu erreichen.
Jüngste Fortschritte in den Neurowissenschaften ermöglichen es Forschern, Neuronen, die die Nahrungsaufnahme bei wachen, sich verhaltenden Tieren fördern, entweder zu manipulieren oder aufzuzeichnen. Insbesondere wurden faserphotometrische Aufzeichnungen (eine In-vivo-Aufzeichnungstechnik) von fressenden Neuronen mit einer Sequenz von Fasten durchgeführt, um die neuronale Aktivität zu fördern, und anschließender Wiederernährung, um die Veränderung der neuronalen Aktivität zu untersuchen 13,14,15. Während es am besten ist, In-vivo-Aufnahmen im Heimkäfig16 des Tieres durchzuführen, werden sie oft in einem externen Bereich durchgeführt, um die Mobilität zu gewährleisten, während sie an ein Patchkabel gebunden sind. Darüber hinaus können In-vivo-Aufzeichnungen dadurch beeinflusst werden, dass ein Handler den Raum betritt, ohne dass er Zugang zu den Lebensmitteln hat. Um beide verwirrenden Probleme bei photometrischen Aufzeichnungen von Neuronen in den Fütterungskreisläufen zu lösen, haben wir eine Heimkäfigmodifikation entwickelt, um angebundene Tiere über einen längeren Zeitraum unterzubringen, die an den Autofeeder gekoppelt ist (Protokollabschnitte 3 und 4). Eine Einschränkung dieses Ansatzes besteht darin, dass für die Konstruktion des Käfigdeckeleinsatzes ein Laserschneider erforderlich ist. Während ein rotierendes Werkzeug und eine Ritzvorrichtung zum Schneiden des Acryleinsatzes verwendet werden könnten, würden die Werkzeuge wahrscheinlich daran scheitern, kleine Laschen und einen dünnen Schlitz zu erzeugen.
Es gibt Einschränkungen für das hier beschriebene Fütterungssystem. Für die Montage werden nämlich 3D-gedruckte Teile benötigt. Darüber hinaus läuft die Uhr des Beispiel-Autofeeders in einem 24-Stunden-Zyklus, so dass der Zeitpunkt der Futterabgabe für zirkadiane Studien manuell an die Freilaufperiode des Tieres angepasst werdenmuss 17. Schließlich ist das Gerät auf 16 Kammern und drei programmierte Zeitintervalle begrenzt. Der Futterautomat verteilt das Futter; Der Verbrauch wird nicht überwacht. Futter, das über einen bestimmten Zeitraum nicht verzehrt wird, kann vom Käfigboden oder vom Gitterrost geholt werden, aber es kann zu Fehlern bei der Abrechnung und dem Abrufen von nicht gefressenem Futter kommen.
Um die Vorteile eines handelsüblichen Futterautomaten hervorzuheben, der in einen Standard-Nagetierkäfig eingebaut ist, zeigen wir, dass das Gerät benutzerfreundlich ist und in bestimmten Zeitintervallen präzise Futterzuteilungen liefert. Dieses System behindert den Bereich des Heimkäfigs nicht. Da sich der Futterautomat außerhalb des Käfigs des Tieres befindet und leicht von der 3D-gedruckten Halterung abgenommen werden kann, können regelmäßige Wartung, Futternachfüllung und Reinigung mit minimaler Störung des Tieres durchgeführt werden.
Als Beispiel haben wir den Autofeeder verwendet, um eine Kalorienrestriktion und letztendlich Unfruchtbarkeit zu induzieren. Wir demonstrieren den Einsatz des Autofeeders in einer 21-tägigen Kalorienrestriktionsstudie (Abbildung 5) und haben die Feeder anschließend für zahlreiche Experimente im Labor eingesetzt. Wie in den Ergebnissen beschrieben, handelte es sich bei den Futterautomaten um zuverlässige und präzise Futterzuführungen. Die interne, wiederaufladbare Batterie scheint mit der Zeit etwas nachzulassen, aber nach fast einem Jahr der Nutzung der Feeder laufen sie mindestens 15 Tage, bevor sie auch nur einen leichten Stromverlust feststellen. Der Hersteller schätzt, dass der Akku ab einer vollständigen Ladung 60 Tage lang laufen kann. Bei längeren Studien (>30 Tage) ist es ratsam, voll aufgeladene Ersatz-Feeder zum Drehen zu haben, wenn die Batterielebensdauer des Feeders unter 50 % der maximalen Ladung liegt.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Jason Lê wird vom von den National Institutes of Health finanzierten Forschungsausbildungsprogramm nach dem Abitur unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| #7 Stopper W/ 3-1/2" curved sipper tube no ball | Labex | 2067 | |
| AN75 mouse cage bottom | Ancare | AN75HT | |
| Automatic Fish Feeder for Aquarium | Petbank-tek.com | Amazon distribution (#B0BRCWP16K) | |
| Rodent Micro-filter Tops | Ancare | N10MBTPLF | |
| Rubber Stoppers, One Hole | United Scientific | S24009 | |
| standard rodent chow | Prolab IsoPro 3000 |
Referenzen
- Arble, D. M., Bass, J., Laposky, A. D., Vitaterna, M. H., Turek, F. W. Circadian timing of food intake contributes to weight gain. Obesity (Silver Spring). 17 (11), 2100-2102 (2009).
- Hatori, M., et al. Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet. Cell Metab. 15 (6), 848-860 (2012).
- Acosta-Rodriguez, V. A., de Groot, M. H. M., Rijo-Ferreira, F., Green, C. B., Takahashi, J. S. Mice under caloric restriction self-impose a temporal restriction of food intake as revealed by an automated feeder system. Cell Metab. 26 (1), 267-277.e2 (2017).
- Gallop, M. R., Tobin, S. Y., Chaix, A. Finding balance: understanding the energetics of time-restricted feeding in mice. Obesity (Silver Spring). 31 (Suppl 1), 22-39 (2023).
- Hua, L., et al. Time-restricted feeding improves the reproductive function of female mice via liver fibroblast growth factor 21. Clin Transl Med. 10 (6), e195(2020).
- Strilbytska, O., Klishch, S., Storey, K. B., Koliada, A., Lushchak, O. Intermittent fasting and longevity: From animal models to implication for humans. Ageing Res Rev. 96, 102274(2024).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Longo, V. D., Panda, S. Fasting, Circadian rhythms, and time-restricted feeding in healthy lifespan. Cell Metab. 23 (6), 1048-1059 (2016).
- Matikainen-Ankney, B. A., et al. An open-source device for measuring food intake and operant behavior in rodent home-cages. Elife. 10, e66173(2021).
- Sahasrabudhe, A., Guy, C. R., Greenwell, B. J., Menet, J. S. Manipulation of rhythmic food intake in mice using a custom-made feeding system. J Vis Exp. (190), (2022).
- Kreisman, M. J., Tadrousse, K. S., McCosh, R. B., Breen, K. M. Neuroendocrine basis for disrupted ovarian cyclicity in female mice during chronic undernutrition. Endocrinology. 162 (8), ebqab103(2021).
- Allaway, H. C., Southmayd, E. A., De Souza, M. J. The physiology of functional hypothalamic amenorrhea associated with energy deficiency in exercising women and in women with anorexia nervosa. Horm Mol Biol Clin Investig. 25 (2), 91-119 (2016).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Chen, Y., Lin, Y. C., Kuo, T. W., Knight, Z. A. Sensory detection of food rapidly modulates arcuate feeding circuits. Cell. 160 (5), 829-841 (2015).
- Mandelblat-Cerf, Y., et al. Arcuate hypothalamic AgRP and putative POMC neurons show opposite changes in spiking across multiple timescales. Elife. 4, e07122(2015).
- Kahnau, P., et al. A systematic review of the development and application of home cage monitoring in laboratory mice and rats. BMC Biol. 21 (1), 256(2023).
- Eckel-Mahan, K., Sassone-Corsi, P. Phenotyping circadian rhythms in mice. Curr Protoc Mouse Biol. 5 (3), 271-281 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten