Method Article
Kultivierung und Bildgebung von ex vivo organotypischen Pseudomyxoma-Peritonei-Tumorschnitten aus resezierten humanen Tumorproben
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Protokoll für die Herstellung, Kultivierung und Visualisierung von menschlichen Krebserkrankungen, die Metastasen in die Peritonealoberflächen gebildet haben. Resezierte Tumorproben werden mit einem Vibratom geschnitten und auf permeablen Einsätzen kultiviert, um die Sauerstoffversorgung und Viabilität zu erhöhen, gefolgt von Bildgebung und nachgeschalteten Analysen mittels konfokaler Mikroskopie und Durchflusszytometrie.
Zusammenfassung
Das Pseudomyxoma peritonei (PMP) ist eine seltene Erkrankung, die durch die Ausbreitung eines muzinösen Primärtumors und die daraus resultierende Ansammlung von Muzin-sezernierenden Tumorzellen in der Bauchhöhle entsteht. PMP kann durch verschiedene Arten von Krebs entstehen, einschließlich Blinddarmkrebs, Eierstockkrebs und Darmkrebs, obwohl Blinddarmtumoren bei weitem die häufigste Ätiologie sind. PMP ist aufgrund seiner (1) Seltenheit, (2) begrenzten Mausmodellen und (3) muzinöser, azellulärer Histologie schwierig zu untersuchen. Die hier vorgestellte Methode ermöglicht die Echtzeit-Visualisierung und -Abfrage dieser Tumorarten unter Verwendung von patienteneigenen ex vivo organotypischen Schnitten in einem Präparat, bei dem die Tumormikroumgebung (TME) intakt bleibt. In diesem Protokoll beschreiben wir zunächst die Präparation von Tumorschnitten mit einem Vibratom und die anschließende Langzeitkultur. Zweitens beschreiben wir die konfokale Bildgebung von Tumorschnitten und wie funktionelle Messwerte der Viabilität, der Kalziumbildgebung und der lokalen Proliferation überwacht werden können. Kurz gesagt, die Schichten werden mit bildgebenden Farbstoffen beladen und in eine Bildgebungskammer gelegt, die auf ein konfokales Mikroskop montiert werden kann. Zeitraffervideos und konfokale Bilder werden verwendet, um die anfängliche Lebensfähigkeit und zelluläre Funktionalität zu beurteilen. Dieses Verfahren untersucht auch die translationale zelluläre Bewegung und parakrine Signalinteraktionen im TME. Abschließend beschreiben wir ein Dissoziationsprotokoll für Tumorschnitte, die für die durchflusszytometrische Analyse verwendet werden sollen. Die quantitative Durchflusszytometrie kann für therapeutische Tests vom Labor bis zum Krankenbett verwendet werden, um Veränderungen innerhalb der Immunlandschaft und des Epithelzellgehalts zu bestimmen.
Einleitung
Das Pseudomyxoma peritonei (PMP) ist ein seltenes Syndrom mit einer Inzidenzrate von 1 pro Million Menschen und Jahr1. Die meisten PMP-Fälle werden durch Metastasen aus Blinddarmneoplasien verursacht. Da Mäuse keinen menschenähnlichen Blinddarm haben, bleibt die Modellierung dieser Krebsart eine große Herausforderung. Während die Grunderkrankung oft durch eine chirurgische Resektion heilbar ist, sind die Behandlungsmöglichkeiten bei metastasierten Erkrankungen begrenzt. Daher ist die Begründung für die Entwicklung dieses neuartigen organotypischen Schnittmodells die Untersuchung der Pathobiologie von PMP. Bis heute gibt es keine Appendiceal-Organoid-Modelle, die dauerhaft kultiviert werden können. Ein aktuelles Modell hat sich jedoch als nützlich für die pharmakologische Testung von Therapeutika und Immuntherapie erwiesen2. Aus diesem Grund haben wir ein organotypisches Schnittkultursystem angepasst, das bereits bei anderen Krebsarten des Menschen eingesetzt wurde, wie z. B. Gehirn-, Brust-, Bauchspeicheldrüsen-, Lungen-, Eierstockkrebs und anderen 3,4,5,6.
Neben Appendiceal-Neoplasien resultiert PMP gelegentlich auch aus anderen Tumorarten, darunter Ovarialkarzinome7 und in seltenen Fällen intraduktale papilläre muzinöse Neoplasien8 und Kolonkarzinom9. Darüber hinaus neigen diese Tumoren dazu, langsam zu wachsen, mit schlechten Transplantatraten in patientenabgeleiteten Xenograft-Modellen (PDX)10,11. Angesichts dieser Herausforderungen besteht ein ungedeckter Bedarf an der Entwicklung von Modellen zur Untersuchung dieser Krankheit, um die Pathobiologie von PMP zu verstehen und zu verstehen, wie diese Krebszellen an die Peritonealoberflächen rekrutiert werden, sich vermehren und der Immunüberwachung entkommen.
Während Tumorschnitte aus dem systemischen Gefäßkreislauf geschnitten werden, enthalten sie zelluläre und azelluläre Komponenten, darunter die extrazelluläre Matrix, Stromazellen, Immunzellen, Krebszellen, Endothelzellen und Nerven. Diese semi-intakte Mikroumgebung ermöglicht die funktionelle Untersuchung dieser Zelltypen, was im Vergleich zu 3D-Organoidkulturen, die nur aus Krebszellen bestehen, einen einzigartigen Vorteil hat12. Während organotypische Schnittkulturen in mancher Hinsicht vorteilhaft sind, sind sie im Vergleich zu 3D-Organoiden, die expandiert werden können, auch von Natur aus ein Ansatz mit niedrigem Durchsatz und eignen sich für das Multiplex-Screening therapeutischer Prüfpräparate13,14,15. Im Fall von PMP gibt es keine Berichte, die eine zuverlässige Etablierung und fortwährende Weitergabe von PMP-abgeleiteten Organoiden belegen16. Dies ist wahrscheinlich auf das langsame Wachstum von PMP-abgeleiteten Tumorzellen sowie auf die geringe Anzahl bösartiger Epithelzellen zurückzuführen, die in diesen muzinösen Tumoren zu finden sind. Angesichts der Notwendigkeit, Modelle zur Untersuchung von PMP zu entwickeln, sind organotypische Schnitte besonders gut geeignet, um diese Krankheit zu untersuchen. Wir stellen ein Protokoll zur Präparation, Bildgebung und Analyse von PMP aus menschlichen Proben vor.
Protokoll
Die Deidentifizierung und Gewinnung aller Gewebe wurde im Rahmen eines vom IRB genehmigten Protokolls an der University of California, San Diego, durchgeführt.
1. Aufbereitung von humanem PMP-Gewebe für die Gewebeverarbeitung und -kultur
- Transport von Tumorgewebe und Mikrodissektion
- Bereiten Sie die Transport- und Nährmedien vor: Füllen Sie 10 % (v/v) Dulbecco's Modified Eagle Media (DMEM), 10 % FBS, 2 mM L-Glutamin, 1 % Penicillin/Streptomycin (Pen-Streptokokken) aus.
- Nach der Ankunft des Gewebes und gemäß einem vom IRB genehmigten Protokoll wird das PMP-Tumorgewebe in 35 Schalen mit einem Durchmesser von 6 cm überführt, die vollständiges DMEM enthalten.
- Präparieren Sie feste Regionen des Tumors mit einem Skalpell von verflüssigtem Muzin. Während Muzinknötchen, die in feste Teile des Gewebes eingebettet sind, geschnitten werden können, entfernen Sie alle verflüssigten Regionen des Tumors. Entfernen Sie nicht nur verflüssigten Schleim oder stark schleimige Geweberegionen, sondern auch Gewebe, das sich nur schwer mit einem Skalpell schneiden lässt. Schneiden Sie die Gewebeknötchen in kleinere Stücke, die etwa 1 cm3 groß sind.
HINWEIS: Die Gewinnung von Tumorknötchen, die von Schleim und dichter EZM gereinigt sind, ist für ein erfolgreiches Schneiden mit einem Vibratom unerlässlich. Zur Qualitätskontrolle wird Tumorgewebe, das im Forschungslabor ankommt, zunächst von einem Pathologen geschnitten, das anschließend vom UCSD-Biorepository verteilt wird. Gewebespender, die sich einem palliativen Debulking des Omentalkuchens unterziehen, sind optimale Fälle für dieses Protokoll, da sie eine hohe Krankheitslast aufweisen, die eine größere Schnittproduktion aus der erhöhten Masse an Gewebeverfügbarkeit für die Forschung ermöglicht.
VORSICHT: Für die Arbeit mit menschlichem Gewebe ist eine Zertifizierung der Biosicherheitsstufe 2 (BSL2) erforderlich. Erkundigen Sie sich bei der Institution nach einer Schulung zu BSL2-Verfahren.
- Agarose-Präparation und Gewebeeinbettung
- Bereiten Sie eine 5%ige Lösung von niedrig schmelzender Agarose in PBS ohne FBS am selben Tag des Eintreffens des Gewebes vor. Achten Sie genau auf die Agaroselösung, da sie dazu neigt, schnell zu kochen.
HINWEIS: Agarose mit niedriger Schmelze ist für die Einbettung von Gewebestücken unerlässlich. Hochschmelzende Agarose verfestigt sich bei höheren Temperaturen, wodurch die Lebensfähigkeit von Gewebeschnitten verringert wird, wenn sie eingebettet werden. Darüber hinaus führt FBS in der auflösenden Lösung zur Bildung von Ausscheidungen. - Legen Sie die erhaltenen Gewebestücke in 6-cm-Schalen ohne Flüssigkeit. Legen Sie nicht mehr als 2-3 Stücke pro 6 cm Schale, damit sie als Agarosewürfel entnommen werden können, ohne andere Gewebe zu stören oder zu berühren.
- Die flüssige 5%ige Agaroselösung in 6 cm große Schalen geben, die die 1 cm3 Tumorproben enthalten. Fügen Sie so viel Agarose hinzu, dass die Probe gerade bedeckt ist. Nach der Zugabe legen Sie die eingebetteten Taschentücher für 30 Minuten in einen 4 °C kalten Kühlschrank.
- Bereiten Sie eine 5%ige Lösung von niedrig schmelzender Agarose in PBS ohne FBS am selben Tag des Eintreffens des Gewebes vor. Achten Sie genau auf die Agaroselösung, da sie dazu neigt, schnell zu kochen.
- Aufbringen von Gewebeproben auf das Vibratom
- Den erstarrten Agar aus dem Kühlschrank nehmen und die Agarosewürfel mit einem Skalpell etwas größer als die Breite des Gewebes schneiden.
- Tragen Sie Sekundenkleber auf die Vibratomstufe auf und legen Sie den Agarosewürfel vorsichtig auf den Sekundenkleber. Warten Sie 1-2 Minuten, bis der Kleber fest geworden ist. Zu diesem Zeitpunkt sollte der Agarosewürfel mit Gewebe auf dem Tisch fixiert werden.
- Fixieren Sie die Klinge am Vibratom und stellen Sie die gewünschte Dicke des Gewebeabschnitts ein. Für eine optimale nachgeschaltete Bildgebung mittels konfokaler Mikroskopie sollten die Schnitte etwa 150 bis 250 Mikrometer groß sein. Klicken Sie auf die Starttaste und fahren Sie mit dem Schneiden des Agarose-Gewebeblocks fort, bis das Gewebe vollständig geschnitten ist.
Anmerkungen: Wenn das Gewebe nicht schneidet oder sich vom Agarosewürfel löst, sollten Sie das Gewebe in eine höher konzentrierte Agarose einbetten und alle zusätzlichen Gewebestücke abschneiden, die möglicherweise zu dicht zum Schneiden sind oder an der Vibratomklinge haften.
- Kultivieren von Gewebeschnitten auf durchlässigen Einlagen
- Bereiten Sie eine permeable Einlegeplatte für die Kultur vor, indem Sie 2 ml des vollständigen DMEM-Mediums über und 3 ml unter der permeablen Membran hinzufügen.
- Heben Sie die Gewebescheiben vorsichtig mit einem dünnen Pinsel aus der Schneidkammer des Vibratoms und legen Sie zwei bis vier Scheiben in durchlässige Kulturschalen mit komplettem DMEM-Medium. Nach 24 h saugen Sie die Medien mit einer Pipette ab und ersetzen Sie die Medien durch frische Nährmedien.
- Kultivieren Sie die Scheiben bis zu 7 Tage lang bei 37 °C/5 % CO2 und tauschen Sie das Medium alle 24 Stunden aus. Zu diesem Zeitpunkt werden Kontrollen für die Zelltötung (Bortezomib) und testbare Chemotherapien 5-Fluoruracil (5-FU) zu den Nährmedien hinzugefügt, um eine pharmakologische Intervention durchzuführen.
- Nach 7 Tagen der Kultivierung ist mit einem Verlust der Lebensfähigkeit von etwa 15%-25% im Vergleich zum Zeitpunkt von Tag 0 (unmittelbar nach dem Schneiden) unter nicht medikamentös behandelten Bedingungen (vollständiges DMEM) zu rechnen. Messen Sie die Lebensfähigkeit mit Lebend-Tot-Viabilitätsfarbstoffen wie Calcein AM (lebend) und Propidiumiodid (tot).
2. Konfokale Bildgebung lebender menschlicher Gewebeschnitte
HINWEIS: Nach der Präparation der organotypischen Tumorschnitte ist es wichtig, die Viabilität des Gewebes zu bestimmen, um eine effiziente und optimierte nachgelagerte Analyse durchführen zu können. Da Tumorproben 150-250 μm dick sind, ist die konfokale oder Zwei-Photonen-Mikroskopie gegenüber Weitfeldmikroskopen für die Durchführung von Studien in situ sehr zu empfehlen. Die Durchflusszytometrie kann auch zur Bestimmung der Lebensfähigkeit und der Zellpopulationen verwendet werden (Methoden siehe unten). Die räumliche Auflösung geht jedoch während der durchflusszytometrischen Analyse verloren, und die Viabilität wird wahrscheinlich unterschätzt, da Tumorschnitte durch mechanische und chemische Methoden getrennt werden müssen.
- Reagenzienvorbereitung und Versuchsaufbau
- Legen Sie Tumorschnitte für die konfokale Bildgebungsanalyse in eine einzelne Vertiefung einer 12-Well-Schale, die PBS mit 1 % FBS enthält. Für Calcium-Bildgebungsexperimente werden die Scheiben anstelle von PBS in extrazellulärer Calciumlösung inkubiert, die wie folgt hergestellt wurde: 125 mM NaCl, 5,9 mM KCl, 2,56 mM CaCl 2, 1 mM MgCl2, 25 mM HEPES, 0,1% BSA, pH 7,4, 3 mM Glucose, steril filtriert. Bereiten Sie diese Lösung im Voraus vor und lagern Sie sie bis zu 1 Monat bei 4 °C (siehe Abschnitt 2.1.8).
- Färben Sie die Proben gemäß den vom Hersteller empfohlenen Konzentrationen und Protokollen mit bildgebenden Farbstoffen (siehe Materialtabelle), um die Lebensfähigkeit von Gewebeschnitten zu bestimmen. Bild für 10 min-1 h nach Zugabe des Viabilitätsfarbstoffs.
- Übertragen Sie die Scheiben nach der Inkubation in eine optisch klare Petrischale mit Glasboden, die PBS mit 1 % FBS enthält, um sie für die Bildgebung auf einem konfokalen Bildgebungsgerät zu verwenden.
HINWEIS: Für die konfokale Bildgebung wurde die konfokale Nikon A1R-Plattform verwendet. - Öffnen Sie die konfokale Bildgebungssoftware. Beginnen Sie mit der Bildgebung bei 10x und wählen Sie den XYZ-Bildmodus. Konfigurieren Sie dann die Erfassungseinstellungen wie folgt.
- Schalten Sie die folgenden Laser ein: 488 nm und 561 nm. Stellen Sie die Verstärkung auf 100 mit einer Laserleistung von 1 % ein. Passen Sie die Laserleistung und -verstärkung während der Bildaufnahme nach Bedarf an. Wählen Sie je nach gewünschter Bildqualität 512 x 512 Pixel oder 1024 x 1024 Pixel für eine höhere Auflösung.
- Wählen Sie " Interlock entfernen" und dann " Scannen" aus, um das Imaging zu starten.
- Für die Calcium-Bildgebung werden Gewebeschnitte mit Fluo-4-AM 1 h lichtgeschützt inkubiert. Befolgen Sie das Protokoll des Herstellers zum Auflösen von Fluo-4-AM in DMSO. Waschen Sie die Scheiben nach 1 Stunde 3x mit extrazellulärer Calciumlösung und befolgen Sie das Bildgebungsprotokoll in den Schritten 2.1.4-2.1.5.
- Für Kalzium-Bildgebungsexperimente mit Fluo-4-AM wählen Sie XYZT und heben Sie die Auswahl des 561-nm-Lasers auf, um die Aufnahmegeschwindigkeit zu erhöhen. Verwenden Sie zusätzlich den Resonanzscanner, um die Geschwindigkeit der Bildgebung weiter zu erhöhen.
3. Dissoziation lebender Schichten für die Durchflusszytometrie
HINWEIS: Die Dissoziation lebender Gewebeschnitte kann für verschiedene nachgelagerte Anwendungen verwendet werden, einschließlich der Immuntypisierung, der Beurteilung der Lebensfähigkeit und der Abfrage der Veränderungen der Zellpopulationen nach pharmakologischer Intervention. Es sollten Maßnahmen ergriffen werden, um sicherzustellen, dass die Gewebequalität und die Lebensfähigkeit der Zellen während des Dissoziationsprozesses erhalten bleiben.
- Schneiden Sie ein kleines Stück vom Ende einer 1-ml-Pipettenspitze ab, um die Öffnung zu erweitern, um eine kräftige mechanische Dissoziation zu ermöglichen, indem Sie 1 Minute lang pipettieren.
- Inkubieren Sie die Scheiben bei 37 °C unter Rotation für 5-15 Minuten in 1 ml Verdauungspuffer, bestehend aus DMEM mit hohem Glukosegehalt, 10 % sanfter Kollagenase/Hyaluronidase (GCH), 10 % FBS und 10 % DNaseI (1 mg/ml Vorrat).
HINWEIS: Batch-abhängige Veränderungen der Kollagenase/Hyaluronidase werden häufig gefunden. - Führen Sie während der Inkubation 2-3 Mal eine kräftige Zerstörung des Gewebes durch mechanische Dissoziation durch. Achten Sie darauf, die Verdauung alle 5 Minuten mit dem Auge zu überprüfen, um eine vollständige Verdauung zu gewährleisten. Falls erforderlich, stoppen Sie die enzymatische Verdauung, indem Sie mit Schritt 3.1.4 fortfahren.
- Nach dem Aufschluss pipettieren Sie die Scheiben und das Aufschlussmedium auf einen 70-μm-Filter, der auf einem konischen 50-ml-Röhrchen platziert ist. Größere Stücke mit einer sterilen Pinzette oder einer Pipette entnehmen.
- Zerdrücken Sie mit dem stumpfen hinteren Ende einer 5-ml-Kunststoffspritze alle größeren, nicht dissoziierten Scheiben und waschen Sie sie weiter mit 4 ml PBS, das 2 % FBS enthält.
- Nehmen Sie den dissoziierten Zellüberstand in ein konisches 50-ml-Röhrchen und schleudern Sie ihn 5-10 Minuten lang bei 300 x g . Entfernen Sie den Überstand und waschen Sie das Pellet mit 1 ml PBS mit 2 % FBS.
- Um die Probe für die Durchflusszytometrie vorzubereiten, fügen Sie den Blockierungspuffer mit 50 μl humanem Fc-Block hinzu und lassen Sie ihn 15 Minuten bei Raumtemperatur stehen. Führen Sie eine extrazelluläre Färbung mit den entsprechenden Antikörpern in 50 μl PBS mit 2 % FBS durch.
HINWEIS: Es gibt viele Durchflusszytometriesysteme. Sobald die Probe für die Durchflusszytometrie vorbereitet ist, lesen Sie das Protokoll des Herstellers für den Betrieb des Geräts.
4. Pharmakologische Intervention unter Verwendung lebender Gewebeschnitte zur Viabilitäts- und Proliferationsanalyse
HINWEIS: Sobald die organotypischen Tumorschnitte präpariert sind, können interventionelle Ansätze mit verschiedenen Methoden durchgeführt werden, darunter Arzneimitteltests, siRNA sowie Virusinfektionen lebender Gewebeschnitte. Hier werden wir Arzneimitteltests sowie nachgelagerte funktionelle Auslesungen diskutieren, die eine Viabilitätsanalyse unter Verwendung der lokalen Proliferation beinhalten.
- Bereiten Sie 10 ml 10 % v/v komplettes DMEM mit 10 % FBS, 2 mM L-Glutamin, 1 % Pen-Streptokokken vor.
- Aliquot von 5 ml Komplettmedien für Kontroll- und Behandlungsbedingungen. Zu den verbleibenden 5 ml Medium wird Bortezomib (2 μM) hinzugefügt, um den Zelltod in Tumorschnitten als Positivkontrolle zu induzieren.
HINWEIS: Bortezomib ist in hohen Konzentrationen ein zytotoxisches Medikament, das den Zelltod induziert. Die anderen Zytostatika können als Positivkontrolle für die Zelltötung verwendet werden. - Unter Verwendung von zwei bis vier Gewebeschichten, die auf die permeablen Schalen aufgetragen wurden, werden die in Schritt 4.2 hergestellten Medien sowie alle zusätzlichen Kombinationstherapien, die für die nachgeschaltete Viabilitäts-LIVE/DEAD-Analyse unter Verwendung der konfokalen Mikroskopie, wie in Schritt 2.1.2 beschrieben, verwendet werden, in die Schale gegeben, oder eine kommerzielle lumineszierende Viabilitätsanalyse mit sequenziell aufeinander abgestimmten Schichten verwendet.
HINWEIS: Die sequenzielle Schichtanpassung ist für die Analyse der Lumineszenzviabilität unerlässlich, da der Lumineszenz-Viabilitätsassay auf dem zellulären ATP-Gehalt beruht. Da während der Zelllyse die internen Kontrollen verloren gehen, sind ähnlich große Schichten erforderlich, da die Ergebnisse von der Startanzahl der lebensfähigen Zellen abhängen (d. h. unausgeglichene Scheiben führen zu unausgeglichenen Ergebnissen). Wenn der Benutzer keine sequenziellen Schichten erhält, ist eine lumineszierende Viabilitätsanalyse nicht möglich, und daher ist eine andere Methode zur Bewertung der Viabilität erforderlich (Durchflusszytometrie oder konfokale Bildgebung basierend auf Lebendzellanalyse). - Lassen Sie die Gewebeschnitte 2-5 Tage lang in einer Kultur, die vollständiges DMEM enthält, und wechseln Sie alle zwei Tage das Medium sowie Bortezomib und 5-FU.
- Für die lumineszierende Viabilitätsanalyse geben Sie 500 μl PBS in eine 12-Well-Schale und übertragen Sie die sequenziell aufeinander abgestimmten Gewebescheiben mit einem Pinsel in die PBS-Lösung oder verwenden Sie den Sog einer 1-ml-Pipette, um diese vorsichtig zu übertragen.
- Entfernen Sie das PBS und fügen Sie die vorbereitete Lösung für die Lumineszenz-Viabilitätsanalyse hinzu. Siehe Bedienungsanleitung für die Zubereitung des Reagens.
- Fügen Sie 500 μl der lumineszierenden Viabilitätslösung pro Bedingung hinzu und inkubieren Sie mit einer langsamen Drehung auf dem Schüttler bei Raumtemperatur für 30 min. Lesen Sie die Lumineszenz mit einem Lumineszenzplattenleser ab.
Ergebnisse
Kurz gesagt, menschliche Tumorproben von PMP werden nach einem vom IRB genehmigten Protokoll gewonnen. Das Gewebe wird präpariert, mikropräpariert und in einer Agaroseform verfestigt, um mit einem Vibratom geschnitten zu werden (Abbildung 1A; Video 1). Nach dem Schneiden werden Gewebeschnitte auf permeablen Einlegemembranen platziert und kultiviert (Abbildung 1B), die sowohl für bildgebende Assays in situ als auch für zelluläre und funktionelle Abfragen mittels Durchflusszytometrie, konfokaler Bildgebungsanalyse und Zytotoxizitätsassays verwendet werden können. Ein repräsentativer Arbeitsablauf der Kultivierung und Verarbeitung von humanen PMP-Gewebeschnitten ist in Abbildung 1C dargestellt. Eine erste bildgebende Analyse kann lichtmikroskopisch durchgeführt werden (Abbildung 2A-B). Die Färbung von Mucin in Gewebeschnitten wurde mittels Periodsäure-Schiff (PAS)-Färbung (Abbildung 2C) sowie muzinspezifischer Antikörper (Abbildung 2D) visualisiert. Um die Lebensfähigkeit zu beurteilen, werden Scheiben, die aus verschiedenen Regionen geschnitten wurden, in Calcein AM und Propidiumiodid inkubiert, um ihre Gesundheit und Lebensfähigkeit zu bestimmen (Abbildung 2E-F). Die meisten Zellen (ca. 85%) sind lebensfähig (Calcein AM+; grün), während einige Zellen tot sind (Propidiumiodid; rot), wenn sie nach dem ersten Schnitt durch konfokale Mikroskopie sichtbar gemacht werden. Die extrazelluläre Matrix kann mit weißem Einfall in einer Winkelposition von 180° sichtbar gemacht werden. Tumore, die vor der Operation mit einer Chemotherapie behandelt wurden, zeigen oft mehr PI-Signale. Die Proliferation von Gewebeschnitten kann mit Hilfe von EdU verfolgt werden, das dem Schichtkulturmedium zugesetzt wird. Für den Nachweis wurde ein kommerzielles Zellproliferations-Assay-Kit verwendet, und der Assay wurde nach 72 Stunden Kultur an festen Schichten durchgeführt. Aktiv proliferierende Zellen in Kultur können im FITC-Kanal (grün) gemessen werden. Die Zellkerne (DAPI) überlappen sich mit Zellen, die sich während der Kultur vermehrt haben (EdU+) (Abbildung 2G). Diese Ergebnisse werden quantifiziert, um die Anzahl der proliferierenden Zellen (DAPI+-Kerne) innerhalb des Tumorschnitts zu bestimmen (Abbildung 2H). Die hier gezeigten Ergebnisse deuten darauf hin, dass kultivierte Scheiben während der Schnittkultur lebensfähig und proliferativ sind.
Um die Funktionalität von Immunzellen zu identifizieren, wurden Ca2+-Bildgebungsstudien an lebenden Tumorschnitten durchgeführt (Abbildung 3; Video 2). Mit diesem Ansatz können direkte und parakrine Signalmechanismen identifiziert werden. Um lokale Immunzellen zu markieren, wurde eine in situ Zytomarkierung durchgeführt, indem Schichten mit einem CD11b-PE-konjugierten Antikörper zusammen mit Fluo-4-AM inkubiert wurden (Abbildung 3A). Pseudofarbenskalierte Bilder, die intrazelluläre Ca2+-Spiegel zeigen, ermöglichen eine bessere Visualisierung der unterschiedlichen Konzentrationen von intrazelluläremCa2+ (Abbildung 3B). Die spontane Aktivität wurde verfolgt und Zeitrafferbilder werden für vor (Abbildung 3C), während (Abbildung 3D) und nach (Abbildung 3E) einer intrazellulären Ca2+-Antwort innerhalb des hervorgehobenen (weiß gepunkteten Kreisfelds; Abbildung 3A,B) CD11b+ Immunzelle. Die rohen Spuren der Ca2+-Antworten in der CD11b-Immunzelle (rot) zusammen mit anderen responsiven (schwarz) und nicht-responsiven Zellen (blau) sind dargestellt (Abbildung 3F). Quantifizierung des Bereichs unter der Kurve der Rohspuren der antwortenden Immunzelle (CD11b+; rote Abbildung 3F) im Vergleich zur Quantifizierung der nicht ansprechenden Zelle (blau; Abbildung 3F) quantifiziert wurden (Abbildung 3G). Diese Ergebnisse deuten darauf hin, dass die funktionelle Verfolgung von Lebendzellen mit dieser lebenden Gewebeschnittplattform durchgeführt werden kann.
Die nachgelagerte Analyse mittels Durchflusszytometrie kann sowohl zur Immuntypisierung als auch zur Untersuchung von Veränderungen in Zellprofilen als Reaktion auf Therapeutika verwendet werden. Die Ergebnisse können auf direkte Signalübertragung oder indirekte (parakrine) Signalübertragung zurückzuführen sein. Repräsentative Ergebnisse der Immuntypisierung einer Patiententumorprobe mit PMP sind in Abbildung 4A dargestellt. Das Immunprofil des Tumors wurde quantifiziert und es wurde festgestellt, dass die Spenderprobe 337 einen hohen Gehalt an M2-Makrophagen aufwies (Abbildung 4B). Diese Ergebnisse deuten darauf hin, dass die Verwendung von PMP-abgeleiteten Gewebeschnitten es den Forschern ermöglicht, die einzigartige zelluläre Spenderlandschaft der Tumorproben der Patienten zu untersuchen. Eine weitere Analyse und Befragung der molekularen, zellulären und genomischen Landschaft ist gerechtfertigt, um einen therapeutischen Ansatz vom Labor bis zum Krankenbett zu entwickeln, der für die Patientenergebnisse von Vorteil sein kann.
Die Pharmakotypisierung und die nachgelagerte Analyse von Gewebeschnitten aus menschlichem PMP-Gewebe sind eine direkte Methode zur Messung von Chemoresistenz und Arzneimittelsensitivität (Abbildung 5). Die Ergebnisse zeigen eine Zellabtötung von Tumorschnitten, die durch Zytotoxizitätsanalysen sowie konfokale TUNEL-Bildgebung als Reaktion auf die Zytostatika Bortezomib (2 μM) und 5-Fluorouracil (5-FU; 2 μM) bestätigt wurde (Abbildung 5A-C). Da die Tumorabtötungsreaktionen sehr heterogen sind, ist es wichtig, die Daten auf der Grundlage des Tumorgrades und der HIPEC-Priorität zu stratifizieren, da sich eine wiederholte Chemotherapie als unwirksame Methode zur Ablation von Tumorzellen in vivo und ex vivo erwiesen hat 17,18. Zusätzlich zur TUNEL-Analyse wurde eine Lumineszenz-Viabilitätsanalyse mit sequenziell abgestimmten Schichten durchgeführt (Abbildung 5D). Bei der Durchführung von Zytotoxizitätsassays ist es wichtig, sequenziell aufeinander abgestimmte Tumorschnitte zu verwenden, da nicht übereinstimmende Schnitte zu unzuverlässigen Ergebnissen führen.

Abbildung 1: Schematische Darstellung einer ex vivo organotypischen Schnittkulturplattform von Pseudomyxoma peritonei mit repräsentativen Gewebeschnitten. Ein repräsentativer Workflow zur Präparation organotypischer Schnittkulturen für die Immuntypisierung und zur Untersuchung funktioneller Eigenschaften von Pseudomyxomtumoren appendicealen Ursprungs. (A) Das Bild eines lebenden Tumorknotens aus einer Pseudomyxoma peritonei (PMP)-Neoplasie. Der Tumorknoten ist in Agarose eingebettet, die mit Sekundenkleber an einem Vibratom fixiert wird. (B) Die repräsentative Verteilung der schneidenden Tumorschnitte und die Anordnung in einer Trans-Well-Kulturschale. (C) Das Schema, das den Arbeitsablauf der Schnittkultur und die Abfrage der Tumorschnitte darstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Konfokale Bildgebung und funktionelle Analyse lebender Gewebeschnitte. (A) Hellfeldbild 2-fache Vergrößerung eines repräsentativen Gewebeschnitts, der von einem Patienten mit Pseudomyxoma peritonei appendicealen Ursprungs geschnitten wurde. (B) Eine 10-fache Vergrößerung des repräsentativen Gewebeschnitts in A. (C) PAS-Färbung eines Gewebes eines Patienten mit Pseudomyxoma peritonei. Maßstabsbalken 1 mm. (D) Immunfluoreszenz-Bildgebung mit MUC2-Antikörpern (grün), EPCAM (rot) und DAPI (blau). Maßstabsbalken 50 μm. (E) Immunfluoreszenzbildgebung unter Verwendung von lebenden (Calcein AM; grün) und toten (Propidiumiodid; rot) Farbstoffen von Spender 39. Maßstabsbalken 50 μm. (F) Quantifizierung der Viabilitätsanalyse unter Verwendung von drei separaten Schichten von Spender 39 während des anfänglichen Gewebeschnitts. Fehlerbalken sind der Standardfehler des Mittelwerts. (G) Immunfluoreszenz-Bildgebung der Proliferation mit EdU (grün). Zellkerne werden mit DAPI (blau) markiert. (H) Quantifizierung der Anzahl der EdU-positiven Zellen pro 1.000 Zellen. N = 3 repräsentative Scheiben von Spender 39. Fehlerbalken sind der Standardfehler des Mittelwerts. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
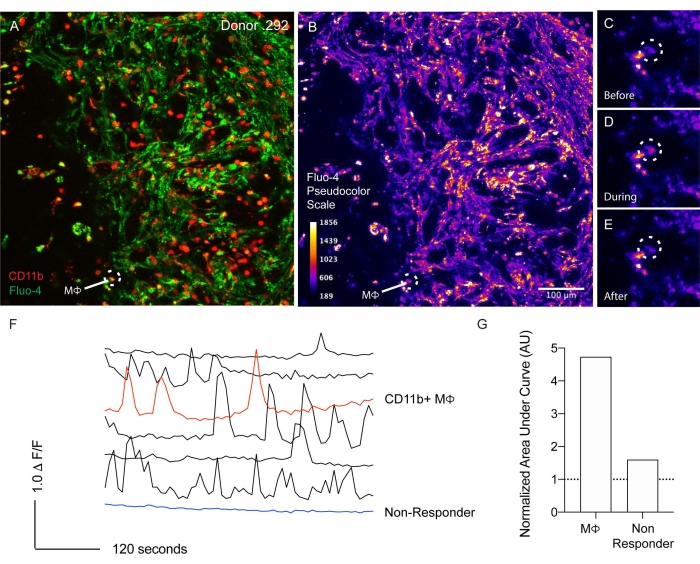
Abbildung 3: Lebendzellverfolgung mittels Calcium-Bildgebung lebender Gewebeschnitte. (A) In-situ-Zytomarkierung eines lebenden Gewebeschnitts von Spender 292. CD11b-markierte Makrophagen sind rot dargestellt. Calcium-Bildfarbstoff Fluo-4-AM (grün). Makrophagen, die zusammen mit CD11b und Fluo-4-AM markiert sind, sind weiß hervorgehoben. (B) Pseudofarbskala einer lebenden Gewebescheibe (dargestellt in A). Makrophagen weiß hervorgehoben wie in A. Maßstabsbalken mit 100 μm gelten für A. Pseudofarben-Maßstabsbalken als mittlere Grauwerte. (C-E) Bild mit hoher Vergrößerung von Fluo-4-AM vor (C), während (D) und nach (E) Calciumaktivierung. (F) Quantifizierung des Calciumgehalts anhand von Rohspuren. Der in A-E hervorgehobene CD11b+-Makrophage ist rot hervorgehoben. Eine Zelle, die nicht reagiert, wird blau hervorgehoben. Die anderen antwortenden Zellspuren sind schwarz dargestellt. (G) Quantifizierung des normalisierten Bereichs unter der gezeigten Kurve zwischen CD11b+-Makrophagen und einer nicht reagierenden Zelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
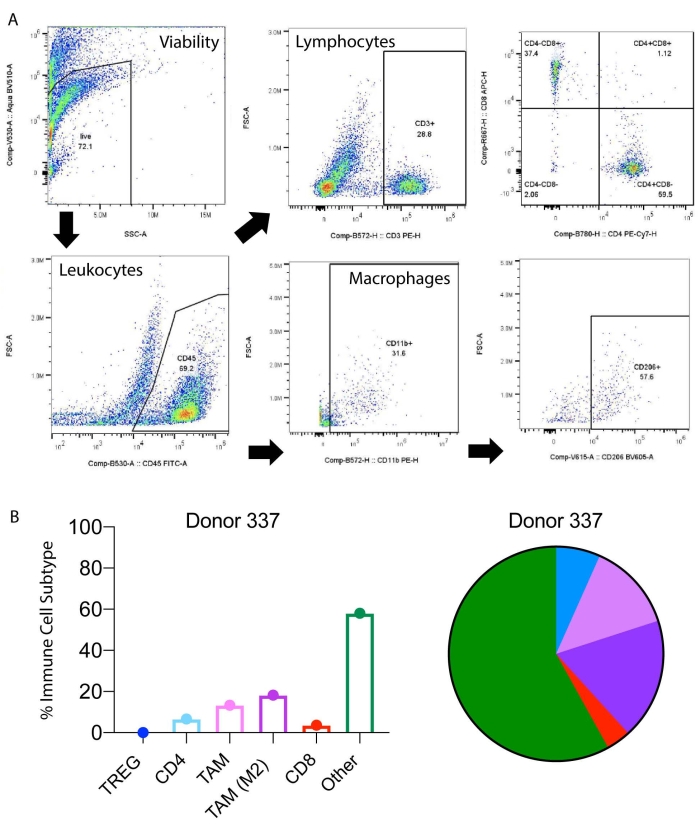
Abbildung 4: Immuntypisierung lebender humaner Tumorschnitte aus Pseudomyxoma peritonei . (A) Repräsentatives Schema zur durchflusszytometrischen Charakterisierung von Immunzellprofilen aus Pseudomyxomtumoren appendicealen Ursprungs. (B) Der prozentuale Anteil der Immunzelluntergruppen ist farbkodiert und der durchschnittliche Balken des Spenders wird aufgetragen. Die obigen Farbmarkierungen werden für Teilmengen von Immunzellen in Kreisdiagrammen bereitgestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Repräsentative Analyse für die pharmakologische Intervention mittels organotypischer Schnittkultur. (A) Immunfluoreszenz repräsentativer Bilder aus der TUNEL-Analyse an unbehandelten Schnitten (linke Spalte), 5-FU (2 μM; mittlere Spalte) oder Bortezomib (2 μM; rechte Spalte) behandelten Schnitten. (B) Quantifizierung der TUNEL-Immunfluoreszenz als Prozentsatz der TUNEL-positiven DAPI+-Zellen von Spender 339. (C) Quantifizierung der TUNEL-Immunfluoreszenz als Prozentsatz der TUNEL-positiven PanCK+-Zellen von Spender 339. (D) Quantifizierung von medikamentös behandelten Schichten mittels lumineszierender Viabilitätsanalyse von Spender 339, gepoolt aus 2-3 sequenziell übereinstimmenden biologischen Replikaten. CTL steht für Kontrolle. Konzentration zur Kontrolle, 5-FU (2 μM) und Bortezomib (2 μM). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Video 1: Schneiden lebender menschlicher Gewebeschnitte aus metastasierten muzinösen Tumorknoten. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Calcium-Bildgebung lebender organotypischer Tumorschnitte aus Pseudomyxoma peritonei. Pseudofarbenbilder mit maximaler Projektion aus konfokalen Bildern eines lebenden Gewebeschnitts, der zum Zeitpunkt 00:00 mit Fluo-4-AM beladen ist. Der Maßstabsbalken beträgt 50 μm (unten rechts). Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Dieses Manuskript beschreibt eine Technik, die zur Kultivierung, Abfrage und Analyse von humanen Pseudomyxoma peritonei (PMP)-Tumorproben verwendet werden kann. Wir haben zahlreiche nachgeschaltete funktionelle Assays verwendet, um die Mikroumgebung des Tumorimmunsystems zu untersuchen, und eine Plattform für Tests vom Labor bis zum Krankenbett.
Während die Methode in unseren Händen sehr effizient ist, erfordert es etwas Übung, Tumorproben mit einem Vibratom zu schneiden. Wir stießen nämlich auf Probleme, die auf stark schleimhaltige Proben zurückzuführen waren, sowie auf Proben, die unsachgemäß mikrodispariert wurden, um unzerschneidbare Gerüste (Bauchdecke, Aszites, verschiedene ECM-Proteine) zu entfernen. Daher ist die Mikrodissektion des PMP-Gewebes zur Entfernung von überschüssigem Mucin ein wichtiger Schritt dieses Protokolls. Wir berichten von einer Erfolgsrate von 80 % bei Patienten mit soliden Knötchen, wie bereits berichtet. Es war technisch weniger schwierig, hochgradige Probenzu schneiden 18. Darüber hinaus ist für dieses Protokoll auch die Herstellung von Agarose (ohne FBS) und die Verfestigung des Gewebes in Agarose wichtig, um Gewebeschnitte herzustellen. Darüber hinaus ist es für den Forscher wichtig, Informationen über den Gewebezustand und die chirurgischen Parameter der Probe (Lokalisation der Metastase, vorbehandelte Proben) zu kennen, da diese zu neuen Erkenntnissen beitragen und zur Lösung potenzieller Probleme bei der Fehlerbehebung beitragen. Ein weiterer wichtiger Schritt in diesem Protokoll ist die funktionelle Analyse der Tumorzelle. Hier ist es wichtig, einen Epithelmarker (z. B. Zytokeratinfärbung) in Kombination mit einer funktionellen Auslesung (Apoptose, Proliferation) zu verwenden, um die Wirksamkeit zu beurteilen. Dies ist bei dieser speziellen Tumorart notwendig, da viele PMP-Tumoren weniger als 10 % der zellulären Zusammensetzung als Tumorzellen aufweisen18. Daher ist die Durchflusszytometrie oder konfokale Bildgebung die bevorzugte Analysemethode. Hochdurchsatz-Assays mit lumineszenzbasierter Bildgebung können jedoch bei Tumoren mit höherem Tumorzellgehalt oder bei der Beurteilung der Rolle von Therapeutika auf dem TME geeignet sein.
Obwohl die organotypische Scheibenkultur ein mächtiges Werkzeug ist, hat sie gewisse Einschränkungen. Eine Herausforderung dieser Technik ist zum Beispiel die zelluläre Heterogenität innerhalb von Tumoren. Um der Heterogenität des Tumors Rechnung zu tragen, sollten sequenziell geschnittene Schnitte aus ähnlichen Tumorregionen zwischen den Gruppen für die Behandlung und die Analyse der Zellviabilität abgeglichen werden. Das Schneiden und Vorbereiten von Scheiben erfordert Übung in der Mikrozerlegung von nicht schneidbaren Tumorgerüsten. Diese Fähigkeiten sind für das erfolgreiche Schneiden und Optimieren von Gewebeschnitten erforderlich, um experimentelle Verzerrungen zu begrenzen. Eine weitere Einschränkung ist die Lebensfähigkeit des Gewebes während der Schnittkultur. Während es in Kulturen 19,20 möglich ist, Hirn- oder Herzschnitte monatelang zu erhalten, wurden Schnittkulturen aus PMP derzeit nur für etwa 1 Woche in Kultur18 getestet, was langfristige experimentelle Untersuchungen, einschließlich chronischer medikamentöser Behandlung und genetischer Manipulation, verhindert. Verbesserungen der Kulturmethoden, wie z. B. die Zugabe von Nahrungsergänzungsmitteln und Wachstumsfaktoren, können erforderlich sein, um die Lebensdauer von PMP-Schnittkulturen zu verlängern.
Die organotypische Schnittkultur ist eine weit verbreitete Technik zur Untersuchung verschiedener Organe, einschließlich Gehirn, Niere und Leber. Wir haben diese Technik für den Einsatz während der PMP übernommen und damit ein alternatives Modellsystem zur Verfügung gestellt, das unseres Wissens nach das erste Modell ist, das die Mikroumgebung des PMP-Tumors in einem semi-intakten Präparat untersucht. In Verbindung mit 3D-Organoiden und Explantatkulturen bietet diese Technik eine robuste und flexible Plattform, um die Wirksamkeit der Behandlung schnell zu beurteilen und die sofortige Umsetzung neuartiger Therapien vom Labor bis zum Krankenbett zu ermöglichen.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Die Autoren bedanken sich bei Kersi Pestonjamasp von der Moores Cancer Center Imaging Core Facility für die Hilfe mit dem UCSD Specialized Cancer Support Center P30 Grant 2P30CA023100. Diese Arbeit wurde zusätzlich durch ein JoVE-Publikationsstipendium (JRW) sowie großzügige Schenkungen aus dem Nachlass von Elisabeth und Ad Creemers, der Euske Family Foundation, dem Gastrointestinal Cancer Research Fund und dem Peritoneal Metastasis Research Fund (AML) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 M CaCl2 solution | Sigma | 21115 | |
| 1 M HEPES solution | Sigma | H0887 | |
| 1 M MgCl2 solution | Sigma | M1028 | |
| 100 micron filter | ThermoFisher | 22-363-549 | |
| 22 x 40 glass coverslips | Daiggerbrand | G15972H | |
| 3 M KCl solution | Sigma | 60135 | |
| 5 M NaCl solution | Sigma | S5150 | |
| ATPγS | Tocris | 4080 | |
| Bovine Serum Albumin | Sigma | A2153 | |
| Calcein-AM | Invitrogen | L3224 | |
| CD11b | Biolegend | 101228 | |
| CD206 | Biolegend | 321140 | |
| CD3 | Biolegend | 555333 | |
| CD4 | Biolegend | 357410 | |
| CD45 | Biolegend | 304006 | |
| CD8 | Biolegend | 344721 | |
| CellTiter-Glo | Promega | G9681 | |
| DMEM | Thermo Fisher | 11965084 | |
| DPBS | Sigma Aldrich | D8537 | |
| FBS, heat inactivated | ThermoFisher | 16140071 | |
| Fc-block | BD Biosciences | 564220 | |
| Fluo-4 | Thermo Fisher | F14201 | |
| Gentle Collagenase/Hyaluronidase | Stem Cell | 7912 | |
| Imaging Chamber | Warner Instruments | RC-26 | |
| Imaging Chamber Platform | Warner Instruments | PH-1 | |
| LD-Blue | Biolegend | L23105 | |
| L-Glutamine 200 mM | ThermoFisher | 25030081 | |
| LIVE/DEAD imaging dyes | Thermofisher | R37601 | |
| Nikon Ti microscope | Nikon | Includes: A1R hybrid confocal scanner including a high-resolution (4096x4096) scanner, LU4 four-laser AOTF unit with 405, 488, 561, and 647 lasers, Plan Apo 10 (NA 0.8), 20X (NA 0.9) dry objectives. | |
| Peristaltic pump | Isamtec | ISM832C | |
| Propidium Iodide | Invitrogen | L3224 | |
| Vacuum silicone grease | Sigma | Z273554-1EA |
Referenzen
- Bevan, K. E., Mohamed, F., Moran, B. J. Pseudomyxoma peritonei. World Journal of Gastrointestinal Oncology. 2 (1), 44-50 (2010).
- Votanopoulos, K. I., et al. Appendiceal cancer patient-specific tumor organoid model for predicting chemotherapy efficacy prior to initiation of treatment: A feasibility study. Annals of Surgical Oncology. 26 (1), 139-147 (2019).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. Journal of Clinical Pathology. 66 (3), 253-255 (2013).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Scientific Reports. 9 (1), 2133(2019).
- Ohnishi, T., Matsumura, H., Izumoto, S., Hiraga, S., Hayakawa, T. A novel model of glioma cell invasion using organotypic brain slice culture. Cancer Research. 58 (14), 2935-2940 (1998).
- Seidman, J. D., Elsayed, A. M., Sobin, L. H., Tavassoli, F. A. Association of mucinous tumors of the ovary and appendix. A clinicopathologic study of 25 cases. The Amerian Journal of Surgical Pathology. 17 (1), 22-34 (1993).
- Mizuta, Y., et al. Pseudomyxoma peritonei accompanied by intraductal papillary mucinous neoplasm of the pancreas. Pancreatology. 5 (4-5), 470-474 (2005).
- Gong, Y., Wang, X., Zhu, Z. Pseudomyxoma peritonei originating from transverse colon mucinous adenocarcinoma: A case report and literature review. Gastroenterology Research and Practice. 2020, 5826214(2020).
- Fleten, K. G., et al. Experimental treatment of mucinous peritoneal metastases using patient-derived xenograft models. Translational Oncology. 13 (8), 100793(2020).
- Kuracha, M. R., Thomas, P., Loggie, B. W., Govindarajan, V. Patient-derived xenograft mouse models of pseudomyxoma peritonei recapitulate the human inflammatory tumor microenvironment. Cancer Medicine. 5 (4), 711-719 (2016).
- Jiang, X., et al. Long-lived pancreatic ductal adenocarcinoma slice cultures enable precise study of the immune microenvironment. Oncoimmunology. 6 (7), 1333210(2017).
- Sundstrom, L., Morrison, B., Bradley, M., Pringle, A. Organotypic cultures as tools for functional screening in the CNS. Drug Discovery Today. 10 (14), 993-1000 (2005).
- Liu, L., Yu, L., Li, Z., Li, W., Huang, W. Patient-derived organoid (PDO) platforms to facilitate clinical decision making. Journal of Translational Medicine. 19 (1), 40(2021).
- Croft, C. L., Futch, H. S., Moore, B. D., Golde, T. E. Organotypic brain slice cultures to model neurodegenerative proteinopathies. Molecular Neurodegeneration. 14 (1), 45(2019).
- Carr, N. J. New insights in the pathology of peritoneal surface malignancy. Journal of Gastrointestinal Oncology. 12, 216-229 (2021).
- Votanopoulos, K. I., et al. Outcomes of repeat cytoreductive surgery with hyperthermic intraperitoneal chemotherapy for the treatment of peritoneal surface malignancy. Journal of the American College of Surgeons. 215 (3), 412-417 (2012).
- Weitz, J., et al. An ex-vivo organotypic culture platform for functional interrogation of human appendiceal cancer reveals a prominent and heterogenous immunological landscape. Clinical Cancer Research. 28 (21), 4793-4806 (2022).
- Pitoulis, F. G., Watson, S. A., Perbellini, F., Terracciano, C. M. Myocardial slices come to age: an intermediate complexity in vitro cardiac model for translational research. Cardiovascular Research. 116 (7), 1275-1287 (2020).
- Habeler, W., Peschanski, M., Monville, C. Organotypic heart slices for cell transplantation and physiological studies. Organogenesis. 5 (2), 62-66 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten