Method Article
Fixierung von embryonalem Mausgewebe zur Zytonemanalyse
In diesem Artikel
Zusammenfassung
Hier wird ein optimiertes Schritt-für-Schritt-Protokoll für die Fixierung, Immunfärbung und das Schneiden von Embryonen bereitgestellt, um spezialisierte Signalfilopodien, sogenannte Cytoneme, in sich entwickelndem Mausgewebe nachzuweisen.
Zusammenfassung
Entwicklungsgewebsstrukturierung und postentwicklungsbedingte Gewebehomöostase hängen von der kontrollierten Abgabe von zellulären Signalen ab, die als Morphogene bezeichnet werden. Morphogene wirken konzentrations- und zeitabhängig, um unterschiedliche transkriptionelle Programme zu spezifizieren, die das Zellschicksal anleiten und verstärken. Ein Mechanismus, durch den geeignete morphogene Signalschwellen sichergestellt werden, ist die Abgabe der Signalproteine durch spezialisierte Filopodien, die Zytoneme genannt werden. Cytoneme sind sehr dünn (≤200 nm im Durchmesser) und können bis zu einer Länge von mehreren hundert Mikrometern wachsen, was ihre Konservierung für die Festbildanalyse schwierig macht. Dieses Papier beschreibt eine verfeinerte Methode für den empfindlichen Umgang mit Mausembryonen zur Fixierung, Immunfärbung und Dickschnittung, um die Visualisierung von Zytonemen mit Hilfe der konfokalen Standardmikroskopie zu ermöglichen. Dieses Protokoll wurde erfolgreich verwendet, um Zytoneme zu visualisieren, die während der Entwicklung von Maus-Neuralrohren verschiedene zelluläre Signalkompartimente verbinden. Die Technik kann auch angepasst werden, um Zytoneme über Gewebetypen hinweg nachzuweisen, um die Abfrage von Entwicklungssignalen mit beispielloser Auflösung zu erleichtern.
Einleitung
Die Embryonalentwicklung wird durch koordinierte Aktivierung von morphogenen Signalwegen orchestriert. Morphogene sind kleine, sezernierte Proteine, die in Sonic Hedgehog (SHH), transformierende Wachstumsfaktor-β (TGF-β) / Knochenmorphogenes Protein (BMP), Wingless-related integration site (WNT) und fibroblast und epidermale Wachstumsfaktor (FGF / EGF) Familien kategorisiert werden. Morphogene werden während der Gewebeentwicklung aus zellulären Organisationszentren produziert und freigesetzt und etablieren Signalgradienten über organisierende Zellfelder, um die Gewebemorphogenese 1,2,3,4,5 zu informieren. Eine Darstellung von Morphogengradienten findet sich im sich entwickelnden Nervensystem, wo das mutmaßliche zentrale Nervensystem durch die Aktivierung des Morphogenwegs gemustert wird. Dieses Gewebe, das als Neuralrohr bezeichnet wird, besteht aus entgegengesetzten Gradienten von SHH, die vom ventralsten Notochord und der Bodenplatte abgesondert werden, und WNTs / BMPs, die von der dorsalen Dachplatte abgesondert werden, um unterschiedliche neuronale Vorläuferregionen zu strukturieren6. Das Neuralrohr wird häufig verwendet, um die Integrität des morphogenen Gradienten in der Entwicklungsforschung zu untersuchen.
Die Bildung von Morphogengradienten beruht auf einer strengen Regulierung der Signalstreuung7. Ein zellulärer Mechanismus, durch den dies geschieht, ist die Bildung von langen Signalfilopodien, den sogenannten Zytonemen, die die direkte Abgabe von Morphogenen von signalproduzierenden Zellen an bestimmte Zielzellpopulationen erleichtern. Es wurde beobachtet, dass Zytoneme Hunderte von Mikrometern ausdehnen, um Morphogene auf signalempfangenden Zellmembranen abzulagern 8,9. Die Störung des zytonemvermittelten Morphogentransports führt zu Entwicklungsanomalien sowohl bei Fliegen als auch bei Wirbeltieren, was ihre Bedeutung während der Gewebestrukturierungunterstreicht 10,11,12,13,14.
Bis heute wurden Cytoneme in Drosophila-, Küken- und Zebrafischmodellen dokumentiert, aber die Bildgebung der Strukturen in sich entwickelnden Säugetierembryonen bleibt eine Herausforderung 8,9,15. Eine Hürde für die effektive Abbildung von Zytonemen in komplexen Säugetiergeweben in situ ist ihre dünne und zerbrechliche Natur, die sie anfällig für Schäden durch herkömmliche Fixierungsmethodenmacht 8. Wir hatten zuvor Protokolle für ein modifiziertes Elektronenmikroskopie-Fixiermittel (MEM-fix) entwickelt und optimiert, um Zytoneme in kultivierten Zellen zu erhalten und ihre Untersuchung mittels konfokaler Mikroskopiezu ermöglichen 16,17.
Die Verwendung der MEM-Fix-Technik hat die Identifizierung einiger der Moleküle ermöglicht, die an der SHH-induzierten Zytonembildung und -funktion beteiligt sind11,16,17. Die Bestätigung dieser Befunde im physiologisch relevanten Kontext der Neuralrohrstrukturierung erforderte jedoch die Entwicklung neuartiger Techniken zur Fixierung und Abbildung von Mausembryonalgewebe. Ein Protokoll zur Fixierung von Mausembryonen in einer Weise, die die Integrität des Zytonems aufrechterhält und die Immunfärbung und anschließende Schnittung von embryonalem Gewebe für die konfokale Analyse ermöglicht, wird hier beschrieben. Dieses Protokoll wurde unter Verwendung eines membrangebundenen grün fluoreszierenden Proteins (GFP) entwickelt, um Membranerweiterungen aus den SHH-produzierenden Zellen im sich entwickelnden Neuralrohr zu markieren. Die Umsetzung dieses Protokolls wird sich mit unbeantworteten Fragen zur Prävalenz und Bedeutung von Cytonemen bei der Entwicklung von Säugetiersystemen befassen.
Protokoll
Dieses Protokoll folgt den genehmigten Tierpflegerichtlinien des Institutional Animal Care and Use Committee (IACUC) und des St. Jude Children's Research Hospital. Alle Sorten wurden fünf Generationen nach der Sorte C57BL/6J zurückgekreuzt.
1. Isolierung von Embryonen und Färbung des gesamten Berges
- Züchten Sie 6 Wochen alte Weibchen und überwachen Sie das Vorhandensein von Vaginalpfropfen.
- Euthanasie der schwangeren Mutter durch CO 2 -Inhalation in einer CO2 -Kammer gefolgt von zervikaler Dislokation gemäß den AVMA-Richtlinien18. Machen Sie einen Y-Schnitt in die Peritonealhöhle mit Sezierschere und Pinzette. Entfernen Sie die Gebärmutter, die die E9.5-Embryonen enthält, gemäß den genehmigten institutionellen Richtlinien.
- Sezieren Sie die Embryonen in vollständigem Wachstumsmedium (Dulbecco's Modified Eagle Medium, ergänzt mit nicht-essentiellen Aminosäuren, Na-Pyruvat, L-Glutamin und 10% fetalem Rinderserum). Verwenden Sie eine Pinzette, um den Dottersack, die Plazenta und die umgebenden Membranen zu entfernen.
HINWEIS: Bewahren Sie bei Bedarf jeden Dottersack für die Genotypisierung des Embryos auf. - Spülen Sie die isolierten Embryonen in Hanks ausgewogener Salzlösung (HBSS), um verbleibendes Fruchtfleisch und Blut zu entfernen.
- Bereiten Sie das Fixiermittel vor. Paraformaldehyd (PFA) zu HBSS hinzufügen, um eine endgültige Arbeitskonzentration von 4% PFA zu erhalten.
VORSICHT: PFA ist eine giftige Chemikalie, daher muss eine Inhalation oder direkte Hautexposition vermieden werden. Die Herstellung der Fixierlösung erfolgt unter einem Abzug mit der richtigen persönlichen Schutzausrüstung aus Handschuhen und einem Laborkittel. - Fügen Sie 1 ml Fixiermittel zu jedem Brunnen einer 24-Well-Platte hinzu und legen Sie jeden Embryo in einen einzelnen Brunnen. Inkubieren Sie die Embryonen in fixativer Form für 45 min mit sanfter Bewegung auf einer Wippe.
HINWEIS: Kritisch: Alle Waschungen und Inkubationen müssen mit sanfter Bewegung (maximal 20 U / min) auf einer Wippe oder einem kreisförmigen Shaker durchgeführt werden, da eine abrupte Handhabung oder Bewegung der Embryonen die fixierten Cytoneme zerstört. Verwenden Sie eine Pipette, um alle Lösungen vorsichtig zu entfernen. - Entfernen Sie das Fixiermittel und waschen Sie die Embryonen 3 x 30 min in phosphatgepufferter Kochsalzlösung (PBS) mit Ca 2+ und Mg2+ mit Zugabe von 0,1% Triton.
- Nach dem Waschen die Embryonen in Blockierlösung (PBS mit Ca 2+ und Mg2+, 0,1% Triton und 5% Ziegenserum) mit sanfter Erregung inkubieren. Block 2 x 1 h. Nach der zweiten blockierenden Inkubation führen Sie eine schnelle Spülung der Embryonen mit frischer Blockierungslösung durch.
- Bereiten Sie im zweiten Blockierungsschritt die primäre Antikörperlösung11 vor. Verdünnen Sie die Antikörper gegen die optimierte Konzentration in PBS mit Ca 2+ und Mg 2+, 0,1% Tween-20 und 5% Ziegenserum.
HINWEIS: Zur verbesserten Visualisierung von Membran-GFP kann Hühner-Anti-GFP (1:250) verwendet werden. - Entfernen Sie die blockierende Lösung und fügen Sie 1 ml primäre Antikörperlösung zu jeder Vertiefung hinzu. 3 Tage bei 4 °C mit sanfter Rotation inkubieren.
- Nach der primären Antikörperinkubation waschen Sie die Embryonen 5 x 1 h bei 20 U / min auf einer Wippe in PBS mit Ca 2 + und Mg2 +, 0,1% Tween-20 und 5% Ziegenserum.
- Bereiten Sie die sekundäre Antikörperlösung unter Verwendung von F(ab')2-Fragment-Secondaries bei einer 1:1.000-Verdünnung in PBS mit Ca 2+ und Mg 2+, 0,1% Tween-20 und 5% Ziegenserum vor.
HINWEIS: Die Verwendung von F(ab')2-Fragmenten verbessert die Antikörperpenetration in die Probe erheblich. - Fügen Sie 1 ml sekundäre Antikörperlösung zu jeder Vertiefung hinzu. 3 Tage lang bei 4 °C im Dunkeln mit sanftem Schaukeln inkubieren.
HINWEIS: Wichtig: Minimieren Sie ab diesem Zeitpunkt die Exposition des Embryos gegenüber direktem Licht. Optional: Um das Bakterienwachstum zu verhindern, fügen Sie der sekundären Antikörperlösung 0,2% Natriumazid hinzu. - Entfernen Sie die sekundäre Antikörperlösung und waschen Sie die Embryonen 3 x 30 min in PBS mit Ca 2+ und Mg 2+, 0,1% Tween-20 und 5% Ziegenserum. Wenn keine Aktinfärbung mit Phalloidin oder anderen Aktinfarbstoffen durchgeführt wird, fügen Sie nach der ersten Wäsche 4′,6-Diamidino-2-phenylindol (DAPI) zu PBS mit Ca 2+ und Mg 2+, 0,1% Tween-20 und 5% Ziegenserum hinzu und inkubieren Sie für 1 h, gefolgt von 3 x 30 min Waschungen wie oben beschrieben.
HINWEIS: Zu diesem Zeitpunkt können die Embryonen über Nacht bei 4 °C in PBS oder HBSS im Dunkeln bis zum Einbettungsschritt am nächsten Tag gelagert werden. Es wird jedoch empfohlen, dass Embryonen sofort eingebettet und geschnitten werden.
2. Einbettung, Schnitt und Montage von Embryonen
- Es ist eine 4%ige w/v Low Melting Point (LMP) Agaroselösung herzustellen, die in HBSS oder PBS mit Ca2+ undMg2+ zu einem Endvolumen von ~3 ml pro Embryo gelöst ist. Das entsprechende Gewicht von LMP-Agarose zu HBSS oder PBS mit Ca 2+ und Mg2+ und Mikrowelle geben, bis die LMP-Agarose aufgelöst ist.
HINWEIS: Sobald die LMP-Agarose aufgelöst ist, lagern Sie die Lösung in einem Perlenbad, Inkubator oder Wasserbad, das auf 55 ° C eingestellt ist, um zu verhindern, dass die LMP-Agaroselösung erstarrt. - Verwenden Sie eine 12-Well-Platte als Einbettungsform für Embryonen. Legen Sie die 12-Well-Platte in das 55 °C warme Perlenbad. Fügen Sie 2,5-3 ml von 4% LMP-Agarose zu jeder Vertiefung hinzu, die einen Embryo enthält.
HINWEIS: Obwohl andere Formen verwendet werden können, sind 12-Well-Plattenvolumina optimal für die Vorbereitung des Agaroseblocks in späteren Stadien zum Schneiden. - Übertragen Sie die Embryonen mit einem perforierten Löffel in einzelne Vertiefungen, die 4% ige LMP-Agaroselösung enthalten (Abbildung 1A).
- Übertragen Sie die 12-Well-Platte aus dem Perlenbad auf eine Tischplatte. Verwenden Sie Pipettenspitzen, um den Embryo sanft einzubetten und auszurichten, so dass er in der Lösung zentriert ist. Sobald die Embryonen orientiert sind, legen Sie die Platte für 10 Minuten auf -20 ° C, um eine schnelle Erstarrung des Blocks zu ermöglichen.
KRITISCH: Stellen Sie sicher, dass der Embryo in der Mitte des Blocks positioniert ist. Embryonen, die zu Boden sinken oder zu nahe am Rand des Schimmelpilzes liegen, werden wahrscheinlich während des Schneidens aus dem Agaroseblock entfernt.
- Übertragen Sie die 12-Well-Platte aus dem Perlenbad auf eine Tischplatte. Verwenden Sie Pipettenspitzen, um den Embryo sanft einzubetten und auszurichten, so dass er in der Lösung zentriert ist. Sobald die Embryonen orientiert sind, legen Sie die Platte für 10 Minuten auf -20 ° C, um eine schnelle Erstarrung des Blocks zu ermöglichen.
- Entfernen Sie den gesamten Agaroseblock mit einem Skalpell aus dem Brunnen und schneiden Sie einen rechteckigen Block um den Embryo herum, wobei auf jeder Seite ~ 0,3 cm Block verbleiben. Erlauben Sie zusätzliche Länge entlang des Schwanzendes des Embryos. Wenn er auf dem Vibratom montiert ist, richten Sie den Embryo in einer aufrechten Position im oberen Teil des Blocks aus (Abbildung 1B).
- Tragen Sie einen Streifen Klebeband auf den Probenhalter des Vibratoms auf und kleben Sie den Agaroseblock auf das Band, so ausgerichtet, dass die Klinge axiale Abschnitte des Embryos in einer anterioren (kranialen) bis hinteren Sequenz erzeugt.
- Füllen Sie die Vibratomkammer mit kaltem HBSS, um sicherzustellen, dass die Probe vollständig eingetaucht ist, und umgeben Sie die Kammer dann mit Eis.
- Stellen Sie die Vibratomgeschwindigkeit auf 0,2 mm/s und die Frequenz zwischen 5 und 7 (50-70 Hz) ein, wobei die Schnittstärke auf 100 μm eingestellt ist. Führen Sie eine serielle axiale Schnittung des Embryos durch.
HINWEIS: Verwenden Sie eine langsame Geschwindigkeit zum Schneiden. Wenn die Schnittgeschwindigkeit über 0,25 mm/s erhöht wird, kann das Schneiden den Embryo zerreißen oder den Embryo aus dem Block entfernen.- Verwenden Sie während der Abschnittsserie eine Pinzette, um einzelne Abschnitte vorsichtig auf eine separate 60-mm-Schale zu übertragen, die mit HBSS gefüllt ist. Verwenden Sie eine Pinzette, um den Block zu greifen, nicht das Gewebe, um Gewebeschäden und die Zerstörung von Cytonemen zu vermeiden.
HINWEIS: Gewebeschnitte sollten im Agaroseblock verbleiben. Wenn das Gewebe aus dem Block in die Vibratomkammer fällt, übertragen Sie es vorsichtig, indem Sie den Abschnitt herausheben. Greifen oder kneifen Sie das Gewebe nicht. KRITISCH: Jede Faltung von Gewebeabschnitten oder abrupte Handhabung zerstört fixierte Zytoneme in den Gewebeabschnitten.
- Verwenden Sie während der Abschnittsserie eine Pinzette, um einzelne Abschnitte vorsichtig auf eine separate 60-mm-Schale zu übertragen, die mit HBSS gefüllt ist. Verwenden Sie eine Pinzette, um den Block zu greifen, nicht das Gewebe, um Gewebeschäden und die Zerstörung von Cytonemen zu vermeiden.
- Wenn Sie keine F-Aktin-Färbung durchführen, fahren Sie mit Schritt 2.10 fort.
- Um eine F-Aktin-Färbung durchzuführen, entfernen Sie HBSS und inkubieren Sie Abschnitte für 40 min mit Actin-Red und DAPI-Lösung, die in PBS mit Ca 2 + und Mg2 +, 0,1% Tween-20 und 5% Ziegenserum bei Raumtemperatur verdünnt ist.
- Waschen Sie Abschnitte 3 x 20 min in PBS mit Ca 2+ und Mg 2+ und 0,1% Tween-20.
- Zeichnen Sie mit einem hydrophoben Markierungsstift eine hydrophobe Barriere um die Ränder eines geladenen Objektträgers und fügen Sie ein kleines Volumen HBSS hinzu, um den Bereich zu füllen.
- Verwenden Sie eine Pinzette oder einen perforierten Löffel, um Abschnitte auf den Objektträger zu übertragen.
HINWEIS: Alle Gewebeabschnitte, die nicht mit Agarose umhüllt sind, können über eine Transferpipette übertragen werden. - Entfernen Sie überschüssige Agaroseblöcke mit einer Pinzette.
- Sobald alle Abschnitte auf den Objektträger übertragen wurden, entfernen Sie überschüssige Flüssigkeit durch Pipettieren und die Ecke eines saugfähigen Handtuchs und fügen Sie dann mehrere Tropfen Montagemedium zum Objektträger hinzu. Verwenden Sie genügend Montagemedium, um den gesamten Deckglasbereich beim Aushärten abzudecken. Montieren Sie das Deckglas, indem Sie es vorsichtig auf den Schlitten legen.
HINWEIS: Vermeiden Sie es, Druck auszuüben oder den Decklack zu stören, bis das Montagemedium ausgehärtet ist.
3. Bildgebung
- Führen Sie die Bildgebung von Gewebeschnitten mit einem konfokalen oder höher aufgelösten Mikroskopdurch 11. Analysieren Sie mindestens drei Embryonen pro Genotyp.
HINWEIS: Bilder von Gewebeschnitten wurden mit einem TCS SP8 STED 3x konfokalen Mikroskop aufgenommen, gefolgt von einer LIGHTNING-Dekonvolution.
Ergebnisse
Die Verwendung einer größeren Form einer 12-Well-Platte mit 2,5-3 ml Agaroselösung pro Well war ideal für die Einbettung und Suspendierung mehrerer Embryonen über einen kurzen Zeitraum (Abbildung 1A). Die überschüssige Fläche ermöglicht eine korrekte Orientierung beim Schneiden des Agaroseblocks zum Schneiden. Beim Schneiden des Agaroseblocks ist es wichtig, überschüssige Agarose entlang der Unterseite des Blocks zu halten, wo sie auf das Band am Objekthalter geklebt wird. Der Embryo sollte sich in der oberen Hälfte des Blocks befinden (Abbildung 1B). Der untere Teil sollte jedoch nicht zu groß sein, da überschüssiger Block die Wahrscheinlichkeit erhöht, den Schnittwinkel zu ändern, wenn die Klinge während des Schneidens in den Block drückt. Beispiele für korrekt ausgerichtete Schnitte sind dargestellt (Abbildung 1C,D).
Bei der Entwicklung dieses Protokolls wurde die Vibratom-Schnittaufnahme mit der Kryostatenschnitt verglichen. Kryostatenschnitt des Gewebes konservierte Zellerweiterungen selten (Abbildung 2 Kryostat und Abbildung 3A,B-Vibratom). Kryostatenschnitte ermöglichten den Nachweis einiger GFP-positiver Membranfragmente zwischen Zellen des Notochords und des Neuralrohrs (Abbildung 2A Pfeilspitze) und zwischen benachbarten Neuralrohrzellen (Abbildung 2B, B 'Pfeilspitzen). Die F-Aktin-Färbung der zellulären Erweiterungen in den stark filamentösen mesenchymalen Zellen, die das Neuralrohr umgeben, war jedoch in Kryostatenabschnitten beeinträchtigt (Abbildung 2C, C' Pfeil, vs. Abbildung 3C,D). Diese Kryostatenergebnisse deuten darauf hin, dass nach dieser Methode nur noch einige Spuren gebrochener Zellerweiterungen übrig bleiben. Daher wird die Vibratomsektion bevorzugt, um diese empfindlichen Erweiterungen für die nachfolgende Analyse effizient zu erhalten.
Eine minimale Störung des gesamten Embryos und einzelner Gewebeabschnitte ist für eine qualitativ hochwertige Bildgebung der Zellerweiterungen unerlässlich. Gewebeabschnitte, die einer Faltung oder Knickung unterzogen wurden, zeigen sich durch das Fehlen des Notochords oder eine große Trennung (>30 μm) zwischen dem Notochord und der ventralen Bodenplatte des Neuralrohrs (Abbildung 3B). Dies geht in der Regel mit dem Verlust von mesenchymalen Zellen einher, die normalerweise das Neuralrohr umgeben (Abbildung 3A, Pfeil). Beschädigte Abschnitte führen auch zu einem Verlust sichtbarer zellulärer Membranerweiterungen, die zwischen Epithelzellen wandern (Abbildung 3B im Vergleich zu Abbildung 3A, Pfeilspitzen). Selbst geringfügige Verzerrungen der Abschnitte können zu einer Fragmentierung der aktinbasierten Erweiterungen und zur Bildung großer Lücken zwischen den Zellen führen (Abbildung 3D, Pfeilspitzen, im Vergleich zu gut erhaltener Abbildung 3C), was die Notwendigkeit einer sorgfältigen Handhabung bei allen Schritten unterstreicht.
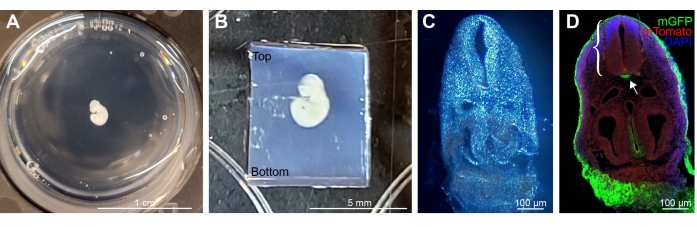
Abbildung 1: Beispiel für E9.5 Shh-Cre; Rosa26 mTmG gefärbter, eingebetteter und geschnittener Embryo. (A) Ein einzelner Embryo in einer 12-Well-Platte, eingebettet in 4% LMP-Agarose. (B) Beispiel eines korrekt ausgerichteten Embryos innerhalb des Agaroseblocks, der für die Vibratommontage auf Größe zugeschnitten wurde. Überschüssiger Agaroseblock ist entlang des Bodens vorhanden. (C) Hellfeldbild eines 100 μm dicken Embryonenabschnitts, eingebettet in LMP-Agarose. (D) Immunfluoreszenzbildgebung eines Abschnitts nach Entfernung von Agarose. Anti-GFP-gefärbtes mGFP (grün) repräsentiert Shh-exprimierende Zellen im Gewebe, wobei andere Zelllinien die Membrantomate (rot) und DAPI in Blau exprimieren. Neuralrohr (Bracket) und mGFP-positives Notochord (Pfeil) sind deutlich sichtbar. Maßstabsstäbe = 1 cm (A), 5 mm (B) und 100 μm (C,D). Abkürzungen: LMP = niedriger Schmelzpunkt; mGFP = Membrangrün fluoreszierendes Protein; Shh = Sonic Hedgehog; DAPI = 4',6-Diamidino-2-phenylindol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Beispiel für kryostatisch geschnittene Neuralrohrbodenplatte und Notochord mit fragmentierten Membranerweiterungen. (A) 20 μm dick E9,5 Shh-Cre; Rosa26 mTmG 19,20,21 Abschnitt gefärbt für GFP (grün), F-Aktin (rot) und DAPI (blau). mGFP-Puncten sind zwischen dem Notochord und der Bodenplatte (Pfeilspitze) und (B,B') sichtbar, die zwischen benachbarten Zellen des Neuralrohrs wandern. (C,C') Die F-Aktinfärbung erkennt keine klaren Zytoneme auf mesenchymalen Zellen, die das Neuralrohr umgeben (Pfeil). Maßstabsstäbe = 20 μm. Abkürzungen: mGFP = Membran grün fluoreszierendes Protein; Shh = Sonic Hedgehog; DAPI = 4',6-Diamidino-2-phenylindol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Beispiele für optimale und suboptimale Vibratomgewebeschnitte und Färbung der Neuralrohrbodenplatte, Notochord und der umgebenden Zellen. Beispiele für fein behandelte Abschnitte (A,C), verglichen mit (B) einem gefalteten Gewebeabschnitt und (D) einem schlecht behandelten Abschnitt aus einem Shh-Cre; Rosa26 mTmG und ein ShhGFP/+ Embryo 19,20,21. Optimal gehandhabte Abschnitte ermöglichen den Nachweis von Zytonemen zwischen benachbarten Bodenplatten-Neuralepithelzellen (A, Pfeilspitzen). Neuralrohrbenachbarte Notochord- (A, mGFP-exprimierende) und mesenchymale Zellen (A, Pfeil) sollten sichtbar sein. (C,D) F-Aktin- und DAPI-gefärbte Abschnitte sollten einen konsistenten Abstand von mesenchymalen Zellen und F-Aktin-basierten Zytonemen (Pfeilen) aufweisen, die das Neuralrohr und das Notochord umgeben (C). Jede geringfügige Faltung oder Störung der Abschnitte kann zu Lücken und gebrochenen F-Aktin-Fragmenten (D, Pfeilspitzen) führen. Maßstabsstäbe = 10 μm. Abkürzungen: mGFP = Membran grün fluoreszierendes Protein; Shh = Sonic Hedgehog; DAPI = 4',6-Diamidino-2-phenylindol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Dieses Protokoll wurde für die Konservierung empfindlicher Zytoneme in embryonalen Gewebeschnitten für die hochauflösende Fluoreszenzmikroskopie entwickelt. Bisher stützte sich die Visualisierung von Cytonemen im Gewebe über verschiedene Modellorganismen hinweg weitgehend auf die ektopische Expression fluoreszierend markierter Proteine mittels Lebendgewebebildgebung. Leider ist die Verwendung von fluoreszenzmarkierter Live-Bildgebung selten förderlich für die Analyse von endogen exprimierten Proteinen, kann zu Zeitbeschränkungen führen und erfordert spezielle Bildgebungsstadien und Mikroskope. Das hier beschriebene Färbe- und Schnittverfahren bewahrt Zytoneme und andere zelluläre Erweiterungen, um eine Immunhistochemie für den eventuellen Nachweis von endogen exprimierten Proteinen zu ermöglichen. Diese Technologie wird neue Erkenntnisse darüber ermöglichen, wie Morphogene in vivo durch verschiedene Gewebe transportiert werden, und erweitert den Umfang der Modellsysteme, in denen Zytoneme untersucht werden können.
Dieses Protokoll verwendet Ganzkörper-Färbung und Vibratom-Dickschnitt, wodurch die Verwendung von Gleichgewichtslösung wie Glycerin oder kryoprotektiven Lösungen wie Saccharose vermieden wird. Es zielt darauf ab, die Handhabung von geschnittenem Gewebe zu minimieren, um die maximale Erhaltung der Zellausdehnungen zu ermöglichen. Eine reduzierte Handhabung des Gewebes nach der Schnittaufnahme führte zu durchweg besseren Ergebnissen bei der Gesamtkonservierung von Zytonemen. Daher ist das Schneiden des Embryos einer der letzten Schritte vor der Bildgebung.
MEM-fix, eine Fixationstechnik, die zur Konservierung von Cytonemen kultivierter Zellen entwickelt wurde, besteht aus einer Kombination von Glutaraldehyd und PFA, die eine verbesserte 3D-Konservierung der angeborenen Zellarchitektur ermöglicht, die mit ihren lebenden Abmessungen vergleichbar ist16,17. Leider war MEM-fix für die Embryofixierung nicht nützlich, da Glutaraldehyd automatisch fluoreszieren kann und die Antikörperpenetration und Epitopbindung in Zellen aufgrund der hohen Proteinvernetzungsaktivität stark einschränkt22,23. So wurden die Abschnittsprotokolle nach der PFA-Fixierung optimiert, um die Erhaltung der Zellausdehnungen im embryonalen Gewebe zu ermöglichen. Obwohl PFA zytonemartige Erweiterungen im embryonalen Gewebe erhalten kann, sollte die Bildanalyse mit Vorsicht durchgeführt werden. PFA kann eine teilweise Austrocknung einzelner Zellen und Gewebe verursachen, was zu einer geringfügigen Volumenreduktion und der Bildung kleiner extrazellulärer Räume innerhalb des fixierten Gewebes führt.
Dieses Protokoll vermeidet die zusätzlichen Schritte der Saccharose-Resättigung zur Kryoprotektion und Gewebereinigung, da Saccharose- oder Glycerinlösungen eine geringfügige Resättigung des Gewebesverursachen können 24. Die daraus resultierende geringfügige Schwellung kann feste Zellerweiterungen und Zytoneme zerstören, die zwischen Zellen und über Gewebe wandern. Dies wurde deutlich, wenn man dickschnittiges Vibratom mit Kryostatenschnitten vergleicht. Obwohl eine zunehmende Gewebedicke die Erhaltung intakter Cytoneme verbesserte, wiesen die Saccharose-gesättigten Kryostat-Abschnitte durchweg eine geringere Inzidenz von nachweisbaren Cytonemen auf.
Die Optimierung dieses Protokolls ergab, dass 100 μm dicke Abschnitte die besten waren, um die Erhaltung intakter Cytoneme zu gewährleisten. Dünnere Abschnitte werden typischerweise für die Bildgebung verwendet, da die meisten konfokalen Mikroskope nur in der Lage sind, eine Bildgebung mit ausreichender Auflösung durchzuführen, um zelluläre Erweiterungen bis zu einer Tiefe von ~ 20-40 μm zu visualisieren, ohne25 zu klären. Die mechanischen Kräfte und der Verzug, die beim Schneiden dünner Abschnitte auf embryonale Zellen von der Klinge ausgeübt werden, zerstören jedoch Cytoneme. Dickere Abschnitte ermöglichen einen größeren Tiefenbereich innerhalb des Abschnitts, während intakte Erweiterungen innerhalb des Gewebes erhalten bleiben. Darüber hinaus ermöglicht die Verwendung dickerer Abschnitte eine einfache Handhabung, um ein übermäßiges Falten oder Knicken der Gewebeabschnitte zu verhindern.
Dieses Protokoll wurde für die maximale Erhaltung von Cytonemen im Gewebe von E8-10,5-Mausembryonen optimiert. Eine minimale Manipulation des Gewebes nach dem Schneiden führte zu einer durchweg verbesserten Gesamtkonservierung der Zytoneme. Es ist wahrscheinlich, dass eine weitere Optimierung erforderlich sein wird, um die Technik aufgrund der erhöhten Größe und Gewebekomplexität für spätere Entwicklungsstadien und erwachsene Gewebeabschnitte anzupassen. Dies erfordert eine Sektion, gefolgt von einer Immunfluoreszenzfärbung. Solches Gewebe kann zusätzliche Reinigungsschritte und eine Anpassung der Gewebehandhabung während des Schneidens erfordern, um zytonemartige Erweiterungen zu erhalten. Diese zusätzlichen Schritte müssen für zukünftige Anwendungen dieses Protokolls in Betracht gezogen und angegangen werden.
Offenlegungen
Die Autoren haben keine konkurrierenden Interessen zu erklären.
Danksagungen
Die Bilder wurden mit Mikroskopen aufgenommen, die vom Cell and Molecular Biology Imaging Core am St. Jude Children's Research Hospital unterhalten wurden. Mausstämme wurden von JAX erhalten. Diese Arbeit wurde durch den Zuschuss der National Institutes of Health R35GM122546 (SKO) und durch das ALSAC des St. Jude Children's Research Hospital unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 12-well plate; Nunc Cell-Culture Treated | Thermo Scientific | 150628 (Fisher Scientific 12-565-321) | |
| 24-Well Plate, Round Nunc | Thermo Fisher Scientific | 142475 | |
| 60 mm dish | Corning, Falcon | 353004 (Fisher Scientific 08772F) | |
| Absorbant towels (Professional Kimtech Science Kimwipes) | Kimberly-Clark KIMTECH | 34155 (Fisher Scientific 06666A) | |
| Actin Red 555 ReadyProbes Reagent | Invitrogen | R37112 | |
| Alexa Fluor 488 AffiniPure F(ab')2 Fragment Donkey Anti-Chicken IgY (IgG) (H+L) | Jackson Immunoresearch Lab Inc | 703-546-155 | 1:1,000 working concentration |
| Bead Bath 6L 230V | Lab Armor | Item #12L048 (Mfr. Model #74220-706) | set to 55 °C |
| chicken anti-GFP | Aves Labs | SKU GFP-1020 | 1:250 working concentration |
| CO2 chamber | plexiglass chamber connected to a CO2 emitting line. | ||
| Confocal laser-scanning microscope | Leica Microsystems | model: Leica TCS SP8 | |
| DAPI Solution (1 mg/mL) | Thermo Fisher Scientific | 62248 | |
| Dissecting scissors (Vannas Scissors) | World Precision Instruments | 14003 | |
| Dulbecco's Modified Eagle Medium, high glucose, no glutamine | Thermo Fisher Scientific, Gibco | 11960044 | |
| Eppendorf Research Plus single channel pipette, 0.1-2.5 µL | Eppendorf | 3123000012 | |
| Eppendorf Research Plus single channel pipette, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research Plus single channel pipette, 100-1,000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research Plus single channel pipette, 20-200 µL | Eppendorf | 3123000055 | |
| Feather Disposable Scalpel #10 | Fisher Scientific | Catalog No.NC9999403 | |
| Fetal Bovine Serum, certified, United States | Thermo Fisher Scientific, Gibco | 16000044 | |
| Fisherbrand Fine Point High Precision Forceps | Fisher Scientific | 22-327379 | |
| Fisherbrand Labeling Tape | Fisher Scientific | 15-954 | |
| Formaldehyde, 16%, methanol free, Ultra Pure EM Grade | Polysciences | 18814-10 | |
| Hank's Balanced Salt Solution (HBSS) | Thermo Fisher Scientific, Gibco | 14025 | |
| ImmEdge Hydrophobic Barrier Pap Pen | Vector laboratories | H-4000 | |
| Leica Application Suite X (LAS X) with LIGHTNING | Leica Microsystems | Microscope software | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific, Gibco | 25030081 | |
| Low Melting Point Agarose- UltraPure | Invitrogen | 16520 | |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific, Gibco | 11140050 | |
| Moria MC 17 BIS Perforated Spoon | Fine Science Tools | 1037018 | |
| Mounting media (ProLong Diamond Antifade Mountant) | Thermo Fisher Scientific, Invitrogen | P36961 | |
| Mouse: B6.129X1(Cg)-Shhtm6Amc/J (ShhGFP/+) | The Jackson Laboratory | Strain #:008466 | |
| Mouse: B6.Cg-Shhtm1(EGFP/cre)Cjt/J (Shh-Cre) | The Jackson Laboratory | Strain #:005622 | |
| Mouse: C57BL/6J (B6) | The Jackson Laboratory | Strain #:000664 | |
| Mouse: Gt(ROSA)26Sortm4(ACTB-tdTomato,-EGFP)Luo/J (Rosa26 mTmG) | The Jackson Laboratory | Strain #:007576 | |
| Normal Goat Serum | Jackson ImmunoResearch | 005-000-121 (Fisher Scientific NC9660079) | |
| PBS + Ca2+ + Mg2+ | Thermo Fisher Scientific, Gibco | 14040133 | |
| Premium Microcentrifuge Tubes: 1.5 mL | Fisher Scientific | 05-408-129 | |
| SHARP Precision Barrier Tips, Extra Long for P-10 and Eppendorf 10 µL | Denville Scientific | P1096-FR | |
| SHARP Precision Barrier Tips, For P-1000 and Eppendorf 1,000, 1,250 µL | Denville Scientific | P1126 | |
| SHARP Precision Barrier Tips, For P-20 and Eppendorf 20 µL | Denville Scientific | P1121 | |
| SHARP Precision Barrier Tips, For P-200 and Eppendorf 200 µL | Denville Scientific | P1122 | |
| Sodium Azide | Sigma-Aldrich | S8032 | |
| Sodium Pyruvate (100 mM) (100x) | Thermo Fisher Scientific, Gibco | 11360070 | |
| Super Glue | Gorilla | ||
| SuperFrost Plus microscope slides | Fisher Scientific | 12-550-15 | |
| TPP centrifuge tubes, volume 15 mL, polypropylene | TPP Techno Plastic Products | 91015 | |
| TPP centrifuge tubes, volume 50 mL, polypropylene | TPP Techno Plastic Products | 91050 | |
| Transfer pipette, polyethylene | Millipore Sigma | Z135003 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Vari-Mix Platform Rocker | Thermo Fisher Scientific | 09-047-113Q | set to 20 RPM |
| Vibratome | Leica Biosytems | VT1000 S |
Referenzen
- Crick, F. Diffusion in embryogenesis. Nature. 225 (5231), 420-422 (1970).
- Zeng, X., et al. A freely diffusible form of Sonic hedgehog mediates long-range signalling. Nature. 411 (6838), 716-720 (2001).
- Yu, S. R., et al. Fgf8 morphogen gradient forms by a source-sink mechanism with freely diffusing molecules. Nature. 461 (7263), 533-536 (2009).
- Zhou, S., et al. Free extracellular diffusion creates the Dpp morphogen gradient of the Drosophila wing disc. Current Biology. 22 (8), 668-675 (2012).
- Ribes, V., Briscoe, J. Establishing and interpreting graded Sonic Hedgehog signaling during vertebrate neural tube patterning: the role of negative feedback. Cold Spring Harbor Perspectives in Biology. 1 (2), 002014 (2009).
- Le Dréau, G., Martí, E. Dorsal-ventral patterning of the neural tube: a tale of three signals. Developmental Neurobiology. 72 (12), 1471-1481 (2012).
- Kornberg, T. B., Guha, A. Understanding morphogen gradients: a problem of dispersion and containment. Current Opinion in Genetics & Development. 17 (4), 264-271 (2007).
- Ramirez-Weber, F. A., Kornberg, T. B. Cytonemes: cellular processes that project to the principal signaling center in Drosophila imaginal discs. Cell. 97 (5), 599-607 (1999).
- Sanders, T. A., Llagostera, E., Barna, M. Specialized filopodia direct long-range transport of SHH during vertebrate tissue patterning. Nature. 497 (7451), 628-632 (2013).
- Bischoff, M., et al. Cytonemes are required for the establishment of a normal Hedgehog morphogen gradient in Drosophila epithelia. Nature Cell Biology. 15 (11), 1269-1281 (2013).
- Hall, E. T., et al. Cytoneme delivery of sonic hedgehog from ligand-producing cells requires Myosin 10 and a dispatched-BOC/CDON co-receptor complex. eLife. 10, 61432 (2021).
- Huang, H., Kornberg, T. B. Cells must express components of the planar cell polarity system and extracellular matrix to support cytonemes. eLife. 5, 18979 (2016).
- Brunt, L., et al. Vangl2 promotes the formation of long cytonemes to enable distant Wnt/β-catenin signaling. Nature Communications. 12 (1), 2058 (2021).
- Roy, S., Huang, H., Liu, S., Kornberg, T. B. Cytoneme-mediated contact-dependent transport of the Drosophila decapentaplegic signaling protein. Science. 343 (6173), 1244624 (2014).
- Mattes, B., et al. Wnt/PCP controls spreading of Wnt/β-catenin signals by cytonemes in vertebrates. eLife. 7, 36953 (2018).
- Bodeen, W. J., Marada, S., Truong, A., Ogden, S. K. A fixation method to preserve cultured cell cytonemes facilitates mechanistic interrogation of morphogen transport. Development. 144 (19), 3612-3624 (2017).
- Hall, E. T., Ogden, S. K. Preserve cultured cell cytonemes through a modified electron microscopy fixation. Bio-protocol. 8 (13), (2018).
- American Veterinary Medical Association. AVMA guidelines for the euthanasia of animals. American Veterinary Medical Association. , (2020).
- Harfe, B. D., et al. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-528 (2004).
- Chamberlain, C. E., Jeong, J., Guo, C., Allen, B. L., McMahon, A. P. Notochord-derived Shh concentrates in close association with the apically positioned basal body in neural target cells and forms a dynamic gradient during neural patterning. Development. 135 (6), 1097-1106 (2008).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Bacallao, R., Sohrab, S., Phillips, C., Pawley, J. B. . Handbook Of Biological Confocal Microscopy. , 368-380 (2006).
- Tagliaferro, P., Tandler, C. J., Ramos, A. J., Pecci Saavedra, J., Brusco, A. Immunofluorescence and glutaraldehyde fixation. A new procedure based on the Schiff-quenching method. Journal of Neuroscience Methods. 77 (2), 191-197 (1997).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Scientific Reports. 6 (1), 1-13 (2016).
- Clendenon, S. G., Young, P. A., Ferkowicz, M., Phillips, C., Dunn, K. W. Deep tissue fluorescent imaging in scattering specimens using confocal microscopy. Microscopy and Microanalysis. 17 (4), 614-617 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten