Method Article
Visualisierung und Quantifizierung pharmazeutischer Verbindungen in der Haut mittels kohärenter Raman-Streubildgebung
In diesem Artikel
Zusammenfassung
Eine kohärente Raman-Streubildgebungsmethodik zur Visualisierung und Quantifizierung pharmazeutischer Verbindungen in der Haut wird beschrieben. Dieses Papier beschreibt die Vorbereitung von Hautgewebe (Mensch und Maus) und die topische Formulierungsanwendung, die Bildaufnahme zur Quantifizierung der räumlich-zeitlichen Konzentrationsprofile und die vorläufige pharmakokinetische Analyse zur Beurteilung der topischen Arzneimittelabgabe.
Zusammenfassung
Die kutane Pharmakokinetik (cPK) nach topischer Formulierungsanwendung war ein Forschungsgebiet von besonderem Interesse für Regulierungs- und Arzneimittelentwicklungswissenschaftler, um die topische Bioverfügbarkeit (BA) mechanistisch zu verstehen. Semi-invasive Techniken wie Tape-Stripping, dermale Mikrodialyse oder dermale Open-Flow-Mikroperfusion quantifizieren alle die cPK auf der Makroskala. Während diese Techniken ein umfangreiches cPK-Wissen geliefert haben, fehlt der Gemeinschaft ein mechanistisches Verständnis der Penetration und Permeation von Wirkstoffen (API) auf zellulärer Ebene.
Ein nichtinvasiver Ansatz zur Behandlung von cPK im Mikromaßstab ist die kohärente Raman-Streubildgebung (CRI), die selektiv auf intrinsische molekulare Schwingungen abzielt, ohne dass extrinsische Markierungen oder chemische Modifikationen erforderlich sind. CRI verfügt über zwei Hauptmethoden - kohärente Anti-Stokes-Raman-Streuung (CARS) und stimulierte Raman-Streuung (SRS), die eine empfindliche und selektive Quantifizierung von APIs oder inaktiven Inhaltsstoffen ermöglichen. CARS wird typischerweise verwendet, um strukturelle Hautinformationen abzuleiten oder chemische Kontraste zu visualisieren. Im Gegensatz dazu wird das SRS-Signal, das linear mit der molekularen Konzentration ist, verwendet, um APIs oder inaktive Inhaltsstoffe innerhalb von Hautschichtungen zu quantifizieren.
Obwohl Mausgewebe üblicherweise für cPK mit CRI verwendet wurde, müssen topische BA und Bioäquivalenz (BE) letztendlich in menschlichem Gewebe vor der behördlichen Zulassung beurteilt werden. Dieses Papier stellt eine Methodik zur Vorbereitung und Abbildung von Ex-vivo-Haut vor, die in quantitativen pharmakokinetischen CRI-Studien bei der Bewertung von topischem BA und BE verwendet werden soll. Diese Methodik ermöglicht eine zuverlässige und reproduzierbare API-Quantifizierung in der Haut von Mensch und Maus im Laufe der Zeit. Die Konzentrationen in lipidreichen und lipidarmen Kompartimenten sowie die Gesamt-API-Konzentration im Laufe der Zeit werden quantifiziert; Diese werden für Schätzungen von mikro- und makroskaligen BA und möglicherweise BE verwendet.
Einleitung
Die Methoden zur Bewertung der cPK nach der Anwendung des topischen Arzneimittels haben sich von klassischen In-vitro-Permeationstests (IVPT) Studien 1,2,3,4,5 und Tape-Stripping 6,7,8 auf zusätzliche Methoden wie Open-Flow-Mikroperfusion oder dermale Mikrodialyse 9,10,11 ausgeweitet. 12,13,14. Es gibt potenziell verschiedene lokale Orte therapeutischer Wirkung, abhängig von der interessierenden Krankheit. Daher kann es eine entsprechende Anzahl von Methoden geben, um die Geschwindigkeit und das Ausmaß zu bewerten, mit der eine API an den beabsichtigten lokalen Ort der Aktion gelangt. Während jede der oben genannten Methoden ihre Vorteile hat, ist der Hauptnachteil der Mangel an cPK-Informationen im Mikromaßstab (dh die Unfähigkeit zu visualisieren, wohin die API geht und wie sie durchdringt).
Eine nichtinvasive Methodik von Interesse zur Schätzung von topischem BA und BE ist CRI, die in zwei Bildgebungsmodalitäten unterteilt werden kann: CARS und SRS-Mikroskopie. Diese kohärenten Raman-Methoden ermöglichen eine chemisch spezifische Bildgebung von Molekülen über nichtlineare Raman-Effekte. In CRI werden zwei Laserpulszüge fokussiert und innerhalb einer Probe gescannt; Der Energieunterschied zwischen den Laserfrequenzen wird so eingestellt, dass er auf Schwingungsmoden abzielt, die für die interessierenden chemischen Strukturen spezifisch sind. Da CRI-Prozesse nichtlinear sind, wird ein Signal nur am Mikroskopfokus erzeugt, was eine dreidimensionale pharmakokinetische tomographische Abbildung des Gewebes ermöglicht. Im Rahmen von cPK wurde CARS verwendet, um gewebestrukturelle Informationen zu erhalten, wie z.B. die Lage lipidreicher Hautstrukturen15. Im Gegensatz dazu wurde SRS verwendet, um die molekulare Konzentration zu quantifizieren, da sein Signal linear mit der Konzentration ist. Für Ex-vivo-Hautproben ist es vorteilhaft, CARS in der epi-Richtung16 und SRS im Getriebemodus17 durchzuführen. Daher ermöglichen dünne Gewebeproben die Erkennung und Quantifizierung von SRS-Signalen.
Als Modellgewebe bietet das nackte Mausohr mehrere Vorteile mit kleineren Nachteilen. Ein Vorteil ist, dass das Gewebe bereits ~200-300 μm dick ist und keine weitere Probenvorbereitung erfordert. Darüber hinaus werden mehrere Hautschichtungen durch axiale Fokussierung durch ein Sichtfeld (z. B. Stratum corneum, Talgdrüsen (SGs), Adipozyten und subkutanes Fett) beobachtet16,18. Dies ermöglicht eine vorläufige präklinische Abschätzung der kutanen Permeationswege und topische BA-Schätzungen, bevor zu menschlichen Hautproben übergegangen wird. Das Nacktmausmodell weist jedoch Einschränkungen auf, wie z. B. Schwierigkeiten bei der Extrapolation auf In-vivo-Szenarien aufgrund von Unterschieden in der Hautstruktur19. Während das nackte Mausohr ein ausgezeichnetes Modell ist, um vorläufige Ergebnisse zu erhalten, ist das Modell der menschlichen Haut der Goldstandard. Obwohl es verschiedene Kommentare zur Eignung und Anwendbarkeit gefrorener menschlicher Haut zur genauen Rekapitulation der In-vivo-Permeationskinetik gegeben hat 20,21,22, ist die Verwendung von gefrorener menschlicher Haut eine anerkannte Methode zur Bewertung der In-vitro-API-Permeationskinetik 23,24,25 . Dieses Protokoll visualisiert verschiedene Hautschichten in der Haut von Mäusen und Menschen und quantifiziert die API-Konzentrationen in lipidreichen und lipidarmen Strukturen.
Während CRI in zahlreichen Bereichen eingesetzt wurde, um Verbindungen in Geweben spezifisch sichtbar zu machen, gab es begrenzte Bemühungen, die cPK von topisch applizierten Arzneimitteln zu untersuchen. Um den topischen BA/BE von topischen Produkten mit CRI zu bewerten, ist es notwendig, zunächst ein standardisiertes Protokoll zu haben, um genaue Vergleiche anzustellen. Frühere Bemühungen mit CRI für die Arzneimittelabgabe an die Haut haben eine Variabilität innerhalb der Daten gezeigt. Da es sich um eine relativ neue Anwendung von CRI handelt, ist die Erstellung eines Protokolls von entscheidender Bedeutung, um zuverlässige Ergebnisse zu erhalten 18,26,27. Dieser Ansatz zielt nur auf eine bestimmte Wellenzahl im biologisch stillen Bereich des Raman-Spektrums ab. Die meisten APIs und inaktiven Inhaltsstoffe weisen jedoch Raman-Verschiebungen innerhalb des Fingerabdruckbereichs auf. Dies stellte bisher aufgrund des inhärenten Signals, das vom Gewebe im Fingerabdruckbereich ausgeht, vor Herausforderungen. Jüngste Fortschritte in den Bereichen Laser und Berechnung haben diese Barriere beseitigt, die auch in Kombination mit dem hier vorgestellten Ansatz genutzt werden kann28. Dieser hier vorgestellte Ansatz ermöglicht die Quantifizierung einer API, die eine Raman-Verschiebung in der stillen Region (2.000-2.300 cm-1) aufweist. Dies ist nicht auf die physiochemischen Eigenschaften des Arzneimittels beschränkt, was bei einigen zuvor erwähnten cPK-Überwachungsmethoden der Fall sein könnte29.
Das Protokoll muss die Variabilität der Hautdicke von Probe zu Probe für verschiedene Präparate reduzieren, da dicke menschliche Hautproben nach der Anwendung des Arzneimittels aufgrund der Lichtstreuung durch die dicke Probe ein minimales Signal erzeugen. Ein Ziel dieses Manuskripts ist es, eine Methodik der Gewebepräparation vorzustellen, die reproduzierbare Bildgebungsstandards gewährleistet. Darüber hinaus ist das CRI-System wie beschrieben eingerichtet, um potenzielle Fehlerquellen zu reduzieren und Signal-Rauschen zu minimieren. Dieses Papier wird jedoch nicht die Leitprinzipien und technischen Vorteile des CRI-Mikroskops diskutieren, da dies zuvorbehandelt wurde 30. Schließlich wird das umfangreiche Datenanalyseverfahren untersucht, um eine Interpretation der Ergebnisse zu ermöglichen, um den Erfolg oder Misserfolg eines Experiments zu bestimmen.
Protokoll
Die Verwendung von nacktem Mausohrgewebe wurde vom Massachusetts General Hospital Institutional Animal Care and Use Committee (IACUC) genehmigt, während die Verwendung von menschlichem Hautgewebe vom Massachusetts General Hospital Institutional Review Board (IRB) genehmigt wurde. Gemäß den IACUC-Protokollen wurden frisch eingeschläferte Mäuse von Kollaborateuren mit nackten Mäusekolonien erhalten. Menschliches Gewebe wurde aus elektiven Abdominoplastik-Verfahren am Massachusetts General Hospital über ein genehmigtes Protokoll gewonnen. Darüber hinaus wurden bestimmte andere Gewebetypen als die Bauchhaut über eine Körperspendebehörde erworben, ebenfalls durch ein vom IRB genehmigtes Protokoll.
1. Vorbereitung des Gewebes
- Vorbereitung von nacktem Mausohrhautgewebe
- Nachdem Sie frisch geerntete nackte Mauskörper erworben haben, entfernen Sie die Ohren mit einer Pinzette und einer mikrochirurgischen Schere. Legen Sie ein Ohr in eine kleine Petrischale (d. h. 35 mm x 10 mm). Legen Sie den nackten Mauskörper in einen Biohazard-Beutel, der gemäß den lokalen IACUC-Protokollen entsorgt werden soll.
- Spülen Sie jedes Mausohr mit phosphatgepufferter Kochsalzlösung (PBS) aus und tupfen Sie es vorsichtig mit einem Aufgabenwischer trocken. Wiederholen Sie den Vorgang zweimal, um Restschmutz oder Ablagerungen am Ohr zu entfernen, die die Bildqualität beeinträchtigen können (siehe Abbildung 1).
- Wenn das Ohr innerhalb von 24 h benutzt werden soll, legen Sie es in eine kleine Petrischale (d.h. 35 mm x 10 mm) mit frischem PBS in einen Kühlschrank (2-8 °C). Wenn das Ohr nach 24 Stunden nach der Ernte verwendet wird, legen Sie es in eine Petrischale (35 mm x 10 mm) ohne PBS, bedecken Sie die Schale mit Parafilm und legen Sie sie in einen Gefrierschrank von -20 ° C.
- Präparation von menschlichem Hautgewebe
- Nach der Beschaffung von menschlichem Gewebe legen Sie es in eine große Petrischale (d. h. 60 mm x 15 mm) in einer biologischen Haube, um genügend Platz für die Probenvorbereitung zu schaffen.
- Platzieren Sie die Stratum corneum-Seite mit dem Gesicht nach unten, so dass das subkutane Fett zugänglich ist.
- Beginnen Sie mit einer Pinzette und einer mikrochirurgischen Schere, das Unterhautfett vorsichtig zu entfernen. Sobald das Unterhautfett nicht mehr mit der Schere entfernt werden kann, wechseln Sie zu einem 10-Blatt-Einwegskalpell (oder einem gleichwertigen Skalpell), um das verbleibende subkutane Fett zu entfernen. Verwenden Sie das Skalpell in einem Winkel von 45° zur Haut, während Sie die Haut mit einer Pinzette ruhig halten (siehe Abbildung 1).
HINWEIS: Um qualitativ hochwertige Transmissions-SRS-Bilder zu erhalten, müssen die Proben so dünn wie möglich sein, ohne durchstochen zu werden.

Abbildung 1: Bilder mit idealer Dicke für die Abbildung von Maus- und Menschenhaut. (A) Mausohrhaut gegen Licht gehalten, das sichtbar Licht durchlassen kann. (B) Ideale menschliche Haut, die nach der Zubereitung an Licht gehalten wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Schneiden Sie die menschliche Haut in 1 cm x 1 cm große Stücke.
HINWEIS: Frische Haut, kann bis zu 24 h ohne die Verwendung eines Agarosegelbettes verwendet werden, wie zuvorbeschrieben 31. Frische Haut kann jedoch länger verwendet werden, wenn sie auf einem Agarosegelbett aufbewahrt wird. Soll die Haut später verwendet werden, wird die Haut in einen Probentransportbeutel gegeben und dann in einen -20 °C Gefrierschrank gelegt. Gefrorene Haut muss mit dem folgenden Verfahren aufgetaut werden, um optimale Ergebnisse zu erzielen (siehe Schritt 3.1.2).
2. Laser- und Mikroskopaufbau
- Schalten Sie ca. 30 Minuten vor der Bildgebung den breit abstimmbaren Ultrakurzpulslaser (im Folgenden als Laser bezeichnet) ein und lassen Sie ihn aufwärmen. Aktivieren Sie das Laserwarn-Zeichen-/Schlosssystem, um das Personal außerhalb des Geschehens beim Betreten über potenzielle Gefahren zu informieren.
HINWEIS: Bei der Arbeit mit Lasern der Klasse IV muss immer eine geeignete Brille getragen werden. Für den hier verwendeten spezifischen Laser ist die empfohlene richtige Brille OD ≥ 6 für den Arbeitsbereich des Lasers 800-1.300 nm. - Während sich der Laser erwärmt, aktivieren Sie die verbleibende Hardware für die Mikroskopsteuerung, CARS-Erkennung und SRS-Erkennung.
- Richten Sie das Mikroskop richtig aus, um eine optimale Bildgebung zu gewährleisten. Klicken Sie im Fenster Bildaufnahmesteuerung in der Mikroskopsteuerungssoftware (im Folgenden MC-Software) auf die Transmissionslampe , damit Licht von der Durchleuchtungslampe des Mikroskops kommen kann.
- Sorgen Sie für eine korrekte Köhler-Ausleuchtung, um das Mikroskop entlang der vertikalen Achse auszurichten: Schließen Sie die Iris nach unten, so dass ein Minimum an Licht durch das Okular32 gesehen wird.
- Während Sie durch das Okular schauen, öffnen Sie die Iris, um zu sehen, ob das Polygon alle Seiten gleichzeitig berührt. Stellen Sie die Kondensatorhöhe ein, wenn vor dem Öffnen der Iris keine Polygonform zu sehen ist.
- Wenn die Polygonform nicht alle Seiten gleichzeitig berührt, passen Sie die Position der Blendenausrichtung mithilfe der Einstellknöpfe an.
HINWEIS: Siehe Sanderson et al.33 für ein detailliertes Mikroskop-Setup. - Legen Sie einen Objektträger mit einem Deckglas und einem doppelseitigen Abstandshalter, der eine Ölprobe enthält (z. B. Olivenöl, da es viele -CH2-Bindungen in Ölen gibt), auf den Mikroskop-Bühnenhalter.
- Suchen Sie im Fenster Erfassungseinstellungen der MC-Software das Dropdown-Menü des Mikroskops und stellen Sie das Mikroskopobjektiv auf 20x ein.
- Stellen Sie sicher, dass der CARS-Erkennungsfilter (645 nm/50 nm) in Position ist, um das epiCARS-Signal entlang der Photomultiplierröhre des mikroskopseitigen Ports zu visualisieren und zu messen.
HINWEIS: Dieser spezielle Filter wird für die Abbildung von Lipiden als Anti-Stokes-CARS-Signal ausgewählt, das bei 652 nm für eine Pumpwellenlänge von 803 nm und eine Stokes-Wellenlänge von 1.040 nm erzeugt wird (siehe Gl. (1)). (1)
(1)
Dabei haben die λ-Variablen die Einheiten nm; λPumpe ist die Wellenlänge des Pumpstrahls; und λ Stokes ist die Stokes-Strahlwellenlänge. - Schauen Sie durch das Okular, um die Kante der Ölprobe zu finden, die verwendet wird, um die Ausrichtung des Systems zu überprüfen.
- Stellen Sie mit den Fokusknöpfen am Mikroskop sicher, dass sich die Kante im Z-Fokus befindet, und stellen Sie den Bühnenregler ein, um den XY-Fokus zu erhalten.
- Nachdem sich der Laser aufgewärmt hat, stellen Sie den Pumpenstrahl auf 803 nm ein, wobei die Motorfeinabstimmung in der grafischen Benutzeroberfläche des Lasers auf 50,0 eingestellt ist. Die genaue Motorfeinabstimmung kann von Setup zu Setup unterschiedlich sein.
HINWEIS: Der Pumpstrahl ist der einzige Strahl mit einer einstellbaren Wellenlänge auf diesem Laser, da die Wellenlänge des Stokes-Strahls auf 1.040 nm festgelegt ist. Diese Konfiguration zielt auf die CH-Schwingung bei 2850 cm-1 ab (siehe Gl. (2) zur Berechnung der Pumpenwellenlänge für das Wellenzahl-Targeting). (2)
(2)
Wobei Einheiten der relativen Wellenzahl (cm−1) und λ Variablen Einheiten in cm haben.
Einheiten der relativen Wellenzahl (cm−1) und λ Variablen Einheiten in cm haben. - Überprüfen Sie die Ausrichtung des Lasers auf das Mikroskop vor der Bildgebung; siehe Abbildung 2 für die Darstellung des Laserpfades. Installieren Sie bei der Ersteinrichtung des Mikroskops zwei Iris im Strahlengang als Hilfsmittel für die korrekte Ausrichtung in das Mikroskop. Da der optische Pfad des Lasers im Laufe der Zeit driften kann, stellen Sie sicher, dass die Laserstrahlpfade die Mitte der Iris so durchqueren, dass sie korrekt in das Mikroskop gelangen.
- Schließen Sie mit dem IR-Viewer alle Iris vollständig und stellen Sie sicher, dass der Strahl auf beiden zentriert ist: zuerst auf der Iris, die dem Laser am nächsten ist, und schließlich am Mikroskopeingang.
- Überprüfen Sie zuerst den Pumpenstrahl, um sicherzustellen, dass der Strahl gerade in das Mikroskop geht. Sobald die Pumpe ausgerichtet ist, überprüfen Sie, ob der Stokes-Strahl auch korrekt in das Mikroskop gelangt.
- Wenn die Balken nicht durch die Iris ausgerichtet sind, führen Sie die Balken iterativ durch die Iris mit den x- und y-Einstellknöpfen der beiden Spiegelhalterungen für die Pumpe und die Stokes-Balkenwege.
- Sobald sich die Strahlflecken überlappen, bevor Sie in das Mikroskop eintreten, überprüfen Sie, ob sie das Mikroskop korrekt durchqueren.
- Klicken Sie im Fenster Image Acquisition Control der MC-Software auf den TD-Kanal für die Übertragung, ALG1 (Analogkanal 1) für den kohärenten Anti-Stokes-Raman-Kanal und ALG2 (Analogkanal 2) für den stimulierten Raman-Streukanal. Verwenden Sie die folgenden Einstellungen (wie in diesem Protokoll): Verstärkung von 1 und ein Offset von -1 für ALG1, Verstärkung von 1,25 und Offset von -2 für ALG2.
HINWEIS: Je nach Systemkonfiguration können analoge Kanäle unterschiedliche Nummerierungen für einzelne Bildkanäle aufweisen. Wenn der SRS-Detektor vorhanden ist, gibt es kein Übertragungssignal, da kein Licht durchdringen kann (dh man kann in diesem Setup keine Bilder mit TD und ALG2 gleichzeitig visualisieren).
- Klicken Sie im Fenster Image Acquisition Control der MC-Software auf den TD-Kanal für die Übertragung, ALG1 (Analogkanal 1) für den kohärenten Anti-Stokes-Raman-Kanal und ALG2 (Analogkanal 2) für den stimulierten Raman-Streukanal. Verwenden Sie die folgenden Einstellungen (wie in diesem Protokoll): Verstärkung von 1 und ein Offset von -1 für ALG1, Verstärkung von 1,25 und Offset von -2 für ALG2.

Abbildung 2: Schematische Anordnung für einen kohärenten Raman-Laserbildgebungspfad. Die Strahlen werden unabhängig voneinander für die Spotgröße konditioniert und über eine Zeitverzögerungsstufe angepasst, um eine kohärente Raman-Streuung in Samples für die gewünschte Abstimmfrequenz zu erzeugen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Schalten Sie den Leistungsmesser ein und messen Sie mit einem Hochleistungs-Wärmeleistungssensor die Leistung der Pumpe und der Stokes-Strahlen einzeln für das Experiment.
HINWEIS: In diesem speziellen Beispiel betrug die Pumpenstrahlleistung 80 mW, während die Stokes-Strahlleistung vor dem Eintritt in das Mikroskop 180 mW betrug. - Klicken Sie im Fenster Bildaufnahmesteuerung auf die Schaltfläche Focus x2, um das Bild in der MC-Software anzuzeigen.
- Stellen Sie im Fenster Erfassungseinstellungen sicher, dass das Pixelverhältnis und die Verweildauer auf die gewünschten Parameter für das Experiment eingestellt sind.
HINWEIS: In diesem Protokoll wurden ein Pixelverhältnis von 1.024 x 1.024 und eine Verweilzeit von 2 μs/Pixel verwendet. - Bestätigen Sie die Laserausrichtung in Bezug auf das Mikroskop, indem Sie den Pumpstrahl entsperren und den TD-Kanal betrachten.
HINWEIS: Der Laser ist richtig ausgerichtet, wenn der Strahl im Bild zentriert mit den richtigen Detektoreinstellungen zu sehen ist. - Verwenden Sie andernfalls die X- und Y-Einstellknöpfe am Periskop, um den Strahl in der Mitte des Bildes neu zu positionieren.
- Bestätigen Sie die Ausrichtung von Laser und Mikroskop, indem Sie dasselbe Bild sowohl im CARS- als auch im SRS-Kanal sehen.
- Um das Ausrichtungsbild zu erfassen, klicken Sie im Fenster Bildaufnahmesteuerung mit dem entsprechenden Filtermodus (z. B. Kalman Line 3) auf die Schaltfläche XY-Scan.
- Speichern Sie diesen Satz von Bildern mit einem beschreibenden Dateinamen, um ihn im Laufe der Zeit zu vergleichen und die Systemleistung/-ausrichtung zu bestätigen.
3. Lipid-Bildgebung
- Mausohr und menschliches Gewebe
- Wenn Sie frisches Tuch verwenden, überspringen Sie Schritt 3.1.2.
- Entfernen Sie die Mausohrhaut aus dem -20 °C Gefrierschrank und legen Sie sie für 10 min in eine Inkubationskammer (32 °C). Entfernen Sie das Mausohr aus der Inkubationskammer.
HINWEIS: Siehe Schritt 1.1.2. Zur Vorbereitung der Mausohrhaut. Eine grobe Handhabung oder ein Abkratzen des Gewebes kann zu einem mechanischen Abbau, einer Zerstörung oder einer Störung des Gewebes, insbesondere des Stratum corneum, führen. - Wenn Sie ein nacktes Mausohr verwenden, legen Sie den vorderen Teil des Ohres in Richtung des Glasbodens einer 35 mm großen Schale Nr. 0. Wenn Sie menschliche Haut verwenden, legen Sie sie mit dem Stratum corneum mit dem Gesicht nach unten, da dies die Quantifizierung des Arzneimittels von den oberflächlichen Schichten in die tieferen Schichten ermöglicht (Abbildung 1).
HINWEIS: Der hintere Teil des nackten Mausohrs ist anfälliger für Unvollkommenheiten durch das Gehäuse. Wenn die menschliche Haut nicht mit der Stratum corneum-Seite platziert wird, die auf dem umgekehrten Mikroskop nach unten zeigt, kann man nicht an der Dermis vorbeisehen, da eine beträchtliche Menge an Licht gestreut ist und das Medikament, das in das Stratum corneum eindringt, nicht gesehen werden kann. - Sobald das Gewebe auf dem Glasboden zentriert wurde, verwenden Sie einen Applikator mit Baumwollspitze, um sicherzustellen, dass die Haut flach ist und vollständigen Kontakt mit der Deckglasoberfläche der Glasbodenschale hat.
HINWEIS: Dies ist ein Schritt, der Schwierigkeiten bei der Abbildung der Haut verursachen kann, wenn sie nicht vollständig flach ist. - Legen Sie eine Unterlegscheibe auf die Haut, um Bewegungen während der Bildgebung zu verhindern. Stellen Sie sicher, dass das Gewebe durch das mittlere Loch der Unterlegscheibe für die SRS-Transmissionserkennung sichtbar ist.
- Entfernen Sie den Schiebetischeinsatz und ersetzen Sie ihn durch die Inkubationskammer, in der sich der einzelne Schaleneinsatz befindet.
- Legen Sie die Glasbodenschale mit dem Hautgewebe in den Einzelschalenaufsatz der Inkubationskammer.
HINWEIS: Alternativ können Sie eine 6-Well-Platte verwenden, um mehrere Hautproben und Formulierungen gleichzeitig abzubilden. - Verringern Sie das Pixelverhältnis im Fenster "Erfassungseinstellungen" der MC-Software (z. B. von 1.024 x 1.024 auf 512 x 512), um die Galvo-Scangeschwindigkeit zu beschleunigen, während die Z-Tiefe geändert wird, um das Stratum corneum zu finden (siehe Abbildung 3A für die Maus oder Abbildung 3E für den Menschen).
- Nachdem das Stratum corneum gefunden wurde, registrieren Sie diese axiale Position als Nullposition im Fenster Erfassungseinstellungen und ändern Sie das Pixelverhältnis für jedes spezifische Experiment (z. B. 1.024 x 1.024).
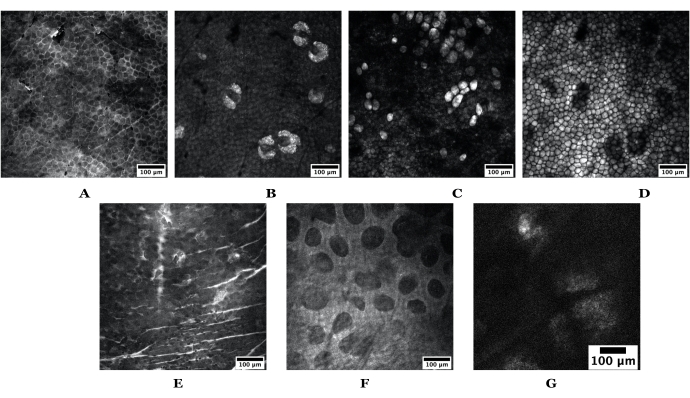
Abbildung 3: Beispiel für mit SRS ermittelte Hauttiefen. Die oberen Bilder stammen aus nackter Mausohrhaut, die Folgendes darstellt: (A) stratum corneum, (B) Talgdrüsen, (C) Adipozyten, (D) subkutanes Fett. Der untere Satz von Bildern stammt von menschlicher Haut, die Folgendes darstellen: (E) Stratum corneum, (F) papilläre Dermis und (G) eine Talgdrüse. Maßstabsstäbe = 100 μm. Sowohl Maus- als auch menschliche Hautbilder wurden mit einem 20-fachen Objektiv bei 1024 Pixeln x 1024 Pixeln aufgenommen; das menschliche SG wurde mit 512 x 512 Pixeln aufgenommen. Abkürzungen: SRS = stimulierte Raman-Streuung; SG = Talgdrüse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Anwendung der topischen Formulierung
- Die vorgegebene Formulierungsdosis auf die Haut pipettiert (z. B. 10 μL/cm2).
HINWEIS: Die Viskosität der Formulierung spielt eine Rolle bei der Pipettenwahl. Die Verwendung einer Verdrängungspipette für viskose Formulierungen, wie Cremes oder Gele, und einer Luftverdrängungspipette für Lösungen wird empfohlen. In diesem Experiment war Ruxolitinib die Modellverbindung in einer einfachen Lösung von Propylenglykol (Propan-1,2-diol). - Reiben Sie die Formulierung 30 s lang mit der Kolbenspitze einer Spritze oder einem behandschuhten Finger im Uhrzeigersinn. Beachten Sie den Zeitpunkt, zu dem die Formulierung für eine spätere cPK-Analyse angewendet wird (siehe Schritte 6.15-6.17 unten).
HINWEIS: Die Dauer der Anwendung hängt vom Experiment ab; Jeder kann anders sein. - Nachdem die vorgegebene Zeit für das Eindringen der Formulierung abgelaufen ist, entfernen Sie die überschüssige Formulierung und legen Sie die Haut mit der Formulierungsseite in Richtung der Glasbodenschale.
HINWEIS: Die Formulierung wird mit einem empfindlichen Aufgabenwischer oder einem kleinen (~ 1 Zoll) 3D-gedruckten Rakel in eine einzige Richtung (z. B. von Norden nach Süden) entfernt.
5. Versuchsaufbau zur Wirkstoffquantifizierung
- Stellen Sie den Pumpenstrahl auf 803 nm ein. Überprüfen Sie die Pump- und Stokes-Strahlleistungen mit der Fotodiode, um sicherzustellen, dass sie die gewünschten Leistungen für das Experiment haben. Entsperren Sie jeden Strahl einzeln, um die Leistung zu messen und die Strahlen erneut zu blockieren.
HINWEIS: In diesem speziellen Beispiel betrug die Pumpenstrahlleistung 100 mW, während die Stokes-Strahlleistung 180 mW betrug. - Stellen Sie die Glasbodenschale in eine Inkubationskammer mit einem Einsatz für eine Glasbodenschale. Befestigen Sie die Schale mit Clips, um Bewegungen während der Bildgebung zu verhindern.
- Schalten Sie die Transmissionslampe in der MC-Software ein. Wenn Sie durch das Okular schauen, stellen Sie den axialen Fokus mit dem Einstellknopf ein, um sicherzustellen, dass das Gewebe im Fokus ist.
- Entsperren Sie sowohl die Pumpe als auch die Stokes-Strahlen. Stellen Sie sicher, dass die Kanäle ALG1 und ALG2 aktiviert sind, und klicken Sie dann in der MC-Software auf Focus x2, um die Haut in den CARS- und SRS-Kanälen zu visualisieren. Stellen Sie sicher, dass sich die SRS-Fotodiode über dem Kondensator befindet.
- Klicken Sie im Dropdown-Menü Gerät auf Multi Area Time Lapse (MATL). Achten Sie darauf, dass eine XY-Stufenwarnung angezeigt wird. Wenn sich die Bühne bewegt, um ihren mechanischen Ursprung zu finden, klicken Sie auf OK.
- Gehen Sie im MATL-Modul zu Ansicht und klicken Sie dann in der MC-Software auf Liste registrierter Punkte. Beginnen Sie, entweder 1) spezifische Tiefen innerhalb der Haut (dh Stratum corneum, SGs, Adipozyten, subkutanes Fett, wie während der Live-Bildgebung mit lipidabgestimmtem Kontrast bestimmt) oder 2) XY-Positionen hinzuzufügen, wenn ganze Tiefenstapel genommen werden sollen. Beispiele siehe Abbildung 3.
- Sobald das Stratum corneum identifiziert ist, scrollen Sie durch den axialen Fokus (oder Z-Fokus), um bestimmte oben erwähnte Gewebeschichtungen zu identifizieren. Siehe Abbildung 3 für Beispiele in der Haut von Mensch und Maus.
- Bei der Abbildung bestimmter Tiefen im Gegensatz zu vollständigen Z-Tiefenstapeln klicken Sie für jede Hautschichtung auf Punkt registrieren, um sie der MATL-Warteschlange hinzuzufügen. Klicken Sie bei Stapeln mit voller Tiefe im Fenster Erfassungsparameter auf Punkt registrieren für jede XY-Position mit Tiefenauswahl.
- Sobald alle gewünschten XY- (Full Z-Depth Stacks) oder XYZ (spezifische Hautschichtungen) Positionen in der MATL-Software registriert wurden, ändern Sie das Dateiverzeichnis und den Namen in einer Weise, die während der gesamten Experimente für Bild- und cPK-Analysen konsistent ist (siehe Schritte 6.15- 6.17).
- Setzen Sie die Anzahl der Wiederholungen im MATL-Modul auf 1 und klicken Sie auf Bereit. Warten Sie, bis Play von einem grauen zu einem schwarzen Pfeil wechselt, was darauf hinweist, dass die Software bereit ist. Drücken Sie Play , um mit der Abbildung des vorläufigen Lipidstapels (im Folgenden " Lipidbilder") zu beginnen.
HINWEIS: Dies wird verwendet, um lipidreiche und lipidarme Regionen einzelner Gewebeschichtungen während der Analyse zu trennen. Der Zyklus und die Gesamtzeit sind unten rechts in der registrierten Punkteliste angegeben. - Sobald der Zyklus abgeschlossen ist, blockieren Sie sowohl die Pumpe als auch die Stokes-Balken. Ändern Sie die Wellenlänge auf der grafischen Benutzeroberfläche des Lasers auf die gewünschte Wellenlänge, basierend auf der angestrebten Wellenzahl oder Raman-Schwingung.
HINWEIS: Beispielsweise werden 843 nm für den Pumpenstrahl verwendet, um 2.250 cm-1 unter Verwendung von Gl. (2) anzuvisieren, und die Motorfeinabstimmung wird auf 50,1 geändert. Das hier vorgestellte Beispielmedikament, Ruxolitinib, enthält ein Nitril, das auf 2.250 cm-1 ausgerichtet werden kann. Die Wellenzahl, die für die Hautstruktur anvisiert wird, ist immer die gleiche (2.850 cm-1); Die Wellenzahl für eine API kann jedoch eine beliebige Wellenzahl sein, muss aber a priori bekannt oder berechnet sein. - Passen Sie die manuelle Zeitverzögerungsstufe (Abbildung 2) an, um eine zeitliche Überlappung für die neue Wellenlänge und die Pumpenstrahlleistung sicherzustellen. Stellen Sie sicher, dass die gleichen Kräfte sowohl für die Lipid- als auch für die API-Bildgebung verwendet werden, die a priori festgelegt wurden.
- Verwenden Sie die Dauer pro Zyklus, um die Gesamtzahl der pro Experiment erforderlichen Wiederholungen zu berechnen. Teilen Sie einfach den gesamten gewünschten Zeitverlauf des Experiments durch den der Zyklusdauer.
HINWEIS: Die Zyklusdauer ist eine Funktion der Bildgröße, der Pixelverweildauer, der Kalman-Mittelwertbildung und der Anzahl der Bilder pro Zyklus. Die Optimierung dieser Parameter verkürzt die Zykluszeit und erhöht so die zeitliche Auflösung. - Sobald die Gesamtzahl der Zykluswiederholungen ausgewählt wurde, entsperren Sie den Pumpenstrahl, überprüfen Sie die Leistung mit der Fotodiode und stellen Sie sicher, dass sie der gewünschten Leistung entspricht. Entsperren Sie schließlich den Stokes-Strahl, um die Bildgebung zu ermöglichen.
- Drücken Sie Play , um mit der automatisierten Abbildung der Sollwerte zu beginnen.
- Nachdem die MATL-Bildgebung abgeschlossen ist, schalten Sie den Pumpstrahl wieder auf 803 nm und stellen Sie die Leistung wieder auf die ursprüngliche Lipidbildgebungsleistung ein, die in Schritt 5.1 verwendet wurde.
- Ändern Sie wie in den vorherigen Schritten den Dateinamen so, dass er für Bilder nach dem Experiment während der gesamten Studie konsistent ist.
- Legen Sie die Anzahl der Wiederholungen auf 1 fest.
- Klicken Sie auf Bereit | Play-Taste , um einen Lipidstapel nach dem Zeitverlauf zu erfassen und sicherzustellen, dass während der Bildgebung keine Gewebebewegung stattgefunden hat (Abbildung 4).

Abbildung 4: Gewebebewegung in nackter Mausohrhaut, demonstriert durch die Visualisierung von Talgdrüsen. Ein Beispiel für eine begrenzte Gewebebewegung ist in A und B dargestellt, während eine wesentliche Gewebebewegung in C und D dargestellt ist. (A) zeigt die Talgdrüsen zum Zeitpunkt der Formulierungsanwendung und (B) die gleiche Tiefe bei 120 min nach der Anwendung. (C) Talgdrüsen der Maus zum Zeitpunkt der Formulierungsanwendung und (D) 120 min nach der Anwendung der Formulierung; Die Talgdrüsen sind kaum sichtbar, was ein Hinweis darauf ist, dass dieses Experiment die Aufnahme in die Talgdrüsen während der gesamten experimentellen Dauer nicht gemessen hat. Maßstabsstäbe = 100 μm. Bilder sind 1024 Pixel x 1024 Pixel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Datenanalyse
- Erfassen von Bildern als . OIB (oder . (OIR ) je nach Mikroskop und MC-Software) Dateitypen, wobei jede XYZ-Position einen separaten Unterordner hat.
- Kompilieren Sie Lipidbilder mit API-Kanalbildern, indem Sie Lipidbilder mit der folgenden Endung _lipid.oib umbenennen.
- Führen Sie die folgenden Schritte mit jeder Skin-Schichtung durch (hier der Einfachheit halber nur mit der SG-Schichtung demonstriert; siehe Abbildung 3B).
- Importieren Sie ein SG-Lipidbild in ImageJ (oder Fiji)34 und aktivieren Sie das Kontrollkästchen Split Channels , um die Datei in die CARS- und SRS-Kanäle aufzuteilen.
HINWEIS: Fidschi teilt die Datei in die Anzahl der während des Experiments aufgenommenen Bilder über die Anzahl der Kanäle auf. - Öffnen Sie den ROI-Manager (Region of Interest), indem Sie auf | analysieren klicken Tools | ROI-Manager.
- Markieren Sie mit dem SRS-Kanal (z. B. C = 1) ein SG im Bild.
HINWEIS: SGs sind die hellen Stellen aufgrund der gezielten -CH2- Vibration. - Fügen Sie dies dem ROI-Manager hinzu, indem Sie im ROI-Manager auf Add [t] klicken oder t auf der Tastatur drücken. Wiederholen Sie diesen Vorgang für jedes SG innerhalb des Bildes.
- Um lipidreiche Bereiche auszublenden, wählen Sie jeden ROI aus und klicken Sie auf die Registerkarte Mehr | ODER (Kombinieren) | Zum ROI-Manager hinzufügen.
- Um lipidarme Regionen auszublenden, verwenden Sie das Rechteckwerkzeug im FIJI-Menü und zeichnen Sie ein Quadrat um das gesamte Bild. Fügen Sie dies dem ROI-Manager hinzu.
- Klicken Sie auf den neu hinzugefügten quadratischen ROI zusätzlich zum ROI, der alle lipidreichen Regionen im ROI-Manager auswählt. Wählen Sie unter Mehr die Option XOR aus, um eine Maske der lipidarmen Regionen zu generieren und sie dem ROI-Manager hinzuzufügen.
- Importieren Sie ein SG-Lipidbild in ImageJ (oder Fiji)34 und aktivieren Sie das Kontrollkästchen Split Channels , um die Datei in die CARS- und SRS-Kanäle aufzuteilen.
- Laden Sie die API-Bilder in Fidschi.
- Verketten Sie die Bilder in numerischer Reihenfolge (z. B. Image0001, Image0002, Image0003 usw.), indem Sie die folgende Menüreihenfolge verwenden: Bild | Stapel | Tools | Verketten.
- Alternativ können Sie diese Bilder importieren, indem Sie eines der Bilder nach Fidschi laden und dann auf der Setup-Seite eine Option namens Gruppendateien mit ähnlichen Namen auswählen.
HINWEIS: Dies bietet die Möglichkeit, alle Bilder mit einem ähnlichen Dateinamen zu importieren und automatisch zu verketten.
- Alternativ können Sie diese Bilder importieren, indem Sie eines der Bilder nach Fidschi laden und dann auf der Setup-Seite eine Option namens Gruppendateien mit ähnlichen Namen auswählen.
- Während das verkettete Bild aktiv ist, gehen Sie zum ROI-Manager, wählen Sie die lipidreichen Regionen (d. h. das SG) aus, klicken Sie auf Mehr und wählen Sie Multi-Measure. Warten Sie, bis das Fenster Ergebnisse angezeigt wird.
- Suchen Sie in den Standardmesseinstellungen nach Fläche, Mittelwert, Min, Max und Median. Wenn andere Metriken für die Analyse gewünscht werden, aktivieren Sie diese Optionen, indem Sie das entsprechende Kontrollkästchen im Fenster Messwerte festlegen (| analysieren aktivieren Maße einstellen...).
- Exportieren Sie die Daten aus dem Ergebnisfenster in eine Tabelle, und fügen Sie eine Spalte mit dem Titel Region hinzu.
- Fügen Sie jeder Datenreihe für die lipidreichen Regionen lipidreiche hinzu. Fügen Sie lipidarme Regionen hinzu, die außerhalb der Lipide lagen.
- Fügen Sie eine Spalte mit dem Titel Layer und den entsprechenden Layer hinzu, der analysiert wurde (Supplemental Table S1).
- Wiederholen Sie die Schritte 6.5 - 6.7 für die lipidarmen Regionen, während der entsprechende ROI ausgewählt ist.
- Um die Daten zu visualisieren, speichern Sie die Tabelle und importieren Sie sie entweder in JupyterLab (Paket matplotlib)35 oder in R (Paket ggplot2)36. Zeichnen Sie die Daten in Abhängigkeit von der Bildnummer im Vergleich zur mittleren Intensität, um die Konzentrationszeitdaten zu schätzen. (Abbildung 5).
- Importieren Sie die Tabelle in RStudio, um eine nichtkompartimentelle Analyse (NCA) für die pharmakokinetische Analyse der CRI-Daten durchzuführen.
- Fügen Sie eine Spalte mit dem Titel time hinzu.
- Berechnen Sie für Image0001 die Dauer zwischen der Formulierungsanwendung und dem ersten Bild.
HINWEIS: Dies ist der erste Zeitpunkt. Die Zyklusdauer wird verwendet, um die verbleibenden Bilder (und damit Zeitpunkte) zu berechnen, die mit der Zeit zunehmen. Wenn beispielsweise die Zeit seit der Anwendung 30 min beträgt, hat Image0001 einen Zeitpunkt von 30 min und mit einer Zyklusdauer von 8 min hat Image0002 einen Zeitpunkt von 38 min, Image0003 einen Zeitpunkt von 46 min und so weiter. - Führen Sie NCA in RStudio (mit dem NonCompart-Paket)37 für die aus der Kalkulationstabelle importierten Intensitätszeitdaten aus, wobei der folgende Aufruf für eine Ebene/Region erforderlich ist:
sNCA(x = Zeit, y = Mittelwert, Dosis = 1, timeUnit = "s", doseUnit = "mg")
Dabei bezieht sich x auf Zeitpunkte, y auf die Intensität, und die Dosis kann als eins belassen werden, berechnet als die mM-Dosis des Arzneimittels in der Formulierung oder die Produktdosis.
HINWEIS: Der NCA-Ausgang liefert Parameter wie Cmax und AUCalle. Da es sich jedoch um Ex-vivo-Haut handelt, handelt es sich bei diesen Parametern tatsächlich um Jmax und AUCflux-all. - Vergleichen Sie Jmax- und AUC-Flux-all-Metriken visuell, indem Sie sie (Abbildung 6) zusätzlich zu statistischen Vergleichen über experimentelle Bedingungen darstellen. Siehe Abbildung 6 für ein Beispiel für die Analyse von Ex-vivo-CRI-Studien.
HINWEIS: Die entsprechenden statistischen Tests hängen von jedem spezifischen Datensatz ab. Es ist auch wichtig zu beachten, dass alle pharmakokinetischen Parameter log-normalverteilt sind und alle Vergleiche die log-transformierten (natürlichen log oder log10) Daten verwenden müssen.

Abbildung 5: Intensitäts- und Zeitprofile. (A) Ein Beispiel für Flussprofile, die eine Sättigung und damit nur eine Abnahme der Intensität erreicht haben, ist zu sehen. Jeder ROI hat ein anderes Flussprofil, um die Heterogenität in den Daten zu demonstrieren, die man erfassen könnte. (B) Ein Beispiel für Konzentrationen, die nach Beginn der Bildgebung zunehmen. Jeder ROI ist ein anderes Sichtfeld (angezeigt durch die verschiedenen Farbspuren) innerhalb desselben Gewebes desselben Experiments. Zusätzlich zu den globalen Konzentrationen besteht die Möglichkeit aufzuklären, welche lokale Umgebung ein API / eine Formulierung bevorzugt, wie von lipidreichen und lipidarmen Regionen angegeben. Die in A dargestellten Profile deuten darauf hin, dass es keine Absorption des Arzneimittels in das Gewebe gibt, da der Wirkstoff bereits durchdrungen ist und begonnen hat, das Gewebe zu verlassen, sobald die Bildgebung begonnen hat. In B hat das Gewebe jedoch keine Sättigung erreicht, und es gibt immer noch eine Absorption des API, gefolgt von einer Eliminierung. Die Segmentierung der Bilder in lipidreiche und lipidarme Bilder hilft bei der Aufklärung der Lokalisation des API (oder der Inaktiven) und der Permeationswege in die Haut (d.h. Stratum corneum). Eine höhere Konzentration innerhalb der lipidreichen Regionen weist darauf hin, dass der Wirkstoff in der Lipidstruktur der untersuchten Schicht lokalisiert ist, was zu gezielten Informationen über die Arzneimittelabgabe beiträgt. Abkürzungen: ROI = Region of interest; API = pharmazeutischer Wirkstoff. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Die Bildgebung gilt als erfolgreich, wenn sich das Gewebe nach Abschluss des Experiments weder axial (<10 μm) noch in lateraler Richtung signifikant bewegt hat (Abbildung 4). Dies ist ein unmittelbarer Hinweis darauf, ob die SRS-Messung für den API of Interest nicht repräsentativ für die Anfangstiefe ist, für die die Quantifizierung schichtspezifisch ist. Dies wird durch die Abbildung von Z-Stacks für jede XY-Position von Interesse gemildert, wobei der Kompromiss die zeitliche Auflösung ist. Wenn in diesen Studien gefrorene Haut verwendet wird, sind die Penetration und Permeation des API im Vergleich zu frischer Haut schnell, und es ist eine minimale Zeit zwischen der Anwendung der Formulierung und dem Beginn der Bildgebung unerlässlich. Eine weitere Überlegung ist das Ziel, das für die Experimente verwendet wird. Bei Verwendung eines 60-fachen Objektivs ist die Auswahl einer flachen Fläche innerhalb eines einzigen Sichtfelds (FOV) relativ einfach. Für ein 20-faches Objektiv ist das betrachtete Feld jedoch viel größer, und daher ist ein wichtiger Schritt in der Gewebepräparation die Gewährleistung eines gleichmäßigen Kontakts der Haut mit der Glasboden-Bildgebungsschale. Ein flaches Sichtfeld und eine ähnliche Tiefe im Vergleich zur ursprünglichen Tiefe innerhalb des Sichtfelds sind zwei Schlüssel zu positiven Ergebnissen.
Die Ausrichtung des Lasers sowie der Dynamikumfang des Bildes müssen mit größter Sorgfalt angegangen werden. Eine Fehlausrichtung der Laserpulszüge in das Mikroskop kann zu einer Vielzahl von Problemen führen, einschließlich niedriger Signalpegel oder ungleichmäßig angeregter FOVs, die zu kontrastarmen Bildern führen können. Eine weitere Überlegung besteht darin, sicherzustellen, dass bei der Bildaufnahme der gesamte Dynamikbereich der Intensitätswerte genutzt wird. Andernfalls werden die Bilddaten komprimiert, und Konzentrationsunterschiede sind möglicherweise schwer zu erkennen.
Eine weitere Überlegung ist, dass die Heterogenität der Haut zu Variationen in den berechneten mikroskaligen Flussprofilen innerhalb desselben Datensatzes führen kann. Die Intensitäten (ein Proxy für Konzentrationen) beginnen hoch und nehmen über die experimentelle Dauer ab (Abbildung 5A), während andere Studien auf eine Zunahme gefolgt von einer Abnahme des Flusses über die experimentelle Dauer hinweisen (Abbildung 5B). Derzeit kann die absolute Konzentrationsquantifizierung aufgrund des Versuchsaufbaus nicht sofort erfolgen. Daher sind Konzentrationen, die nach der Anwendung abnehmen, möglicherweise das Ergebnis einer Sättigung innerhalb der Tiefe des Interesses, und die Quantifizierung stellt nur die API-Eliminierung dar. Wenn der Dynamikumfang nicht groß genug oder die Haut zu dick ist, werden die Konzentrationen bei der visuellen Inspektion stagniert, so dass sich während der Bildgebungsdauer keine Änderung ergibt. Dies ist eine Funktion sowohl eines suboptimalen Dynamikbereichs als auch der Hautdicke, was darauf hindeutet, dass das Experiment wiederholt werden muss.
Die Konzentrations-Zeit-Profile werden dann der NCA jedes Profils unterzogen, um die Exposition, den maximalen Fluss und die Zeit bis zum maximalen Fluss zu schätzen. Die statistische Analyse (Abbildung 6) wird unter experimentellen Bedingungen durchgeführt, um Kovariaten weiter zu untersuchen, die zu potenziellen Unterschieden in den Expositionen beitragen. Vergleiche der globalen cPK-Parameter geben Aufschluss darüber, welche Formulierung einen höheren Fluss oder eine höhere Exposition bietet. Im Gegensatz dazu werden die mikroskaligen cPK-Parameter (d.h . die lipidreichen und lipidarmen Regionen) Aufschluss über die lokalen Bioverteilungs- und Permeationswege geben. Wenn beispielsweise zwei Formulierungen mit der gleichen API-Konzentration verglichen werden und sich in den inaktiven Inhaltsstoffen unterscheiden, kann eine Formulierung dazu neigen, das Stratum corneum über die lipidreiche Region im Vergleich zu der der lipidarmen Region zu durchdringen. Diese Beobachtung deutet darauf hin, dass diese spezifische Formulierung die Permeation in Richtung der lipidreichen Regionen "schiebt", um die Penetration und Permeation zu erleichtern.
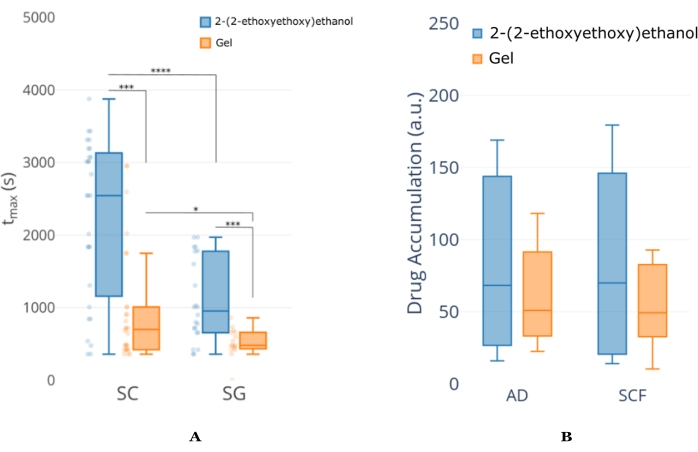
Abbildung 6: Beispiel für eine NCA-Analyse des Konzentrations-Zeit-Profils aus dem Ohrgewebe der Maus. (A) Ein Beispiel für eine tmax-Analyse (Zeit, in der die maximale Konzentration auftritt) zwischen zwei Formulierungen für denselben API. Diese Analyse zeigt, dass das 2-(2-Ethoxyethoxy)ethanol im Vergleich zur Gelformulierung eine verlängerte API-Permeation bietet, unabhängig von der Hautschicht. Es kann auch gesehen werden, dass das tmax für die SC-Schicht länger ist als das SG, was darauf hindeutet, dass die 2-(2-Ethoxyethoxy) -Ethanolformulierung weiterhin API liefert, selbst wenn die Bildgebungsdauer abgelaufen ist. (B) Ein Beispiel für eine Analyse der Gesamtexposition zwischen derselben Formulierung/API-Kombination in A , aber in Tiefen weiter in die Haut. Diese Zahl wurde von18 geändert. Abkürzungen: SC = stratum corneum; SG = Talgdrüse; AD = Adipozyten; SCF = subkutanes Fett. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Tabelle S1: Beispieldatensatz aus manueller Bildanalyse. Die Spalten geben die Informationen an, die aus dem Abschnitt Datenanalyse dieses Manuskripts gewonnen wurden (z. B. Rahmen, Fläche, Mittelwert, min, max, Median), während zusätzliche Spalten für die Verwendung in einer cPK-Analyse hinzugefügt wurden (z. B. Layer, Region, time_minutes). Diese Daten können über NCA analysiert und aufgetragen werden, um das Konzentrationsprofil innerhalb der SG-Hautschicht zu visualisieren. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Die Evaluation von topischem BA/BE ist ein Forschungsgebiet, das einen facettenreichen Ansatz erfordert, da keine einzelne Methode in vivo cPK vollständig charakterisieren kann. Dieses Protokoll stellt eine Methodik für die Bewertung des BA/BE eines topischen Arzneimittels auf der Grundlage einer kohärenten Raman-Bildgebung vor. Einer der ersten Punkte, die übersehen werden könnten, ist, wie dünn die Hautproben sein müssen, insbesondere für die quantitative Transmissions-SRS-Bildgebung. Wenn die Haut zu dick ist (d.h. Licht kann nicht ohne weiteres durchdringen), wird vom SRS-Detektor wenig bis gar kein Signal gemessen, und es liefert daher schlechte Konzentrationsdaten. Es muss darauf geachtet werden, diese Gewebeproben richtig vorzubereiten, da dies ein Experiment machen oder brechen kann. In Bezug auf das nackte Mausohr ist abgesehen vom Spülen mit PBS und dem Abtupfen des Flecks, um den verbleibenden Schmutz am Ohr zu entfernen, wenig Vorbereitung erforderlich.
Mausohren haben typischerweise eine Dicke von mehreren hundert μm, was für die Übertragung von SRS optimal ist. Menschliche Hautproben sind typischerweise mehrere mm dick, einschließlich Unterhautfett, obwohl die Dicke je nach anatomischer Quelle des Hautgewebes und Alter des Spenders sehr unterschiedlich ist. Daher muss so viel überschüssiges Gewebe wie möglich entfernt werden, um Lipidstrukturen und API-Konzentrationen in der Epidermis und Dermis im Laufe der Zeit genau zu quantifizieren. Wird der Schritt der Gewebepräparation übersehen, dann sind die restlichen Schritte des Versuchsaufbaus weitgehend ungeeignet, da die Ausgangsbedingungen nicht optimal sind.
Das Laser-/Mikroskop-Setup ist die nächste Herausforderung oder der nächste potenzielle Stolperstein. Eine Fehlausrichtung des Lasers im Strahlengang und schließlich im Mikroskop führt zu einem schlechten Kontrast und damit zu schlechten Bildgebungsergebnissen. Es wird empfohlen, zuerst den CARS-Kanal einzurichten, da sein Signal leichter zu finden ist. Die Pumpen- und Stokes-Impulszüge müssen sich sowohl zeitlich als auch räumlich überlappen. Die Ausrichtung des Pumpenlasers wird mit dem Transmissionsdetektor innerhalb der MC-Software des Mikroskops überprüft, wenn der SRS-Detektor aus dem Weg geräumt wird. Beim Anzeigen des CARS-Kanals (ALG1) in der MC-Software wird der Stokes-Strahl entsperrt. Wenn jedoch kein Signal von der Ölprobe vorhanden ist, ist es zunächst notwendig, den Stokes-Strahl auszurichten und dann die Zeitüberlappung anzupassen. Es kann notwendig sein, diese beiden Anpassungen zu iterieren, bis das Signal optimiert ist. Die räumliche Überlappung der beiden Strahlen wird durch einen IR-Viewer auf der Blende betrachtet, während die Zeitverzögerungsstufe (Abbildung 2) so eingestellt ist, dass sich die Strahlen zeitlich überlappen. Diese beiden Ausrichtungsschritte sind entscheidend, um die CARS-Signalerzeugung sicherzustellen.
Sobald ein Signal im CARS-Kanal sichtbar ist, ist der SRS-Kanal (ALG2) der nächste, der eingerichtet werden muss. Mögliche Probleme bei fehlendem Signal sind, dass die Lock-in-Phase oder die Verstärkungseinstellungen zu niedrig sind oder dass der Offset in der Lock-in-Software zu hoch eingestellt ist. Darüber hinaus kann die Kondensatorposition so eingestellt werden, dass das durchgelassene Licht auf die Fotodiode fokussiert und somit das SRS-Signal optimiert wird. Die unsachgemäße Einrichtung des Lasers / Mikroskops führt zu einem Mangel an Signal, wodurch die Konzentrationsschätzungen abgenommen werden und die Permeationsinformationen fehlen. Die Laserleistung der Pumpe und der Stokes-Strahlen kann für individuelle Studien optimiert werden. Es ist jedoch wichtig, dass die Potenzen der Strahlen für jedes Experiment gleich sind. Unterschiedliche Laserleistungen zwischen Replikaten führen zu falschen Konzentrationsunterschieden, die eher auf das Setup als auf die API / Formulierung zurückzuführen sind.
Jede Studie erfordert eine einzigartige Dosisdauer (d. h. die Zeitdauer , in der die Formulierung auf der Haut verbleibt) und muss unabhängig untersucht werden, um die kutane API-Penetration / Permeation zu quantifizieren, da dies formulierungsabhängig ist. Eine weitere Überlegung bei der Entwicklung eines Protokolls ist der okklusive Charakter der Formulierungsanwendung. Es ist wichtig zu wissen, ob die Formulierung so konzipiert wurde, dass sie unter okklusiven oder nichtokklusiven Bedingungen verabreicht werden kann. Die hier vorgestellte CRI-Methodik verwendet ein inverses Mikroskop; Dies bedeutet, dass die Hautoberfläche mit dem Gesicht nach unten und unter okklusiven Einstellungen ist. Ein aufrechtes Mikroskop kann die Möglichkeit bieten, nicht-okklusive Bedingungen zu haben; Die Hautoberfläche ist jedoch möglicherweise nicht flach, was diese Art von Experimenten zu einer Herausforderung machen würde.
Es muss anerkannt werden, dass der okklusive Charakter dieser Experimente nicht die typische klinische Verwendung ist; Nichtsdestotrotz werden Permeationswege in diesen Studien analysiert. Die hier vorgestellte CRI-Methode bietet die Möglichkeit, mikroskalige Veränderungen zu visualisieren und zu quantifizieren, die sonst mit Methoden wie dermaler Mikrodialyse, dermaler Open-Flow-Mikroperfusion, Bandstripping oder IVPT-Studien nicht zu unterscheiden sind. Jüngste Entwicklungen der schnellen Wellenzahlabstimmung haben den Weg für die gleichzeitige Quantifizierung der Hautstruktur und mehrerer Schwingungsbindungen außerhalb der stillen Region geebnet. Weitere Berechnungsmethoden, um den Beitrag spezifischer Analyten von dem der Haut zu analysieren, befinden sich jedoch noch in der Entwicklung28. Dies ist auch für In-vivo-CRI-Studien von besonderer Relevanz, obwohl die Leistungen, die in diesem Setup auf der Tischplatte verwendet werden (ca. 50 mW im Fokus), für den klinischen Einsatz möglicherweise nicht zulässig sind. Das Potenzial dieser Methodik, von einem Labortisch in die Klinik übersetzt zu werden, kann es den Forschern ermöglichen, die Permeation des Arzneimittels sowohl in vivo als auch ex vivo im selben Umfeld zu quantifizieren, um In-vitro-in-vivo-Beziehungen zu entwickeln, die für den Fortschritt in der topischen Arzneimittelentwicklung entscheidend sind.
Die schiere Menge an Daten, die aus einem Versuchslauf gewonnen werden, kann zwischen 10 Bildern pro Standort und 70 Bildern pro Standort liegen. Wenn es mehrere Stellen pro Gewebestück gibt, führt dies zu Gigabyte an Informationen. Die Bilder selbst liefern globale Konzentrationszeitdaten und werden so quantifiziert, wie sie sind, ohne Vorverarbeitung. Dies maximiert jedoch nicht den Nutzen von CRI, da lokale Bioverteilungsdaten zusätzlich zu Permeationspfaddaten extrahiert werden können. Die Bildsegmentierung ist zeitaufwendig, liefert aber detaillierte Informationen, die mit anderen Methoden nicht möglich sind. Beispielsweise ist es möglich, den bevorzugten Penetrationsweg durch das Stratum corneum (lipidreich oder lipidarm) abzuschätzen, was Aufschluss darüber geben kann, welche inaktiven Inhaltsstoffe zu einem bestimmten Weg beitragen könnten oder ob er arzneimittelabhängig ist. Die Analyse eines Experiments kann mehrere Stunden bis Tage dauern, abhängig von der Anzahl der Bilder und der experimentellen Dauer. Daher wird ein automatisierter Ansatz die Datenanalyse unterstützen und eine konsistente Annotation von lipidreichen und lipidarmen Regionen über Hautschichtungen hinweg ermöglichen18.
Offenlegungen
CLE ist Erfinder von Patenten für die CARS-Mikroskopie, die an mehrere Mikroskophersteller lizenziert wurden. Alle anderen Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren danken Dr. Fotis Iliopoulos und Daniel Greenfield von der Evans' Group für ihre Diskussion und das Korrekturlesen dieses Manuskripts. Darüber hinaus möchten sich die Autoren für die Unterstützung von LEO Pharma bedanken. Abbildung 2 wurde mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Tissue Preparation | |||
| Autoclavable Biohazard Bags | FisherBrand | 22-044562 | As refered to in text: biohazard bags https://www.fishersci.com/shop/products/fisherbrand-polyethylene-biohazard-autoclave-bags-without-sterilization-indicator-8/22044562?searchHijack=true&searchTerm= 22044562&searchType=RAPID& matchedCatNo=22044562 |
| Cell Culture Buffers: Dulbecco's Phosphate-Buffered Salt Solution 1x | Corning | MT21030CV | As refered to in text: PBS https://www.fishersci.com/shop/products/corning-cellgro-cell-culture-buffers-dulbecco-s-phosphate-buffered-salt-solution-1x-8/MT21030CV?searchHijack=true&searchTerm= 21-030-cv&searchType= RAPID&matchedCatNo=21-030-cv |
| Disposable Scalpels | Exel International | 14-840-00 | As refered to in text: scalpel https://www.fishersci.com/shop/products/exel-international-disposable-scalpels-3/1484000?keyword=true |
| High Precision 45° Angle Broad Point Tweezers/Forceps | Fisherbrand | 12-000-132 | As refered to in text: forceps https://www.fishersci.com/shop/products/high-precision-45-angle-broad-point-tweezers-forceps/12000132#?keyword= |
| Kimwipes Delicate Task Wipers, 1-Ply | Kimberly-Clark Professional Kimtech Science | 06-666 | As refered to in text: task wiper https://www.fishersci.com/shop/products/kimberly-clark-kimtech-science-kimwipes-delicate-task-wipers-7/06666 |
| Parafilm M Laboratory Wrapping Film | Bemis | 13-374-12 | As refered to in text: parafilm https://www.fishersci.com/shop/products/curwood-parafilm-m-laboratory-wrapping-film-4/1337412 |
| Petri Dish (35 mm x 10 mm) | Fisherbrand | FB0875711YZ | As refered to in text: small petri dish https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-specialty-6/FB0875711YZ?keyword=true |
| Petri Dish (60 mm x 15 mm) | Fisherbrand | FB0875713A | As refered to in text: large petri dish https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-clear-lid-12/FB0875713A?keyword=true |
| Surgical Scissors | Roboz | NC9411473 | As refered to in text: scissors https://www.fishersci.com/shop/products/scissors-327/NC9411473?searchHijack=true&searchTerm= RS-5915SC&searchType=RAPID& matchedCatNo=RS-5915SC |
| Laser/microscope | |||
| 650/60 nm BrightLine single-band bandpass filter | Semrock | As refered to in text: CARS filter - CH2 vibrations (645nm/60nm filter) | |
| Control box IX2-UCB | Olympus | As refered to in text: Control Box | |
| D700/30m | Chroma | As refered to in text: CARS filter - deuterated band https://www.chroma.com/products/parts/d700-30m | |
| DeepSee Insight | Spectra-Physics | As refered to in text: Laser https://www.spectra-physics.com/f/insight-x3-tunable-laser | |
| Digital Handheld Optical Power and Energy Meter Console | ThorLabs | PM100D | As refered to in text: power meter https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=3341 |
| Fluoview Software | Olympus | As refered to in text: Microscope Control software | |
| Frosted Microscope Slides | FisherBrand | As refered to in text: microscope slides https://www.fishersci.com/shop/products/fisherbrand-frosted-microscope-slides-4/22265446 | |
| FV1000 | Olympus | As refered to in text: Microscope | |
| Incubation Chamber | Tokai Hit | GM-800 | As refered to in text: incubation chamber |
| Integrating Sphere Photodiode Power Sensor | ThorLabs | S142C | As refered to in text: photodiode https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=3341 |
| Power supply FV31-PSU | Olympus | As refered to in text: Power Supply | |
| Precision 4063, 80MHz Dual Channel Function Generator | BK Precision | As refered to in text: function generator | |
| ProScan – Precision Microscope Automation | Prior Scientific Instruments | As refered to in text: stage controller https://www.prior.com/microscope-automation/inverted-microscope-systems/proscan-linear-stage-highest-precision-microscope-automation | |
| SecureSeal Imaging Spacers | Grace Biolabs | 654004 | As refered to in text: spacer https://gracebio.com/product/secureseal-imaging-spacers-654004/ |
| SRS Detection Kit | APE | As refered to in text: SRS detector | |
| UPLSAPO 20X NA:0.75 | Olympus | As refered to in text: 20X Objective https://www.olympus-lifescience.com/en/objectives/uplsapo/ | |
| Lipid/Drug Imaging | |||
| 35 mm Dish, No. 0 Uncoated Coverslip, 14 mm Glass Diameter | MatTek Corporation | NC9711297 | As refered to in text: Glass bottom dish https://www.fishersci.com/shop/products/glass-bottom-mircrowell-dish/nc9711297 |
| Cotton-tipped applicators | FisherBrand | As refered to in text: Cotton-tipped applicator | |
| Distriman Postive Displacement Pipette | Gilson | As refered to in text: Postive Displacement Pipette https://www.fishersci.com/shop/products/gilson-distriman-positive-displacement-repetitive-pipette/F164001G#?keyword= | |
| Distriman Postive Displacement Pipette Tips | Gilson | As refered to in text: Tips for pipette https://www.fishersci.com/shop/products/gilson-distritip-syringes-6/f164100g?keyword=true | |
| Data Analysis | |||
| FIJI | Open-source | As refered to in text: FIJI/ImageJ https://imagej.net/software/fiji/ | |
| Jupyter-Lab | open-source | As refered to in text: JupyterLab https://jupyter.org/ | |
| Rstudio | Open-source | As refered to in text: Rstudio https://www.rstudio.com/ |
Referenzen
- Finnin, B., Walters, K. A., Franz, T. J. In vitro skin permeation methodology. In Transdermal and topical drug delivery: principles and methodology. Transdermal and topical drug delivery: principles and practice. Benson, H. E., Watkinson, A. C. , John Wiley & Sons. Hoboken NJ USA. 85-108 (2012).
- Shin, S. H., et al. On the road to development of an in vitro permeation test (IVPT) model to compare heat effects on transdermal delivery systems: exploratory studies with nicotine and fentanyl. Pharmaceutical Research. 34 (9), 1817-1830 (2017).
- Hossain, A., et al. Preparation, characterisation, and topical delivery of terbinafine. Pharmaceutics. 11 (10), 548(2019).
- Santos, L. L., Swofford, N. J., Santiago, B. G. In vitro permeation test (IVPT) for pharmacokinetic assessment of topical dermatological formulations. Current Protocols in Pharmacology. 91 (1), 79(2020).
- Iliopoulos, F., Caspers, P. J., Puppels, G. J., Lane, M. E. Franz cell diffusion testing andquantitative confocal Raman spectroscopy: In vitro-in vivo correlation. Pharmaceutics. 12 (9), 887(2020).
- Cordery, S., et al. Topical bioavailability of diclofenac from locally-acting, dermatological formulations. International Journal of Pharmaceutics. 529 (1-2), 55-64 (2017).
- Pensado, A., et al. Stratum corneum sampling to assess bioequivalence between topicalacyclovir products. Pharmaceutical Research. 36 (12), 1-16 (2019).
- Zhang, Y., et al. Dermal delivery of niacinamide-in vivo studies. Pharmaceutics. 13 (5), 726(2021).
- Bodenlenz, M., et al. Open flow microperfusion as a dermal pharmacokinetic approach to evaluate topical bioequivalence. Clinical Pharmacokinetics. 56 (1), 91-98 (2017).
- Eirefelt, S., et al. Evaluating dermal pharmacokinetics and pharmacodymanic effect of soft topical PDE4 inhibitors:Open flow microperfusion and skin biopsies. Pharmaceutical Research. 37 (12), 1-12 (2020).
- Stagni, G., O'Donnell, D., Liu, Y. J., Kellogg, J. D. L., Shepherd, A. M. Iontophoretic current and intradermal microdialysis recovery in humans. Journal of Pharmacological and Toxicological Methods. 41 (1), 49-54 (1999).
- Garcia Ortiz, P., Hansen, S. H., Shah, V. P., Menne, T., Benfeldt, E. Impact of adultatopic dermatitis on topical drug penetration: assessment by cutaneous microdialysis and tape stripping. Acta Dermato-Venereologica. 89 (1), 33-38 (2009).
- Joshi, A., Patel, H., Joshi, A., Stagni, G. Pharmacokinetic applications of cutaneous microdialysis: Continuous+intermittent vs continuous-only sampling. Journal of Pharmacological and Toxicological Methods. 83, 16-20 (2017).
- Kuzma, B. A., et al. Evaluation of local bioavailability of metronidazole from topical formulations using dermal microdialysis: Preliminary study in a Yucatan mini-pig model. European Journal of Pharmaceutical Sciences. 159, 105741(2021).
- Begley, R., Harvey, A., Byer, R. L.Coherent anti-Stokes Raman spectroscopy. Applied Physics Letters. 25 (7), 387-390 (1974).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807-16812 (2005).
- Hill, A. H., Manifold, B., Fu, D. Tissue imaging depth limit of stimulated Raman scattering microscopy. Biomedical Optics Express. 11 (2), 762-774 (2020).
- Feizpour, A., Marstrand, T., Bastholm, L., Eirefelt, S., Evans, C. L. Label-free quantification of pharmacokinetics in skin with stimulated Raman scattering microscopy and deep learning. Journal of Investigative Dermatology. 141 (2), 395-403 (2021).
- Ghosh, B., Reddy, L. H., Kulkarni, R. V., Khanam, J. Comparison of skin permeability of drugs in mice and human cadaver skin. Indian Journal of Experimental Biology. 38 (1), 42-45 (2000).
- Nielsen, J. B., Plasencia, I., Sørensen, J. A., Bagatolli, L. Storage conditions of skin affect tissue structure and subsequent in vitro percutaneous penetration. Skin Pharmacology and Physiology. 24 (2), 93-102 (2011).
- Barbero, A. M., Frasch, H. F. Effect of frozen human epidermis storage duration and cryoprotectant on barrier function using two model compounds. Skin Pharmacology and Physiology. 29 (1), 31-40 (2016).
- Babu, R., et al. The influence of various methods of cold storage of skin on the permeation of melatonin and nimesulide. Journal of Controlled Release. 86 (1), 49-57 (2003).
- Skelly, J. P., et al. FDA and AAPS report of the workshop on principles and practices of in vitro percutaneous penetration studies: relevance to bioavailability and bioequivalence. Pharmaceutical Research. 4 (3), 265-267 (1987).
- OECD. Guidance document for the conduct of skin absorption studies. OECD. , (2004).
- OECD. Test no. 428: Skin absorption: In vitro method. OECD. , (2004).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 330 (6009), 1368-1370 (2010).
- Saar, B. G., Contreras-Rojas, L. R., Xie, X. S., Guy, R. H. Imaging drug delivery to skin with stimulated Raman scattering microscopy. Molecular Pharmaceutics. 8 (3), 969-975 (2011).
- Pence, I. J., Kuzma, B. A., Brinkmann, M., Hellwig, T., Evans, C. L. Multi-windowsparse spectral sampling stimulated Raman scattering microscopy. Biomedical Optics Express. 12 (10), 6095-6114 (2021).
- Herkenne, C., et al. In vivo methods for the assessment of topical drug bioavailability. Pharmaceutical Research. 25 (1), 87-103 (2008).
- Alfonso-Garcıa, A., Mittal, R., Lee, E. S., Potma, E. O. Biological imaging with coherent Raman scattering microscopy: a tutorial. Journal of Biomedical Optics. 19 (7), 071407(2014).
- Osseiran, S., et al. Longitudinal monitoring of cancer cell subpopulations in monolayers, 3D spheroids, and xenografts using the photoconvertible dye DiR. Scientific Reports. 9 (1), 1-10 (2019).
- Evennett, P. Kohler illumination: a simple interpretation. Proceedings of the Royal Microscopical Society. 28 (4), 189-192 (1983).
- Sanderson, J. Fundamentals of microscopy. Current Protocols in Mouse Biology. 10 (2), 76(2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hunter, J. D. Matplotlib: A 2D graphics environment. Computing in Science & Engineering. 9 (3), 90-95 (2007).
- Wickham, H. ggplot2: Elegant Graphics for Data Analysis. , Springer-Verlag. New York. (2016).
- Kim, H., Han, S., Cho, Y. S., Yoon, S. K., Bae, K. Development of R packages:'Non-Compart' and 'ncar' for noncompartmental analysis (NCA). Translational and Clinical Pharmacology. 26 (1), 10-15 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten