Method Article
Natriumtaurocolat induzierte schwere akute Pankreatitis bei C57BL/6 Mäusen
In diesem Artikel
Zusammenfassung
Tiermodelle für schwere akute Pankreatitis ermöglichen die Untersuchung pathophysiologischer Veränderungen im Anfangsstadium und erleichtern die Beobachtung der Evolution von Entzündungsereignissen. Hier stellen wir ein Protokoll für die Induktion einer schweren akuten biliären Pankreatitis durch retrograde Infusion von Natriumtaurocholat in den Pankreasgang von anästhesierten C57BL/6-Mäusen zur Verfügung.
Zusammenfassung
Die Induktion einer biliären akuten Pankreatitis durch Natriumtautolett-Infusion wurde von der wissenschaftlichen Gemeinschaft aufgrund der Darstellung des klinischen Zustands des Menschen und der Reproduktion entzündlicher Ereignisse, die dem Beginn der klinischen biliären Pankreatitis entsprechen, weit verbreitet verwendet. Die Schwere der Pankreasschädigung kann durch Messung der Konzentration, Geschwindigkeit und des Volumens der infundierten Gallensäure beurteilt werden. Diese Studie bietet eine aktualisierte Checkliste der Materialien und Methoden, die bei der Protokollreproduktion verwendet werden, und zeigt die wichtigsten Ergebnisse dieses akuten Pankreatitis (AP) -Modells. Die meisten früheren Veröffentlichungen haben sich darauf beschränkt, dieses Modell bei Ratten zu reproduzieren. Wir haben diese Methode bei Mäusen angewendet, die zusätzliche Vorteile bietet (d.h. die Verfügbarkeit eines Arsenals von Reagenzien und Antikörpern für diese Tiere zusammen mit der Möglichkeit, mit genetisch veränderten Mäusstämmen zu arbeiten), die für die Studie relevant sein könnten. Für die Induktion einer akuten Pankreatitis bei Mäusen präsentieren wir ein systematisches Protokoll mit einer definierten Dosis von 2,5% Natriumtarocholat bei einer Infusionsgeschwindigkeit von 10 μL/min für 3 min bei C57BL/6-Mäusen, die ihren maximalen Schweregrad innerhalb von 12 h nach der Induktion erreichen, und heben Ergebnisse mit Ergebnissen hervor, die die Methode validieren. Mit Übung und Technik beträgt die geschätzte Gesamtzeit von der Einleitung der Anästhesie bis zum Abschluss der Infusion 25 Minuten pro Tier.
Einleitung
Beim Menschen ist das Vorhandensein von Gallensteinen die häufigste Ursache für eine Pankreatitis aufgrund der Obstruktion des terminalen Teils des Choledochals, die den Fluss der Pankreassekrete unterbricht und einen intensiven Entzündungsprozess in der Bauchspeicheldrüse verursacht, mit einer Erhöhung der Konzentration von Verdauungsenzymen im Serum und Entzündungsmediatoren1,2.
Zwei verschiedene Theorien wurden vorgeschlagen, um die Entwicklung einer akuten Pankreatitis (AP) zu erklären. Die Theorie des "gemeinsamen Kanals" legt nahe, dass die in der Gallenblase vorhandenen Steine das distale gemeinsame Gallengangssystem behindern, so dass die Gallensekretion retrograd in den Pankreasgang fließen kann. Die zweite Theorie (die Theorie der "Gangobstruktion") legt nahe, dass die Obstruktion des Pankreasgangs durch überschüssige Gallensteine eine Blockade im Fluss der Pankreassekretion zum Zwölffingerdarm verursacht, was zu einer duktalen Hypertonie führt3. Obwohl die Mechanismen, die zu einer akuten biliären Pankreatitis führen, nicht vollständig verstanden sind, ist das Ergebnis ein intensiver Entzündungsprozess. Der Ausbruch des Verdauungsenzyms und die Selbstverdauung der Bauchspeicheldrüse führen zu histopathologischen Veränderungen, einem Anstieg der entzündlichen Zytokine (IL-1β, IL-6, TNF-α) in der Aszitflüssigkeit und im Serum sowie zu einem Anstieg der Proteine in der akuten Phase4,5,6.
Schwere akute Pankreatitis ist eine Erkrankung, die aufgrund der Beteiligung mehrerer Organe und eines hohen Mortalitätsrisikos klinische Aufmerksamkeit verdient. Tiermodelle für die Reproduktion der akuten Pankreatitis (AP) sind wichtig, da sie die pathophysiologischen Mechanismen der Krankheit erklären und bei der Überwachung der Entwicklung von Entzündungsereignissen ab den Anfangsstadien der Krankheit helfen. Dies ist in den Kliniken in der Regel nicht möglich2,7. Darüber hinaus ist der Zugang zu Pankreasgewebe in präklinischen Studien einfach, was die Aufklärung von Veränderungen im Zusammenhang mit klinischen Bedingungen8 sowie die Möglichkeit der Arbeit mit isogenen Spezies, die Beseitigung unerwünschter Variablen und die Spiegelung der klinischen Ähnlichkeit mit den im menschlichen Zustand beobachteten Ergebnissen begünstigt9.
Biliäre und nicht-biliäre Modelle für die Induktion einer akuten Pankreatitis bei Ratten und Mäusen wurden in der wissenschaftlichen Literatur häufig untersucht. Nicht-biliäre Induktionsmethoden umfassen die Verabreichung von supramaximalen stimulierenden Dosen des Cholecystokinin-Sekretagogue oder seines analogen Cerulein10; Verabreichung von fast tödlichen Dosen von L-Arginin; oder Verabreichung einer cholinarmen Diät, die mit Ethionin11 ergänzt wird. Obwohl diese Methoden leicht zu reproduzieren sind und zu einer Bauchspeicheldrüsenentzündung führen, replizieren sie nicht die Mechanismen, die theoretisch AP auslösen (dh den Rückfluss von Gallensekretion in den Pankreasgang). Die Technik, die das Gallenmodell anspricht, basiert auf der retrograden Infusion von Gallensäuren in den Pankreasgang und erfordert gut ausgebildete Forscher, um dieses Protokoll durchzuführen. Mehrere Studien wurden mit dieser Methode an Ratten veröffentlicht (offenbar aus technischen Gründen, da diese Experimente chirurgische Eingriffe beinhalten)12,13. Der Ansatz bei Mäusen könnte jedoch interessantere Ergebnisse in der Studie über Entzündungen liefern3,14,15. In dieser Studie zeigen wir eine Checkliste der Schritte, die für die Reproduktion einer schweren akuten Pankreatitis durch Infusion von Natriumtaurocholat in C57BL/6 anästhesierten Mäusen zu befolgen sind.
Für Arbeiten, die Experimente mit Antikörpern und die Analyse der Gen- und Proteinexpression erfordern, ist die Verwendung von Mäusen vorzuziehen, da das Materialarsenal für diese Tiere größer ist und die Möglichkeit besteht, unter anderem mit isogenen und Knockout-Spezies zu arbeiten, die für Studien relevant sind16. Mäuse C57BL/6 ist ein Inzuchtstamm von Mäusen, der ursprünglich für das Studium der Antitumoraktivität und Immunologie entwickelt wurde. Dieser Stamm wird von den Forschern zunehmend bevorzugt, da er isogen ist, was eine größere Reproduzierbarkeit der Ergebnisse ermöglicht, was die Verwendung einer kleineren Anzahl von Tieren in einem Versuch und eine geringere Variabilität der Ergebnisse zwischen derselben Gruppe bedeuten kann17,18.
Perides et al. (2010)14 veröffentlichten ein Protokoll für die AP-Induktion bei Mäusen durch Natriumtaurocholat-Infusion. Hier aktualisieren wir dieses Modell unter Verwendung einer höheren Natriumtaurocilatkonzentration (2,5%) in C57BL/6-Mäusen mit einem definierten Volumen und einer definierten Infusionsgeschwindigkeit (Abbildung 1). Der maximale Schweregrad wird bei Mäusen innerhalb von 12 h nach der Induktion erreicht. Die Erhöhung der Konzentration von IL-6 sowohl im Serum als auch in der Peritonealhöhle korreliert mit dem Fortschreiten der AP. In der Praxis beträgt die geschätzte Gesamtzeit von der Einleitung der Anästhesie bis zum Abschluss der Infusion 25 Minuten pro Tier. Es ist wichtig, dass ein ausgebildeter Forscher dieses Experiment durchführt. Um sicherzustellen, dass die Lösung ordnungsgemäß in den gemeinsamen Gallengang injiziert wird, führen Sie mehrere Pilottrainingseinheiten mit Methylenblau anstelle von Natriumtaurocholat durch.
Protokoll
Dieses Protokoll wurde von der Ethikkommission für die Verwendung von Tieren der USP Medicine School, Nr. Projekt: 1343/2019-CEUA: FMUSP genehmigt. Für dieses Protokoll wurden C57BL/6-Mäuse im Alter von 6 Wochen mit einem Gewicht von 20 ± 2 g verwendet (n = 9/Gruppe).
1. Laparotomie
- Tiere mit Xylazin (10 mg/kg) und Ketaminlösung (80 mg/kg) subkutan (0,1 ml/10 g Körpergewicht) mit einer 1 ml Spritze und einer 13x0,45 mm Nadel 26G 1/2 betäuben. Überprüfen Sie auf ausreichende Anästhesietiefe, indem Sie den Zeh einklemmen. Kontrollieren Sie die Körpertemperatur mit beheizten Pads. Stellen Sie sicher, dass alle chirurgischen Materialien steril sind.
- Reinigen Sie den Bauchbereich mit 5% Povidon-Jod-Lösung und entfernen Sie mit einem Trimmer die Haare zwischen Brust und Unterbauch (ca. 2 cm2). Reinigen Sie den Operationsbereich mit 70% Alkohol.
- Immobilisieren Sie das Tier auf dem OPERATIONSBRETT mit chirurgischem Klebeband. Verwenden Sie eine Schere, um 5 mm der Haut horizontal auf dem oberen Teil des Abdomens und 1 cm unter dem Xiphoid-Prozess zu schneiden. Wiederholen Sie den Schnitt am Peritoneum. Dies führt zu einer Laparotomie mit minimaler Exposition der Höhle.
2. Lokalisieren und Freilegen der Bauchspeicheldrüse
- Ziehen Sie mit Hilfe eines Retraktors die Leber in Richtung des Kopfes der Maus, ~ 1 cm vom Darm entfernt.
- Lokalisieren Sie die Region der Bauchspeicheldrüse, die mit Natriumtaurocholat (Pankreaskopf) injiziert wird. Lokalisieren Sie den Zwölffingerdarm in Bezug auf die Leber - unterhalb der Leber, auf der rechten Seite (auf der linken Seite, wenn die Maus betrachtet wird). Der Zwölffingerdarm ist der erste Teil des Dünndarms und ist mit dem letzten Teil des Magens verbunden.
- Heben Sie mit Hilfe einer Pinzette die Leber in Richtung Tierkopf an und ziehen Sie vorsichtig den Dünndarmteil. Fixieren Sie die beiden seitlichen Enden des Dünndarms mit einer 6-0 Polypropylennaht, um den distalen Teil des gemeinsamen Gallengangs besser zu sehen.
3. Induktion einer schweren akuten Pankreatitis
- Verschließen Sie vorübergehend den proximalen gemeinsamen Gallengang mit einem Mikrogefäßclip, um zu verhindern, dass eine retrograde Infusion in die Leber austritt. Der gemeinsame Gallengang ist auf der Leberseite des Zwölffingerdarms zu sehen und seine Verbindung mit dem Zwölffingerdarm erscheint weiß. Legen Sie das Organ aus der Bauchhöhle frei.
- Punktion der periampullären Region (weißlicher Teil der Dünndarmwand), um mit einer 0,4 mm Nadel, die mit einem 0,54 mm Polyethylenrohr verbunden ist, Zugang zum gemeinsamen Gallengang zu erhalten.
- Machen Sie einen vorübergehenden Verschluss des distalen gemeinsamen Gallengangs mit 8-0 Naht, um zu verhindern, dass die Natriumtarocolatlösung in den Zwölffingerdarm austritt.
- Starten Sie die Infusionspumpe und programmieren Sie eine 2,5% ige Natriumtautocholatlösung (verdünnt in 0,9% Kochsalzlösung) infusion mit einer konstanten Geschwindigkeit von 10 μL/10 g Körpergewicht für 3 min.
- Entfernen Sie nach der Infusion den Mikrogefäßclip, den temporären 8-0 Naht und die Injektionsnadel aus dem Gallengang der Bauchspeicheldrüse, um den physiologischen Fluss der Galle wiederherzustellen.
- Am Ende nähen Sie den Bauch mit 6-0 nichtabsorbierenden Monofilament-Polypropylennaht. Die Zeit zwischen der Laparotomie und der Endnaht sollte maximal 30 min betragen (siehe Abbildung 1).
- Nach der Operation bringen Sie die Tiere in Polyethylenboxen unter, die mit Holzspänen und Wasser und Futter ad libitum ausgekleidet sind.
- Behandeln Sie Kontrollmäuse auf die gleiche Weise wie die experimentellen Mäuse, stellen Sie jedoch sicher, dass das Infusat nur aus Kochsalzlösung besteht. Führen Sie den chirurgischen Eingriff und die Infusion von Kochsalzlösung (10 ml / min, für 3 min) in einer Kontrollgruppe (SHAM) durch, um die durch Operation und Kanülierung verursachte entzündliche Verzerrung zu beseitigen.
- Verwenden Sie Tramadol 12,5 mg/kg subkutan alle 8 Stunden, beginnend nach der postoperativen Genesung.
4. Analysemethoden
- Nach 12 h nach AP-Induktion werden die Tiere mit Xylazin (10 mg/kg) und Ketamin (80 mg/kg) betäubt, um etwa 250 μL Blut über den Plexus orbitalis zu sammeln.
- Halten Sie die Haut sanft auf dem Rücken, fördern Sie einen leichten Vorsprung des Augapfels und positionieren Sie ihn mit dem Auge nach oben.
- Geben Sie dem Tier einen Tropfen Augensalbe mit Lokalanästhetikum ein.
- Positionieren Sie das Ende des Kapillarrohrs im medialen Augenwinkel und führen Sie es vorsichtig mit einem Winkel von ~ 30 ° -45 ° unter den Augapfel ein. Drehen Sie das Kapillarrohr, bis der Blutfluss beginnt. Denken Sie daran, dass es nicht notwendig ist, Gewalt für das Verfahren anzuwenden.
- Sobald die Sammlung vorbei ist, stellen Sie die Homöostase sicher, indem Sie die Augenlider durch leichte Kompression mit der Gaze geschlossen halten. Entsorgen Sie das Kapillarrohr im Behälter für scharfe Gegenstände19.
- Zentrifugieren Sie das Serum (700 x g, 15 min) und lagern Sie den Überstand für die Amylase- und IL-6-Dosierung (Schritt 4.7 und 4.8).
- Einschläfern Sie Mäuse durch CO2-Ersticken .
- Verwenden Sie eine 27 G Nadel, um 4 ml eiskaltes 1x PBS in die Peritonealhöhle zu injizieren. Tened die Bauchhaut und stellen Sie sicher, dass die Nadel langsam in das Peritoneum gedrückt wird, um keine Organe zu punktieren. Nach der Injektion das Peritoneum 10 s lang sanft einmassieren, um die am Peritoneum haftenden Zellen zu entfernen.
- Machen Sie mit einer Schere und einer Pinzette einen kleinen Schnitt (0,5 cm) auf der Innenhaut und der Muskulatur, um die Bauchhöhle freizulegen. Führen Sie eine Zwiebelpipette in das Peritoneum ein und sammeln Sie die Flüssigkeit. Achten Sie darauf, kein Fettgewebe oder andere Organe anzusaugen.
- Sammeln Sie so viel Flüssigkeit wie möglich und deponieren Sie die gesammelte Zellsuspension in Röhren, die auf Eis aufbewahrt werden. Entsorgen Sie die Zwiebelpipette im Behälter für scharfe Gegenstände20. Zentrifugieren Sie die Peritonealflüssigkeit (250 x g, 5 min) und lagern Sie den Überstand für die IL-6-Dosierung (Schritt 4.9).
- Sammeln Sie die Bauchspeicheldrüsenregion neben dem Zwölffingerdarm (<5mm).
- Verarbeiten Sie die Bauchspeicheldrüse, indem Sie 10% Formalin fixieren und in Paraffin einarbeiten.
- Färben Sie die Objektträger mit Hämatoxylin und Eosin für histopathologische Analysen unter Lichtmikroskopie. Verwenden Sie das Schmidt-Protokoll21 (Pankreasödem, Azinuszelle, Verletzung/Nekrose, Bauchspeicheldrüsenentzündung), um das Ausmaß der AP zu beurteilen.
- Messen Sie Amylase (U / dL) mit handelsüblichen Kits gemäß den Empfehlungen des Herstellers.
- Messen Sie IL-6 by Luminex Assays mit kommerziellen Kits gemäß den Empfehlungen des Herstellers.
- Der in den Schritten 4.1 und 4.4 erhaltene Serum- und Peritonealflüssigkeitsüberstand wird erforderlichenfalls in einem Gefrierschrank bei -80 °C gelagert.
Ergebnisse
Der Schweregrad der Pankreatitis wurde nach der Schmidt-Skala21 zwischen 0-3 bewertet, wobei Null der Abwesenheit, 1 einer leichten Präsenz (<25%), 2 einer moderaten Präsenz (zwischen 25 und 50%) und 3 einer intensiven Präsenz (> 50%) entspricht (Tabelle 1). Die durchgeführten Messungen waren Plasma-Amylase-Aktivität, Pankreasödem, Azinuszellen, Verletzungen/Nekrose, Pankreasentzündungen (durch histologische Analyse von H &E-gefärbten Abschnitten) und IL-6-Zytokinkonzentration im Serum und in der PerC-Flüssigkeit. Nach 12 h schwerer AP zeigte die APTA-Gruppe einen Anstieg der Serum-Amylase-Konzentration (6194 ± 336,7 U/dL) im Vergleich zur Scheingruppe (3845 ± 135,7 U/dL). Gleichzeitig zeigte die APTA-Gruppe eine erhöhte IL-6-Zytokinkonzentration im Serum und in der PerC-Flüssigkeit (Abbildung 2). Abbildung 3 zeigt eine repräsentative Hämatoxylin-Eosin-Färbung der Schein- und APTA-Gruppe .

Abbildung 1: Schematische Darstellung der Induktion einer schweren akuten Pankreatitis durch 2,5% Natriumtarocholat bei C57BL/6-Mäusen. (A) Gallenblase; B) gemeinsamer Gallengang; C) Pankreasgang; D) Vena pfortader; (E) Mikrogefäßclip; (F) Punktionsstelle (Nadel an einem Polyethylenrohr befestigt und mit Infusionspumpe verbunden); (G) vorübergehende Nadelfixierung im gemeinsamen Gallengang. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
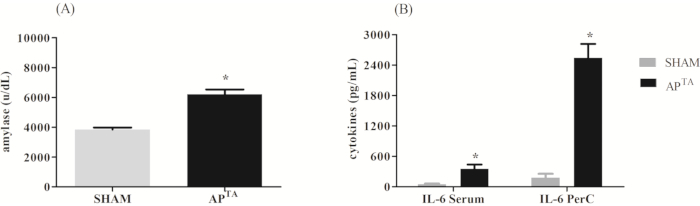
Abbildung 2: Repräsentative Ergebnisse nach 12 h schwerer akuter Pankreatitis. (A) Serum-Amylase-Konzentration (U/dl) des Tieres. (B) IL-6-Zytokinkonzentration im Serum und in der PerC-Flüssigkeit. Unterschiede zwischen den Gruppen wurden durch ungepaarte t-Test-Analyse * p <0,05 bewertet, wenn APTA ≠ Schein (n = 9 / Gruppe). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Interstitielles Ödem | Entzündliche Infiltration | Parenchym-Nekrose | Parenchymblutung | |
| SCHEIN | 1±0* | 0.0 | 0.0 | 0.0 |
| APTA | 3±0* | 3±0 | 3±0 | 3±0 |
| *P<0,05 bei SHAM≠APTA. |
Tabelle 1: Histologische Veränderungen im Pankreasgewebe nach 12 h schwerer AP. Die Bauchspeicheldrüse wurde nach der Schmidt-Skala bearbeitet und analysiert21. Die Ergebnisse wurden als mittelwerter ± SEM ausgedrückt und die Unterschiede zwischen den Gruppen wurden durch den Student t-Test bewertet. * p <0,05, wenn APTA sham ≠; (n=9/Gruppe).

Abbildung 3: Repräsentative Hämatoxylin-Eosin-Färbung im Pankreasgewebe nach 12 h schwerer AP. Histologische Veränderungen im (A) SHAM und (B) APTA Pankreasgewebe (Hämatoxylin-Eosin-Färbung - 40-fache Vergrößerung). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Methode zur Induktion einer akuten Pankreatitis durch retrograde Natriumtaurocholat-Infusion wurde bereits bei Ratten gezeigt22,23,24. Drei ähnliche Werke, die 2008, 2010 und 2015 veröffentlicht wurden, dienten als Referenz für das Protokoll3,14,15. In dieser Arbeit listen wir alle kritischen Schritte zur Reproduktion dieser Methode in C57BL/6-Mäusen und einige Möglichkeiten zur Validierung auf.
Ein kritischer Schritt in diesem Test ist die Blockierung des Gallengangs auf Höhe des Hilums mit einem Mikrogefäßclip (Schritt 3.1), um natriumtautocholat-Reflux in die Leber zu vermeiden. Dieser Schritt erfordert viel Aufmerksamkeit, da sich die Pfortader neben dem Gang befindet (Abbildung 1D), daher muss darauf geachtet werden, dass sie nicht zusammen blockiert wird. Die Nadel sollte nur in den distalsten Kanalabschnitt eingeführt werden. Wird es tief in den Gang eingebracht, kann es zu einem Bruch kommen, bei dem die Säure zum Drüsenparenchym und/oder zu anderen Kanälen überläuft14. Überprüfen Sie, ob das Polyethylenrohr Luft im Inneren enthält, um die Verstopfung des gemeinsamen Gallengangs zu verhindern.
Dieses Modell erfordert einen Schnitt im Bauch der Maus. Das Einführen der Kanüle durch die Öffnung des Pankreasgangs erfordert Erfahrung, die jedoch mit Training erreicht werden kann15,25. Es ist wichtig zu betonen, dass der Schweregrad der Pankreatitis in diesem Modell proportional von der Konzentration, dem Volumen der Infusion, dem Druck der Infusion und dem Zeitpunkt der AP-Induktion abhängt. Daher muss eine konstante Infusionsmaschine mit kontrolliertem Volumen und Druck verwendet werden.
Für diese Studie haben wir eine Konzentration von 2,5% mit einer Infusionsgeschwindigkeit von 10 μL/min für 3 min und konstanten Druck standardisiert. Bei 12 h AP wurden erhöhte Entzündungsparameter und Nekrose des Pankreasgewebes beobachtet, wobei die Tiere innerhalb von 16 h nach AP-Induktion starben.
Obwohl die Hauptursachen für AP Alkoholkonsum oder Gallensteine sind, sind diese Modelle experimentell nicht reproduzierbar26. Derzeit umfasst das am häufigsten verwendete Protokoll für die AP-Induktion bei Mäusen 7 intraperitoneale Injektionen von Cerulein (50 μg/kg Körpergewicht) in 1 h-Intervallen27. Cerulein wurde auch verwendet, um eine leichte oder mittelschwere akute Pankreatitis zu induzieren. Die Variabilität dieses Modells schränkt seine Verwendung bei der Untersuchung der destruktiven Auswirkungen der Krankheit ein, die klinische Morbidität und Mortalität verleihen10. Modelle, die in kurzer Zeit eine hohe Mortalität auslösen, sind für die Untersuchung schwerer AP (nekrotisierend) relevant, da sie die Wirksamkeit neuer Medikamente oder Interventionen bewerten können. Zu diesen Modellen gehören die hämorrhagische AP-Induktion bei jungen weiblichen Nagetieren (zwischen 4 und 6 Wochen) durch eine Cholin-defiziente Diät28 und L-Arginin (z. B. 3 x 3 g/kg oder 2 x 4 g/kg) basierende akute Pankreatitis-Induktion bei Mäusen, aber die richtige Dosierung von L-Arginin zur Induktion von AP sollte von jedem Labor und in jedem Mausstamm getestet werden29. Im Jahr 2015 zeigte eine Studie, dass eine intraduktale Taurocholat-Infusion gefolgt von einer distalen gemeinsamen Gallengangsligatur zu einem schweren, nekrotischen Modell der Pankreatitis bei Mäusen führt3. Dieses Modell ist jedoch aufgrund seines irreversiblen Zustands nicht nützlich, um die Wirksamkeit und Interventionen von Medikamenten zu testen.
Die in dieser Studie gefundenen Ergebnisse korrelieren mit neuerer Literatur wie der Erhöhung der Serum-Amylase-Konzentration und IL-6, die mit dem Fortschreiten der Krankheit assoziiert sind. Es ist möglich, dass die Messung von Proteinen wie TNF-α, IL-1β und Myeloperoxidase in Zukunft ein klinisch-prognostischer Parameter für schwere akute Pankreatitis sein wird30,31,32.
Zusammenfassend lässt sich sagen, dass das in der vorliegenden Studie verwendete Protokoll zur Induktion von AP bei Mäusen durch die Infusion von Natriumtirocholat direkt in den gemeinsamen Gallengang zu einer schweren akuten Pankreatitis mit Nekrose des Pankreasgewebes führt, die bereits 12 h nach der Induktion mit Erhöhung des IL-6-Zytokins im Serum und in der Peritonealflüssigkeit und mit hoher Letalität (100% Mortalität in 16 h, B. Daten werden nicht angezeigt).
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Die Autoren danken dem Postgraduiertenprogramm in der Medizinischen Klinik der Universität von São Paulo; Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) und University of São Paulo Medical School (FMUSP).
Materialien
| Name | Company | Catalog Number | Comments |
| 0.4 mm needle | INTRAG MEDICAL TECH | 90183210 | 30G |
| 0.54 mm polyethylene tube | Tygon | 730010 | - |
| Styrofoam block | - | - | - |
| masking tape for mounting the mouse | Missner | 1236 | - |
| Infusion pump scheduled to 10µL / min. | Havard aparatus-Peristaltic Pump Series | MA1 55-7766 | Model 66 Small Peristaltic |
| Scissors and forceps | |||
| Antiseptic providine iodine | Pfizer | 12086OR | antisepsis |
| 70% ethanol | SIGMA | 459836 | Mix 700 mL 100% ethanol with 300 mL dH2O |
| Razor blade | Lord | bdk9a1ghk6 | For trichotomy |
| Sodium taurocholate | Sigma-Aldrich | 86339- 1G | CAS NUMBER- 345909-26-4 |
| microvessel clip | Medicon Surgical | 56.87.35 | Approximator, opening 4.0 mm, closing pressure 30 - 40 g |
| 6-0 prolene | Bioline | 5162 | Suture line |
| Ketamin NP (cloridrato de dextrocetamina) 50mg/mL | Cristália | ||
| Xilazine 2% | Syntec | ||
| Sterile saline solution (0.9% (wt/vol) saline) | Farmace | 105851 | |
| Methyl Blue | Sigma-Aldrich Chemicals | M5528 | |
| MILLIPLEX MAP Mouse Cytokine/Chemokine Magnetic Bead Panel - Immunology Multiplex Assay | MERCK | MCYTOMAG-70K | Simultaneously analyze multiple cytokine and chemokine biomarkers with Bead-Based Multiplex Assays using the Luminex technology, in mouse serum, plasma and cell culture samples. |
| Amylase Assay | Labtest | 11 | |
| Desmarres retractor 13-mm width | ROBOZ | RS-6672 |
Referenzen
- Li, X., et al. Significantly different clinical features between hypertriglyceridemia and biliary acute pancreatitis: A retrospective study of 730 patients from a tertiary center. BMC Gastroenterology. 18 (1), 1-8 (2018).
- Rechreche, H., Abbes, A., Iovanna, J. L. Induction of antioxidant mechanisms in lung during experimental pancreatitis in rats. Indian Journal of Experimental Biology. 58 (5), 297-305 (2020).
- T, L., et al. Intraductal infusion of taurocholate followed by distal common bile duct ligation leads to a severe necrotic model of pancreatitis in mice. Pancreas. 44 (3), (2015).
- Botoi, G., Andercou, A. Interleukin 17-prognostic marker of severe acute pancreatitis. Chirurgia. 104 (4), 431-438 (2009).
- Li, D., Li, J., Wang, L., Zhang, Q. Association between IL-1beta, IL-8, and IL-10 polymorphisms and risk of acute pancreatitis. Genetics and Molecular Research. 14 (2), 6635-6641 (2015).
- Feng, C., et al. Effect of peritoneal lavage with ulinastatin on the expression of NF-kappaB and TNF-alpha in multiple organs of rats with severe acute pancreatitis. Experimental and Therapeutic Medicine. 10 (6), 2029-2034 (2015).
- Fang, D. Z., et al. Effects of sildenafil on inflammatory injury of the lung in sodium taurocholate-induced severe acute pancreatitis rats. International Immunopharmacology. 80, (2020).
- Ceranowicz, P., Cieszkowski, J., Warzecha, Z., Dembinski, A. Experimental models of acute pancreatitis. Postępy Higieny i Medycyny Doświadczalnej(Online). 69, 264-269 (2015).
- Wan, M. H., et al. Review of experimental animal models of biliary acute pancreatitis and recent advances in basic research. HPB (Oxford). 14 (2), 73-81 (2012).
- Mayerle, J., Sendler, M., Lerch, M. M. Secretagogue (Caerulein) induced pancreatitis in rodents. Pancreapedia: The Exocrine Pancreas Knowledge Base. (1), (2013).
- Wang, N., et al. Resveratrol protects against L-arginine-induced acute necrotizing pancreatitis in mice by enhancing SIRT1-mediated deacetylation of p53 and heat shock factor 1. International Journal of Molecular Medicine. 40 (2), 427-437 (2017).
- Ma, Z. H., et al. Effect of resveratrol on peritoneal macrophages in rats with severe acute pancreatitis. Inflammation Research. 54 (12), 522-527 (2005).
- Souza, L. J., et al. Anti-inflammatory effects of peritoneal lavage in acute pancreatitis. Pancreas. 39 (8), 1180-1184 (2010).
- Perides, G., Acker, G. J. v., Laukkarinen, J. M., Steer, M. L. Experimental acute biliary pancreatitis induced by retrograde infusion of bile acids into the mouse pancreatic duct. Nature Protocols. 5 (2), 335-341 (2010).
- Wittel, U. A., et al. Taurocholate-induced pancreatitis: a model of severe necrotizing pancreatitis in mice. Pancreas. 36 (2), 9-21 (2008).
- Tao, L., Reese, T. A. Making mouse models that reflect human immune responses. Trends Immunology. 38 (3), 181-193 (2017).
- Vandamme, T. F. Use of rodents as models of human diseases. Journal of Pharmacy and Bioallied Science. 6 (1), 2-9 (2014).
- Song, H. K., Hwang, D. Y. Use of C57BL/6N mice on the variety of immunological researches. Laboratory Animal Research. 33 (2), 119-123 (2017).
- Bogdanske, J. J., Stelle, S. H. -. V., Riley, M. V., Schiffman, B. M. . Suturing Principles and Techniques in Laboratory Animal Surgery. 1st edition. (1), (2010).
- Ray, A., Dittel, B. N. Isolation of mouse peritoneal cavity cells. Journal of Visualized Experiments. (35), e1488 (2010).
- Schmidt, J., et al. A better model of acute pancreatitis for evaluating therapy. Annals of Surgery. 215 (1), 44-56 (1992).
- Liu, D. L., et al. Resveratrol improves the therapeutic efficacy of bone marrow-derived mesenchymal stem cells in rats with severe acute pancreatitis. International Immunopharmacology. 80, 106128 (2020).
- Yang, X. F., et al. Chaiqin chengqi decoction alleviates severe acute pancreatitis associated acute kidney injury by inhibiting endoplasmic reticulum stress and subsequent apoptosis. Biomedicine & Pharmacotherapy. 125 (12), 110024 (2020).
- Yang, X. F., et al. Chaiqin chengqi decoction alleviates severe acute pancreatitis associated acute kidney injury by inhibiting endoplasmic reticulum stress and subsequent apoptosis. Biomedicine & Pharmacotherapy. 125, 110024 (2020).
- Venglovecz, V., Z, R., Hegyi, P. The effects of bile acids on pancreatic ductal cells. Pancreapedia: The Exocrine Pancreas Knowledge Base. (1), (2019).
- Roberts, S. E., Akbari, A., Thorne, K., Atkinson, M., Evans, P. A. The incidence of acute pancreatitis: impact of social deprivation, alcohol consumption, seasonal and demographic factors. Alimentary Pharmacology and Therapeutics. 38 (5), 539-548 (2013).
- Lerch, M. M., Gorelick, F. S. Models of acute and chronic pancreatitis. Gastroenterology. 144 (6), 1180-1193 (2013).
- Nakamura, K., Fukatsu, K., Sasayama, A., Yamaji, T. An immune-modulating formula comprising whey peptides and fermented milk improves inflammation-related remote organ injuries in diet-induced acute pancreatitis in mice. Biosci Microbiota Food Health. 37 (1), 1-8 (2018).
- Kui, B., et al. New insights into the methodolgy of L-Arginine-induced acute pancreatitis. PLoS One. 10 (2), 011758 (2015).
- Xue, J., et al. Alternatively activated macrophages promote pancreatic fibrosis in chronic pancreatitis. Nature Communication. 6, 7158 (2015).
- Lesina, M., Wormann, S. M., Neuhofer, P., Song, L., Algul, H. Interleukin-6 in inflammatory and malignant diseases of the pancreas. Seminars in Immunology. 26 (1), 80-87 (2014).
- Rao, S. A., Kunte, A. R. Interleukin-6: An early predictive marker for severity of acute pancreatitis. Indian Journal of Critical Care Medicine. 21 (7), 424-428 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten