Method Article
Bestimmung des Funktionellen Status des Corticospinal Tract innerhalb einer Woche nach dem Schlaganfall
In diesem Artikel
Zusammenfassung
Dieses Protokoll dient zur Bewertung der Funktion des Kortikospinaltraktes innerhalb von 1 Woche nach dem Schlaganfall. Es kann verwendet werden, um Patienten in Studien mit Interventionen auszuwählen und zu schichten, die entwickelt wurden, um die motorische Erholung und Ergebnisse der oberen Gliedmaßen zu verbessern, und in der klinischen Praxis zur Vorhersage der funktionellen Ergebnisse der oberen Gliedmaßen 3 Monate nach dem Schlaganfall.
Zusammenfassung
Eine hohe interindividuelle Variabilität bei der Wiederherstellung der Funktion der oberen Extremität (UL) nach einem Schlaganfall bedeutet, dass es schwierig ist, das Erholungspotenzial einer Person allein auf der Grundlage klinischer Bewertungen vorherzusagen. Die funktionelle Integrität des Kortikospinaltraktes ist ein wichtiger prognostischer Biomarker für die Wiederherstellung der UL-Funktion, insbesondere für Personen mit schwerer anfänglicher UL-Beeinträchtigung. Dieser Artikel stellt ein Protokoll zur Bewertung der Funktion des Kortikospinaltraktes innerhalb von 1 Woche nach dem Schlaganfall vor. Dieses Protokoll kann verwendet werden, um Patienten in Studien mit Interventionen zur Verbesserung der UL-Motorrückgewinnung und der Ergebnisse nach einem Schlaganfall auszuwählen und zu schichten. Das Protokoll ist auch Teil des PREP2-Algorithmus, der die UL-Funktion für einzelne Patienten 3 Monate nach dem Schlaganfall vorhersagt. Der Algorithmus kombiniert sequenziell eine UL-Stärkebeurteilung, Alter, transkranielle magnetische Stimulation und Schlaganfall-Schwere innerhalb weniger Tage nach dem Schlaganfall. Die Vorteile der Verwendung von PREP2 in der klinischen Praxis werden an anderer Stelle beschrieben. Dieser Artikel konzentriert sich auf die Verwendung einer UL-Stärkebewertung und transkraniellen magnetischen Stimulation zur Bewertung der Funktion des Kortikospinaltraktes.
Einleitung
Die Funktion der oberen Gliedmaßen ist häufig nach einem Schlaganfall beeinträchtigt, und die Wiederherstellung der UL-Funktion ist wichtig, um die Unabhängigkeit in den täglichen Lebensaktivitäten wiederzuerlangen1. Schlaganfall-Rehabilitationsstudien zielen oft darauf ab, die UL-Wiederherstellung und die Ergebnisse nach einem Schlaganfall zu verbessern. Die Mehrheit der Schlaganfall-Rehabilitationsforschung wird mit Patienten im chronischen Stadium (>6 Monate nach dem Schlaganfall) durchgeführt, aber die meisten Rehabilitationen erfolgen früh nach Schlaganfall2,3. Mehr Forschung muss mit Patienten bald nach einem Schlaganfall durchgeführt werden, um eine Evidenzbasis für die Rehabilitationspraxis zu bauen.
Eine der größten Herausforderungen bei der Forschung kurz nach dem Schlaganfall ist die Erkennung der Auswirkungen des Eingriffs vor dem Hintergrund der Erholung, die in den ersten Wochen und Monaten nach dem Schlaganfall auftritt. Eine hohe intersubjekte Variabilität in der klinischen Präsentation und Erholung erzeugt Lärm, der die positiven Auswirkungen von Interventionen verschleiern kann. Interventions- und Kontrollgruppen sind in der Regel auf klinische Maßnahmen der anfänglichen neurologischen Beeinträchtigung enden. Diese Maßnahmen sind jedoch oft schlechte Prädiktoren für das Potenzial des Patienten für eine spätere Genesung, insbesondere solche mit schwerer Anfangsbeeinträchtigung4,5. Dies bedeutet, dass Gruppen für klinische Basismaßnahmen und nicht für ihr Wiederherstellungspotenzial abgeglichen werden können, was es schwieriger macht, die Auswirkungen der Intervention zu ermitteln. Biomarker können diese Herausforderung angehen, indem sie das Potenzial eines einzelnen Patienten zur motorischen Rückgewinnung identifizieren, so dass Gruppen genau aufeinander abgestimmt und geschichtet werden können6,7,8. Biomarker können auch verwendet werden, um Patienten auszuwählen, die am ehesten auf diebekannten oder hypothetischen Wirkmechanismen der Intervention 6 reagieren.
Die funktionelle Integrität des Kortikospinaltraktes (CST) ist ein wichtiger Biomarker, der die Wiederherstellung der UL-Funktion nach Schlaganfall5,8,9,10,11,12vorhersagt. Der CST transportiert absteigende Motorleistung vom primären Motorkortex bis zum Rückenmark und ist für die Koordination und Feinmotorik unerlässlich. Patienten mit einem funktionellen CST nach einem Schlaganfall sind wahrscheinlicher, Kraft, Koordination und Geschicklichkeit wiederzuerlangen als Patienten ohne. Eine klinische Bewertung kann ausreichen, um zu bestätigen, dass das CST bei leicht behinderten Patienten13,14,15funktionsfähig ist. Jedoch, Patienten mit schwereren Anfänglichen Beeinträchtigung kann oder auch nicht eine funktionelle CST haben, und eine neurophysiologische Bewertung mit transkraniellen magnetischen Stimulation (TMS) wird benötigt9,10,11,16,17.
TMS ist eine nichtinvasive und schmerzlose Technik, die verwendet werden kann, um CST-Funktion18zu testen. Die TMS-Spule liefert einen magnetischen Stimulus über den primären motorischen Kortex, der einen absteigenden Volley im CST erzeugt und ein motorisch evoziertes Potential (MEP) in den Muskeln der kontralateralen Extremität19auslöst. Das Vorhandensein eines MEP im paretischen Arm oder der paretischen Hand (MEP+) weist auf einen funktionellen CST hin und ist mit einem größeren Potenzial für die Wiederherstellung der UL-Funktion verbunden. Patienten, die MEP- sind am ehesten eine schlechtere UL-Erholung haben, ohne Rückkehr der koordinierten und geschickten Handfunktion4,6,9,12,16.
Die Untersuchung aller Patienten mit TMS ist unpraktisch und unnötig, da Patienten mit leichter Anfangsbeeinträchtigung höchstwahrscheinlich eine funktionelle CST17haben. Daher ist ein hierarchischer Ansatz erforderlich, so dass TMS nur für Patienten mit schwererer Anfangsbeeinträchtigung angewendet wird. Der PREP2-Algorithmus wurde mit einer Kombination aus klinischen Maßnahmen und TMS entwickelt, um die CST-Funktion zu bewerten und das wahrscheinliche UL-Ergebnis nach 3 Monaten nach dem Schlaganfall vorherzusagen (Abbildung 1)17. PREP2 beginnt am Tag 3 nach dem Schlaganfall, indem die Stärke der Schulterentführung und Fingerverlängerung im paretischen Arm (SAFE-Score) unter Verwendung von Noten des Medical Research Council getestet wird. Wenn die Summe dieser Noten 5 oder mehr von 10 ist, ist es "sicher", davon auszugehen, dass der Patient MEP+ ist. Von diesen Patienten wird erwartet, dass sie je nach Alter von17Jahren bis zu 3 Monate nach dem Schlaganfall ein gutes oder ausgezeichnetes UL-Ergebnis haben. Diese Patienten benötigen kein TMS, um den MEP-Status zu bestimmen, wodurch kostendeckend und unnötige Tests für den Patienten minimiert werden.
Patienten mit einem SAFE-Score von weniger als 5 am Tag 3 nach dem Schlaganfall benötigen TMS, um die funktionelle Integrität ihres CST zu bestimmen. Wenn ein MEP aus der paretischen Extensor-Carpi-Radialis (ECR) oder den ersten dorsalen Interosseus-Muskeln (FDI) entlockt werden kann, ist der Patient MEP+ und wird voraussichtlich nach 3 Monaten nach dem Schlaganfall die Feinmotorik der Hand wiederherstellen. Ungefähr die Hälfte der Patienten mit einem SAFE-Score unter 5 am Tag 3 nach dem Schlaganfall sind MEP+. Wichtig ist, dass Patienten einen SAFE-Score bis Null haben und MEP+ sein können. Dies verdeutlicht die Notwendigkeit von TMS in dieser Untergruppe von Patienten, da die klinische Bewertung allein nicht zwischen Patienten mit und ohne funktionellem CST unterscheiden kann. Patienten, die MEP sind, haben erhebliche CST-Schäden. Es wird erwartet, dass diese Patienten je nach Gesamtschwere des Schlaganfalls ein begrenztes oder schlechtes UL-Funktionsergebnis haben, gemessen mit dem National Institute of Health Stroke Scale (NIHSS) (Abbildung 1)17. Von diesen MEP-Patienten wird nicht erwartet, dass sie eine koordinierte und geschickte Fingerkontrolle wiedererlangen und zu Forschungszwecken gruppiert werden können.

Abbildung 1: Der PREP2-Algorithmus. SAFE = Schulterentführung, Fingerextension Score, die die Summe der Medizinischen Forschungsratsnoten für jede dieser Bewegungen von 5 ist, für eine Gesamtnote SAFE von 10. MEP+ = Motor Evoked Potentials können aus den paretischen Extensor-Carpi-Radialis (ECR) und/oder den ersten dorsalen Interossen(FDI) Muskeln der paretischen UL mit transkranieller Magnetstimulation entlockt werden. NIHSS = National Institutes of Health Stroke Scale. Der Algorithmus sagt eines von vier möglichen UL-Funktionsergebnissen nach 3 Monaten nach dem Schlaganfall voraus. Jede Vorhersagekategorie ist mit einem Rehabilitationsschwerpunkt verbunden, der für die Anpassung der UL-Therapie2verwendet werden kann. Die farbigen Punkte stellen proportional die Genauigkeit des PREP2-Algorithmus dar. Die Punkte sind farbkodiert basierend auf der Ergebniskategorie, die tatsächlich 3 Monate nach dem Schlaganfall erreicht wurde (Grün = Ausgezeichnet; Blau = Gut; Orange = Begrenzt; Rot = Schlecht). Abbildung reproduziert von Stinear et al.17. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
In der klinischen Praxis sagt PREP2 eine von vier Ergebniskategorien voraus, die verwendet werden können, um die Rehabilitation für einzelne Patienten zu maßschneidern und Patienten und Familien zu helfen, zu verstehen, was sie für ihre UL-Wiederherstellung erwarten können. Bis heute ist PREP2 das einzige extern validierte UL-Vorhersagetool, das klinische Bewertung und Biomarkerinformationen in einem Entscheidungsbaum17kombiniert. Es ist auch das einzige UL-Vorhersageinstrument mit Forschung über die Auswirkungen der Umsetzung in der klinischen Praxis20,21. PREP2-Prognosen sind für etwa 75% der Patienten genau, zu optimistisch für 17% und zu pessimistisch für 8% der Patienten nach 3 Monaten nach dem Schlaganfall17. Die Genauigkeit ist für MEP-Patienten am höchsten (genau für 90% der MEP-Patienten), wobei der Wert der Verwendung von TMS zur Identifizierung dieser Patienten mit schweren Schäden an den absteigenden motorischen Wegen17hervorgehoben wird. PREP2 bleibt bei ca. 80% der Patienten nach 2 Jahren nach dem Schlaganfall22korrekt. Dies unterstützt den Einsatz von PREP2 zur Vorhersage der ul-Funktionsmotorergebnisse nach 3 Monaten und längerfristig. Informationen über die Bereitstellung von PREP2-Vorhersagen und deren Verwendung in der klinischen Praxis fallen nicht in den Anwendungsbereich dieses Methodenpapiers, detaillierte Ressourcen sind jedoch online verfügbar23.
PREP2 bietet Forschern ein Werkzeug, um Patienten für klinische Studien auszuwählen und zu schichten. Auf diese Weise können Patienten nicht nur nach klinischen Ausgangsmerkmalen gruppiert werden, sondern auch nach ihrem neurobiologischen Potenzial für die UL-Wiederherstellung. Trotz der zunehmenden Beweise für die Verwendung von TMS als prognostischem Biomarker für die UL-Wiederherstellung kann mangelnde Vertrautheit mit TMS-Protokollen in Krankenhausumgebungen mit subakuten Schlaganfallpatienten ein Hindernis für seine Verwendung in der Forschung sein. Daher soll dieses Protokoll zeigen, wie der SAFE-Score und TMS zur Bewertung der CST-Funktion bei Patienten in einem Krankenhaus frühzeitig nach einem Schlaganfall verwendet werden können.
Protokoll
Alle Forschungen, die mit menschlichen Teilnehmern durchgeführt werden, müssen von der zuständigen institutionellen Ethikkommission genehmigt werden, und die Studie muss in Übereinstimmung mit der Erklärung von Helsinki durchgeführt werden.
1. Patienten-Screening
- Überprüfen Sie alle Patienten auf PREP2-Tauglichkeit innerhalb von 72 h nach Schlaganfallbeginn.
HINWEIS: Patienten sind geeignet, wenn sie innerhalb der letzten 72 h einen einseitigen ischämischen oder hämorrhagischen Schlaganfall hatten, eine neue UL-Schwäche haben und 18 Jahre oder älter sind.
2. SAFE-Score
HINWEIS: Stellen Sie sicher, dass Patienten mit Unaufmerksamkeit oder Müdigkeit auf den Arm fokussiert sind, um eine genaue Beurteilung der Stärke zu ermöglichen.
- Positionieren Sie den Patienten mit vollem Rücken voll unterstützt und aufrecht entweder im Bett oder in einem Stuhl und ihren paretischen Arm an ihrer Seite mit dem Ellenbogen in der Verlängerung.
- Demonstrieren Sie Schulterentführung. Bitten Sie den Patienten, den Arm seitlich und bis zum Ohr zu heben. Verwenden Sie die Grade des Medical Research Council (MRC), um die Schulterentführungsstärke zu bewerten.
HINWEIS: MRC-Typen werden wie folgt beschrieben: 0 = keine spürbare Muskelaktivität; 1 = fühlbare Muskelaktivität, aber keine Bewegung; 2 = begrenzter Bewegungsbereich ohne Schwerkraft; 3 = voller Bewegungsumfang gegen die Schwerkraft, aber kein Widerstand; 4 = voller Bewegungsumfang gegen Schwerkraft und Widerstand, aber schwächer als die andere Seite; 5 = normale Leistung. - Um Schulterentführungsgrade 4 oder 5 zu bewerten, legen Sie Ihre Hand über den Arm des Patienten, proximal zum Ellenbogen und wenden Sie Widerstand an.
HINWEIS: Der Patient muss in der Lage sein, den vollen Bewegungsumfang gegen Widerstand zu erreichen, um eine Punktzahl von 4 oder höher zu erhalten. - Legen Sie den paretischen Unterarm in Pronation mit den Fingern vollständig gebeugt und bieten Unterstützung unter dem Handgelenk.
- Demonstrieren Sie die Fingerverlängerung. Bitten Sie den Patienten, seine Finger zu richten und die Noten des Medical Research Council zu verwenden, um die Fingerverlängerungsstärke zu erzielen.
- Um fingerverlängerungsgrade 4 oder 5 zu punkten, wenden Sie den Widerstand über das Dorsum der Finger an, distal zu den metacarpophalangealen Gelenken, während der gesamten Bewegung.
HINWEIS: Der Patient muss in der Lage sein, eine volle Verlängerung gegen Widerstand zu erreichen, um eine Punktzahl von 4 oder höher zu erhalten. - Um Finger mit ungleicher Stärke zu punkten, verwenden Sie die Mehrheitsregel. Wenn drei Finger die gleiche Punktzahl haben, verwenden Sie diese Punktzahl. Wenn zwei Finger eine niedrigere Punktzahl als die anderen beiden Finger haben, verwenden Sie die niedrigere Punktzahl.
- Fügen Sie die MRC-Typen für Schulterentführung und Fingerverlängerung für eine SAFE-Punktzahl von 10 zusammen. Wenn der Patient am Tag 3 nach dem Schlaganfall einen SAFE-Score von 5 oder mehr hat, kann davon ausgegangen werden, dass er einen funktionellen Kortikospinaltrakt hat und TMS nicht erforderlich ist. Wenn der Patient am Tag 3 nach dem Schlaganfall einen SAFE-Score von weniger als 5 hat, ist TMS erforderlich, um seinen MEP-Status zu bestimmen.
3. Transkranielle Magnetische Stimulation (TMS)
- Bewerten Sie die Patienteneignung für TMS.
- Führen Sie eine TMS-Sicherheitscheckliste mit dem Patienten aus, um absolute und relative Kontraindikationen für TMS24zu identifizieren.
HINWEIS: Diese Informationen sollten durch Patienten- und Familieninterviews sowie aus den Krankenakten gesammelt werden. Weitere Informationen finden Sie im Abschnitt repräsentative Ergebnisse. - Bitten Sie den Arzt des Patienten, die TMS-Checkliste zu überprüfen und gegebenenfalls zu genehmigen.
- Überprüfen Sie am Tag des TMS-Tests den medizinischen Status des Patienten mit dem klinischen Team und dem Patienten, um sicherzustellen, dass sich seit der Unterzeichnung der Checkliste nichts geändert hat.
HINWEIS: Zu den zu berücksichtigenden Ereignissen gehören Sturz mit Kopfverletzung, Anfall, wenn der Patient medizinisch unwohl geworden ist, hypoglykämisch ist oder instabilen Blutdruck hat. Stellen Sie sicher, dass der Patient alle verordneten Medikamente vor dem Test eingenommen hat.
- Führen Sie eine TMS-Sicherheitscheckliste mit dem Patienten aus, um absolute und relative Kontraindikationen für TMS24zu identifizieren.
- Bereiten Sie die Umgebung vor.
- Entfernen Sie Möbel aus dem Bett. Bewegen Sie das Bett von der Wand weg, um Platz für die TMS-Einheit zu schaffen.
- Platzieren Sie die TMS-Einheit an der Kopf des Bettes zur Seite gegenüber der paretischen Gliedmaße. Winkeln Sie die TMS-Einheit so, dass die Person, die TMS liefert, den Bildschirm leicht sehen kann.
- Testen Sie das TMS-Setup, um zu überprüfen, ob es ordnungsgemäß funktioniert.
HINWEIS: Dieses Protokoll verwendet eine Single-Pulse-TMS-Einheit. Das Elektromyographie-Signal (EMG) kann mit 2 kHz abgetastet und mit 10 Hz-Hochpass- und 1.000 Hz-Tiefpassfiltern gefiltert werden. Die EMG-Ausrüstung muss von der TMS-Einheit so ausgelöst werden, dass die EMG-Spur mindestens 50 ms vor dem TMS-Stimulus beginnt und mindestens 50 ms nach dem TMS-Stimulus endet. - Stellen Sie sicher, dass Sie mit dem Protokoll für die Beschwörung der Notfallhilfe im TMS-Bewertungsraum vertraut sind, falls dies erforderlich ist.
- Bereiten Sie den Patienten vor.
HINWEIS: Patienten mit intravenösen (IV) Linien, nasogastrischer Fütterung oder niedrigen Konzentrationen von zusätzlichem Sauerstoff über eine Nasenkanüle können mit TMS getestet werden, sofern sie vom behandelnden Arzt als medizinisch stabil angesehen werden. Zusätzlicher Sauerstoff sollte während der gesamten TMS-Sitzung fortgesetzt werden. Das Anhalten und Trennen der nasogastrischen Fütterung und nicht-essentieller Flüssigkeiten durch IV-Leitungen wird die Durchführung der TMS-Bewertung erleichtern.- Entfernen Sie alle Kleidungsstücke, die die Unterarme bedecken. Entfernen Sie alle Elemente, die das paretische Handgelenk abdecken, wie z. B. eine Uhr oder ein Identifikationsarmband, um die Platzierung der EMG-Elektroden zu ermöglichen.
- Positionieren Sie den paretischen Arm auf einem Kissen mit proniertem Unterarm und vollständig unterstützt vom Ellenbogen bis zur Hand.
- Palpate den paretischen Unterarm, um den Muskelbauch für den Extensor carpi radialis (ECR) Muskel zu lokalisieren. Identifizieren Sie Positionen für zwei Oberflächen-EMG-Elektroden über dem Muskelbauch, so dass Faktoren wie die Position von IV Kanüle oder Verbände.
HINWEIS: Es ist wichtig, dass mindestens eine Elektrode über dem Muskelbauch positioniert ist. Dies kann eine Diskussion mit dem Pflegepersonal über die Neupositionierung von Verbänden vor dem Test erfordern, wenn möglich. - Reinigen Sie die Haut an jeder Elektrodenstelle mit einem Alkohol-Hautreinigungstuch. Rasieren Sie jede Elektrodenstelle, um jedes Haar zu entfernen. Die Elektrodenstellen leicht mit einer Schleifcreme oder einem Klebeband abschleifen. Achten Sie auf Patienten, die zerbrechliche Haut haben und vermeiden Sie alle Bereiche der gebrochenen Haut.
- Stellen Sie an jedem Standort selbstklebende Einweg-Aufnahmeelektroden sicher auf.
- Suchen Sie die Elektrodenstellen für den ersten dorsalen Interosseus-Muskel (FDI). Eine Elektrode wird auf den Di-Muskelbauch und eine auf das Dorsum der Hand gelegt.
HINWEIS: Die Platzierung der Elektroden kann je nach Patientenfaktoren wie der Position einer IV Kanüle oder Verbänden variieren. - Bereiten Sie die Haut vor und tragen Sie die selbstklebenden Aufnahmeelektroden wie zuvor beschrieben auf.
- Legen Sie den Referenzelektrodengurt um den Arm, nur proximal zum Ellenbogen. Alternativ können Sie die Haut vorbereiten und eine selbstklebende Referenzelektrode über die seitliche Epicondyle des Humerus legen.
- Positionieren Sie den Patienten für den Test im Bett.
- Senken Sie die Bettschienen. Bewegen Sie den Patienten so hoch wie möglich auf dem Bett und in Richtung des Rands des Bettes auf der nicht-paretischen Seite.
HINWEIS: Der Patient sollte nur von geschultem Personal bewegt werden. - Stellen Sie die Bettschiene aus Sicherheitsgründen wieder auf die paretische Seite. Entfernen Sie nach Möglichkeit das Kopfteil des Bettes, und entfernen Sie alle nicht verwendeten IV-Pole, die am Bett befestigt sind und die Spulenposition behindern können.
- Heben Sie den Kopf des Bettes so hoch wie möglich. Positionieren Sie Kissen hinter dem Rücken des Patienten, um sie in eine aufrechte Sitzposition zu bringen, ohne dass ihr Kopf das Bett kontaktiert. Legen Sie kein Kissen hinter den Kopf. Wenn möglich, heben Sie die Knie an, um zu verhindern, dass der Patient während des Tests das Bett hinunterrutscht.
- Stellen Sie sicher, dass der paretische Unterarm in Pronation ist und vollständig durch ein Kissen vom Ellenbogen bis zum Handgelenk unterstützt wird. Prüfen Sie, ob der TMS-Spulenzugriff angemessen ist, indem Sie die TMS-Spule gegen den Kopf des Patienten halten. Nehmen Sie bei Bedarf Anpassungen an der Position des Patienten vor.
- Senken Sie die Bettschienen. Bewegen Sie den Patienten so hoch wie möglich auf dem Bett und in Richtung des Rands des Bettes auf der nicht-paretischen Seite.
- Positionieren Sie den Patienten in einem Stuhl oder Rollstuhl für den Test (alternative Option).
- Stellen Sie sicher, dass der Patient aufrecht und bequem im Stuhl sitzt. Legen Sie ein Kissen unter jeden Arm. Stellen Sie sicher, dass der paretische Unterarm proniert und vollständig vom Kissen unterstützt wird.
- Überprüfen Sie die EMG-Ablaufverfolgung: Schließen Sie die Kabel zwischen dem Patienten und der EMG-Einheit an. Stellen Sie sicher, dass das EMG-Signal frei von elektrischen Geräuschen ist.
- Liefern Sie TMS.
- Für den TMS-Test sollten zwei geschulte Mitarbeiter anwesend sein. Weisen Sie den Patienten an, geradeaus zu schauen, den Kopf still zu halten und die Augen offen zu halten.
- Die Person, die die Spule hält, sollte neben dem Kopf des Patienten auf ihrer nicht-paretischen Seite stehen und die Mitte der Spule über der Position des primären motorischen Kortex der hubbetroffenen Hemisphäre positionieren. Dieser ist ca. 4 cm seitlich vom Scheitelpunkt auf der interauralen Linie entfernt.
HINWEIS: Eine weitere Möglichkeit, die Position der Startspule zu identifizieren, besteht darin, etwa ein Drittel des Abstands vom Scheitelpunkt zur Vorderseite des Ohrs zu messen. - Richten Sie die Spule mit dem nach hinten zeigenden Griff in einem etwa 45°-Winkel in der mittelsagittalen Ebene aus, um einen hinteren zu vorderen Strom im darunterliegenden Gewebe zu erzeugen.
HINWEIS: Die in diesem Protokoll verwendete Spule ist eine flache Figur-acht-Spule, aber eine Branding-Spule oder kreisförmige Spule kann auch verwendet werden. - Passen Sie die Betthöhe für den Komfort des Spulenhalters an. Verwenden Sie ggf. einen Schritt. Die zweite Person (nicht der Spulenhalter) ist für die Überwachung des Patientenkomforts während der gesamten TMS-Sitzung verantwortlich. Sie können am Fußdese des Bettes stehen, um den Patienten zu überwachen und sicherzustellen, dass der Patient eine neutrale Kopfposition behält oder den Patienten vom Bett aus überwacht, während er die TMS-Gerätesteuerung bei Bedarf einstellt.
HINWEIS: Dies hängt von den einzelnen TMS-Setups ab. Der Patient sollte auf Komfort, Wachsamkeit und nebenwirkungen wie vasovagale Reaktionen auf das TMS überwacht werden. - Beginnen Sie mit einer Stimulusintensität von 30% maximaler Stimulatorleistung (MSO). Erhöhen Sie die Intensität in 10% MSO-Schritten mit drei bis fünf Reizen bei jeder Intensität und Kopfhautposition.
- Bewegen Sie die Spule systematisch in 1 cm Schritten in jede Richtung (vorder, hinter, medial, seitlich), um den optimalen Ort für die Produktion von MdEP in den aufgezeichneten Muskeln zu finden. Kleine Anpassungen der Spulenrotation können ebenfalls erforderlich sein.
- Erhöhen Sie weiterhin die Stimulusintensität und bewegen Sie die Spule, bis die MdEP konsequent in einer oder beiden Muskeln beobachtet werden oder bis 100% MSO erreicht ist.
- Wenn 100 % MSO erreicht werden, ohne dass MdEP beobachtet werden, verwenden Sie aktive Erleichterungen, um die ernäbte erregerbarkeit zu erhöhen und die Wahrscheinlichkeit, einen MdEP zu entlocken. Bitten Sie den Patienten, ein Kissen mit beiden Armen an der Brust zu umarmen und zu versuchen, ihre paretische UL so weit wie möglich zu aktivieren. Bei Patienten ohne distale UL-Aktivität bitten Sie sie, sich am Schultergurt zu erheben und zurückzuziehen.
- Klassifizieren Sie den MEP-Status des Patienten.
- Klassifizieren Sie den Patienten als MEP+, wenn MdEP mit einer Amplitude als Reaktion auf mindestens fünf Reize beobachtet werden. Dies kann entweder in Ruhe oder während der freiwilligen Erleichterung sein. Dl-Latenzen liegen in der Regel bei 20–30 ms, während ECR-Latenzen in der Regel 15 bis 25 ms betragen.
- Klassifizieren Sie den Patienten als MdEP- wenn ein MdEP nicht zu 100 % MSO entlockt werden kann, weder im Ruhezustand noch beim Versuch, freiwillige Erleichterungen zu erleichtern.
- Elektroden entfernen und die Haut mit einem Alkoholwisch abwischen. Die Haut kann leicht rot sein, aber dies löst sich in der Regel ohne jede Behandlung auf.
Ergebnisse
Der SAFE-Score und TMS können verwendet werden, um den Funktionsstatus des CST innerhalb einer Woche nach dem Schlaganfall zu ermitteln. Patienten, die am 3. Tag einen SAFE-Score von mindestens 5 haben oder MEP+ sind, wenn sie mit TMS getestet wurden, haben einen funktionellen CST und werden voraussichtlich zumindest eine gewisse Koordination und Geschicklichkeit wiedererlangen. Patienten, die MEP sind, haben keinen funktionellen CST und sind daher wahrscheinlich auf Verbesserungen der proximalen Armbewegungen und groben Bewegungen der Hand beschränkt. Der Funktionelle Status des CST kann daher verwendet werden, um Patienten für Studien auf der Grundlage ihrer Fähigkeit, geschickte Handfunktion wiederherzustellen, auszuwählen.
Der PREP2-Algorithmus sagt UL-Funktionsergebnisse voraus, indem er den SAFE-Score- und MEP-Status mithilfe dieses Protokolls erhält. Der PREP2-Algorithmus wurde bei Patienten ab 18 Jahren mit ischämischem oder hämorrhagischem Schlaganfall und neuer UL-Schwäche entwickelt und validiert, wie an anderer Stelle ausführlich beschrieben16,17,20. Eine wichtige Komponente des PREP2-Algorithmus ist die Bestimmung des MEP-Status mit TMS für Patienten mit einem SAFE-Score von weniger als 5. Die Patienten müssen auf ihre Eignung für das Verfahren geprüft werden. Dazu gehört auch das Ausfüllen einer Sicherheitscheckliste, die anschließend vom behandelnden Arzt überprüft und genehmigt wird. Der Zweck der Checkliste besteht darin, kontraindikationen oder Vorsichtsmaßnahmen für die Verwendung von TMS zu identifizieren, wie z. B. das Vorhandensein eines Herzschrittmachers, Krampfanfälle, Gehirnoperationen und Kopfverletzungen. Kontraindikationen und Vorsichtsmaßnahmen für TMS sind gut etabliert und wurden zuvor ausführlich beschrieben24.
Ein Patient gilt als MEP+, wenn ein MEP konstant in einer angemessenen Latenz (20–30 ms für dlIns, 15–25 ms für ECR) und mit einer Spitzen-zu-Spitzen-Amplitude anwesend ist. Der Patient ist MEP+, unabhängig davon, ob ein MdEP in Ruhe entlockt wird oder wenn er versucht, freiwillige UL-Erleichterungen zu erden. Der MdEP muss nur in einem Muskel vorhanden sein, damit der Patient als MEP+ betrachtet werden kann. Dieses Protokoll unterscheidet sich von anderen Protokollen, bei denen ein MEP bei einer Peak-to-Peak-Amplitude für mindestens 5 von 10 Spuren eine Überschreitung von 50 V überschreiten kann. Diese anderen Protokolle sollen die Ruhemotorschwelle des Patienten als Grundlage für eine weitere neurophysiologische Bewertung festlegen. Für die Vorhersage der UL-Wiederherstellung ist das einfache Vorhandensein oder Fehlen eines MEP ein stärkerer Prädiktor als mep Amplitude und die Identifizierung der Ruhemotorschwelle ist nicht erforderlich8,9,16,25.
Abbildung 2, Abbildung 3und Abbildung 4 enthalten Beispiele für EMG-Aufnahmen von Patienten, die innerhalb von 1 Woche nach einem Schlaganfall mit TMS getestet wurden.

Abbildung 2: Beispiele für MEP+-Patienten. (A) Dieser Patient hatte Abgeordnete in den paretischen FDI (obere Spur) und ECR-Muskeln (untere Spur). Die Latenz der direkt di MEP (25 ms) war erwartungsgemäß etwas länger als die EKR (21 ms). (B) Dieser Patient hatte Abgeordnete in den FDI- und ECR-Muskeln. Die Epinusamplitude des ECR war klein (40 V), trat jedoch zu einer entsprechenden Latenz zeit. Obwohl dieser Patient eindeutig über einen großen Direktinvestitionen-Abgeordneten hatte, würden sie allein auf der Grundlage der ECR-Spur als MEP+ betrachtet. (C) Dieser Patient hatte einen kleinen MEP im FDI-Muskel (40 V) und kein MEP im ECR-Muskel. Der MdEP trat zu einer entsprechenden Latenz (27,5 ms) auf. Dieser Patient kann als MEP+ betrachtet werden, da der MEP auf mindestens fünf Spuren beobachtet wurde (siehe Schritt 3.8.1 im Protokoll). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Beispiele für MEP-Patienten. Diese Patienten konnten die Abgeordneten im Ruhezustand nicht mit 100 % MSO nachweisen und versuchten, aktive bilaterale Erleichterungen zu ermöglichen, um die Wahrscheinlichkeit zu erhöhen, einen MdEP zu entlocken. Die EMG-Spuren zeigen keine Muskelaktivität während der Moderation aufgrund einer schweren Parese. (A) Dieser Patient hatte trotz aller Bemühungen, einen Muskel zu entlocken, keinen MdEP von einer Amplitude in beiden Muskeln. (B) Dieser Patient hatte keinen MEP im FDI-Muskel (obere Spur). Die untere Spur (ECR) enthält einen länglichen Schwanz des Stimulusartefakts. Wenn dies während des Latenzfensters für beide Muskeln vorhanden ist, kann die Identifizierung eines Abgeordneten schwierig sein. Siehe Abbildung 4 für Hinweise zur Fehlerbehebung bei EMG-Lärmproblemen. Wenn das Problem nicht gelöst werden kann, wird das Ergebnis der DL-Ablaufverfolgung verwendet, die in diesem Fall MEP-ist. (C) Die Fluktuation, die in der ECR-Muskel-EMG-Spur zu sehen ist, ist kein MdEP. Dies ist eine Motoreinheit, die sporadisch feuert. Diese können aufgrund ihrer einheitlichen Form und ihres Aussehens bei Latenzen identifiziert werden, die nicht der erwarteten Latenz für ECR entsprechen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
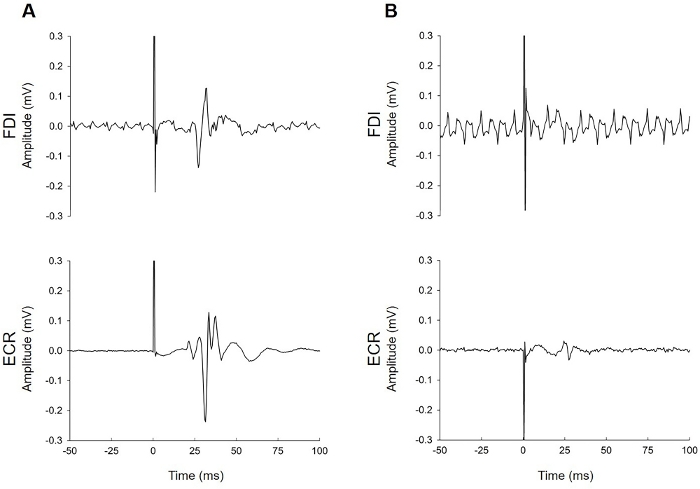
Abbildung 4: Beispiele für EMG-Spuren, die durch elektrisches Rauschen kontaminiert sind. (A) Dieser Patient hatte Abgeordnete in beiden Muskeln, die trotz des elektrischen Lärms in der Di-Spur eindeutig erkennbar sind. (B) Dieser Patient hatte Abgeordnete nur in der EKR. Laute Signale können ein häufiges Problem während der EMG-Aufnahme sein. Der Forscher muss sich überlegen, ob der Lärm ökologisch (aufgrund von Problemen mit elektrischem Rauschen im Raum oder im EMG-Setup) oder biologisch (zugrunde liegende Muskelaktivität des Patienten) ist. Fehlerbehebungsvorschläge umfassen, sind aber nicht beschränkt auf die Überprüfung, ob die Hautvorbereitung ausreichend war, die Elektrode hat den Kontakt mit der Haut verloren (dies ist besonders häufig bei FDI, wenn ein Patient Schweiß an den Händen hat), Probleme mit dem Erdungsband oder der Elektrode, Kabel sind fest am Patienten und der EMG-Einheit befestigt, jemand berührt den Patienten oder den TMS-Wagen während des Tests, entkoppeln das Bett von seiner elektrischen Stromversorgung, die Patientenposition, so dass sie in der Lage sind, mit ihren ULs vollständig auf Kissen unterstützt zu entspannen. In beiden Spuren war das Hintergrundgeräusch nur in einem Muskel vorhanden. Dies deutet darauf hin, dass Lärmprobleme spezifisch für das Setup für diesen Muskel waren (z. B. ein loses Kabel, schlechte Elektrodenleitung aufgrund mangelnden Kontakts mit der Haut oder eine fehlerhafte Elektrode). Geräusche, die in den Spuren für beide Muskeln vorhanden sind, weisen auf Probleme mit der Erdungselektrode oder des Gurtes oder elektrisches Rauschen in der Umgebung hin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die mit MEP-Status ausgewertete CST-Funktion ist ein wichtiger prognostischer Biomarker für die UL-Wiederherstellung und das Ergebnis nach einem Schlaganfall. Insgesamt 95% der Patienten mit einem funktionellen CST bei 1 Woche Nachschlag erreichen einen Action Research Arm Test (ARAT) Score von mindestens 34 von 57 durch 3 Monate poststroke17. Umgekehrt erreichen 100% der Patienten ohne funktionelles CST nach 1 Woche nach dem Schlaganfall einen ARAT-Score von weniger als 34 bis 3 Monaten nach dem Schlaganfall17. Die Bewertung der CST-Funktion innerhalb einer Woche nach dem Schlaganfall kann die Patientenauswahl und -schichtung in Studien verbessern, die auf die Verbesserung der UL-Wiederherstellung und der Ergebnisse nach einem Schlaganfall abzielen.
Die erste Überlegung für die TMS-Bewertung ist die Patientensicherheit. Die TMS-Sicherheitscheckliste sollte vor der TMS-Bewertung von einem Arzt überprüft und unterzeichnet werden. Die Checkliste muss auch am Tag der TMS-Bewertung mit dem Patienten überprüft werden, um zu bestätigen, dass es keine Änderungen an den Antworten auf die Checkliste gegeben hat. Es kann sinnvoller sein, den TMS-Test in einem separaten Behandlungsraum als im Bettraum des Patienten durchzuführen. In diesem Fall kann die Hautvorbereitung und Elektrodenplatzierung für Oberflächen-EMG im Bettbereich des Patienten stattfinden, bevor sie zum Verfahrensraum für TMS-Tests transportiert wird. Die Vorbereitung des Patienten im Bettbereich minimiert die Zeit für den Eingriff, was für einige Patienten erträglicher sein kann. Wenn der Patient zu einem Testraum transportiert wird, ist es wichtig, sicherzustellen, dass alle ergänzenden medizinischen Geräte (z. B. Sauerstofftherapie, IV-Leitungen, Katheter, aufblasbare Matratze) während und nach dem Transport angemessen funktionieren.
Auch die Patientenpositionierung ist ein wichtiger Aspekt. Ein Patient, der sehr müde Poststroke ist wahrscheinlich bequemer, wenn in ihrem Bett getestet, anstatt einen Stuhl. Das Testen eines Patienten im Bett kann anspruchsvoller sein, aber bei sorgfältiger Patientenpositionierung ist es möglich, die TMS-Spule angemessen über der UL-Darstellung des Motorkortex mit der richtigen Spulenausrichtung zu positionieren. Das Testen des Patienten in einem Stuhl erleichtert den Zugang zum Kopf mit der TMS-Spule, kann aber mit Patiententransfers größere Herausforderungen bieten.
Die in diesem Protokoll beschriebene TMS-Einrichtung kann je nach verfügbarer TMS-Ausrüstung und Patientenfaktoren variieren. Hier wurde eine flache Figur-acht-Spule verwendet, konnte aber durch eine Figur-acht-Branding-Spule oder kreisförmige Spule ersetzt werden. In ähnlicher Weise kann die Platzierung der Elektroden je nach Länge der Elektrodenleitungen oder Problemen mit der Platzierung aufgrund von Hautläsionen, IV Kanülen und Verbänden variieren. Typische Dl-Platzierung beinhaltet eine Elektrode über den FDI-Muskelbauch und eine über den seitlichen Aspekt des zweiten metacarpophalangealen Gelenks. Dieses Protokoll beschreibt eine Bauchsehnenmontage für die Positionierung von DL-Elektroden, wobei die zweite Elektrode auf dem Dorsum der Hand platziert wird. Das Platzieren der zweiten Elektrode über dem Dorsum der Hand ist hilfreich, wenn der Patient schwitzt oder die Elektroden selbst zu groß sind, um in die Standardkonfiguration zu passen.
Es ist wichtig, die TMS-Bewertung genau abzuschließen, insbesondere wenn festgestellt wird, dass ein Patient MEP-ist. Es müssen alle Anstrengungen unternommen werden, um einen MdEP zu entlocken, wenn möglich, einschließlich der Bereitstellung von Anreizen bei bis zu 100 % MSO, der Sicherstellung, dass der Patient während des Tests mit offenen Augen wach ist, und die Erleichterung der Muskelaktivierung in einem oder beiden Armen. Die in diesem Protokoll beschriebene Technik verwendet keine Neuronavigation, um den Hotspot für die TMS-Spule zu identifizieren. Dadurch entfällt die Notwendigkeit eines Magnetresonanztomographie-Scans (MRT) und die Dauer der Sitzung wird reduziert. Dies bedeutet jedoch auch, dass die Bewegung der Spule bei der Suche nach dem optimalen Stimulationsort systematisch und gründlich erfolgen muss, um sicherzustellen, dass alle Anstrengungen unternommen wurden, um einen Abgeordneten zu entlocken.
TMS ist nur für Patienten mit einem SAFE-Score von weniger als 5 erforderlich. Das bedeutet, dass TMS nur für etwa ein Drittel der Patienten benötigt wird, was die Kosten senkt und die Zugänglichkeit verbessert. Wenn TMS nicht verfügbar ist, sinkt die Genauigkeit der Vorhersagen für Patienten mit einem SAFE-Score von weniger als 5 % auf 55 %, selbst wenn MRT-Biomarker verfügbar sind17. Forschungs- und klinische Standorte ohne Zugang zu TMS können immer noch die erste Hälfte des PREP2-Algorithmus für Patienten mit einem SAFE-Score von 5 oder mehr abschließen. Dies würde jedoch die Auswahl von Patienten für Forschungsstudien auf diejenigen beschränken, die eine leichte bis moderate UL-Schwäche haben.
Der SAFE-Score und TMS sind in der klinischen Praxis nützlich und bieten Forschern eine prinzipientreue Methode zur Auswahl und Stratifizierung von Patienten für klinische Studien auf der Grundlage der CST-Funktion und der neurobiologischen Fähigkeit des Patienten zur UL-Wiederherstellung.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken Professor Winston Byblow und Harry Jordan für ihren wertvollen Beitrag zu dieser Arbeit. Diese Arbeit wurde vom Health Research Council of New Zealand finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| alcohol/skin cleansing wipes | Reynard | alcohol prep pads | |
| electromyography electrodes | 3M | red dot electrodes | |
| Magstim TMS coil | Magstim | flat figure-8 coil | |
| razors | any | ||
| skin prep tape | 3M | red dot skin prep tape | |
| TMS stimulator | Magstim | Magstim 200 single pulse stimulator |
Referenzen
- Veerbeek, J. M., Kwakkel, G., van Wegen, E. E., Ket, J. C., Heymans, M. W. Early prediction of outcome of activities of daily living after stroke: a systematic review. Stroke. 42 (5), 1482-1488 (2011).
- Lohse, K. R., Schaefer, S. Y., Raikes, A. C., Boyd, L. A., Lang, C. E. Asking New Questions with Old Data: The Centralized Open-Access Rehabilitation Database for Stroke. Frontiers in Neurology. 7, 153(2016).
- Stinear, C., Ackerley, S., Byblow, W. Rehabilitation is initiated early after stroke, but most motor rehabilitation trials are not: a systematic review. Stroke. 44 (7), 2039-2045 (2013).
- Stinear, C. M. Prediction of recovery of motor function after stroke. Lancet Neurology. 9 (12), 1228-1232 (2010).
- Byblow, W. D., Stinear, C. M., Barber, P. A., Petoe, M. A., Ackerley, S. J. Proportional recovery after stroke depends on corticomotor integrity. Annals of Neurology. 78 (6), 848-859 (2015).
- Stinear, C. M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurology. 16 (10), 826-836 (2017).
- Kim, B., Winstein, C. Can Neurological Biomarkers of Brain Impairment Be Used to Predict Poststroke Motor Recovery? A Systematic Review. Neurorehabilitation and Neural Repair. 31 (1), 3-24 (2016).
- Boyd, L. A., et al. Biomarkers of stroke recovery: Consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. International Journal of Stroke. 12 (5), 480-493 (2017).
- Escudero, J. V., Sancho, J., Bautista, D., Escudero, M., Lopez-Trigo, J. Prognostic value of motor evoked potential obtained by transcranial magnetic brain stimulation in motor function recovery in patients with acute ischemic stroke. Stroke. 29 (9), 1854-1859 (1998).
- Pennisi, G., et al. Absence of response to early transcranial magnetic stimulation in ischemic stroke patients: prognostic value for hand motor recovery. Stroke. 30 (12), 2666-2670 (1999).
- Rapisarda, G., Bastings, E., de Noordhout, A. M., Pennisi, G., Delwaide, P. J. Can motor recovery in stroke patients be predicted by early transcranial magnetic stimulation? Stroke. 27 (12), 2191-2196 (1996).
- Bembenek, J. P., Kurczych, K., Karli Nski, M., Czlonkowska, A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke - a systematic review of the literature. Functional Neurology. 27 (2), 79-84 (2012).
- Smania, N., et al. Active finger extension: a simple movement predicting recovery of arm function in patients with acute stroke. Stroke. 38 (3), 1088-1090 (2007).
- Nijland, R. H., van Wegen, E. E., Harmeling-van der Wel, B. C., Kwakkel, G. EPOS Investigators. Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke. 41 (4), 745-750 (2010).
- Katrak, P., et al. Predicting upper limb recovery after stroke: the place of early shoulder and hand movement. Archives of Physical Medicine and Rehabilitation. 79 (7), 758-761 (1998).
- Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., Byblow, W. D. The PREP algorithm predicts potential for upper limb recovery after stroke. Brain. 135 (Pt 8), 2527-2535 (2012).
- Stinear, C. M., et al. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Annals of Clinical and Translational Neurology. 4 (11), 811-820 (2017).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1 (8437), 1106-1107 (1985).
- Stinear, C. M., Byblow, W. D., Ackerley, S. J., Barber, P. A., Smith, M. C. Predicting Recovery Potential for Individual Stroke Patients Increases Rehabilitation Efficiency. Stroke. 48 (4), 1011-1019 (2017).
- Connell, L. A., Smith, M. C., Byblow, W. D., Stinear, C. M. Implementing biomarkers to predict motor recovery after stroke. NeuroRehabilitation. 43 (1), 41-50 (2018).
- Smith, M. C., Ackerley, S. J., Barber, P. A., Byblow, W. D., Stinear, C. M. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabilitation and Neural Repair. 33 (8), 635-642 (2019).
- Stinear, C., Byblow, W., Ackerley, S., Smith, M. C. PRESTO: predict stroke outcomes. , http://www.presto.auckland.ac.nz (2019).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety of TMS Consensus Group. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology. 120 (12), 2008-2039 (2009).
- Talelli, P., Greenwood, R. J., Rothwell, J. C. Arm function after stroke: neurophysiological correlates and recovery mechanisms assessed by transcranial magnetic stimulation. Clinical Neurophysiology. 117 (8), 1641-1659 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten