Method Article
Ein dezentralisiertes (Ex Vivo) Murine Blasenmodell mit dem Detrusormuskel entfernt für direkten Zugang zum Suburothelium während der Blasenfüllung
In diesem Artikel
Zusammenfassung
Das detrusorfreie Blasenmodell ermöglicht den direkten Zugang zum Suburothel, um lokale Mechanismen zur Regulierung der biologisch aktiven Mediatorverfügbarkeit in Suburothelium/Lamina propria während der Lagerung und Leerung von Urin zu untersuchen. Das Präparat ähnelt dem Füllen einer intakten Blase und ermöglicht Druckvolumenstudien ohne systemische Einflüsse.
Zusammenfassung
Frühere Studien haben die Freisetzung chemischer Substanzen aus flachen Blasenschleimhautplatten, die in Ussing-Kammern angebracht und Veränderungen des hydrostatischen Drucks oder der mechanischen Dehnung und von kultivierten Urothelzellen bei hydrostatischen Druckänderungen, Dehnungs-, Zellschwellungs- oder Schleppkräften und in Blasenlumen am Ende der Füllung ausgesetzt sind, festgestellt. Solche Ergebnisse führten zu der Annahme, dass diese Mediatoren auch in Suburothelium (SubU)/Lamina propria (LP) während der Blasenfüllung freigesetzt werden, wo sie Zellen tief in der Blasenwand beeinflussen, um letztendlich die Blasenerregbarkeit zu regulieren. Es gibt mindestens zwei offensichtliche Einschränkungen in solchen Studien: 1) Keiner dieser Ansätze liefert direkte Informationen über das Vorhandensein von Mediatoren in SubU/LP, und 2) die verwendeten Reize sind nicht physiologisch und rekapitulieren nicht die authentische Füllung der Blase. Hier diskutieren wir ein Verfahren, das den direkten Zugang zur suburotheliale Oberfläche der Blasenschleimhaut im Verlauf der Blasenfüllung ermöglicht. Das murine detrusorfreie Präparat, das wir erstellt haben, ähnelt der Füllung der intakten Blase und ermöglicht druckvolumende Untersuchungen an der Blase in Ermangelung verwirrender Signale durch Wirbelsäulenreflexe und Detrusor-Glattmuskel. Anhand des neuartigen detrusorfreien Blasenmodells haben wir kürzlich gezeigt, dass intravesische Messungen von Mediatoren nicht als Proxy für das verwendet werden können, was während der Blasenfüllung im SubU/LP freigesetzt oder vorhanden ist. Das Modell ermöglicht die Untersuchung von urothelium-abgeleiteten Signalmolekülen, die freigesetzt, durch Stoffwechsel erzeugt und/oder im Laufe der Blasenfüllung in den SubU/LP transportiert werden, um Informationen an Neuronen und glatten Muskel der Blase zu übertragen und ihre Erregbarkeit während der Kontinenz und Micturition zu regulieren.
Einleitung
Der Zweck dieses Modells ist es, den direkten Zugang zur submukossalen Seite der Blasenschleimhaut während verschiedener Phasen der Blasenfüllung zu ermöglichen.
Die Blase muss auf eine vorzeitige Kontraktion während der Befüllung verzichten und entleeren, wenn kritisches Volumen und Druck erreicht werden. Abnormale Kontinenz oder Leerung des Urins sind häufig mit abnormaler Erregbarkeit des Detrusor glatten Muskels (DSM) im Laufe der Blasenfüllung verbunden. Die Erregbarkeit von DSM wird durch Faktoren bestimmt, die den glatten Muskelzellen innewohnen, und durch Einflüsse, die von verschiedenen Zelltypen innerhalb der Blasenwand erzeugt werden. Die Wand der Harnblase besteht aus Urothelium (Mukosa), Suburothelium (SubU)/lamina propria (LP), Detrusor glatter Muskel (DSM) und Serosa (Abbildung 1A). Das Urothel besteht aus Schirmzellen (d.h. der äußersten Schicht des Urothel), Zwischenzellen und Basalzellen (d. h. der innersten Schicht des Urothel). Verschiedene Arten von Zellen, einschließlich interstitielle Zellen, Fibroblasten, affefente Nerventerminals, kleine Blutgefäße und Immunzellen befinden sich in der SubU/LP. Es wird allgemein angenommen, dass das Blasenurothel ein Sinnesorgan ist, das Reflex-Micturition und Kontinenz initiiert, indem es Mediatoren in die Submukose freisetzt, die Zellen in der SubU/ LP und im DSM1,2,3. Zum größten Teil basieren solche Annahmen auf Studien, die die Freisetzung von Mediatoren gezeigt haben: aus Schleimhautteilen, die Veränderungen des hydrostatischen Drucks ausgesetzt sind4,5; von kultivierten urotheliale Zellen, die dehnung6,7, Hypotonizität-induzierte Zellschwellung7 oder Schleppkräfteausgesetzt 8; von isolierten Blasenwandstreifen auf Rezeptor oder Nervenaktivierung9,10,11,12,13,14; und in Blase Lumen am Ende der Blasenfüllung15,16,17,18,19. Während solche Studien entscheidend waren, um die Freisetzung von Mediatoren bei mechanischer Stimulation von Blasenwandsegmenten oder kultivierten Urothelzellen zu demonstrieren, müssen sie durch direkte Beweise für die Freisetzung von Mediatoren in der Submucosa gestützt werden, die durch physiologische Reize ausgelöst werden, die die Blasenfüllung reproduzieren. Dies ist eine schwierige Aufgabe, da sich der SubU/LP tief in der Blasenwand befindet und den direkten Zugang zur Nähe von SubU/LP während der Blasenfüllung behindert.
Hier illustrieren wir ein dezentralisiertes (ex vivo) murines Blasenmodell mit dem Detrusormuskel entfernt13, das entwickelt wurde, um Studien über lokale Mechanismen der Mechanotransduktion zu erleichtern, die an der Signalisierung zwischen dem Blasenurothel, DSM und anderen Zelltypen in der Blasenwand teilnehmen. Dieser Ansatz ist der Verwendung von flachen Blasenwandblättern, Blasenwandstreifen oder kultivierten Urothelzellen überlegen, da er direkte Messungen in der Nähe von SubU/LP von Urothel-abgeleiteten Mediatoren ermöglicht, die als Reaktion auf physiologische Drücke und Volumina in der Blase freigesetzt oder gebildet werden und mögliche phänotypische Veränderungen in der Zellkultur vermeiden. Es kann verwendet werden, um Verfügbarkeit, Freisetzung, Stoffwechsel und transurotheliale Transport von Mediatoren in SubU/LP in verschiedenen Stadien der Blasenfüllung zu messen (Abbildung 1B). Das Präparat kann auch verwendet werden, um urotheliale Signalisierung und Mechanotransduktion in Modellen von überaktiven und unteraktiven Blasensyndromen zu untersuchen.
Protokoll
Alle in diesem Manuskript beschriebenen Verfahren mit Tieren wurden gemäß dem National Institutes of Health Guide for the Care and Use of Laboratory Animals und dem Institutional Animal Use and Care Committee an der University of Nevada durchgeführt.
ANMERKUNG: Das hier vorgestellte Modell besteht in der Entfernung des Detrusormuskels, während das Urothel und SubU/LP intakt bleiben (Abbildung 1B), um den Ermittlern den direkten Zugang zu SubU/LP im Verlauf der Blasenfüllung zu ermöglichen.
1. Zerlegung der detrusorfreien Blasenpräparation
- Die isolierte Blase in eine mit Kälte (10 °C) gefüllte und mit 5% CO2/95 %O2 Krebs Bicarbonatlösung (KBS) gefüllte Sezschale (mM) legen: 118,5 NaCl, 4.2 KCl, 1.2 MgCl2, 23.8 NaHCO3, 1.2 KH2PO4, 11.0 dextrose, 1.8 CaCl2 (pH 7.4)13.
- Pin einen kleinen Teil der Kuppel der isolierten Blase an eine Sylgard-bedeckte Sezieren Schale mit KBS gefüllt. Stellen Sie sicher, dass der Stift durch ein Stück der Serosa oder den äußersten Rand des Detrusormuskels weit weg vom innersten Rand des Muskels geht, der dem SubU/LP gegenübersteht.
- Identifizieren Sie mit einem Mikroskop die Harnröhre und harnstoffer und heften Sie sie an den Boden der Sezschale.
- Entfernen Sie die überschüssigen Fett- und Bindegewebe, so dass der gesamte Hauptkörper der Blase, die Harnröhre und beide Harnleiter angezeigt werden.
- Binden Sie die Harnleiter mit 6-0 Nylon Nähte. Dann heften Sie die offenen Enden der Harnleiter an den Boden der Sezschale, um die Zubereitung zu sichern.
- Mit feiner Spitzenzange ziehen Sie vorsichtig ein Stück des Serosa an der Ecke zwischen Harnleiter und Blasenkörper.
- Passen Sie das Licht des Mikroskops an, um die Transparenz zu erhöhen und den Rand der Submukosa unter dem Detrusormuskel zu unterscheiden.
- Beginnen Sie mit dem Schneiden(nicht schälen!) die Blasenwand mit einer Feinspitze scheren entlang der Innenseite der Detrusor-Muskelschicht, während Sie das geschnittene Segment sanft von der Zubereitung wegziehen. Stellen Sie jederzeit sicher, dass die seitliche Kante der Schleimhaut sichtbar ist und vermeiden Sie es zu berühren.
- Entfernen Sie den Detrusormuskel vollständig, indem Sie die Sezierende Schale umdrehen, so dass die Position des Präparats bequem ist, um den Detrusormuskel weiter zu sezieren.
- Lassen Sie ein kleines Stück Detrusormuskel auf der Oberseite der Blasenkuppel, um die Fähigkeit zu gewährleisten, die Vorbereitung während der verbleibenden Schritte des Protokolls zu immobilisieren.
- Machen Sie eine doppelte Schleife von 6-0 Nylonfaden, legen Sie es um den Hals der Blase Vorbereitung, und lassen Sie die Schleife locker.
- Fügen Sie eine zweite Doppelschleife von 6-0 Seidenfaden, legen Sie es um den Hals der Blase Vorbereitung, und lassen Sie die Schleife verlieren. Zwei Nähte zu haben verhindert Lecks um die Nähte.
- Schneiden Sie ca. 2 cm von 20 PE-Schläuche (Katheter), aufflackern Sie die Spitze, indem Sie langsam die Spitze in der Nähe einer Flamme bewegen.
- Füllen Sie den Katheter mit warmen (37 °C) sauerstoffhaltigen KBS.
- Legen Sie den Katheter in die Öffnung der Harnröhre der Blase ein und drücken Sie den Katheter vorsichtig, bis die Katheterspitze ungefähr die Mitte der Blase erreicht.
- Binden Sie die Naht um den Katheter und das umgebende Gewebe des Blasenhalses.
- Füllen Sie die Blase langsam mit ca. 50-100 l warmem (37 °C) sauerstoffhaltigem KBS, heben Sie sie kurz (<10 s) über die Oberfläche von KBS und überwachen Sie Leckagen an den Nähten und dem Blasenkörper.
- Wenn kein Leck beobachtet wird, ist die Vorbereitung für das Experiment bereit. Wenn ein Leck um die Naht beobachtet wird, entfernen Sie die Naht und ersetzen Sie sie. Wenn ein Leck aus einem Loch im Blasenkörper bemerkt wird, entsorgen Sie das Präparat.
2. Füllung der denuded Blasenvorbereitung
- KBS (37 °C) in eine 3 ml Kammer einer wassergemantelten Organschale mit Sylgardboden durchdringen.
- Stellen Sie die Sauerstoff- und Saugleitungen ein.
- Legen Sie das denuded Blasenpräparat in die Kammer.
- Sichern Sie den Katheter an der Seite der Kammer, damit das Präparat nicht über der Oberfläche der Perfusionslösung schwebt.
- Schließen Sie den Blasenkatheter an einen längeren PE20-Schlauch (Infusionsleitung) an, der mit dem Drei-Wege-Stopphahn verbunden ist, und verwenden Sie die gleiche Größe.
- Stellen Sie sicher, dass die Leitungen zwischen der Infusionspumpe, dem Druckaufnehmer und der Blase offen sind.
- Füllen Sie die Infusionsspritze mit frischen, warmen (37 °C) und sauerstoffhaltigen KBS.
- Passen Sie die Pumpenparameter an: Spritzentyp/-volumen (d. h. 1 ml), Betrieb (d. h. Infuse), Durchfluss (d. h. konstante) und Durchfluss (d. h. 15 l/min).
- Drücken Sie die Starttaste an der Spritzenpumpe, um die Blase zu füllen.
- Überwachen Sie Füllvolumen und intravesischen Druck während der Blasenfüllung.
3. Nachweis von Mediatoren im SubU/LP-Aspekt der denuded Blasenvorbereitung
- Sammeln Sie Aliquots der Badlösung in eiskalte Mikrozentrifugenrohre oder Hochleistungs-Flüssigkeitschromatographie (HPLC)-Einsätze.
- Bereiten Und verarbeiten Sie die Proben entsprechend der entsprechenden Erkennungsanwendung. Im Falle der Detektion der Purinverfügbarkeit verarbeiten Sie die Proben mit HPLC mit Fluoreszenzdetektion13,18.
Ergebnisse
Die Wand der murinen detrusorfreien Blasenzubereitung ist intakt und enthält alle Schichten außer dem DSM und serosa. Proof-of-Principle-Studien zeigten, dass die DSM-freie Blasenwand Urothelium und SubU/LP enthält, während die Tunika muscularis und die Serosa fehlen (Abbildung 2)13.
Die Füllung der detrusorfreien Blase entspricht der normalen Blasenfüllung. Abbildung 3 zeigt Schaltpläne des Versuchsaufbaus zum Füllen von Ex-vivo-Blasenpräparaten bei unterschiedlichen Füllraten, Volumen und intraluminalen Drücken. Die murinen ex vivo intakten und denuded Blasenpräparaten erfordern eine breite Palette von Füllvolumen, um Denhohlraum zu erreichen13. Die Druck-Volumen-Beziehungen sind in den intakten und denuded Vorbereitungen bemerkenswert ähnlich (Film 1, Film 2und Abbildung 4). Daher eignet sich die DSM-freie Zubereitung für funktionelle Studien über die Rolle von Urothelium und SubU/LP bei Blasenmechanosensation und Mechanotransduktion.
Mögliche Verwendung des detrusorfreien Blasenmodells
Messung der Verfügbarkeit von Mediatoren in Blasenlumen und SubU/LP während der Blasenfüllung
Die Versuchseinrichtung zum Sammeln von Extraluminalproben (EL; z. B. Badeproben SubU/LP) und Intraluminal (IL) während des Füllens von Blasenpräparaten während der Überwachung des Blasendrucks ist in Abbildung 5dargestellt. Die Eignung des Modells zur Messung von Urothelum-abgeleiteten Mediatoren, die während der Befüllung in der SubU/LP-Seite freigesetzt werden, wurde durch Messung der Freisetzung von Purinmediatoren (z. B. Adenosin 5'-Triphosphat, ATP; Adenosin 5'-Diphosphat, ADP; Nicotinamid-Adenin-Dinukleotid, NAD; Adenosin 5'-Monophosphat, AMP; und Adenosin, ADO) in der Lösung, die den SubU/LP der denuded Zubereitung badet. Wie in Abbildung 6Adargestellt, wurden im Bad vernachlässigbare Mengen an Purinen mit einem isolierten Blasenpräparat mit intaktem DSM nachgewiesen, während die Mengen dieser Purine in Proben, die aus dem Bad mit einem denuded Blasenpräparat entnommen wurden, signifikant höher waren(Abbildung 6B). Insbesondere die Verteilung von Purinen und Metaboliten in Proben, die aus dem Lumen und dem SubU/LP am Ende der Füllung entnommen wurden, unterschied sich erheblich(Abbildung 6C).
Untersuchung des extrazellulären Metabolismus von Mediatoren in SubU/LP während der Blasenfüllung
Die Zugabe des hochfluoreszierenden Analogons von ATP, 1,N6-etheno-ATP (ATP) auf die suburotheliale Seite der detrusorfreien Zubereitung führte zu einer Abnahme der atP und einer Zunahme der ATP-Produkte "ADP", "AMP" und "ADO"(Abbildung 7Aa und Abbildung 7Ab). Ebenso führte die Zugabe von 'ATP zum Präparationslumen zu einer Abnahme von 'ATP und einer Erhöhung der 'ADP, 'AMP und 'ADO' im Lumen (Abbildung 7Ba und Abbildung 7Bb). Daher eignet sich das Modell für Studien des Stoffwechsels von bioaktiven Mediatoren auf beiden Seiten des Urothel während der Blasenfüllung.
Untersuchen Sie den transurotheliale Transport von Mediatoren während der Blasenfüllung
Die Zugabe von 'ATP zur SubU/LP-Seite des denuded-Präparats führte zu dem Auftreten von 'AMP,'ADO und einigen 'ADP' im Lumen, was darauf hindeutet, dass Purine von der SubU/LP zum Lumen13 transportiert werden können (Abbildung 7Ac). Ebenso führte das Hinzufügen von 'ATP in das Lumen zur Darstellung von 'AMP' und 'ADO' in SubU/LP13 (Abbildung 7Db). Beachten Sie, dass auf der gegenüberliegenden Seite der Anwendung kein ATP beobachtet wurde. Zusammen deuten diese Beobachtungen stark darauf hin, dass die detrusorfreie Blasenpräparation für Studien über den bilateralen transurotheliale Transport von Mediatoren während der Füllung geeignet ist.
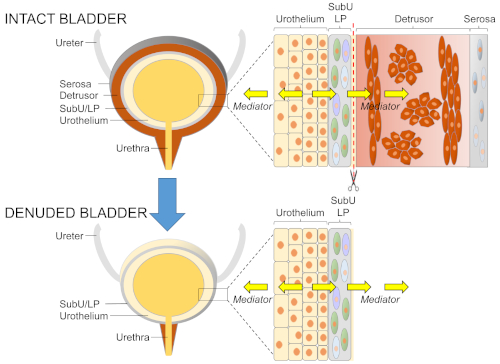
Abbildung 1: Prinzip des detrusorfreien Blasenmodells. (A) Die Blasenwand besteht aus Urothelium, Suburothelium/Lamina propria (SubU/LP), Detrusormuskel und Serosa. Jede dieser Schichten enthält verschiedene Zelltypen, die für Blasenfunktionen während der Lagerung und Leerung von Urin wichtig sind. Während der Blasenfüllung werden biologisch aktive Mediatoren aus dem Urothel in das Blasenlumen und in die SubU/LP freigesetzt, um Zellen tief in der Blasenwand, einschließlich des Detrusormuskels, zu beeinflussen. Während der Zugang zum Blasenlumen relativ einfach ist, gibt es keinen direkten Zugang zum SubU/LP während der Füllung, um urothelium-abgeleitete Mediatoren zu erkennen, die Zellen in der Blasenwand beeinflussen und die Erpressbarkeit des Detrusators beeinflussen könnten. (B) Die Entfernung der Detrusormuskelschichten zusammen mit der Serosa setzt die gesamte Oberfläche von SubU/LP frei, wo ein direkter Zugang zum SubU/LP ermöglicht, wo urotheliumabgeleitete Signalmoleküle in verschiedenen Phasen der Blasenfüllung gemessen werden können. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
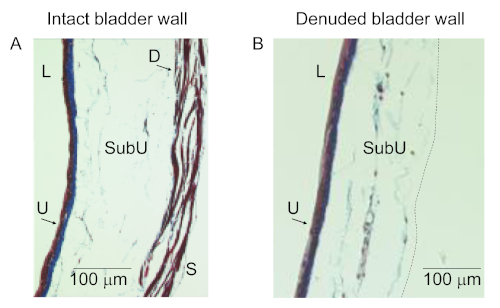
Abbildung 2: Histologie der murinen intakten und detrusorfreien Blasenwände. Massons trichrome Färbung von intakt enfilled (A) und detrusorfreien (B) Blasenwänden zeigt, dass das denuded Präparat intaktes Urothel (U) und SubU/LP enthält, aber nicht die Detrusormuskulatur (D) und Serosa (S). L, lumen. Diese Zahl wurde aus einer früheren Veröffentlichung13wiedergegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
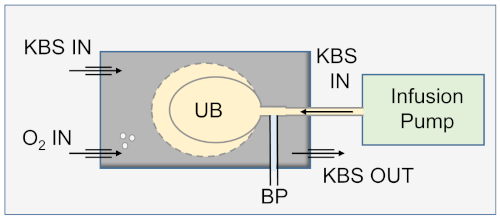
Abbildung 3: Schematische Darstellung des Versuchsaufbaus, der bei der Füllung von Ex-vivo-Blasenpräparaten verwendet wird. Das ex vivo intakte oder denuded Harnblase (UB) Präparat wird in eine warme (37 °C) wasserummantelte Organkammer gelegt, die mit sauerstoffhaltiger Krebs-Bicarbonat-Lösung (KBS, 37 °C, pH 7,4) durchlässig ist. Das Blasenpräparat wird mit KBS zu unterschiedlichen Füllraten und Volumina infundiert und der intraluminale Blasendruck (BP) wird während des gesamten Experiments aufgezeichnet Diese Zahl wurde aus einer früheren Publikation13reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
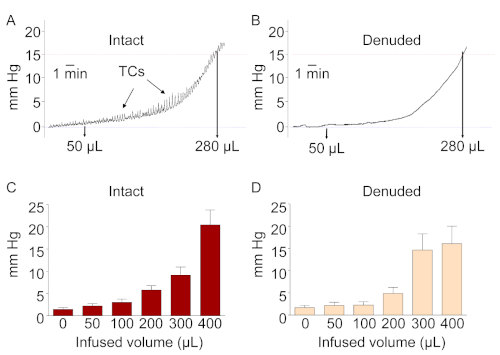
Abbildung 4: Druck-Volumen-Beziehungen in intakten und detrusorfreien Präparaten. (A) und (B) sind repräsentative Aufnahmen des intravesischen Volumens und des Drucks von ex vivo intakten und denuded Blasenpräparaten, die mit Krebs-Bicarbonat-Lösung bei 15 l/min gefüllt sind. Wie erwartet entwickelte die intakte Zubereitung aufgrund des Vorhandenseins des Detrusors vorübergehende Kontraktionen (TCs). Im Gegensatz dazu fehlten in der denuded Vorbereitung TCs. (C) und (D) zeigen zusammengefasste Daten der Druck-Volumen-Beziehungen von intakten und denuded Blasenpräparaten, die >250 L Lösung aufnehmen. Beachten Sie, dass die Füllmengen und intravesischen Drücke in den intakten und denuded Blasenpräparaten bemerkenswert ähnlich waren. Diese Zahl wurde aus einer früheren Veröffentlichung13wiedergegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
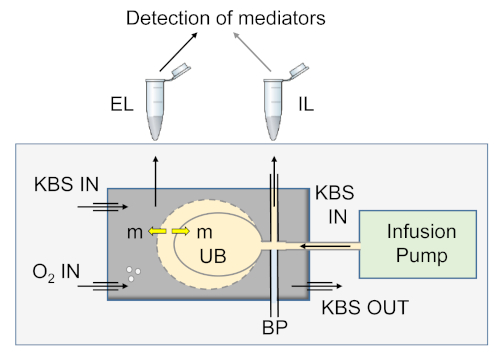
Abbildung 5: Schematische Darstellung des isolierten Blasenmodells, das zur Bewertung der Verfügbarkeit von Urothelum-abgeleiteten Mediatoren in SubU/LP und Lumen während der Füllung verwendet wird. Das Blasenpräparat wird in eine Wassermantelkammer gelegt und mit sauerstoffhaltiger Krebs Bicarbonatlösung (KBS) überlagert. Die Harnblase (UB) wird über einen Katheter in der Harnröhre, die mit einer Infusionspumpe verbunden ist, mit warmsauerstoffhaltigem KBS gefüllt. Der Blasendruck (BP) wird während der Blasenfüllung über einen Drei-Wege-Anschluss durch die Infusionsleitung überwacht. Proben aus extraluminalen (EL, Organbad) und intraluminalen (IL) Lösungen werden zur Detektion von Mediatoren (m) nach Nachweisanwendungen verarbeitet. Diese Zahl wurde aus einer früheren Veröffentlichung13wiedergegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Die detrusorfreie Blasenpräparation eignet sich zur Messung der Verfügbarkeit von Mediatoren in SubU/LP während der Befüllung. Repräsentative Chromatogramme, die die Verfügbarkeit von Purinen in den extraluminalen Proben in intakten (A) und detrusorfreien (B) Blasenpräparaten belegen. Beachten Sie, dass Purinmediatoren in der denuded Vorbereitung besser erkannt werden als in der intakten Zubereitung. (C) Der relative Beitrag einzelner Purine zu den im Lumen und in SubU/LP der denuded Präparation nachgewiesenen Purinbecken ist erheblich unterschiedlich. Diese Zahl wurde aus einer früheren Veröffentlichung13wiedergegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
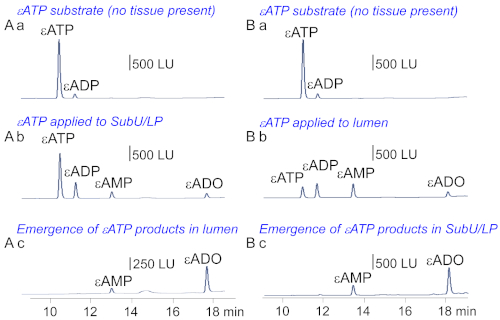
Abbildung 7: Das detrusorfreie Blasenpräparat eignet sich zur Untersuchung des Stoffwechsels und des transurotheliale Transports von Mediatoren während der Blasenfüllung. (A,B) Repräsentative Chromatogramme, die das Substrat von ATP (Aa,Ba) zeigen. Wenn das Substrat entweder auf die SubU/LP (Ab) oder das Lumen (Bb) angewendet wird, wurde die Strate verringert und die Produkte "ADP", "AMP" und "ADO" erhöht. Daher wird die Anwendung auf beiden Seiten der Anwendung herabgestuft. Die Bildung von ATP-Produkten ist jedoch in SubU/LP und Lumen asymmetrisch. Beachten Sie, dass die Produkte von 'ATP' und -ADO, aber nicht das Substrat 'ATP' auf der gegenüberliegenden Seite der Anwendung von 'ATP ' (Ac,Bc) erschienen. Daher scheinen Purine während der Ablage durch die Wand der detrusorfreien Zubereitung transportiert zu werden. Diese Zahl wurde von13geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Video 1: Repräsentative Aufzeichnung der intakten Blasenfüllung. Die Blase wurde mit 15 l/min gefüllt. Video wurde mit einem Zoom-Stereomikroskop mit einer aufgeladenen gekoppelten Gerätekamera (CCD) bei 5 Hz aufgenommen; die Aufnahme wurde bei Erreichen des Intraluminaldrucks von 25 mmHg gestoppt. Die volle Dauer des Bildes beträgt 64x Echtzeit. Dieses Video wurde von13reproduziert. Bitte klicken Sie hier, um dieses Video anzusehen (Rechtsklick zum Download).

Video 2: Repräsentative Aufzeichnung der detrusorfreien Blasenfüllung. Die Blase wurde mit 15 l/min gefüllt. Video wurde mit einem Zoom-Stereomikroskop mit einer CCD-Kamera bei 5 Hz aufgenommen; Die Aufnahme wurde bei Erreichen des Intraluminaldrucks von 25 mm Hg gestoppt. Die volle Dauer des Bildes beträgt 64-mal in Echtzeit. Dieses Video wurde von13reproduziert. Bitte klicken Sie hier, um dieses Video anzusehen (Rechtsklick zum Download).
Diskussion
Die Blase hat zwei Funktionen: Lagerung und Leerung von Urin. Der normale Betrieb dieser Funktionen erfordert eine ordnungsgemäße mechanische Erfassung des intraluminalen Volumens und des Drucks sowie die Transduktion von Signalen durch Zellen in der Blasenwand, um die Erregbarkeit der Detrusormuskulatur zu regulieren. Die Blasenschleimhaut (Urothelium) wird geglaubt, um Blasenerregbarkeit zu regulieren, indem eine Vielzahl von Signalmolekülen in der SubU/LP freigesetzt wird, die zahlreiche Zelltypen in der Blasenwand beeinflussen. Derzeit sind die meisten Versuche zur Charakterisierung von Urothelum-abgeleiteten Mediatoren die Verwendung von Blasenpräparaten (z. B. flache Blasenwandblätter, Blasenwandstreifen oder kultivierte Zellen), die keine physiologische Blasenfüllung reproduzieren. Messungen von Mediatoren, die im Blasenlumen am Ende der Blasenfüllung freigesetzt werden, werden häufig als Indikation für die Freisetzung dieser Mediatoren von der gegenüberliegenden Seite des Urothel verwendet. Neuere Studien deuten jedoch darauf hin, dass der intraluminale Gehalt von Mediatoren nicht repräsentativ für das ist, was tief in der Blasenwand verfügbar ist13. Neue experimentelle Ansätze, die den Zugang zu SubU/LP während der Blasenfüllung ermöglichen, sind erforderlich, um unser Verständnis der lokalen Signalmechanismen zwischen Blasenurothelium, SubU/LP und DSM zu fördern.
Hier zeigen wir ein neuartiges Tierblasenmodell, bei dem der Detrusormuskel entfernt wird, um direkten Zugang zu Mediatoren zu ermöglichen, die während der Füllung13aus dem Urothel in SubU/LP freigesetzt werden. Das denuded Präparat ähnelt der Füllung der intakten Blase13,18, was darauf hindeutet, dass das Fehlen des Detrusormuskels die mechanosensitiven Eigenschaften des Urothel während der Blasenfüllung nicht verändert. Das Präparat ermöglicht druck-Volumen-Studien an der Blase in Ermangelung einer verwirrenden Signalisierung durch Wirbelsäulenreflexe und Detrusormuskel. Daher können in SubU/LP freigesetzte Mediatoren ohne systemische Einflüsse oder Kontamination aus anderen Quellen gemessen werden. Die Möglichkeit, während der Blasenfüllung direkt auf die Umgebung von SubU/LP bei unterschiedlichen Volumina und Drücken zuzugreifen, macht das Modell geeignet, Freisetzung, Stoffwechsel und transurotheliale Transport biologisch aktiver Mediatoren während der Lagerung stell- und vorentleerungs Stufen der Blasenfüllung zu untersuchen.
Der wichtigste Schritt in diesem Protokoll ist die Entfernung des Detrusor glatten Muskels, während das Urothel und SubU/LP intakt zu halten. Das Verfahren ist besonders einfach in der Mausblase aufgrund der lockeren Verbindung zwischen dem Detrusormuskel und SubU/LP. Die Präparate zeigten eine hervorragende Reproduzierbarkeit mit bemerkenswert ähnlichen Druckvolumeneigenschaften wie intakte Blasen13. Das Modell ist auch in Blasen von größeren Tieren möglich, bei denen der Detrusormuskel teilweise oder vollständig entfernt werden kann. Zum Beispiel haben wir bereits gezeigt, dass das Modell in der Blase vom Cynomolgus-Affen Macaca fascicularis reproduziert werden kann und haben gezeigt, dass Mediatoren in SubU/LP während der Vorbereitungsfüllung13gemessen werden können.
Die mögliche Einschränkung dieses Ex-vivo-Modells ist genau das Problem, das die Stärke der Zubereitung ist, im Wesentlichen das Fehlen von systemischen Wirkungen des zentralen Nervensystems und der Zirkulation ermöglicht eine gründliche Untersuchung der lokalen Mechanismen der Schleimhaut-Detrusor-Konnektivität während der Blasenfüllung. Der Mangel an systemischen Effekten wird mit zahlreichen ex vivo Ansätzen geteilt, einschließlich isolierter Blasenwandblätter oder Streifen oder kultivierter Urothelzellen. Das detrusorfreie Blasenmodell ist jedoch den oben genannten Ansätzen in der urotheliale Forschung überlegen, da es einen direkten Zugang zum SubU/LP im Zuge der Blasenfüllung ermöglicht. Daher wird die Verwendung dieses Ansatzes das Verständnis von mechanosensitiven Mechanotransduktionsmechanismen verbessern, die während der Befüllung der Blase im Urothel entstehen.
Offenlegungen
Teile dieser Arbeit wurden zuvor im Journal of Physiology (PMCID: PMC6418748; DOI:10.1113/JP27692413). Wiley and Sons, Inc. hat die Genehmigung für die Verwendung von Materialien aus dieser Publikation erteilt. Die Autoren haben keine finanziellen oder anderen Konflikte offenzulegen.
Danksagungen
Diese Arbeit wurde vom National Institute of Diabetes and Digestive and Kidney Diseases Grant DK41315 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| CaCl2 | Fisher | C79 | Source flexible |
| Dextrose | Fisher | D16 | Source flexible |
| Dissecting pins | Fine Science Tools | 26002-20 | Source flexible |
| Infusion Pump | Kent Scientific | GenieTouch | Source flexible |
| KCl | Fisher | P217 | Source flexible |
| KH2PO4 | Fisher | P284 | Source flexible |
| Light source | SCHOTT ACEI | Source flexible | |
| Microscope | Olympus SZX7 | Flexible to use any scope | |
| MgCl2 | Fisher | M33 | Source flexible |
| NaCl | Fisher | S671 | Source flexible |
| NaHCO3 | Fisher | S233 | Source flexible |
| Needles 25G | Becton Dickinson | 305122 | Source flexible |
| Organ bath | Custom made | Flexible source; We made it from Radnoti dissecting dish | |
| PE-20 tubing | Intramedic | 427405 | Source flexible |
| Pressure transducer | AD instrument | Source flexible | |
| S&T Forceps | Fine Science Tools | 00632-11 | Source flexible |
| Software pressure-volume | AD Instruments | Power lab | |
| Suture Nylon, 6-0 | AD surgical | S-N618R13 | Source flexible |
| Suture Silk, 6-0 | Deknatel via Braintree Scientific, Inc. | 07J1500190 | Source flexible |
| Syringes 1 mL | Becton Dickinson | 309602 | Source flexible |
| Vannas Spring Scissors | Fine Science Tools | 15000-08 | Source flexible |
| Water circulator | Baxter | K-MOD 100 | Source flexible |
Referenzen
- Apodaca, G., Balestreire, E., Birder, L. A. The uroepithelial-associated sensory web. Kidney International. 72, 1057-1064 (2007).
- Fry, C. H., Vahabi, B. The Role of the Mucosa in Normal and Abnormal Bladder Function. Basic and Clinical Pharmacology and Toxicology. , 57-62 (2016).
- Merrill, L., Gonzalez, E. J., Girard, B. M., Vizzard, M. A. Receptors, channels, and signalling in the urothelial sensory system in the bladder. Nature Reviewes Urology. 13, 193-204 (2016).
- Ferguson, D. R., Kennedy, I., Burton, T. J. ATP is released from rabbit urinary bladder epithelial cells by hydrostatic pressure changes--a possible sensory mechanism?. Journal of Physiology. 505, 503-511 (1997).
- Wang, E. C., et al. ATP and purinergic receptor-dependent membrane traffic in bladder umbrella cells. Journal of Clinical Investigation. 115, 2412-2422 (2005).
- Miyamoto, T., et al. Functional role for Piezo1 in stretch-evoked Ca(2)(+) influx and ATP release in urothelial cell cultures. Journal of Biological Chemistry. 289, 16565-16575 (2014).
- Mochizuki, T., et al. The TRPV4 cation channel mediates stretch-evoked Ca2+ influx and ATP release in primary urothelial cell cultures. Journal of Biological Chemistry. 284, 21257-21264 (2009).
- McLatchie, L. M., Fry, C. H. ATP release from freshly isolated guinea-pig bladder urothelial cells: a quantification and study of the mechanisms involved. BJU International. 115, 987-993 (2015).
- Birder, L. A., Apodaca, G., de Groat, W. C., Kanai, A. J. Adrenergic- and capsaicin-evoked nitric oxide release from urothelium and afferent nerves in urinary bladder. American Journal of Physiology Renal Physiology. 275, F226-F229 (1998).
- Birder, L. A., Kanai, A. J., de Groat, W. C. DMSO: effect on bladder afferent neurons and nitric oxide release. Journal of Urology. 158, 1989-1995 (1997).
- Birder, L. A., et al. Vanilloid receptor expression suggests a sensory role for urinary bladder epithelial cells. Proceedings of the National Academy of Sciences U S A. 98, 13396-13401 (2001).
- Birder, L. A., et al. Beta-adrenoceptor agonists stimulate endothelial nitric oxide synthase in rat urinary bladder urothelial cells. Journal of Neuroscience. 22, 8063-8070 (2002).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. Journal of Physiology. 597, 1467-1485 (2019).
- Yoshida, M., et al. Non-neuronal cholinergic system in human bladder urothelium. Urology. 67, 425-430 (2006).
- Beckel, J. M., et al. Pannexin 1 channels mediate the release of ATP into the lumen of the rat urinary bladder. Journal of Physiology. 593, 1857-1871 (2015).
- Collins, V. M., et al. OnabotulinumtoxinA significantly attenuates bladder afferent nerve firing and inhibits ATP release from the urothelium. BJU International. 112, 1018-1026 (2013).
- Daly, D. M., Nocchi, L., Liaskos, M., McKay, N. G., Chapple, C., Grundy, D. Age-related changes in afferent pathways and urothelial function in the male mouse bladder. Journal of Physiology. 592, 537-549 (2014).
- Durnin, L., Hayoz, S., Corrigan, R. D., Yanez, A., Koh, S. D., Mutafova-Yambolieva, V. N. Urothelial purine release during filling of murine and primate bladders. American Journal of Physiology Renal Physiology. 311, F708-F716 (2016).
- Gonzalez, E. J., Heppner, T. J., Nelson, M. T., Vizzard, M. A. Purinergic signalling underlies transforming growth factor-beta-mediated bladder afferent nerve hyperexcitability. Journal of Physiology. 594, 3575-3588 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten